Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
:
D. Starostka 1; D. Koláček 1; P. Mikula 1; M. Tichý 2,3
:
Oddělení klinické hematologie, Nemocnice s poliklinikou Havířov, p. o.
1; Ústav klinické a molekulární patologie, Lékařská fakulta UP v Olomouci
2; CGB laboratoř, a. s.
3
:
Transfuze Hematol. dnes,21, 2015, No. 4, p. 173-183.
:
Comprehensive Reports, Original Papers, Case Reports
Úvod:
Lymfom z plášťových buněk (MCL) je vzácná zralá B-lymfoidní neoplazie charakteristická nadměrnou expresí cyklinu D1 a většinou spojená s translokací t(11;14). MCL vykazuje klasickou morfologii nebo se vyskytuje v některé ze 4 morfologických variant (malobuněčná, pleomorfní, blastoidní a podobná lymfomu z marginální zóny). Imunofenotyp je charakteristický vysokou expresí pan-B-markerů CD19, CD20, CD22 a CD79, povrchových imunoglobulinů IgM, IgD včetně jejich lehkých řetězců a znaku CD5. Specifická je intranukleární exprese cyklinu D1. Povrchový FMC7 je většinou pozitivní, pravidelně je pozitivní také CD43, CD38, bcl-2 a transkripční faktor SOX11. Znaky CD23, CD10, CD11c, CD103, CD200 a bcl-6 jsou u MCL typicky negativní.
Materiál a metody:
Soubor zahrnoval 16 případů nově diagnostikovaného MCL (vzorky periferní krve, kostní dřeně, lymfatické uzliny a cerebrospinálního likvoru). Cytomorfologické hodnocení se realizovalo v nátěrech periferní krve, kostní dřeně, imprintech lymfatické uzliny a cytospinu cerebrospinálního likvoru po klasickém panoptickém barvení se zařazením k jednotlivým cytomorfologickým formám MCL. Imunofenotyp byl stanoven imunofenotypizací na průtokovém cytometru FACS Canto II výrobce Becton-Dickinson po přípravných procedurách. Multiparametrová analýza povrchové exprese diagnostických markerů zahrnovala stanovení pozitivity či negativity znaků CD19, CD20, CD22, CD79b, povrchových lehkých řetězců kappa a lambda, CD23, FMC7, CD5, CD10, CD25, CD35, CD38, CD11c, CD103 a CD200 a intenzity jejich exprese (MFI, mean fluorescence intensity) s využitím vlastního diagnostického panelu.
Výsledky:
V souboru bylo 11 mužů a 5 žen s mediánem věku 70 let. Cytomorfologické nálezy zahrnovaly 7 případů klasického MCL a 9 variantních forem (4krát malobuněčná, 3krát pleomorfní, 1krát blastoidní a 1krát podobná lymfomu z marginální zóny). Povrchové markery CD19, CD20, CD22 a CD79b byly konstantně pozitivní s vysokou úrovní exprese (nejvyšší intenzita exprese u CD20). Povrchové lehké řetězce kappa a lambda se vyskytly alternativně u poloviny případů (intenzita exprese lambda zřetelně převažovala). Znak CD5 měl většinou vysokou úroveň exprese, dva případy byly CD5-negativní. FMC7 byl pozitivní u 10 případů a vykazoval velmi variabilní úroveň exprese. Exprese CD25 byla variabilní, marker CD35 byl pozitivní u 3/4 nemocných, CD38 byl většinově pozitivní s vysokou intenzitou exprese. Negativní byly CD23, CD11c a CD103, většinově negativní byl také CD43. 1 případ byl CD10-pozitivní, 2 případy byly CD200-pozitivní. Variabilita intenzity exprese byla obvyklá i u znaků s vysokou mírou exprese.
Závěr:
Stanovení imunocytologického profilu je jedním ze základních prvků diagnostiky MCL. Cytomorfologická a imunofenotypová variabilita MCL je značná. Je nutná pečlivá diferenciální diagnostika MCL, chronické lymfocytární leukemie, lymfomu z marginální zóny a některých případů B-prolymfocytární leukemie. Použitý imunofenotypizační panel je vhodný pro diagnostiku drtivé většiny případů MCL.
Klíčová slova:
lymfom z plášťových buněk, cytologie, imunofenotyp
ÚVOD
Lymfom z plášťových buněk (mantle-cell lymfom, MCL) je vzácná zralá B-lymfoidní neoplazie charakteristická nadměrnou expresí cyklinu D1 (eventuálně cyklinu D2 či D3) a většinou spojená s translokací t(11;14). MCL je nádor z malých až středně velkých B-lymfocytů podobných centrocytům. Má klasickou morfologii nebo se vyskytuje v některé ze 4 morfologických variant. Morfologický obraz nemoci je tedy značně variabilní: od malých zralých lymfocytů podobných těm u chronické lymfocytární leukemie (CLL) přes středně velké centrocytoidní lymfocyty s jadernými nepravidelnostmi (zářezy jádra, lobulizace) až k bizarním lymfoidním elementům podobným prolymfocytům či blastům s jemnou jadernou strukturou a nukleoly u blastoidní varianty MCL. Poměrně příznačný je výskyt „buttock cells“. Infiltrace kostní dřeně je přítomna u 2/3 případů, typicky je smíšená nodulární a paratrabekulární, méně často intersticiální nebo difuzní. V ostatních postižených tkáních je patrný naznačeně nodulární nebo difuzní způsob infiltrace. Vzácně je nádorová léze omezena na vnitřní plášťovou zónu („in situ“ MCL) [1–4]. Hlavní morfologické varianty MCL popisuje tabulka 1, raritně se vyskytuje také MCL s prolymfocytoidními rysy [1].
![Morfologické varianty MCL [1]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/5b4cb1695a9708d922ce8529d730f682.png)
Z hlediska imunofenotypu vykazuje většina případů vysokou expresi pan-B-markerů CD19, CD20, CD22 a CD79, povrchových imunoglobulinů IgM, IgD, jejich lehkých řetězců (převažuje lehký řetězec lambda) a znaku CD5 (obr. 1). FMC7 je většinou pozitivní, pravidelně je pozitivní CD43, CD38 a bcl-2. Charakteristickým rysem je intranukleární exprese cyklinu D1. Negativní expresi mají znaky CD10, CD11c, CD23, CD25, CD103, CD200 a bcl-6. Proliferační aktivitu odráží exprese znaku Ki-67 [1, 3, 5]. Poměrně specifickým markerem MCL je transkripční faktor SOX11, jehož zvýšenou expresi lze prokázat imunohistochemicky nebo molekulárně geneticky [6].
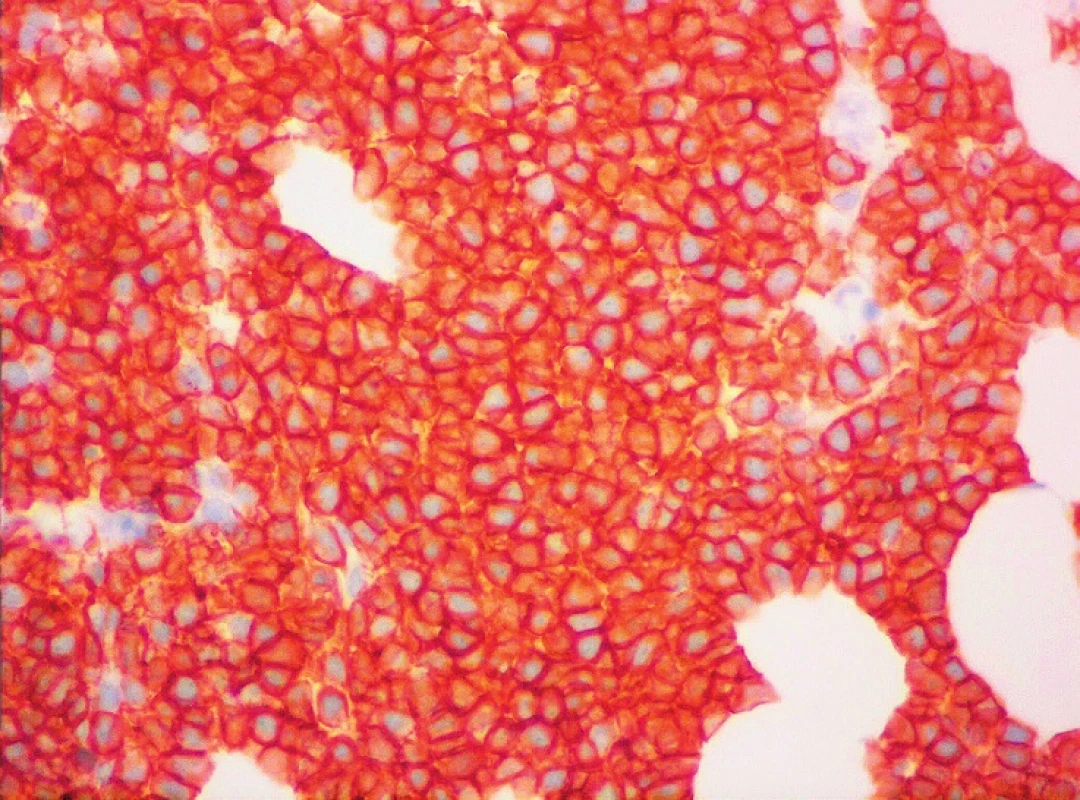
Z uvedeného vyplývá, že základem diagnózy MCL je pečlivé morfologické vyšetření (histologie a cytologie) a stanovení imunofenotypu nádorové populace (imunohistochemie a imunofenotypizace pomocí průtokové cytometrie). Úloha histologie s imunohistochemií je v tomto kontextu klíčová, zejména při průkazu CD5 a cyklinu D1.
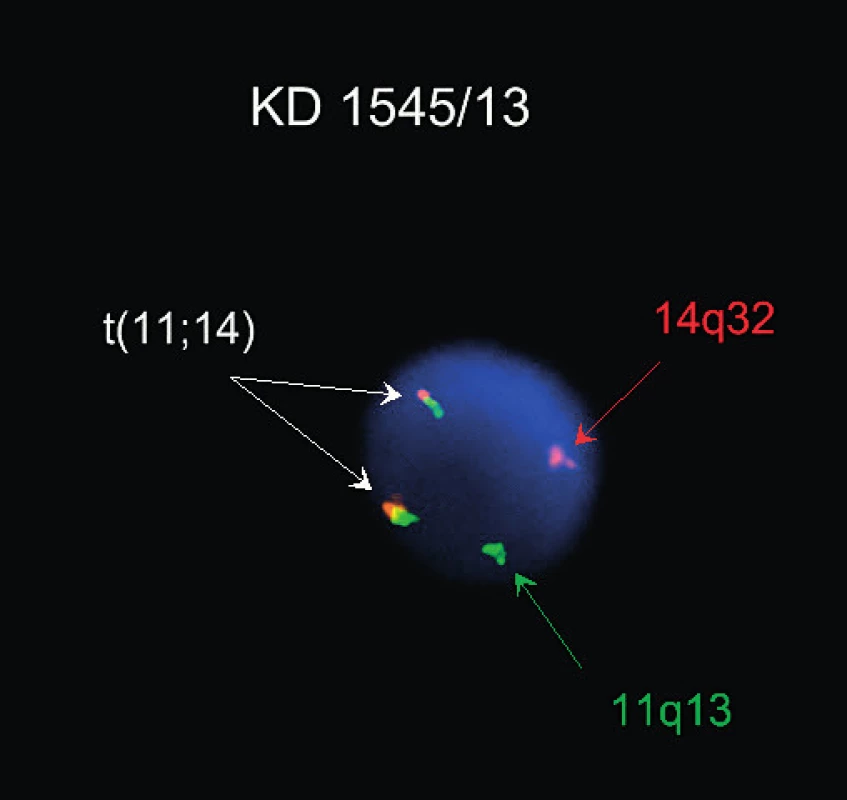
K diagnóze významným způsobem přispívá genetická analýza. Je přítomna přestavba genu pro těžký imunoglobulinový řetězec, většinou v nemutované formě. Změny karyotypu jsou obvykle komplexní. Diagnostická je translokace t(11;14)(q13;q32) mezi geny pro IGH a cyklin D1 (CCND1) vedoucí k nadměrné expresi cyklinu D1 (obr. 2). Časté jsou změny v oblasti 11q22-23 (40–75 %) a del13q14 (43–51 %), ostatní aberace zahrnují změny v oblasti 3q26, 7p21, 8q24, 1p13-p31, 6q23-q27, 9p21, 13q11, 17p13 a trizomii 12. Případy pleomorfní a blastoidní varianty MCL mají často tetraploidii se zmnožením genu CCND1 nebo mutací genu TP53. Vzácné případy bez translokace t(11;14) exprimují cyklin D2 nebo D3 [1, 2, 3, 7].
MATERIÁL A METODIKA
Vyšetřovaný soubor zahrnoval 16 případů histologicky verifikovaného lymfomu z plášťových buněk nově diagnostikovaného v letech 2013 a 2014. Histopatologická diagnóza byla ve všech případech považována za jistou, imunohistochemická analýza prokázala pozitivitu cyklinu D1 u všech případů. Analyzovaným materiálem bylo 31 vzorků periferní krve, kostní dřeně, lymfatické uzliny a cerebrospinálního likvoru.
Cytomorfologické hodnocení světelnou mikroskopií s využitím mikroskopu Nikon Eclipse (objektiv Plan Apo 100x/1.4 Oil NCG) se realizovalo v nátěrech periferní krve (14krát), kostní dřeně (14krát), imprintech lymfatické uzliny (2krát) a cytospinu cerebrospinálního likvoru (1krát) po klasickém panoptickém barvení (barviva May-Grünwald, Giemsa-Romanowski). Hodnocené detailní morfologické prvky při 1000násobném zvětšení zahrnovaly: velikost buněk, poměr cytoplazmy a jádra, tvar a lokalizace jádra, charakter jaderného chromatinu, přítomnost nukleolů, barvitelnost cytoplazmy, přítomnost intracytoplazmatických vakuol, granulí nebo inkluzí, výskyt anizocytózy a anizomorfie. Na základě většinového cytologického obrazu byly případy zařazeny k jednotlivým cytomorfologickým formám MCL (klasický MCL, varianta pleomorfní, malobuněčná, podobná lymfomu z marginální zóny a blastoidní).
Imunofenotyp jednotlivých případů byl stanoven metodou průtokové cytometrie ve vzorcích periferní krve (14krát), kostní dřeně (14krát), lymfatické uzliny (2krát) a cerebrospinálního likvoru (1krát). Imunofenotypizace pomocí průtokové cytometrie se prováděla v režimu „lyse-wash“ po přípravných procedurách, které zahrnovaly eventuální mechanickou dezintegraci (u lymfatických uzlin), filtraci a korekci celularity analyzované suspenze buněk. Inkubace s monoklonálními protilátkami trvala 15 minut. K lýze a promývání bylo použito zařízení LyseWash Assistant výrobce Becton-Dickinson. K multiparametrové analýze povrchové exprese diagnostických markerů sloužil průtokový cytometr FACS Canto II výrobce Becton-Dickinson s optimalizovaným nastavením technických parametrů (voltáž a kompenzace) a klinický software FACS Diva. Analýza exprese zahrnovala stanovení pozitivity či negativity jednotlivých znaků (cut-off hodnota exprese 30 % na B-lymfocytech) a intenzity jejich exprese (MFI, mean fluorescence intensity) na B-lymfocytech. U všech případů bylo stanoveno skóre pro chronickou lymfocytární leukemii (CLL-skóre) podle E. Matutes. Analýza probíhala na nejméně 5000 B-lymfocytů ve zkumavkách: CD45-PerCp-Cy5.5/CD3-FITC/CD4-PE-Cy7/CD8-APC-Cy7/CD16+56-PE/CD19-APC, CD19-PerCp-Cy5.5+kappa-FITC+lambda-PE/CD200-PE-Cy7/CD95-APC, CD19-PerCp-Cy5.5+CD23-PE+ FMC7-FITC/CD79b-APC/CD5-PE-Cy7, CD20-APC-Cy7/CD10-PE/CD43-APC/CD35-FITC/CD38-PE-Cy7 a CD20-PerCp-Cy5.5+CD22-PE+CD103-FITC/CD25-PE-Cy7/CD11c-APC. Všechny použité protilátky pocházely od firmy Becton-Dickinson. Negativní izotypové kontroly nebyly použity.
VÝSLEDKY
Věkové rozpětí nemocných bylo 48–88 let s věkovým mediánem 70 let, v souboru bylo 11 mužů a 5 žen.
Cytomorfologie
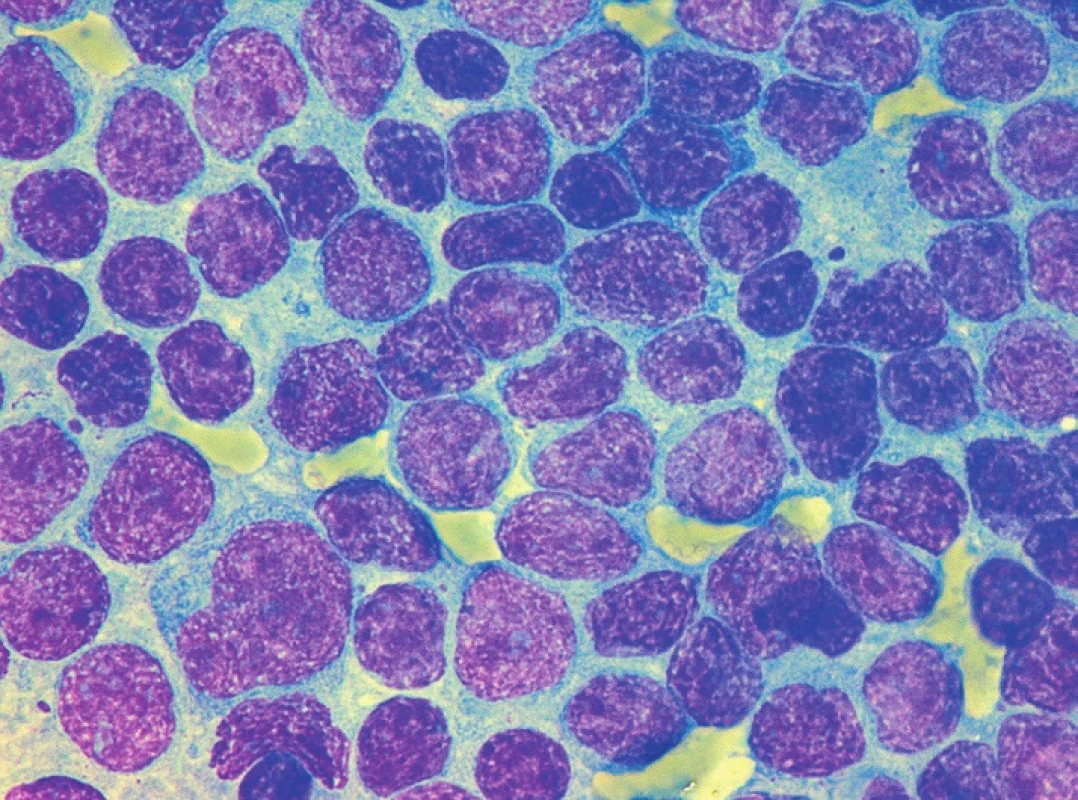
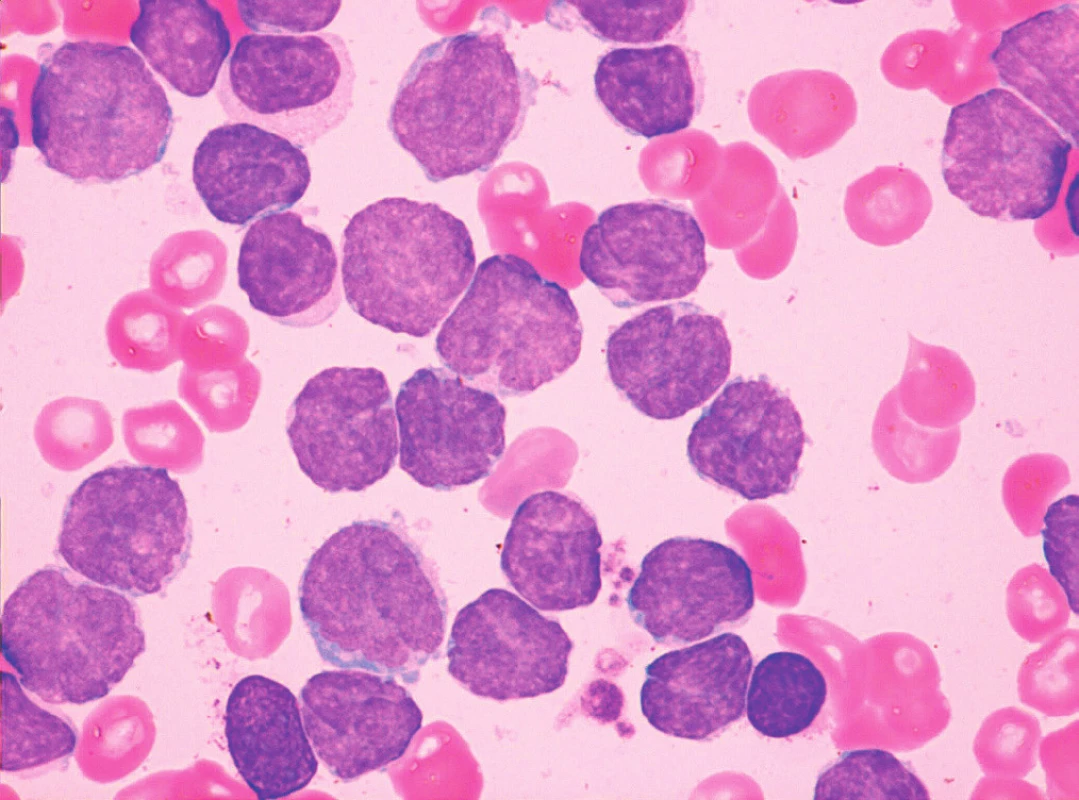
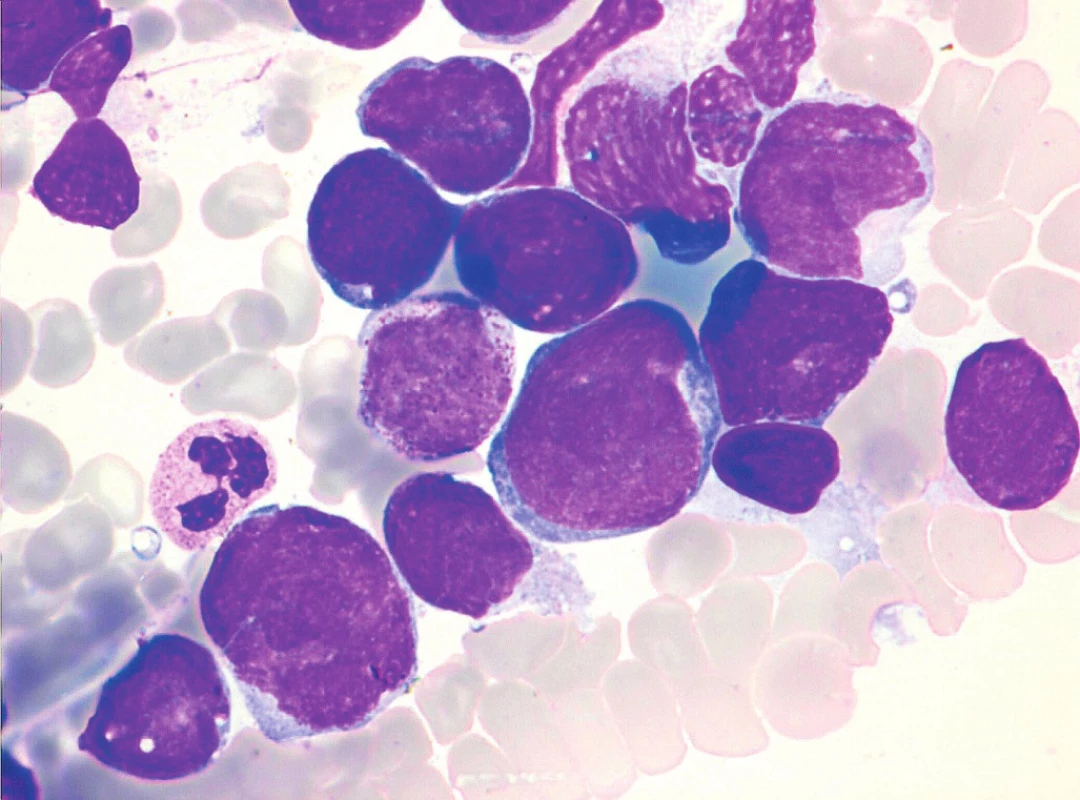
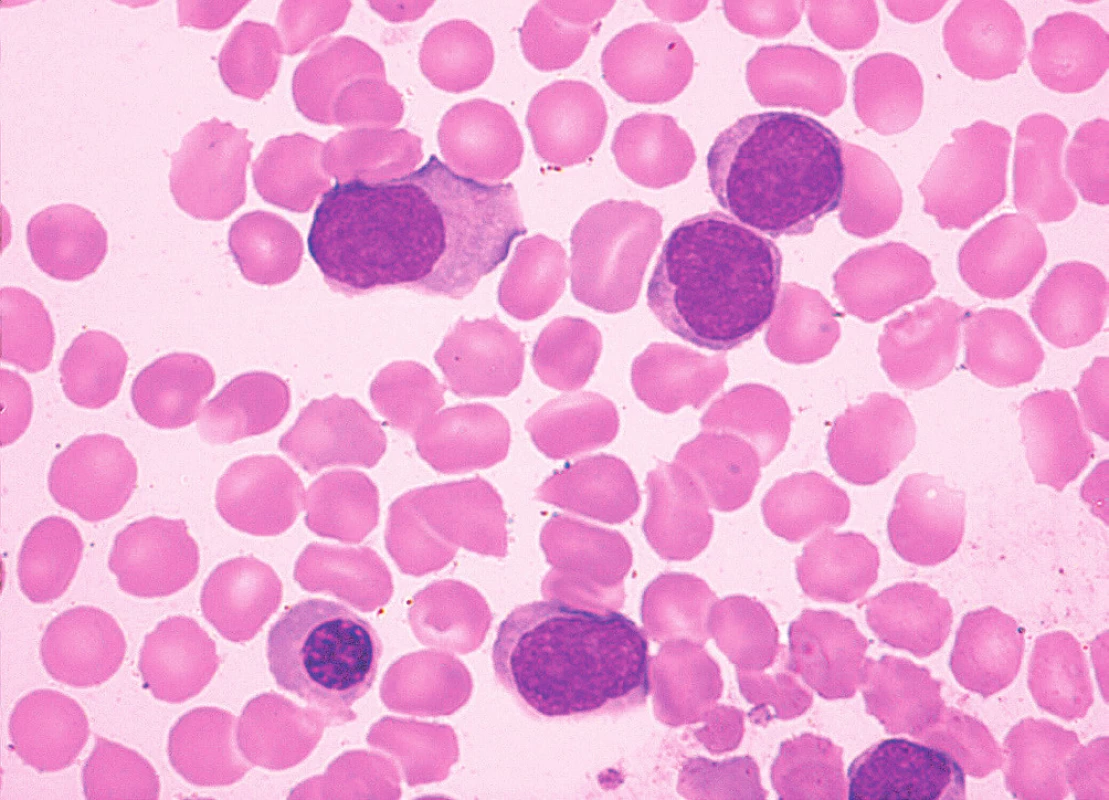
Sedm případů z celkového počtu 16 vykazovalo klasickou cytomorfologii. Malobuněčná varianta nemoci se vyskytla ve 4 případech, pleomorfní variantu MCL jsme pozorovali u 3 pacientů. Jeden z případů pleomorfní varianty byl charakteristický výskytem bilobárních jader. Vzácnější byly případy blastoidní varianty (1 případ) a varianty podobné lymfomu z marginální zóny (1 pacient). Cytologické rysy jednotlivých morfologických typů MCL dokumentují obrázky 3–10.
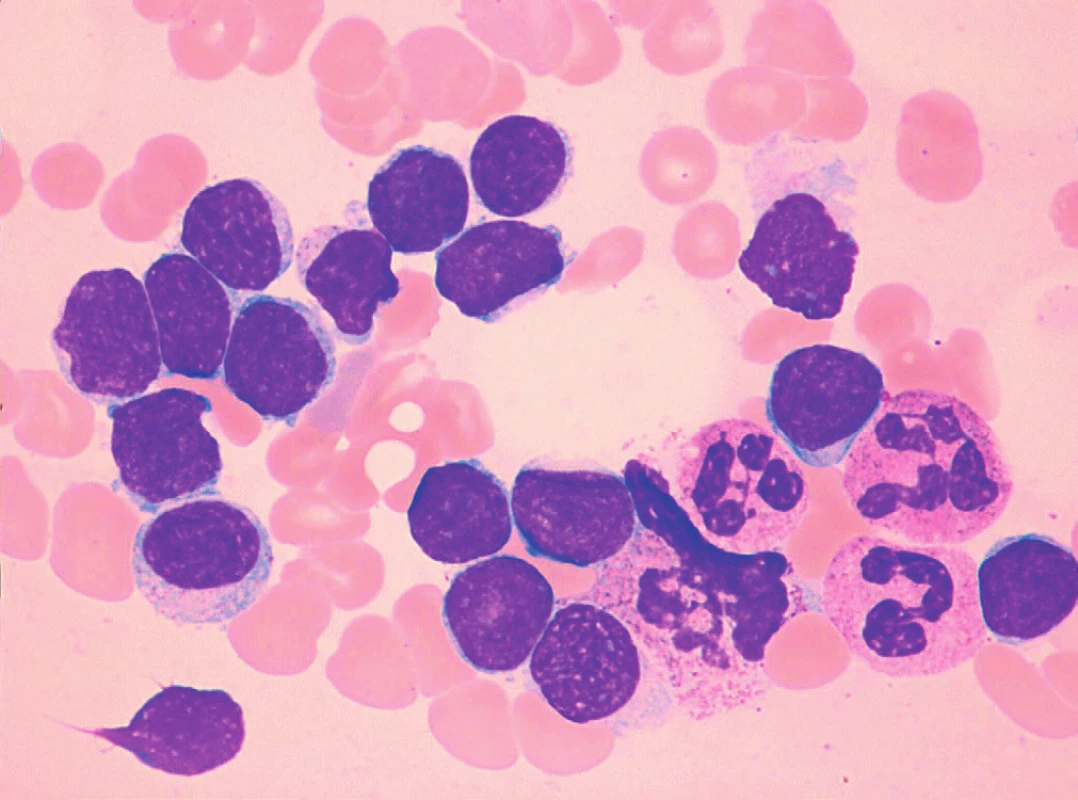
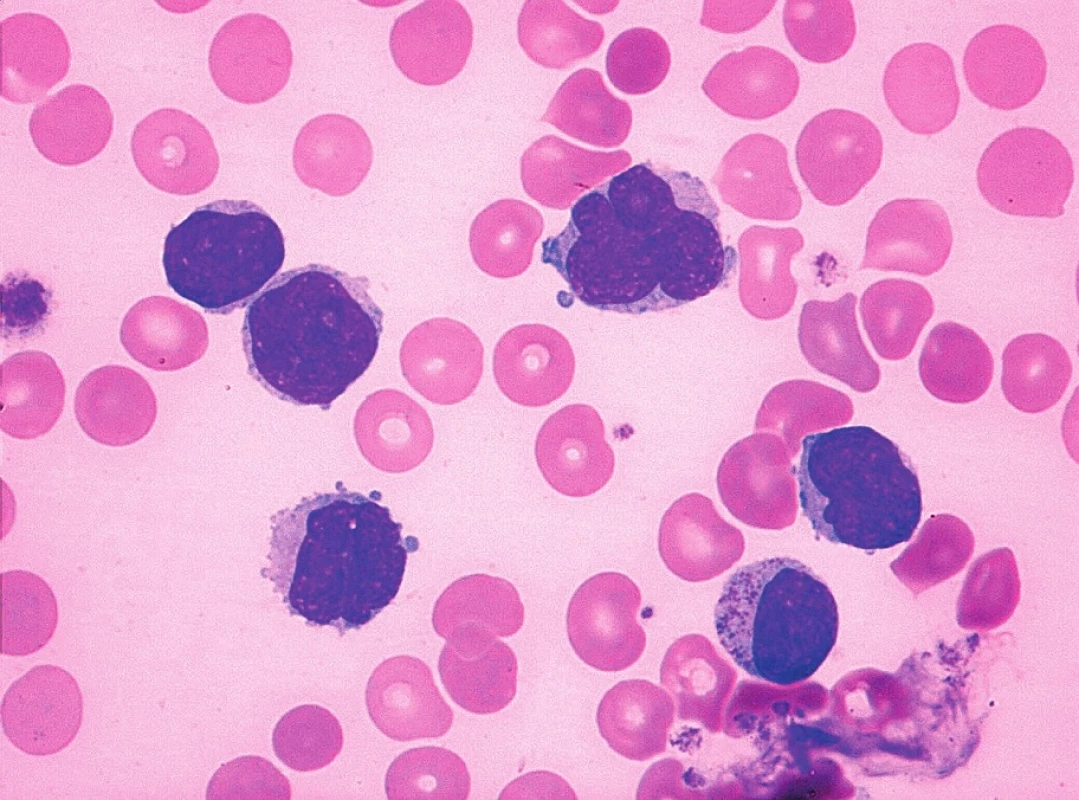
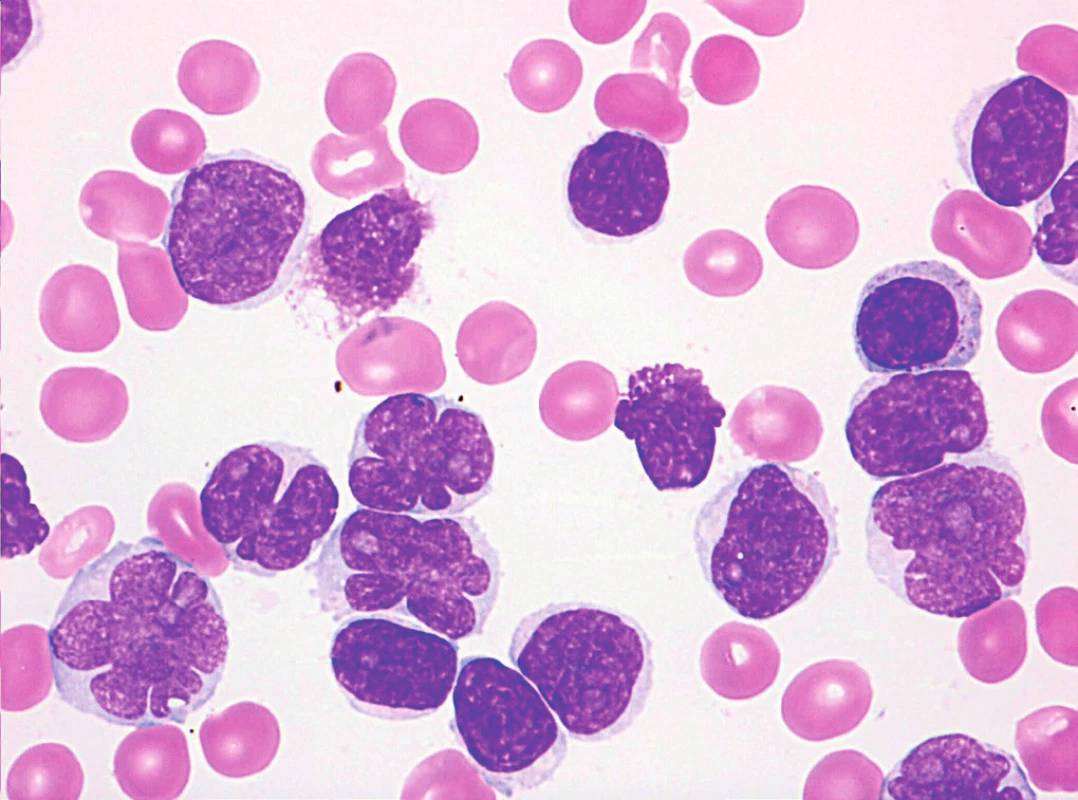
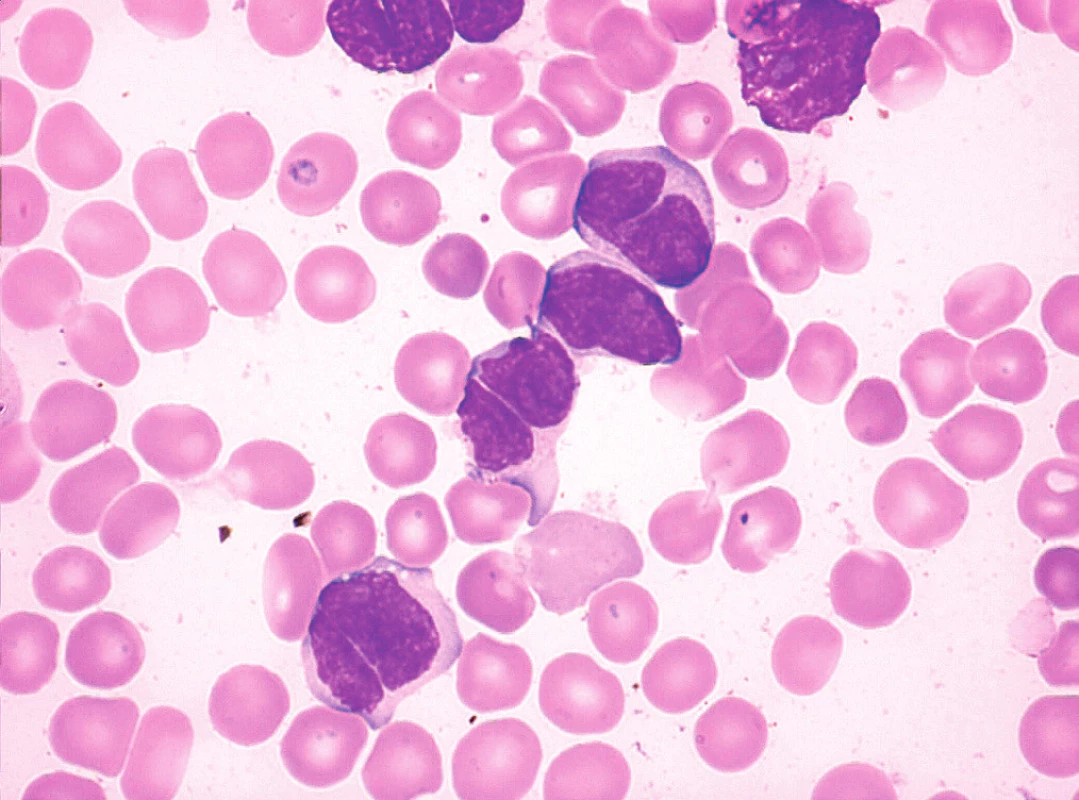
Imunofenotyp
Imunofenotypový profil souboru MCL popisuje tabulka 2. Tabulka shrnuje počet pozitivních a negativních případů pro jednotlivé vyšetřované diagnostické znaky a podává informace o kvantitativní charakteristice intenzity jejich exprese.
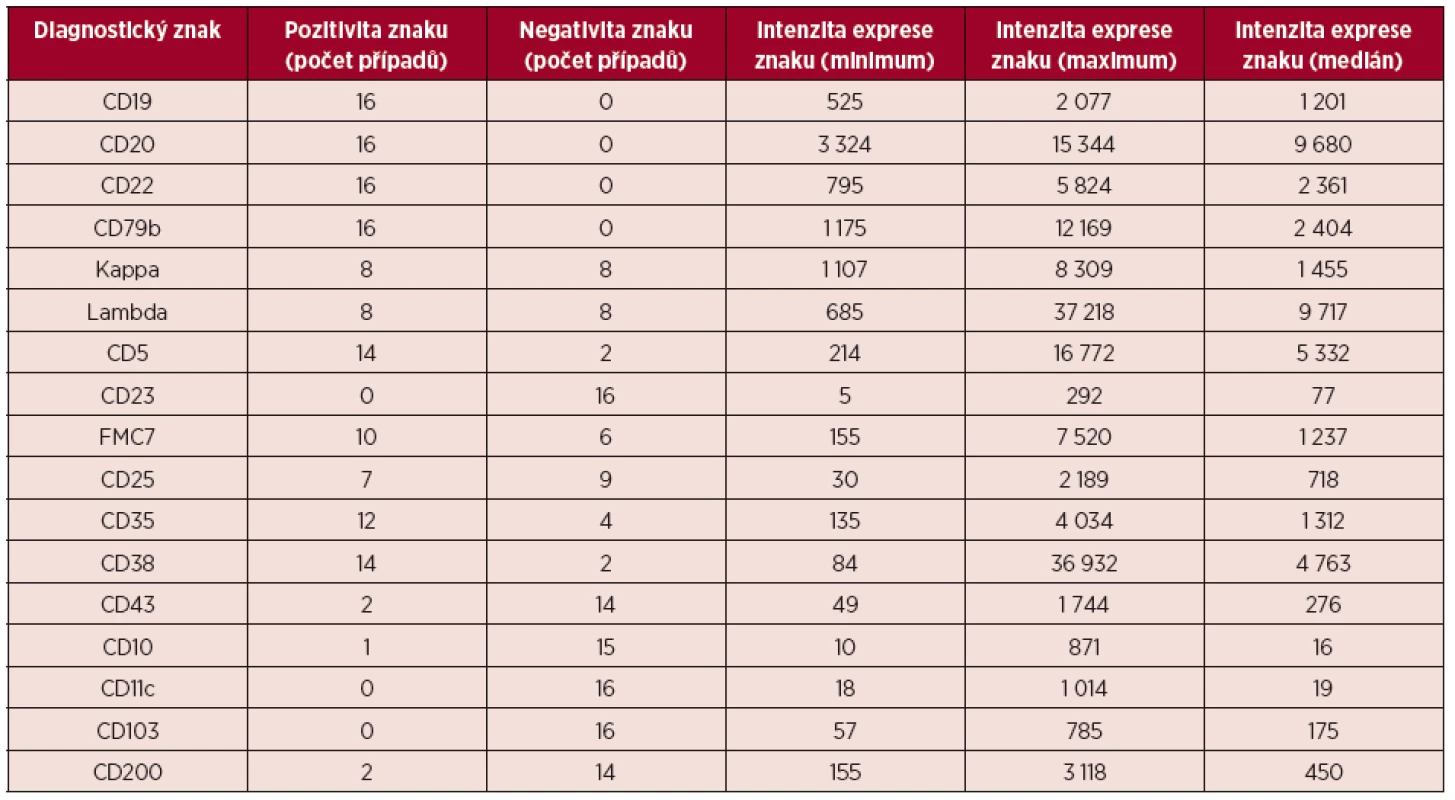
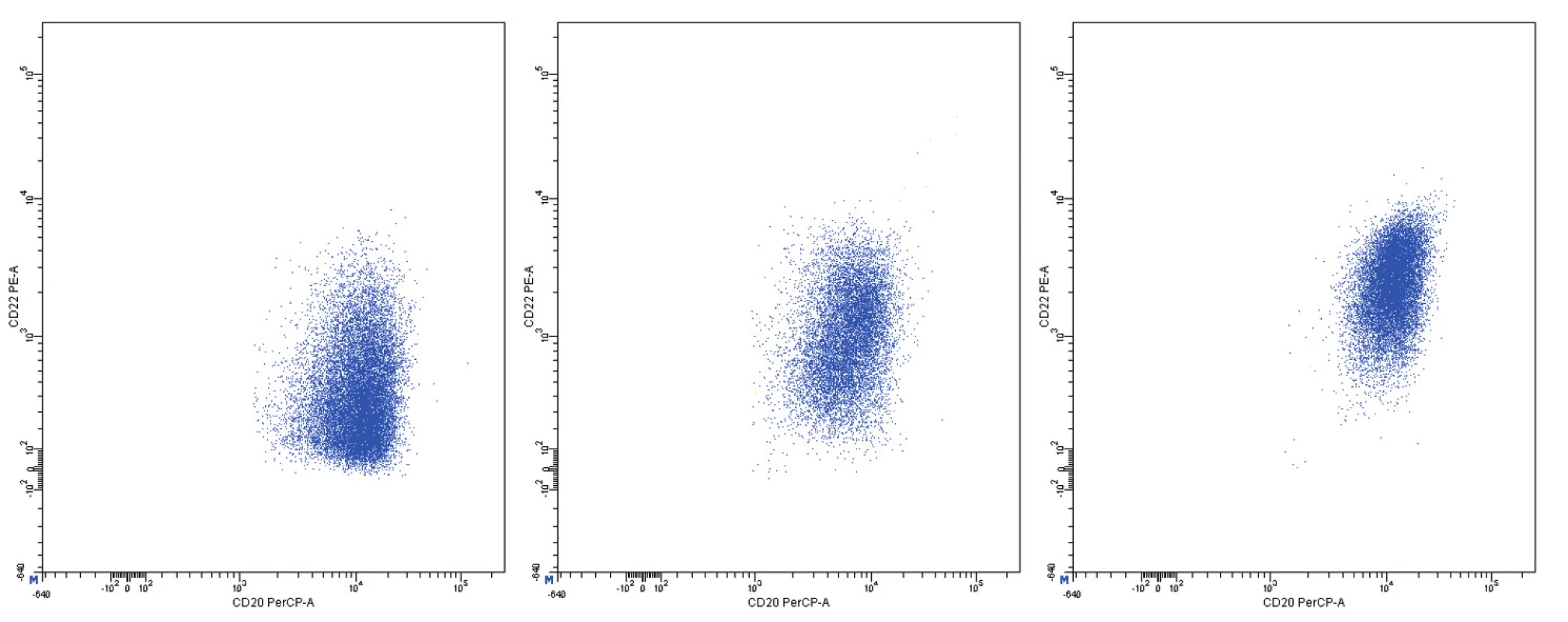
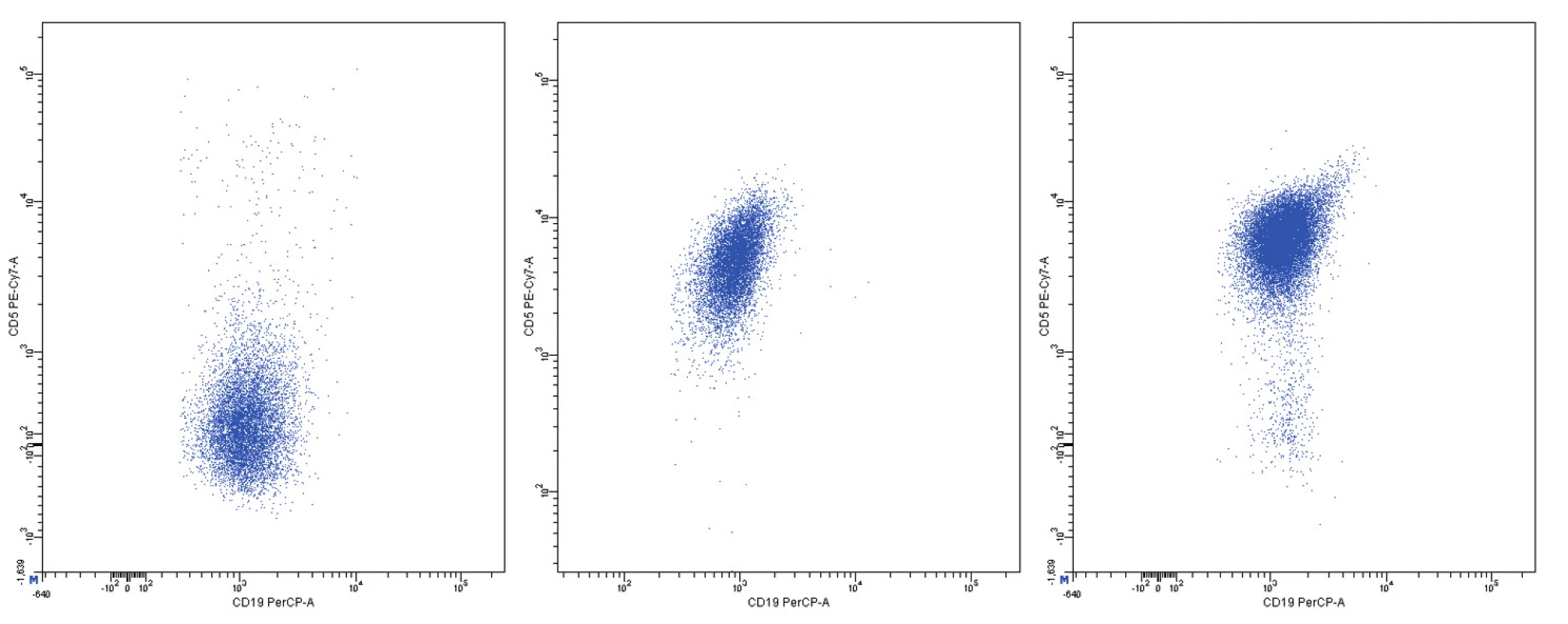
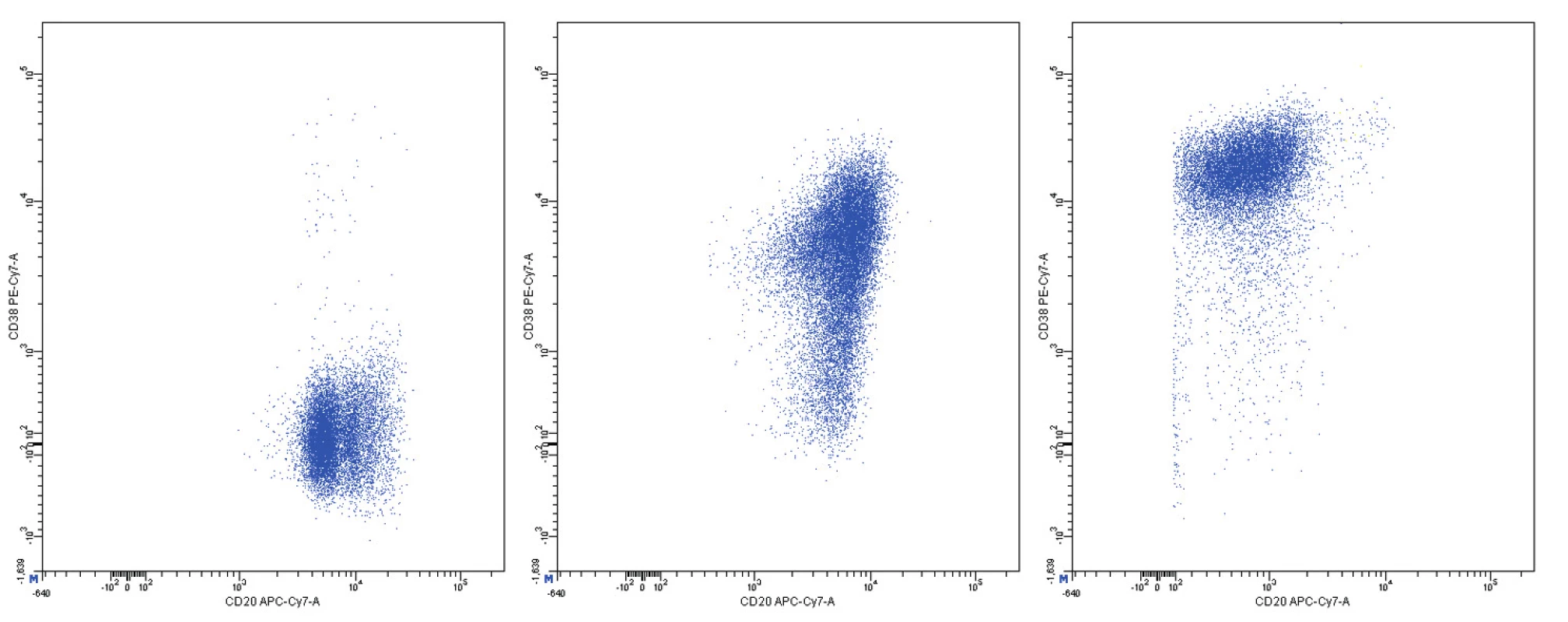
Pozitivita povrchové exprese pan-B markerů CD19, CD20, CD22 a CD79b s vysokou intenzitou exprese byla konstantním rysem všech analyzovaných případů MCL. Nejvyšší intenzitu exprese z nich vykazoval znak CD20 (medián MFI více než 4krát vyšší než u CD22 a CD79b a 8krát vyšší než u CD19). Povrchové lehké řetězce kappa a lambda se vyskytly shodně u poloviny případů, intenzita exprese lehkých řetězců lambda byla zřetelně vyšší než u lehkých řetězců kappa (7krát vyšší medián MFI). Znak CD5 měl většinou vysokou úroveň exprese, ovšem i v našem souboru jsme pozorovali dva CD5-negativní případy MCL. FMC7 byl pozitivní u 10 případů a vykazoval velmi variabilní úroveň exprese. Marker CD43 byl většinově negativní. Pozitivita znaku CD23 se nevyskytla u žádného pacienta, stejně tak tomu bylo i u znaků CD11c a CD103. Exprese CD25 byla variabilní, marker CD35 byl pozitivní u 3/4 nemocných (většinou nižší úroveň exprese). CD38 byl většinově pozitivní s vysokou intenzitou exprese. Vzácná byla pozitivita CD10 s nízkou úrovní exprese u jediného z případů. S pozitivitou CD200 jsme se setkali pouze u 2 případů (jeden případ s vysokou a jeden případ s nižší úrovní exprese). CLL skóre bylo následující: hodnota 0 – 2krát, hodnota 1 – 6krát, hodnota 2 – 7krát, hodnota 4 – 1krát. Z hodnocení exprese jednotlivých markerů vyplývá, že variabilita intenzity exprese byla obecným rysem i u silně exprimovaných znaků (obr. 11–13). Pozoruhodné bylo, že jeden z případů MCL vykazoval imunofenotyp příznačný pro CLL (CD19+CD5+CD23-CD79b-dimFMC7-CD200+lambda-dim), v jiném z případů byl imunofenotyp velmi blízký lymfomu z marginální zóny (MZL).
DISKUSE
MCL se řadí mezi CD5-pozitivní B-lymfoproliferace, které představují významnou skupinu definovaných diagnostických jednotek v rámci WHO klasifikace zralých B-lymfoidních neoplazií [8]. Za fyziologických okolností je antigen CD5 exprimován na povrchu většiny T-lymfocytů, u B-lymfocytů je jeho výskyt omezen na povrchovou expresi u minoritního B-lymfocytárního subsetu, tzv. B-1 buněk lymfatických uzlin, sleziny, pleurální a peritoneální dutiny. CD5 je ligandem CD72, účastní se v modulaci signálu z BCR a je mediátorem interakce mezi jednotlivými B-lymfocyty a B-lymfocyty a T-lymfocyty [8, 9]. Vzhledem k popsané minoritní expresi antigenu CD5 na fyziologických B-lymfocytech je jeho patologická přítomnost klíčovým diferenciálně diagnostickým rysem. Laboratorní diagnostika CD5-pozitivních B-lymfoproliferací je multidisciplinární a zahrnuje metody morfologické (cytologie a histologie), metody stanovení imunofenotypu (imunohistochemie a průtoková cytometrie) a metody cytogenetiky a molekulární cytogenetiky [8]. S jejich využitím lze mezi CD5-pozitivními B-lymfoproliferacemi vyčlenit jednotky s vysokou expresí CD5 u většiny případů (CLL, lymfom z malých lymfocytů a MCL), jednotky s expresí CD5 u významné menšinové části případů (B-prolymfocytární leukemie – B-PLL, splenický MZL) a jednotky s raritní expresí CD5 (ostatní typy MZL, difuzní velkobuněčný B-lymfom – DLBCL, folikulární lymfom – FL, lymfoplazmocytární lymfom – LPL a Burkittův lymfom) [8].
Cytomorfologické vyšetření a stanovení imunofenotypu průtokovou cytometrií má v rozpoznání MCL v rámci diferenciální diagnostiky CD5-pozitivních B-lymfoproliferací stejně důležité místo jako ostatní diagnostické modality, velkou výhodou je rychlost a všeobecná dostupnost těchto metodik. Imunofenotypizace průtokovou cytometrií navíc disponuje možností poměrně nekomplikované a multiparametrové analýzy širokým portfoliem monoklonálních protilátek.
Cytologické vyšetření může vést diagnostiku směrem k MCL v případě klasické centrocytové morfologie, při výskytu „buttock cells“ nebo u pleomorfní varianty MCL. Vzhledem k morfologické variabilitě MCL jsou ovšem možnosti cytologické diferenciální diagnostiky poměrně široké. U malobuněčné varianty MCL do ní vstupuje CLL, MZL, LPL a FL. Morfologický obraz pleomorfní varianty MCL může být obdobný jako u pleomorfní varianty atypické CLL, obtíže může činit také odlišení pleomorfní varianty MCL od DLBCL nebo prolymfocytoidní formy MCL od některých případů B-PLL [1, 8, 10]. Případy blastoidní varianty MCL mohou připomínat akutní leukemii nebo DLBCL [1, 10]. Nutné je také rozpoznat „MZL-like“ variantu MCL od MZL.
Tato obecná konstatování dokreslují údaje o cytomorfologii případů MCL v hodnoceném souboru. Téměř polovina z nich (7 z 16) byla zařazena k malobuněčné nebo pleomorfní variantě MCL, kde zejména odlišení od typické nebo atypické CLL bylo pouze na základě cytologie prakticky nemožné (viz obr. 5 a 6). Stejně tak tomu bylo v případě „MZL-like“ varianty MCL a MZL (viz obr. 10). Případ blastoidní varianty byl morfologicky velmi blízký imunoblastické formě DLBCL (viz obr. 9).
Některé literární zdroje potvrzují prognostický význam morfologických variant MCL. Případy pleomorfní a blastoidní varianty mají agresivnější průběh a vyžadují intenzivnější léčbu [11, 12, 13, 14], naopak malobuněčná varianta MCL je prognosticky příznivější [15].
Většinový imunofenotyp MCL je kromě pozitivní exprese cyklinu D1 charakteristický pozitivitou pan-B-markerů, CD5, FMC7 a CD38 a negativitou znaků CD23, CD10 a CD200. Variantní imunofenotyp MCL se vyznačuje atypickou expresí jednoho či více uvedených znaků [16]. V této souvislosti je třeba připomenout, že variabilita imunofenotypu může souviset kromě přirozené fenotypové pestrosti také s izotypem a klonem použité monoklonální protilátky a druhem konjugovaného fluorochromu.
Výskyt variantních imunofenotypových forem MCL není výjimečný, některé práce udávají jejich zastoupení až ve 40 % všech případů MCL [16]. CD5-negativní formy MCL mohou tvořit až 12 % všech případů MCL a jsou popsány u všech morfologických typů MCL [16–19]. V našem souboru se vyskytly 2 případy CD5-negativního MCL, u kterých byla negativita CD5 jednoznačně verifikována také imunohistochemicky. CD5-negativita byla u těchto lymfomů jedinou odchylkou od většinového imunofenotypu MCL. Exprese znaků CD23 a FMC7 je důležitým prvkem odlišení MCL a CLL v typických případech [20, 21, 22]. Pozitivita znaku CD23 se ovšem udává v rozmezí 0–45 % všech případů MCL [16, 20, 21, 22] a až 40 % případů MCL může být FMC7-negativní [20, 21, 22]. S pozitivitou CD23 jsme se v analyzovaném souboru nesetkali. FMC-7 byl v hodnoceném souboru negativní u 44 % případů MCL, což potvrzuje některé literární údaje a také naše dřívější pozorování. Vzácnou aberací imunofenotypu u MCL je pozitivita CD10, která je jinak typická pro FL a část DLBCL [23, 24, 25]. Tato atypie se vyskytuje u MCL až s 11% frekvencí a může se kombinovat s jinými variantami imunofenotypu, např. s CD5-negativitou [16, 25]. V našem souboru jsme pozorovali 1 případ CD10-pozitivního MCL, který byl současně FMC7-negativní. V souboru se také vyskytly 2 případy CD38-negativního MCL. V rozporu s literárními údaji byla většina vyšetřených případů MCL CD43-negativní, což může souviset s použitou monoklonální protilátkou. Literatura uvádí, že nebyla prokázána souvislost výskytu variantních imunofenotypových forem MCL a jeho morfologických variant [16], a ani my jsme tuto souvislost nepozorovali.
Z hlediska imunofenotypu je v diferenciální diagnostice MCL podstatné zejména odlišení od CLL, B-PLL a splenického MZL [1, 2, 8]. Případy CD5-pozitivního non-splenického MZL, DLBCL, FL a LPL jsou z hlediska diferenciální diagnostiky MCL marginální vzhledem k jejich raritnímu výskytu; drtivá většina těchto nádorů je totiž CD5-negativní.
CLL stojí na prvním místě diferenciální diagnostiky MCL vzhledem k tomu, že jde o nejčastější CD5-pozitivní lymfoproliferaci s širokým morfologickým překryvem, zejména u malobuněčných a pleomorfních variant MCL. Na rozdíl od MCL jsou pan-B-antigeny (CD19, CD20, CD22, CD79) u CLL slabě exprimovány stejně jako dominantní povrchové lehké řetězce kappa nebo lambda, sIgM a IgD. Stejně jako u MCL je pro CLL typická pozitivita CD5, CD43 a bcl-2. Variabilní expresi mají u CLL markery CD25, CD11c, CD38 a ZAP-70; negativní je FMC7, CD10, CD103 a cyklin D1 [1, 2, 5, 26, 27]. Robustním nástrojem při rozlišení MCL a CLL je stanovení skóre podle systému sestaveného Estellou Matutes již v roce 1994 (tab. 3). Většina případů CLL vykazuje skóre 4 nebo 5, pro valnou část MCL je příznačné skóre 1 nebo 2 [28]. V našem souboru mělo 15 případů z 16 skóre 0–2. U atypické CLL se setkáváme s vyšší expresí CD19, CD20, CD22 a CD79b a sIg včetně lehkých řetězců [1, 5, 28]. Zejména tyto atypické případy mohou činit obtíže při odlišení od MCL.
![Skórovací systém pro CLL podle Estelly Matutes [28]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/01aea54346a9437ebaafe74226f6f20b.png)
Jako velmi užitečný se při rozlišení MCL a CLL jeví znak CD200, jeho vysoká exprese je v rámci CD5 + B-lymfoproliferací pro CLL poměrně specifická [29, 30, 31, 32]. CD200 je u CLL pozitivní prakticky ve všech případech včetně forem s atypickým imunofenotypem [29, 30, 31]. U MCL je pozitivita CD200 vzácná (výskyt do 10 %), navíc je CD200 nevýrazně exprimován [29, 30]. V hodnoceném souboru se vyskytly dva případy CD200-pozitivního MCL. Případ MCL imitující CLL s Matutes skóre 4 byl popsán výše. Druhý z případů měl méně intenzivní expresi CD200, navíc byl CD38-negativní, vykazoval nižší expresi CD5 a svým imunofenotypem se blížil MZL.
Pro úplnost je nutné uvést také potřebu diferenciální diagnostiky MCL, B-PLL a splenického MZL s leukemizací. B-PLL vykazuje CD5-pozitivitu až u třetiny případů, u splenického MZL je to až 25 % [1, 33, 34]. Obě tyto B-lymfoidní neoplazie mají také určitý morfologický a imunofenotypový překryv s MCL. V jejich odlišení od MCL má nezastupitelné místo stanovení cyklinu D1. V histologickém hodnocení je v rámci širší diferenciální diagnostiky považována exprese cyklinu D1 za klíčový diagnostický znak charakteristický pro většinu MCL [35, 36]. Jde o znak s vysokou specificitou pro MCL, i když byly popsány také případy jiných cyklin D1-pozitivních lymfomů [37].
ZÁVĚR
Stanovení imunocytologického profilu je jedním ze základních prvků diagnostiky MCL. Tento lymfom vykazuje pestrou morfologii s častým výskytem variantních forem a jeho imunofenotyp je taktéž značně variabilní. Pečlivá diferenciální diagnostika MCL, CLL, MZL a některých případů B-PLL či vzácně jiných lymfoproliferací vyžaduje komplexní multidisciplinární přístup. Z hlediska imunocytologické charakteristiky jsou klíčovými diferenciálně diagnostickými prvky při odlišení MCL od jiných CD5-pozitivních B-lymfoproliferací (zejména CLL) cytomorfologie, exprese pan-B-markerů a znaků CD5, CD23, CD79b, CD43, CD38, CD10, FMC7 a CD200. V tomto kontextu jsme potvrdili diagnostickou hodnotu pečlivého cytomorfologického vyšetření a také imunofenotypizačního panelu používaného na našem pracovišti. Existence CD5-negativních nebo cyklin D1 negativních případů či forem s netypickým morfologickým obrazem či variantním imunofenotypem může ztěžovat diagnostiku MCL i jiných B-lymfomů.
Podíl autorů na rukopisu
DS – diagnostika, evidence dat, statistika, příprava rukopisu
DK – diagnostika, evidence dat, statistika, příprava rukopisu
PM – diagnostika, revize rukopisu
MT – diagnostika, revize rukopisu
Čestné prohlášení autora
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce: 24. 6. 2015
Přijato po recenzi: 12. 8. 2015
MUDr. David Starostka
Oddělení klinické hematologie
Nemocnice s poliklinikou Havířov, p.o.
Dělnická 1132/24
736 01 Havířov-Město
e-mail: david.starostka@nsphav.cz
Sources
1. Swerdlow SH, Campo E, Lee Harris N, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Fourth Edition. IARC: Lyon 2008.
2. Kačírková P, Campr V, Karban J, Mikulenková D. Hematoonkologický atlas krve a kostní dřeně. Grada Publishing, a. s. Praha. 2007.
3. Dreyling M, Kluin-Nelemans HC, Bea S, et al. Update on the molecular pathogenesis and clinical treatment of mantle cell lymphoma: report of the 11th annual conference of the European Mantle Cell Lymphoma Network. Leuk Lymphoma 2013; 54: 699–707.
4. Richard P, Vassallo J, Valmary S, Missoury R, Delsol G, Brousset P. „In situ-like“ mantle cell lymphoma: a report of two cases. J Clin Pathol 2006; 59: 995–996.
5. Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111: 3941–3967.
6. Mozos A, Royo C, Hartmann E, De Jong D, Baró C, Valera A. SOX11 expression is highly specific for mantle cell lymphoma and identifies the cyclin D1-negative subtype. Haematologica 2009; 94: 1555–1562.
7. Rubio-Moscardo F, Climent J, Siebert R, et al. Mantle cell lymphoma genotypes identified with CGH to BAC microarrays define a leukemic subgroup of disease and predict patient outcome. Blood 2005; 105: 4445–4454.
8. Starostka D, Mikula P. Možnosti diagnostiky CD5-pozitivních B-lymfoproliferací. Onkologie 2014; 8(3): 102–106.
9. Hardy RR. B-1 B Cell Development. J Immunol 2006; 177: 2749–2754.
10. Sen R, Gupta S, Gill M, Kohli R, Gupta V, Verma R. Blastoid variant of mantle cell lymphoma – a rare case report. Am J Med Case Rep 2014; 2: 161–163.
11. Jares P, Campo E. Advances in the understanding of mantle cell lymphoma. Br J Haematol 2008; 142(2): 149–165.
12. Räty R, Franssila K, Jansson SE, Joensuu H, Wartiovaara-Kautto U, Elonen E. Predictive factors for blastoid transformation in the common variant of mantle cell lymphoma. Eur J Cancer 2003; 39(3): 321-329.
13. Pittaluga S, Verhoef G, Criel A, et al. Prognostic significance of bone marrow trephine and peripheral blood smears in 55 patients with mantle-cell lymphoma. Leuk Lymphoma 1996, 21: 115–125.
14. Bosch F, Lopez-Guillermo A, Campo E, et al. Mantle cell lymphoma: presenting features, response to therapy and prognostic factors. Cancer 1998, 82: 567–575.
15. Schlette E, Lai R, Onciu M, Doherty D, Bueso-Ramos C, Medeiros J. Leukemic mantle cell lymphoma: clinical and pathologic spectrum of twenty-three cases. Mod Pathol 2001; 14(11): 1133–1140.
16. Gao J, Peterson L, Nelson B, Goolsby C, Chen YH. Immunophenotypic variations in mantle cell lymphoma. Am J Clin Pathol 2009; 132(5): 699–706.
17. Liu Z, Dong HY, Gorczyca W, et al. CD5- mantle cell lymphoma. Am J Clin Pathol 2002; 118: 216–224.
18. Seok Y, Kim J, Choi JR, et al. CD5-negative blastoid variant mantle cell lymphoma with complex CCND1/IGH and MYC aberrations. Ann Lab Med 2012; 32: 95–98.
19. Hashimoto Y, Omura H, Tanaka T, Hino N, Nakamoto S. CD5-negative mantle cell lymphoma resembling extranodal marginal zone lymphoma of MALT: a case report. J Clin Exp Hematopathol 2012; 52: 185–191.
20. Ahmad E, Garcia D, Davis BH. Clinical utility of CD23 and FMC7 antigen coexistent expression in B-cell lymphoproliferative disorder subclassification. Cytometry 2002; 50: 1–7.
21. Garcia DP, Rooney MT, Ahmad E, et al. Diagnostic usefulness of CD23 and FMC7 antigen expression patterns in B-cell lymphoma classification. Am J Clin Pathol 2001; 115: 258–265.
22. Gong JZ, Lagoo AS, Peters D, et al. Value of CD23 determination by flow cytometry in differentiating mantle cell lymphoma from chronic lymphocytic leukemia/small lymphocytic lymphoma. Am J Clin Pathol 2001; 116: 893–897.
23. Zanetto U, Dong H, Huang Y, et al. Mantle cell lymphoma with aberrant expression of CD10. Histopathology 2008; 53: 20–29.
24. Dong HY, Gorczyca W, Liu Z, et al. B-cell lymphomas with coexpression of CD5 and CD10. Am J Clin Pathol 2003; 119: 218–230.
25. Morice WG, Hodnefield JM, Kurtin PJ, et al. An unusual case of leukemic mantle cell lymphoma with a blastoid component, showing loss of CD5 and aberrant expression of CD10. Am J Clin Pathol 2004; 122: 122–127.
26. Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Döhner H. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia (IWCLL) updating the National Cancer Institute-Working Group (NCI-WG) 1996 guidelines. Blood 2008; 11: 5446–5456.
27. Krober A, Seiler T, Benner A, et al. V(H) mutation status, CD38 expression level, genomic aberrations, and survival in chronic lymphocytic leukemia. Blood 2002; 100: 1410–1416.
28. Matutes E, Owusu-Ankomah K, Morilla R, Garcia Marco J, Houlihan A, Que TH. The immunological profile of B-cell disorders and proposal of a scoring system for the diagnosis of CLL. Leukemia 1994; 8: 1640–1645.
29. Alapat D, Coviello-Malle J, Owens R, et al. Diagnostic usefulness and prognostic impact of CD200 expression in lymphoid malignancies and plasma cell myeloma. Am J Clin Pathol 2012; 137(1): 93–100.
30. Palumbo GA, Parrinello N, Fargione G, et al. CD200 expression may help in differential diagnosis between mantle cell lymphoma and B-cell chronic lymphocytic leukemia. Leuk Res 2009; 33: 1212–1216.
31. Spacek M, Karban J, Radek M, etal. CD200 expression improves differential diagnosis between chronic lymphocytic leukemia and mantle cell lymphoma. Blood 2014; 124(21): abstrakt 5637.
32. Dorfman DM, Shahsafaei A. CD200 (OX-2 membrane glycoprotein) expression in B cell-derived neoplasms. Am J Clin Pathol 2010; 134: 726–733.
33. Matutes E, Oscier D, Montalban C, et al. Splenic marginal zone lymphoma proposals for a revision of diagnostic, staging and therapeutic criteria. Leukemia 2008; 22: 487–495.
34. Baseggio L, Traverse-Glehen A, Petinataud F, Callet-Bauchu E, Berger F, Ffrench M. CD5 expression identifies a subset of splenic marginal zone lymphomas with higher lymphocytosis: a clinico-pathological, cytogenetic and molecular study of 24 cases. Haematologica 2010; 95: 604–612.
35. Yatabe Y, Suzuki R, Tobinai K, et al. Significance of cyclin D1 overexpression for the diagnosis of mantle cell lymphoma: a clinicopathologic comparison of cyclin D1-positive MCL and cyclin D1-negative MCL-like B-cell lymphoma. Blood 2000; 95(7): 2253–2261.
36. Zhou DM, Chen G, Zheng XW, Zhu WF, Chen BZ. Clinicopathologic features of 112 cases with mantle cell lymphoma. Cancer Biol Med 2015; 12(1): 46–52.
37. Juskevicius D, Ruiz C, Dirnhofer S, Tzankov A. Clinical, morphologic, phenotypic, and genetic evidence of cyclin D1-positive diffuse large B-cell lymphomas with CYCLIN D1 gene rearrangements. Am J Surg Pathol 2014; 38(5): 719–727.
Labels
Haematology Internal medicine Clinical oncologyArticle was published in
Transfusion and Haematology Today

2015 Issue 4
Most read in this issue
- Iron metabolism in blood donors
- Hereditary amyloidosis – aetiology, clinical features and treatment options
- The cytomorphology and immunophenotype of mantle-cell lymphoma
- The role of rituximab maintenance in elderly patients with mantle cell lymphoma in first remission – single centre experience
