-
Medical journals
- Career
Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Authors: J. Blatný 1; O. Zapletal 1; S. Köhlerová 1; V. Fiamoli 1; M. Jelínková 1; P. Ovesná 2
Authors‘ workplace: Oddělení dětské hematologie, FN Brno, LF MU Brno 1; Institut biostatistiky a analýz, LF MU, Brno 2
Published in: Transfuze Hematol. dnes,20, 2014, No. 4, p. 103-106.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Profylaxe je zlatým standardem léčby těžké formy hemofilie. Profylaktická, stejně jako „on-demand“ léčba je po výtce vedena a dávkována pouze na základě hmotnosti pacienta. Existuje však významná interindividuální variabilita mezi jednotlivými osobami s hemofilií a identická léčba tak může vést k významně odlišným výsledkům. S pomocí farmakokinetiky lze léčbu optimalizovat pro každého jednotlivce a zvýšit tak nejen její efektivitu, ale dosáhnout i optimalizace vynakládaných finančních prostředků. Autoři shrnují vlastní i literární zkušenosti s léčbou hemofilie na základě farmakokinetiky a vyzdvihují výhody takové léčby pro pacienty, zdravotníky i plátce zdravotní péče.
Klíčová slova:
hemofilie, koncentrát faktoru, farmakokinetikaÚvod
Profylaxe je zlatým standardem léčby osob s těžkou formou hemofilie (PWH – Persons with haemophilia), zejména v dětském věku. V posledních letech však i u nás roste počet dospělých s hemofilií, kteří využívají výhody profylaktické léčby. Ti, u nichž není profylaxe indikována či není možno ji z jakéhokoli důvodu poskytovat, jsou léčeni pouze při krvácení (léčba „on-demand“). Od konce 60. let, kdy byla profylaxe poprvé zavedena do klinické praxe (1), až do současnosti je nejčastěji používáno dávkování vycházející pouze z hmotnosti léčeného. I když za uplynulých více než 40 let tento přístup přinesl obrovské změny v léčbě hemofilie, zdá se, že strategie uniformního dávkování podle hmotnosti má své limity, na které v současnosti při snaze o další zkvalitnění péče začínáme narážet.
Standardní dávkování totiž nezohledňuje fakt, že efekt léčby (tedy doba, po kterou je v krvi nemocného hladina faktoru vyšší než kritická hodnota) je významně odlišný u jednotlivých PWH. Významná interindividuální variabilita daná rozdíly v poločasu podávaného koncentrátu faktoru resp. v jeho metabolismu („clearance“) je patrná jak u osob s hemofilií B (deficit FIX), tak především u osob s hemofilií A (deficit FVIII). Podle literárních údajů se může poločas koncentrátu podaného léčebně osobě s hemofilií A (tedy doba, za kterou klesne hladina FVIII v krvi pacienta na polovinu) pohybovat od 7 do 20 h (2), nebo dokonce od 6 do 28,8 h (3). Tyto rozdíly jsou dány především hladinou von Willebrandova faktoru (vWF), ale působí zde i jiné činitele, například věk (4).
Rozdíly jsou tedy větší než 200 % a je zcela zjevné, že dávkování pouze podle hmotnosti pacienta může vést k významně odlišným výsledkům u jednotlivých PWH. Když totiž přeneseme výše uvedené číselné údaje do praktické každodenní léčby, znamená to, že doba, po kterou se po podání identické dávky FVIII (např. 30 IU/kg) hladina faktoru udržuje nad 1 %, se může u jednotlivých PWH lišit až o 2,5 dne (5)! Pro hemofilii B jsou sice rozdíly vyjádřené procentuálně patrně méně signifikantní, ale s ohledem na významně delší přirozený poločas FIX je i zde interindividuální variabilita velmi významná. Z výše uvedeného jednoznačně plyne, že při užití dávkování zohledňujícího pouze hmotnost je část osob léčena nadměrně a část osob je léčena nedostatečně. V obou případech dochází k neefektivnímu využití léku (a tím i finančních zdrojů), neboť v prvním případě jsou zdroje vynakládány zbytečně a ve druhém případě neúčelně (nízké dávkování vede k vyššímu počtu krvácení, které následně nejen zhoršuje zdravotní stav a kvalitu života PWH, ale vynutí si i další prostředky na léčbu takových krvácení). I když se to týká především léčby profylaktické, má interindividuální variabilita význam i pro léčbu „on demand“. Jakým způsobem tedy zohlednit tyto signifikantní rozdíly mezi jednotlivci? Odpovědí je dle názoru autorů individualizovaná („na míru šitá“) léčba na základě farmakokinetiky.
Díky vyšetření farmakokinetiky lze u každého jednotlivce stanovit poločas léku/koncentrátu faktoru, kterým je léčen (T1/2), výši maximální hladiny, které dosáhneme podáním dané léčebné dávky („peak“), odpověď konkrétní osoby na léčbu (IVR – „in vivo recovery“) a z farmakokinetické křivky lze odečíst i dobu, za kterou klesne hladina faktoru v krvi pacienta pod určitou mez. Z praktického pohledu je vhodné se zaměřit kromě T1/2 a IVR i na dobu, kdy hladina klesne na 12 %, neboť v době, kdy je hladina FVIII nad 12 %, v podstatě nedochází k žádným klinicky významným kloubním krvácením (6), případně pod 1 %, kdy PWH již léčbou není chráněna vůbec. Všechny tyto parametry se liší nejen pro jednotlivé PWH, ale mohou se lišit i pro jednotlivé koncentráty koagulačních faktorů. Jak lze tedy výstup farmakokinetické analýzy (PK) využít v praxi:
- PK poskytne detailní a pro daného jedince specifické informace o efektu léčby.
- Na základě PK lze dle potřeby upravit léčbu (její interval, dávkování, případně i výběr koncentrátu).
- Léčená osoba může, se znalostí PK, přizpůsobit své aktivity poskytované léčbě a maximalizovat tak její efekt (např. prováděním rizikových aktivit pouze v době, kdy je ochrana podaným lékem maximální).
- Kombinací výše uvedeného (tedy sladěním ideálního dávkovacího režimu a aktivit léčené osoby) lze s pomocí PK dosáhnout optimalizace nákladů („cost-effectivity“) na léčbu každé PWH.
Vyšetření PK není nikterak náročné. Existují např. doporučení ISTH (International Society for Thrombosis and Haemostasis) jak pro PK u osob s hemofilií A, tak s hemofilií B. Pro příklad uveďme doporučení pro vyšetření PK u osob s hemofilií A, jimiž se řídí pracoviště autorů. Odběry hladiny FVIII jsou provedeny po minimálně 48 h (ideálně 72 h, je-li to možné) bez léčby FVIII. Tím eliminujeme přítomnost faktoru kolujícího v krvi pacienta po jeho předchozím podání. Pak je podána dávka FVIII (ideálně dávka identická s tou, která je podávána při profylaxi a/nebo léčbě krvácení – výsledky PK pak odpovídají reálné každodenní situaci a jsou optimálně použitelné pro danou osobu při dané léčebné strategii). Následně jsou odběry prováděny v těchto intervalech: 30 min., 1 hod., 3 hod., 6 hod., 12 hod., 24 hod., 48 hod. (případně i 72 hod.). U dětí mladších 6 let se počet odběrů většinou redukuje na pět. Z uvedeného jasně vyplývá, že i když lze PK vyšetření provést za hospitalizace (zejména menší děti a/nebo osoby žijící ve větší vzdálenosti od centra provádějícího vyšetření), lze vše stejně dobře zajistit i formou ambulantní a/nebo stacionární péče s minimem zameškaných hodin z práce/školy. Ty se v podstatě omezí pouze na jeden den (pouze první den je prováděn více než 1 odběr za 24 h). Parametry PK lze však zjistit i u osob, které nechtějí a/nebo nemohou kompletní PK vyšetření podstoupit. S použitím populačních farmakokinetických modelů založených na Bayesiánské statistické metodě, lze s pomocí 1 až 2 odběrů s velkou přesností určit základní PK parametry u každého jedince s hemofilií (4, 7).
Jak tedy užít PK v klinické praxi? Pro ilustraci níže uvádíme postupy a doporučení, která jsou standardně zavedena na oddělení dětské hematologie FN Brno:
- Vyšetření PK je nabídnuto všem dětem s těžkou formou hemofilie A/B, které absolvovaly již minimálně 50 ED („exposure days“). V případě souhlasu rodiny je možno jej opakovat každé 2 roky (PK se s věkem může měnit).
- V případě žádosti o vyšetření PK u dítěte s jinou než těžkou formou choroby je toto rovněž zváženo a podle možností se mu snažíme vyhovět.
- Vyšetření PK je vždy provedeno při přechodu na jiný derivát, ať už je příčina této změny jakákoli. Důvodem je snaha o prokázání „non-inferiority“ při přechodu na jinou léčbu, tedy snaha maximálně ochránit pacienta.
- PK spolu s vyšetřením inhibitoru provádíme i mimo výše uvedená doporučení v případě, že dochází ke zhoršení efektu stávající léčby. PK rovněž používáme na monitorování efektu imunotoleranční léčby (ITT – „immune tolerance treatment“)
Výstupem PK vyšetření pro klinika je křivka a tabulka uvedená na obrázku 2. Výstupem pro pacienta je pak text uvedený na obrázku 1, který obsahuje i výkladovou část, jenž umožní pacientu pochopit význam výstupů PK vyšetření a převést tuto informaci do denní praxe.
Image 1. Výstup vyšetření farmakokinetiky pro pacienta. 
Image 2. Výstup vyšetření farmakokinetiky pro lékaře. 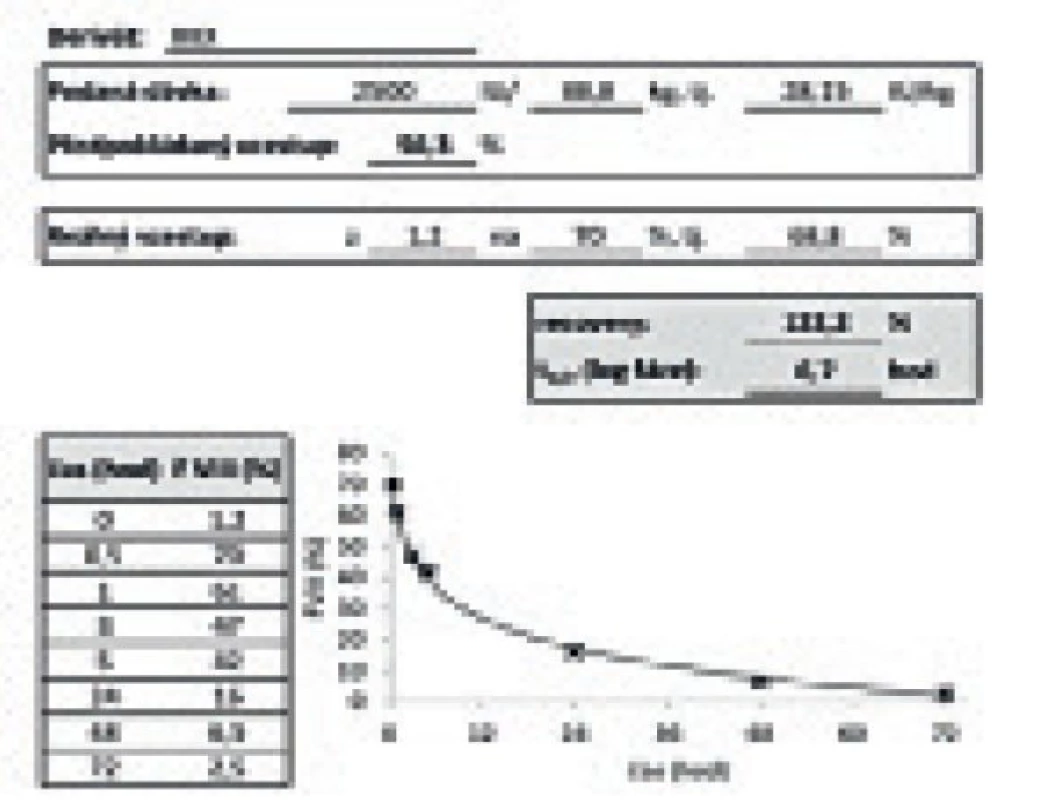
Závěrem lze tedy shrnout, že vyšetření farmakokinetiky má v léčbě hemofilie svůj jednoznačný význam a může z něj profitovat každý. Zdravotníkům poskytne informace nezbytné pro klinickou i ekonomickou optimalizaci nákladné léčby hemofilie a pacient se může cítit bezpečněji, neboť je schopen využít beze zbytku ochrany, kterou mu léčba poskytuje. Je navíc schopen, ve spolupráci se zdravotníky, přizpůsobit co nejlépe léčbu svým potřebám a/nebo své potřeby poskytované léčbě. Farmakokinetika tak jednoznačně přispívá k omezení počtu krvácení, má potenciál zlepšit kvalitu života osob s hemofilií a rovněž může být použita jako nástroj ke zvýšení nákladové efektivity („cost-effectivity“) léčby hemofilie.
Podíl autorů na tvorbě manuskriptu
JB napsal manuskript, MJ zodpovídala za veškerá laboratorní vyšetření. OZ, VF, SK, MJ a PO text připomínkovali a podíleli se na jeho závěrečné formě. Poděkování patří Jakubovi Gregorovi, který provedl grafické a formální úpravy a zpracoval text do podoby odpovídající standardům časopisu.
Doručeno do redakce: 27. 8. 2014
Přijato po recenzi: 30. 9. 2014
MUDr. Jan Blatný, Ph.D.
Oddělení dětské hematologie
Fakultní nemocnice Brno
jblatny@fnbrno.cz
Sources
1. Nilsson IM, Hedner U, Ahlberg A. Haemophilia prophylaxis in Sweden. Acta Paediatr Scand 1976; 65(2): 129-135.
2. van den Berg HM, De Groot PH, Fischer K. Phenotypic heterogenity in severe hemophilia. J Thromb Haemost 2007; 5(suppl.1): 151-156.
3. Fijnvandraat K, Peters M, Ten Cate JW. Interindividual variation in half-life of infused recombinant factor VIII is related to pre-infusion von Willebrand factor antigen levels. Br J Haematol 1995; 91(2): 474-476.
4. Björkman S, Oh M, Spotts G, et al. Population pharmacokinetics of recombinant factor VIII: the relationships of pharmacokinetics to age and body weight. Blood 2012; 119(2): 612-618.
5. Collins PW, Fischer K, Morfini M, et al. Implications of coagulation factor VIII and IX pharmacokinetics in prophylactic treatment of haemophilia. Heamophilia 2011; 17(1): 2-10.
6. Den Uijl IE, Mauser Bunschoten EP, Roosendaal G, et al. Clinical severity of haemophilia A: does the classification of the 1950s still stand? Haemophilia 2011; 17(6): 849-853.
7. Bjorkmann S. Pharmacokinetics of plasma-derived and recombinant factor IX – implications for prophylaxis and on-demand therapy. Haemophilia 2013; 19(6): 808-813.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2014 Issue 4-
All articles in this issue
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
- Phase IV open-label study of the efficacy and safety of deferasirox after allogeneic stem cell transplantation
- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Činnost transfuzní služby v České republice v období 1989–2013
- Indikátory kvality Českého národního registru dárců dřeně za rok 2013 a srovnání s předchozími roky
- The prognostic significance of early treatment response in pediatric relapsed acute myeloid leukemia: results of the international study Relapsed AML 2001/01
- Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials
- A novel integrated cytogenetic and genomic classification refines risk stratification in pediatric acute lymphoblastic leukemia
- Tacrolimus/sirolimus vs tacrolimus/methotrexate as GVHD prophylaxis after matched, related donor allogeneic HCT
- Factors that predict thrombosis in relatives of patients with venous thromboembolism
- Outcome of aplastic anemia in adolescence: a survey of the Severe Aplastic Anemia Working Party of the European Group for Blood and Marrow Transplantation
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Význam vyšetření párů těžkých/lehkých řetězců imunoglobulinu (Hevylite™) u mnohočetného myelomu
- Činnost transfuzní služby v České republice v období 1989–2013
- Retransfuzní systém s dvojitou integrovanou filtrací – parametry kvality produktu
- Farmakokinetika jako nástroj k optimalizaci léčby osob s hemofilií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

