-
Medical journals
- Career
Problematika těhotných žen s BCR/ABL negativními myeloproliferativními neoplaziemi
Authors: J. Kissová 1; M. Penka 1; P. Ovesná 2; A. Buliková 1; Romana Gerychová 3
Authors‘ workplace: Oddělení klinické hematologie Fakultní nemocnice Brno 1; Institut biostatistiky a analýz Masarykovy univerzity Brno 2; Gynekologicko-porodnická klinika Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity Brno 3
Published in: Transfuze Hematol. dnes,19, 2013, No. 4, p. 197-208.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Klinický průběh BCR/ABL negativních myeloproliferativních neoplazií je často komplikován trombotickými a v menší míře i krvácivými komplikacemi. I přesto, že tato onemocnění jsou všeobecně považována za choroby staršího věku, až 20 % pacientů s esenciální trombocytemií je mladších 40 let. Zvyšování věku rodiček a současně i zlepšení diagnostiky hematologických chorob vedou k narůstající incidenci gravidit u těchto onemocnění. Výskyt těhotenských komplikací je ve srovnání s ostatními graviditami vyšší, reprodukční ztráty u těchto žen jsou 2–3krát častější. Nejčastější komplikací gravidit těchto žen je spontánní abort v 1. trimestru gravidity (25–40 %), pozdní ztráty plodu (8–21 %). Intrauterinní retardace růstu plodu, porod mrtvého plodu a abrupce placenty jsou méně časté. Tyto komplikace vznikají bez ohledu na počet trombocytů, častěji se objevují u pacientek s komplikacemi v předchozích graviditách a s pozitivitou mutace JAK2 V617F. Omezený počet publikovaných dat činí obtížným získat jasný pohled na všeobecné riziko těchto příhod. Terapeutické možnosti představují od podávání kyseliny acetylsalicylové, nízkomolekulárního heparinu až k cytoredukční léčbě cíleně podle zhodnocení rizikových faktorů pacientky. V práci byla hodnocena retrospektivní data skupiny 7 žen s celkovým počtem 14 gravidit při diagnóze BCR/ABL negativního myeloproliferativního onemocnění. Ve shodě s literárními údaji byla zjištěna vyšší incidence těhotenských komplikací, zvláště u pacientek s pozitivitou mutace JAK2 V617F. Nízký počet gravidit v jednotlivých centrech neumožňuje jednoznačné vyjádření nejen k rizikovým faktorům těhotenských komplikací, ale i k terapeutickým doporučením. Limitace publikovaných dat s touto problematikou je výzvou ke spolupráci center nejen na úrovni celostátní, ale i mezinárodní.
Klíčová slova:
myeloproliferativní neoplazie, gravidita, trombocytemie, polycytemie, myelofibrózaÚVOD
BCR/ABL negativní myeloproliferativní neoplazie (MPN) jsou klonální onemocnění kmenové buňky, charakterizovaná proliferací jedné nebo více myeloidních linií, doprovázená zvýšeným výskytem trombotických i krvácivých komplikací. Tato skupina chorob definovaná WHO klasifikací zahrnuje tři nejčastější skupiny onemocnění – esenciální trombocytemii (ET), pravou polycytemii (PV) a primární myelofibrózu (PMF). Maximum incidence těchto onemocnění je mezi 50–70 roky věku. Nicméně, zejména v případě ET, je druhý vrchol u žen v reprodukčním věku a 15 % pacientů s PV je v době diagnózy mladší než 40 let (1, 2). Tato onemocnění se tedy vyskytují i u žen v reprodukčním věku, mohou být diagnostikována v graviditě či během vyšetření pro sterilitu či infertilitu.
Průběh těhotenství je spojen s vyšším rizikem trombotických komplikací, přibližně 6krát vyšším než u žen mimo graviditu (3, 4). Tato tendence je umocněna u žen s BCR/ABL negativními MPN. Gravidity pacientek s MPN jsou spojeny s relativně vysokou incidencí komplikací – spontánních abortů, abrupce placenty, preeklampsie a intrauterinní růstové retardace plodu (1, 5). Mezi myeloproliferativními neoplaziemi je nejčastější diagnózou mladých žen ET, méně časté jsou gravidity u PV a PMF. Těhotenské ztráty u žen s MPN jsou přibližně 2–3krát častější ve srovnání s všeobecnou populací. Při stanovení léčebné strategie těhotných žen s MPN vyvstávají tři hlavní problémy: teratogenicita látek užívaných v léčbě MPN, riziko těhotenských ztrát, trombohemoragické a jiné maternální komplikace. Léčebnými možnostmi těchto žen je podávání kyseliny acetylsalicylové (ASA), u pacientek s vysokým rizikem by mělo být zvažováno použití nízkomolekulárního heparinu (LMWH) a/nebo interferonu (IFN) alfa.
Přehled literárních dat bcr/abl negativních mpn v graviditě
V literatuře je publikováno kolem 500 případů gravidit s ET (tab. 1, 2) a méně než 50 gravidit u PV (tab. 3), minimální počet gravidit je zaznamenán u PMF (tab. 4). Publikovaná data jsou převážně retrospektivní a různorodá s ohledem na léčbu a výsledky gravidit. Navíc, v případě kazuistik či nízkých počtů gravidit, je tendence popsat pacientky spíše komplikované. Incidence spontánních abortů u fyziologických gravidit je 5 % během l. trimestru gravidity a 10–12 % do 24. týdne. Intrauterinní úmrtí plodu po 24. týdnu je zjišťováno asi u 1 % gravidit (5, 6, 7, 8). Porody v termínu u fyziologických gravidit tedy činí cca 80 % a potraty mezi 10–15 %. Projevy žilního trombembolismu v graviditě jsou uváděny u 1–2/1000 gravidit (9,10).
Table 1. Esenciální trombocytemie a gravidita – souhrn literárních dat (5, 11). 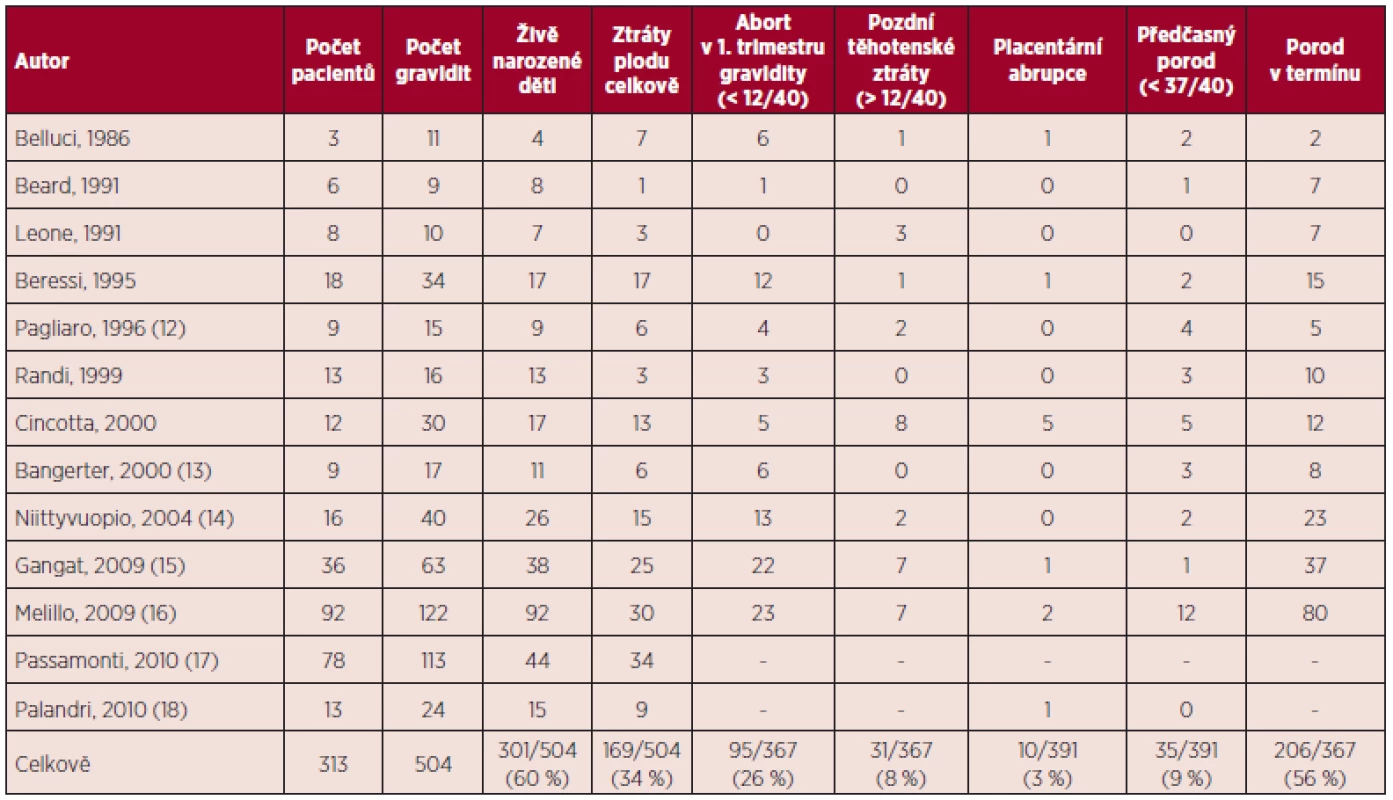
Table 2. Esenciální trombocytemie a gravidita – maternální komplikace v literatuře (5, 11). 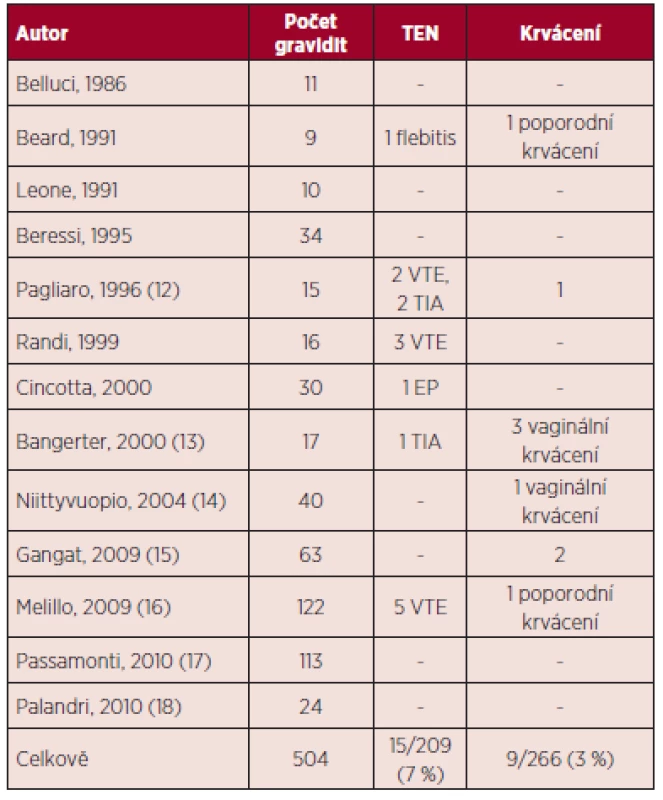
TEN – trombembolická nemoc, VTE – venózní trombembolismus, TIA – tranzitorní ischemická ataka, EP – embolie plicní Table 3. Pravá polycytemie a gravidita – souhrn literárních dat (5, 11). 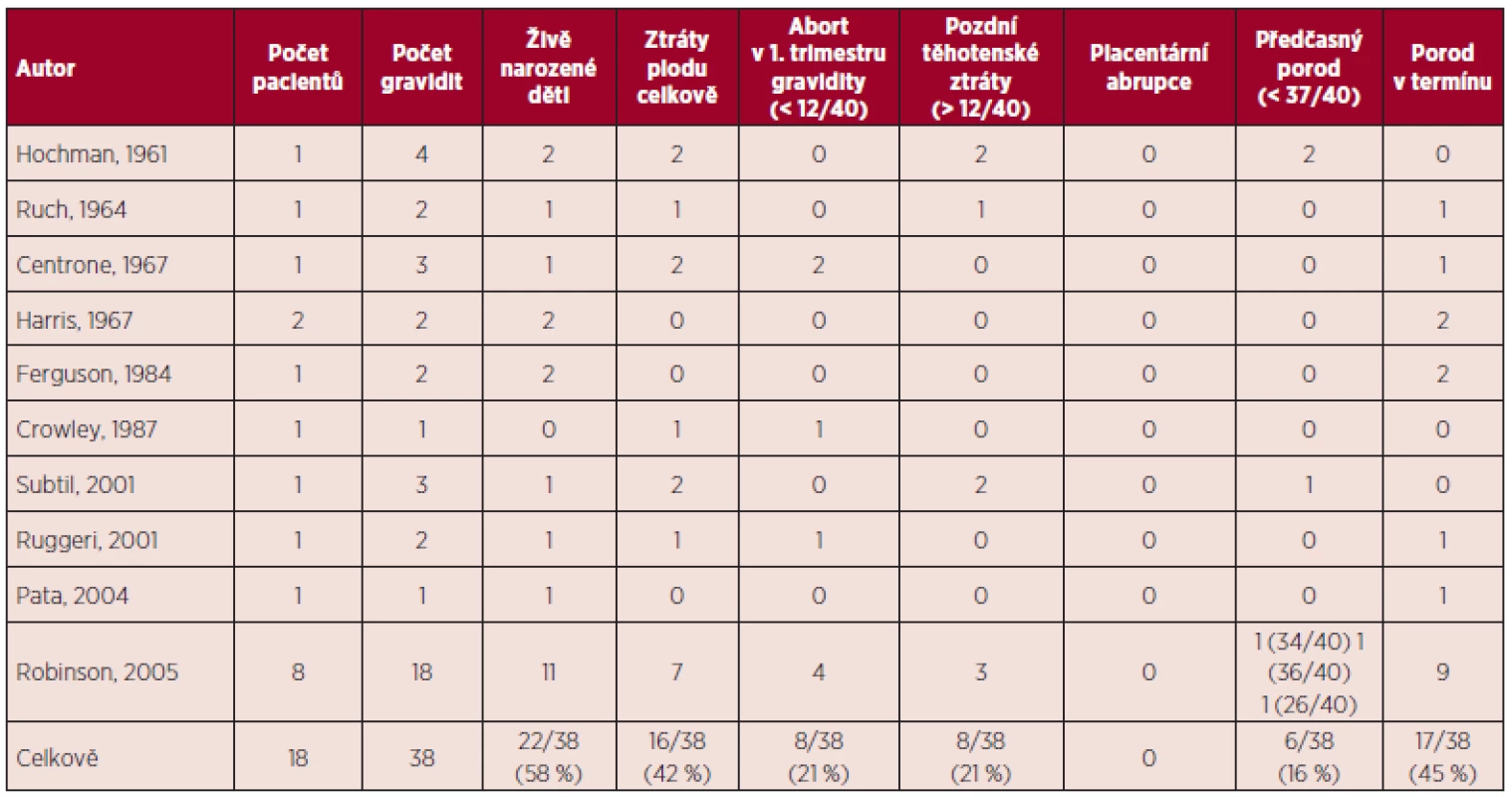
V přehledu publikovaných dat týkajících se gravidit u ET (viz tab. 1) je počet živě narozených dětí 60 %, u PV 58 %, procento těhotenských ztrát je u ET 34 %, u PV 42 %. Porody v termínu jsou v případě gravidit u MPN podstatně méně časté než u ostatních gravidit, u ET 56 %, u PV 45 %. Nejčastější komplikací těchto onemocnění je abort v l. trimestru gravidity, u ET činí 26 %, u PV 21 %. Pozdní těhotenské ztráty jsou publikovány u ET v 8 %, u PV 21 %, porod mrtvého plodu je uváděn u ET v 5 %, u PV 3 %, předčasný porod v 9 % u ET a 16 % u PV. V případě ET je rovněž uváděno riziko placentární abrupce (3 %). Data týkající se gravidit u PMF jsou velmi omezená (viz tab. 4), publikované případy naznačují až 50% riziko fetálních ztrát (11). Incidence maternálních komplikací u ET byla 7 % pro trombotické komplikace a 3 % pro krvácivé komplikace. V případě PV je publikováno vyšší procento maternálních komplikací ve srovnání s ET (11).
Table 4. Primární myelofibróza a gravidita – souhrn literárních dat (5, 11). 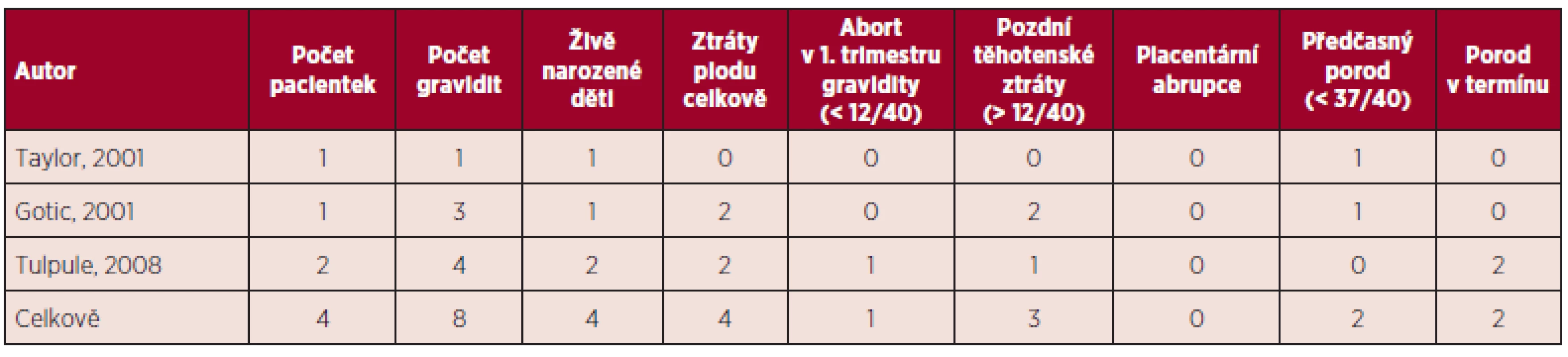
Patofyziologie těhotenských ztrát u mpn, rizikové faktory
Trombembolie je společně s krvácením nejčastější příčinou mateřské úmrtnosti. Trombotická okluze placentární cirkulace může být i pozdní manifestací placentární dysfunkce. U gravidních pacientek s MPN může protrombotický stav ovlivnit přestavbu děložních spirálních arterií, která je zásadní pro adekvátní přísun krve do placenty. Jestliže je remodelace mateřských spirálních arterií poškozená tvorbou mikrotrombů, dochází k abnormálnímu přísunu krve a výsledná placentární hypoperfuze může vést k abnormální interakci matky s plodem, ke zvýšení rizika preeklampsie a retardaci růstu plodu u MPN pacientek. Nicméně, tento mechanismus není vysvětlením pro opakované časné těhotenské ztráty. Patogeneze opakovaných těhotenských ztrát v 1. trimestru gravidity u těchto onemocnění tedy není jasná (11).
K patogenezi trombózy u MPN přispívají pravděpodobně četné faktory, včetně stupně trombocytózy, leukocytóza, zvýšení hematokritu, aktivace krevních destiček a leukocytů, formace destičko-leukocytových agregátů, cirkulující protrombotické a endoteliální faktory a jejich interakce (19, 20, 21). V případě těhotných žen s MPN jsou zvažovanými rizikovými faktory feto/maternálních komplikací anamnéza trombózy, krvácení a extrémní trombocytóza (1, 5). Nicméně, prediktory výsledků gravidity dosud nejsou jednoznačně určeny. Věk, parita, trombofilní stav, počet krevních destiček, leukocytů a hladina hemoglobinu nebyly jako prediktory výsledku gravidity u ET potvrzeny (15, 16, 22). V současnosti není jasné, zda přítomnost mutace JAK2 V617F zvyšuje riziko těhotenských komplikací u MPN. V r. 2007 Passamonti publikoval analýzu 103 gravidit u žen s ET. Podle této analýzy mají JAK2 V617F pozitivní ženy vyšší riziko komplikací gravidity než ženy s negativitou této mutace, tyto výsledky ukazují na možný vztah mezi JAK2 V617F a těhotenskými ztrátami (22). Data studie Mayo Clinic naznačují identický počet těhotenských ztrát mezi JAK2 V617F pozitivními a negativními ženami (15), nicméně italský registr uvádí, že mutace JAK2 V617F je spojena s horšími výsledky gravidit (fetální ztráty JAK2 V617F pozitivních 9/25, 36 %, negativních 2/24, 8,3 %, p = 0,037) (16).
Existují rovněž recentní data týkající se preventivního vyšetřování mutace JAK2 V617F u žen s těhotenskými ztrátami bez diagnózy MPN. Mutace JAK2 V617F byla detekována častěji u žen s těhotenskými ztrátami (1,06 %) než u kontrolních subjektů (23). Tento výsledek vedl k hypotéze, že JAK2 V617F může být dalším rizikovým faktorem i u žen s anamnézou recidivujících abortů. 389 žen s anamnézou rekurentních abortů bylo testováno na přítomnost JAK2 V617F, mutace nebyla detekována v žádném případě (23).
Rizikové faktory, které určují vysoké riziko v graviditě pacientek s BCR/ABL negativními MPN, stanovené na základě konsensu 21 expertů v rámci ELN (European LeukemiaNet) jsou uvedeny v tabulce 5 (24). Stejné rizikové faktory jsou součástí doporučení BCSH (British Comittee for Standards in Haematology) (25).
Table 5. Rizikové faktory v graviditě BCR/ABL negativních MPN dle doporučení ELN (24) a BCSH (25). 
Péče o gravidní s bcr/abl negativní mpn
Nezbytnou součástí terapeutické rozvahy při stanovení diagnózy MPN u žen v reprodukčním věku je péče o graviditu. V případě plánování gravidity je nutné informovat pacientky o potenciálních rizicích pro ženu a plod. Standardním postupem u pacientů s MPN mimo graviditu je poskytnout léčbu na základě zhodnocení trombotického či hemoragického potenciálu. Cílem léčby MPN v graviditě je zabránit fetální i maternální morbiditě a mortalitě. Léčebnými možnostmi těhotných žen s MPN jsou aspirin, heparin, cytoredukční látky, venepunkce, ale důkazy pro jednoznačná terapeutická doporučení jsou limitované.
Zvýšením plazmatického objemu v těhotenství dochází k redukci počtu trombocytů i hematokritu. Efekt snížení krevních destiček o 10–20 % je dobře známý u normálních gravidit (26, 27, 28). Redukce počtu krevních destiček u těhotných žen s ET je větší než redukce vídaná u normálních gravidit (29), u některých těhotných žen s ET počet trombocytů vykazuje progresivní pokles během gravidity až k normálním hodnotám (1). Přirozené snížení hematokritu může vést k omezené nutnosti venepunkce, která je volbou v případě rezistentních případů. Cílová hodnota hematokritu u těhotných žen by měla být udržována pod 0,45 (30, 31).
Cytoredukční léčba
Spontánní pokles hematokritu a trombocytů v době gravidity redukuje nutnost cytoredukční léčby a dostupná data neukazují vztah mezi počtem trombocytů a nepříznivým výsledkem gravidity (15, 16, 22). Jestliže je cytoredukce indikována, interferon alfa představuje nejbezpečnější možnost pro pacientky v graviditě. Z důvodu potenciálně teratogenního efektu by neměly být použity v graviditě cytoredukční látky jako hydroxyurea a busulfan. Zvláště během organogeneze v l. trimestru gravidity mohou tyto léky indukovat kongenitální malformace nebo aborty. Užívání anagrelidu v graviditě rovněž není doporučováno, i když byly publikovány zprávy o několika graviditách: popsány byly jak normální gravidity, tak i spontánní aborty v l. trimestru gravidity (32, 33, 34). Molekula anagrelidu je poměrně malá, prochází placentární bariérou a léčba v graviditě představuje potenciální možnost vzniku trombocytopenie u plodu (1). Pokud žena užívá anagrelid či hydroxyureu v době před plánováním gravidity, tyto léky by měly být vysazeny v době 3–6 měsíců před koncepcí. Pacientky s jasnou indikací k cytoredukční léčbě by měly být převedeny na interferon alfa. Navzdory malému počtu zaznamenaných gravidit ET léčených IFN alfa se zdá, že redukuje nejen komplikace během gravidity, ale má také potenciál zlepšit počet úspěšně zakončených těhotenství (16, 33, 35). IFN alfa je velká molekula, u které se nepředpokládá přestup placentární bariérou. Je pravděpodobně vylučován do mléka, a tedy se kojení během aplikace INF alfa nedoporučuje (36). K dispozici je rovněž několik zpráv o trombocytaferéze u těhotných žen s ET (37, 38). Efekt je většinou přechodný a není spojován s redukcí komplikací v graviditě. Trombocytaferéza by měla být zvažována ve vysoce rizikových situacích s excesivním zvýšením počtu destiček a po nedostatečné odpovědi na redukci počtu destiček IFN alfa (5). V případě intolerance IFN u pacientek s vyšším rizikem, je podle některých autorů možno zvážit podávání LMWH během l. trimestru a od 2. trimestru nasadit hydroxyureu (39).
Aspirin
Důkazy bezpečnosti podávání nízkých dávek kyseliny acetylsalicylové (ASA) během gravidity byly publikovány opakovaně (40, 41). Podávání ASA je doporučováno v nepřítomnosti jasných kontraindikací, jakými jsou astma, peptická ulcerace a krvácivá diatéza. V případě počtu trombocytů nad 1000 x 109/l narůstá riziko krvácivých komplikací, před zvažováním nasazení ASA je nutno vyloučit sekundární formu von Willebrandovy choroby. Výsledky studií zkoumajících účinnost ASA jsou rozdílné. Ve většině prací byl zaznamenán pozitivní efekt ASA na výsledek gravidity (5, 14, 17), zvláště v případech ET s recidivujícími spontánními aborty (33). Italský registr neprokázal jednoznačně pozitivní efekt ASA na výsledek těhotenství (16).
Nízkomolekulární heparin
Podávání nízkomolekulárního heparinu (LMWH) je v graviditě bezpečné, heparinem indukovaná trombocytopenie v graviditě byla popsána zřídka a riziko osteopenie je extrémně nízké. Neexistují prospektivní data, která by prokázala jednoznačně pozitivní efekt podávání heparinu v graviditě. U všech žen s MPN je doporučováno podávat LMWH po dobu 6 týdnů po porodu v nepřítomnosti projevů signifikantní krvácivé příhody (1). Publikované studie uvádějí též úspěšné použití LMWH ve vztahu k výsledku gravidity (12, 13). Nicméně, v těchto studiích byl heparin podáván buď týden před porodem, nebo během 2. trimestru gravidity, zatímco při hodnocení aspirinu byl ve studiích podáván po celou dobu gravidity.
Doporučení pro nejvhodnější léčbu těhotných žen v graviditě s MPN založená na důkazech dosud nejsou dána, neboť dosud byly publikovány jen retrospektivní studie. V posledních letech byla publikována doporučení European LeukemiaNet (ELN) pro léčebnou strategii gravidit u BCR/ABL negativních MPN vytvořená na základě konsensu 21 expertů (tab. 6) (24). V doporučení České pracovní skupiny pro BCR/ABL negativní MPN (CZEMP) z roku 2011 jsou rozpracovány principy diagnostiky a léčby včetně gravidit, komplexní problematika těhotných žen s MPN v těchto doporučeních podrobně analyzována není (21).
Table 6. Léčebná strategie BCR/ABL negativních MPN v graviditě podle doporučení ELN (24). 
ELN – European LeukemianNet, ASA – kyselina acetylsalicylová, LMWH – nízkomolekulární heparin Cíl práce
V naší práci byla zpracována retrospektivní data týkající se všech gravidit u žen s diagnózou BCR/ABL negativního myeloproliferativního onemocnění sledovaných na Oddělení klinické hematologie FN Brno v době od roku 2005 do roku 2013. Cílem práce je srovnání literárních dat s výsledky gravidit pacientek na našem pracovišti a upozornit na nutnost spolupráce jednotlivých center v této oblasti.
Materiál a metodika
Hodnocený soubor zahrnuje data 7 pacientek s minimálně jednou graviditou při diagnóze BCR/ABL negativního MPN. Celkově bylo zhodnoceno 14 gravidit, nebyly zahrnuty ukončené gravidity ze zdravotních či osobních důvodů. Diagnóza BCR/ABL negativního MPN byla stanovena na základě diagnostických kritérií WHO klasifikace v rozmezí let 2000–2008. U všech pacientek byla odebrána kompletní gynekologická anamnéza týkající se období před diagnózou MPN i po ní. Byla zaznamenána přítomnost kardiovaskulárních rizik (kouření, hyperlipidemie, hypertenze, diabetes mellitus, BMI > 25). Hodnocena byla u všech pacientek rovněž přítomnost vrozeného či získaného trombofilního stavu (mutace FV Leiden, mutace PT G20210A, deficit proteinu C a S, přítomnost antifosfolipidových protilátek, antitrombin, hladina homocysteinu, test ProC-global). Výsledky gravidit byly kategorizovány jako živě narozené děti a reprodukční ztráty, poslední uvedené zahrnují spontánní aborty v 1. trimestru gravidity, spontánní aborty do 24. týdne gravidity a intrauterinní úmrtí plodu po 24. týdnu gravidity. Kromě těchto událostí byly zaznamenány abrupce placenty a předčasné porody. Mezi maternální komplikace byly zahrnuty preeklampsie, gestační hypertenze, trombóza a krvácení. Vzhledem k nízkému počtu gravidit nebyly provedeny podrobnější statistické analýzy.
Výsledky
Diagnózy BCR/ABL negativních MPN byly následující – šest pacientek mělo diagnózu esenciální trombocytemie (85,7 %), jedna pacientka pravou polycytemii (14,3 %). Průměrný věk v době stanovení diagnózy MPN byl 29 let. U pěti pacientek byla zjištěna pozitivita mutace JAK2 V617F (71,4 %). Další charakteristiky základního onemocnění uvedeny v tabulce 7.
Table 7. Charakteristika souboru pacientek s diagnózou BCR/ABL negativního MPN. 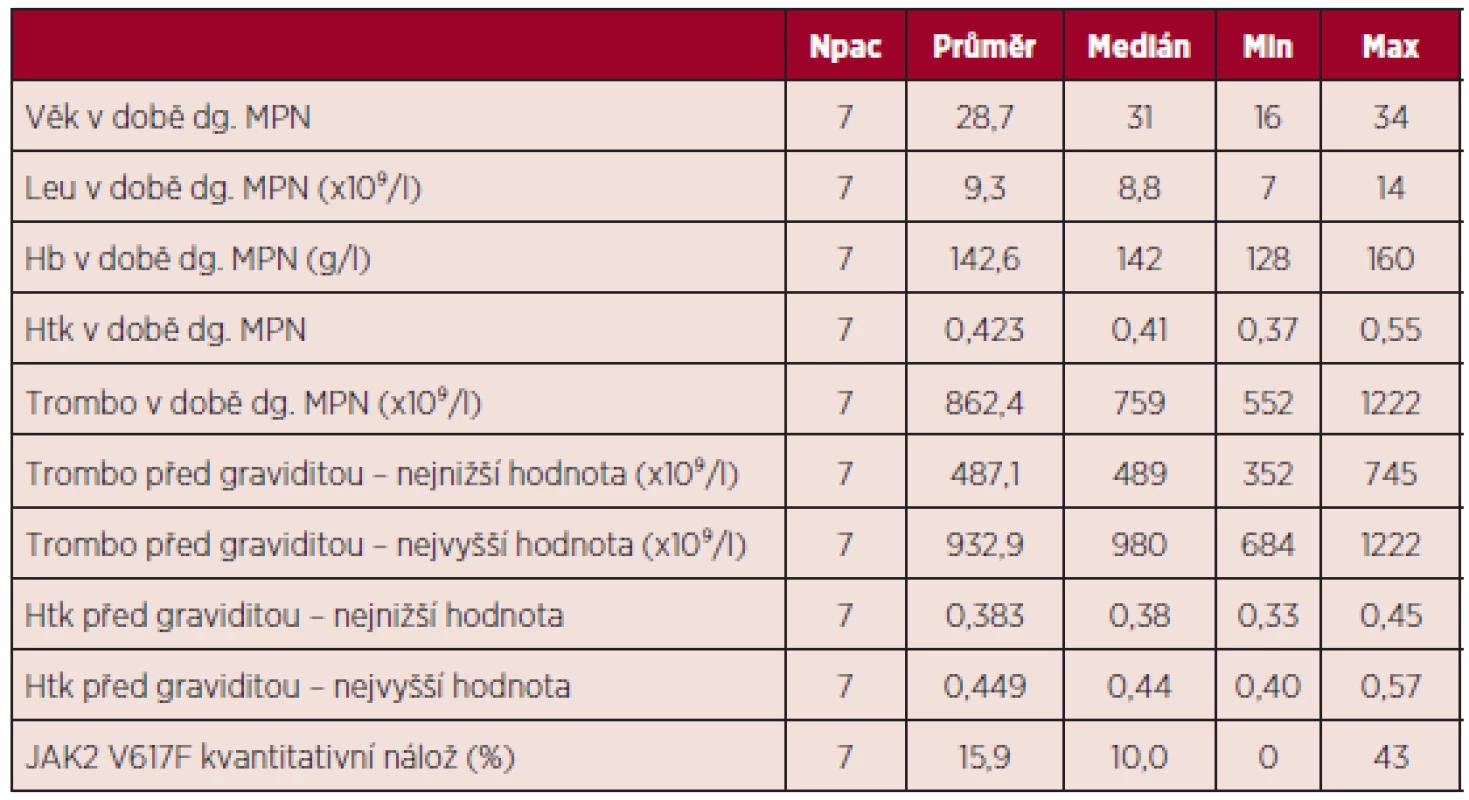
dg. – diagnóza, Leu – počet leukocytů, Hb – hemoglobin, Htk – hematokrit, Trombo – počet trombocytů Při hodnocení výskytu trombofilních stavů nebyla u žádné z pacientek zjištěna hereditární trombofilie, rovněž nebyla potvrzena přítomnost antifosfolipidových protilátek. Z kardiovaskulárních rizik hodnocených mimo graviditu nebyla u žádné pacientky zaznamenána hyperlipidemie, diabetes mellitus ani hypertenze, jedna pacientka byla kuřačka a u dvou pacientek byl v období před graviditou BMI nad 25. Z hodnoceného souboru jen dvě pacientky prodělaly gravidity před diagnózou MPN (celkem 6 gravidit), u zbývajících 5 pacientek nebyla potvrzena žádná gravidita před diagnózou MPN. Výsledky gravidit před stanovením diagnózy MPN ukazuje tabulka 8.
Table 8. Výsledky gravidit před stanovením diagnózy MPN. 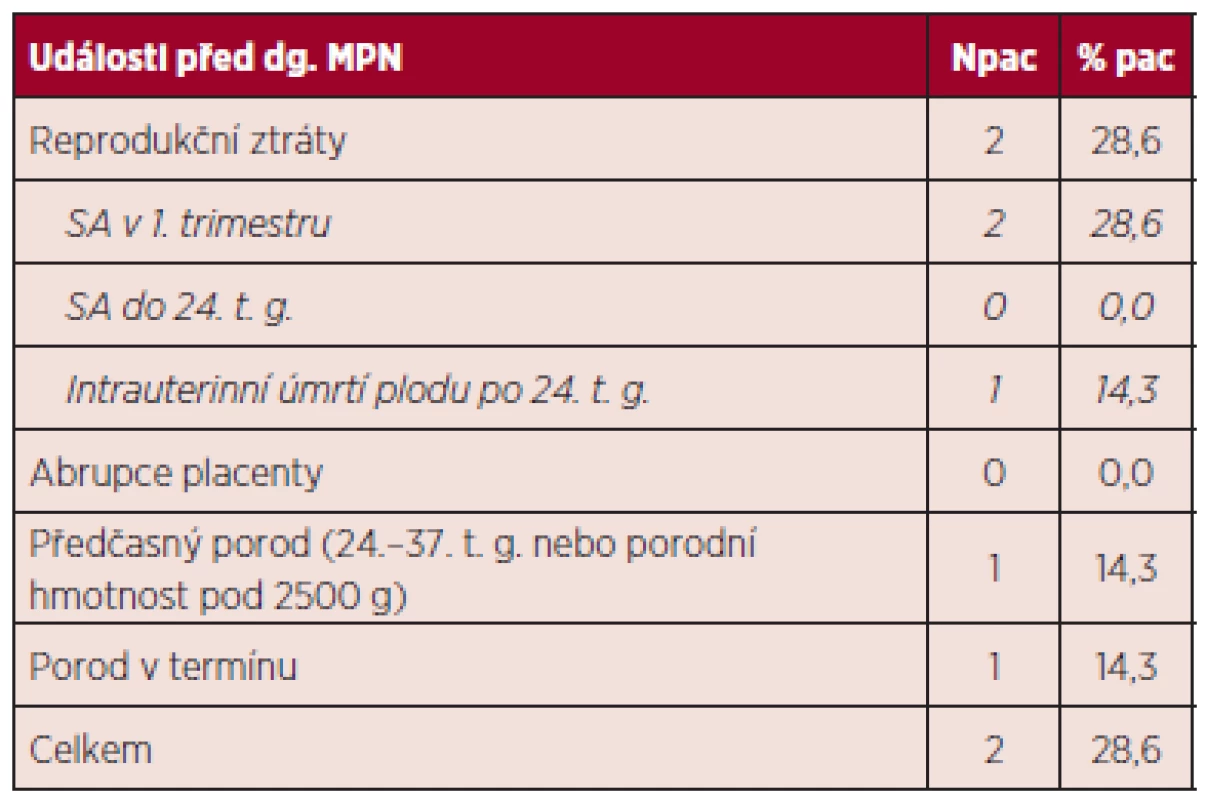
dg. – diagnóza, SA – spontánní abort, t. g. – týden gravidity Celkově bylo hodnoceno 14 gravidit při diagnóze BCR/ABL negativního MPN. Dvě pacientky ze 7 sledovaných měly po diagnóze MPN zaznamenánu jednu graviditu, tři byly gravidní dvakrát a dvě pacientky byly gravidní třikrát. Průměrný věk v době gravidity činil 31 let; u 4 gravidit byl věk pacientky v době otěhotnění nad 35 let. Průběh 14 zaznamenaných gravidit ve vztahu k pozitivitě či negativitě mutace JAK2 V617F uvádí tabulka 9.
Table 9. Průběh zaznamenaných gravidit v době diagnózy MPN. 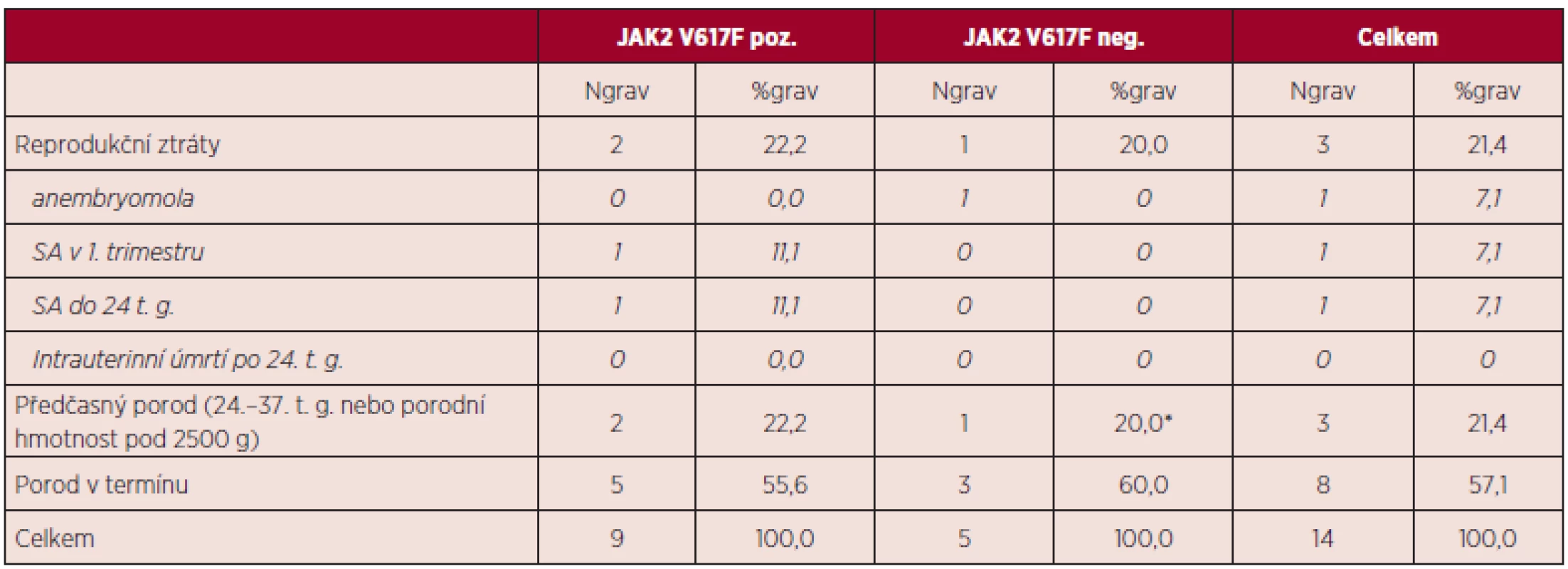
SA – spontánní abort, t. g. – týden gravidity, *předčasný SC porod – prevence ruptury dělohy po dvou operativních porodech Důvodem dvou případů předčasného porodu (JAK2 V617F pozitivita) byla indukce porodu pro preeklampsii. Příčinou případu spontánního abortu do 24. týdne gravidity byla abrupce placenty.
Vývoj parametrů krevního obrazu v průběhu gravidity a jejich vztah k výsledkům gravidity uvádí tabulka 10. Vztah některých rizikových faktorů pro vznik tromboembolické nemoci a přechozích gravidit k výsledkům gravidit v době MPN uvádí tabulka 11. Všechny tři spontánní aborty v době diagnózy MPN byly zaznamenány u pacientek s předchozí negativní gynekologickou anamnézou.
Table 10. Vztah věku a laboratorních parametrů v průběhu gravidity k výsledkům gravidit v průběhu diagnózy MPN. 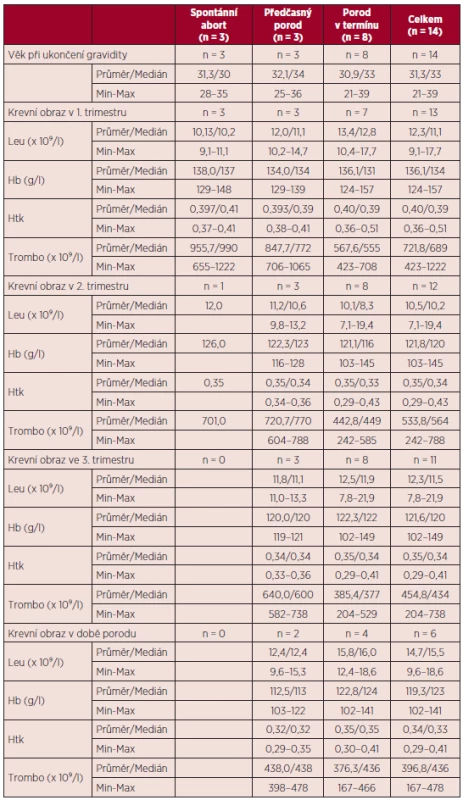
Leu – počet leukocytů, Hb – hemoglobin, Htk – hematokrit, Trombo – počet trombocytů Table 11. Vztah diagnózy, pozitivních rizikových faktorů pro vznik TEN a předchozích gravidit k výsledkům gravidity v době diagnózy MPN. 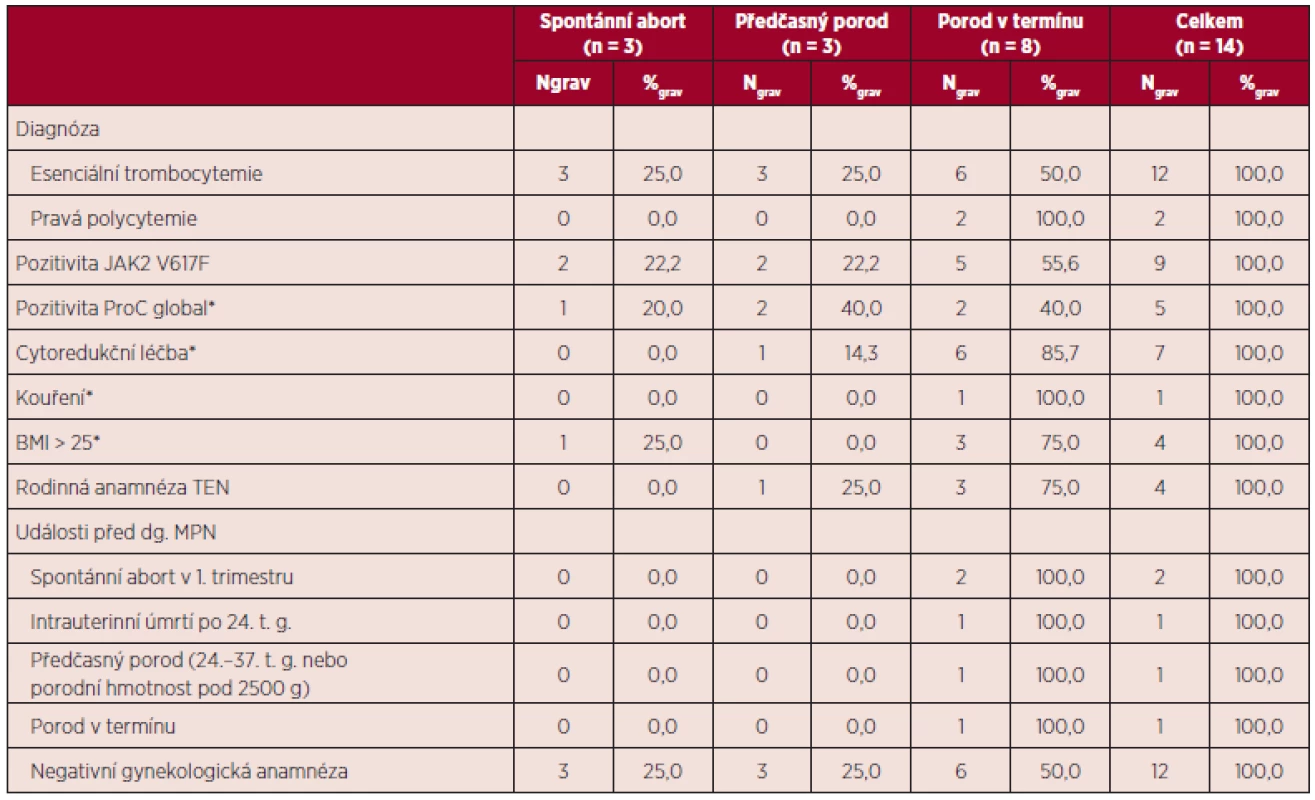
*mimo graviditu, t. g. – týden gravidity, TEN – trombembolická nemoc Maternální komplikace jsou uvedeny v tabulce 12, zvlášť jsou uvedeny komplikace v případě pozitivity a negativity mutace JAK2 V617F. Ve skupině JAK2 V617F pozitivních pacientek byly zaznamenány krvácivé komplikace, preeklampsie a gestační hypertenze, ve skupině JAK2 V617F negativních žen bylo jedinou komplikací krvácení v průběhu tří gravidit u pacientky se sekundární formou von Willebrandovy choroby.
Table 12. Maternální komplikace v hodnoceném souboru. 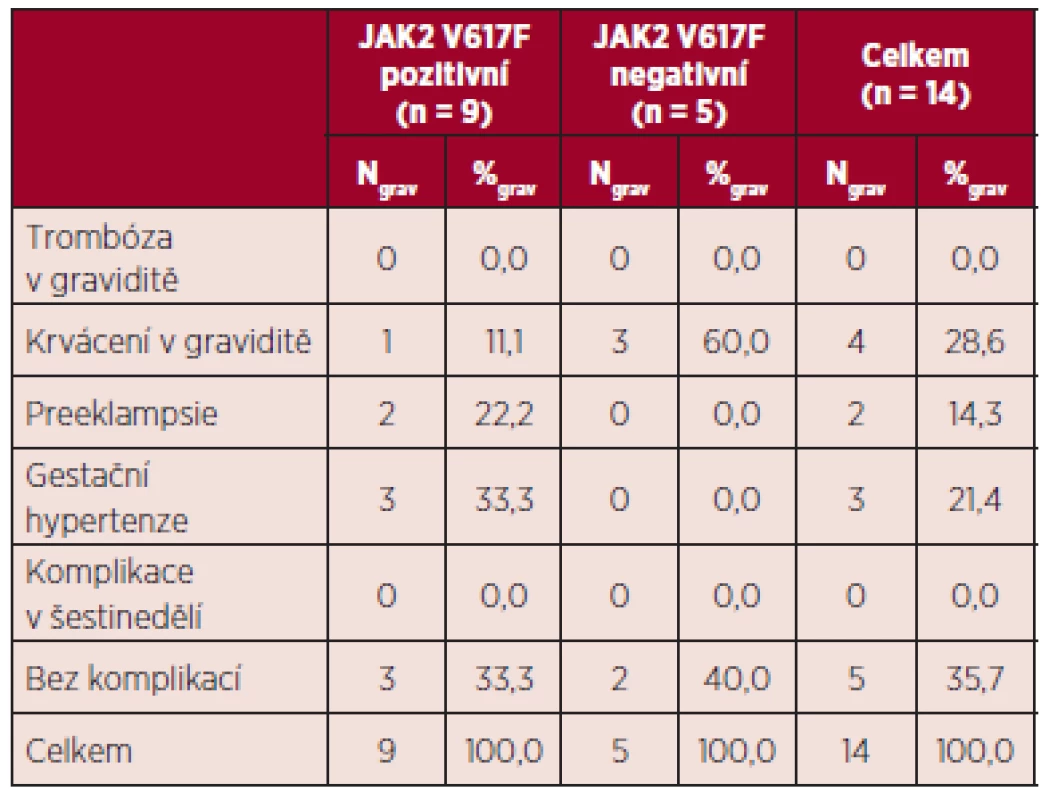
Cytoredukční léčba v období před hodnocenými graviditami byla zaznamenána u 4 pacientek, v léčbě těchto pacientek byl podáván anagrelid, INF alfa i hydroxyurea. V průběhu tří těhotenství (21,4 %) bylo pokračováno v cytoredukční léčbě INF alfa po celou dobu těhotenství. Kyselina acetylsalicylová byla podávána po celou dobu gravidity u 8 gravidit (57,1 %), u 5 gravidit (35,7 %) nebyla ASA podávána pro sekundární formu von Willebrandovy choroby. Nízkomolekulární heparin byl podáván ve 13 případech těhotenství (92,8 %), pouze v případě anembryomoly aplikován nebyl. V 10 graviditách (71,4 %) byl LMWH podáván ke konci gravidity a v době šestinedělí, ve dvou těhotenstvích po celou dobu gravidity (14,3 %), v jedné graviditě (7,1 %) byl LMWH podáván pouze přechodně po prodělaném spontánním abortu.
Srovnání výsledků našeho souboru s publikovanými výsledky uvádí tabulka 13.
Diskuse
V souboru gravidit pacientek s BCR/ABL negativními MPN byl v souladu s literárními údaji zaznamenán vyšší výskyt komplikací gravidity. Reprodukční ztráty v našem souboru činily 21,4 %, porody v termínu 57,1 %, předčasné porody 21,3 %, což i přes nízký počet hodnocených gravidit jsou výsledky srovnatelné s literárními údaji (viz tab. 13). V naší práci jsme ve skupině pacientek s pozitivitou mutace JAK2 V617F zaznamenali vyšší výskyt komplikací gravidity ve srovnání se skupinou pacientek s negativitou této mutace. Rozdíly nebyly statisticky srovnávány pro nízký počet hodnocených gravidit. V případě maternálních komplikací byly ve skupině pacientek JAK2 V617F negativních registrovány pouze krvácivé komplikace, jednalo se o gravidity u pacientky se sekundární von Willebrandovou chorobou. Ve skupině JAK2 V617F pozitivních pacientek byl zjištěn vyšší výskyt preeklampsie (22,2 %) a gestační hypertenze (33,3 %). Tyto výsledky jsou ve shodě s literárními daty, která uvádějí vyšší riziko preeklampsie u pacientek s MPN (5, 11). Některá publikovaná data rovněž potvrzují pozitivitu JAK2 V617F jako významný rizikový faktor pro těhotenské komplikace u žen s BCR/ABL negativními MPN (16, 22). U žádné z hodnocených pacientek nebyla zjištěna trombofilní mutace či výskyt antifosfolipidových protilátek, tudíž podíl trombofilních stavů na výsledek gravidity v našem souboru nelze hodnotit. Rovněž vliv kardiovaskulárních rizik nelze posoudit pro nízký počet pozitivních rizikových faktorů (viz tab. 11). Pozitivní anamnéza těhotenských komplikací před stanovením diagnózy MPN v našem souboru neměla vliv na průběh gravidit v průběhu MPN, opět zde hraje roli nízký počet hodnocených gravidit a dále i fakt, že tyto pacientky byly brány jako rizikové a byla jim v graviditě poskytnuta komplexní léčba (viz tab. 11). Počet krevních destiček, leukocytů a hladina hemoglobinu v literatuře nebyly potvrzeny jako prediktory výsledku gravidity u ET (15, 16, 22). Průměrný počet trombocytů v l. trimestru gravidity byl v našem souboru u pacientek s reprodukčními ztrátami vyšší než ve skupině pacientek s porodem v termínu (955,7 x 109/l versus 567,6 x 109/l), obdobné výsledky přináší medián počtu trombocytů (990 x 109/l versus 555 x 109/l). Tyto výsledky naznačují možný vliv vyššího počtu trombocytů na komplikace gravidity na rozdíl od publikovaných dat. Během 2. trimestru bylo zaznamenáno spontánní snížení počtu trombocytů, při hodnocení pacientek bez cytoredukční léčby v graviditě (11 pacientek) bylo zjištěno, že při srovnání hodnot trombocytů mezi 1. a 3. trimestrem došlo u těchto pacientek ke spontánnímu snížení počtu trombocytů průměrně o 28,8 %, a pokud byly srovnány tyto hodnoty s počty trombocytů v době porodu, jednalo se o průměrné snížení o 40,5 %. Tento pokles je větší než lze vídat u normálních gravidit, kde je popisováno snížení o 10–20 % (5, 26, 28) a kde je tento spontánní pokles vztahován ke zvýšení plazmatického objemu.
Table 13. Srovnání výsledků našeho souboru s výsledky literárních dat. 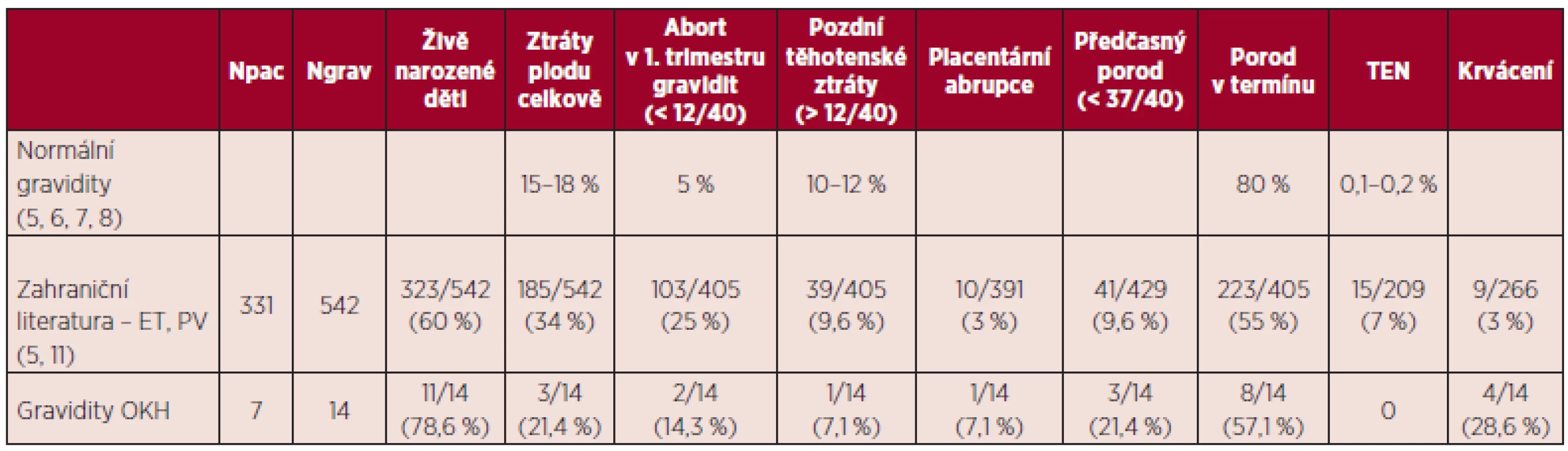
TEN – trombembolická nemoc, OKH – oddělení klinické hematologie V našem souboru pacientek s MPN v graviditě byla v léčbě podávána kyselina acetylsalicylová, nízkomolekulární heparin a interferon alfa. Efekt léčby na výsledek gravidity nelze vzhledem k malému souboru gravidit hodnotit. V literatuře je popisován významný efekt interferonu alfa na výsledek gravidity, podle publikace Melillové et al. je po léčbě IFN alfa popisováno až 95 % živě narozených dětí (16). V našem souboru nebyly u tří pacientek léčených v graviditě IFN alfa zaznamenány žádné reprodukční ztráty. Komplexní mechanismus účinku interferonu alfa v graviditě nemá dosud jednoznačné vysvětlení: kromě možného přínosu cytoredukčního efektu by podávání IFN mohlo hrát roli v maternálně-fetální interakci, která podléhá vlivu interferonů trofoblastu, přirozeně produkovaným placentou (42).
Závěr
BCR/ABL negativní MPN jsou významnou příčinou maternálních a fetálních komplikací gravidity. Péče o ženy s diagnózou MPN v reprodukčním věku vyžaduje multidisciplinární přístup – úzkou spolupráci hematologa s odbornými zkušenostmi v léčbě MPN a porodníka erudovaného v problematice rizikových gravidit.
Výsledky gravidit v našem souboru naznačují ve shodě s literárními údaji vyšší incidenci reprodukčních ztrát i mateřských komplikací u pacientek s diagnózou BCR/ABL negativních MPN. Strategie léčby v těhotenství u těchto chorob představuje specifický přístup podle stratifikace rizikových faktorů. V současné době je vyšší riziko těhotenských komplikací definováno rizikovými faktory, mezi které patří prodělaná žilní nebo tepenná trombóza, předchozí krvácení související se základním onemocněním, předchozí komplikace gravidity a přetrvávající zvýšení počtu krevních destiček nad 1500 x 109/l. Vyšší výskyt komplikací v graviditě je rovněž spojován s pozitivitou mutace JAK2 V617F.
Jednoznačná doporučení k léčbě u MPN gravidit nejsou dosud určena z důvodu limitace publikovaných dat. Při rozhodování o léčebné strategii lze využít publikovaná doporučení European LeukemiaNet i České pracovní skupiny pro myeloproliferativní choroby (CZEMP).
Limitace dat umožňujících stanovit jednoznačná terapeutická doporučení je výzvou ke spolupráci odborníků v problematice gravidit BCR/ABL negativních MPN. Cílem je zajistit na základě prospektivních dat co nejoptimálnější léčbu této skupiny onemocnění v graviditě.
Podíl autorů na přípravě rukopisu
J. K. – léčba pacientů, příprava rukopisu a schválení finální verze
M. P. – léčba pacientů, úprava rukopisu a schválení finální verze
P. O. – statistické zpracování dat, úprava rukopisu a schválení finální verze
A. B. – úprava rukopisu a schválení finální verze
R. G. – léčba pacientů, schválení finální verze
Poděkování
Podpořeno grantem MZ ČR - RVO (FNBr, 65269705). Práce byla částečně podpořena grantem Masarykovy university Brno, Česká republika, MUNI/A/0723/2012.
Doručeno do redakce: 23. 7. 2013
Přijato po recenzích: 1. 10. 2013
MUDr. Jarmila Kissová
Oddělení klinické hematologie
FN a LF MU Brno
Jihlavská 20
625 00 Brno
e-mail: jkiss
Sources
1. Harrison C. Pregnancy and its management in the Philadelphia negative myeloproliferative diseases. Br J Haematol 2005; 129 : 293-306.
2. Lavi N, Brenner B, Avivi I. Management of pregnant women with myeloproliferative neoplasms. Thromb Res 2013; 131(Suppl 1):S11-3.
3. Hellgren M. Hemostasis during normal pregnancy and puerperium. Semin Throm Hemost 2003; 29 : 125-30.
4. Brenner B. Haemostatic changes in pregnancy. Thromb Res 2004; 114 : 409-14.
5. Griesshammer M, Struve S, Harrison CM. Essential thrombocythemia/polycythemia vera and pregnancy: the need for an observational study in Europe. Semin Thromb Hemost 2006; 32 : 422-9.
6. Prine LW, MacNaughton H. Office management of early pregnancy loss. Am Famil Physician 2011; 84 : 75-82.
7. Everett C. Incidence and outcome of bleeding before the 20th week of pregnancy: prospective study from general practice. BMJ 1997; 315 : 32-4.
8. Wang X, Chen C, Wang L, Chen D, Guang W, French J. Conception, early pregnancy loss, and time to clinical pregnancy: a population-based prospective study. Fertil Steril 2003; 79 : 577-84.
9. Middeldorp S. How I treat pregnancy-related venous thromboembolism. Blood 2011; 118 : 5394-400.
10. Greer IA. Thrombosis in pregnancy: updates in diagnosis and management. Hematology Am Soc Hematol Educ Program 2012; 2012 : 203-7.
11. Harrison CN, Robinson SE. Myeloproliferative disorders in pregnancy. Hematol Oncol Clin North Am 2011; 25 : 261-75.
12. Bangerter M, Güthner C, Beneke H, Hildebrand A, Grünewald M, Griesshammer M. Pregnancy in essential thrombocythaemia: treatment and outcome of 17 pregnancies. Eur J Hematol 2000; 65 : 165-9.
13. Pagliaro P, Arrigoni L, Muggiasca ML, Poggio M, Russo U, Rossi E. Primary thrombocythemia and pregnancy: treatment and outcome in fifteen cases. Am J Hematol 1996; 53 : 6-10.
14. Niittyvuopio R, Juvonen E, Kaaja R, et al. Pregnancy in essential thrombocythaemia: experience with 40 pregnancies. Eur J Haematol 2004; 73 : 431-6.
15. Gangat N, Wolanskyj AP, Schwager S, Tefferi A. Predictors of pregnancy outcome in essential thrombocythemia: a single institution study of 63 pregnancies. Eur J Haematol 2009; 82 : 350-3.
16. Melillo L, Tieghi A, Candoni A, et al. Outcome of 122 pregnancies in essential thrombocythemia patients: A report from Italian registry. Am J Hematol 2009; 84 : 636-640.
17. Passamonti F, Rumi E, Randi ML, Morra E, Cazzola M. Aspirin in pregnant patients with essential thrombocythemia: a retrospective analysis of 129 pregnancies. J Thromb Haemost 2010; 8 : 411-3.
18. Palandri F, Polverelli N, Ottaviani E, Castagnetti F, Baccarani M, Vianelli N. Long-term follow-up of essential thrombocythemia in young adults: treatment strategies, major thrombotic complications and pregnancy outcomes. A study of 76 patients. Haematologica 2010; 95 : 1038-40.
19. Falanga A, Marchetti M. Thrombotic disease in the myeloproliferative neoplasms. Hematology Am Soc Hematol Educ Program 2012; 2012 : 571-81.
20. Penka M, Schwarz J, Pavlík T, et al. Jak léčíme nemocné s esenciální trombocytémií a dalšími myeloproliferacemi provázenými trombocytémií a co může být prediktivní známkou rizika trombózy u těchto nemocných - zpráva z registru pacientů léčených Thromboreductinem. Vnitř Lék 2008; 54 : 775-82.
21. Schwarz J, Penka M, Campr V, et al. Diagnostika a léčba BCR/ABL-negativních myeloproliferativních onemocnění – principy a východiska doporučení CZEMP. Vnitř Lék 2011; 57 : 189-213.
22. Passamonti F, Randi ML, Rumi E, et al. Increased risk of pregnancy complications in patients with essential thrombocythemia carrying the JAK2 (V617F) mutation. Blood 2007; 110 : 485-489.
23. Dahabreh IJ, Jones AV, Voulgarelis M, et al. No evidence for increased prevalence of JAK2 V617F in women with a history of recurrent miscarriage. Br J Haematol 2009; 144 : 802-3.
24. Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. European LeukemiaNet. J Clin Oncol 2011; 29 : 761-70.
25. Harrison CN, Bareford D, Butt N, et al. British Committee for Standards in Haematology. Guideline for investigation and management of adults and children presenting with a thrombocytosis. Br J Haematol 2010; 149 : 352-75.
26. Sejeny SA, Eastham RD, Baker SR. Platelet counts during normal pregnancy. J Clin Pathol 1975; 28 : 812-3.
27. Gernsheimer TB. Thrombocytopenia in pregnancy: is this immune thrombocytopenia or...? Hematology Am Soc Hematol Educ Program 2012; 2012 : 198-202.
28. Cairns JW, Mahon A, Waters DA, Chanarin I. Platelet levels in pregnancy. J Clin Pathol 1977; 30 : 392.
29. Chow EY, Haley LP, Vickars LM. Essential thrombocythemia in pregnancy: platelet count and pregnancy outcome. Am J Hematol 1992; 41 : 249-51.
30. Spivak JL. The optimal management of polycythaemia vera. Br J Haematol 2002; 116 : 243-54.
31. McMullin MF, Bareford D, Craig J, et al. The optimal management of polycythaemia vera. Br J Haematol 2003; 120 : 543-4.
32. Sobas MA, Pérez Encinas MM, Rabuñal Martinez MJ, Quinteiro García C, Bello López JL. Anagrelide treatment in early pregnancy in a patient with JAK2V617F-positive essential thrombocythemia: case report and literature review. Acta Haematol 2009; 122 : 221-2.
33. Wright CA, Tefferri A. A single institutional experience with 43 pregnancies in essential thrombocythemia. Eur J Haematol 2001; 66 : 152-9.
34. Doubek M, Brychtova Y, Doubek R, Janku P, Mayer J. Anagrelide therapy in pregnancy: report of a case of essential thrombocythemia. Ann Hematol 2004; 83 : 726-7.
35. Hasselbalch HC. A new era for IFN-α in the treatment of Philadelphia-negative chronic myeloproliferative neoplasms. Expert Rev Hematol 2011; 4 : 637-55.
36. Kumar AR, Hale TW, Mock RE. Transfer of interferon alfa into human breast milk. J Hum Lact 2000; 16 : 226-8.
37. Koh LP, Devendra K, Tien SL. Four pregnancies in two patients with essential thrombocythaemia-a case report. Ann Acad Med Singapore 2002; 31 : 353-6.
38. Beard J, Hillmen P, Anderson CC, Lewis SM, Pearson TC. Primary thrombocythaemia in pregnancy. Br J Haematol 1991; 77 : 371-4.
39. Tefferi A, Passamonti F. Essential thrombocythemia and pregnancy: Observations from recent studies and management recommendations. Am J Hematol 2009; 84 : 629-30.
40. CLASP (Collaborative Low-dose Aspirin Study in Pregnancy) Collaborative Group. A randomised trial of low-dose aspirin for the prevention and treatment of pre-eclampsia among 9364 pregnant women. Lancet 1994; 343 : 619-29.
41. Nørgård B, Fonager K, Pedersen L, Jacobsen BA, Sørensen HT. Birth outcome in women exposed to 5-aminosalicylic acid during pregnancy: a Danish cohort study. Gut 2003; 52 : 243-7.
42. Demmers KJ, Derecka K, Flint A. Trophoblast interferon and pregnancy. Reproduction 2001; 121 : 41-9.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 4-
All articles in this issue
- Problematika těhotných žen s BCR/ABL negativními myeloproliferativními neoplaziemi
- Maligní nádory vzniklé po úspěšné léčbě akutní myeloidní leukemie u dospělých nemocných: dlouhodobé zkušenosti jednoho pracoviště
- Venepunkční a aferetická léčba polyglobulií
- Vliv zpracování destičkového lyzátu na hladinu vybraných destičkových faktorů
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
- Antitrombin
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Venepunkční a aferetická léčba polyglobulií
- Antitrombin
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

