-
Medical journals
- Career
Vliv zpracování destičkového lyzátu na hladinu vybraných destičkových faktorů
Authors: B. Kubešová
Authors‘ workplace: Tkáňové zařízení ; Kryo s. r. o.
Published in: Transfuze Hematol. dnes,19, 2013, No. 4, p. 223-228.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Autorka se zaměřila na destičkové faktory z alfa granulí trombocytů, konkrétně PDGF, IGF 1, TGF a VEGF. Trombocyty byly nejprve destruovány termodestrukcí, aby se faktory vyplavily do plazmy. Plazma byla defibrinovaná tepelně, čímž došlo jak k vysrážení koagulačních faktorů, tak k inaktivaci komplementu. Po centrifugaci byl destičkový lyzát přetlačen plazmaextraktorem do ozařovacího vaku. Byl přidán roztok Riboflavinu a destičkový lyzát byl virově a bakteriálně inaktivován systémem Mirasol. Konečný roztok byl lyofilizován.
Autorka validovala každý kritický výrobní krok. Destičkové faktory byly měřeny na začátku procesu, po mikrobiální inaktivaci a po lyofilizaci.
Výrobní proces neměl významný vliv na hladinu destičkových faktorů. Toto zjištění je zásadní pro další využití destičkového lyzátu.Klíčová slova:
destičkový faktor, růstové faktory, destičkový lyzát, plazma bohatá na destičkyÚvod
Kultivace lidských kmenových buněk vyžadují specifická média a suplementy do nich. V případě, že kultivované buňky mají být následně aplikovány člověku, jsou požadavky na tato média velmi přísné. Pro kultivaci mesenchymálních kmenových buněk se nezbytným suplementem do média stal destičkový lyzát (1). Destičkový lyzát je na hranici buněčných přípravků, transfuzních přípravků, krevních derivátů a léčivých přípravků pro moderní terapii (ATMP), což se projevuje i při snaze o legislativní zařazení.
V této práci jsme se zabývali hledáním vhodného postupu, při kterém byly získány destičkové faktory ve formě destičkového lyzátu, a to ve formě, která je výchozí surovinou pro další využití. Hladiny faktorů byly v průběhu procesu monitorovány, abychom zjistili, nakolik jsou procesem zpracování změněny.
Materiál a metodika
Pro výzkum byla využita plazma bohatá na destičky (PRP) získaná přístrojovou separací. Pro separaci byl použit přístroj Haemonetics MCS. Během procedury se s krví automaticky mísí antikoagulační roztok (3,8% natrium citricum). Průměrný obsah trombocytů v odseparované PRP je cca 4 x vyšší jak v plné krvi, tedy cca 1200 x 109/l koncentrátu.
Destrukci trombocytů jsme provedli tak, že trombocyty byly třikrát zmraženy při teplotě -80 °C a pak rozmraženy při pokojové teplotě. Tím došlo k destrukci membrán a vylití obsahu alfa granul do plazmy.
Vak s plazmou a s destruovanými trombocyty jsme ponořili do vodní lázně 57 °C na 30 minut. Tím došlo k vysrážení koagulačních faktorů a k inaktivaci komplementu. Výsledný produkt byl centrifugován při 3000 g 15 minut. Supernatant – destičkový lyzát – byl přetlačen do sběrného vaku a koaguláty s trombocytovými membránami byly likvidovány.
Pro inaktivaci patogenů jsme zvolili Systém Mirasol. Systém Mirasol pro ošetření trombocytů a plazmy vy-užívá Riboflavin (vitamin B2) v kombinaci s UV zářením k poškození patogenních agens, které obsahují nukleové kyseliny. Tento systém je efektivní proti klinicky relevantním patogenům, aniž by došlo k poškození potřebných složek.
Faktory byly vyšetřovány kvantitativní technikou imunochemické analýzy (immunoassay). Kromě PDGF (platelet derived growth factor) byly vyšetřovány i tyto faktory: TGF (transforming growth factor), VEGF (vascular endothelial growth factor) a IGF-I (insulin like growth factor). PDGF: Human PDGF-BB Platinum ELISA, BMS2071, Bender MedSystems GmbH (eBioscience). IGF-I: Immulite 2000 IGF-I, L2KGF2, Siemens.
První tři metody jsou manuální dvoukrokové nekompetitivní (sendvičové) imunoanalytické metody. V prvním kroku reaguje analyt ve vzorku se specifickou protilátkou na stěně mikrotitrační jamky. Po odstranění nadbytku antigenu a promytí se přidává druhá biotinylovaná specifická protilátka, která se během druhé inkubace navazuje na antigen zachycený první protilátkou. Po promytí se vzniklý komplex zviditelní pomocí konjugátu křenová peroxidáza-streptavidin a substrátu (tetrametylbenzidin). Signál se měří na ELISA readeru při 450 nm. Koncentrace analytu se odečítá z kalibrační křivky stanovované v každé sérii.
Stanovení IGF-I je plně automatizovaná jednokroková chemiluminiscenční imunoanalytická metoda prováděná na analyzátoru Immulite 2000 firmy Siemens. IGF-I ve vzorku reaguje během jedné inkubace se dvěma specifickými protilátkami; monoklonální myší protilátka je navázána na povrchu reagenční kuličky, druhá polyklonální králičí protilátka je značena alkalickou fosfatázou. Po promytí je množství vzorku detekováno chemiluminiscencí vyvolané přidáním substrátu. Přístroj Immulite 2000 automaticky vyhodnocuje koncentrace analytu porovnáním signálu vzorku s kalibrační křivkou. Kalibruje se vždy nová šarže reagencie a po uplynutí výrobcem garantované doby stability se provádí kalibrace – 14 dní.
Faktory byly vyšetřeny v rozmrazené plazmě bohaté na destičky od jednotlivých dárců (30 vzorků), potom po smíchání PRP do jednoho objemu, tepelné defibrinaci, inaktivaci komplementu, inaktivaci patogenů systémem Mirasol (laboratoře NTC a. s.) (3 vzorky) a následně na konci zpracování po lyofilizaci (3 vzorky) (obr. 1).
Image 1. Schéma zpracování a odběru vzorků k vyšetření destičkových faktorů. 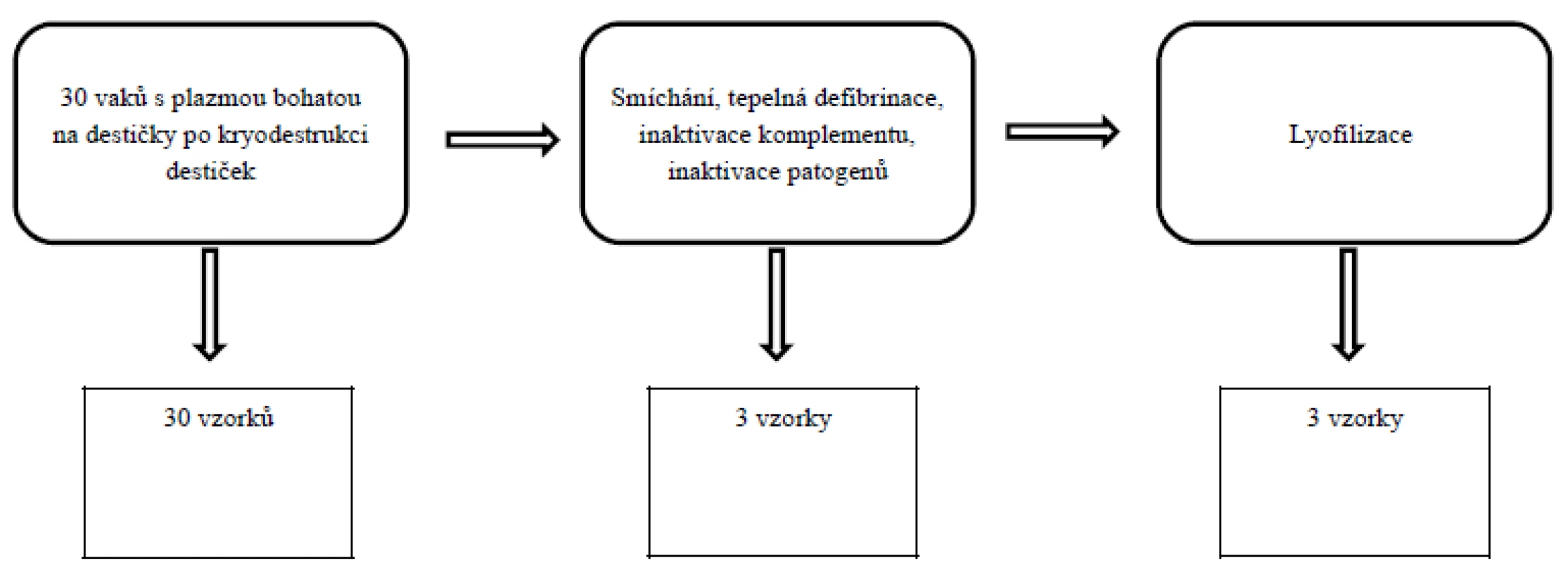
Kromě faktorů bylo souběžně provedeno také vyšetření celkové bílkoviny v destičkovém lyzátu. Stanovení celkové bílkoviny ve vzorcích bylo provedeno na analyzátoru Cobas 8000 C701 soupravou TP2 (Celkový protein 2. generace) fotometricky biuretovou reakcí. Analyzátor i souprava jsou produkty firmy Roche Diagnostic GmbH, Mannheim, Germany.
Zkoušky na endotoxiny byly provedeny v kontrolní laboratoři ITEST plus s.r.o., Hradec Králové. Stanovení bakteriálních endotoxinů bylo provedeno LAL testem – kinetickou turbidimetrickou metodou.
Výsledky
Vzorky k vyšetření destičkových faktorů byly odebrány z destičkového lyzátu (DL) před smísením do jednoho objemu, potom po smíchání, tepelné defibrinaci, inaktivaci komplementu, inaktivaci patogenů systémem Mirasol a pak na konci zpracování po lyofilizaci. Schéma odebrání vzorků pro vyšetření destičkových faktorů je zobrazeno na obrázku 1.
V tabulce 1 jsou uvedeny hladiny růstových faktorů IGF-I, TGF, PDGF, VEGF v DL od jednotlivých dárců.
Table 1. Hladina růstových faktorů IGF1, TGF, PDGF, VEGF v DL od jednotlivých dárců. 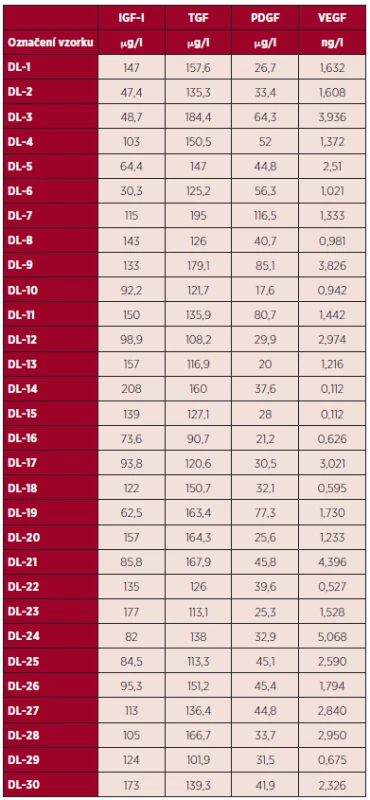
Tabulka 2 uvádí hladiny růstových faktorů IGF-I, TGF, PDGF, VEGF v DL po smíchání rozmrazené plazmy bohaté na destičky, tepelné defibrinaci, inaktivaci komplementu a inaktivaci patogenů systémem Mirasol.
Table 2. Výsledky měření hladiny vybraných destičkových faktorů v DL po smíchání, tepelné defibrinaci, inaktivaci komplementu a inaktivaci patogenů. 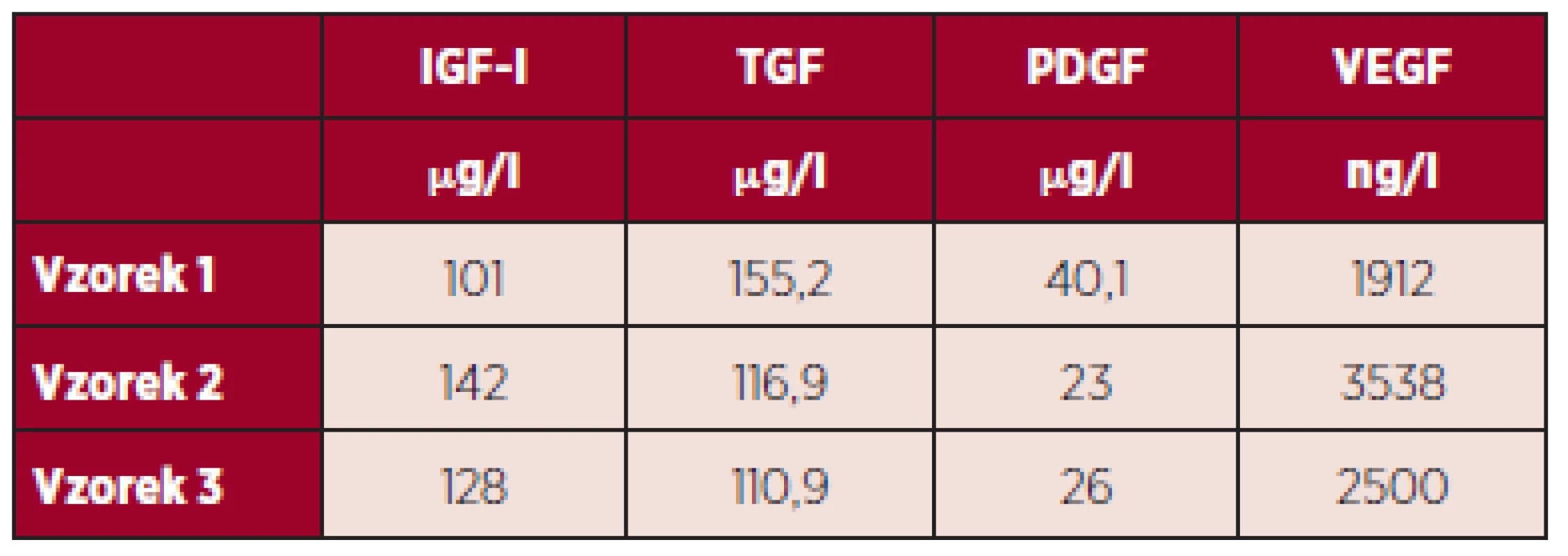
V tabulce 3 jsou uvedeny výsledky měření hladiny vybraných destičkových faktorů po lyofilizaci, tedy na konci procesu zpracování.
Table 3. Výsledky měření hladiny vybraných destičkových faktorů v DL po lyofilizaci. 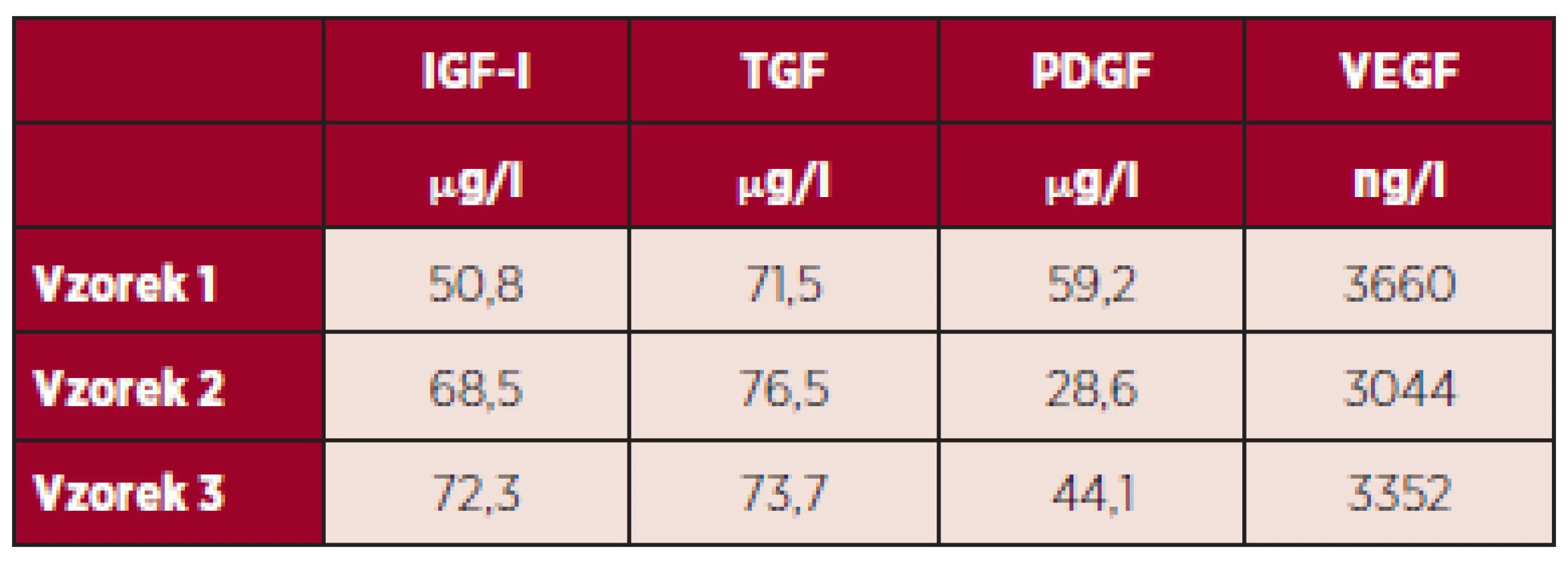
Naměřené výsledky byly statisticky hodnoceny pomocí Studentova t-testu. Rozdíly v naměřených hodnotách nebyly statisticky významné.
V tabulce 4 je uvedena hladina celkové bílkoviny na začátku procesu a na konci – po lyofilizaci. Vzorky po lyofilizaci byly pro měření resuspendovány v odpovídajícím objemu fyziologického roztoku.
Table 4. Hladina celkové bílkoviny na začátku a na konci procesu zpracování. 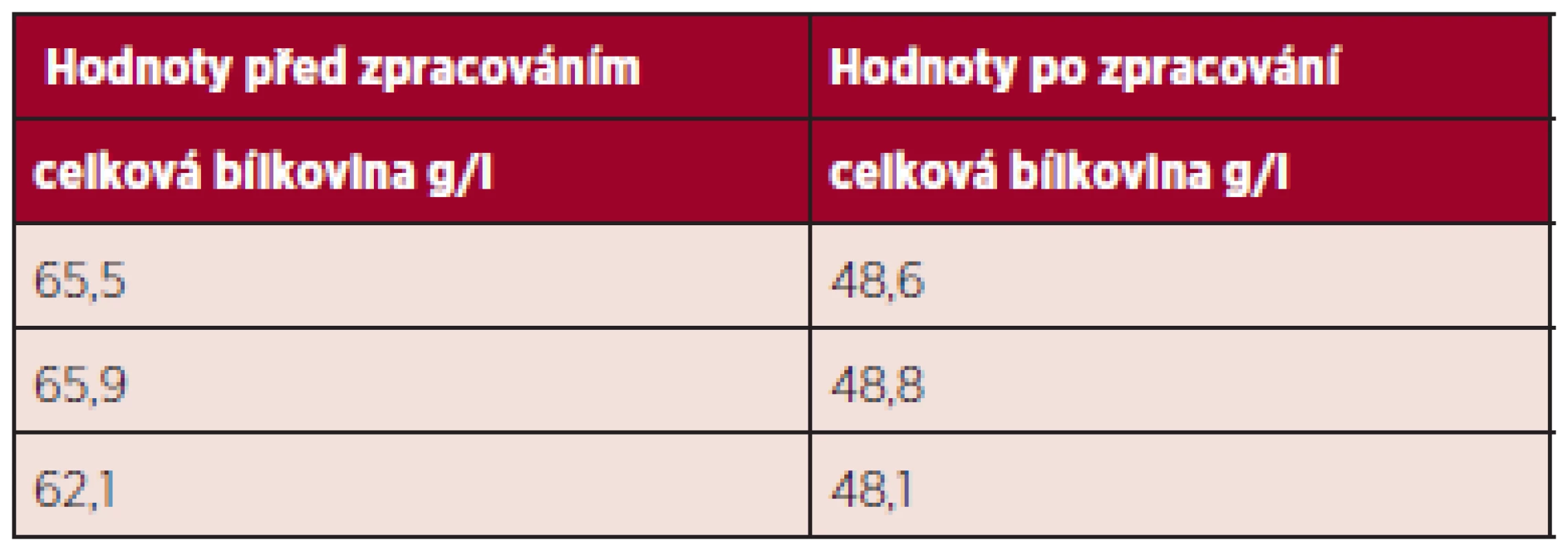
Hladina celkové bílkoviny po procesu zpracování klesla přibližně o jednu třetinu.
Pro vyšetření bakteriálních endotoxinů je limitní hodnota dle zadavatele 0,25 EU/ml. Ve všech měřených vzorcích byla hodnota podlimitní, tedy neměřitelná.
Vzorky byly vyšetřeny mikrobiologicky a všechny vzorky byly sterilní.
Diskuse
Trombocyty hrají centrální úlohu v hemostáze a v hojení ran. Hojení ran je komplexem intra - a extracelulárních kroků, které jsou regulovány signálními proteiny, a celý proces není dosud kompletně poznán. Co je jisté, je to, že krevní destičky v něm hrají velmi důležitou a dost možná zcela rozhodující roli. Aktivace destiček je odpovědí na poškození tkáně a vede kromě podpory srážení i k sekreci biologicky aktivních proteinů. Tyto proteiny připravují podmínky pro hojení tkáně, které zahrnují buněčnou chemotaxi, proliferaci a diferenciaci, odstranění tkáňového detritu, angiogenezi, tvorbu extracelulární matrix a regeneraci odpovídajícím typem tkáně.
V naší práci jsme hledali vhodný proces získání obsahu alfa granulí z lidských trombocytů. V alfa granulích jsou obsaženy tzv. destičkové faktory a chtěli jsme je získat tak, aby nedošlo k velkému snížení jejich hladiny. Důvodem našeho snažení jsou vysoké hojivé a biostimulační účinky destičkových faktorů, které mají stimulační vliv na celou řadu buněk (2, 3, 4, 5, 6, 7, 8). Stimulující účinky jsou popsány na osteoblastech, fibroblastech, cévním endotelu, buňkách získaných z periostu a na mesenchymálních kmenových buňkách (9). Klíčové destičkové faktory, které mají mohutný biostimulační účinek, jsou především PDGF (platelet derived growth factor) a TGF-beta (transforming growth factor). V naší práci jsme se rozhodli sledovat z dalších faktorů ještě IGF (insulin like growth factor) a VEGF (vascular endothelial growth factor) (10, 11). Z fyzikálního hlediska se tyto faktory chovají v podstatě stejně (12, 13, 14).
Celá řada in vitro studií dokazuje vliv destičkového lyzátu (což je vlastně plazma obohacená o obsah alfa granulí) na buněčné kultury (15, 16, 17).
Pro kultivace mesenchymálních kmenových buněk je použití destičkového lyzátu již uznávaným „zlatým“ standardem. V současné době je ale stále nevýhodou, že příprava tohoto lyzátu probíhá jen v laboratorních podmínkách jednotlivých pracovišť. To ovšem znamená, že každá laboratoř používá trochu jiný postup. Pracovníci, kteří mesenchymální kmenové buňky kultivují, si musí destičkový lyzát připravovat sami v laboratorních podmínkách a neexistuje jednotný postup.
Proto jsme chtěli vytvořit a otestovat standardní postup, který by ve výsledku obsahoval vybrané destičkové faktory a splňoval veškeré kvalitativní požadavky a současně i legislativní nároky na bezpečnost.
Museli jsme vyřešit několik procesních kroků. A nakonec zjistit, nakolik celý proces ovlivní hladinu destičkových faktorů, zejména PDGF.
Suplement do média musí být sérum, aby nedocházelo k nežádoucímu vysrážení plazmatických faktorů. Ty by vytvořily síť, do které by mohly být zachyceny buňky, a kultivace by tím byla znehodnocena.
Hledali jsme způsob defibrinace plazmy, který by současně vedl i k inaktivaci komplementu a z praktického hlediska byl použitelný pro zpracování větších objemů PRP. Tepelná defibrinace je bezpečný a poměrně snadný způsob změny plazmy na sérum, který současně vede i k inaktivaci komplementu. Testováním pod mikroskopem na erytrocytovém náplavu jsme si ověřili, že nedochází k pozdním vznikům fibrinových vláken.
Další podmínkou bylo, že výsledný produkt musí být zcela bezpečný z pohledu možného přenosu infekčních agens. Plazmu bohatou na destičky jsme získali z transfuzního oddělení. Jednalo se o krevní destičky od zdravých dárců, které byly získané přístrojovou separací. Dárci byli vyšetřeni na povinné laboratorní testy konkrétně HBsAg, anti-HCV, HIV-1,2 (Ab/Ag) a syfilis. I přes negativní laboratorní výsledky vyšetření předepsaných testů, bylo zapotřebí zvolit některou z možností, které řeší diagnostické okno při vyšetření infekčních markerů.
První možnost je minimálně šestiměsíční karanténa a druhá je inaktivace patogenů. Zvolili jsme druhou možnost, tedy inaktivaci patogenů. Chtěli jsme zamezit přenosu i běžně nevyšetřovaných patogenů. Hledali jsme způsob inaktivace, kdy by přidávaná látka neměla negativní účinek na kultivované buňky po přidání lyzátu ke kultivačnímu médiu. Z tohoto pohledu nás nejvíce zaujala technologie firmy Caridian – Mirasol. Tento systém využívá přidání Riboflavinu s následným ozářením UV zářením. Tím dojde k destrukci DNA i RNA případných agens. Riboflavin v produktu zůstává, ale pro kultivaci buněk je neškodný. Naopak se ukázalo, že je pro buňky výhodný. Využití Riboflavinu a následného ozáření UV záření je bezpečné. Riboflavin, který v destičkovém lyzátu zůstává, je kultivovanými buňkami metabolizován.
Další otázkou, kterou jsme řešili, byla výsledná podoba destičkového lyzátu. Chtěli jsme, aby byl snadno transportovatelný, skladovatelný a prakticky použitelný.
Ideální je v tomto případě úprava pomocí lyofilizace. Tato úprava je obecně velmi šetrná k plazmatickým faktorům, a proto jsme doufali, že bude šetrná i k destičkovým faktorům.
Po tepelné defibrinaci plazmy a kryodestrukci trombocytů jsme centrifugací odstranili sražené plazmatické faktory a detritus z rozpadlých trombocytových membrán. Proto jsme měřili hladinu celkové bílkoviny. Pokles o necelou třetinu nás nepřekvapil. Počítali jsme i s možností, že dojde k poklesu destičkových faktorů. To se naštěstí nepotvrdilo. Pravděpodobně je to dáno relativně malou molekulovou hmotností těchto faktorů. Při centrifugaci neklesnou na dno vaku, ale zůstanou v supernatantu.
Hladinu destičkových faktorů nesnížila ani inaktivace patogenů, ani konečná lyofilizace. Toto bylo v souladu s naším předpokladem.
Při studiu využití destičkového lyzátu jsme našli celou řadu odborných prezentací, kde bylo využíváno destičkového lyzátu nebo plazmy bohaté na destičky pro podporu hojení nejrůznějších ran na zvířecích modelech, zejména při arteficiálním poškození mandibuly krysy nebo Achillovy šlachy králíka (18, 19).
Řada prací se zabývá využitím plazmy bohaté na destičky u lidských pacientů s chronickými i akutními poškozeními. Popisuje se významně pozitivní účinek na chronické, nehojící se kožní rány a bércové vředy (20). Dochází k poklesu pooperativních infekcí, snížení bolestí a ke zmenšení pooperačního krvácení. Některá pracoviště, mezi nimi i klinika čelistní chirurgie ve Fakultní nemocnici u Svaté Anny v Brně, již standardně využívají autologní PRP při těžkých rekonstrukčních operacích (21). Stále více se plazma obohacená destičkami využívá v kosmetické a plastické chirurgii. Již poměrně běžně se vlastní plazma obohacená krevními destičkami aplikuje do podkoží k efektu omlazení pleti, při mezoterapii nebo k podpoře hojení jizev (22). Významné je i použití v oftalmologii, kde nejčastější diagnózou je syndrom suchého oka. Syndrom suchého oka se stává téměř epidemiologickou záležitostí, protože počet lidí, kteří tímto trpí, se dramaticky zvyšuje. Není přitom zcela jasné, co tuto situaci a tento dramatický nárůst způsobuje. Spekuluje se o vlivu klimatizace, práce s počítači apod. Destičkový lyzát je v tuto chvíli nejúčinnější léčbou na tento syndrom, který jinak vede ke korneálním defektům a může dojít až k slepotě. Vždy se ovšem jednalo o autologní materiál, nikdy ne alogenní (23).
Další výzkum se bude věnovat hledání ideální koncentrace pro jednotlivé typy diferencovaných buněk a pro mesenchymální kmenové buňky.
Závěr
Předkládaná práce komplexně posuzuje proces získání a zpracování destičkového lyzátu tak, aby došlo k zachování v něm obsažených destičkových faktorů.
Vyšetřili jsme vybrané destičkové faktory PDGF, IGF, TGF a VEGF před zahájením procesu zpracování (v PRP, která byla třikrát zmražena a opět rozmražena tak, aby došlo k maximální destrukci trombocytů a uvolnění obsahu alfa granul a tím pádem destičkových faktorů do plazmy) a po ukončení celého procesu, tedy v lyofilizovaném a znovu rehydratovaném destičkovém lyzátu.
Přestože došlo k poklesu celkové bílkoviny při defibrinaci a následném odstranění aktivovaných plazmatických faktorů a buněčného detritu, hladina sledovaných destičkových faktorů se statisticky významně nezměnila.
Doručeno do redakce: 8. 7. 2013
Přijato po recenzi: 2. 12. 2013
MUDr. Barbara Kubešová
Navrátilova 8a
616 00 Brno
barbarka.barbarka@seznam.cz
Sources
1. Awidi A, Abu Harfeil N, Jafar H, et al. The in vitro effect of autologous platelet lysate on different types of mesenchymal stem cells. Regenerative Research 2012; 1; 25-32.
2. Schmitz JP, Hollinger JO. The biology of platelet-rich plasma (letter to the editor). J Oral Maxillofac Surg 2001; 59 : 1119.
3. Carlson NE, Roach RB Jr. Platelet-rich plasma, clinical applications in dentistry. J Am Dent Association 2002; 133(10): 1383-6.
4. Schliephake H. Bone growth factors in maxillofacial reconstruction. Int J Oral Maxillofacial Surg 2002; 31(5): 469-84.
5. Pietramaggiori G, Kaipainen A, Czeczugy JM, et al. Freeze-dried platelet-rich plasma shows beneficial healing properties in chronic wounds. Wound Repair and Regeneration 2006; 573-580.
6. Marx RE. Platelet-Rich Plasma: Evidence to Support Its Use. J Oral Maxillofac Surg 62 2004; 489-496.
7. Hom DB, Linzie BM, Huang TC. The Healing Effects of Autologous Platelet Gel on Acute Human Skin Wounds. Arch Facial Plast Surg 2007; 174-183.
8. Alio JL, Abad M, Artola A, et al. Use of Autologous Platelet-Rich Plasma in the Treatment of Dormant Corneal Ulcers. American Academy of Opthalmology Published 2007; 1286-1293.
9. Marx RE,Carlson ER,Eistachedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol 1998; 85 : 638-646.
10. Bates DO, Lodwick D, Williams B. Vascular endothelial growth factor and micro vascular permeability. Microcirculation 1999; 6(2): 83-96.
11. Yancopoulos GD, et al. Vascular-specific growth factor and blood vessel formation. Nature 2000; 407(6801): 242-248.
12. Bowen-Pope DF, Vogel A, Ross R. Production of platelet derived growth factor receptors accompany transformations by a wide spectrum of agents. Proc Natl Acaid Sci USA 1984; 81 : 2396-2400.
13. Singh JP, Chaikin MA, Stiles CD. Phylogenetic analysis of platelet derived growth factor by radio-receptor assay. J Cell Biol 1982; 95 : 667-671.
14. Mochizuki H, et al. Insulin-like growth factor-I supports formation and activation of osteoclasts. Endocrinology 1992; 131(3): 1075 : 1080.
15. Guicheux J, et al. Growth hormone stimulatory effects on osteoclastic resorption are partly mediated by insulin-like growth factor I: an vitro study. Bone 1988; 22(1): 25-31.
16. Cicha I, Garlichs ChD, Daniel WG, et al, Platelets and Blood Cells: Activated human platelets release connective tissue growth factor. Schattauer GmbH, Stuttgard 2004; 755-60.
17. Mirabet V, Solves P, Miňana D, et al. Human Platelet lysate enhances the proliferative activity of cultured human fibroblast-like cells from different tissue. Cell Tissue Banking 2008; 9 : 1-10.
18. Kurtz CA, et al. Insulin-like growth factor I accelerates functional recovery from Achilles tendon injury in a rat model. Am J Sports Med 1999; 27(3): 363-369.
19. Aspenberg P, Virchenko O. Platelet concentrate injection improves Achilles tendon repair in rats; Acta Orthopscand 2004; 75 (1): 93-99G.
20. Caloprisco G, Borean A. Chronic skin ulcers: A regenerative simulation by topical hemotherapy; The International Journal of Artificial Organs 2004; 27 : 816-817.
21. Fassmann A, Izakovičová-Hollá L, Slapnička J. Kostní tkáňové inženýrství v orofaciální oblasti. Vyd. 1. Hradec Králové: Nucleus HK, 2006; 105 s. edice zubního lékařství.
22. Man D, Plosker H, Winland-Brown J E. Experimental Cosmetic: The Use of Autologous Platelet-Rich Plasma (Platelet Gel) and Autologous Platelet-Poor Plasma (Fibrin Glue) in Cosmetic Surgery. Plastic and Reconstructive Surgery 2001; 229-237.
23. Noble BA, Loh RS, Maclennan S, Pesudovs K, et al. Comparison of autologous serum eye drops with conventional therapy in a randomized controlled crossover trial for ocular surface disease. Br J Opthalmology 2004; 1-9.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 4-
All articles in this issue
- Problematika těhotných žen s BCR/ABL negativními myeloproliferativními neoplaziemi
- Maligní nádory vzniklé po úspěšné léčbě akutní myeloidní leukemie u dospělých nemocných: dlouhodobé zkušenosti jednoho pracoviště
- Venepunkční a aferetická léčba polyglobulií
- Vliv zpracování destičkového lyzátu na hladinu vybraných destičkových faktorů
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
- Antitrombin
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Venepunkční a aferetická léčba polyglobulií
- Antitrombin
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

