-
Medical journals
- Career
Antitrombin
Authors: M. Matýšková 1; M. Šlechtová 1; J. Zavřelová 1; I. Hrachovinová 2; M. Penka 1
Authors‘ workplace: Oddělení klinické hematologie, Fakultní nemocnice Brno 1; Ústav hematologie a krevní transfuze, Praha 2
Published in: Transfuze Hematol. dnes,19, 2013, No. 4, p. 244-249.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Antitrombin je jeden z nejdůležitějších inhibitorů serinových proteáz (serpinů), především trombinu a faktoru Xa. Jeho vrozený nedostatek je řazen mezi trombofílie. Klinicky se projevuje hlavně žilními trombózami včetně embolie plic a atypickou lokalizací trombóz, jsou popsány i arteriální trombózy, komplikace v graviditě. Laboratorně stanovujeme jeho inhibiční aktivitu, v případě vrozeného defektu i antigen. Problematické se ukazuje stanovení inhibiční aktivity u osob s defektem typu II, kdy běžně používané testy (většinou anti-Xa, někdy i anti-IIa ) nemusí defekt zachytit a je nezbytné doplnit genetické vyšetření.
Klíčová slova:
antitrombin, vrozené defekty antitrombinu, tromboembolická nemoc, laboratorní stanoveníÚvod
Antitrombin (AT) je důležitým regulačním proteinem systémů hemostázy. Dříve byl označován jako antitrombin III, protože byl třetí v pořadí klasifikace antitrombinů dle Seegerse – tabulka 1 (1). V přítomnosti heparinu či jiných glykosaminoglykanů (GAG) je AT schopen inhibovat většinu serinových proteáz, které se procesů krevního srážení účastní, a tím zabraňovat nadměrnému srážení krve. V případě nedostatku antitrombinu se zvyšuje riziko tromboembolické nemoci.
Table 1. Klasifikace antitrombinů dle Seegerse (Owen Ch A 2001) (1). 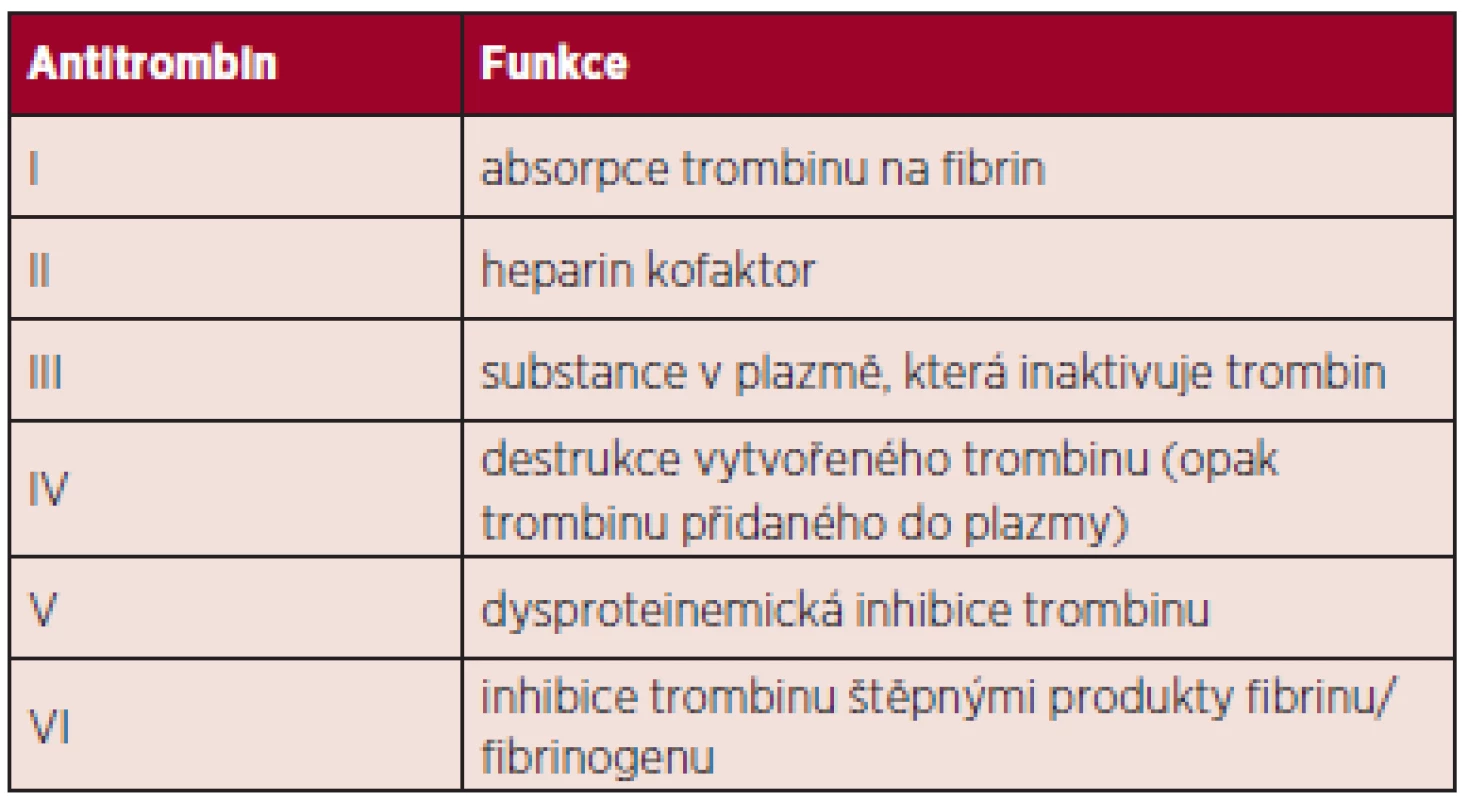
Patofyziologie
Inhibitory serinových proteáz, serpiny, jsou většinou nespecifické inhibitory s vysokou strukturální i funkční homologií. Obecně je většina serinových proteáz u savců zařazena do skupiny nazývané chymotrypsinová („chymotrypsin superfamily“). Mezi serinové proteázy v organismu patří trypsin, chymotrypsin, enzymy koagulace, fibrinolýzy a komplementu. Komplex serpin-serinová proteáza je po uvolnění do cirkulace vychytáván v játrech serpinovými receptory (2). Serpiny jsou důležitým regulačním faktorem nejen v systémech hemostázy (3).
V roce 2006 byla vydána klasifikace serpinů. Serpiny byly rozděleny do 16 skupin označovaných A-P („clade“): Písmeno znamená taxonomickou skupinu se společným předchůdcem a označuje všechny jeho „potomky“, tj. „SERPINXy“ (4). Podle nové klasifikace serpinů je AT označován jako SERPINC1 (tab. 2) (5).
Table 2. Klasifikace serpinů (5). 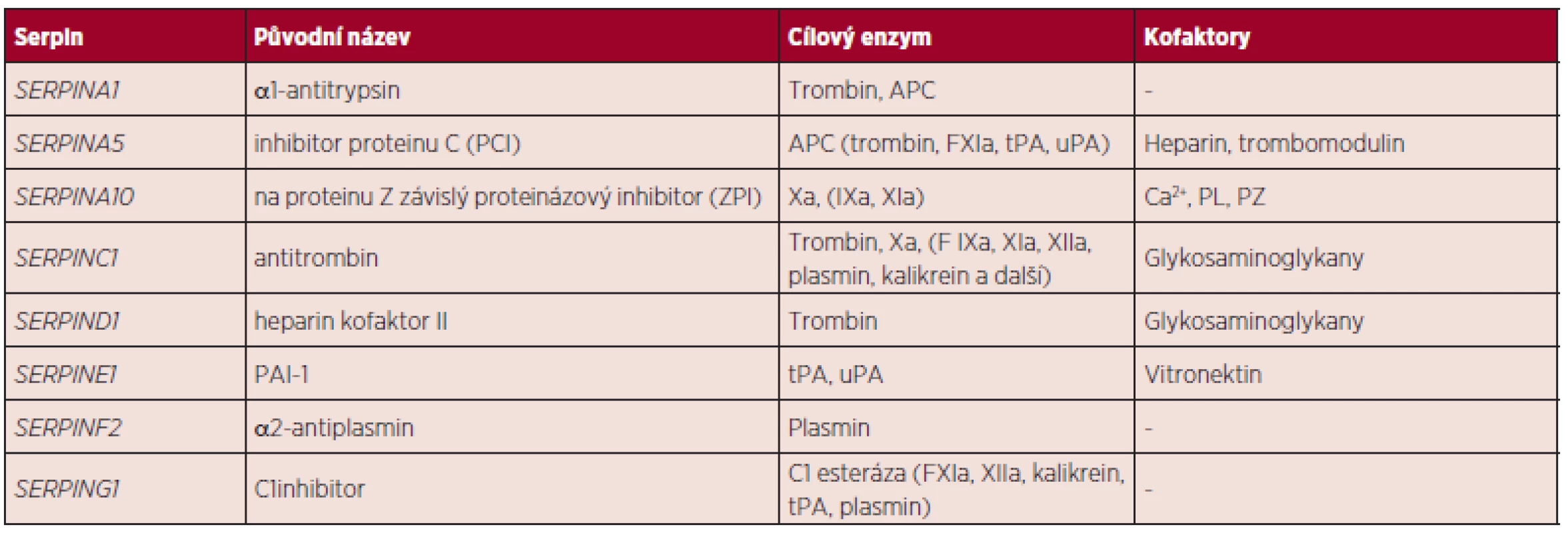
Antitrombin je jednořetězový a2-globulin syntetizovaný především v játrech. Gen pro AT je lokalizován na chromozomu 1q23-25, obsahuje sedm exonů. Plazmatický antitrombin obsahuje 432 aminokyselin (6). V cirkulaci je přítomen ve dvou izoformách alfa (90–95 %) a beta (5–10 %). Přesná fyziologická role těchto dvou izoforem je nejasná, beta-izoforma má vyšší afinitu k heparinu (7). Koncentrace v plazmě je udávána mezi 112-140 µg/ml, aktivita 80–120 %. Nižší hladina bývá u novorozenců, hladiny dospělých dosahuje cca v šesti měsících věku. Za klinicky nevýznamné je považováno snížení hladiny u žen s hormonální kontracepcí a starších mužů (8).
AT je řazen mezi negativní proteiny akutní fáze (9), jeho poločas v plazmě je 45–60 hodin, za patologických stavů se výrazně zkracuje i na méně než tři hodiny (10). AT je přítomný i extravaskulárně a je s plazmatickým v rovnováze. Regulace syntézy AT je zřejmě navázána na regulaci syntézy fibrinogenu. Při štěpení fibrinogenu při aktivaci koagulace klesá i antitrombin. Proto štěpení fibrinogenu dává signál i k další syntéze AT (2).
AT působí primárně na endotelu, kde se váže např. na heparan sulfát a má širokou antiproteázovou aktivitu. Je primárním inhibitorem trombinu a faktoru (F) Xa, inhibuje však v různé míře většinu serinových proteáz, se kterými tvoří ireverzibilní komplex. Za přítomnosti heparinu a dalších GAG jako kofaktoru, je inhibice trombinu urychlena až 2000x (6). Vazba AT s heparinem vyžaduje přítomnost unikátní specifické pentasacharidové sekvence v molekule heparinu a dalších GAG (11). Tato vazba indukuje konformační změny v molekule antitrombinu a ty urychlují vazbu F Xa a dalších serinových proteáz. K inhibici trombinu je navíc nezbytné, aby se molekula GAG navázala jak na AT, tak na trombin (6). Vzniklý pevný, neštěpitelný komplex trombin-AT je rychle vychytáván z cirkulace.
AT má ale také řadu dalších biologických aktivit – působí protizánětlivě, protivirově a proti angiogenezi. Důležité protizánětlivé působení, se objevuje při jeho interakci s endotelem (12). Inhibicí trombinu a F Xa redukuje AT trombinem/F Xa vyvolané uvolnění prozánětlivých cytokinů (interleukin 6 a 8). Je schopen stimulovat tvorbu prostacyklinu v buňkách endotelu vazbou s heparan sulfátem. Přes prostacyklin tak působí vazodilataci, inhibičně na destičky, na aktivaci mononukleárů a indukuje rezistence na endotoxin (13).
Defekt antitrombinu
Vrozené defekty dělíme (tab. 3) na tzv. klasické – typ I, kdy je rovnoměrné snížení aktivity i antigenu AT a typ II, kdy je přítomna variantní forma AT, je také označován jako funkční defekt. Typ II se dále dělí dle lokalizace postižení na poruchu v reakčním místě, poruchu v místě vazby heparinu (HBS) a na pleiotropní (mnohočetný) defekt (14). Tento typ defektu je charakterizován normální hladinou antitrombinu při redukci inhibiční aktivity v krvi. Pouze u pleiotropního defektu může být snížený i antigen AT v důsledku snížené syntézy a sekrece, zvýšeného rozpadu či vychytávání.
Table 3. Klasifikace defektů antitrombinu. 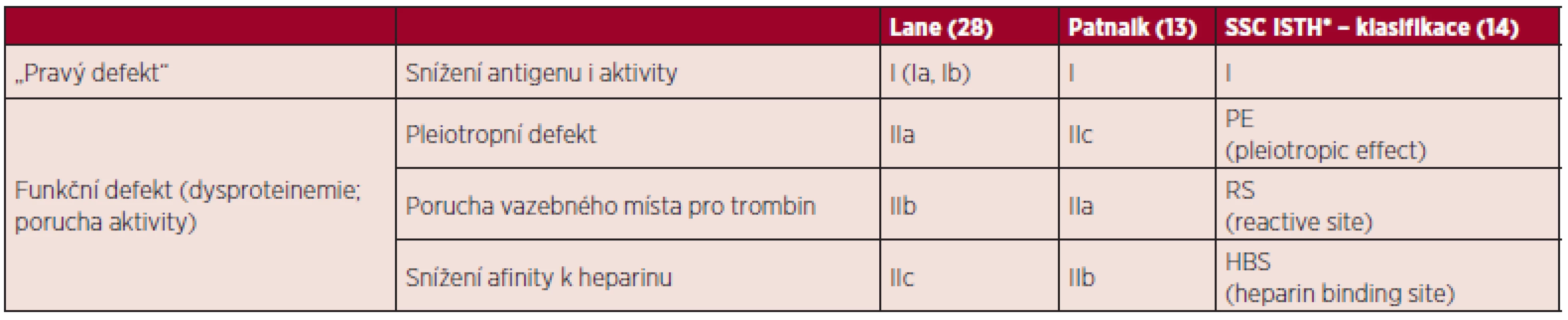
SSC ISTH* – Scientific and Standardization Committee International Society on Thrombosis and Haemostasis Zatím je popsáno více než 250 mutací, část z nich je zadána v online databázi (15). Z defektů jsou nejčastější u typu I nonsense mutace a malé delece či inzerce; popsány jsou ale i velké delece (16), u typu 2 se jedná o missense mutace, následují malé delece/inzerce/ duplikace (16, 17). Velké inzerce jsou však popsány překvapivě i u typu II (18).
Aktivita antitrombinu kolísá mezi 40–60 % (u typu I), a nebylo pozorováno, že by riziko trombózy záviselo na hladině AT. Na rozdíl od osob s žilním tromboembolismem (VTE), u kterých nebyl nalezen defekt, a kde aktivita přirozených inhibitorů (AT, protein C, protein S) při dolní hranici referenčních mezí zvyšuje riziko trombózy (19).
Aktivita antitrombinu může kolísat za různých patologických stavů, při podávání kumarinů může být zvýšená a maskovat tak případný deficit (13).
Nedostatek antitrombinu u nemocného se sklonem k trombóze popsal poprvé r. 1965 Egeberg (1), v bývalém Československu v r. 1977 Hule (20). Jedná se o onemocnění autozomálně většinou dominantně dědičné, pouze u typu II se vzácně nalézá negativní rodinná anamnéza a jsou popsány nově vzniklé mutace (6, 21).
Prevalence defektu v populaci je udávaná dosti rozdílně: někde se udává 0,2–0,5/1000 obyvatel, jiné údaje mluví o 0,2–2/1000 obyvatel (6, 13, 14, 22). Tait a kol. udává prevalenci defektu ve zdravé populaci u AT typ I 0,21–0,75/1000, u typu II 1,45–2,43/1000 (23). Rozdíly jsou zřejmě proto, že řada defektů typu II nemusí být poznána. U antitrombinu Cambridge II (p.A384S ), je udávána vyšší prevalence nejen ve Velké Británii, ale např. i ve Španělsku – 0,2 % ve zdravé populaci (24). Prevalence defektu ve skupině osob s trombofilií je udávána mezi 1–2 % (25). V již zmiňované španělské studii byl AT Cambridge II nalezen u 1,7 % z 1018 vyšetřených jedinců s VTE, u 0,6 % byly nalezeny jiné mutace AT (24).
Muži i ženy jsou defektem AT postiženi stejně a není zde pozorována rasová závislost (13). Homozygotní postižení bylo popsáno pouze u defektů s nedostatečnou vazbou na heparin (26), u ostatních je neslučitelné se životem (27).
Získané defekty AT jsou poměrně časté. Jedná se o stavy, kdy je snížená syntéza bílkovin (např. hepatopatie), zvýšené ztráty (nefrotický syndrom, enteropatie), zvýšená konzumpce či inaktivace (např. sepse s diseminovanou intravaskulární koagulopatií, popáleniny, polytrauma, jaterní veno-okluzivní choroba, velké hematomy, metastazující nádory), diluce (hemodialýza, plazmaferéza), případně v důsledku léčby (heparin, L-asparagináza, estrogeny) (28). Nízká hladina AT u závažných stavů např. spojených s infekcí či polytraumatem, je považována za faktor zvyšující stávající riziko trombózy a predikující zhoršení, případně úmrtí pacienta (29, 30).
Klinické projevy vrozeného nedostatku antitrombinu
Ze známých trombofilních defektů je nedostatek AT (hlavně I typu) řazen mezi rizikovější faktory, pro vznik VTE je popisováno 5–50násobné zvýšení rizika (25). Roční incidence první DVT nebo EP je udávána u osob s defektem AT 1,7 %/rok (31, 32); poměr rizika u AT (RR) 28,2 (95 % CI, 13,5–58,6) (32), „hazard ratio“ 10,2 (31).
Klinická manifestace ale závisí na typu defektu. Obecně se udává, že nositelé defektu typu II, především HBS (heparin binding site, vazebné místo pro heparin) mají nižší riziko VTE, ale i toto závisí na typu postižení. I u typu II jsou popsány závažné trombotické projevy (velká „in-frame“ inzerce – 18) či významné zvýšení rizika hluboké žilní trombózy u AT Cambridge II (OR 9,75–95 % CI, 2,2–42,5) (24).
Primárně je defekt sdružen s trombózami hlubokých žil hlavně dolních končetin, plicní embolií, setkáváme se ale i s atypickou lokalizací trombóz. Jsou popsány trombózy sinusů, žil splanchniku, retinální žíly, dolní duté žíly (6, 33). Uváděny jsou i arteriální trombózy, tato asociace je však u většiny defektů pouze lehká. Ale např. AT Cambridge II (p. A384S) byl nalezen u 0,8 % z 1224 pacientů po prodělaném infarktu myokardu a ve skupině signifikantně zvyšoval jeho riziko – 5,66x (95% CI: 1,53–20,88; p = 0,009), pokud se vzali pouze jedinci < 45 let riziko bylo ještě vyšší (OR: 9,98; 95% CI: 1,60–62,24; p = 0,009) (34).
První VTE se mohou objevit v období puberty, obvykle bez zjevné příčiny (udáváno asi 60 %) nebo při „přechodném“ riziku – např. lehčí úraz (např. naražení lýtka), ale i větší fyzická námaha. Riziko trombózy významně stoupá kolem 20. roku věku, kolem 50. roku má již trombózu v anamnéze asi 50 % nositelů defektu (13), jiné práce uvádějí, že ve věku 50–60 let mělo trombózu 80–90 % osob s trombofilií (33).
Varianta AT Rouen-VI (p.N187D) je konformačně nestabilní AT, kdy se u nositelů objevují trombózy při horečkách (35).
U žen se s prvními projevy setkáváme často v těhotenství a šestinedělí. U žen s defektem AT, které nemají v anamnéze trombózu, se trombóza vyskytla v 31 % v graviditě, v případě pozitivní anamnézy v 49 %, více než polovina těchto trombóz se objevila po porodu (13). Obecně u žen s defektem AT je doporučení nepodávat hormonální kontracepci, která zvyšuje riziko časné VTE (36). Vedle zvýšeného rizika VTE v graviditě jsou popsány i častější potraty (po 14. týdnu gestace) či další komplikace gravidity (37–39).
Vždy je u pacientů s deficitem AT nutné počítat s rezistencí na heparin (13).
Diferenciálně diagnosticky musíme pomýšlet na získaný nedostatek AT, který většinou doprovází velké trombózy a někdy i léčbu heparinem.
I když je typ I považován za jeden z nejrizikovějších známých trombofilních defektů, klinické projevy závisí především na typu defektu. Ve sledování máme např. rodinu s defektem AT I. typu, kdy se tromboembolické příhody u všech postižených jedinců vyskytují od začátku puberty. Opakované vysazení antikoagulace (na žádost pacientů) vedlo k recidivám hluboké žilní trombózy. Hladina inhibiční aktivity AT se v rodině pohybuje 55–60 %. Geneticky se jedná o mutaci v exonu 7 : 13246-8 del TGA, která se projeví jako záměna p.N376K a delece p.E377del.
V další rodině s defektem AT typu I (jedná se o rodinu popsanou v r. 1977 Hulem) jsou VTE příhody pouze u jedinců s kombinovaným defektem (+FV Leiden), u osob se samotným defektem AT se trombózy vyskytují až po 60. roce věku. Hladina AT v této rodině kolísá mezi 45–73 %, ve vyšším věku klesá až k 30 %. Geneticky byla nalezena mutace v exonu 4 : 6490 CGA/TGA, která vede ke vzniku stop-kodonu p.R197X (40).
V další rodině s kombinovaným defektem AT I. typu a FV Leiden v heterozygotní formě (kosegregace defektu) se trombóza vyskytla pouze u ženy při podávání hormonální kontracepce, matka a sestra se stejným defektem trombózu nikdy neměly (41).
Laboratorní vyšetření
U nositelů defektu AT je základní koagulační vyšetření většinou v normě, defekt můžeme zjistit až přímým stanovením AT. Vzhledem ke konzumpci AT při trombotických příhodách, ale i jiných závažných stavech, je nutné jeho stanovení zopakovat mimo akutní stav a vyloučit podávání heparinu (25, 42).
K funkčnímu vyšetření, tj. ke stanovení inhibiční aktivity antitrombinu se využívá chromogenní metody – běžně dostupné je stanovení inaktivace F Xa nebo trombinu. Při stanovení AT se využívá jeho schopnosti tvořit v přítomnosti heparinu stechiometrické ireverzibilní komplexy s trombinem (IIa) nebo F Xa. Vyšetřovaná plazma je v přítomnosti heparinu inkubována s nadbytkem trombinu nebo F Xa. Zbytkový trombin (F Xa) detekujeme pomocí specifického chromogenního substrátu, který je trombinem (F Xa) štěpen za vzniku barevného produktu. Intenzita zbarvení se detekuje spektrofotometricky, je přímo úměrná množství zbytkového trombinu (F Xa) a nepřímo úměrná množství AT ve vzorku (43).
Jsou popsány rozdíly ve stanovení inhibiční aktivity pomocí anti-Xa a anti-IIa testů ve prospěch anti-Xa stanovení (44). Jak se ale ukazuje, ne všechny defekty jsou detekovány testem na basi měření aktivity anti-Xa (t. č. nejběžněji užívané), a je popsána i závislost na používané reagencii (45). Proto je třeba u pacientů s opakovanými tromboembolickými příhodami od mladého věku ověřit hladinu aktivity AT i stanovením anti-IIa aktivity, případně použít jinou reagencii, test provádět bez přítomnosti heparinu nebo i zkrátit inkubaci (16, 46). U některých defektů nemusí být defekt fenotypicky zjištěn vůbec. Např. AT Cambridge II (p.A384S) neovlivní stanovení anti-Xa aktivity ani antigenu, může být lehce nižší aktivita anti-IIa (24); AT Stockholm také nemusí být stanovením anti-Xa aktivity zachycen (47). U AT Wibble jsou popsány hraniční nálezy aktivity i antigenu a alterace termostability defektního antitrombinu (48).
Molekulárně biologické vyšetření je u některých typů (především typ II) často jedinou možností defekt jednoznačně diagnostikovat.
Imunologické stanovení, tj. stanovení antigenu je vhodné při podezření na defekt typu II. V běžné praxi nemá význam. Využívá se stanovení EID, ELISA či LIA testy.
Závěr
Defekt antitrombinu patří k nejdéle známým vrozeným trombofilním defektům. I když je defekt antitrombinu relativně vzácný, je nutné na tuto možnost myslet především v rodinách s opakovanými trombózami. K identifikaci těchto rodin je nezbytná důkladná anamnéza a to nejen osobní, ale i rodinná. Pokud se jedná o trombofilní rodinu, je vhodné při laboratorním stanovení aktivity AT použít nejen test založený na anti-Xa aktivitě, ale i anti-IIa, v případě hraničních nálezů se případně domluvit i na molekulárně biologickém vyšetření rodiny.
Podíl autorů na rukopisu
M. Matýšková – příprava první verze rukopisu; revize rukopisu
M. Šlechtová – spoluautor části týkající se kliniky a nálezů pacientů; schválení poslední verze rukopisu
J. Zavřelová – korektura a připomínky rukopisu týkající se laboratorního vyšetření; schválení poslední verze rukopisu
I. Hrachovinová – připomínky k rukopisu týkající se laboratorního vyšetření a molekulárně genetických nálezů; schválení poslední verze rukopisu
M. Penka – revize a schválení poslední verze rukopisu
Doručeno do redakce: 3. 9. 2013
Přijato po recenzi: 29. 10. 2013
MUDr. Miloslava Matýšková, CSc.
Oddělení klinické hematologie FN Brno
Jihlavská 20
625 00 Brno
mmatys@fnbrno.cz
m.matyskova@gmail.com
Sources
1. Owen Ch A. A history of blood coagulation. May Foundation for Medical Education and Research Rochester, Minnesota 2001 : 97-102.
2. Pizzo SV. The physiological role of antithrombin III as an anticoagulant. Sem Hematol 1994; 31(2)Suppl 1 : 4-7.
3. Huntington JA. Serpin structure, function and dysfunction. J Thromb Haemost 2011; 9(Suppl 1): 26-34.
4. Law RHP, Zhang Q, McGowan S, et al. An overview of the serpin superfamily. Genome Biol 2006; 7 : 216.11.
5. Hernández-Espinosa D, Ordóñez A, Vicente V, Corral J. Factors with conformational effects on haemostatic serpins: Implications in thrombosis. Thromb Haemost 2007; 98(3): 557-563.
6. Olds RJ, Lane DA, Mille B, et al. Antithrombin: The principal inhibitor of thrombin. Sem Thromb Hemost 1994; 20(4): 353-372.
7. McCoy AJ, Pei XY, Skinner R, Abrahamns J-P, Carrell RW. Structure of beta-antithrombin and the effect of glycosylation on antithrombin‘s heparin affinity and activity. J Mol Biol 2003; 326(3): 823-833.
8. Tait RC, Walker ID, Islam AM, et al. Influence of demographic factors on antithrombin III activity in a healthy population. Br J Haematol 1993; 84 : 476-480.
9. Niessen RWLM, Lamping RJ, Jansen PM, et al. Antithrombin acts as a negative acute phase protein as established with studies on HepG2 cells and in baboons. Thromb Hemost 1997; 78 : 1088-1092.
10. Fourrier F, Jourdain M, Tournois A, Caron C, Goudemand J, Chopin C. Coagulation inhibitor substitution during sepsis. Int Care Med 1995; 21: S264-S268.
11. Ragazzi M, Ferro DR. Conformation of the pentasacharide corresponding to the binding site of heparin for antithrombin III. Carbohydrate Res 1990; 195 : 169-185.
12. Zhang W, Chuang Y-J, Swanson R, et al. Angiogenic antithrombin down-regulates the expression of the proangiogenic heparan sulfate proteoglycan, perlecan, in endothelial cells. Blood 2004; 103 : 1185-1191.
13. Patnaik MM, Moll S. Inherited antithrombin deficiency: a review. Haemophilia 2008; 14 : 1229-1329.
14. Lane DA, Bayston T, Olds RJ, et al. Antithrombin mutation database: 2nd (1997) update. For the Plasma Coagulation Inhibitors Subcommittee of the SSC ISTH. Thromb Haemost 1997; 77 : 197-211.
15. Antithrombin Mutation Database. http://www1.imperial.ac.uk/departmentofmedicine/divisions/experimentalmedicine/haematology/coag/antithrombin/
16. Cooper PC, Coath F, Daly ME, Makris M. The phenotypic and genetic assessment of antithrombin deficiency. Int Jnl Lab Hem 2011; 33 : 227-237.
17. Luxembourg B, Delev D, Geisen CH, et al. Molecular basis of antithrombin deficiency. Thromb Haemost 2011; 105 : 635-646.
18. Martínez-Martínez I, Johnson DJD, Yamasaki M, et al. Type II antithrombin deficiency caused by a large in-frame insertion: structural, functional and pathological relevance. J Thromb Haemost 2012; 10(9): 1859-1866.
19. Bucciarelli P, Passamonti SM, Biguzzi E, et al. Low borderline plasma levels of antithrombin, protein C and protein S are risk factors for venous thromboembolism. J Thromb Haemost 2012; 10 : 1783-1791.
20. Hule V. Vrozené rodinné snížení antitrombinu III. Vnitř Lék 1977; 23(9): 887-892.
21. Martínez-Martínez I, Ordóñez A, Navarro-Fernández J, et al. Antithrombin Murcia (K241E) causing antithrombin deficiency: a pos-sible role for altered glycosylation. Haematologica 2010; 95(8): 1358-1365.
22. Wells PS, Blajchman MA, Henderson P, et al. Prevalence of antithrombin deficiency in healthy blood donors: A cross-sectional Study. Am J Hematol 1994; 45 : 321-324.
23. Tait RC, Walker ID, Perry DJ, et al. Prevalence of antithrombin deficiency in the healthy population. Br J Haematol 1994; 87(1): 106-112.
24. Corral J, Hernández-Espinosa D, Soria JM. Antithrombin Cambridge II (A384S): an underestimated risk factor for venous thrombosis. Blood 2007; 109 : 4258-4263.
25. Kottke-Marchant K, Duncan A. Antithrombin deficiency. Issues in laboratory diagnosis. Arch Pathol Lab Med 2002; 126 : 1326-1336.
26. Chowdhury V, Lane DA, Mille B, et al. Homozygous antithrombin deficiency: Report of two new cases (99Leu to Phe) associated with arterial and venous thrombosis. Thromb Haemost 1994; 72 : 198-202.
27. Ishiguro K, Kojima T, Kadomatsu K, et al. Complete antithrombin deficiency in mice results in embryonic lethality. J Clin Invest 2000; 106(7): 873–878.
28. Lane DA, Olds RR, Thein S-L. Antithrombin and its deficiency states. Blood Coag Fibrinol 1992; 3 : 315-341.
29. Wilson RF, Mammen EF, Tyburski JG, Warsow KM, Kubinec SM. Antithrombin levels related to infection and outcome. J Trauma Injury Infection Crit Care 1996; 40(3): 384-387.
30. Penner J. Antithrombin Deficiency in special clinical syndromes – Part II: Trauma/burns. Sem Hematol 1995; 32(4, Suppl 2): 42-47.
31. Vossen CY, Conard J, Fontcuberta J, et al. Risk of a first venous thrombotic event. In carriers of a familial thrombophilic defect. The European Prospective Cohort on Thrombophilia (EPCOT). J Thromb Haemost 2005; 3 : 459-464.
32. Lijfering WM, Brouwer J-LP, Veeder NJGM, et al. Selective testing for thrombophilia in patients with first venous thrombosis: results from a retrospective family cohort study on absolute thrombotic risk for currently known thrombophilic defects in 2479 relatives. Blood 2009; 113 : 5314-5322.
33. Pabinger I, Schneider B, for the Gesellschaft fur Thrombose - und Hamostaseforschung (GTH) Study Group on Natural Inhibitors. Thrombotic risk in hereditary antithrombin III, protein C, or protein S deficiency. Arteiol Thromb Vasc Biol 1996; 16 : 742-748.
34. Roldán V, Ordóñez A, Marín F, et al. Antithrombin Cambridge II (A384S) supports a role for antithrombin deficiency in arterial thrombosis. Thromb Haemost 2009; 101 : 483-486.
35. Bruce D, Perry DJ, Borg J-Y, Carrell RW, Wardell M.R. Thrombo-embolic disease due to thermolabile conformational changes of antithrombin Rouen-VI (187 Asn-Asp). J Clin Invest 1994; 94 : 2265-2274.
36. van Vlijmen EF, Brouwer JL, Veeger NJ, Eskes TKAB, de Graefft PA, van der Meer J. Oral contraceptives and the absolute risk of venous thromboembolism in women with single or multiple thrombophilic defects: results from a retrospective family cohort study. Arch Intern Med 2007; 167 : 282-289.
37. Sanson BJ, Friederich PW, Simioni P, et al. The risk of abortion and stillbirth in antithrombin-, protein C-, and protein S-deficient women. Thromb Haemost 1996; 75(3): 387-388.
38. Roqué H, Paidas MJ, Funai EF, Kuczynski E, Lockwood ChJ. Maternal thrombophilias are not associated with early pregnancy loss. Thromb Haemost 2004; 91 : 290-295.
39. Folkeringa N, Brouwer JLP, Korteweg FJ, et al. Reduction of high fetal loss rate by anticoagulant treatment during pregnancy in antithrombin, protein C or protein S deficient women. Br J Haematol 2007; 136 : 656-661.
40. Hrachovinová I, Habart D, Salaj P, Matýšková M, Vorlová Z. Molecular basis of inherited defect of antithrombin in ten Czech families. Čas Lék Čes 2000; 139(19): 595-597.
41. Matýšková M, Šlechtová M, Zavřelová J, Penka M. Combined FV Leiden and antithrombin deficiency in women. Thrombosis Res 2009; 123(Suppl 2): S155, Abstract P55.
42. Khor B, Van Cott EM. Laboratory tests for antithrombin deficiency. Am J Hematol 2010; 85 : 947-950.
43. Matýšková M, Zavřelová J, Čech Z. Hemokoagulační laboratorní vyšetření. In: Penka M, Buliková A, a kol. Neonkologická hematologie. 2. vyd. Praha, Grada Publishing, a.s., 2009; 199-217.
44. Demers Ch, Henderson P, Blajchman MA, et al. An antithrombin III assay based on factor Xa inhibition provides a more reliable test to identify congenital antithrombin III deficiency than an assay based on thrombin inhibition. Thromb Haemost 1993; 69(3): 231-235.
45. Merz M, Böhm-Weigert M, Braun S, et al. Clinical multicenter evaluation of a new FXa-based antithrombin assay. Int J Lab Hem 2011; 33 : 498-506.
46. Kristensen SR, Rasmusen B, Pedersen S, Bathum L. Detecting antithrombin deficiency may be a difficult task – more than one test is necessary J Thromb Haemost 2007; 5 : 617-618.
47. Ungerstedt JS, Schulman S, Egberg N, Antovic J, Blombäck M. Discrepancy between antithrombin activity methods revealed in antithrombin Stockholm? Do factor Xa-based methods overestimate antithrombin activity in some patients? Blood 2002; 99(6): 2271-2272.
48. Beauchamp NJ, Pike RN, Daly M. Antithrombins Wibble and Wobble (T85M/K): Archetypal conformational disease with in vivo latent-transition, thrombosis, and heparin activation. Blood 1998; 92 : 2696-2706.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 4-
All articles in this issue
- Problematika těhotných žen s BCR/ABL negativními myeloproliferativními neoplaziemi
- Maligní nádory vzniklé po úspěšné léčbě akutní myeloidní leukemie u dospělých nemocných: dlouhodobé zkušenosti jednoho pracoviště
- Venepunkční a aferetická léčba polyglobulií
- Vliv zpracování destičkového lyzátu na hladinu vybraných destičkových faktorů
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
- Antitrombin
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Venepunkční a aferetická léčba polyglobulií
- Antitrombin
- Stabilita koagulačních parametrů v rozmražené plazmě
- Markery poškození krevních buněk
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

