-
Medical journals
- Career
Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
Authors: D. Pospíšilová 1; J. Houda 1; D. Holub 2; B. Ludíková 1; R. Mojzíková 3; P. Pospíšilová 3; Z. Židová 3; K. Kapraľová 3; M. Horváthová 3; M. Hajdúch 2; P. Džubák 2
Authors‘ workplace: Dětská klinika, Lékařská fakulta Univerzity Palackého v Olomouci a Fakultní nemocnice Olomouc 1; Ústav molekulární a translační medicíny, Lékařská fakulta Univerzity Palackého v Olomouci 2; Ústav biologie, Lékařská fakulta Univerzity Palackého v Olomouci 3
Published in: Transfuze Hematol. dnes,18, 2012, No. 2, p. 58-65.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod.
Peptidický hormon hepcidin je hlavním faktorem ovlivňujícím homeostázu železa (Fe). Zajišťuje komunikaci mezi místy střádání Fe (hepatocyty a makrofágy) a místy, kde se Fe vstřebává (enterocyty), spotřebovává (erytroidní buňky) nebo recykluje a uvolňuje do krevního oběhu (makrofágy). Syntéza hepcidinu je regulována signály reagujícími na zánět, aktivitu erytropoézy, hladinu Fe, jeho zásoby v organismu a tenzi kyslíku. Zvýšení hladiny hepcidinu vede k zadržení Fe v enterocytech a makrofázích a snížení jeho hladiny v plazmě.Cíl práce.
Zhodnotit hladiny hepcidinu a jejich diagnostický přínos u dětských pacientů s vybranými typy anémií: Diamondovou-Blackfanovou anémií (DBA), deficitem pyruvátkinázy (PK), sideropenickou anémií (IDA) a anémií doprovázející střevní záněty (IBD).Pacienti a metody.
Hladina hepcidinu byla vyšetřena metodou proteomické analýzy u 33 dětí – 17 chlapců a 16 dívek (6 pacientů s DBA, 5 pacientů s deficitem PK, 10 pacientů se IDA a 12 pacientů s IBD) ve věku 6 měsíců až 18 let. Hladiny byly srovnávány se souborem 16 zdravých dětí vyšetřených před plánovanými chirurgickými výkony.Výsledky.
U pacientů s těžkou formou DBA jsou hladiny hepcidinu signifikantně vyšší než u kontrol (p < 0,0005) i přes vysoké hladiny erytropoetinu, což je zcela rozdílný nález ve srovnání s pacienty s talasemií. Příčinou je pravděpodobně absence „erytroidního regulátoru“ při těžké redukci erytropoézy. U pacientů s deficitem PK je hladina hepcidinu naopak signifikantně nižší (p < 0,02), což teoreticky odpovídá akceleraci erytropoézy. Pro tuto teorii svědčí i zvýšená hladina potenciálního erytroidního regulátoru produkce hepcidinu: GDF15. Nízká hladina hepcidinu může přispívat k prohloubení přetížení Fe u těchto pacientů. U pacientů se IDA byly nalezeny signifikantně nižší hladiny (p < 0,01) hepcidinu, které jsou pravděpodobně výrazem zvýšené poptávky organismu po Fe. Mezi hladinami hepcidinu u pacientů s IBD a kontrolami nebyl překvapivě zjištěn signifikantní rozdíl. U dětských pacientů s IBD pravděpodobně převažuje skutečný deficit Fe nad klasickým obrazem anémie chronických chorob.Závěr.
Stanovení hladin hepcidinu může zpřesnit diagnostiku celé řady anémií informací o aktuálním stavu metabolismu železa. Může poskytnout nejen důležitou informaci o aktuálním deficitu železa pro potřeby erytropoézy, stupni přetížení železem, ale i o aktuální schopnosti enterocytů vstřebávat Fe ze střevního lumen. Může být vodítkem při rozhodnutí o indikacích perorální a parenterální aplikace železa. Znalost hladiny hepcidinu může při korelaci s hladinami ostatních proteinů účastnících se regulace metabolismu Fe přinést velmi důležité poznatky o dosud nejasných aspektech homeostázy Fe v organismu.Klíčová slova:
hepcidin, proteomická analýza, sideropenická anémie, anémie chronických chorob, nespecifické střevní záněty, Diamondova-Blackfanova anémie, deficit pyruvátkinázyÚvod
Železo (Fe) jako čtvrtý nejrozšířenější element zemské kůry patří mezi prvky nezbytné pro růst a přežití organismu. Je jednou ze základních stavebních a funkčních složek molekul zajišťujících transport kyslíku – hemoglobinu a myoglobinu, mimoto je nezbytné pro funkci řady důležitých enzymů: kataláz, akonitáz, ribonukleotid – reduktázy, peroxidáz a cytochromoxidáz, které se účastní důležitých reakcí oxidativního metabolismu a buněčného růstu a proliferace. Schopnost železa katalyzovat redox-reakce může na druhé straně při jeho nadbytku vést ke vzniku toxických hydroxylových radikálů, které mohou poškozovat buňky a tkáně. Nedostatek i nadbytek železa je ve svých důsledcích pro organismus škodlivý. Koncentrace železa v plazmě a extracelulární tekutině je proto udržována v poměrně úzkém rozmezí, které zajišťuje adekvátní přísun železa nutný pro zachování všech buněčných pochodů bez rizika jeho toxicity (1). Homeostáza železa v organismu je velmi precizně regulována systémy, které zajišťují kontrolu potřebné koncentrace železa v buňkách, plazmě a v extracelulárních tekutinách.
Většina genů, jejichž proteinové produkty hrají důležitou roli v metabolismu Fe, byla identifikována v posledních 10 letech. Hlavním faktorem ovlivňujícím homeostázu železa v organismu je peptidický hormon hepcidin. Poprvé byl popsán v roce 2001 (2), a to původně jako peptid s antimikrobiální aktivitou, později byla objasněna jeho klíčová role v metabolismu železa. Primárně je syntetizován v hepatocytech jako pre-prohepcidin s 84 aminokyselinami, který je postupně přes prohepcidin konvertován signálními peptidázami a posttranslačně upravován konvertázou furinem (3) na bioaktivní peptid s 25 aminokyselinami, který hraje klíčovou roli v regulaci homeostáze Fe (4, 5). Je rychle vylučován z organismu.
Hepcidin je signální molekulou zprostředkující komunikaci mezi místy střádání Fe (hepatocyty a makrofágy) a místy, kde se Fe vstřebává (enterocyty), spotřebovává (erytroidní buňky) nebo recykluje a uvolňuje do krevního oběhu (makrofágy). Má funkci hlavního negativního regulátoru uvolňování železa z enterocytů duodena, z makrofágů a z hepatocytů. Zvýšení hladiny hepcidinu vede k blokádě exportu Fe z uvedených buněk, která je umožněna vazbou hepcidinu na feroportin. Feroportin, hlavní bílkovina zajišťující export Fe z buněk (6), je po vazbě hepcidinu internalizován a degradován a ztrácí tak schopnost exportovat Fe do plazmy. Výsledkem je zadržení železa v enterocytech a makrofázích a snížení jeho hladiny v plazmě. Protože možnosti exkrece Fe z organismu jsou výrazně limitovány, je kontinuální homeostáza železa zajišťována kontrolou střevní absorpce v enterocytech regulovanou právě hepcidinem a jeho vlivem na feroportin. Při poklesu zásob Fe se hladina hepcidinu snižuje a absorpce Fe zvyšuje, při doplnění zásob Fe dochází ke zvýšení hladiny hepcidinu vedoucí k degradaci feroportinu a poklesu absorpce Fe.
Syntéza hepcidinu je regulována signály reagujícími na zánět, aktivitu erytropoezy, hladinu Fe a jeho zásoby v organismu a tenzi kyslíku (7). Zánět, zvýšená hladina Fe v krvi nebo zvýšené zásoby Fe v organismu stimulují produkci hepcidinu, zatímco nedostatek Fe, hypoxie a zvýšení erytropoetické aktivity se zvýšenou potřebou přísunu Fe produkci hepcidinu tlumí.
Erytropoetická aktivita má přitom na expresi hepcidinu pravděpodobně větší vliv než stav zásob Fe v organismu (7). Konkrétní faktory suprimující produkci hepcidinu však nebyly dosud kompletně popsány. Pouze u některých anémií doprovázených neefektivní erytropoézou bylo prokázáno, že zvýšená hladina růstového diferenciačního faktoru 15 (growth differentiation factor 15, GDF15) koreluje se sníženou hladinou hepcidinu (8). Hierarchie a vzájemná souhra jednotlivých regulačních systémů je dosud stále předmětem intenzivního výzkumu.
Řada vrozených i získaných anémií je přímo způsobena nebo pouze doprovázena narušeným metabolismem železa, což se může různým způsobem odrážet v hladině hepcidinu. Změny hladiny hepcidinu mohou být tedy jak vlastní příčinou, tak častěji následkem změn, které vedou k anémii a deficitu Fe v organismu nebo naopak k jeho akumulaci v buňkách a tkáních s rozvojem přetížení organismu železem.
Metody vyšetření hladin hepcidinu v krvi a moči mají zatím svá logistická i technická úskalí. Pouze společnost Intrinsic LifeSciences (Los Angeles, USA) má k dispozici vlastní standardizovanou ELISA metodu ke stanovení hladiny hepcidinu, jejíž validita byla ověřena v několika publikovaných studiích (9, 10, 11). Tato společnost se zabývá komerčním měřením hladiny hepcidinu, které je používáno spíše pro účely výzkumu. Zbývající dostupné komerční ELISA diagnostické soupravy nejsou dostatečně prověřené a ne všechny měří hladinu výhradně biologicky aktivního hepcidinu-25. Metoda vyšetření hladin hepcidinu pomocí hmotnostní spektrometrie odráží specificky pouze hepcidin-25, je však velmi technicky pracná a vyžaduje vyšší finanční nároky a vysoce sofistikované přístrojové vybavení. Výsledky jsou tedy přesnější, metoda je však zatím méně praktická pro rutinní klinické použití. Hlavním problémem při hodnocení hladin hepcidinu v dětském věku je mimo jiné i absence údajů o normálních hodnotách pro dětský věk.
Cílem práce bylo stanovit hladiny hepcidinu u dětských pacientů s vybranými typy anémií, definovat roli hepcidinu v patogenezi těchto onemocnění, jeho diagnostický význam a shrnout nejnovější informace o možném terapeutickém využití jeho agonistů a antagonistů u jednotlivých poruch metabolismu Fe ve světle současných poznatků.
Image 1. Regulace systémové homeostázy železa (Fe) hepcidinem. 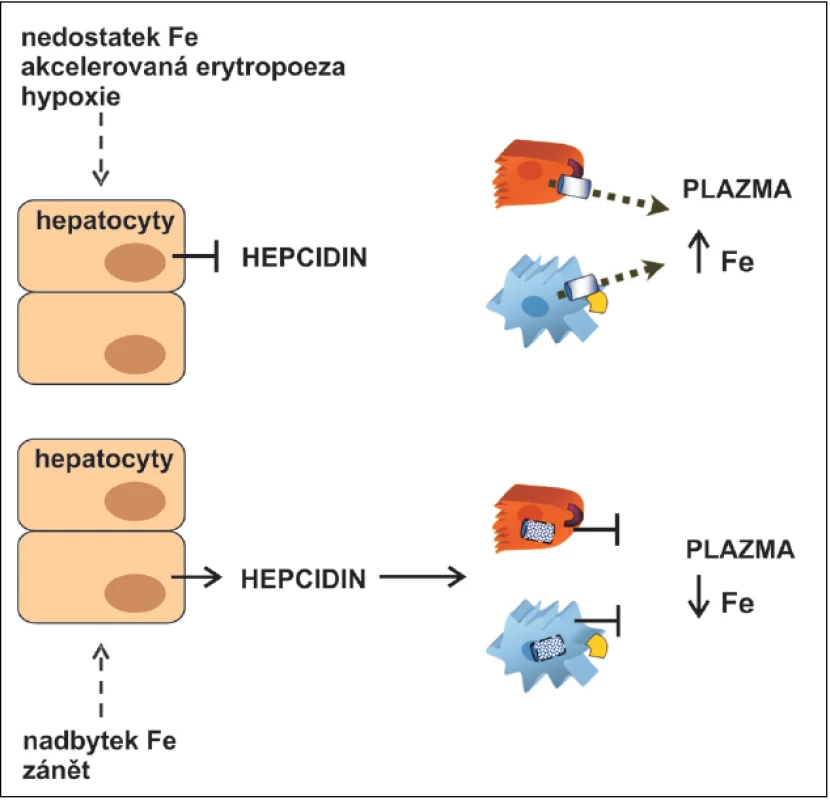
Pacienti a metody
Vyšetření hladin hepcidinu bylo provedeno u dětských pacientů se čtyřmi typy anémií, a to u dvou dobře definovaných vrozených defektů erytropoézy a dvou nejčastěji se vyskytujících typů získané anémie v dětském věku:
- Diamondovy-Blackfanovy anémie (DBA)
- hereditárních enzymopatií – deficitu glukózo-6 fosfátdehydrogenázy (G-6PD) a pyruvátkinázy (PK)
- sideropenické anémie (iron deficiency anaemia, IDA)
- anémie doprovázející nespecifické střevní záněty (inflammatory bowel diseases, IBD).
Hladiny hepcidinu byly stanoveny celkem u 33 dětských pacientů (16 dívek a 17 chlapců) ve věku 6 měsíců až 18 let s uvedeným typem anémie a u 16 zdravých kontrol. Do souboru bylo zahrnuto 6 pacientů s DBA, 5 pacientů s hereditární enzymopatií, 10 pacientů se IDA a 12 pacientů s anémií doprovázející IBD. U všech pacientů bylo po vyšetření kompletního krevního obrazu (analyzátor Sysmex XE-500) provedeno vyšetření sérových ukazatelů metabolismu železa: hladiny Fe v séru, celkové vazebné kapacity pro Fe (CVK), hladiny feritinu a s výjimkou pacientů s DBA i solubilního transferinového receptoru (sTfR). K biochemickým analýzám byly použity standardní vyšetřovací postupy. Diagnóza u pacientů s DBA a deficitem PK byla potvrzena molekulárně-genetickou analýzou s průkazem kauzálních mutací.
Vzhledem k tomu, že zatím neexistují normy hladin hepcidinu pro dětský věk, byly ke stanovení korelací hladin hepcidinu mezi pacienty s anémií a zdravou dětskou populací použity hladiny hepcidinu stanovené v souboru 16 zdravých dětí ve věku 8 měsíců až 18 let s normálními hodnotami krevního obrazu, které byly vyšetřeny v rámci plánovaného operačního výkonu (pupeční kýla, tříselná kýla, výkony z oboru plastické chirurgie).
Vyšetření hladiny hepcidinu u pacientů a kontrol
Po získání informovaného souhlasu byl u pacientů a kontrol proveden odběr žilní krve. Část plazmy určené k měření hladiny hepcidinu byla rozdělena do alikvotů, aby se předešlo opakovanému rozmrazování, a zamrazena při -80 °C.
Použitá metoda měření hladiny hepcidinu je založena na extrakci na pevné fázi (SPE) a kapalinové chromatografii spřažené s hmotnostní spektrometrií (LC-MS/MS). Pro zjištění absolutní kvantifikace hepcidinu byl použit izotopově značený interní standard [13C9, 15N1-Phe4]-hepcidin, který byl přidáván ke každému vzorku séra. Nativní a značený hepcidin byl extrahován ze vzorku séra použitím SPE pomocí Oasis® HLB SPE mikrotitračních destiček. Získané extrakty vzorků s hepcidinem byly separovány na koloně s reverzní fází (C18) pomocí LC a dále analyzovány pomocí monitorování vybraných iontů (SRM) na hmotnostním spektrometru QTRAP 5500 (AB SCIEX). Pro SRM byl vybrán čtyřnásobně nabitý prekurzor hepcidinu a jeho fragmentační b3+ ion. Bylo připraveno osm kalibrantů o koncentracích 2,5; 5; 10; 25; 50; 100; 250; 500 ng/ml hepcidinu postupným ředěním v králičím séru. Kalibrační křivka byla sestavena na základě poměrů ploch „píků“ hepcidin/interní standard a koncentrace standardů. Regresní rovnice získaná z kalibračních standardů byla použita pro zpětný výpočet koncentrace hepcidinu ve vzorku.
Statistické metody
Ke stanovení korelace hladin hepcidinu u zdravých kontrol a jednotlivých typů anémií bylo použito Mann-Whitney testu. Hladiny p < 0,05 jsou hodnoceny jako statisticky významné.
Vyšetření hladiny GDF15
Hladina GDF15 v séru byla stanovena pomocí komerční diagnostické soupravy firmy R&D Systems dle návodu od výrobce.
Výsledky a diskuse
Výsledky vyšetření krevního obrazu, biochemických parametrů, zastoupení erytropoézy v kostní dřeni, kauzální mutace, hladiny hepcidinu a GDF15 u pacientů s vrozenou poruchou erytropoézy jsou shrnuty v tabulkách 1 a 2.
Table 1. Základní charakteristiky souboru pacientů s Diamondovou-Blackfanovou anémií. 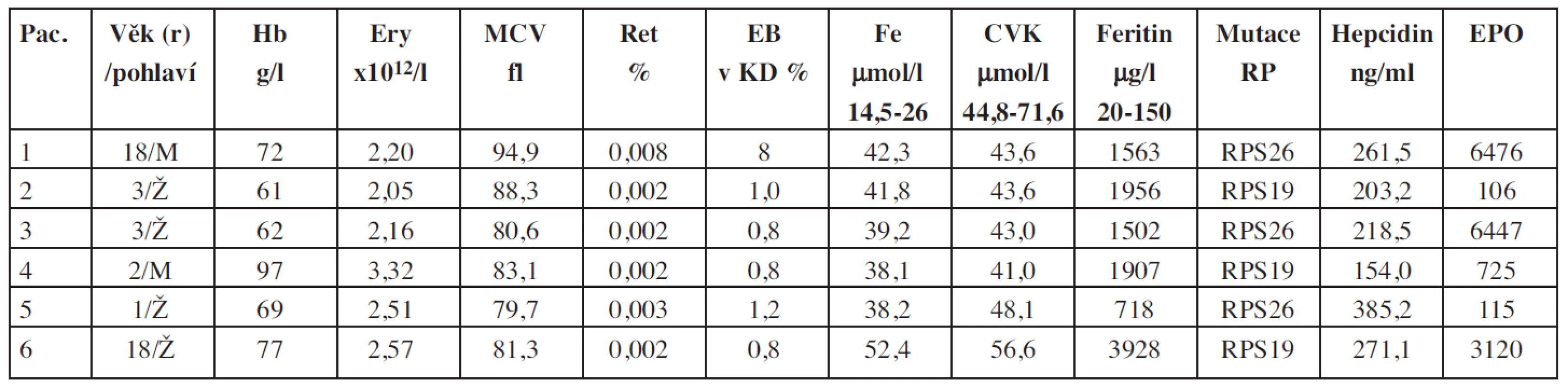
Vysvětlivky: CVK = celková vazebná kapacita; EB = erytroidní buňky; EPO = erytropoetin; Ery = erytrocyty; Hb = hemoglobin; KD = kostní dřeň; RP = ribosomální proteiny; Ret = retikulocyty Table 2. Základní charakteristiky souboru pacientů s deficitem pyruvátkinázy. 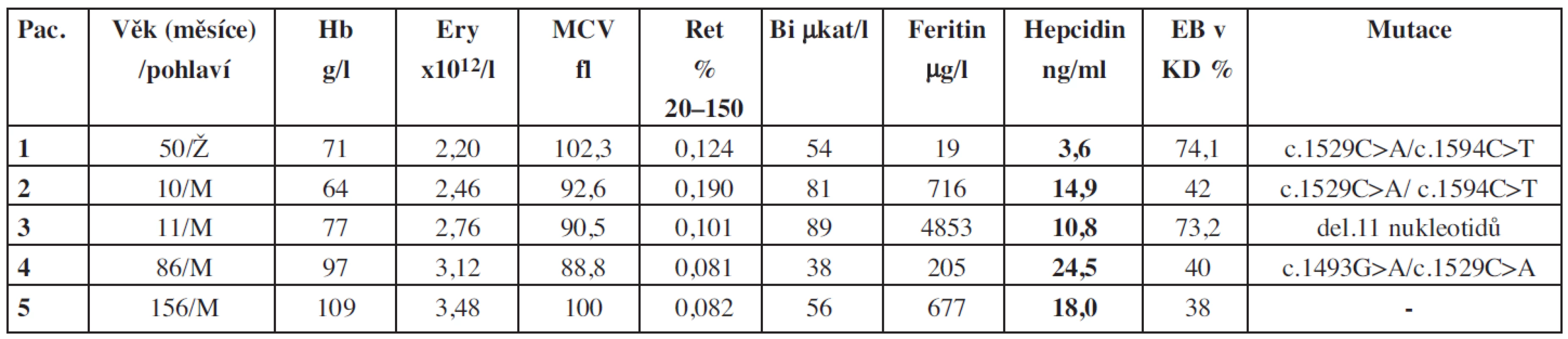
Vysvětlivky: Bi = bilirubin v séru; EB = erytroidní buňky; EPO = erytropoetin; Ery = erytrocyty; Hb = hemoglobin; KD = kostní dřeň; Pac. = pacient/pacientka Výsledky vyšetření krevního obrazu, biochemických parametrů a hladin hepcidinu u pacientů s IDA a pacientů s IBD jsou shrnuty v tabulkách 3 a 4.
Table 3. Základní charakteristiky souboru pacientů se sideropenickou anémií. 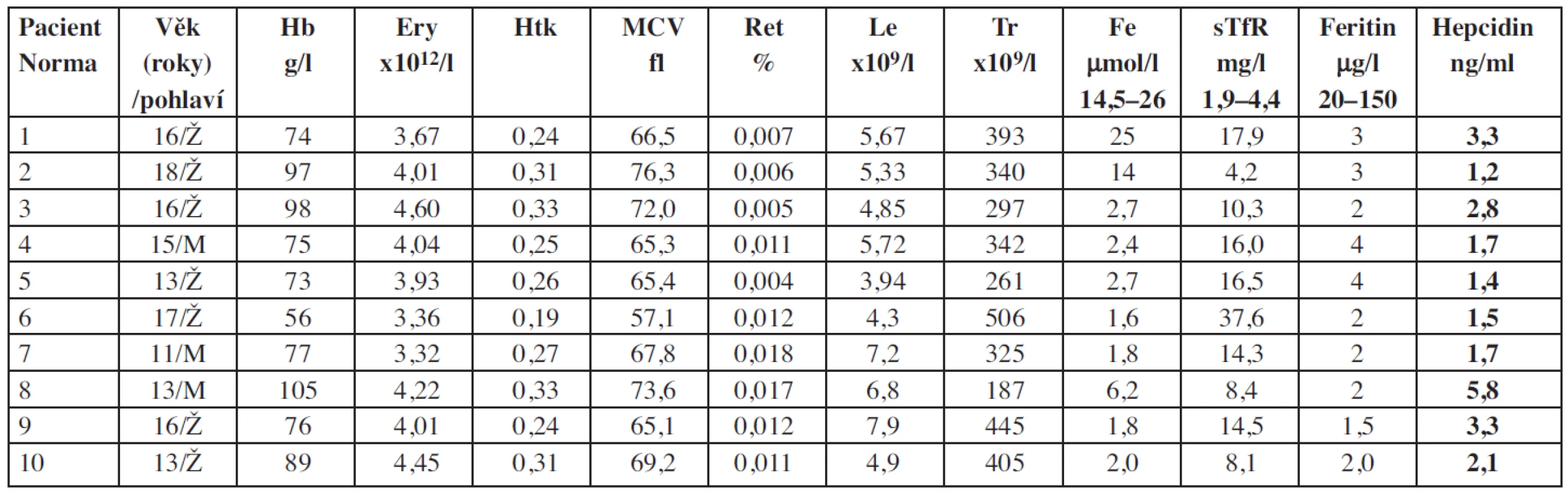
Vysvětlivky: Ery = erytrocyty; Hb = hemoglobin; Le = leukocyty; Ret = retikulocyty; Tr = trombocyty Table 4. Základní charakteristiky souboru pacientů s anémií doprovázející nespecifické střevní záněty (IBD). 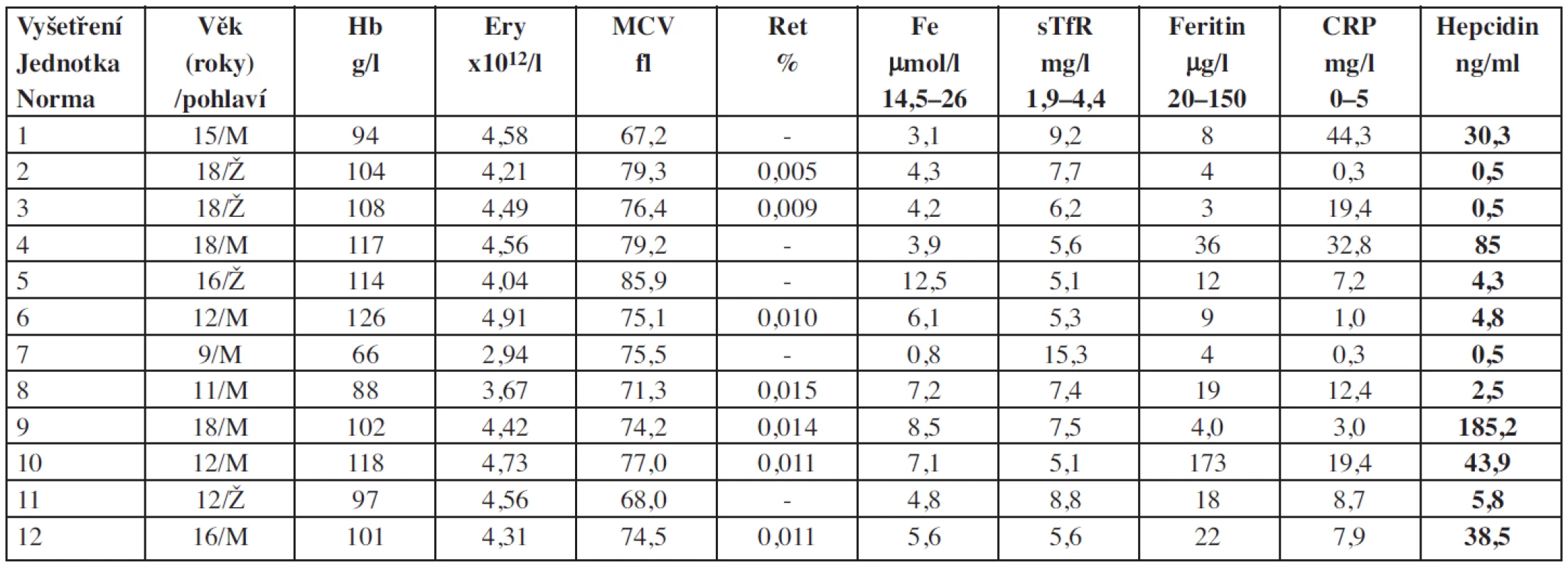
Vysvětlivky: Ery = erytrocyty; Hb = hemoglobin; Ret = retikulocyty 1. Diamondova-Blackfanova anémie
U všech vyšetřených pacientů souboru s těžkou formou DBA byla při vyšetření zjištěna těžká normocytární anémie s retikulocytopenií, zvýšená saturace transferinu a vysoké hladiny feritinu (tab. 1 a 2). Hladina hepcidinu v tomto souboru pacientů byla signifikantně vyšší ve srovnání s kontrolami (p > 0,0005).
U žádného pacienta nebyly v době vyšetření přítomny známky zánětlivého procesu.
DBA je charakterizována defektem erytropoézy s makrocytární anémií, retikulocytopenií s chyběním nebo snížením počtu erytroidních prekurzorových buněk v kostní dřeni. Příčinou onemocnění jsou mutace genů kódujících ribosomální proteiny. 30–40 % pacientů má těžkou anémii se závislostí na pravidelném podávání transfuzí. U všech těchto pacientů je pravidlem rozvoj závažného přetížení Fe s vysokou hladinou feritinu, které vzniká jako následek kombinace opakovaných transfuzí a chybějící erytropoézy v kostní dřeni a vždy vyžaduje léčbu chelátory. Vysoké hladiny hepcidinu u těžké anémie bez přítomnosti infekce nebo zánětu v tomto případě pravděpodobně odpovídají významnému přetížení železem s vysokou hladinou feritinu a zvýšenou saturací trasferinu.
Data o hladinách hepcidinu u pacientů s DBA zatím v literatuře nebyla publikována. Byla však publikována data o hladinách hepcidinu u pacientů s talasemia major, kteří mají srovnatelnou tíži anémie, potřebu transfuzí i stupeň přetížení železem. Na rozdíl od vyšetřených pacientů s DBA byly u pacientů s talasemií opakovaně popsány naopak snížené hladiny hepcidinu (12–15), které mohou přispívat k prohloubení stupně přetížení Fe. Podobně byly popsány snížené hladiny hepcidinu u pacientů s kongenitální dyserytropoetickou anémií (16, 17) a kongenitální sideroblastickou anémií (18). U všech zmíněných nemocí hladina hepcidinu negativně koreluje s hladinou GDF15 (8). Tato onemocnění jsou charakterizována neefektivní erytropoézou se zmnožením erytroidních prekurzorových buněk v kostní dřeni, což je pravděpodobně hlavním faktorem negativně ovlivňujícím produkci hepcidinu s cílem umožnit zvýšení absorpce Fe k zajištění dostatečné syntézy hemoglobinu.
U pacientů s DBA pravděpodobně není produkován erytroidní regulátor hepcidinu vzhledem k velmi nízké erytropoetické aktivitě. Zajímavý je fakt, že u pacientů s DBA jsou extrémně vysoké hodnoty erytropoetinu, na který deficitní erytropoéza není schopna reagovat. Tento výsledek je v souladu s analýzami na myších modelech, které ukázaly, že suprese hepcidinu erytropoetinem je nepřímá a vyžaduje plně funkční erytropoézu v kostní dřeni (19).
2. Hereditární enzymopatie
U všech pacientů se jednalo o středně těžkou nebo těžkou hemolytickou anémii s retikulocytózou a známkami extravaskulární hemolýzy (tab. 2). U tří dětí anémie vyžadovala opakované transfuze erytrocytů. U dvou pacientů se středně těžkou anémii byly transfuze podávány pouze ojediněle při infekcích. U tří pacientů byly rovněž přítomny zvýšené hladiny feritinu, u nejmladšího pacienta až s obrazem závažného přetížení železem s výrazně zvýšenou hladinou feritinu, což si vyžádalo léčbu chelátory Fe. U všech pacientů byla popsána akcelerace erytropoézy v kostní dřeni (tab. 2). V této skupině pacientů jsme prokázali signifikantně nižší hladinu hepcidinu ve srovnání s kontrolami (p > 0,02) (graf 1).
Graph 1. Srovnání hladin hepcidinu u pacientů s těžkou formou Diamondovy-Blackfanovy anémie (DBA) závislých na transfuzích, pacientů s deficitem pyruvátkinázy (PK) a kontrolní skupiny. 
Na patogenezi přetížení železem u pacientů s deficitem PK se mohou podílet opakované transfuze, hemolýza, ale i neefektivní erytropoéza. Může k němu přispívat i koincidence deficitu PK s vrozenou poruchou metabolismu železa. Až 20 % evropské populace má mírnou alteraci v metabolismu železa spojovanou s heterozygotním přenašečstvím mutace c.187C>G (p.His63Asp) a c.845C>A (p.Cys282Tyr) v HFE genu způsobujících vrozenou hemochromatózu. Poslední studie prokázaly abnormality v HFE-genu u 35 % pacientů s PK deficitem, kteří nejsou závislí na transfuzích (20). Tyto abnormality jsou spojeny se zvýšením hladiny Fe v séru a feritinu a mohou vést při dlouhém trvání k rozvoji cirhózy jater. Přetížení železem i bez mutace genu pro hemochromatózu bylo popsáno u polytransfundovaných pacientů a pacientů s PK deficitem po splenektomii. Pro přetrvávající výraznou hyperferitinemii byly u pacienta č. 4 vyloučeny mutace genů asociovaných s hemochromatózou, a to konkrétně mutace HFE1, HFE2A kódujícího hemojuvelin a HFE2B kódujícího hepcidin. Na přetížení železem se u tohoto pacienta pravděpodobně podílejí také snížené hladiny hepcidinu vedoucí ke zvýšenému vstřebávání Fe. U deficitu PK se kombinují oba faktory regulující protichůdně produkci hepcidinu: anémie s vyššími nároky na přísun železa při větším obratu erytropoézy a zvýšená hladina železa s vysokou hladinou feritinu. Bylo prokázáno, že u pacientů s deficitem PK je zvýšena hladina GDF 15, která je v tomto případě pravděpodobně zmíněným „erytroidním regulátorem“ snižujícím produkci hepcidinu (21). Zvýšenou hladinu GDF15 jsme prokázali u všech čtyř pacientů s deficitem PK (tab. 2). Snížení hladiny hepcidinu vede ke zvýšení resorpce Fe i přes jeho zvýšené zásoby, což dále přispívá ke zvyšování zásobního železa a k progresi přetížení železem.
3. Sideropenická anémie
U všech vyšetřených pacientů se IDA byly hladiny hepcidinu signifikantně nižší ve srovnání s kontrolami, rozdíl je statisticky významný (p < 0,01) (graf 2).
Graph 2. Srovnání hladin hepcidinu u pacientů se sideropenickou anémií (IDA), anémií doprovázející nespecifické střevní záněty (IBD) a kontrolní skupiny. 
U pacientky č. 2 jsme pro zajímavost provedli kontrolní vyšetření hladiny hepcidinu za 3 měsíce po zahájení léčby, kdy při normalizaci krevního obrazu došlo ke zvýšení hladiny hepcidinu k hodnotě blízké mediánu u kontrolní skupiny.
Hladiny hepcidinu nejlépe korelovaly se sníženou hladinou feritinu a zvýšenou hladinou sTfR.
IDA jako celosvětově nejrozšířenější anémie postihuje 20–30 % světové populace. V dětském věku se vyskytuje nejčastěji ve dvou věkových obdobích: u kojenců a batolat a poté v období adolescence, tedy v obdobích, která jsou charakterizována rychlým růstem a zvýšenými nároky na erytropoézu. V období růstu může mít IDA u kojenců a dětí do 3 let věku negativní dopad na růst a vývoj a může vést ke dlouhotrvajícímu snížení mentálních a motorických funkcí a poruch chování (22). Pokud není léčba zahájena včas, mohou být uvedené změny ireverzibilní (23). Proto je prevence a včasná diagnóza IDA velmi důležitá. Ve vyspělých zemích byly již vytvořeny programy prevence nedostatku železa především u malých dětí.
Odlišení IDA od ostatních mikrocytárních anémií vyžaduje vyšetření parametrů metabolismu Fe v séru (saturace transferinu, CVK, feritin, sTfR), k čemuž je nezbytný odběr žilní krve. Možnost vyšetření hepcidinu v moči jako screeningového testu pro detekci nedostatku Fe u malých dětí by pro klinickou praxi mohla být obrovským přínosem.
4. Anémie u pacientů s nespecifickými střevními záněty
V souboru 12 pacientů s IBD (Crohnovou chorobou a ulcerózní kolitidou) jsou hodnoty hepcidinu rozdílné od velmi nízkých ke zvýšeným. Rozdíl mezi pacienty a kontrolami není statisticky významný (graf 2). Hladiny hepcidinu jsou tak nižší, než by se teoreticky dalo očekávat u anémie doprovázející chronické choroby. Nízká hladina hepcidinu koreluje s nízkou hladinou feritinu a vysokou hladinou sTfR, které jsou nepochybnou známkou deficitu Fe v organismu a byly prokázány u 8/12 pacientů. V malém souboru vyšetřených pacientů tedy převažují děti s IBD s významným deficitem Fe.
U typické anémie chronických zánětů (ACD) je produkce hepcidinu několikanásobně vyšší. Zvýšená hladina hepcidinu s následnou retencí Fe v enterocytech a makrofázích vysvětluje jednu ze základních charakteristik anémie chronických chorob, kterou je zvýšená sekvestrace Fe v makrofázích a nízká hladina Fe v séru (24). V patogenezi anémie u pacientů s nespecifickými střevními záněty je však situace komplikovaná dalšími faktory. Na etiologii anémie se podílí nejen chronický zánět, ale i špatné vstřebávání Fe zánětlivě změněnou sliznicí, nedostatečný příjem potravy a chronické ztráty krve ze střeva při zánětu sliznice. Vzniká tak často kombinace anémie chronických chorob se skutečným nedostatkem železa (tzv. ACD/IDA). Odlišení „klasické“ anémie chronických chorob od ACD/IDA obecně není jednoduché, zatím neexistuje žádný parametr vhodný k jednoznačnému odlišení těchto dvou typů anémie. Důležitými markery jsou transferin, saturace transferinu a sTfR. Každý z těchto ukazatelů však má různé limitace a žádný z nich není jednoznačně spolehlivý, protože jsou ovlivněny i jinými faktory než jsou změny rovnováhy železa (25). Kromě těchto základních ukazatelů metabolismu Fe se diskutuje o poměru log. sTfR/feritin, procentu hypochromních erytrocytů, šíři distribuce erytrocytů nebo obsahu hemoglobinu v retikulocytech, žádná z těchto metod však zatím nebyla přijata do rutinní praxe. Proto je zvažováno možné využití stanovení hladiny hepcidinu.
Na hladinu hepcidinu u ACD/IDA působí opět dva protichůdné faktory: anémie se skutečným deficitem Fe, což by teoreticky mělo vést ke snížení hladiny hepcidinu a následně ke zvýšenému vstřebávání železa ze střeva, a zánět střevní sliznice, který by měl v důsledku zvýšení produkce IL-6 při zánětlivém procesu vést ke zvýšení hladiny hepcidinu a snížení resorpce Fe. Zatím však bylo publikováno jen málo prací hodnotících hepcidin u IBD, a to pouze u dospělých (26, 27, 28) s protichůdnými výsledky. Studie u dětských pacientů dosud nejsou k dispozici. Dle výsledků vyšetření u našich pacientů koreluje obraz skutečného deficitu Fe i přes chronické zánětlivé onemocnění s nízkou hladinou hepcidinu. U pacienta s UC s nejnižší hladinou hepcidinu (pacient č. 7, tab. 4) je přítomna výrazná anémie charakteru ACD/IDA i při přetrvávající zánětlivé aktivitě s krvácením ze střevní sliznice. Hladina hepcidinu by tedy mohla právě u anémie chronických chorob být jedním z ukazatelů, které pomohou odpovědět na otázku, zda je u pacientů skutečný deficit železa nebo zda převažuje zánětlivá složka s blokádou resorpce železa, a být tak vodítkem při rozhodování, zda má smysl léčit pacienty perorálně podávanými preparáty Fe. Dle našich výsledků je signál skutečného deficitu Fe v organismu nadřazen signálům chronického zánětu. Tomu odpovídají i rozporuplné publikované výsledky různých hladin hepcidinu u dospělých pacientů s IBD.
Vývoj metod stanovení hladiny hepcidinu bude mít v budoucnu jistě význam pro klinickou praxi. V posledních letech byly získané poznatky o metabolismu hepcidinu u některých typů anémií a také hereditárních hemochromatóz podkladem pro vývoj agonistů a antagonistů hepcidinu, které mohou mít efekt v léčbě některých poruch homeostázy Fe, především u přetížení železem u pacientů s talasémií nebo u anémie chronických chorob. Jako nejslibnější se jeví možné použití agonistů hepcidinu u talasémií. Na myších modelech talasémie bylo prokázáno, že agonisté hepcidinu mohou působit nejen jako prevence přetížení železem, ale mohou rovněž zlepšit erytropoézu, pravděpodobně snížením nadměrné syntézy globinu nebo snížením oxidativního stresu v erytroidních prekurzorech. Spekuluje se i o využití inhibitorů enzymatické aktivity matriptázy 2, která negativně ovlivňuje expresi hepcidinu, u hereditární hemochromatózy. Zvýšením produkce hepcidinu by se mohlo předejít komplikacím plynoucím z nadměrné absorpce Fe nebo nadměrného uvolňování Fe z makrofágů. Byla by však nezbytná důsledná titrace inhibice produkce hepcidinu, protože u HFE myší se při kompletní inaktivaci enzymu vyvinula sideropenická anémie. Dalším z kandidátů pro léčbu hemochromatózy je použití farmakologických dávek kostního morfogenetického proteinu 6 (bone morphogenetic protein - BMP6), přirozeného ligandu BMP receptoru, který je hlavním proteinem stimulujícím transkripci hepcidinu. Antagonisté hepcidinu, látky, které snižují produkci hepcidinu, by mohly být využity u stavů s restrikcí Fe způsobenou vysokou hladinou hepcidinu a uvolnit retinované Fe pro erytropoézu. Vzhledem k tomu, že se v případě těchto typů anémií nejedná o bezprostředně život ohrožující stavy, je nezbytné před použitím antagonistů hepcidinu velmi bedlivě ověřit jejich potenciální vedlejší účinky. Zatím je efekt těchto látek zkoumán na myších modelech.
Závěry
U pacientů trpících různými typy anémií mohou jednotlivé mechanismy regulující metabolismus železa a tím i produkci hepcidinu působit protichůdně. Znalost hladiny hepcidinu v séru a moči může být nejen významnou informací při pátrání po patofyziologii anémie nebo poruch metabolismu železa, ale i důležitým diagnostickým testem. Může sloužit například jako test k časnému vyhledávání sideropenie u malých dětí, k odlišení ACD od ACD/IDA nebo být vodítkem při rozhodování o indikaci léčby perorálně podávanými preparáty železa nebo léčby intravenózní. Naše dílčí výsledky mohou významnou měrou přispět k odhalení řady nejasností v hierarchii vlivu jednotlivých regulátorů produkce hepcidinu.
Stanovení hladin hepcidinu proteomickou metodou bude v budoucnu jistě patřit k metodám, které především umožní zpřesnit diagnostiku celé řady anémií informací o aktuálním stavu metabolismu železa. Může poskytnout nejen důležitou informaci o aktuálním deficitu železa pro potřeby erytropoézy, stupni přetížení železem, ale i o aktuální schopnosti enterocytů vstřebávat Fe ze střevního lumen. Znalost hladiny hepcidinu může při korelaci s hladinami ostatních proteinů účastnících se regulace metabolismu Fe přinést velmi důležité poznatky o dosud nejasných aspektech homeostázy Fe v organismu. Je třeba zdůraznit, že v některých případech nelze stanovit definitivní závěr z jednoho vyšetření hladiny hepcidinu. Ta se u různých patologických stavů dynamicky mění, měření je proto nutno opakovat v různých fázích vývoje onemocnění. Vzhledem k náročnosti zavedené proteomické detekce hepcidinu je však otázka jejího rutinního použití otevřená.
Poděkování
Tato práce byla podpořena grantem IGA MZ ČR NS9951-4/2008, IGA UPOL 9011100251, operačním programem Věda a výzkum pro inovace (projekt CZ.1.05/2.1.00/01.0030) a Interním grantem Univerzity Palackého v Olomouci LF-2011-011.
Doc. MUDr. Dagmar Pospíšilová, Ph.D.
Dětská klinika Lékařská fakulta Univerzity Palackého v Olomouci
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: pospisid@fnol.cz
Doručeno do redakce: 7. 3. 2012
Přijato po recenzi: 15. 4. 2012
Sources
1. Ganz T, Nemeth E. Hepcidin and iron homeostasis. Biochim Biophys Acta; publikováno elektronicky 25. ledna 2012. DOI 10.1016/j.bbamcr.2012.01.014.
2. Park CH, Valore EV, Waring AJ, Ganz T. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001; 276 : 7806–7810.
3. Valore EV, Ganz T. Posttranslational processing of hepcidin in human hepatocytes is mediated by the prohormone convertase furin. Blood Cells Mol Dis 2008; 40 : 132–138.
4. Ganz T, Nemeth E. Iron imports: IV. Hepcidin and regulation of body iron metabolism. Am J Physiol Gastrointest Liver Physiol 2006; 290: G199–G203.
5. Cherian S, Forbes DA, Cook AG, et al. An insight into the relationships between hepcidin, anemia, infections and inflammatory cytokines in pediatric refugees: a cross-sectional study. PLoS ONE 2008; 3: e4030.
6. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science 2004; 306 : 2090–2097.
7. Fleming RE, Ponka P. Iron overload in human disease. N Engl J Med 2012; 366 : 348–359.
8. Tanno T, Noel P, Miller JL. Growth differentiation factor 15 in erythroid health and disease. Curr Opin Hematol 2010; 17 : 184–190.
9. Ganz T, Olbina G, Girelli D, Nemeth E, Westerman M. Immunoassay for human serum hepcidin. Blood 2008; 112 : 4292–4297.
10. Young MF, Glahn RP, Ariza-Nieto M, et al. Serum hepcidin is significantly associated with iron absorption from food and supplemental sources in healthy young women. Am J Clin Nutr 2009; 89 : 533–538.
11. Melis MA, Cau M, Congiu R, et al. A mutation in the TMPRSS6 gene, encoding a transmembrane serine protease that suppresses hepcidin production, in familial iron deficiency anemia refractory to oral iron. Haematologica 2008; 93 : 1473–1479.
12. Gardenghi S, Grady RW, Rivella S. Anemia, ineffective erythropoiesis and hepcidin: interacting factors in abnormal iron metabolism leading to iron overload in ß-thalassemia. Hematol Oncol Clin North Am 2010; 24 : 1089–1107.
13. Gardenghi S, Marongiu MF, Ramos P, et al. Ineffective erythropoiesis in beta-thalassemia is characterized by increased iron absorption mediated by down-regulation of hepcidin and up-regulation of ferroportin. Blood 2007; 109 : 5027–5035.
14. Ginzburg Y, Rivella S. ß-thalassemia: a model for elucidating the dynamic regulation of ineffective erythropoiesis and iron metabolism. Blood 2011; 118 : 4321–4330.
15. Kattamis A, Papassotiriou I, Palaiologou D, et al. The effects of erythropoetic activity and iron burden on hepcidin expression in patients with thalassemia major. Haematologica 2006; 91 : 809–812.
16. Tamary H, Shalev H, Perez-Avraham G, et al. Elevated growth differentiation factor 15 expression in patients with congenital dyserythropoietic anemia type I. Blood 2008; 112 : 5241–5244.
17. Casanovas G, Swinkels DW, Altamura S, et al. Growth differentiation factor 15 in patients with congenital dyserythropoietic anaemia (CDA) type II. J Mol Med (Berl) 2011; 89 : 811–816.
18. Ramirez JM, Schaad O, Durual S, et al. Growth differentiation factor 15 production is necessary for normal erythroid differentiation and is increased in refractory anaemia with ring-sideroblasts. Br J Haematol 2009; 144 : 251–262.
19. Vokurka M, Krijt J, Sulc K, Necas E. Hepcidin mRNA levels in mouse liver respond to inhibition of erythropoiesis. Physiol Res 2006; 55 : 667–674.
20. Zanella A, Bianachi P, Iurlo A, et al. Iron status and HFE genotype in erytrocyte pyruvate kinase deficiency: Study of Italian cases. Blood cells Mol Dis 2001; 27, 653–661.
21. Finkenstedt A, Bianchi P, Theurl I, et al. Regulation of iron metabolism through GDF15 and hepcidin in pyruvate kinase deficiency. Br J Haematol 2009; 144 : 789–793.
22. Kazal LA Jr. Prevention of iron deficiency in infants and toddlers. Am Fam Physician 2002; 66 : 1217–1225.
23. Lozoff B, Klein NK, Nelson EC, McClish DK, Manuel M, Chacon ME. Behavior of infants with iron-deficiency anemia. Child Dev 1998; 69 : 24–36.
24. Nemeth E, Valore EV, Territo M, Schiller G, Lichtenstein A, Ganz T. Hepcidin, a putative mediator of anemia of inflammation, is a type II acute-phase protein. Blood 2003; 101 : 2461–2463.
25. Oustamanolakis P, Koutroubakis IE, Kouroumalis EA. Diagnosing anemia in inflammatory bowel disease: beyond the established markers. J Crohns Colitis 2011; 5 : 381–391.
26. Oustamanolakis P, Koutroubakis IE, Messaritakis I, Malliaraki N, Sfiridaki A, Kouroumalis EA. Serum hepcidin and prohepcidin concentrations in inflammatory bowel disease. Eur J Gastroenterol Hepatol 2011; 23 : 262–268.
27. Nagy J, Lakner L, Poór VS, et al. Serum prohepcidin levels in chronic inflammatory bowel diseases. J Crohns Colitis 2010; 4 : 649–653.
28. Arnold J, Sangwaiya A, Bhatkal B, Geoghegan F, Busbridge M. Hepcidin and inflammatory bowel disease: dual role in host defence and iron homeostasis. Eur J Gastroenterol Hepatol 2009; 21 : 425–429.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2012 Issue 2-
All articles in this issue
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
- Identifikace patogeneticky významných mutací u chronické lymfocytární leukemie pomocí „sekvenování nové generace“
- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Současné možnosti laboratorní diagnostiky heparinem indukované trombocytopenie
- Kolapsový stav u 18leté dívky – kazuistika
- Význam stanovení hladiny hepcidinu v diagnostice vybraných typů anémií v dětském věku
- Hodnocení časné molekulární odpovědi po 3 měsících léčby imatinibem může u nemocných s chronickou myeloidní leukemií přispět k upřesnění odhadu prognózy – zkušenosti jednoho centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

