-
Medical journals
- Career
Náhlá progrese mnohočetného myelomu charakterizovaná parciálním „light-chain escape“ fenoménem a sekundární translokací t(8;14)
: T. Pika 1; J. Balcárková 2; P. Lochman 3; J. Minařík 1; M. Jarošová 2; L. Raida 2; J. Bačovský 1; V. Ščudla 1
: III. interní klinika, LF Univerzity Palackého a Fakultní Nemocnice Olomouc, 2Hemato-onkologická klinika, LF Univerzity Palackého a Fakultní Nemocnice Olomouc, 3Oddělení klinické biochemie a imunohematologie, Fakultní Nemocnice Olomouc 1
: Transfuze Hematol. dnes,17, 2011, No. 1, p. 30-35.
: Comprehensive Reports, Original Papers, Case Reports
Autoři předkládají případ nemocného s mnohočetným myelomem s primárně dobrou odpovědí na indukční chemoterapii a vysokodávkovanou terapii s podporou autologních periferních kmenových buněk. Následná časná abruptivní progrese onemocnění byla charakterizována klonem morfologicky dediferencovaných myelomových buněk se ztrátou schopnosti syntézy kompletní molekuly monoklonálního imunoglobulinu a výraznou nadprodukcí volných lehkých řetězců kappa. Cytogenetické vyšetření prokázalo vývoj karyotypu s přítomností sekundárních, prognosticky nepříznivých cytogenetických změn – translokace t(8;14)(q24;q32) a zvýšený počet kopií oblasti 1q21. Progrese myelomu byla spojena s výraznou rezistencí na kombinovanou chemoimunoterapii.
Klíčová slova:
mnohočetný myelom, lehké řetězce imunoglobulinu, cytogenetika, t(8;14)Úvod
Mnohočetný myelom je zhoubné hematologické onemocnění charakterizované klonální proliferací a akumulací neoplasticky transformovaných elementů terminálních stadií B-lymfocytární linie, charakterizované produkcí monoklonálního imunoglobulinu (paraprotein, M-protein) nebo jeho strukturálních součástí (lehké řetězce) detekovatelných v séru a/nebo v moči a s asociovaným orgánovým postižením charakterizovaným zkratkou CRAB (hyperkalcemie, renální nedostatečnost, anémie, kostní léze). Samotné biologické a klinické vlastnosti onemocnění jsou determinovány nejen stupněm postižení, charakteristikou vnitřních interakcí v mikroprostředí kostní dřeně, léčebnou odpovědí nemocného na zvolený typ chemo/radioterapie, ale zejména genetickou výbavou nádorového klonu (1, 2, 3). Předložené sdělení popisuje méně obvyklé pozorování nemocného s progredujícím mnohočetným myelomem.
Popis případu
58letý nemocný byl v březnu 2008 hospitalizován ve spádovém rehabilitačním oddělení pro vertebrogenní algický syndrom. Hospitalizaci předcházely několikaměsíční, postupně progredující bolesti zad v dolní hrudní a bederní páteři i bolesti levého ramene. V rámci komplexního přešetření byla zjištěna vysoká sedimentace (FW 95/h), normocytární normochromní anémie (Hb 95 g/l), hyperkalcemie (2,78 mmol/l), mírná renální insuficience (kreatinin 137 μmol/l) a hyperproteinemie s hodnotou celkové bílkoviny (CB 104 g/l). Nemocný byl rehydratován a promptně odeslán k další péči na specializované oddělení III. interní kliniky FN v Olomouci.
Subjektivní obtíže zahrnovaly několikaměsíční, stupňující se bolesti dolní hrudní a bederní páteře, bez propagace do dolních končetin a výrazné bolesti levého ramene s omezením pohyblivosti paže. Další příznaky zahrnovaly zvýšenou únavu, ponámahovou dušnost a úbytek na hmotnosti asi 9 kg za poslední 3 měsíce.
V oblasti kalvy byly zjištěny 3 hmatné polotuhé polokulovité rezistence do průměru 2 cm temporoparietálně vpravo a znatelně omezená hybnost levého ramenního kloubu zejména při elevaci a rotaci paže. Ostatní fyzikální nález byl bez podstatných odchylek.
V laboratorním obraze byla přítomna vysoká sedimentace erytrocytů (FW 127/142), normocytární normochromní anémie (Hb 94) bez alterace bílé řady či počtu destiček a se záchytem 1 % plazmatických buněk v manuálním diferenciálním rozpočtu leukocytů. V biochemickém rozboru séra byla zjištěna hyperproteinemie (CB 114 g/l), hypoalbuminemie (33 g/l), a vyšší hladinu β2-mikroglobulinu (β2-m, 3,88 mg/l). Elektroforetické a imunofixační vyšetření séra potvrdilo vysoký „peak“ monoklonálního imunoglobulinu IgA kappa v dimerické formě (50,2 g/l), nefelometrické vyšetření séra (FreeliteTM) ukázalo vysoké hladiny volných lehkých řetězců (VLŘ) kappa (129,9 mg/l; normální rozmezí: 3,3–19,4 mg/l) s výraznou patologií indexu klonality kappa/lambda (12,44; normální rozmezí: 0,26–1,65). Elektroforetické a imunofixační vyšetření moče nebylo vzhledem k nízké kvantitě proteinurie (150 mg/den) výtěžné. Viskozita séra byla zvýšena na 3,66 (normální hodnota < 1,95).
Trepanobioptické vyšetření kostní dřeně odhalilo 35 % intersticiálně – nodulární infiltraci kostní dřeně poměrně dobře diferencovanou myelomovou populací (CD 138+) s monoklonální expresí řetězců kappa a s útlakem reziduální hemopoézy. Cytogenetické vyšetření kostní dřeně s nálezem normálního karyotypu, 46 XY, bylo doplněno metodou fluorescenční in situ hybridizace s imunofluorescenčním značením myelomových buněk – metodou cIg FISH, označovanou také jako metoda FICTION (4, 5). Byly nalezeny změny v počtu kopií IgH genu, chromozomu 1, oblasti 1q21, chromozomů 7, 9 a 17 (tab. 1). Radiografické vyšetření skeletu, vyšetření pozitronovou emisní tomografií (18FDG - PET/CT) a scintigrafické vyšetření skeletu s pomocí 99mTc-MIBI potvrdilo četné osteolytické a aktivní léze, v oblasti kalvy a levé lopatky s projevy extramedulárního šíření. Doplněné neurologické vyšetření, včetně elektromyografie, zjistilo kompletní denervaci m. infraspinatus vlevo při útlaku n. suprascapularis extramedulární myelomovou masou.
1. Výsledky cytogenetiky a cIg FISH. 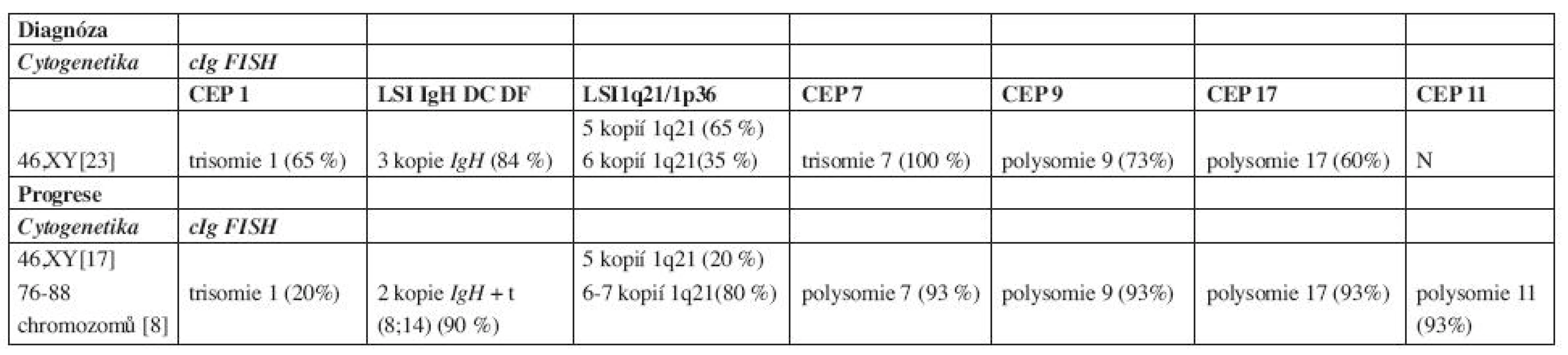
(polysomie 3–6 kopií chromozomů, N – normální nález, CEP – označení pro centromerickou sondu, LSI – označení pro genovou sondu) Stav byl tedy uzavřen jako symptomatický mnohočetný myelom typu IgA-kappa, st. III-A dle Durieho-Salmona, st. 2 dle International Staging System s iniciální extramedulární propagací v oblasti kalvy a levé lopatky (6, 7). V rámci přípravy k vysokodávkované chemoterapii s podporou periferních kmenových buněk (HD-T/ASCT) byl zvolen indukční režim CTD junior (Cyklofosfamid 800 mg i.v. 1. den, Thalidomid 200 mg p.o. denně, Dexametazon 40 mg p.o. 1.–4. a 12.–15. den cyklu) v 21denních intervalech podání v souladu s tehdejším platným protokolem České myelomové skupiny (CMG) (8, 9). Terapie byla doplněna ložiskovou aktinoterapií na oblast levé lopatky a extramedulární léze kalvy v celkové dávce 30 Gy. Jako antiresorpční terapie byla zvolena intravenózní aplikace pamidronátu v pravidelných měsíčních intervalech. Bazální analgetická léčba byla zajištěna transdermální formou fentanylu, na průlomovou bolest byl nemocný vybaven metamizolem a paracetamolem.
Celkem byly podány 4 cykly indukční chemoterapie režimem CTD junior, pro známky polyneuropatie dolních končetin a obstipaci s redukcí dávky thalidomidu od 2. cyklu na 50 % (100 mg denně p.o.). Indukční chemoterapií bylo dosaženo velmi dobré parciální remise onemocnění (VGPR) se snížením hodnoty M-proteinu z 50,2 na 3,62 g/l, tedy s redukcí o > 90 % (10). Rovněž byl zaznamenán pokles hladin VLŘ kappa z hodnoty 129,9 na 82 mg/l. Průběh chemoterapie byl kromě polyneuropatie dolních končetin 2.–3. st., provázen opakovanou exacerbací chronické bronchitidy s nutností antibiotické terapie, vznikem steroidního diabetu II. typu s nutností trvalé terapie perorálními antidiabetiky, ale i epizodou hluboké žilní popliteální trombózy levé dolní končetiny se scintigraficky verifikovanou asymptomatickou plicní embolizací a to i přes trvalou profylaktickou terapii nízkomolekulárním heparinem. Dodatečně byla zjištěna pozitivita lupus antikoagulans. Měsíc po ukončení indukční chemoterapie a po sanaci možných infekčních fokusů byla provedena stimulace a sběr periferních kmenových buněk (stimulační režim vysokodávkovaný Cyklofosfamid 2,5g/m2 + G-CSF 10 μg/kg/den 3.–10. den, leukocytaferéza provedena 11. den s výtěžkem 6,5 x 106/kg CD34+ buněk). V 6 měsíci od diagnózy nemoci byla provedena HD-T/ASCT (přípravný režim vysokodávkovaný Melfalan 200 mg/m2), průběh komplikován respiračním infektem, mukozitidou I. st. a sepsí způsobenou bakterií Enterococcus faecalis.
Po 90 dnech od převodu štěpu bylo provedeno celkové přešetření onemocnění: M-protein 1,47 g/l, hodnoty VLŘ kappa 20,08 mg/l s pouze lehce nadhraniční hodnotou indexu κ/λ – 2,23, ale normální hodnoty hemogramu a ukazatelů biochemického spektra. Histobiopsie kostní dřeně prokázala 1 % monoklonálních plazmocytů jako obraz minimální reziduální nemoci. Výsledný stav byl hodnocen jako velmi dobrá parciální remise a v souladu s doporučeními CMG byl nemocný ponechán bez udržovací terapie, pouze s nastavenou perorální antiresorpční terapií klodronátem (9, 10). Při kontrole ve 4. měsíci od HD-T/ASCT byla zachycena pouze imunofixační pozitivita M-proteinu s normálními hladinami polyklonálních imunoglobulinů, avšak při vyšetření hladin VLŘ byl zjištěn mírný nárůst hladiny řetězce kappa (38,7 mg/l) i indexu κ/λ (3, 55), nemocný byl celkově zcela asymptomatický. V odstupu 2 měsíců byl nemocný odeslán ze spádového interního zařízení pro 2 týdny trvající levostrannou bronchopneumonii s významným poklesem červené složky hemogramu. Byla zjištěna anémie (Hb 80 g/l) s normálními hodnotami bílých krvinek a trombocytů, elevace CRP (232 mg/l), mírný nárůst hladiny M-proteinu na 4,8 g/l, avšak vyšetření VLŘ potvrdilo extrémní nárůst hladiny kappa (1763 mg/l) a indexu κ/λ (226). Histobiopsie kostní dřeně potvrdila progresi myelomu s masivní, 88 % kompaktní infiltrací kostní dřeně anaplastickou myelomovou populací plazmoblastického vzhledu. Cytogenetické vyšetření odhalilo vývoj karyotypu s přítomností nového klonu s počtem až 88 chromozomů, pro špatnou morfologii chromozomů byly hodnoceny pouze početní změny. Metodou cIg FISH byla potvrzena změna karyotypu s nálezem polysomie chromozomů 7, 9, a 17, trisomie chromozomu 1 a 11 a polysomie 1q21. V době diagnózy byly zjištěny tři kopie IgH genu a v době progrese došlo k vývoji karyotypu a jedna nadpočetná kopie genu IgH byla zahrnuta do přestavby, translokace mezi chromozomy 8 a 14, t(8;14)(q24;q32) (tab. 1). V séru byl rovněž zjištěn nárůst hladiny β2-m (2,9 mg/l) a extrémně vysoká hodnota sérové thymidinkinázy (100 IU/l). Aktuální stav byl uzavřen jako: „abruptivní progrese“ mnohočetného myelomu IgA-kappa, s přítomností parciálního „light-chain escape“ fenoménu a se záchytem sekundárních cytogenetických změn.
Chemoterapie režimem VMP junior (Bortezomib 1,3 mg/m2 i.v. 1., 4., 8. a 15. den, Alkeran 9 mg/m2 p.o. 1.–4. den, Prednison 2 mg/kg p.o. 1.–4. den 28denního cyklu) vedla již po 1. cyklu k poklesu hladiny VLŘ kappa (246,7 mg/l) i indexu κ/λ (29,8), zatímco hodnota M-proteinu zůstala beze změny (4,91 g/l), bylo ale zjištěno vymizení BJ-urie (9). V průběhu 3. cyklu chemoterapie VMP došlo k postupnému vývinu oboustranné protruze očních bulbů s pravostrannou diplopií. CT a následně i MR vyšetření zobrazilo extramedulární expanze v obou očnicích s deviací zejména pravého bulbu mediálně (obr. 1, 2). V laboratorním obraze byl zjištěn opětovný nárůst hladiny VLŘ kappa (685 mg/l) s prohloubením patologie indexu κ/λ (237,1), zatímco hodnoty M-proteinu zaznamenaly pouze lehké navýšení na 7,6 g/l. Vzhledem ke zřejmé rezistenci na uvedenou chemoterapii byla zvolena záchranná chemoterapie režimem RAD (Lenalidomid 25 mg p.o. 1.–21. den, Adriablastin 9 mg/m2 i.v. 1. a 15. den, Dexametason 40 mg p.o. 1.–4. a 15.–18. den 28denního cyklu), podaného vzhledem k opětovné závažné exacerbaci infekce dýchacích cest v redukované, 50 % dávce. Souběžně probíhala ložisková radioterapie oblasti pravé očnice. Přes současnou chemo/aktinoterapii došlo k dalšímu rozvoji mnohočetných extramedulárních lézí (rty, paže, trup, žebra a kalva) s dalším nárůstem hladiny VLŘ kappa (873 mg/l) i indexu κ/λ (249) (graf 1). Nemocný zmírá na progresi základního onemocnění komplikovaného nasedající bilaterální bronchopneumonií 17 měsíců od diagnózy myelomu.
Obr. 1. MR vyšetření očnic, expanze v oblasti spodiny pravé očnice. T1 vážená sekvence s potlačením tuku po aplikaci paramagnetické kontrastní látky v koronální rovině. Přístroj Symphony – Siemens 1,5 T. (Poskytnuto MUDr. J. Hrbkem, Radiologická klinika, FN Olomouc). 
Obr. 2. MR vyšetření očnic, expanze v oblasti pravé očnice a druhá, menší léze, v oblasti laterální stěny levé očnice. T1 vážená sekvence s potlačením tuku po aplikaci paramagnetické kontrastní látky v transverzální rovině. Přístroj Symphony – Siemens 1,5 T. (Poskytnuto MUDr. J. Hrbkem, Radiologická klinika, FN Olomouc). 
1. Průběh onemocnění, srovnání hladiny paraproteinu (IgA kappa) a volných lehkých řetězců kappa (Kappa free). CTD junior (Cyklofosfamid, Thalidomid, Dexametazon), ASCT (vysokodávkovaná chemoterapie s podporou autologního štěpu), VMP junior (Bortezomib, Melfalan, Prednizon), RAD (Lenalidomid, Adriablastin, Dexametazon). 
Diskuse
Předložené pozorování demonstruje průběh mnohočetného myelomu s úvodní dobrou odpovědí na indukční chemoterapii CTD a HD-T/ASCT, avšak s následnou časnou prudkou progresí onemocnění a s rezistencí na kombinovanou léčbu novými biologickými působky, kortikosteroidy a antracyklinu. Představuje zřejmě příklad vyselektování rezistentního anaplastického klonu charakterizovaného morfologicky dediferencovanou populací se ztrátou schopnosti syntézy kompletní molekuly M-proteinu, nadprodukcí VLŘ kappa a přítomností sekundárních prognosticky nepříznivých cytogenetických změn spojených s progresí myelomu s výskytem sekundární translokace t(8;14)(q24;q32) a zvýšení počtu kopií oblasti 1q21 v době progrese MM (11, 12).
Jako „light-chain escape (LCE)“ fenomén, tedy „únik“ nebo „průlom“ je označován stav, kdy se relaps/ /progrese onemocnění vyznačuje masivní produkcí VLŘ detekovatelných v séru a/nebo v moči, avšak bez adekvátního nárůstu hladiny M-proteinu (13). Termín LCE byl poprvé použit J.R. Hobbsem, který popsal detekci LCE fenoménu v moči u části relabujících nemocných (14). V odborné literatuře jsou popisovány 2 typy LCE fenoménu: 1. Pravý typ – definovaný jako nárůst v hladinách VLŘ se stabilní nebo klesající hladinou M-proteinu a 2. parciální typ – definovaný jako masivní nárůst hladin VLŘ, avšak pouze s nízkým nárůstem hladiny M-proteinu (13). Vysvětlením pro tento fenomén je pravděpodobně přítomnost duální plazmocytární populace v kostní dřeni s jednou, produkující převážně kompletní molekuly M-proteinu, a s druhou, většinou méně diferencovanou, produkující ve vysoké míře převážně lehký řetězec imunoglobulinu. V době relapsu/progrese s možnou dediferenciací nádorového klonu dochází ke změně poměru nádorové populace v kostní dřeni ve prospěch syntézy lehkých řetězců, jak bylo demonstrováno pomocí dvojitých imunohistochemických technik (15). LCE fenomén je typický zejména pro relabující/ /progredující onemocnění po předchozí terapii, zejména pak s použitím nových biologických léků (thalidomid, lenalidomid), ale bylo popsáno i pozorování progrese původně asymptomatického onemocnění bez předchozí chemoterapie do symptomatické formy s LCE fenoménem. LCE fenomén je typický zejména pro nemocné s izotypem IgA, ale byl popsán již i u omezeného počtu nemocných s izotypem IgG, avšak většinou v jeho parciální formě. Samotná prevalence LCE fenoménu značně závisí na použitých detekčních technikách, v souborech zahraničních autorů se pohybuje od 2,5 do 20 % relabujících nemocných, přičemž 3–8 % tvoří pravá forma LCE. Je evidentní, že s možností stanovení sérových hladin VLŘ (FreeliteTM) se záchytnost zvyšuje a dovoluje LCE fenomén detekovat mnohem časněji než při vyšetření moči. Z dosavadních studií vyplývá, že nemocní s obrazem LCE v relapsu mají nepříznivou prognózu, rezistenci na terapii a časté extramedulární postižení a proto časná detekce tohoto fenoménu s použitím nejnovějších technik může odhalit časný relaps onemocnění s bezprostředním nasazením intenzivní terapie a prodloužení přežití nemocných (16, 17, 18, 19, 20).
Cytogenetické změny u mnohočetného myelomu lze rozdělit do 2 velkých, prognosticky rozdílných skupin: hyperdiploidie (charakterizované variabilními trisomiemi chromozomů s nízkou prevalencí IgH translokací) a nonhyperdiploidie (zahrnující hypodiploidie, pseudodiploidie a near-tetraploidie s častými translokacemi IgH genu). Mezi další prognostické ukazatele patří delece chromozomu 13, 17 a změny chromozomu 1. Hyperdiploidní změny se vyznačují příznivější prognózou, postihují častěji starší nemocné a častěji jsou spojeny s izotypem IgG kappa, naopak všeobecně nonhyperdiploidní změny jsou zatíženy nepříznivou prognózou, jsou četnější u mladších nemocných a častěji spojeny s izotypem IgA lambda (21). Mezi nejčastější translokace IgH genu patří translokace t(4;14)(p16;q32) a t(4;16) (q32;q23), které jsou obvykle prognosticky nepříznivé a t(11;14)(q13;q32), která je naopak spojena s prognózu příznivou, resp. neutrální (3, 21, 22). Sekundární cytogenetické změny, akumulované během vývoje nádorového klonu s sebou nesou i změnu charakteru biologického chování a primárně příznivé cytogenetické změny mohou být v případě sekundárních, následných změn, příčinou progrese a léčebné rezistence onemocnění (23, 24). V našem případě byla již v době diagnózy zjištěna hyperdiploidie metodou cIgFISH: trisomie chromozomů 1, 7, polysomie 9, 17 a nadpočetné kopie oblasti 1q21. Následně, v době progrese došlo k cytogenetickému vývoji, k objevení se klonu s počtem až 88 chromozomů a metodou cIgFISH byla potvrzena polysomie chromozomů 7, 9, 11, 17, trisomie chromozomu 1 a 4–5 kopií oblasti 1q21. Dále došlo k vývoji nové translokace t(8;14), jako sekundární změny. Translokace (8;14) (q24;q32) je charakteristickou chromozomální translokací u Burkittova lymfomu a vede k deregulaci c-myc onkogenu. V případě mnohočetného myelomu je nalézána přibližně u 1–2 % nově diagnostikovaných nemocných a stejná četnost se udává i u nemocných s relabujícím onemocněním; některé práce předpokládají asociaci s IgA izotypem, což je v souladu s naším pozorováním (25, 26). Úplný klinický dopad není doposud zcela jasný, předpokládá se ale agresivní průběh, i když publikace hodnotící terapii u nově diagnostikovaných nemocných s t(8;14) s použitím bortezomibu či lenalidomidu hovoří spíše o dobré odpovědi na podávanou chemoterapii (21, 27, 28). V našem případě byla zaznamenána ale sekundární změna, spojená s vývinem plazmablastického fenotypu plazmocytární populace s projevy biochemické dediferenciace vedoucí k dominantní sekreci jednoho typu VLŘ, s extramedulárním šířením a rezistencí na intenzivní kombinovanou chemoimunoterapii se začleněním bortezomibu, lenalidomidu a působků antracyklinového typu.
Závěr
Předložené pozorování popisuje nepříznivý průběh mnohočetného myelomu s kumulací nepříznivých prognostických ukazatelů – nepříznivých cytogenetických změn, pokročilým iniciálním postižením, komplikacemi zatíženou chemoterapií a s následnou „abruptivní“ progresí s multifokálním extramedulárním šířením, manifestující se parciálním LCE fenoménem a rezistencí k intenzivní terapii se začleněním moderních biologických působků. Bylo potvrzeno, že nové možnosti stanovení sérových hladin VLŘ (FreeliteTM) a opakované cytogenetické vyšetření dovolují rozpoznat časný relaps/progresi onemocnění, zejména pokud se jedná o případ LCE fenoménu a identifikovat nemocné s krajně nepříznivou prognózou s nutností časné intenzivní terapie. V předloženém pozorování se jednalo o neobyčejně agresivní onemocnění, přičemž samotná manifestace progrese formou LCE fenoménu proběhla ve velmi krátkém intervalu a provázená již poměrně pokročilým postižením.
MUDr. Tomáš Pika
III. interní klinika, Fakultní Nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: tomas.pika@seznam.czDoručeno do redakce: 13. 12. 2010
Přijato po recenzi: 12. 1. 2011
Sources
1. Kyle RA, Rajkumar SV. Multiple myeloma. Blood 2009; 111 : 2962-2972.
2. International myeloma working group. Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group. Brit J Haematol 2003; 121 : 749-757.
3. Stewart AK, Bergsagel PL, Greipp PR, et al. A practical guide to defining high-risk myeloma for clinical trials, patient counseling and choice of therapy. Leukemia 2007; 21 : 529-534.
4. Balcárková J, Procházková K, Ščudla V, et al. Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem. Trans a Hemat dnes 2007; 4 : 176 -182.
5. Ahmann GJ, Jalal SM, Juneau AL. et al. A novel three-color, clone-specific fluorescence in situ hybridization procedure for monoclonal gammopathies. Cancer Genet Cytogenet 1998; 101 : 7-11.
6. Durie BGM, Salmon SE. A clinical staging system for multiple myeloma. Cancer 1975; 36 : 842-854.
7. Greipp PR, Miguel JS, Durie BGM, et al. International staging system for multiple myeloma. J Clin Oncol 2005; 23 : 3412-3420.
8. Zemanová M, Ščudla V, Pour L, et al. Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu. Trans Hematol dnes 2007; 13 : 126-132.
9. Czech Myeloma Group. Diagnostika a léčba mnohočetného myelomu. Transfuze Hematol dnes 2009; 15 : 5-80.
10. Durie BGM, Harousseau J-L, Miguel JS, et al. International uniform response criteria for multiple myeloma. Leukemia 2006; 20 : 1467-1473.
11. Shaughnessy JD Jr., Zhan F, Burington BE, et al. A validated gene expression model of high-risk multiple myeloma is defined by deregulated expression of genes mapping to chromosome 1. Blood 2007; 109 : 2276-2284.
12. Chng WJ, Santana-Dávila R, Van Wier SA, et al. Prognostic factors for hyperdiploid-myeloma: effects of chromosome 13 deletions and IgH translocations. Leukemia 2006; 20 : 807-13.
13. Bradwell AR. Free light chain escape. In: Bradwell AR. Serum free light chain analysis. 6th edition, The Binding site group Ltd., Birmingham, 2010, 104-105.
14. Hobbs JR. Growth rates and responses to treatment in human myelomatosis. Brit J Haematol 1969; 16 : 607-618.
15. Ayliffe MJ, Davies FE, de Castro D, Morgan GJ. Demonstration of changes in plasma cell subsets in multiple myeloma. Haematologica 2007; 92 : 1135-1138.
16. Mead G, Hobbs J, Sharp K, Harding S, Drayson M. Incidence of light chain escape in myeloma patients at relapse. Brit J Haematol 2008; 141 (Suppl 1): 35.
17. Kühnemund A, Liebisch P., Bauchmüller K, et al. Secondary light chain multiple myeloma with decreasing IgA paraprotein levels correlating with renal insufficiency and progressive disease: Clinical course of two patients and review of the literature. Onkologie 2005; 28 (suppl 3): 165.
18. Kühnemund A, Liebisch P., Bauchmüller K, et al. Light-chain escape-multiple myeloma – an escape phenomenon from plateau phase: report of the largest patients series using LC-monitoring. J Cancer Res Clin Oncol 2009; 135 : 477-84.
19. Dawson MA, Patil S, Spencer A. Extramedullary relapse of multiple myeloma associated with a shift in secretion from intact immunoglobulin to light chains. Haematologica 2007; 92 : 143-144.
20. Granatova J, Bolkova M, Valentova K, Hanzal V, Haber J, Hachova L. Is the light chain escape phenomenon possible without previous hematological therapy? Klin Biochem Metab 2010; 18 : 83-87.
21. Fonseca R, Bergsagel PL, Drach J, et al. International myeloma working group molecular classification of multiple myeloma: spotlight review. Leukemia 2009; 23 : 2210-2221.
22. Liebisch P, Döhner H. Cytogenetics and molecular cytogenetics in multiple myeloma. Eur J Cancer 2006; 42 : 1520-1529.
23. Chng WJ, Mulligan G, Bryant B, Bergsagel L. Survival of genetic subtypes of relapsed myeloma may be modulated by secondary events. Blood 2007; 109 : 3610-3611.
24. Chng WJ, Winkler JM, Greipp PR, et al. Ploidy status rarely changes in myeloma patients at disease progression. Leukemia Res 2006; 30 : 266-271.
25. Sawyer JR, Waldron JA, Jagannath S, Barlogie B. Cytogenetic findings in 200 patients with multiple myeloma. Cancer Genet Cytogenet 1995; 82 : 41-49.
26. Gould J, Alexanian R, Goodacre A, Pathak S, Hecht B, Barlogie B. Plasma cell karyotype in multiple myeloma. Blood 1988; 71 : 453-456.
27. Li JY, Wang LX, Shen WY, Lu SF, Chen LJ, Lu H. Bortezomib in combination with dexamethasone for a young multiple myeloma with t(8;14). Leukemia Research 2009; 33 : 565-600.
28. Yuan J, Shah R, Kulharya A, Ustun C. Near-tetraploidy clone can evolve from a hyperdiploidy clone and cause resistance to lenalidomide and bortezomib in multiple myeloma patient. Leukemia Research 2010; 34 : 954-957.
Vypracováno s podporou VZ MŠMT ČR 6198959205.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2011 Issue 1-
All articles in this issue
- Samková A., Dulíček P., Pařízková E., Vokurka J.: Is coagulation screening before adenoidectomy and tonsillectomy really necessary?
- Pika T., Balcárková J., Lochman P., Minařík J., Jarošová M., Raida L., Bačovský J., Ščudla V.: Progression of multiple myeloma associated with partial „light-chain escape“ phenomenon and secondary t(8;14)
- News of the Society
- Klener P.: Use of monoclonal antibodies for anticancer therapy
- Brychtová Y., Krejčí M., Doubek M., Tomíška M., Navrátil M., Ráčil Z., Dvořáková D., Horký O., Lengerová M., Pospíšilová S., Mayer J.: Long-term results of allogeneic hematopoietic stem cell transplantation after a reduced-intensity conditioning busulfan, fludarabine, and antithymocyte globulin
- Mociková H.: Current recommendations for PET examination in Hodgkinęs lymphoma
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Klener P.: Use of monoclonal antibodies for anticancer therapy
- Samková A., Dulíček P., Pařízková E., Vokurka J.: Is coagulation screening before adenoidectomy and tonsillectomy really necessary?
- Brychtová Y., Krejčí M., Doubek M., Tomíška M., Navrátil M., Ráčil Z., Dvořáková D., Horký O., Lengerová M., Pospíšilová S., Mayer J.: Long-term results of allogeneic hematopoietic stem cell transplantation after a reduced-intensity conditioning busulfan, fludarabine, and antithymocyte globulin
- Pika T., Balcárková J., Lochman P., Minařík J., Jarošová M., Raida L., Bačovský J., Ščudla V.: Progression of multiple myeloma associated with partial „light-chain escape“ phenomenon and secondary t(8;14)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

