-
Medical journals
- Career
Systémová mastocytóza
: Lucie Nováková 1; P. Kučera 2
: Ústav hematologie a krevní transfuze, Praha, 2Oddělení alergologie a klinické imunologie Fakultní nemocnice Královské Vinohrady a 3. lékařská fakulta Univerzity Karlovy, Praha 1
: Transfuze Hematol. dnes,15, 2009, No. 1, p. 31-38.
: Comprehensive Reports, Original Papers, Case Reports
Systémová mastocytóza (SM) je vzácné získané myeloproliferativní onemocnění. Podkladem je klonální proliferace mastocytů a jejich akumulace v tkáních. U většiny pacientů postižených SM je přítomna aktivující bodová mutace v genu kódujícím receptor c-KIT (substituce aspartát/valin v kodonu 816 – D816V). Systémová mastocytóza je na rozdíl od čistě kožní formy diagnostikována zejména v dospělosti. Část nemocných je zároveň postižena jiným klonálním hematologickým onemocněním, zejména myeloidní linie. Velmi vzácným podtypem systémové mastocytózy je mastocelulární leukemie. Symptomy onemocnění jsou dány jednak tkáňovou akumulací patologických mastocytů, jednak uvolněním mediátorů z těchto buněk. Při diagnostice onemocnění je zásadní histologické (s imunohistochemickým) a molekulárně genetické vyšetření postiženého orgánu (zejména kostní dřeně) a stanovení hladiny sérové tryptázy. Přirozený klinický průběh onemocnění je variabilní. Většina pacientů s indolentní formou zůstává bez progrese řadu let či desetiletí, zatímco agresivní forma onemocnění trvale progreduje do fatálního zakončení. Klasickou cytoredukční terapií je v současné době onemocnění nevyléčitelné. Díky detekci mutací do léčby pronikly cílově-specifické látky (tyrozin kinázové inhibitory), které mohou navodit kvalitní terapeutické odpovědi. U pacientů s přítomností mediátory podmíněných symptomů je třeba terapeuticky ovlivňovat i tyto.
Klíčová slova:
systémová mastocytóza, klasifikace, c-kit, tryptázaHistorie
Mastocyty byly popsány v roce 1877 Paulem Ehrlichem, německým nositelem Nobelovy ceny za medicínu. Označil tak buňky pojivové tkáně, které se anilinovými barvivy barvily červenofialově a jejichž cytoplazma byla naplněna granuly (1). Název je odvozen z německého slovesa mästen (krmit, vykrmit), neboť mastocyty (Mastzellen) budily dojem „tukem přecpaných buněk“. Klinická, konkrétně kožní, forma mastocytózy byla popsána také ve druhé polovině 19. století, kdy Nettleship a Tay popsali u dvouletého dítěte léze odpovídající urticaria pigmentosa. Tento pojem užil poprvé Sangster v roce 1878 (2). V roce 1933 Tourraine vyslovil domněnku, že se patologicky zmnožené mastocyty mohou akumulovat také ve vnitřních orgánech. Tato domněnka byla makroskopicky i mikroskopicky potvrzena až v roce 1949 Ellisem při pitvě ročního dítěte (3). První „klasifikace“ mastocytóz pochází z roku 1956 (Degos).
Fyziologie
Mastocyty patří mezi hematopoetické elementy a jsou odvozeny přímo z CD 34+ progenitorů (4). Na rozdíl od dřívějších představ je dnes zřejmé, že jde o buněčnou linii odlišnou od bazofilních granulocytů.
Zásadní roli v růstu a diferenciaci lidských mastocytů má interakce mezi cytokinem SCF (stem cell factor) a jeho receptorem KIT, která spouští nitrobuněčné děje vedoucí k proliferaci a k zabránění apoptózy (5). KIT je glykosylovaný protein (145 kDa) a patří mezi tyrozinkinázové receptory. Tento receptor je tvořen 3 doménami: extracelulární, transmembranózní a intracytosolovou. Interakce mezi SCF a KIT způsobí homodimerizaci receptoru (6) následovanou aktivací cesty Ras/MAP a JAK/STAT kináz a fosforylací četných proteinů (7).
Prekurzory mastocytů migrují z kostní dřeně do tkání, kde dochází k jejich maturaci – morfologicky lze odlišit blastickou buňku bez granul s prokazatelnou tryptázou, blastickou buňku s metachromatickými granuly, promastocyt a zralý mastocyt (8). Tento je velký asi 8–20 μm, většinou kulatý nebo oválný s kulatým centrálně uloženým jádrem a bazofilní cytoplazmou naplněnou četnými granuly. Pro morfologický průkaz mastocytu je důležitá metachromázie granul: toluidinovou modří se barví fialově.
Funkčně jsou mastocyty zejména efektorovými buňkami časných alergických reakcí – na svém povrchu nesou vysoce afinní receptory pro IgE protilátky – Fc∈RI. Po jejich aktivaci dochází k uvolnění již preformovaných biologicky aktivních mediátorů či tvorbě dalších – např. histaminu, heparinu, neutrálních proteáz (tryptáza, chymáza), chemokinů (interleukin-8), cytokinů (tumor necrosis factor-α, interferon), lipidových mediátorů či růstových faktorů (SCF, granulocyte-macrophage colony-stimulating factor, vascular endothelial growth factor). Podle převažující tvorby různých typů proteáz lze zralé mastocyty dělit na 3 fenotypy: 1. „MCT“ – tvoří tryptázu a jsou přítomny zejména ve sliznici GIT a bronchů, 2. „MCTC“ – tvoří tryptázu a chymázu a vyskytují se hlavně v podslizničních oblastech GIT a v dermis a 3. „MCC“ tvořící chymázu a cathepsin G (9). V kůži jsou mastocyty preferenčně lokalizované v místech s vyšším rizikem infekce – více jsou zastoupeny v povrchových vrstvách a nejméně v subkutis, jejich zastoupení roste se vzdáleností anatomické lokalizace od středu těla. Funkční charakteristiky mohou vysvětlovat například i méně častou elevaci tryptázy při anafylaxi indukované potravinou – slizniční mastocyty po homingu mají méně tryptázy a patrně je také část produkce uvolněna do lumina gastrointestinálního traktu a nikoliv do systémové cirkulace. Otázkou je rovněž, zda požité alergeny aktivují mastocyty přímo ve stěně trávicího traktu nebo jsou absorbovány a aktivují mastocyty asociované s cévní stěnou (10).
Kromě alergické odpovědi je významný i další komplex funkcí mastocytů: vzhledem k prokázané aktivaci neimunitními podněty (11) se předpokládá jejich uplatnění v přirozené imunitě, účast při vzniku autoimunitních onemocnění jako je roztroušená skleróza, bulózní pemfigoid nebo revmatoidní arthritis (12) a obecně účast ve vzniku periferní tolerance (13). Za fyziologické situace nejsou detekovatelné v periferní krvi. Ke snížení jejich zastoupení může vést například dlouhodobá kortikoterapie nebo imunodeficitní stavy, naopak přechodné zvýšení počtu mastocytů bylo popsáno u reakcí z přecitlivělosti, onemocnění pojiva, parazitárních onemocnění, při urémii, osteoporóze a u některých hematolologických chorob.
Mastocytózy
Patologické zvýšení počtu mastocytů s lokálními a systémovými důsledky je podkladem onemocnění, která se nazývají mastocytózy.
Mastocytózy se dělí na formy postihující výhradně kůži (urticaria pigmentosa, difuzní kožní mastocytóza a solitární kožní mastocytom), které bývají vázány většinou na dětský věk a často spontánně regredují, a na formy systémové, které jsou předmětem dalšího pojednání. Tyto tvoří cca 10 % mastocytóz.
Systémová mastocytóza
Výskyt
Výskyt onemocnění lze hodnotit jako sporadický; celková prevalence je odhadována na 0,00125 až 0,07 % (14), literární údaje na toto téma jsou však dosti chudé. Klinicky podstatné je, že forma mastocytózy, pro kterou jsou dominantní příznaky způsobené pouze účinkem mediátorů – především na cévní systém, se nalézá u osob se systémovou anafylaxí po bodnutí hmyzem v prevalenci okolo 1 % (15).
Patofyziologie
Za nejdůležitější dosud popsaný mechanismus při vzniku SM jsou považovány mutace v genu kit, které KIT aktivují bez přítomnosti substrátu a jsou ve svém důsledku tedy spojeny se zvýšenou proliferací mastocytů. První popsanou (v r. 1995) a nejčastěji prokazovanou somatickou mutací tohoto typu je mutace Asp816Val (D816V) ve fosfotransferázové (intracytosolové) doméně kit. Kromě mononukleárních buněk (16) ji lze detekovat také v T a B lymfocytech, což mimo jiné podporuje představu, že mastocytóza je klonálním onemocněním hematopoetické kmenové buňky. V průběhu času a konkomitantně s progresí onemocnění expanduje postižený klon natolik, že jej lze detekovat i v periferní krvi. Další mutace postihující kodon 816 jsou např. Asp816Phe a Asp816Tyr, popsány jsou též mutace v místech kodujících trans - nebo juxtamembranózní části receptoru (17).
Na maligní transformaci se též podílejí proonkogenní mechanismy postihující jiné signální dráhy – „kit-independentní“. Vídeňští autoři recentně popsali onkogenní dráhu zahrnující tyrozin kinázy Lyn a Bruton‘s (Btk), respektive jejich konstitutivní aktivaci (fosforylaci) v neoplastických mastocytech – včetně těch bez přítomnosti D816V mutace (18).
U více než poloviny nemocných se SM a asociovanou eozinofilií je prokazatelná fúze FIP1L1-PDGFRα, cytogeneticky delece CHIC2 lokusu na 4q12 (19). Tato má synergický účinek se stimulačním efektem SCF via KIT.
U některých pacientů se SM a bazofilií v periferní krvi je detekovatelná fúze PRKG2-PDGFRß, cytogeneticky t(4;5)(q21.1;q31.3), způsobující inhibici apoptózy mastocytů (20).
Na povrchu patologických mastocytů dochází k over-expresi adhezivních molekul – např. CD2 (jiný název LFA-2) a CD58 (přirozený ligand CD2), která vede k tvorbě jejich clusterů a podporuje fibrózu a angiogenezi v okolí (21). Na vzniku fibrózy a nárůstu angiogeneze se také podílejí cytokiny a mediátory, které jsou z mastocytů uvolňovány: tryptáza, basic fibroblast growth factor a vascular endothelial growth factor (22).
Předmětem výzkumu v souvislosti s patogenezí SM jsou také genové polymorfismy – předpokládá se, že různost klinických forem je částečně dána vrozenými genetickými polymorfismy – či význam zvýšené exprese antiapoptotického onkogenu Bcl-2, prokázané v histologických vzorcích nemocných s mastocytózou (23).
Nejčastěji infiltrovanými orgány při SM bývají kostní dřeň, slezina, játra a lymfatické uzliny. V kostní dřeni bývá většinou přítomna fokální infiltrace morfologicky patologickými mastocyty v paratrabekulární lokalizaci, často se současně vyskytují reaktivní lymfoidní či eozinofilní agregáty. Zatímco fyziologické mastocyty jsou kulaté, patologické jsou podlouhlé nebo vřetenovité. Postižené oblasti kostní dřeně bývají v počátku spíše hypercelulární, s postupující nemocí je akcentována fibróza. Mastocytární infiltrace kostní dřeně může být spojena s osteolytickými nebo osteosklerotickými změnami kostních trámců – v roce 2006 byla publikována práce zabývající se vlivem mastocytů na kostní obrat a na základě analýzy literatury z let 1957 – 2004 byly formulovány tyto závěry: zvýšení počtu mastocytů vede k akcentaci kostního obratu s rezultující kostní resorpcí a na tomto jevu se mimo jiné podílí histamin uvolňovaný z mastocytů (24).
V lymfatických uzlinách se infiltráty mastocytů mohou nacházet ve všech oblastech, ve slezině jsou situovány nejčastěji paratrabekulárně. Infiltrace jaterního parenchymu může vést k fibróze až cirhóze či venookluzivní chorobě a při periportální infiltraci k portální hypertenzi a ascitu.
Klinické projevy
Symptomy onemocnění jsou dány jednak orgánovou akumulací mastocytů (oraganomegalie či projevy dysfunkce orgánů - viz tab. 2), jednak uvolněním mediátorů. Toto může být provázeno systémovými příznaky typu flushe či karcinoid-like syndromu. Jedna z recentních prací ukazuje, že anafylaxí jsou při systémové mastocytóze ohroženi především dospělí: 49 % oproti 9 % nemocných v dětském věku (25).
Diagnostická kritéria
V současné době jsou závazná diagnostická kritéria formulovaná v aktuálně platné WHO klasifikaci (26). Zahrnují 1 velké a 4 malá kritéria:
Velké kritérium
- multifokální, denzní infiltráty mastocytů (15 nebo více mastocytů v agregátu) v řezech kostní dřeně a/nebo jiného extrakutánního orgánu, konfirmace imunohistochemicky (tryptáza nebo jiné speciální barvení)
Malá kritéria
- v bioptických řezech kostní dřeně nebo jiných extrakutánních orgánů je více než 25 % mastocytů vřetenovitých či jiné atypické morfologie nebo v nátěru kostní dřeně je více než 25 % zastižených mastocytů nezralých či jinak atypických
- průkaz mutace kit v kodonu 816 v kostní dřeni, krvi nebo jiných extrakutánních orgánech
- mastocyty v kostní dřeni, krvi nebo jiných extrakutánních orgánech koexprimují CD2 a/nebo CD25 spolu s normálními mastocytárními markery
- hladina sérové tryptázy trvale nad 20 ng/ml (tento parametr není validní v případě asociovaného klonálního myeloidního onemocnění)
Diagnóza systémové mastocytózy je stanovena v případě splnění jednoho velkého a jednoho malého kritéria nebo 3 malých kritérií.
WHO klasifikace SM (tab. 1, 2 a 3)
1. WHO klasifikace (2008) myeloproliferativních onemocnění. 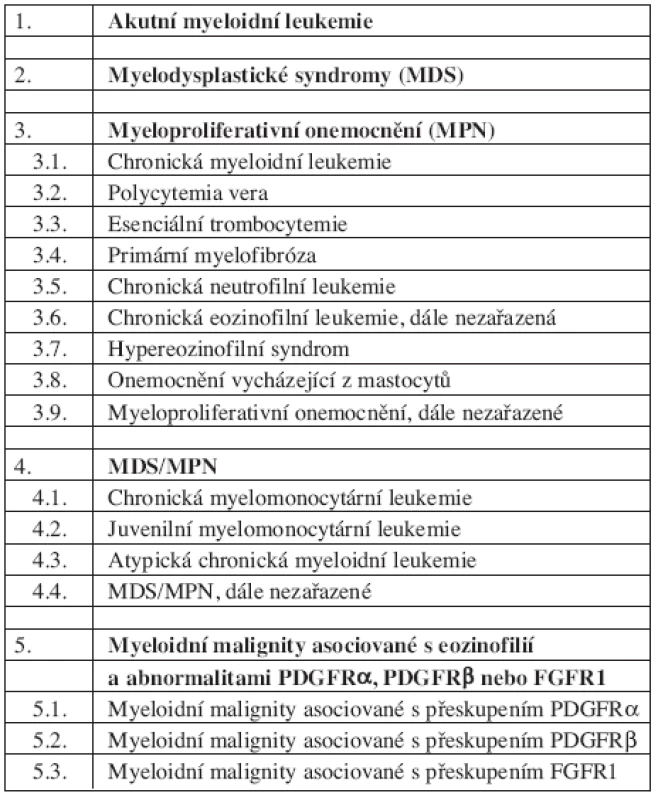
2. Diagnostická kritéria pro jednotlivé varianty systémové mastocytózy. 
WHO klasifikace maligních hematopoetických onemocnění z roku 2008 (26) zařazuje mastocytózy mezi myeloproliferativní onemocnění (v klasifikaci z roku 2001 byla onemocnění z mastocytů samostatnou jednotkou). Případy systémové mastocytózy, u kterých je prokázán fúzní gen s PDGFRα nebo PDGFRβ, jsou však řazeny zvlášť – do skupiny myeloidních neoplazmat asociovaných s uvedenými abnormalitami.
Vyšetřovací program
Při klinickém vyšetření se zaměřujeme na průkaz organomegalie či adenomegalie a kožních lézí charakteru urticaria pigmentosa. Zobrazovací metody používáme také k průkazu kostního postižení – RTG obraz nejčastěji odpovídá osteoporóze či osteolytickým ložiskům.
Histologické vyšetření (nejpřínosnější je vyšetření kostní dřeně) by mělo zachytit infiltraci patologickými mastocyty. K základnímu barvení se doplňují speciální imunochemická vyšetření – např. k průkazu tryptázy nebo CD117.
Důležitým pomocným vyšetřením je imunofenotypizace: fyziologické mastocyty exprimují marker CD203c (NPP3), patologické mastocyty vykazují aberantní koexpresi CD2 a CD25a spolu s výraznější pozitivitou CD11c (27).
Molekulárně genetické vyšetření by mělo v prvé řadě potvrdit nebo vyloučit přítomnost mutace kit D816V (optimální je vyšetření kostní dřeně). Je-li průkaz negativní, je vhodné doplnit vyšetření méně častých mutací kit, při současné eosinofilii nebo v případě onemocnění fenotypově blízkém chronické eozinofilní leukemii pak průkaz fúzního genu FIP1L1-PDGFRα, při bazofilii PRKG2-PDGFRβ.
Cytogenetické vyšetření pomocí FISH je vhodné cílit na chromozomy 4 a 5 (viz výše).
Z biochemických vyšetření je rutinně pro klinickou praxi doporučováno jen stanovení sérové hladiny tryptázy, které má relativně vysokou senzitivitu i specificitu, nicméně její elevace byla prokázána též např. u akutních leukemií, chronické myeloidní leukemie nebo alergických reakcí (28). Stanovení histaminemie, histaminurie či metabolitů prostaglandinu PGD2 je dle literárních údajů zatíženo vysokou falešnou pozitivitou a není doporučováno pro praxi.
Terapie
Léčba systémové mastocytózy by měla být vedena jednak snahou o zmírnění symptomů způsobených mediátory, jednak snahou o dosažení cytoredukce patologických mastocytů. Do dnešního dne není znám léčebný přístup, který by měl kurativní efekt. Indikaci zahájení a typ léčby je proto třeba zvažovat individuálně na základě konkrétních symptomů, jejich intenzity a v kontextu věku či komorbidit daného nemocného.
Léčba symptomů způsobených mediátory
Důležitou zásadou pro pacienty je snížit expozici podnětům, které mohou spouštět degranulaci mastocytů: extrémní tělesná námaha, vysoké či nízké teploty, alkohol, rentgenové kontrastní látky, opioidní analgetika či nesteroidní protizánětlivé léky (asi 5 % osob s mastocytózou má intoleranci acetylsalicylové kyseliny). Lékem první pomoci při závažných akutních projevech je epinefrin – vybaveni by jím měli být zejména ti, kdo již těžké anafylaktické reakce prodělali.
Názor na dlouhodobé terapeutické ovlivnění mediátorových projevů při indolentní mastocytóze není jednotný; doporučení a konsenzy z 90. let se liší od současných. Chronické podávání blokátorů histaminových receptorů H1 je často doporučováno, účinek však není spolehlivě ověřen. Podávání H2 blokátorů doporučují některé současné práce pouze v době klinických projevů, event. v kombinaci s H1 blokátory (29).
Na základě účinku na leukotrienovou dráhu se předpokládá možný pozitivní efekt kompetitivních inhibitorů receptoru pro cysteinyl-leukotrieny (LTD4 je odpovědný především za těžké kardiovaskulární a metabolické projevy). Tato léčiva (zafirlukast, montelukast a pranlukast) jsou často doporučována v kombinaci s antihistaminiky s aditivním efektem, avšak žádná klinická studie toto potvrzující není dosud k dispozici (30, 31). Sodium kromoglykát, léčivo s účinkem na stabilitu buněčných membrán žírných buněk, byl jako jeden z mála testován metodou kontrolované zaslepené studie – jeho účinnost byla ověřena pouze pro GIT projevy, nikoliv na symptomy mimo trávicí trakt (32).
Klasická chemoterapie
Tento typ léčby je indikován v případech mastocelulární leukemie a agresivní systémové mastocytózy; u těchto jednotek existují literární data o podávání různých chemoterapeutických režimů – jejich výčet přesahuje rámec tohoto sdělení. Bez ohledu na zvolený režim jsou však popisovány jen krátké parciální remise.
Interferon alfa
Nejdéle používaným „biologickým“ antiproliferativním lékem u systémové mastocytózy je interferon alfa, u něhož je mimo jiné využíváno působení na zpomalení růstu hematopoetických progenitorů (33). Podávané dávky se dle literatury pohybují kolem 4–5 MU/m2 podkožně 3x týdně, odpovědi je dosahováno u cca 15–20 % pacientů s agresivní formou onemocnění. Z důvodu redukce rizika alergických reakcí jsou v úvodu léčby často asociovány kortikosteroidy. Terapie by měla být dlouhodobá – jednoznačná doporučení v tomto směru však nejsou k dispozici (34, 35).
Cladribin
V posledních letech se objevilo několik prací popisujících velmi dobrý efekt purinového analoga cladribinu, a to v dávce 0,13 mg/kg/den ve 2hodinové infuzi po dobu 5 dní. Většinou bylo podáváno 6 cyklů (36). Vzhledem k malému výskytu choroby jsou v publikovaných souborech pacienti s různými formami onemocnění; i přes tuto nehomogenitu však lze konstatovat, že u většiny nemocných došlo při léčbě cladribinem k rychlé redukci mastocytární infiltrace a aktivace (hodnoceno klinicky i laboratorně), a to často již po podání prvého cyklu. Terapie byla dobře tolerována; většina nežádoucích účinků byla spojena s myelosupresí, z čehož často vyplynula strategie podávání léku v delších intervalech – např. 6 měsíců (37). Přesná podstata příznivého efektu cladribinu není známa – vzhledem ke cladribinem indukované T-lymfopenii se předpokládá pozitivní vliv snížení tvorby interleukinu-3 a interleukinu-4, což jsou cytokiny ovlivňující mimo jiné i proliferaci mastocytů.
Terapie cílově specifickými inhibitory
Imatinib mesylat (Glivec) je kompetitivní inhibitor řady tyrozinových kináz, např. ABL, PDGFR a KIT. Prokázal aktivitu proti neoplastickým mastocytům, které exprimují wild-type kit, je však neúčinný u buněk exprimujících mutantní D816V variantu, což je cca 80 % případů systémové mastocytózy (38). Účinnost byla prokázána také u některých mutací v oblasti kódující transmembránový úsek KIT – např. kodon 522: F522C (39), K509I a zejména je efektivní na mastocyty exprimující onkogen FIP1L1-PDGFRα: zde je imatinib indikován v prvé linii léčby, většinou v dávce 100 mg/den (40). Z tohoto důvodu by všichni pacienti s diagnostikovanou systémovou mastocytózou bez mutace D816V v kit měli být vyšetřeni molekulárně biologicky na přítomnost uvedeného fúzního genu.
Dasatinib (Sprycel) je potentní kinázový inhibitor – in vitro je 325x účinnější nežli imatinib v blokádě BCR-ABL, zároveň má výraznou inhibiční aktivitu proti wild-type kit, D816V mutantám, PDGFRß i tyrozinovým kinázám Lyn/Btk (41, 42). V roce 2008 byly publikovány 2 práce popisující klinické užití dasatinibu u pacientů se systémovou mastocytózou: Purtill et al. publikovali soubor 4 pacientů (2x agresivní SM, 1x indolentní SM, 1x SM s asociovaným klonálním hematologickým onemocněním jiné nežli mastocelulární linie), u kterých byl dasatinib použit s parciálním efektem (43), Verstovsek et al. soubor 33 pacientů (9x ASM, 18x ISM, 6x SM-AHNMD), ve kterém dosáhlo odpovědi 33 % léčených. Jednalo se o 2 kompletní odpovědi a 9 symptomatických zlepšení – jejich trvání však bylo pouze přechodné (44).Dasatinib se na základě uvedených i jiných literárních zpráv jeví jako přínosný a dobře tolerovatelný u nemocných se SM s mutací D816V v kit, nicméně nevede k eliminaci onemocnění, většinou jen k redukci symptomů.
N-benzoylstaurosporin (PKC412, midostaurin) je účinný inhibitor protein - kinázyC, PDGFRα, FLT3 a KIT, který je u SM klinicky testován, stejně jako řada dalších inhibitorů tyrozinových kináz (45).
Dalším terapeutickým směrem je snaha o vývoj anti-CD25 protilátky. Rekombinantní imunotoxin (anti-CD25 + pseudomonádový exotoxin A) prokázal in vitro účinnost na redukci mastocytů. Stejný efekt prokázal i denileukin diftitox (Ontak), což je geneticky vyrobený fúzní protein kombinující sekvenci interleukinu-2 (IL-2) a enzymaticky aktivní oblast difterického toxinu. Po vazbě na IL-2 receptor je internalizován endocytózou a proteolyticky rozštěpen, čímž dojde k uvolnění difterického toxinu, který je následně translokován do cytosolu, kde inhibuje syntézu proteinů (46). V současné době probíhají studie fáze II u pacientů se systémovou mastocytózou.
Systémová kortikoterapie
Glukokortikoidy mají negativní vliv na růst mastocytů jednak přímým inhibičním efektem, jednak tím, že potlačují růst buněk produkujících v tkáních SCF. V monoterapii se však u SM nepoužívají – pro nedostatečný cytoreduktivní účinek a závažné nežádoucí účinky (např. osteoporózu). Indikovány jsou dle některých literárních údajů v kombinaci s cytoreduktivními látkami – zejména v počátku léčby, kdy se předpokládá jejich příznivý efekt při lýze patologických mastocytů. V literatuře lze také najít práce popisující význam glukokortikoidů při ovlivnění malabsorpce a ascitu u agresivních forem SM. Podávaná dávka se u dospělých pohybuje mezi 40 až 60 mg prednisolonu denně a většinou vyústí v redukci symptomů v průběhu 3–4 týdnů. Dávka může být následně snížena na poloviční, např. ve schématu užívání ob den (47).
Transplantace hematopoetických kmenových buněk nebo kostní dřeně
Je nestandardní terapie vyhrazená pro pacienty s pokročilými a potenciálně fatálními formami SM-AHNMD, agresivní mastocytózy a mastocelulární leukemie. Literární údaje o transplantacích v myeloablativním či nemyeloablativním vysoce imunosupresivním režimu (např. fludarabin + cyklofosfamid) jsou sporadické a popisované výsledky rozporuplné (48, 49).
Léčba osteopenie
K terapii osteoporózy spojené s onemocněním lze využít bifosfonáty, kalcium a vitamin D v dávkách běžně užívaných v revmatologii. V roce 2007 byla popsána léčba 4 nemocných asociací interferonu alfa v dávce 3 MU 3x týdně a pamidronátu v dávce 90 mg intravenózně 1x měsíčně. Po dvouletém podávání došlo k signifikantnímu zvýšení kostní denzity a tento příznivý efekt byl zachován resp. podpořen udržovací terapií pamidronátem ve výše uvedené dávce (50).
Závěr
Závěrem lze shrnout, že cytoreduktivní léčba je indikovaná u pacientů s ASM a vybraných nemocných s indolentní formou onemocnění s cílem snížení nálože patologických mastocytů a zlepšení kvality života. V tomto směru jsou přínosné interferon alfa a cladribin. Cílově specifické inhibitory jsou novou terapeutickou možností, nicméně mají také své limitace – např. rezistence KIT-D816V mutanty vůči imatinibu či pouze krátkodobé přetrvávání dosažených odpovědí. Je-li prokázána fúze FIP1L1-PDGFRα, je nemocný jednoznačně indikován k léčbě imatinibem, většinou s výborným efektem.
Léčbu je vždy třeba volit individuálně, samozřejmě v kombinaci s terapií „anti-mediátorovou“. Souběžně se zaváděním nových cílených léků do klinické praxe lze předpokládat „multiple drug approach“. Vzhledem k malé incidenci onemocnění je vhodné podporovat zařazování nemocných do klinických studií.
Hodnocení terapeutické odpovědi
Odpověď na léky, které ovlivňují příznaky spojené s uvolňováním mediátorů, je většinou možno hodnotit pouze na základě pacientova subjektivního vnímání, a je tedy obtížně kvantifikovatelná. Stejný přístup, tedy „deskriptivní“, je akceptován také při posuzování odpovědi na léčbu u indolentní formy. Pouze u agresivních forem existují obecně přijaté definice léčebných odpovědí, které byly publikované Valentem v r. 2003 (47) – (tab. 4). Jejich součástí však bohužel není posouzení trvání dosažené odpovědi. Při použití uvedených kritérií lze např. podáním interferonu alfa a kortikosteroidů docílit ve 20 % velké odpovědi.
4. Kritéria odpovědi na terapii u agresivní systémové mastocytózy. 
Závěr
Mastocytóza je pojem užívaný pro označení heterogenní skupiny chorob, jejichž příznaky vyplývají z akumulace patologických mastocytů. V současné době jsou obecně přijímána WHO definovaná diagnostická kritéria a klasifikace. V posledních letech se objevila řada nových poznatků týkajících se specifických patofyziologických dějů. Některé genové alterace se tak mohou stát terapeutickými cíli a lze předpokládat zlepšení léčebných možností této dosud špatně ovlivnitelné choroby.
Zpracování textu bylo podpořeno Výzkumným záměrem
MŠMT 0021620812
Poděkování doc. MUDr. Tomáši Kozákovi, Ph.D. za možnost podílet se na péči o nemocné se systémovou mastocytózou.
MUDr. Ludmila Nováková
Ústav hematologie a krevní transfúze
U nemocnice 1
128 20 Praha 2
e-mail: ludmila.novakova@uhkt.cz
Do redakce doručeno: 7. října 2008
Přijato do tisku: 4. prosince 2008
Sources
1. Ehrlich P. Beiträge zur Theorie and Praxis der histologischen Färbung (Ph.D thesis), Leipzig, Germany: University of Leipzig; 1878.
2. Sangster A. An anomalous mottled rash, accompanied by pruritis, factious urticaria and pigmentation, „urticaria pigmentosa (?)“. Trans Clin Soc London 1878; 11 : 161.
3. Ellis JM. Urticaria Pigmentosa: a report of a case with autopsy. Arch Pathol 1949; 48 : 426.
4. Kirshenbaum AS, Kessler SW, Goff JP, Metcalfe DD. Demonstration of the origin of human mast cells from CD 34+ bone marrow progenitor cells. J Immunol 1991; 146 : 1410–1415.
5. Ashman LK. The biology of stem cell factor and its receptor c-kit. Int J Biochem Cell Biol 1999; 31 : 1037–51.
6. Blechman JM, Lev S, Givol D, Yarden Y. Structure-function analyse of the kit receptor for the stem cell factor. Stem Cells 1993; 11 (Suppl. 2): 12–21.
7. Denvery C, Mou S, Linnekin D. Stat1 associates with c-kit and is activated in response to stem cell factor. Biochem J 1997; 327 : 73–80.
8. Sperr WR, Escribano L, Jordan J, et al. Morphologic properties of neoplastic mast cells: delineation of stages of maturation and implication for cytological grading of mastocytosis. Leukemia Res 2001; 25 : 529–536.
9. Galli SJ. New insights into „the riddle of the mast cells“: microenvironmental regulation of mast cell development and phenotypic heterogeneity. Lab Invest 1990; 62 : 5–33.
10. Maurer M, Metz M. The status quo and quo vadis of mast cells. Experimental Dermatology 2005; 14 : 923–929.
11. Feger F, Varadaradjalou S, Gao Z, Abraham SN, Arock M. The role of mast cells in host defense and their subversion by bacterial pathogens. Trends Immunol 2002; 23 : 151–158.
12. Gregody GD, Brown MA. Mast cells in allergy and autoimmunity, implication for adaptive imunity. Methods Mol Biol, 2006; 315 : 35–50.
13. Lu LF. Mast cells are essential intermediaries in regulatory T cell tolerance. Nature 2006; 442 : 997–1002.
14. Soter NA. Mastocytosis and skin. Hematol Oncol North Am 2000; 14 : 307–310.
15. Dubois A. Mastocytosis and hymenoptera allergy. Curr Op Allergy Clin Imunology 2004; 4 : 291–295.
16. Nagata H, Worobec AS, et al. Identification of point mutation in the catalytic domain of the proto-oncogene c-kit in the peripheral blood mononuclear cells of patients with mastocytosis. PNAS 1995; 92 : 10560.
17. Longley BJ, Metcalfe DD, Tharp M, et al: Activating and dominant inactivating c-kit catalytic domain mutations in distinct clinical forms of human mastocytosis. PNAS 1999; 96 : 1609.
18. Gleixner KV, Mayerhofer M, Rix U, et al. A kit-independent oncogenic pathway in neoplastic mast cells that involves Btk and is disrupted by the KIT/BTK targeting drug dasatinib. Haematologica 2008; 93(s1): 374.
19. Pardanani A, Ketterling RP, Brockman SR, et al. CHIC2 deletion, a surrogate for FIP1L1-PDGFRA fusion, occurs in systemic mastocytosis associated with eosinophilia and predicts response to imatinib mesylate therapy. Blood 2003; 102 : 3093–3096.
20. Walz C, Metzgeroth G, Haferlach C, et al. Characterization of three new imatinib-responsive fusion genes in chronic myeloproliferative disorders generated by disruption of the platelet-derived growth factor receptor beta gene. Haematologica 2007; 92 : 163–169.
21. Escribano L, Diaz-Augustin B, Bellas C, et al. Utility of flow cytometric analysis of mast cells in the diagnosis and classification of adult mastocytosis. Leukemia Res 2001; 25 : 563–570.
22. Li CY, Baek JY: Mastocytosis and fibrosis: role of cytokines. Int Arch Allergy 2002;127 : 123–126.
23. Cervero C, Escribano L, San Miguel JF, et al. Expression of Bcl-2 by human mast cells and its overespression in mast cell leukemia. Am J Hematol 1999; 60 : 191–195.
24. Chiappetta N, Gruber B. The role of mast cells in osteoporosis. Semin Arthritis Rheum 2006; 36 : 32–36
25. Brockow K, Jofer C, Behrendt H, Ring J. Anaphylaxis in patients with mastocytosis: a study of history, clinical features and risk factors in 120 patients. Allergy 2008; 63 : 226–232.
26. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA. WHO classification of tumours of haematopoietic and lymphoid tissue. IARC Press, Lyon, 2008.
27. Horny HP, Valent P: Histopathological and immunocytochemical aspects of mastocytosis. Int Arch Allergy Immunol 2002; 127 : 115–117.
28. Sperr WR, Jordan JH, Fiegl M, et al. Serum tryptase levels in patiens with mastocytosis: correlation with mast cell burden and implication for defining the category of disease. Int Arch Allergy Immunol 2002; 128 : 136–141.
29. Castells M, Escribano L, Akin C, Schwartz LB. Current options in the treatment of mast cell mediator-related symptoms in mastocytosis. Inflamm Allergy Drug Targets 2006; 5 : 61–77.
30. Kurosawa M, Amano H, Kanbe N, et al. Heterogeneity of mast cells in mastocytosis and inhibitory effect of ketotifen and ranitidine on indolent systemic mastocytosis. J Allergy Clin Immunol 1997; 100 (6 Pt2): 25–32.
31. Riccioni G, Bucciarelli T, Mancini B, Di Ilio C, D‘ Orazio N. Antileukotriene drugs: Clinical application, effectiveness and safety. Curr Med Chem 2007; 14 : 1966–1977.
32. Horan RF, Sheffer AL, Austen KF. Cromolyn sodium in the management of systemic mastocytosis. J Allergy Clin Immunol 1990; 85 : 852–855.
33. Worobec AS, Kirshenbaum AS, Schwarz LB, Metcalfe DD. Treatment of three patients with systemic mastocytosis with interferon alpha-2b. Leukemia Lymphoma 1996; 22 : 501–508.
34. Hauswirth AW, Simonitsch-Klupp I, Uffmann M, et al. Response to therapy with interferon alpha-2b and prednisolone in aggressive systemic mastocytosis: report of five cases and review of the literature. Leukemia Res 2004; 28 : 249–257.
35. Casassus P, Caillat-Vigneron N, Martin, A. et al: Treatment of adult systemic mastocytosis with interferon-alpha: results of a multicentre phase II trial on 20 patiens. Br J Haematol 2002; 119 : 1090–1097.
36. Hanneke C, Kluin-Nelemans HJC, et al. Cladribine therapy for systemic mastocytosis. Blood 2003; 102 : 4270–4276.
37. Tefferi A, Chin-Yang L, Butterfield JH, Hoagland HC. Treatment of systemic mast cell disease with cladribine. New Engl J Med 2000; 344 : 307.
38. Droogendijk H, Kluin-Nelemans HJC, van Doormaal JJ, et al. Imatinib Mesylate in the Treatment of Systemic Mastocytosis. Cancer 2006; 107 : 345–351.
39. Akin C, Fumo G, Yavuz AS, et al. A novel form of mastocytosis associated with a transmembrane c-kit mutation and response to imatinib. Blood 2004; 103 : 3222–3225.
40. Droogendijk H, Kluin-Nelemans HJC, van Daele P. Imatinib mesylate in the treatment of systemic mastocytosis, a phase I/II trial. Blood 2004; 104: Abstract 1516.
41. Schittenhelm MM, Shiraga S, Schroeder A, et al. Dasatinib, a dual SRC/ABL kinase inhibitor, inhibits the kinase activity of wild-type, juxtamembrane, and activation loop mutant KIT isoforms associated with human malignancies. Cancer Res 2006; 66 : 473–481.
42. Shah NP, Lee FY, Luo R, Jiang Y, Donker M, Akin C. Dasatinib inhibits KIT D816V imatinib resistant activating mutation that triggers neoplastic growth in most patients with systemic mastocytosis. Blood 2006; 108 : 286–291.
43. Purtill D, Cooney J, Sinniah R, et al. Dasatinib therapy for systemic mastocytosis: four cases. Eur J Hemat 2008; 80 : 456–458.
44. Verstovsek S, Tefferi A, Cortes J, et al. Phase II study of dasatinib in Philadelphia chromosome-negative acute and chronic myeloid diseases, including systemic mastocytosis: Clin Cancer Res 2008; 14 : 3906–3915.
45. Jensen BM, Akin C, Gilfillan AM. Pharmacological targeting of the KIT growth factor receptor: a therapeutic consideration for mast cell disorders. Br J Pharmacol 2008; online publication 26 May 2008.
46. Foss F. DAB(389)IL-2 (denileukin diftitox, ONTAK): a new fusion protein technology. Clin Lymphoma. 2000; 1(Suppl. 21): 27–31.
47. Valent P, Akin C, Sperr WR, et al. Aggressive systemic mastocytosis and related mast cell disorders: current treatment options and proposed response criteria. Leukemia Res 2003; 27 : 635–641.
48. Spyridonidis A, Thomas AK, Bertz H, et al. Evidence for a graft-versus-mast-cell effect after allogeneic bone marrow transplantation. Bone Marrow Transplant 2004; 34 : 515–519.
49. Nakamura R, Chakrabarti S, Akin C, et al. A pilot study of nonmyeloablative allogeneic hematopoietic stem cell transplant for advanced systemic mastocytosis: Bone Marrow Transplant 2006; 37 : 353–358.
50. Laroche M, Bret J, Brouchet A, Mazieres B. Clinical and densitometric efficacy of the association of interferon alpha and pamidronate in the treatment of osteoporosis in patients with systemic mastocytosis. Clin Rheumatol 2007; 26 : 242–243.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 1-
All articles in this issue
- Expression of the hTERT gene in patients with B-cell chronic lymphocytic leukemia
- Oral mucositis in patients after allogeneic stem cells transplantation with fludarabine and melphalan containing FLU/MEL conditioning regimen
- Level of expression of target antigens CD20 and CD52 in relation to the therapy with monoclonal antibodies in patients with chronic lymphocytic leukemia
- Idiopathic thrombocytopenic purpura – pathogenesis, modern therapy, and an analysis of its prevalence, diagnostics and therapy in the South Moravian Region
- Systemic mastocytosis
- Guidelines for the treatment of invasive candidiasis
- Guidelines for the treatment of invasive aspergillosis
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Systemic mastocytosis
- Idiopathic thrombocytopenic purpura – pathogenesis, modern therapy, and an analysis of its prevalence, diagnostics and therapy in the South Moravian Region
- Guidelines for the treatment of invasive aspergillosis
- Guidelines for the treatment of invasive candidiasis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


