-
Medical journals
- Career
Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
Authors: M. Zemanová 1; V. Ščudla 1; L. Pour 2; E. Gregora 3; P. Pavlíček 3; J. Minařík 1; T. Pika 1; J. Bačovský 1; Z. Adam 2; R. Hájek 2
Authors‘ workplace: pro Českou myelomovou skupinu ; III. interní klinika LF UP a FN Olomouc, 2Interní hematoonkologická klinika FN Brno- Bohunice a LF MU v Brně, 3Odd. klinické hematologie FNKV Praha 1
Published in: Transfuze Hematol. dnes,13, 2007, No. 3, p. 126-132.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
V terapii mnohočetného myelomu se vedle konvenční chemoterapie dostávají v současné době do popředí nové preparáty, z nichž nejširšího použití doznal thalidomid. Velmi dobré výsledky přinesla kombinace nízce dávkovaného thalidomidu s cyklofosfamidem a dexametazonem. Cílem předložené práce bylo ověření účinnosti a posouzení toxicity jednak režimu „CTD-junior“ pro nemocné do 65 let, vyznačující se jednorázovou nitrožilní aplikací cyklofosfamidu v dávce 800 mg 1. den v intervalu 21 dní, thalidomidu 200 mg denně a perorálního podání dexametazonu v dávce 40 mg vždy 1.–4. a 12.–15. den cyklu, jednak režimu „CTD-senior“, určeného pro nemocné nad 65 let, s kontinuálním podáváním perorálního cyklofosfamidu v dávce 50 mg denně, thalidomidu 100 mg denně a perorální formy dexametazonu v dávce 20 mg ve dnech 1–4 a 15–18 v rámci 28denního cyklu. Z celkového souboru 97 nemocných s pokročilou formou mnohočetného myelomu či s projevy rezistence ke konvenční léčbě bylo vyhodnoceno 85 nemocných. Objektivní léčebná odpověď byla dosažena u 68 (80 %) nemocných, z toho kompletní remise byla zaznamenána u 7 nemocných (8 %), parciální remise u 42 nemocných (50 %) a minimální odezva u 19 nemocných (22 %). Stabilizace choroby byla pozorována u 10 pacientů (12 %), zatímco u 7 nemocných (8 %) choroba nadále progredovala. Ukázalo se, že toxicita obou režimů byla poměrně nízká a snadno ovlivnitelná, přičemž nejčastěji se vyskytovala celková slabost, obstipace, neuropatie dolních končetin, porucha glykoregulace a mírná leukopenie. Ze studie vyplývá, že použití thalidomidu jako součásti obou hodnocených režimů významně rozšiřuje současné léčebné možnosti u nemocných rezistentních ke konvenční chemoterapii a v běžné hematologické praxi jsou oba hodnocené režimy velmi dobře použitelné.
Klíčová slova:
mnohočetný myelom, léčebná rezistence, thalidomid, cyklofosfamid, dexametazonÚvod
Mnohočetný myelom (MM) patří dosud mezi nevyléčitelná onemocnění. Díky novým léčebným přístupům je však možno dosáhnout nejen zlepšení léčebné odpovědi a kvality života, ale i významného prodloužení života nemocných. Mezi nové, v současnosti již ověřené preparáty použitelné v léčbě MM patří v poslední době i thalidomid, jehož původní indikací v 50. letech minulého století bylo zejména tlumení ranních nevolností těhotných žen. Pro své negativní vedlejší účinky – malformace plodu – byl však záhy stažen z trhu. Mechanismus jeho účinku není doposud zcela objasněn, kromě antiangiogenního působení má i účinky imunomodulační a je schopen rovněž indukovat apoptózu nádorových buněk (1). V terapii MM byl využíván zprvu v monoterapii, stále častěji ale v kombinaci s dalšími léky, nejčastěji s dexametazonem, nověji i s různými chemoterapeutiky (2).
Kombinaci thalidomidu s perorálním cyklofosfamidem a dexametazonem poprvé zveřejnili v roce 2002 španělští autoři (3); ve skupině 22 nemocných s relabující či refrakterní formou MM dosáhli u 76 % nemocných objektivní terapeutické odpovědi. V následujících letech byl jejich soubor rozšířen (4, 5) a objevilo se i několik dalších, podobně koncipovaných sdělení s obdobně příznivými výsledky (6–15). Jednotlivá doporučení se však rozcházela v dávkování podávaných léků, zejména thalidomidu a cyklofosfamidu. Ukázalo se, že vyšší dávky thalidomidu byly často provázeny vyšším výskytem nežádoucích účinků, zejména závažné neuropatie dolních končetin, vyšší dávky cyklofosfamidu byly častou příčinou neutropenie a závažných infekcí. V podmínkách ČR se navíc zprvu uplatňovala i problematická dostupnost thalidomidu, proto bylo třeba najít takový režim, který by umožnil použití nižší dávky thalidomidu při zachování dobré terapeutické účinnosti. Na podkladě příznivých zkušeností autorského pracoviště sestavila Česká myelomová skupina (CMG) dva léčebné režimy, a to „CTD-junior“ pro nemocné do 65 let a „CTD-senior“ pro pacienty starší 65 let. Náplní předloženého sdělení je rozbor terapeutické účinnosti a stupně toxicity obou režimů v souboru 97 nemocných s relabující či refrakterní formou mnohočetného myelomu a zhodnocení možnosti jejich využití v běžné hematologické praxi.
Soubor nemocných a metodika
V době od ledna 2004 do června 2006 bylo v ČR pomocí režimu CTD léčeno celkem 97 pacientů s mnohočetným myelomem, splňujících SWOG diagnostická kritéria. Poměr mužů a žen byl 1 : 1 (49 : 48), věkový průměr činil 62,4 let (38–82). Imunochemický typ IgG se v souboru vyskytoval nejčastěji, a to celkem u 63 nemocných, typ IgA u 23 nemocných, ve 3 případech byl zachycen paraprotein třídy IgD, u 5 nemocných byly v séru přítomny pouze volné lehké řetězce imunoglobulinů a 3 nemocní trpěli zcela nesekreční formou MM. Poměr výskytu lehkých řetězců kappa a lambda byl 69 : 25. Dle stážovacího systému dle Durieho-Salmona bylo nejvíce zastoupeno klinické stadium IIIA (47 pacientů) a stadium IIA (31 pacientů), pouze 3 nemocní byli léčeni v klinickém stadiu IA. Stadium IIB bylo zjištěno rovněž pouze u 3 nemocných, zatímco stadium IIIB u 13 pacientů.
Léčba byla podávána ve třech koordinačních centrech ČR, a to na III. interní klinice FN Olomouc (62 nemocných), Interní hematoonkologické klinice FN Brno-Bohunice (27 nemocných) a Oddělení klinické hematologie FNKV Praha (8 nemocných). Většina pacientů (74, tj. 76 %) byla léčena pro relaps či progresi MM, u 23 (tj. 24 %) nemocných se jednalo o onemocnění primárně rezistentní k předchozí podávané chemoterapii. Režim CTD byl zvolen nejčastěji jako léčba 3. linie (2.–7. linie), léčba byla zahájena průměrně 34 měsíců (3–204 měsíců) od stanovení diagnózy MM. Celkem 35 nemocných v minulosti prodělalo vysokodávkovanou chemoterapii s autologní transplantací periferních kmenových buněk, ostatní byli léčeni režimy VAD (vincristin, adriablastin, dexametazon), CyVAD (cyklofosfamid +VAD), MP (melfalan, prednison), VBMCP (vincristin, BCNU či CCNU, melfalan, cyklofosfamid, prednison), CIDEX (CCNU, idarubicin, dexametazon), deset nemocných mělo rovněž předchozí zkušenosti s léčbou samotným thalidomidem.
Pro nemocné do věku 65 let byl zvolen režim „CTD-junior“, pro nemocné nad 65 let režim „CTD-senior“. Režim „CTD-junior“ byl podán celkem 37 pacientům (38 %), režim „CTD-senior“ byl aplikován 60 nemocným (62 %). Schéma režimu „CTD-junior“: thalidomid 200 mg p.o. denně ve večerních hodinách, cyklofosfamid 800 mg i.v. 1. den, dexametazon 40 mg p.o. 1.–4. a 12.–15. den cyklu, cyklus se opakoval po 21 dnech. Schéma perorálního režimu „CTD-senior“: thalidomid 100 mg, event. 50 mg denně ve večerních hodinách, cyklofosfamid 50 mg denně, dexametazon 20 mg 1.–4. a 15.–18. den, cyklus se opakoval po 28 dnech. Snížení uvedených dávek bylo prováděno jednotlivě s ohledem na individuální toleranci a případný výskyt vedlejších účinků léčby. Jako profylaxe trombembolické choroby byl po celou dobu terapie režimem CTD u většiny nemocných (63/97) podáván nízkomolekulární heparin (enoxaparin, fraxiparin) v dávce 0,4 ml s.c. 1x denně. Podávání dexametazonu bylo navíc zajištěno standardní profylaxí omeprazolem 20 mg 2x denně p.o., perorální suplementací draslíku a kontrolou stavu glykoregulace.
Thalidomid byl zpočátku poskytován firmou Grünenthal, posléze byl získáván díky mimořádnému dovozu preparátu Myrin (fy Lipomed) na podkladě výjimky SÚKL a schválení revizního lékaře zdravotní pojišťovny vždy individuálně pro konkrétního pacienta. Všichni nemocní byli informováni o použití neregistrovaného léčiva v rámci ČR a byli podrobně seznámeni s jeho možnými nežádoucími účinky, což stvrdili před zahájením léčby podpisem informovaného souhlasu s podáním thalidomidu.
Léčba byla podávána tak dlouho, dokud přetrvával pokles M-proteinu a dokud nemocný léčbu dobře toleroval. U 7 nemocných byly podány 4 cykly režimu „CTD-junior“ jako přípravného režimu před autologní transplantací periferních kmenových buněk s následnou udržovací terapií samotným thalidomidem.
Léčebná odpověď byla hodnocena dle kritérií EBMT (16), tj. zejména dle hodnot monoklonálního imunoglobulinu (MIG) séra nebo moči. Ve vybraných případech u nemocných s nízkosekreční formou MM bylo využito hodnocení dle pohybu volných lehkých řetězců séra (17, 18), u nesekrečních forem MM bylo při hodnocení léčebné odpovědi vycházeno i z míry poklesu zastoupení plazmatických buněk v kostní dřeni.
Výsledky
Z celkového počtu 97 nemocných nebylo možné vyhodnocení léčebné odpovědi u 8 nemocných s nesekreční formou MM a u dalších 4 nemocných s velmi krátkým odstupem od zahájení léčby s podáním pouze 1–2 cyklů chemoterapie CTD. U zbylých 85 nemocných bylo dosaženo objektivní léčebné odpovědi (tj. kompletní, parciální a minimální remise) u 68 nemocných (80 %), z toho kompletní remise (CR) s úplným vymizením monoklonálního imunoglobulinu ze séra potvrzeným negativitou imunofixace byla zaznamenána u jednoho nemocného (1 %), zatímco neměřitelná hodnota MIG s pozitivním nebo neznámým výsledkem imunofixačního vyšetření (nCR) byla zachycena u šesti nemocných (7 %). Parciální remise (PR), tj. pokles MIG o více než 50 % počáteční hodnoty, byla dosažena u 42 nemocných (50 %) a minimální remise, tj. pokles MIG o 25–50 %, u 19 nemocných (22 %). Stabilizace choroby (SD), tj. změny v hodnotách MIG menší než 25 %, bylo dosaženo u 10 pacientů (12 %) a 7 nemocných (8 %) progredovalo i přes podávanou terapii. U 7 pacientů byla zaznamenána progrese choroby po předchozí příznivé terapeutické odpovědi, a to u jednoho nemocného ve 28. měsíci léčby po 1 roce trvání kompletní remise, při níž pokračovala udržovací terapie režimem „CTD-senior“, u dalších 6 nemocných došlo k progresi choroby ve 3.–6. měsíci léčby CTD, a to u 4 nemocných po dosažení parciální remise, u jednoho po dosažení odpovědi typu MR a v jednom případě po přechodné stabilizaci choroby (SD). Je zajímavé, že v průběhu léčby byla u 6 pacientů zachycena extramedulární progrese onemocnění, a to u 3 nemocných i přes významný pokles paraproteinu séra pod 50 %, zatímco u jednoho nemocného byla hodnota MIG trvale stabilní, u dalšího se hodnota MIG séra postupně zvyšovala a u jednoho nemocného se jednalo o nesekreční formu MM. Ložiska plazmocytomu byla zachycena ve 4 případech na skeletu lbi, přičemž u jedné nemocné byla zachycena i plazmocelulární infiltrace mozkomíšních plen, u jedné nemocné byla extramedulární progrese v oblasti paže a u další v oblasti přední strany krku a hrudní stěny.
Mezi nemocnými s režimem „CTD-junior“ a „CTD-senior“ nebyl zachycen významný rozdíl v dosažení léčebné odpovědi typu CR a PR (7 % a 52 % versus 7 % a 48 %), pouze ve skupině nemocných s režimem „CTD-junior“ bylo dosaženo poněkud častěji odpovědi typu MR, nežli ve skupině „CTD-senior“ (30 % vs. 18 %), naopak stabilizace choroby byla častější ve skupině „CTD-senior“ (16 % vs. 4 %) (tab. 1).
Table 1. Výsledky léčby režimy „CTD-junior“ a „CTD-senior. 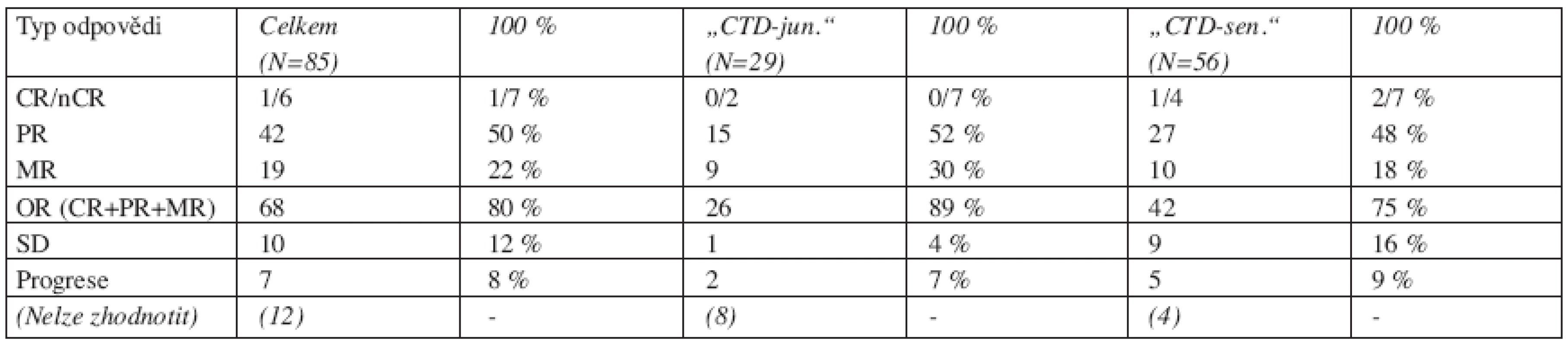
CR = kompletní remise s negativní imunofixací, nCR = nulová hodnota M-proteinu (MIG), ale pozitivní nebo neznámý výsledek imunofixace, PR= parciální remise (pokles MIG pod 50 % vstupní hodnoty), MR = minimální remise (pokles MIG o 25–50 % vstupní hodnoty), SD = stabilizace choroby (změna hodnoty MIG, resp. pokles či vzestup o méně než 25 % vstupní hodnoty), OR = objektivní remise (jakákoliv léčebná odpověď s poklesem MIG alespoň o 25 % vstupní hodnoty) Léčba byla podávána při dobré individuální toleranci po celou dobu poklesu M-proteinu séra, v průměru bylo podáno u jednoho nemocného 5 cyklů CTD (1–28 cyklů), přičemž více než 4 cykly byly podány 70 nemocným (72%). Pouhé 4 cykly režimu „CTD-junior“ byly podány v rámci reindukční terapie před druhou autologní transplantací periferních kmenových buněk celkem 7 nemocným, z nichž 6 pacientů mělo připraveny periferní kmenové buňky po předchozí autologní transplantaci a u jednoho nemocného proběhl úspěšný sběr kmenových krvetvorných buněk po vysokodávkovaném cyklofosfamidu (HD-CFA). U jedné nemocné s nově zjištěným MM, primárně rezistentním k indukčnímu režimu VAD, bylo podáno celkem 7 cyklů „CTD-junior“ a rovněž následovalo podání HD-CFA s úspěšným sběrem periferních kmenových buněk v dostatečném množství k autologní transplantaci. V současné době pokračuje v terapii režimem CTD celkem 39 nemocných, předčasné ukončení léčby bylo nutné u 12 pacientů pro nežádoucí účinky, u 14 pacientů byla léčba změněna za jiný režim z důvodu progrese či neuspokojivé léčebné odpovědi. Během terapie režimem CTD zemřelo celkem 11 nemocných, přičemž příčinou úmrtí byla u 4 progrese základního onemocnění MM, zatímco v případě dalších 7 nemocných byla vyjádřena výrazná polymorbidita s nepříznivým ovlivněním celkového stavu, nicméně i u těchto nemocných bylo dosaženo léčebné odezvy s významným poklesem MIG séra. Jedenáct úmrtí bylo zaznamenáno v odstupu 2–7 měsíců po ukončení terapie CTD, a to většinou v souvislosti s progresí základního onemocnění.
Přehled nežádoucích účinků léčby shrnuje tabulka 2. V souvislosti s aplikací thalidomidu se nejčastěji vyskytovala neuropatie dolních končetin (DKK), a to u 49 nemocných (50 %) – u 27 z nich však existovala mírná či středně těžká neuropatie DKK ještě před započetím léčby režimem CTD, přičemž pouze u 10 pacientů došlo k jejímu zhoršení, a to maximálně o 1 stupeň. Nově vzniklá či progredující neuropatie DKK tedy byla zachycena u 32 (33 %) pacientů. U 29 nemocných (30 %) se vyskytla mírná zácpa, u 26 nemocných (27 %) celková slabost a zvýšená ospalost, u 9 (9 %) suchost kůže a u 2 pacientů (2 %) závažný toxoalergický exantém. U pěti nemocných, z nichž pouze dva jedinci měli zajištěnou profylaxi nízkomolekulárním heparinem (LMWH), byla zaznamenána hluboká žilní trombóza a u jednoho sukcesivní plicní embolie. V souvislosti s užíváním vysokodávkovaného dexametazonu byla nejčastěji zaznamenána porucha glykoregulace či dekompenzace již existujícího diabetu u 6 nemocných (6 %), která u jedné nemocného vyústila v hyperglykemické koma. Psychické změny, zejména porucha soustředění či zvýšená nervozita, byly zaznamenány u 11 nemocných (11 %), u tří z nich bylo nutné zaměnit dexametazon za lépe tolerovaný prednison. Méně často se vyskytly některé další vedlejší účinky léčby, jako třes u 8, retence tekutin u 7, tinnitus u 5, porucha vidění u 3, alopecie u 2 a detrakční syndrom po vysazení dexametazonu u 2 nemocných. Nevolnost či nechutenství pozorovalo celkem 6 pacientů, renální insuficience se během léčby vyvinula u 2 nemocných, a to v souvislosti s progresí MM. Hematologická toxicita 2.–3. stupně dle WHO se vyvinula u 21 nemocných (22 %), přičemž nejčastěji se jednalo o leukopenii, resp. neutropenii u 17 (18 %) nemocných a trombocytopenii u 4 (4 %) nemocných. Při snížení či vynechání dávky cyklofosfamidu však docházelo k rychlé úpravě hodnot krevního obrazu. Nebyl zaznamenán žádný případ febrilní neutropenie. Z infekčních komplikací byl zachycen výskyt herpes zoster ve 3 případech, dále se jednalo o nekomplikované infekce horních cest dýchacích (bronchitida u 9 nemocných a faryngitida u 2 nemocných), bronchopneumonie u 2 pacientů, kandidóza dutiny ústní byla zaznamenána u 6 nemocných a infekce močových cest u 4 pacientů, přičemž u jednoho nemocného byla predisponujícím faktorem nezbytná potřeba permanentního močového katétru pro hypertrofii prostaty. U jedné nemocné došlo k rozvoji salmonelové sepse, která byla úspěšně zvládnuta několikatýdenní antibiotickou terapií.
Table 2. Nežádoucí účinky léčby režimem CTD („junior“ i „senior“). 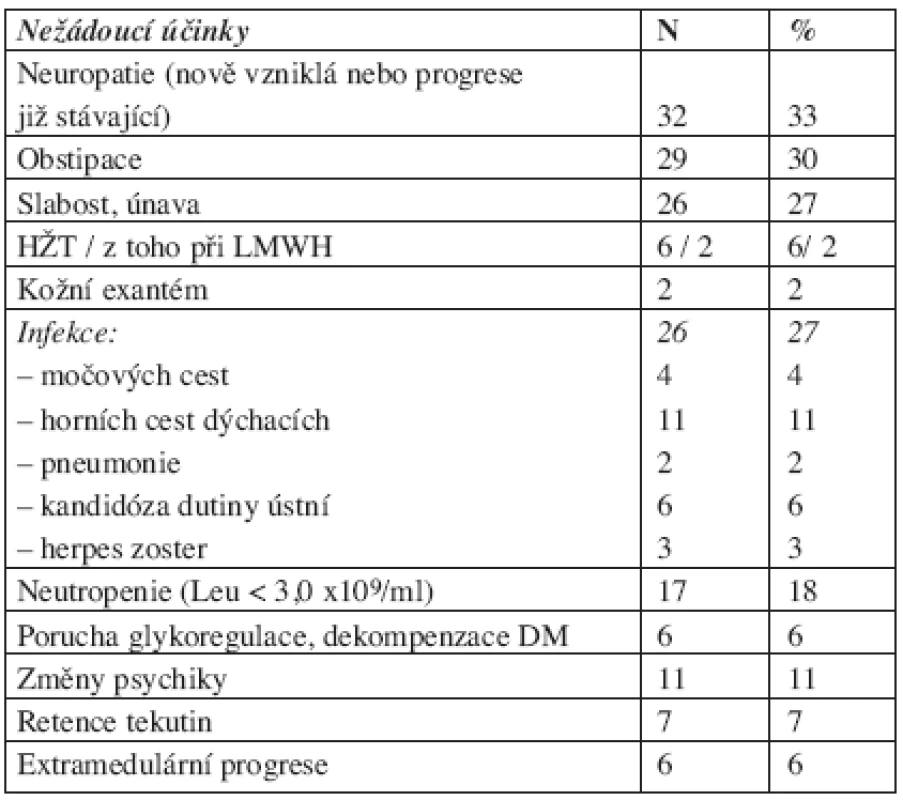
Ve skupině nemocných léčených režimem „CTD-junior“ byla proti skupině „CTD-senior“ poněkud častěji zachycena bronchitida (14 % versus 8 %) a obstipace (46 % vs. 20 %), výskyt ostatních nežádoucích účinků byl srovnatelný v obou skupinách nemocných.
Diskuse
Účinnost thalidomidu u rezistentních či relabujících forem mnohočetného myelomu byla prokázána v několika studiích zahraničních autorů (2, 19, 20). Při monoterapii byly použity zprvu dávky thalidomidu 200–800 mg, objektivní léčebná odpověď byla dosažena u 30 % nemocných, nicméně vysoký výskyt nežádoucích účinků, zejména závažné neuropatie dolních končetin, vedl k sestavení a ověření účinnosti takových kombinačních režimů, které by se vyznačovaly mnohem menší toxicitou při zachování dobrého léčebného výsledku. Kombinace thalidomidu s dexametazonem přinesla zvýšení celkové léčebné odpovědi na 50–60 %, nicméně stále byly užívány neúměrně vysoké dávky thalidomidu (20–22). Další zvýšení léčebné odpovědi přinesla kombinace s jinými cytostatiky, např. doxorubicinem, vincristinem či etoposidem. Mezi vedlejšími účinky se všák stále objevuje neuropatie DKK a zvýšený výskyt hluboké žilní trombózy (23, 24).
Teprve kombinace thalidomidu s dexametazonem a cyklofosfamidem se představila jako poměrně bezpečná, přitom ale vysoce účinná léčba rezistentních, pokročilých forem MM. První zkušenosti zveřejnil tým španělských autorů, který poprvé obohatil léčbu thalidomidem (v iniciální dávce 200 mg/den, s možností navýšení při dobré toleranci až do dávky 800 mg/den) kontinuálním perorálním cyklofosfamidem v dávce 50 mg denně a dexametazonem v dávce 40 mg po 4 dny, podávaným v intervalu 3 týdnů. V pilotní skupině 22 nemocných bylo dosaženo objektivní léčebné odpovědi v 76 %, progredovalo 24 % nemocných (3). V 71členné skupině, analyzované o 2 roky později, bylo dosaženo objektivní léčebné odezvy dokonce u 83 % nemocných, z vedlejších nežádoucích účinků léčby byly v popředí obstipace, somnolence, neutropenie a neuropatie DKK, u 7 % nemocných se vyskytla hluboká žilní trombóza (4, 5).
Ve stejném roce byly zveřejněny výsledky Dimopoulose a kol. (6, 7), vycházející ale z odlišného dávkování léků: thalidomid byl aplikován pulzně, a to v dávce 400 mg ve dnech 1–5 a 14–18, cyklofosfamid v dávce 150 mg/m2 p.o. každých 12 hodin ve dnech 1–5 a dexametazon v dávce 20 mg/m2 ve dnech 1–5 a 14–18, každých 28 dní. Ve skupině 53 pacientů bylo dosaženo objektivní léčebné odpovědi v 60 %, ve 22 % stabilizace choroby, zatímco u 18 % nemocných choroba dále progredovala. Léčba se vyznačovala poměrně dobrou tolerancí, periferní neuropatie DKK byla zaznamenána pouze u 2 nemocných, hluboká žilní trombóza pouze v jednom případě. Poměrně častá však byla neutropenie (40 %), přičemž u 26 % nemocných dosáhla 3.–4. stupně dle WHO.
V posledních 2 letech byly zveřejněny výsledky pozorování několika dalších autorů, lišící se v dávkování thalidomidu a cyklofosfamidu, resp. i aplikační formou cyklofosfamidu (8–15). Je zajímavé, že dosažení celkové léčebné odpovědi (tj. CR, PR a MR) bylo v uvedených studiích obdobné, pohybovalo se v rozmezí 67–88 %, přičemž CR byla zaznamenána pouze ve 2–4 %, zatímco PR ve 42–83 % a MR ve 12–21 %. Stabilizace choroby bylo dosaženo asi u 20 % a progrese nemoci byla pozorována ve 4–25 % případů (4–15) (tab. 3 a 4). Jak patrno z tabelárního přehledu, výsledky naší studie jsou v plném v souladu s výsledky předchozích studií. Zdá se však, že poněkud lepších léčebných výsledků bývá dosaženo při použití intravenózního cyklofosfamidu, avšak za cenu častějšího výskytu infekčních komplikací a leukopenie (8–10, 14). Poněkud příznivější léčebné výsledky režimu „CTD-junior“ oproti režimu „CTD-senior“ v našem pozorování jistě souvisejí i s nižším věkem, menší pokročilostí nemoci, ale zejména s menší „předléčeností“ nemocných s MM (tab. 2). Z uvedených důvodů rovněž nebyl mezi oběma skupinami nemocných zaznamenán v našem souboru výraznější rozdíl ve výskytu závažné leukopenie či infekčních komplikací.
Table 3. Režim CTD – přehled dosavadních dávkovacích schémat. 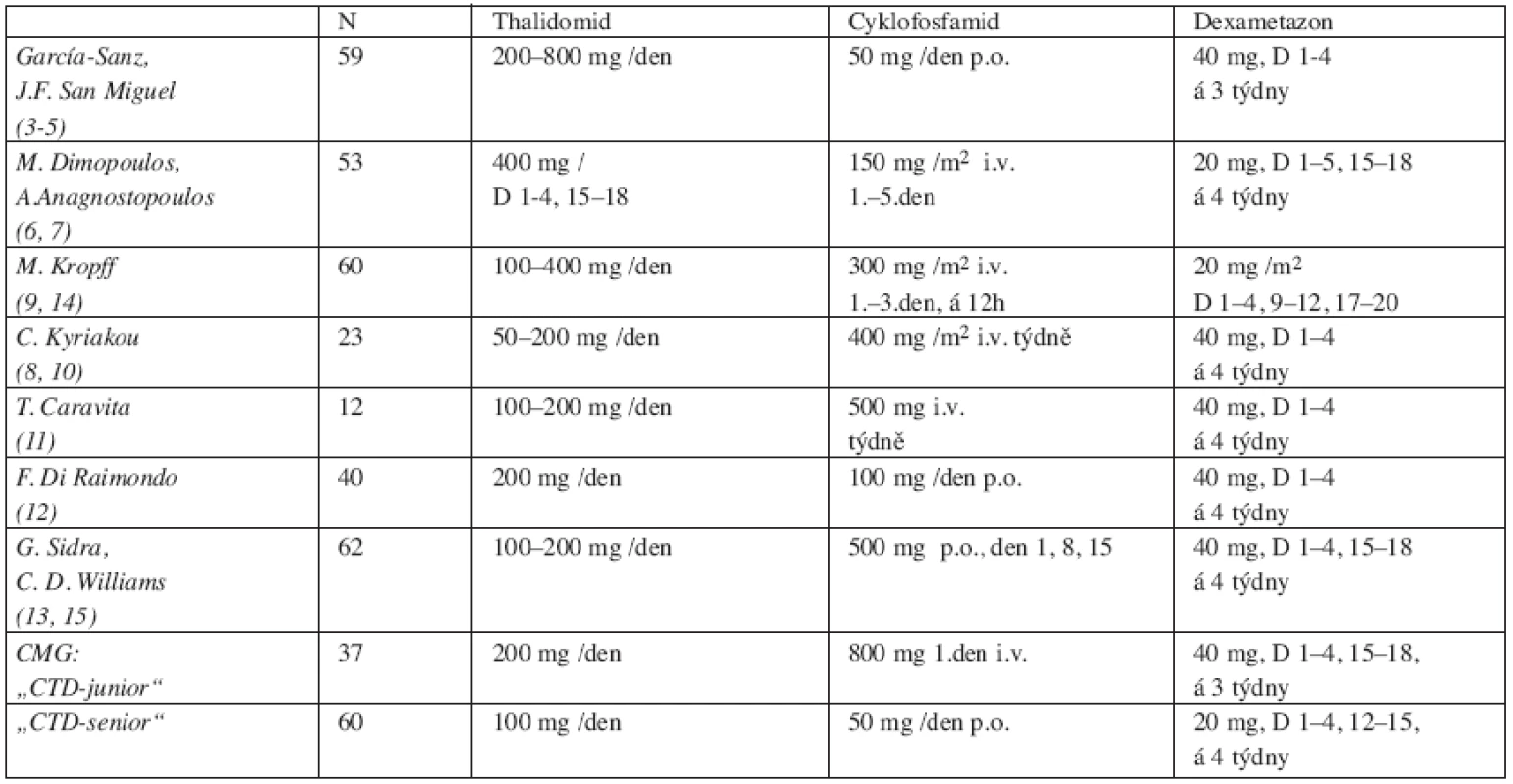
D = den cyklu, CMG = Česká myelomová skupina Table 4. Srovnání léčebné účinnosti a nežádoucích účinků v předchozích studiích. 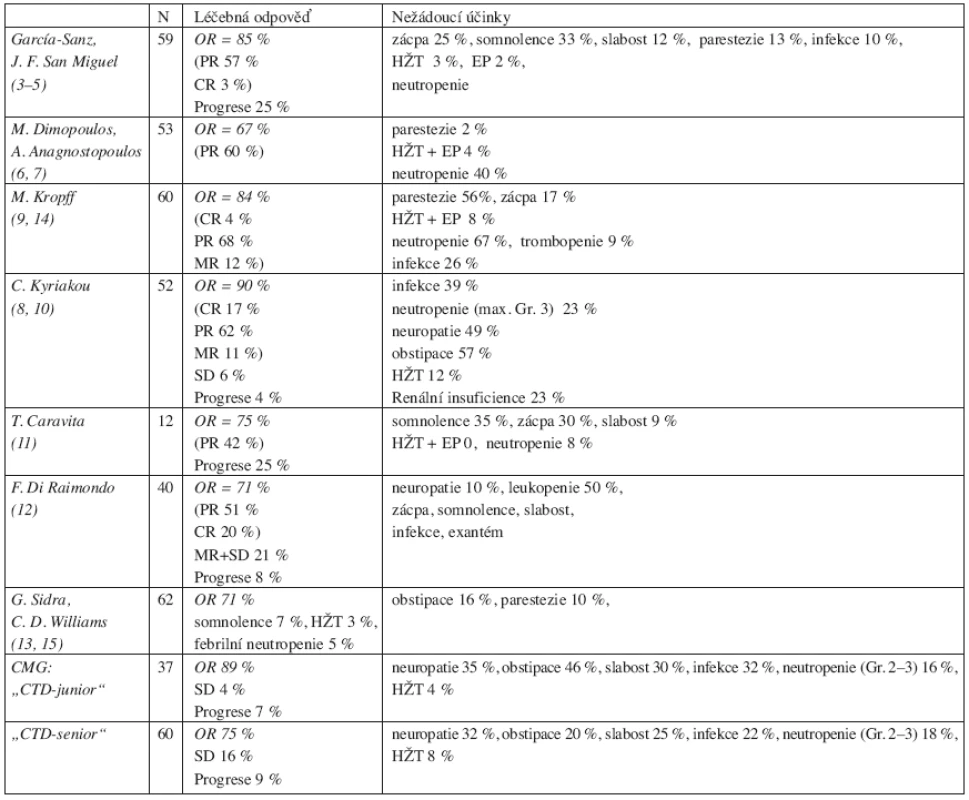
CR = kompletní remise s negativní imunofixací, nCR = nulová hodnota M-proteinu (MIG), ale pozitivní nebo neznámý výsledek imunofixace, PR = parciální remise (pokles MIG pod 50 % vstupní hodnoty), MR = minimální remise (pokles MIG o 25–50 % vstupní hodnoty), SD = stabilizace choroby (změna hodnoty MIG, resp. pokles či vzestup o méně než 25 % vstupní hodnoty), OR = objektivní remise (jakákoliv léčebná odpověď s poklesem MIG alespoň o 25 % vstupní hodnoty); HŽT = hluboká žilní trombóza, EP = embolie plicní, CMG = Česká myelomová skupina Z výsledků dosavadních studií i ze zkušeností tří pracovišť CMG jednoznačně vyplývá, že režim CTD, a to i v proměnlivém složení, dosahuje velmi dobrých výsledků u nemocných s prvotní i získanou ztrátou citlivosti ke standardní chemoterapii, přičemž k dosažení příznivé léčebné odpovědi není třeba používat vysokého dávkování thalidomidu, zatíženého poměrně častým výskytem nežádoucích účinků, zejména neuropatie DKK a hluboké žilní trombózy. Ukázalo se, že při kombinaci s cyklofosfamidem a dexametazonem postačuje obvykle dobře snášená dávka thalidomidu 100–200 mg denně. Výhodou kontinuální, perorální aplikace je i okolnost, že dávku thalidomidu lze navíc upravovat průběžně podle individuální tolerance. V námi analyzovaném souboru se pohybovala denní dávka thalidomidu v rozmezí 50–200 mg. Podání thalidomidu ve večerních hodinách zajišťuje dobrý spánek a zamezuje výskytu výraznější somnolence přes den, poměrně častou obstipaci lze snadno ovlivnit úpravou jídelníčku či podáním laxativ. K zamezení rozvoje závažné neuropatie DKK je nezbytné nejen průběžné hodnocení klinického stavu, ale i pravidelné kontroly EMG v intervalu 6 měsíců, při výskytu subjektivních potíží i v kratším časovém odstupu. Zcela zásadní je rychlé vysazení či snížení dávky thalidomidu, dojde-li k rozvoji neuropatie. Součástí léčby je i péče o pokožku a důsledná hydratace.
Výskyt hluboké žilní trombózy (6 % nemocných) byl v našem souboru srovnatelný s jinými studiemi (3–8 %), přičemž u pacientů, kteří neměli zajištěnou profylaxi nízkomolekulárním heparinem, byl zaznamenán u 12 % (4/34), ale jen u 2 % nemocných (2/63) s touto profylaxí. Žádný z nich neměl prokázanou trombofilii či zvýšené riziko trombembolické nemoci v anamnéze. Otázkou zůstává, zda je u všech nemocných nezbytné každodenní podání LMWH, které je zatíženo nemocnými nevítanou podkožní aplikací a samozřejmě i poměrně značnými finančními nároky na léčbu, nebo zda stačí např. pouze nízké dávky warfarinu (8, 10, 23, 24).
Dávkování cyklofosfamidu lze při kontinuální každodenní aplikaci 50 mg p.o. rovněž dobře upravovat dle aktuálních hodnot krevního obrazu – při závažnějším poklesu leukocytů či trombocytů lze snížit dávku cyklofosfamidu na 50 mg obden, případně lze cyklofosfamid přechodně zcela vysadit až do úpravy hodnot krevního obrazu. Při užití pulzní, nitrožilní aplikace cyklofosfamidu je individuální změna dávkování komplikovanější, neboť lze dávku upravit jen 1x za 3 týdny, přičemž jsou žádoucí důsledné průběžné kontroly krevního obrazu v intervalu 1–2 týdnů. Takto sestavený režim CTD je proto vhodnější zejména pro mladší, méně „předléčené“ pacienty. Výskyt případných infekčních komplikací lze ovlivnit včasnou antibiotickou a antimykotickou terapií, zejména je nutná kontrola sliznice dutiny ústní a časný záchyt poměrně časté kandidózy. Ve vybraných případech je vhodné zvážit profylaxi např. malou dávkou cotrimoxazolu – sumetoprimu (480 mg 1x denně).
Nelze opomenout rovněž i okolnost, že v námi analyzovaném souboru byl u 6 pacientů zachycen výskyt extramedulárních forem plazmocytomu, které byly k léčbě thalidomidem zcela rezistentní. Podobná, i když zatím ojedinělá pozorování uvádějí i jiní autoři (25, 26). Výskyt těchto forem nemoci zřejmě souvisí se zásadní změnou biologických vlastností myelomové tkáně, zejména kinetických a proliferačních charakteristik plazmatických buněk v důsledku pozdní fáze nemoci a pravděpodobně i léčby thalidomidem (26).
Na základě předběžných zkušeností je tedy zřejmé, že režimy „CTD-junior“ i „CTD-senior“ jsou vysoce účinné režimy, velmi dobře použitelné v běžné hematologické praxi. Toxicita je přijatelná a snadno ovlivnitelná, dávkování je velmi jednoduché a vhodné pro ambulantní praxi. Nemocnými je v případě „CTD-senior“ velmi oceňována perorální forma léčby a snadné dávkování. Režim „CTD-junior“ je navíc přínosný v reindukční terapii před opakovanou autologní transplantací periferních kmenových buněk a zdá se, že je snášen lépe, nežli dosud užívané režimy CAD či CED (C - cyklofosfamid, A - adriablastin, D - dexametazon, E - etoposid), toto předběžné pozorování však bude nutné ještě ověřit na rozsáhlejší skupině nemocných. Další nepochybnou předností režimu CTD je okolnost, že zřejmě neovlivňuje výtěžnost separace periferních kmenových buněk při běžném použití vysokodávkovaného cyklofosfamidu, jak tomu bylo, v souladu se zahraničními zkušenostmi (12), i u našich 2 nemocných.
Závěr
Z předloženého sdělení vyplývá, že obě formy režimu CTD (tj. „CTD-junior“ i „CTD-senior“) jsou u nemocných s relabující nebo progredující formou MM účinné a nemocnými velmi dobře snášeny, přičemž případné nežádoucí účinky jsou poměrně snadno ovlivnitelné a některým lze cíleně předcházet souběžnou profylaktickou terapií. Kontinuální podávání umožňuje navíc průběžné úpravy dávek jednotlivých léků v případě výskytu nežádoucích účinků. Jednou z největších předností režimu CTD je možnost snadné, plně ambulantní léčby. Z dosavadních zkušeností vyplývá, že je naprosto nezbytné, aby nemocní se selháním konvenční chemoterapie měli daleko snazší a bezprostřední přístup k léčbě thalidomidem, nežli doposud, a aby došlo co nejdříve k vyrovnání dostupnosti tohoto preparátu v ČR s ostatními zeměmi Evropské unie.
MUDr. Markéta Zemanová, Ph.D.
III. interní klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: marketa.zemanova@fnol.cz
Došlo do redakce: 9. 2. 2007
Přijato: 7. 6. 2007
Sources
1. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klin Farmakol Farm 2005; 19 : 43-46.
2. San Miguel JF. Thalidomide alone or in combination: results in refractory patients. Hematol Rep 2005; 1 : 2-6.
3. García-Sanz R, Gonzáles-Fraile MI, Sierra M, et al. The combination of thalidomide, cyclophosphamide and dexamethasone (ThaCyDex) is feasible and can be an option for relapsed/ refractory multiple myeloma. Hematol J 2002; 3 : 43-48.
4. García-Sanz R, Gonzáles-Porras JR, Hernández JM, et al. The oral combination of thalidomide, cyclophosphamide and dexamethasone (ThaCyDex) is effective in relapsed/ refractory multiple myeloma. Leukemia 2004; 18 : 856-863.
5. Gonzáles-Porras JR, García-Sanz R, Polo-Zarzuela M, et al. ThaCyDex in relapsed/ refractory multiple myeloma. Hematol J 2003; 4, S1 : 234.
6. Dimopoulos MA, Hamilos G, Zomas A, et al. Pulsed cyclophosphamide, thalidomide and dexamethasone: an oral regimen for previously treated patiens with multiple myeloma. Hematol J 2004; 5 : 112-117.
7. Anagnastopoulos A, Hamilos G, Zomas A, et al. Oral hyperfractionated cyclophosphamide and intermittent thalidomide-dexamethasone (pulsed CTD) for previously treated patients with multiple myeloma. Hematol J 2003; 4, S1 : 235.
8. Kyriakou C, Thomson K, D’Sa S, et al. Low-dose thalidomide in combination with oral weekly cyclophosphamide and pulsed dexamethasone is a well tolerated and effective regimen in patients with relapsed and refractory multiple myeloma. Br J Haematol 2005; 129 : 763-770.
9. Kropff M, Lang N, Bisping G, et al. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. Hematol J 2003; 4, S1 : 236.
10. Kyriakou C, D’Sa S, Fox R, et al. Salvage therapy with cyclophosphamide, dexamethasone and thalidomide (CDT) is a well-tolerated and effective regimen in advanced relapsed/ refractory myeloma. Hematol J 2003; 4, S1 : 237.
11. Caravita T, Siniscalchi A, Postorino M, et al. Thalidomide in combination with dexamethasone for relapsed/ refractory multiple myeloma. Hematol J 2003; 4, S1 : 238.
12. Di Raimondo F, Pennisi A, Buglio D, et al. Combination of thalidomide, cyclophosphamide and dexamethasone in refractory-relapsed multiple myeloma. Hematol J 2003; 4, S1 : 241.
13. Sidra G, Williams CD, Russell NH, et al. Combination chemotherapy with cyclophosphamide, thalidomide and dexamethasone for patients with refractory, newly diagnosed or relapsed myeloma. Haematologica 2006; 91 : 862-863.
14. Kropff M, Lang N, Bisping G, et al. Hyperfractionated cyclophosphamide in combination with pulsed dexamethasone and thalidomide (HyperCDT) in primary refractory or relapsed multiple myeloma. Br J Haematol 2003; 122 : 607-616.
15. Williams CD, Byrne JL, Sidra G, et al. Combination chemotherapy with cyclophosphamide, thalidomide and dexamethasone achieves a high response rate in patients with newly diagnosed, VAD-refractory and relapsed myeloma. Blood 2004; 104: Suppl., No. 1499.
16. Blade J, Samson D, Reece D, et al. Criteria for evaluating disease response and progression in patients with multiple myeloma treated by high-dose therapy and haemopoietic stem cell transplantation. Myeloma subcommittee of European Group for Blood and Marrow Transplant. Br J Haematol 1998; 102 : 1115-1123.
17. Bradwell AR, Mead GP, Carr-Smith HD. Clinical apllications of free light chain assays. Multiple myeloma. In: Bradwell AR, Mead GP, Carr-Smith HD. Serum free light chain analysis. 3rd ed. Birmingham: The Binding Site Ltd. 2005 : 67-89.
18. Ščudla V, Minařík J, Schneiderka P, et al. Význam sérových hladin volných lehkých řetězců imunoglobulinu v diagnostice a hodnocení aktivity mnohočetného myelomu a vybraných monoklonálních gamapatií. Vnitř Lék 2005; 51 : 1249-1259.
19. Palumbo A, Giaccone L, Bertola A, et al. Low-dose thalidomide plus dexamethasone is an effective salvage therapy for advanced myeloma. Haematologica 2001; 86 : 399-403.
20. Palumbo A, Falco P, Ambrosini MT, et al. Thalidomide and dexamethasone is an effective salvage regimen for myeloma patients relapsing after autologous transplant. Blood 2004; 104: Suppl., No. 2396.
21. Boccadoro M, Blade J, Attal M, Palumbo A. The future role of thalidomide in multiple myeloma. Acta Haematol 2005; 114, S1 : 18-22.
22. Neuwirtová R, Špička I, Karban J, et al. Naše zkušenosti s léčbou thalidomidem. Transf Hemat dnes, 2002; 1 : 13-19.
23. Zangari M, Anaissie E, Barlogie B, et al. Increased risk of deep-vein thrombosis in patients with multiple myeloma receiving thalidomide and chemotherapy. Blood 2001; 98 : 1614-1615.
24. Cavo M, Zamagni E, Cellini C, et al. Deep-vein thrombosis in patients with multiple myeloma receiving first-line thalidomide-dexamethasone therapy. Blood 2002; 100 : 2272-2273.
25. RosiĖol L, Cibeira MT, Bladé J, et al. Extramedullary multiple myeloma escapes the effect of thalidomide. Haematologica 2004; 89 : 832-836.
26. Saba S, Epstein A, Niesvizky R, Coleman M. Development of high-grade B-cell neoplasms following thalidomide therapy. Haematologica 2005; 90, S1 : 143.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 3-
All articles in this issue
- Chronická B-lymfocytární leukemie Část V. Transplantace krvetvorných buněk
- Co nám v každodenní praxi skutečně říkají tzv. moderní prognostické faktory u chronické lymfatické leukemie?
- Klinický význam 18F-FDG-pozitronové emisní tomografie u folikulárního lymfomu
- Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Rezistence na imatinib a možnosti využití vyššího dávkování léku u pacientů s chronickou myeloidní leukemií
- Výsledky konfirmačních HLA typizací dárců jako indikátor kvality HLA typizace dárců Českého národního registru dárců dřeně (ČNRDD)
- G-CSF u zdravých dárců. Bezpečný nebo škodlivý?
- Návrh populační registrace hematoonkologických diagnóz vycházející z WHO klasifikace nádorových chorob z roku 1999, z hodnocení základních léčebných přístupů a z požadavků Národního onkologického registru ČR
- Produkce a spotřeba transfuzních přípravků v České republice v roce 2006
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G-CSF u zdravých dárců. Bezpečný nebo škodlivý?
- Režim CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Klinický význam 18F-FDG-pozitronové emisní tomografie u folikulárního lymfomu
- Produkce a spotřeba transfuzních přípravků v České republice v roce 2006
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

