-
Medical journals
- Career
Klinický význam 18F-FDG-pozitronové emisní tomografie u folikulárního lymfomu
: A. Janíková 1; K. Bolčák 2; J. Mayer 1; D. Néméthová 3; J. Staníček 2
: Interní hematoonkologická klinika FN Brno, 2Oddělení nukleární medicíny Masarykova onkologického ústavu Brno, 3Institut biostatistiky a analýz Lékařská a Přírodovědecká fakulta Masarykovy univerzity Brno 1
: Transfuze Hematol. dnes,13, 2007, No. 3, p. 117-125.
: Comprehensive Reports, Original Papers, Case Reports
Cíl:
Zhodnotit přínos 18F-FDG-pozitronové emisní tomografie (PET) při stanovení rozsahu onemocnění při diagnóze a po ukončení léčby (stagingu a restagingu) folikulárního lymfomu (FL). PET má zejména u lymfomů vysokého stupně malignity poměrně vysokou senzitivitu a specifitu, avšak význam PET u FL není dosud přesně definován.Metody:
Retrospektivně bylo hodnoceno 127 vyšetření PET u 100 pacientů s FL. U 56 pacientů jsme porovnávali rozsah nemoci zjištěný klasickým stagingem s vyšetřením PET před zahájením léčby. V rámci restagingu byla PET provedena u 71 pacientů (87 % bylo léčeno konvenční léčbou). Porovnávali jsme dobu do progrese (PFS) mezi PET-pozitivními a PET-negativními pacienty.Výsledky:
PET identifikoval ve stagingu oproti klinickému vyšetření a výsledku počítačové tomografie (CT) větší rozsah choroby u 30/56 pacientů, u 7/56 byl nález dle PET menší, 15/56 mělo rozsah shodný a 4/56 pacientů mělo nález diskrepantní s ložisky viditelnými pouze na PET a současnou lymfadenopatií bez PET aktivity u téhož pacienta (p < 0,001). U 15 pacientů s větším rozsahem FL na PET se stadium změnilo významně (ze stadia 0-2 na stadium 3-4). Při zahrnutí výsledků trepanobiopsií se změnilo klinické stadium významně u 13/56 (23 %) nemocných. Po léčbě mělo negativní PET 56/71 pacientů, z nichž 9 (16 %) zrelabovalo v mediánu 10 měsíců, ostatních 47 zůstává v remisi (medián sledování 19 měsíců). Pozitivní PET po léčbě mělo 11/71 pacientů, z nichž 9 (82 %) zrelabovalo v mediánu 6 měsíců. 4/71 pacienti měli PET s hraniční pozitivitou (SUV = standardized uptake value ±2,0), všichni jsou v remisi (medián sledování 39 měsíců). PFS PET-negativních pacientů byl významně delší než PET-pozitivních pacientů (p < 0,001).Závěr:
PET může významnou měrou přispět v diagnostice a léčbě folikulárního lymfomu. Úprava stagingu podle výsledku PET může často změnit léčebnou strategii. Přetrvávání pozitivity na PET po ukončení léčby znamená vysoké riziko časného relapsu a může identifikovat pacienty s horší prognózou.Klíčová slova:
18F-FDG-PET, folikulární lymfom, grading, staging, prognózaÚvod
Folikulární lymfom (FL) patří mezi nejčastěji se vyskytující indolentní lymfomy. Vyniká pomalým růstem, obvykle dobrou radio - i chemosenzitivitou a opakovanými relapsy. Vzdor všem diagnostickým i léčebným snahám zůstává prognóza tohoto onemocnění nepříznivá. Vyléčení lze současnými léčebnými prostředky zajistit pouze u malé části pacientů. Pacienty s lokalizovaným postižením lze někdy vyléčit radioterapií. Většina pacientů však přichází v době rozvinutého onemocnění. Zde je vyléčení možné pouze transplantací kostní dřeně ovšem za cenu rizika komplikací nezřídka mnohem závažnějších než původní onemocnění. Rozvinutý folikulární lymfom se dnes zpravidla léčí kombinací chemoterapie a monoklonální protilátky anti-CD20. Léčbou lze dosáhnout remise choroby avšak s nejistou délkou trvání. I přes různá prognostická skóre a sledování minimální zbytkové choroby se nedaří spolehlivě předem rozpoznat pacienty, kteří by měli užitek z agresivnější léčby a naopak pacienty jejichž léčba by mohla být v rámci stejné diagnózy méně razantní.
Pozitronová emisní tomografie (PET) s 18F-fluoro-deoxyglukózou (18F-FDG) je využívána široce jako metoda stanovení rozsahu onemocnění při diagnóze (stagingu) i hodnocení léčebné odpovědi u řady nádorů (1, 2). 18F-FDG-PET poskytuje doplňující informace ke klasickým stagingovým vyšetřením (3–5) a zaujímá taktéž důležité místo v monitorování léčebné odpovědi a předpovědi rekurence různých lymfomů (6–9). Vysoká senzitivita i specifita 18F-FDG-PET byla především popsána ve studiích s agresivními nehodgkinskými lymfomy a Hodgkinovou chorobou (10–14). Zatímco v době vzniku této práce bylo v databázích MEDLINE více než 630 odkazů na klíčová slova „lymphoma and PET“, na kombinaci slov „low grade lymphoma and PET“ jich bylo nalezeno jen 13. Jak vyplývá z uvedeného, studií zaměřených výhradně na význam 18F-FDG-PET u indolentních lymfomů je podstatně méně a interpretace jejich výsledků je pro heterogenní soubory a malé počty pacientů obtížná. Obecně se předpokládá, že vychytávání izotopu 18F-FDG je úměrné proliferační a metabolické aktivitě tkáně a tudíž je PET u indolentních lymfomů méně spolehlivá (9, 15, 16). Avšak z výsledků několika studií zaměřených na nízce maligní lymfomy je patrné, že PET má zejména u folikulárního lymfomu překvapivě vysokou citlivost (16–18). Nicméně stále není jasné, zda je u folikulárního lymfomu PET vyšetření v rámci klinické praxe smysluplné a přínosné provádět (19). S ohledem na finanční náročnost a limitovanou dostupnost 18F-FDG-PET jsme chtěli zjistit jaké informace může toto vyšetření přinést v klinické praxi u pacientů s folikulárním lymfomem. Definovali jsme si proto užší otázky:
- Jaký význam má 18F-FDG-PET v rámci stagingu u folikulárního lymfomu? Přinese PET vyšetření klinicky podstatné informace oproti současnému standardnímu stagingu zahrnujícímu klinické vyšetření, výpočetní tomografii (CT) hrudníku, břicha pánve a trepanobiopsii kostní dřeně?
- Jaký prognostický význam má u folikulárního lymfomu restagingové vyšetření 18F-FDG-PET po ukončení léčby?
Soubor nemocných a metodika
V retrospektivní studii bylo hodnoceno celkem 127 vyšetření 18F-FDG-PET u 100 pacientů s folikulárním lymfomem léčených a sledovaných na Interní hematoonkologické klinice Fakultní nemocnice Brno v letech 2003 až 2006.
Do sledování byli zařazeni pacienti s ověřeným folikulárním lymfomem (nově diagnostikovaní i relabovaní). Předléčení pacienti byli převážně v prvním relapsu folikulárního lymfomu. Předchozí léčba zahrnovala ve většině případů konvenční chemoterapii typu CHOP (COP, CHOP, COPP) nebo FND se současným podáním rituximabu nebo bez něho (podrobně viz tab. 1, 6). U všech pacientů byl proveden staging v rozsahu klinického vyšetření, CT mediastina, plic, břicha a pánve, trepanobiopsie kostní dřeně a vstupně bylo provedeno celotělové vyšetření 18F-FDG-PET (dále jen PET). Všechna vyšetření vstupního stagingu byla provedena v rozpětí 4-6 týdnů. U 3/127 pacientů bylo provedeno vyšetření CT/PET.
Stanovení rozsahu onemocnění po ukončení léčby (restaging) byl proveden v rozsahu klinického vyšetření a CT mediastina, plic, břicha a pánve. Kontrolní trepanobiopsie kostní dřeně byla vyšetřena obvykle jen u pacientů se vstupně diagnostikovanou infiltrací. PET vyšetření po ukončení léčby bylo prováděno 4–6 týdnů po podání poslední dávky léčby. V několika málo případech (9 ze 127 vyšetření) bylo využito v restagingu fúzní vyšetření CT/PET. Pacienti byli léčeni různými léčebnými postupy z nichž naprostou převahu měly režimy typu CHOP (CHOP, COP, COPP) nebo FND s rituximabem nebo bez něho (podrobně viz tab. 3, 6).
Rozsah onemocnění byl hodnocen podle Ann Arbor stážovacích kritérií. Stadiem 0 pro potřeby tohoto sdělení rozumíme stav s izolovanou pozitivitou na PET při negativním výsledku ostatních vyšetřovacích metod. Předmětem srovnání byl klinický nález, včetně měřitelných ložisek na CT a nálezu trepanobiopsie oproti ložiskům patologického hypermetabolismu glukózy. Pacienti byli v drtivé většině (111/127) vyšetřeni na PET centru Masarykova onkologického ústavu Brno, kde byla patologická aktivita vyjádřena hodnotou SUV (standardized uptake value). 16/127 snímků bylo zhotoveno na PET centru Nemocnice Na Homolce Praha, kde byla uvažována ložiska jednoznačné patologické aktivity bez udání SUV. CT snímky s kontrastem byly provedeny na různých pracovištích obvyklým způsobem. Vycházeli jsme z hodnocení radiologa, v případě nodálních infiltrátů byly uvažovány jako nádorové uzliny větší než 10x15 mm. Vyšetření PET bylo hodnoceno jako negativní, pokud nebyla radiologem konstatována žádná patologická aktivita. PET bylo hodnoceno jako pozitivní, pokud intenzita jakéhokoli nefyziologického signálu byla alespoň 2,5 SUV. V případě 16 pacientů vyšetřených v Nemocnici Na Homolce nebyla hodnota SUV uváděna. Jednalo se o 9/16 PET-pozitivních nemocných (5 v rámci stagingu a 4 v restagingu), které jsme ve srovnání uvažovali jako by měli SUV nad 2,5. Přesnost výsledků všech zobrazovacích metod byla ověřena dle možností histologicky, dalším vývojem, léčebnou odpovědí a opakovaným monitorováním CT/PET.
18F-FDG-PET
Vyšetření bylo prováděno na PET scanneru ECAT Accel firmy Siemens vybaveném detektory LSO (Lutecium oxyorthosilikát) na PET centru Masarykova onkologického ústavu Brno nebo Siemens ECAT ACCEL (PET) respektive Siemens BIOGRAPH DUO LSO scanner (CT/PET) Nemocnice Na Homolce Praha. Pacient byl před vyšetřením lačný minimálně 6 hodin, hydratace byla zajištěna příjmem neslazených nápojů. U diabetiků byla vyžadována glykémie pod 11 mmol/l. Snímání bylo zahájeno minimálně 60–90 minut po intravenózním podání radiofarmaka 18F-FDG (18F-fluoro-deoxy-glukózy) o aktivitě 370 MBq na 70 kg hmotnosti pacienta. Vlastní akvizice v modu 3D probíhala v rozsahu od poloviny stehen po basi lební na lůžku v poloze na zádech s rukama za hlavou a měla parametry: emisní scan 4 minuty, transmisní scan 38 %, obvykle 6–7 postelí (bed position šíře 15 cm/ 7 minut).
V případě PET/CT byl perorálně podán jodový kontrast, i.v. kontrast byl použit selektivně jen u pacientů, kde dosud nebylo provedeno CT. Parametry spirálního CT (PET/CT) byly: 150 keV, kolimace 4,0 mm, tloušťka řezů 5,0 mm, přírůstek rekonstrukce 3,4 mm. Pokud byl podán i.v. kontrast, byl použit modus 80 mAs, jinak byl aplikován modus „low dose“ o 50 mAs. PET kombinovaného scanneru pracoval v modu 3D, 3 minuty na postel.
Snímané souřadnice koincidenčních přímek byly rekonstruovány iterativní metodou OSEM (Ordered Subset Maximalisation Expectation – iterativní metoda rekonstrukce obrazů) do transaxiálních řezů, ze kterých byly reorientací vytvořeny koronární, sagitální a jakékoli šikmé řezy. Na zhodnocení bylo také využito také zobrazení MIP (Maximum Intensity Projections). U PET vyšetření byla v případě dostupnosti dat CT ve formátu DICOM (Digital Imaging and Communications in Medicine) provedena SW (software) fúze obrazů na přesnější lokalizaci ložisek a odlišení míst fyziologické akumulace radiofarmaka.
Výsledné snímky PET hodnotili nezávisle na sobě dva lékaři s atestací z nukleární medicíny.
Statistika
Srovnání rozsahu folikulárního lymfomu v rámci stagingu CT s klinickým vyšetřením versus PET bylo provedeno srovnáním klinických stádií zjištěných dle obou diagnostických postupů (χ2 test dobré shody, p < 0,05). K porovnání skupin PET+ a PET - pacientů po léčbě bylo použito nepárového t-testu u parametrů s očekávanou normální distribucí (věk) a v ostatních případech (srovnání klinických stadií, gradingu a FLIPI) Wilcoxonova testu (Mann-Whitney), ke srovnání relabovaných s nově diagnostikovanými pacienty byl užit Fisherův test (Fisher exact test). Doba do progrese nebo relapsu (PFS = progression free survival) byla definována jako období od restagingu včetně PET po léčbě do relapsu, progrese nebo smrti. Srovnání doby do progrese nebo relapsu u pacientů vyšetřených PET v rámci restagingu bylo provedeno metodikou analýzy přežití PET-pozitivních a PET-negativních pacientů, jako kompletní odpověď byl uvažován stav relaps nebo progrese. Statisticky významný rozdíl byl konstatován při p < 0,05.
Výsledky
1. 18F-FDG-PET v rámci stagingu folikulárního lymfomu
Celkem jsme hodnotili v rámci stagingu CT s klinickým vyšetřením versus PET u 56 pacientů, z nichž 34 bylo žen, 17 pacientů bylo relabovaných. 52 z nemocných mělo grade 1 nebo 2, medián věku ve skupině byl 57 let. Podrobně jsou data uvedena v tabulce 1.
1. Charakteristika souboru pro hodnocení významu 18F-FDGPET v rámci vstupního stagingu (n = 56). 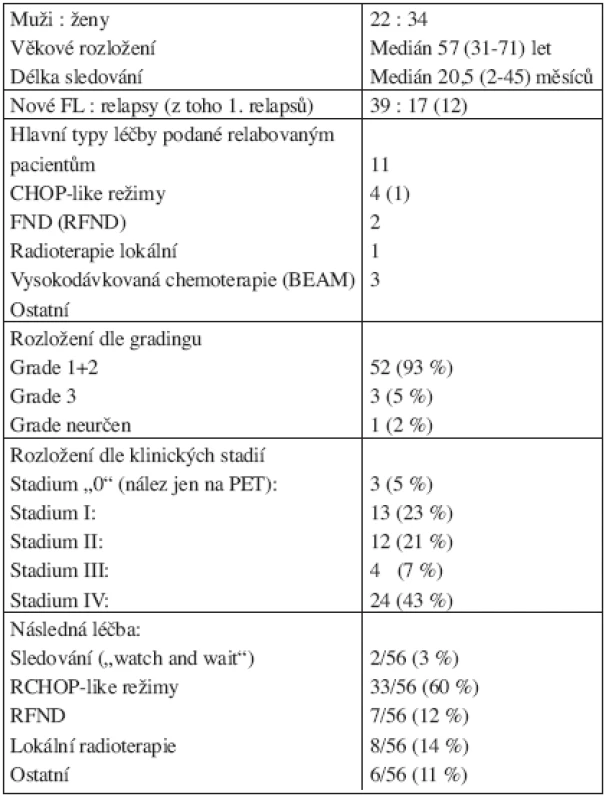
Shodný nález respektive shodné patologické lokality dle klasického stagingu (zvětšení uzlin) a ložiska patologické aktivity na PET (SUV ≥ 2,5) mělo 15/56 (28 %) nemocných. PET identifikoval více ložisek než CT s klinickým vyšetřením u 30/56 (53 %) nemocných, naopak PET označil méně ložisek u 7/56 (12 %) nemocných. U 4/56 (7 %) pacientů jsme nalezli diskrepantní nález mezi CT a klinickým vyšetřením versus PET, to znamená, že některá ložiska byla u téhož pacienta „vidět“ pouze na PET a naopak zjevná lymfadenopatie (na CT nebo palpačně) byla bez patologické PET-aktivity. Uvedené rozdíly byly statisticky významné (χ2= 42,878, df = 16, p < 0,001). Přehledně viz tabulka 2.
2. Přehled rozsahu folikulárního lymfomu definovaného dle PET ve vztahu k CT-stagingu s klinickým vyšetřením před zahájením léčby. 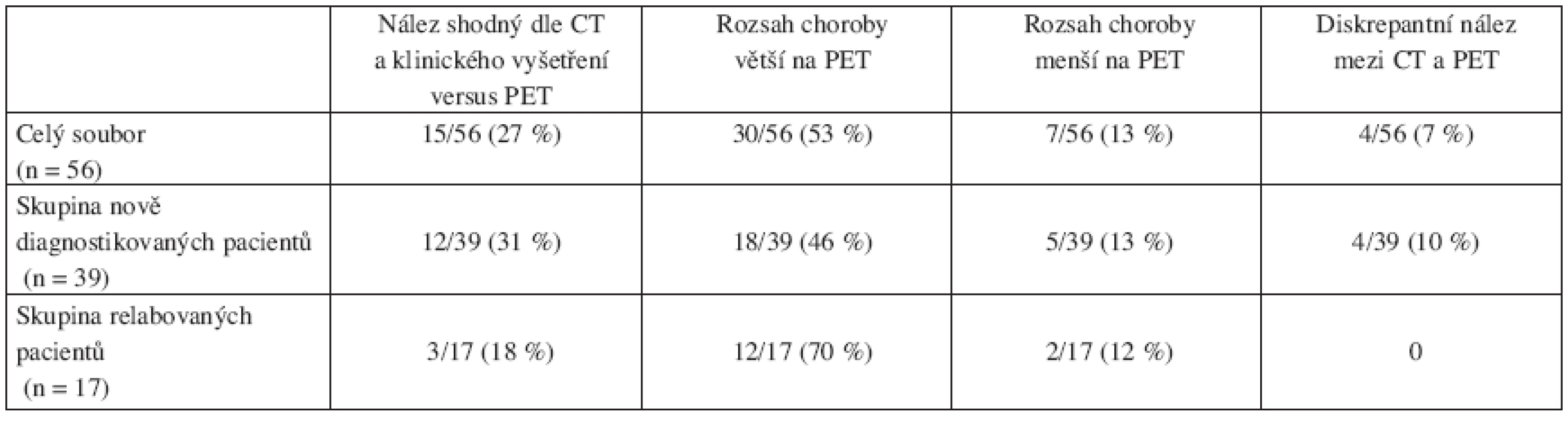
Rozbor 30 pacientů s nálezem většího rozsahu na PET ukázal, že u 15/30 (50 %) nedošlo k podstatné změně klinického stadia, které buď zůstalo zachováno, nebo došlo ke změně ze stadia III na stadium IV. Naopak u dalších 15/30 (50 %) nemocných došlo k významné změně klinického stadia nemoci (ze stadia 0, I nebo II na stadium III nebo IV). Při zahrnutí výsledků biopsií kostní dřeně do stagingu změnil PET významně výsledné klinické stádium folikulárního lymfomu u 13/56 (23 %) pacientů, což se promítlo i do změny léčebné strategie.
Rozbor 7 pacientů s nálezem na PET menším než dle CT s klinickým vyšetřením ukázal, že u 3 pacientů s nově diagnostikovaným folikulárním lymfomem a zjevně velkým rozsahem choroby (klinické stadium III-IV, grade 1–2) PET nezachytil vůbec žádnou patologickou aktivitu. Jeden z uvedených tří pacientů měl rozsah nemoci stadia IV s masivně zvětšenými retroperitoneálními uzlinami a infiltrací prakticky celé páteře včetně patologické fraktury jednoho z bederních obratlů, další pacient s klinickým stadiem IV a značně zvětšenými uzlinami v mediastinu, retroperitoneu a v periferních lokalizacích. Poslední nemocná měla taktéž zřetelnou lymfadenopatii na krku, v axilách, retroperitoneu a na mezenteriu. Všichni tito 3 pacienti jsou v remisi po primární léčbě s mediánem sledování 13 měsíců (6–18 měsíců). Dosud tito pacienti nevykazují žádné odchylky v klinickém chování FL.
Naopak u 3 pacientů byla nalezena evidentní aktivita na PET v pásmu malignity, bez CT nebo klinické korelace (pacienti klinického stadia „0“, avšak stadia III–IV dle PET). U těchto pacientů byla provedena cílená biopsie z aktivních nodálních respektive extranodálních ložisek, kde byl histologicky potvrzen ve všech případech folikulární lymfom (grade 1 nebo 2). Jedna pacientka s rozsahem onemocnění stadia III dle PET (dle CT byla přítomna pouze mírná splenomegalie bez ložisek a bez lymfadenopatie) je 6 měsíců jen ve sledování, neboť jde o jinak zcela asymptomatický relaps FL. Další nemocná měla extranodálně náhodně zachycený lokalizovaný relaps FL v pravé pažní kosti, cca 6 měsíců na to měla již také zcela evidentní retroperitoneální lymfadenopatii dle CT. Třetí pacient měl v rámci pravidelného kontrolního restagingu pouze dle PET ložiska v játrech, skeletu a v normálně velkých uzlinách mediastina, během 5 měsíců došlo ke zjevné progresi FL i v periferních lokalizacích.
Z celého souboru jsme dále vyhodnotili a srovnali standardní staging versus PET zvlášť ve skupině relabovaných a zvlášť ve skupině nově diagnostikovaných pacientů s FL. Nejprve uvádíme analýzu 39 pacientů s nově diagnostikovaným folikulárním lymfomem. U 12/39 (31 %) pacientů byl nález klinického vyšetření s CT a dle PET shodný, u 18/39 (46 %) byl na PET rozsah onemocnění větší, naopak u 5/39 (13 %) byl rozsah nemoci menší. Diskrepantní nález jsme pozorovali u 4/39 (10 %) nemocných. Zjištěné rozdíly jsou významné, PET vyšetření zaznamenalo častěji vyšší klinické stadium (χ2= 39,655 df = 12, p < 0,001). Avšak při zahrnutí výsledků biopsií kostní dřeně do stagingu změnil PET významně klinické stádium folikulárního lymfomu jen u 3/39 (9 %) pacientů.
Rozbor 17 pacientů v relapsu folikulárního lymfomu ukázal, že shodný rozsah nemoci dle CT a kliniky versus PET před zahájením léčby měli 3/17 (18 %) pacientů, zatímco u 12/17 (70 %) PET identifikoval více ložisek. Pouze u 2/17 (12 %) nemocných byl rozsah choroby větší dle kliniky a CT. PET častěji zjistila vyšší klinické stadium, rozdíl však nedosáhl statistické významnosti (χ2= 12,624, df = 9, p < 0,18) pravděpodobně pro celkově nízký hodnocený počet pacientů. Nález na PET i po zhodnocení biopsií kostní dřeně znamenal však změnu léčebné strategie u 10/17 (59 %) pacientů.
2. Prognostický význam 18F-FDG-PET v restagingu folikulárního lymfomu
PET po ukončení léčby jsme provedli u 71 nemocných s folikulárním lymfomem. Pacienti byli ve věku 31–71 let, 46 bylo žen, 44 bylo pacientů s nově diagnostikovaným onemocněním. Naprostá většina pacientů měla grade 1 nebo 2 (64 nemocných) a rozvinuté stadium choroby tzn. klinické stadium III nebo IV (55 pacientů). 62 pacientů bylo léčeno systémovou konvenční polychemoterapií (respektive imunochemoterapií). Podrobněji viz tabulka číslo 3 a číslo 6. Do hodnocení nebyli zařazeni pacienti, u kterých bylo vyšetření PET před léčbou negativní. Medián sledování celé skupiny pacientů je 24 měsíců (2–45).
3. Charakteristika souboru pro hodnocení významu 18F-FDGPET v rámci restagingu po ukončení léčby (n = 71). 
Negativní PET po léčbě mělo 56/71 (79 %) pacientů, přičemž 52/56 (93 %) z nich vykazovalo klasickým restagingem kompletní remisi a 4 (7 %) další měli reziduum dle CT. 9/56 (16 %) PET-negativních pacientů zrelabovalo za 4–31 měsíců (medián 10 měsíců). 7 z těchto 9 relabujících pacientů bylo dle restagingu v kompletní remisi a 2 měli PET-negativní reziduum dle CT. Ostatních 47/56 (84 %) PET-negativních pacientů zůstává v remisi lymfomu s mediánem sledování 19 měsíců (2–45 měsíců). Medián doby do progrese (PFS) nebyl v této skupině dosažen.
Pozitivní PET jsme pozorovali po ukončení léčby u 11/71 (15 %) pacientů, z nichž 5 dosáhlo dle klasického restagingu kompletní remise, 4 další měli na CT reziduální masu a 2 pacienti měli dle CT nález jednoznačně patologické lymfadenopatie (stabilní choroba). Příčinou ložiskové PET-pozitivity u jednoho pacienta byl histologicky verifikovaný adenom tlustého střeva, z hlediska FL byl dle PET i CT v kompletní remisi, která trvá. Jediný z PET pozitivních pacientů po léčbě je vzdor jednoznačnému ložisku na PET (ložisko v plicích nejasné etiologie, vysoko v pásmu malignity, SUV = 6,8) v remisi 12 měsíců od kontrolního restagingu bez průkazu jiné choroby. 9 zbývajících pacientů zrelabovalo v mediánu 6,3 měsíce (1–16 měsíců). Pro výpočet mediánu nebyl započítán pacient, který byl ihned po primární léčbě směřován k vysokodávkované chemoterapii (relaps za 18 měsíců).
U 4/71 (6 %) nemocných jsme zachytili abnormální nález na PET s aktivitou blízkou hranici malignity (SUV ± 2,0). Tito pacienti zůstávají všichni v remisi (medián sledování 39,5 měsíců, 32–45). Přehledně jsou data znázorněna v tabulce 4.
4. Rozbor PET vyšetření po ukončení léčby všech pacientů s folikulárním lymfomem (relabovaných i nově diagnostikovaných) bez ohledu na provedení vstupního PET vyšetření před léčbou. 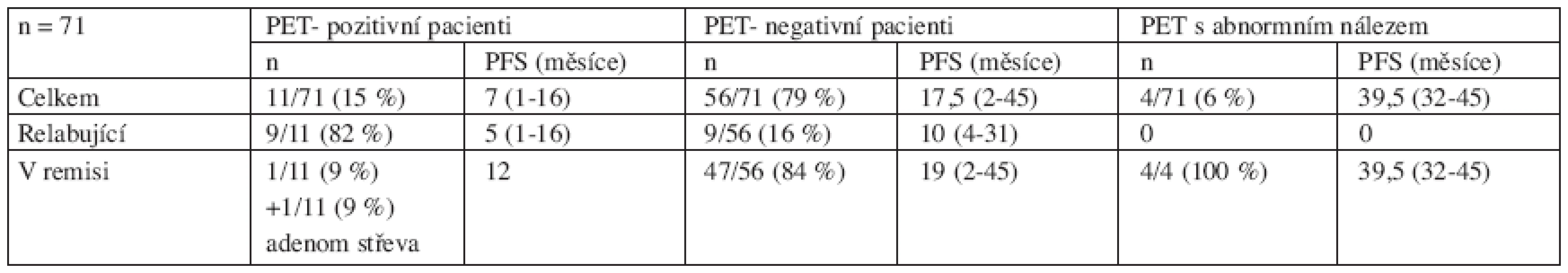
Mezi skupinami PET+ a PET - pacientů po léčbě (tab. 5) nebyl zjištěn rozdíl v distribuci věku, klinického stadia ani FLIPI (Follicular Lymphoma International Prognostic Index), PET+ pacienti měli významně více zastoupen nízký grade FL (p < 0,02) a častěji byli zastoupeni pacienti s nově diagnostikovaným FL (p = 0,015). Metodikou analýzy přežití byla srovnávána doba do progrese nebo relapsu (PFS) pacientů s PET pozitivitou respektive negativitou po léčbě. U pacientů s negativní PET po léčbě nebylo mediánu PFS dosaženo, pacienti s pozitivní PET měli medián PFS 6,3 měsíce (log-rank test: p < 0,001) (viz graf 1).
5. Srovnání významných parametrů skupin PET-pozitivních a PET-negativních pacientů po ukončení léčby. 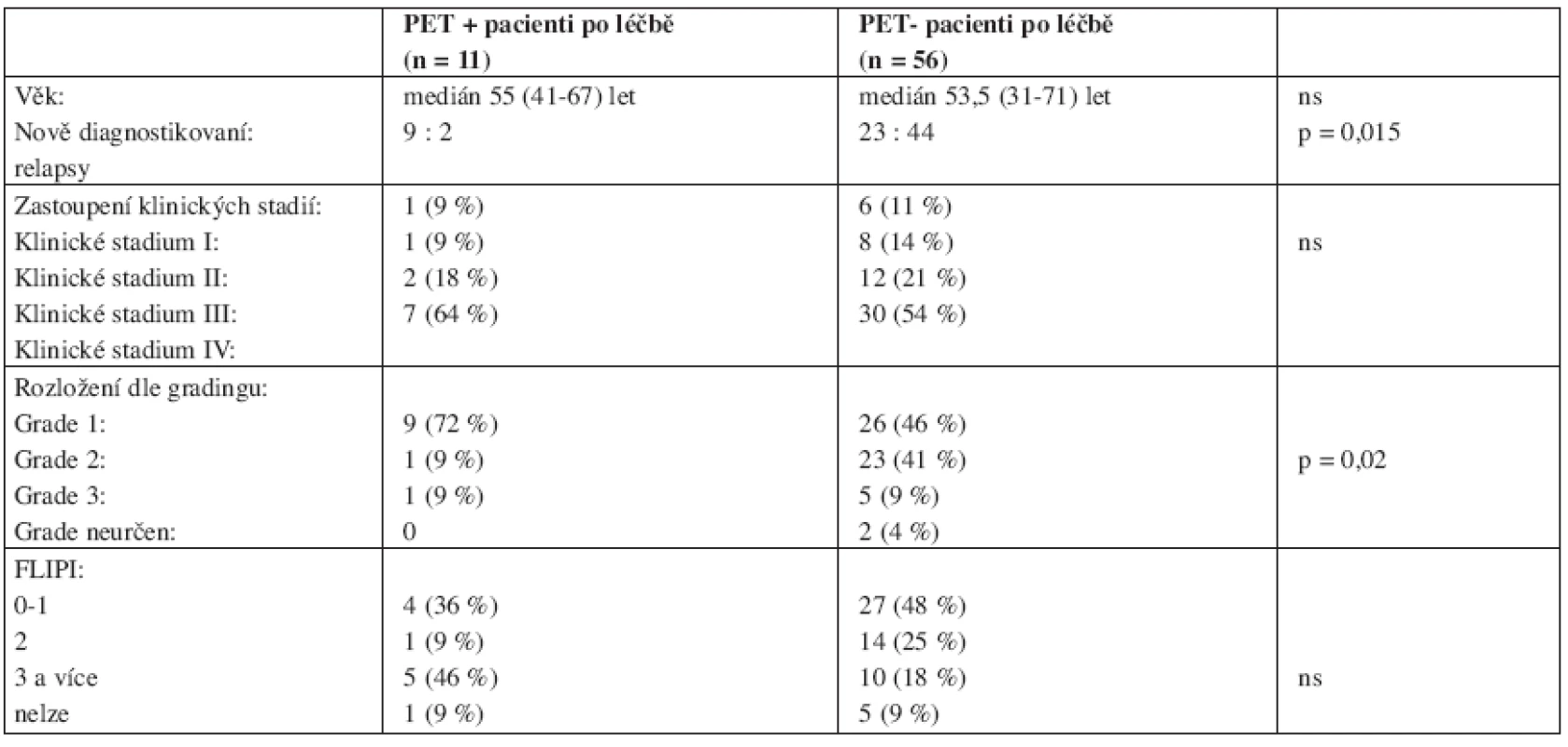
1. Prognóza pacientů s folikulárním lymfomem dle výsledku PET po ukončení léčby s použitím metodiky analýzy přežití, jako kompletní odpověď byl použit stav: relaps nebo progrese (log-rank test: p < 0,001). 
V dalším rozboru jsme se zaměřili pouze na skupinu nemocných s novou diagnózou a vstupně pozitivním PET vyšetřením. Celkem takto bylo vybráno z předchozího souboru 24 nemocných. Po ukončení primární léčby mělo 20/24 (83 %) pacientů negativní PET, z nichž 19 bylo v kompletní remisi dle standardního restagingu, jeden pacient měl reziduální nález na CT. 19/20 (95 %) zůstává v remisi s mediánem 16 měsíců (2–30 měsíců), jeden pacient za 6 měsíců zrelaboval. Pozitivní PET po léčbě mělo 4/24 (17 %) pacientů, 3/4 pacientů měli i nález na CT a všichni zrelabovali (za 1, 3 a 7 měsíců). Zbývající pacient zůstává v remisi (>12 měsíců). Statisticky nehodnoceno pro nízký počet pacientů.
6. Přehled použitých léčebných režimů. 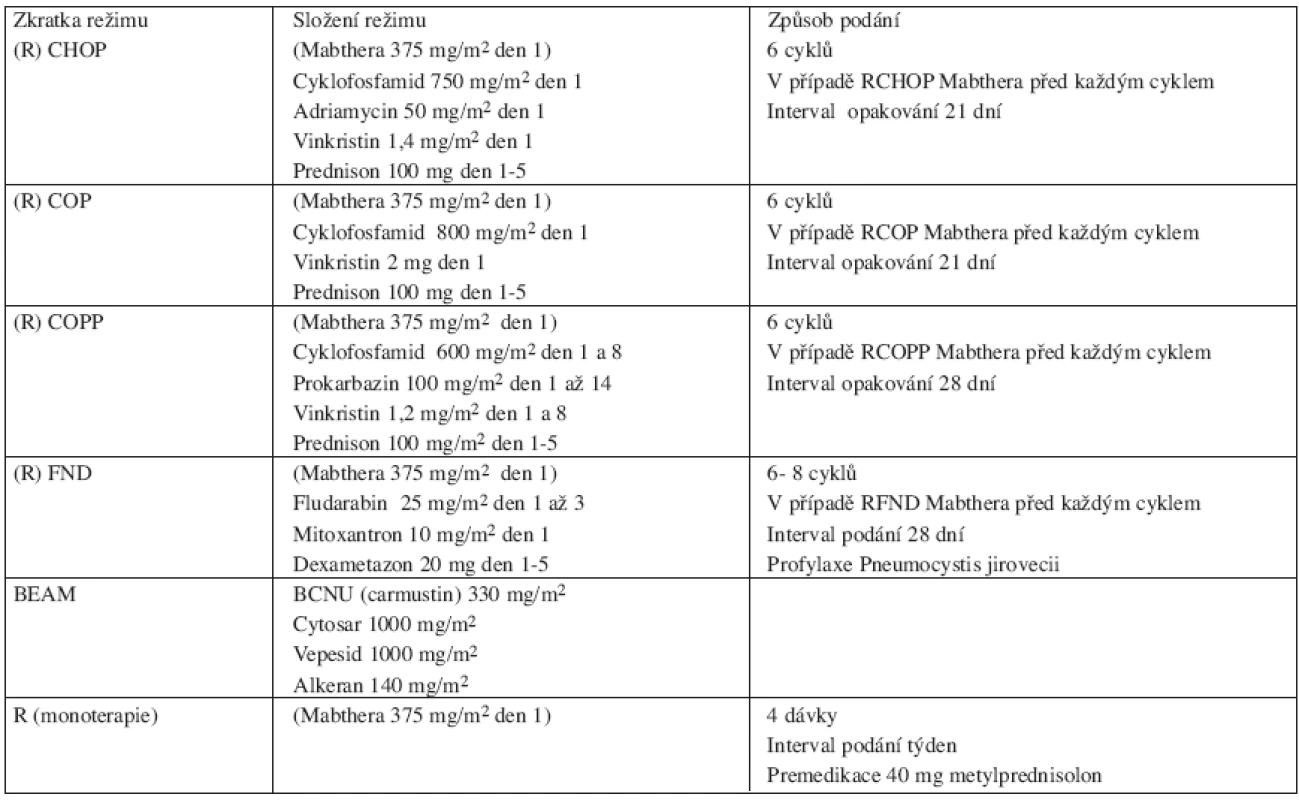
Diskuse
Tato práce si neklade za cíl precizně srovnat a kvantifikovat rozsah postižení folikulárním lymfomem viditelných na PET a CT. Jde o zhodnocení přínosu PET vyšetření nad rámec „standardního stagingového respektive restagingového vyšetření“ u relativně homogenní skupiny pacientů s folikulárním lymfomem a její skutečný význam pro běžnou klinickou praxi. Vycházeli jsme tudíž z běžně zhotovených CT snímků i popisů často z různých pracovišť. Jsme si rovněž vědomi drobné nepřesnosti při zahrnutí výsledků PET několika pacientů bez vyjádření SUV. Tito pacienti však vykazovali jednoznačnou patologickou aktivitu odpovídající malignitě a navíc recentní práce uvádí, že hodnocení vyšetření PET jako negativní či pozitivní se jeví jako dostačující (20). Z hlediska reprodukovatelnosti výsledků a exaktnosti práce jsme přece, tam kde to bylo možné, hodnotu SUV uvažovali.
PET v rámci stagingu identifikoval větší rozsah choroby u více než poloviny pacientů s FL oproti standardnímu vyšetření, přičemž zvýšení klinického stadia promítající se do změny v léčbě bylo pozorováno u necelé čtvrtiny nemocných. Podívejme se na obdobné studie a jejich výsledky. Jerusalem hodnotil PET vyšetření ve stagingu nízce maligních lymfomů, v rámci které bylo vyšetřeno také 24 pacientů s FL. PET zachytil větší rozsah FL u 13/24 (54 %) nemocných (16). Také v jiné studii indolentních lymfomů byl pozorován větší rozsah nemoci dle PET u 7/17 (41 %) pacientů s FL, klinicky významná změna stadia byla pozorována u 29 % případů. Shodný nález PET s CT byl u 9/17 nemocných a menší rozsah lymfomu byl popsán na PET u 1/17 (17). V této souvislosti je třeba říci, že jsme uvažovali pouze pacienty, kde PET „viděl“ větší rozsah postižení, avšak nejsme si jisti, zda všechna ložiska označena jako nádorová pouze dle CT nebo klinického vyšetření opravdu taková byla.
Ze separátního hodnocení nově diagnostikovaných pacientů s FL vyplývá, že zvýšení klinického stadia ač statisticky významné se promítlo do změny v léčbě u necelých 10 %. V zásadě podobný poměr uvádí i práce zaměřená na staging CT versus PET u 47 pacientů s různými lymfomy (nově diagnostikovaní i relabující pacienti včetně 2 FL), pouze u 7 (14,8 %) z nich vedlo zvýšení klinického stadia dle PET ke změně léčebné taktiky (11). U relabovaných pacientů jsme pozorovali vyšší poměr případů s rozsahem lymfomu větším dle PET (i když nedosáhl statistické významnosti), který vedl ve více než polovině případů ke změně v léčebné strategii. Blum a kolektiv studovali PET versus CT u 47 pacientů s indolentními lymfomy. V rámci stagingu a restagingu byl větší rozsah dle PET u 58 %, při progresi byl rozdílný nález u 46 % pacientů, přičemž v 16 % PET ukázal méně a ve 30 % pacientů více ložisek. Histologickým ověřením 22 PET pozitivních lézí byl v 21 z nich prokázán lymfom. Léčebná strategie byla na základě PET změněna u 34 % pacientů (21). Rozdíl vlivu PET na změnu léčby mezi nově diagnostikovanými a relabujícími pacienty si vysvětlujeme tím, že pacienti již jednou sledovaní pro lymfom jsou pravidelně kontrolováni klinicky i zobrazovacími metodami, tedy rozsah nemoci nedosáhne pravděpodobně takového rozměru jako u pacientů nově diagnostikovaných (často s anamnézou i léta trvající lymfadenopatie).
Překvapivě jsme u tří pacientů pozorovali masivně rozvinutý folikulární lymfom bez sebemenší aktivity na PET – tento jev nedokážeme prozatím nijak vysvětlit. V literatuře jsme objevili pouze ojedinělou zmínku podobného charakteru. V jedné studii 1/48 vyšetřovaných pacientů nevykazoval při rozvinutém folikulárním lymfomu žádnou aktivitu na PET (18). Falešně negativní výsledky jsou obvykle očekávány při PET vyšetření u lézí s nízkou metabolickou aktivitou, lézí velmi malých (<1cm v průměru) a ložisek překrytých okolní poměrně vysokou fyziologickou aktivitou (například gastrointestinální trakt). Nízký grade folikulárního lymfomu není pravděpodobně příčinou PET-negativity, což je patrné z literatury i z našeho sledování (17, 18). Ani jeden z uvedených pacientů nevykazoval ložiska očekávané falešné negativity, jen další dlouhodobé sledování těchto tří nemocných ukáže, zda se nějak budou odlišovat od jiných pacientů s FL.
Příklad tří jiných pacientů s ověřeným folikulárním lymfomem viditelným pouze na PET svědčí pro výbornou senzitivitu i specifitu vyšetření u této diagnózy. V této souvislosti uvádíme ještě další případ pacientky, která zemřela na progresi folikulárního lymfomu (verifikováno autopsií) zcela bez patologické lymfadenopatie, avšak s patologickou PET-aktivitou ve skeletu a hraniční aktivitou v normálně velkých uzlinách.
Z hodnocení PET v rámci restagingu je patrné že, ze skupiny PET negativních pacientů zrelabovalo 16 %, zatímco ze skupiny PET+ pacientů zrelabovalo 9/10 (tj. 90 %) nemocných s mediánem sledování celé skupiny 24 měsíců. Medián sledování v naší práci odpovídá solidně délce sledování v podobně koncipovaných studiích, avšak z pohledu mediánu přežití pacientů s FL (kolem 6–9 let) se jeví jako krátký. Vzhledem k pravidelně relabující povaze FL a obecně negativní prognóze především časných relapsů se domníváme, že prezentované výsledky jsou klinicky relevantní již nyní. Pacientku s aktivitou na PET v důsledku adenomu střeva mezi PET-pozitivní pacienty nepočítáme. Obdobně i PFS PET+ pacientů je významně kratší než PET - nemocných. Jsme si vědomi mírného nadhodnocení prognostického významu PET-pozitivity, neboť ve skupině PET+ nemocných po léčbě bylo 6/11 pacientů s nálezem současně na CT.
Svoboda a kolektiv srovnával PFS a přežívání u 18 PET-pozitivních a 32 PET-negativních pacientů s různými lymfomy (pouze 2 pacienti s FL, bez vstupních PET) po záchranné léčbě před autologní transplantací. Ve skupině PET-negativních byl medián PFS 19 měsíců (2–59), přičemž 15 (54 %) pacientů zůstává v remisi 12 měsíců. Ve skupině PET-pozitivních pacientů byl medián PFS signifikantně kratší – 5 měsíců (1–19), pouze jediný pacient zůstává bez progrese, ostatní zrelabovali (p = 0,002) (22). Podobně jako v naší práci, pozitivní PET po léčbě představuje riziko brzkého návratu choroby, ale negativní PET není zárukou dlouhodobé remise.
Prediktivní hodnotu pozitivního PET vyšetření po léčbě u 77 pacientů s různými typy nehodgkinských lymfomů (bez podrobnější specifikace) publikoval také Kahn a kolektiv. Riziko relapsu PET-pozitivních versus PET-negativních pacientů po léčbě byl 15,2 % versus 58,1 %, p < 0,001 (23).
Prakticky jediná studie zaměřená pouze na pacienty s folikulárním lymfomem sledovala v rámci restagingu 24 pacientů, z nichž 18 dosáhlo kompletní remise (CR), 17/18 mělo negativní PET a současně 14/18 mělo i negativní CT. 3 pacienti s nálezem jen na CT byli přehodnoceni po 11 měsících bez progrese jako CR. PET koreloval s klinickým průběhem u 96 % pacientů, 3 % (PET) byla falešně pozitivních a 1 % falešně negativních (medián sledování 36 měsíců) (18). Není zde však uvedena prognostická hodnota PET a také kdy po léčbě byla PET provedena. V naší práci jsme takto korelaci PET a klinického vývoje neposuzovali.
Karam a kolektiv vyšetřili PET v rámci restagingu u 30 pacientů s FL. 20/30 nemocných bylo PET-negativních, 1 měl falešně pozitivní PET, 10/20 pacientů mělo shodný nález dle PET i CT. PET byl označen jako přesnější v identifikaci nádorových lézí než CT (senzitivita PET versus CT 100 % versus 91 % a specifita 91 % versus 50 %). Studie byla zaměřena na hodnocení PET u různých indolentních lymfomů, k prognóze pacientů a klinickému významu se autoři nevyjadřovali (17).
Spaepen a kolektiv vyšetřovali PET v rámci restagingu po primární léčbě u 93 pacientů s lymfomy (z nich 10 FL). PET pozitivní po léčbě byl u 26 nemocných (2 FL) a všichni zrelabovali v mediánu 73 dní, 14 z těchto 26 pacientů mělo nález pouze na PET. Z 67 PET negativních pacientů zůstává 56 (84 %; 6 pacientů s FL) v CR s mediánem 653 dní a 11 (16 %; 2 pacientů s FL) pacientů zrelabovalo v mediánu 404 dní (8).
Jerusalem a kolektiv hodnotil PET u 28 pacientů s lymfomem (včetně 9 FL) po několika cyklech chemoterapie ve vztahu k jejich celkovému přežití a PFS. 5/28 nemocných mělo pozitivní PET a pouze 1 z těchto pacientů dosáhl CR, zatímco z 23 PET-negativních pacientů 21 dosáhlo CR. Všech 5/5 PET pozitivních a 7/21 PET negativních pacientů zrelabovalo, pozitivní prediktivní hodnota PET 100 %, negativní 67 %. PFS i celkové přežití byly u PET+ pacientů výrazně kratší (7).
V naší práci prezentujeme detailně zpracovaný nejpočetnější soubor pacientů s folikulárním lymfomem, u kterých byl srovnáván PET versus standardní staging respektive restaging. Překvapivě jsou naše výsledky PET vyšetření u folikulárního lymfomu velmi podobné výsledkům dosažených ve studiích s převahou agresivních lymfomů (7, 11, 14, 22). Ve vysokém procentu je možné PET zachytit větší rozsah choroby, což je nepochybně zčásti dáno větším rozsahem vyšetřovaných oblastí. Nutno však mít na zřeteli, že přes vysokou obecnou specifitu i senzitivitu existují ojediněle i pacienti s folikulárním lymfomem, kteří jsou zcela PET negativní. Zůstává otevřenou otázkou, zda tito vstupně PET-negativní pacienti budou mít i odlišné chování FL v dalším sledování. PET považujeme za vhodné doplňující stagingové vyšetření u folikulárního lymfomu. Rovněž se na základě našich výsledků domníváme, že PET v restagingu může dobře pomoci předpovědět riziko brzkého relapsu folikulárního lymfomu. Předmětem dalšího zkoumání může být prognostický význam PET provedené časněji v průběhu léčby folikulárního lymfomu (například po 3. nebo 4. cyklu chemoterapie).
MUDr. Andrea Janíková
Interní hematoonkologická klinika
Fakultní nemocnice Brno
Jihlavská 20
625 00 Brno
e-mail: aboril@fnbrno.cz
Podpořeno částečně grantem NR8342-3/2005.
Došlo do redakce: 10. 4. 2007
Přijato: 20. 7. 2007
Sources
1. Jerusalem G, Hustinx R, Beguin Y, et al. The value of positron emission tomography (PET) imaging in disease staging and therapy assessment. Ann Oncol 2002; 13 (Suppl 4): 227–34.
2. Juweid ME, Cheson BD. Positron-emission tomography and assessment of cancer therapy. N Engl J Med 2006; 354 : 496–507.
3. Newman JS, Francis IR, Kaminski MS, et al. Imaging of lymphoma with PET 2-[F-18]-fluoro-2-deoxy-D-glucose: Correlation with CT. Radiology 1994; 90 : 111–6.
4. Moog F, Bangerter M, Diederichts CG, et al. Role of whole-body 2-[F-18]-fluoro-2-deoxy-D-glucose (FDG) PET in nodal staging. Radiology 1997; 203 : 795–800.
5. Stumpe KD, Urbinelli M, Steinert HC, et al. Whole-body positron emission tomography using fluorodeoxyglucose for staging of lymphoma: Effectiveness and comparison with computed tomography. Eur J Nucl Med 1998; 25 : 721–8.
6. Elstrom R, Guan L, Baker G, et al. Utility of FDG-PET scanning in lymphoma by WHO classification. Blood 2003; 101 : 3875–3876.
7. Jerusalem G, Beguin Y, Fassotte MF, et al. Persistent tumor 18F-FDG uptake after a few cycles of polychemotherapy is predictive of treatment failure in non-Hodgkin’s lymphoma. Haematologica 2000; 85 : 613–618.
8. Spaepen K, Stroobants S, Dupont P, et al. Prognostic value of positron emission tomography (PET) with fluorine-18 flurodeoxyglucose ([18F] FDG) after first-line chemotherapy in Non-Hodgkin’s lymphoma: is ([ 18F] FDG-PET a valid alternative to conventional diagnostic methods? J Clin Oncol 2001; 19 : 414–419.
9. Spaepen K, Stroobants S, Verhoef G, et al. Positron emission tomography with [18F] FDG for therapy response monitoring in lymphoma patiens. Eur J Nucl Med 2003; 30 (Suppl 1): S97–S105.
10. Bangerter M, Moog F, Buchmann I, et al. Whole-body 2-[F-18]-fluoro-2-deoxy-D-glucose positron emission tomography (FDG-PET) for accurate staging of Hodgkin’s disease. Ann Oncol 1998; 9 : 1117–22.
11. Hernandez-Maraver D, Hernadez-Navarro F, Gomez-Leon N, et al. Positron emission tomography/computed tomography diagnostic accuracy in lymphoma. Br J Haematol 2006; 135(3): 293–302.
12. Hoh CK, Glaspy J, Rosen P, et al. Whole-body FDG-PET imaging for staging of Hodgkin’s disease and lymphoma. J Nucl Med 1997; 38 : 343–8.
13. Schot BW, Zijlstra JM, Sluiter WJ, et al. Early FDG-PET assessment in combination with clinical risk scores determines prognosis in reccuring lymphoma. Blood 2007; 109 : 486–91.
14. Zinzani PL, Magagnoli M, Chierichetti F, et al. The role of positron emission tomography (PET) in the management of lymphoma patiens. Ann Oncol 1999; 10 : 1181–1184.
15. Hicks RJ. The evolving role of fluorodeoxyglucose positron emission tomography (FDG-PET) in lymphoma: how do we reconcile conflicting results in the era of evidence-based medicine? Leuk Lymphoma 2006; 47 : 2008–10.
16. JerusalemG, Beguin Y, Najjar F, et al. Positron emission tomography (PET) with 18F-fluorodeoxyglucose (18F-FDG) for the staging of low-grade non-Hodgkin’s lymphoma (NHL). Ann Oncol 2001; 12 : 825–830.
17. Karam M, Novak L, Cyriac J, et al. Role of fluorine-18 fluorodeoxyglucose positron emission tomography scan in the evaluation and follow-up of patiens with low-grade lymphomas. Cancer 2006; 107 : 175–83.
18. Wöhrer S, Jaeger U, Kletter K, et al. 18F-fluoro-deoxy-glucose positron emission tomography (18F-FDG-PET) visualizes follicular lymphoma irrespective of grading. Ann Oncol 2006; 17 : 780–784.
19. Jerusalem G, Warland V, Najjar F, et al. Whole-body 18F-FDG PET for the evaluation of patients with Hodgkin’s disease and non-Hodgkin’s lymphoma. Nucl Med Commun 1999; 20 : 13–20.
20. Juweid ME, Stroobants S, Hoekstra OS, et al. Use of positron emission tomography for response assessment of lymphoma: Consensus of the imaging subcomitee of international harmonization project in lymphoma. J Clin Oncol 2007; 25 : 571–578.
21. Blum RH, Seymour JF, Wirth A, et al. Frequent impact of [18F] fluorodeoxyglucose positron emission tomography on the staging and management of patients with indolent non-Hodgkin’s lymphoma. Clin Lymphoma 2003; 4(1): 43–9.
22. Svoboda J, Andreadis C, Elstrom R, et al. Prognostic value of FDG-PET scan imaging in lymphoma patients undergoing autologous stem cell transplantation. Bone Marrow Transplant 2006; 38(3): 211–6.
23. Kahn ST, Flowers C, Lechovwicz MJ, et al. Value of PET restaging after chemotherapy for non-Hodgkin’s lymphoma: Implications for consolidation radiotherapy. Int J Radiat Oncol Biol Phys 2006; 66(4): 961–5.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 3-
All articles in this issue
- B-cell chronic lymphocytic leukemia. Part V. Stem cell transplantation
- What can we currently learn from new prognostic markers of chronic lymphocytic leukemia in the everyday haematological practice?
- Clinical value of 18F-FDG-positron emission tomography in follicular lymphoma
- CTD regimen (cyclophosphamide, thalidomide, dexamethasone) in the treatment of relapsed or refractory multiple myeloma
- Resistance to imatinib and the possibilities of use of the dose escalation of the drug in patients with chronic myeloid leukemia
- Confirmatory HLA typing results as an indicator of quality of the HLA typing of the door pool: Czech national marrow doors registry (CNMDR) experience
- G-CSF in healthy donors. Safe or harmful?
- Proposal for population – oriented registration of hemato-oncologic diagnoses based on 1999 WHO cancer classification analysis of general treatment options and on requirements of the Czech National Cancer Registry
- Production and use of blood components in Czech Republic in the year 2006
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- G-CSF in healthy donors. Safe or harmful?
- CTD regimen (cyclophosphamide, thalidomide, dexamethasone) in the treatment of relapsed or refractory multiple myeloma
- Clinical value of 18F-FDG-positron emission tomography in follicular lymphoma
- Production and use of blood components in Czech Republic in the year 2006
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

