-
Medical journals
- Career
Využití zpětné vazby v rehabilitaci pacientů s poruchami chůze po cévní mozkové příhodě
: N. Burget
: Rehabilitační oddělení Krajské nemocnice T. Bati, a. s., Zlín primář MUDr. P. Skalka
: Rehabil. fyz. Lék., 22, 2015, No. 2, pp. 70-78.
: Review Article
Práce podává přehled nejčastěji používaných postupů s využitím zpětné vazby v rámci rehabilitace pacientů po iktu. S rozvojem roboticky asistované rehabilitace v posledních letech se při tréninku chůze stále více využívají metody zahrnující vizuální nebo akustickou zpětnou vazbu. Řada studií prokazuje větší efektivitu rehabilitační terapie s využitím těchto principů. Zpětná vazba umožňuje do určité míry nahradit insuficientní informace z proprioreceptorů a dalších senzorů pohybu, které byly narušeny cévní mozkovou příhodou. Praktickým příkladem využití je trénink stoje a chůze na pohyblivém chodníku s vizualizací rozložení zátěže plosek zdravé i paretické strany. Prostřednictvím této zpětné vazby je pacientům poskytnut další významný aferentní vstup napomáhající reaktivaci řídících center motoriky poškozených iktem. Vizuální zpětná vazba usnadňuje postiženému přenos váhy na paretickou dolní končetinu, zvyšuje se stabilita stoje i chůze, zlepšuje se kontrola a koordinace prováděných pohybů.
Klíčová slova:
cévní mozková příhoda, chůze, zpětná vazba, pohyblivý chodníkÚVOD
Cévní mozkové příhody (CMP) jsou dle WHO definovány jako rychle se rozvíjející ložiskové nebo celkové příznaky poruchy mozkové funkce trvající déle než 24 hodin nebo končící smrtí nemocného, bez přítomnosti jiné zjevné příčiny než cévního původu (26). Ischemické ikty představují 67-81 %, hemoragické 7-20 % ze všech CMP. Průměrný věk pacientů postižených cévní mozkovou příhodou je 70 let u mužů a 75 let u žen. Alarmující je, že přibližně 25 % příhod postihne jedince mladší 65 let a 5 % pacientů je mladších 45 let (15). Incidence CMP v České republice je přibližně 300/100 tis. obyvatel, mortalita zůstává stále vysoká - až 40 % postižených umírá do 1 roku od vzniku příhody (dle registru cévních mozkových příhod IKTA).
V rámci komplexní rehabilitační péče o pacienty po iktech se zaměřujeme na terapii nejen poruch motorických, ale také senzorických, kognitivních, fatických atd. Velmi podstatné je včasné zahájení rehabilitace, nejlépe již na iktových jednotkách, samozřejmě po stabilizaci základních životních funkcí pacienta. Právě včasnost zahájení léčby mívá zásadní význam pro celkový efekt terapie, protože může zabránit rozvoji patologických pohybových vzorců vznikajících na podkladě abnormálního svalového tonu a brzy aktivizuje mechanismy neuroplasticity (19). V moderní rehabilitaci patří optimální využití spontánní regenerace a neuronální plasticity k nejdůležitějším cílům (1).
V akutním stadiu po iktu má největší význam komplexní rehabilitační ošetřovatelství, které brání rozvoji komplikací (např. kontraktur, dekubitů apod.), jež by v pozdějším období bránily návratu aktivní hybnosti. Zásadní je správné polohování a manipulace s pacientem, provádění pasivních pohybů v antispastických vzorcích s cílem snížení spasticity a prevence vzniku kontraktur. Současně provádíme exteroceptivní a senzorickou stimulaci paretické strany těla k zabránění poklesu její mozkové reprezentace. Využíváme stimulů taktilních, proprioceptivních, termických, verbálních, optických (22).
VERTIKALIZACE
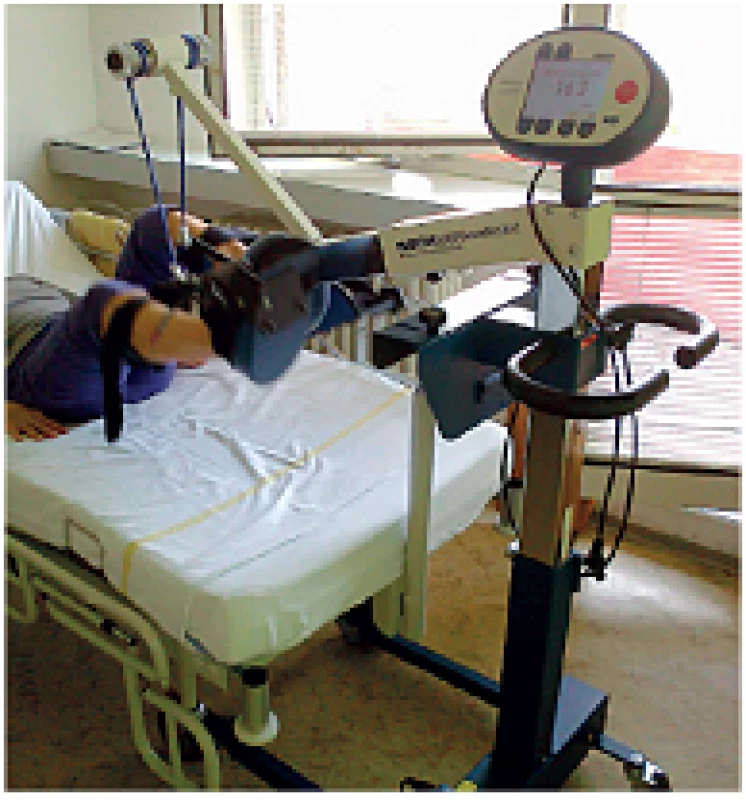
Po stabilizaci stavu pacienta je možné rozvinout celý terapeutický program počínaje mobilizací a vertikalizací. Vertikalizace je nejen předpokladem následné chůze, ale slouží také jako trénink oběhového systému, prevence osteoporózy, pneumonie, kontraktur a podporuje správnou funkci močového měchýře a motilitu střev. Součástí přípravy pacienta na vertikalizaci je využití Motomedu (obr. 1).
Motomed umožňuje i ležícím pacientům pasivní, asistovaný nebo aktivní pohyb dolních končetin s různým stupněm zátěže, zvyšuje symetrii zatížení obou dolních končetin, snižuje kompenzační přetěžování neparetické nohy a vede také ke snadnější iniciaci pohybů pacientem (9). Dalším krokem vertikalizace je nácvik otáčení na lůžku na zdravou i postiženou stranu, posazování v rámci konceptu dle Bobatha, trénink stability sedu a posuny vsedě. Následuje nácvik stoje u lůžka. Jako příprava na trénink chůze se nacvičuje přenášení váhy na paretickou končetinu. Zde již lze velmi dobře využít zpětné vazby (biofeedbacku) použitím posturografických plošin, které zobrazují přesun těžiště váhy pod chodidlem a pacient tak prostřednictvím vizuální zpětné vazby může kontrolovat rozložení váhy na obě dolní končetiny. V časné fázi rehabilitace, pokud pacient ještě není schopen aktivní vertikalizace, je možné využít vertikalizační stůl. Ten dovoluje postupně zvyšovat vertikální zatížení pacienta nastavením sklonu stolu a umožňuje také pasivní trénink chůze. Vytváří simulaci chůzového a krokového mechanismu se střídavou flexí jedné a extenzí druhé dolní končetiny. Aktivují se tak míšní generátory lokomoce, které jsou zodpovědné za koordinovanou aktivaci svalů nezbytnou při chůzi (obr. 2).
2. Simulace chůze na vertikalizačním stole. 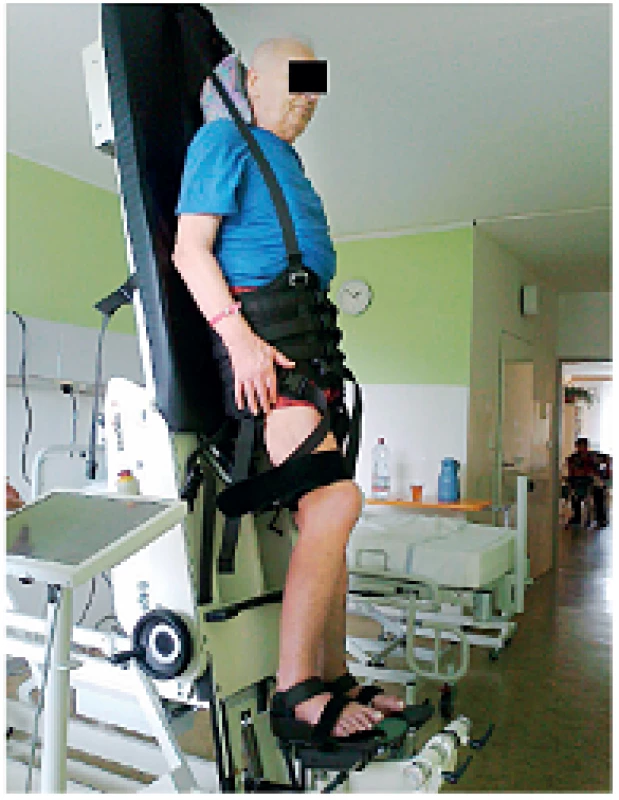
V akutní i subakutní fázi po prodělané cévní mozkové příhodě se v rehabilitaci dále využívá široké spektrum fyzioterapeutických metod, nejčastěji koncept manželů Bobathových, proprioceptivní neuromuskulární facilitace, senzomotorická stimulace, Vojtův princip reflexní lokomoce (17).
Trénink chůze je jen jednou částí ucelené rehabilitace osob postižených iktem. Obnova chůze je pro pacienty velmi důležitý faktor k udržení soběstačnosti a samostatnosti v běžných denních činnostech a v některých případech může reedukace chůze přispět i k návratu do zaměstnání. Pro správnou chůzi je důležitý mechanismus přenosu zátěže mezi švihovou a opornou končetinou, který bývá nezřídka poškozen při poruchách podkorových struktur mozku nebo správnému pohybu brání rozvinutá spasticita extenzorů dolní končetiny zabraňující flexi v kyčli a nutící pacienta k chůzi s typickou cirkumdukcí. Lepších výsledků rehabilitace chůze se dosahuje využitím kombinace několika léčebných metod než preferencí jen jednoho konceptu (4). Chůze hemiparetického pacienta je charakterizována širší opěrnou bází, kratší délkou kroku, nižší rychlostí a frekvencí chůze. Paretická dolní končetina setrvává kratší dobu v oporné fázi a jsou patrny větší výkyvy těžiště, což se projevuje celkovou nestabilitou při chůzi, nacházíme abnormality svalového tonu, nekoordinované aktivace svalů, svalovou slabost (33). Kroky jsou asymetrické a jsou narušeny rovnovážné reakce (36). Tyto symptomy nejsou vyvolány jen svalovou slabostí, ale především poruchou motorického řízení z centrálního nervového systému (CNS). Proto jsou nezbytné rehabilitační postupy, které prostřednictvím zpětnovazebných informací reaktivují míšní a mozková centra k opětovnému řízení pohybu (33). K nácviku správné koordinace pohybů a časové posloupnosti zapojování jednotlivých svalových skupin se s výhodou využívá rytmické akustické stimulace (např. metronom, slovní povely terapeuta), kdy dochází ke snadnější synchronizaci motorických jednotek a zafixování správného stereotypu chůze. Důsledkem je vyšší rychlost i frekvence chůze, délka kroku, symetrie přenosu těžiště (32). Vede také k lepšímu zapojování (timingu) svalových motorických jednotek (33).
VYUŽITÍ ZPĚTNÉ VAZBY V TRÉNINKU CHŮZE
Zpětná vazba představuje pro CNS důležitý impulz, který umožňuje lépe kontrolovat provádění pohybu. Zpětnou vazbu lze dělit na vnitřní a vnější. Vnitřní zpětná vazba je zprostředkována vlastními senzory aktivními během pohybu, např. proprio-receptory, tlakové receptory, zraková kontrola, sluch, hmat apod. Právě složky vnitřní zpětné vazby bývají postiženy cévní mozkovou příhodou. Zevní zpětná vazba bývá zprostředkována externím zdrojem informací, např. slovním vedením terapeuta, akustickými signály, obrazovkou počítače apod. Zevní zpětná vazba může být poskytována jak ve formě informací o průběhu pohybu, tak jako informace až o konečném dosaženém výsledku. V prvním případě má pacient možnost korigovat odchylky hned v průběhu pohybu, což je náročnější na soustředění a mnozí pacienti proto upřednostňují druhý způsob, kdy dostanou informace až po dokončení pohybu a korekci provedou až při dalším nácviku daného úkolu. Zevní zpětná vazba dodávaná terapeutem nebo přístrojem může alespoň částečně nahradit insuficientní informace z receptorů vnitřní zpětné vazby, jež byly poškozeny iktem. Studie prokazují, že zpětná vazba by se neměla využívat při každé cvičební jednotce. Při jejím příliš častém využívání se na ní pacient stává „závislým“ a v konečném důsledku se zhoršuje jeho schopnost vlastní koordinace pohybů potlačením vnitřní zpětné vazby (34).
Mnohé studie dokazují, že trénink s využitím zpětné vazby vykazuje větší efektivitu terapie a dosahuje lepších konečných výsledků než u kontrolovaných skupin pacientů, kterým byl poskytnut standardní rehabilitační program bez využití této metody (31). Tate uvádí např. vzestup rychlosti chůze o 33 % a prodloužení kroku o 79 % u pacientů využívajících zpětnovazebných metod oproti skupině pacientů trénujících bez zpětné vazby, kde se rychlost chůze zvýšila jen o 5 % a krok se prodloužil o 43 % (30). Prostřednictvím zpětné vazby dochází k lepší mozkové integraci a využití proprioceptivních informací o prováděném pohybu (16). Trénink motorických dovedností za využití vizuální zpětné vazby vede ke změnám v propojení kortikospinálních drah a míšních motoneuronů (28). Vizuální nebo i akustická zpětná vazba poskytuje pacientovi přídatnou informaci o správnosti prováděného pohybu a usnadňuje tak jeho koordinaci, kontrolu a řízení. Navíc dříve aktivizuje mechanismy neuroplasticicty a motorického učení využívané v rehabilitačních konceptech (13, 34). Využití akustické i vizuální zpětné vazby (např. pomocí posturografu) v kombinaci s nestabilními plošinami v rámci nácviku posturální stability usnadňuje pacientům přenášení váhy na paretickou končetinu (36). Biofeedback lze s výhodou využít i v rámci rehabilitace starších pacientů po iktu, kdy prokazatelně dochází ke zlepšení stability stoje i chůze a zkrácení reakčního času při ztrátě rovnováhy, což významně snižuje riziko pádu (37).
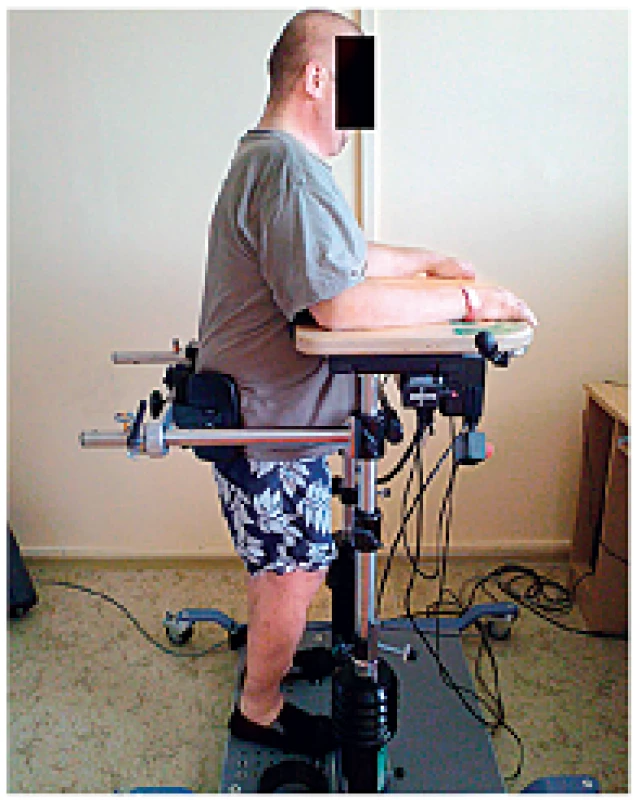
BALANCE TRAINER
Balance Trainer, neboli dynamický vertikalizátor, je zařízení umožňující bezpečnou vertikalizaci pacienta samostatně nebo s dopomocí druhé osoby. Pacient je u přístroje uchycen a stabilizován na chodidlech, kolenou a v bocích. Díky možnosti aretace je přístroj použitelný i pro nácvik prosté stability ve stoji. Terapeutický stůl může být nakloněn proti nastavitelnému odporu, pacient balancuje svou tělesnou hmotností, ale stůl mu zároveň poskytuje dostatečnou oporu a zabraňuje pádu (obr. 3).
Nejčastěji tento systém využíváme k nácviku rovnováhy a schopnosti přenést váhu na paretickou dolní končetinu. K tomu je pacient „nucen“ prostřednictvím zadaných úkolů generovaných na monitoru počítače – např. sledování cíle v prostoru, pohyb po předem zvolené dráze apod. Vlastní pohyb pacienta je na obrazovce znázorňován v reálném čase a pacient tak může reagovat na odchylky od žádané kvality pohybu. Navíc je upozorňován i akustickým signálem v případě pohybu mimo vymezené území (obr. 4, obr. 5).
4. Balance Trainer – pohyb po zadané linii. 
5. Balance Trainer - úkol „Sběr jablek“. 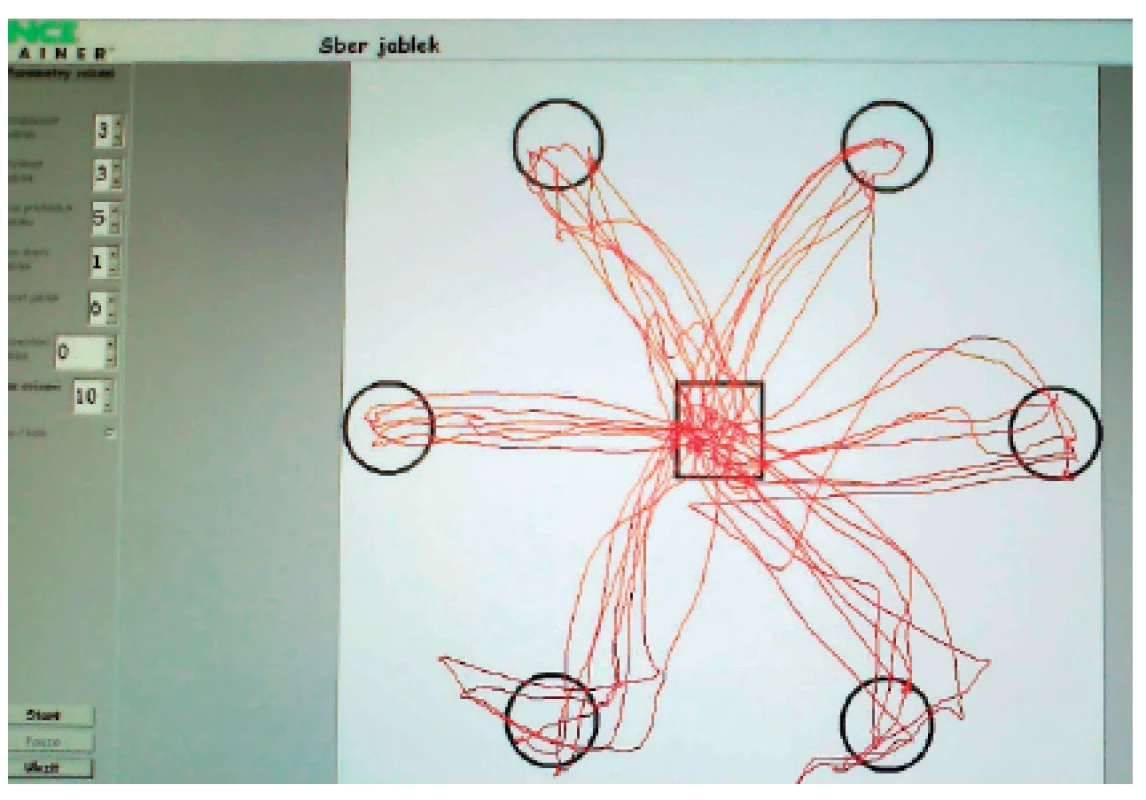
Opakovaným tréninkem narůstá zatížení paretické dolní končetiny, rozložení váhy na obou DKK je symetričtější a zlepšuje se selektivita pohybů (23). Během tréninku je vhodné využít kombinace několika různých úkolů, protože opakování stále stejných impulzů vede ke snížení reaktivity mozku a klesá jeho schopnost vytvářet nové synapse. Na druhé straně musíme terapeutický program volit tak, aby nebyl pro pacienta únavný, při únavě se snižuje koordinace pohybů a dochází k nefyziologickému zapojování motorických jednotek. Pravidelné využívání balančního tréninku vede ke zlepšení i zrychlení posturálních balančních reakcí a reflexů během stoje a chůze (27).
TERAPIE NA POHYBLIVÉM CHODNÍKU
Terapie na pohyblivém chodníku doplňuje tradiční koncepty nácviku chůze. Dlouhodobě prováděný nácvik chůze na pohyblivém chodníku aktivuje procesy neuroplasticity v CNS (10). Pohyblivý chodník, na němž je pacient jištěn závěsným systémem, umožňuje nácvik chůze za podmínek odlehčení tělesné hmotnosti. Poskytuje pacientům jistotu při pohybu a snižuje strach z pádu, který by nežádoucím způsobem zvyšoval spasticitu (7). Častým problémem bývá spontánní iniciace pohybu pacientem, která je zvláště v počátečních obdobích vertikalizace výrazně utlumená. Na pohyblivém chodníku je pohyb iniciován přístrojem a každý krok je pro pacienta stejný, může se tak plně soustředit na správnou koordinaci chůze a nemusí rozptylovat svou pozornost např. sledováním nerovností v terénu (3). Trénink chůze na pohyblivém chodníku u pacientů zvyšuje symetričnost chůze, propulzní aktivitu a zlepšuje koordinaci pohybů (11). Při doplnění pohyblivého chodníku ke klasickým metodám nácviku chůze se o 28 % prodloužila vzdálenost v 6min. testu chůze (8). Klesá také spasticita svalstva dolních končetin a zvyšuje se celková kardiovaskulární výkonnost nemocných (6, 8, 31). Efektivita terapie pomocí pohyblivého chodníku je pravděpodobně způsobena zpětnovazebnou proprioceptivní aktivací míšních krokových generátorů pohybem pásu (20).
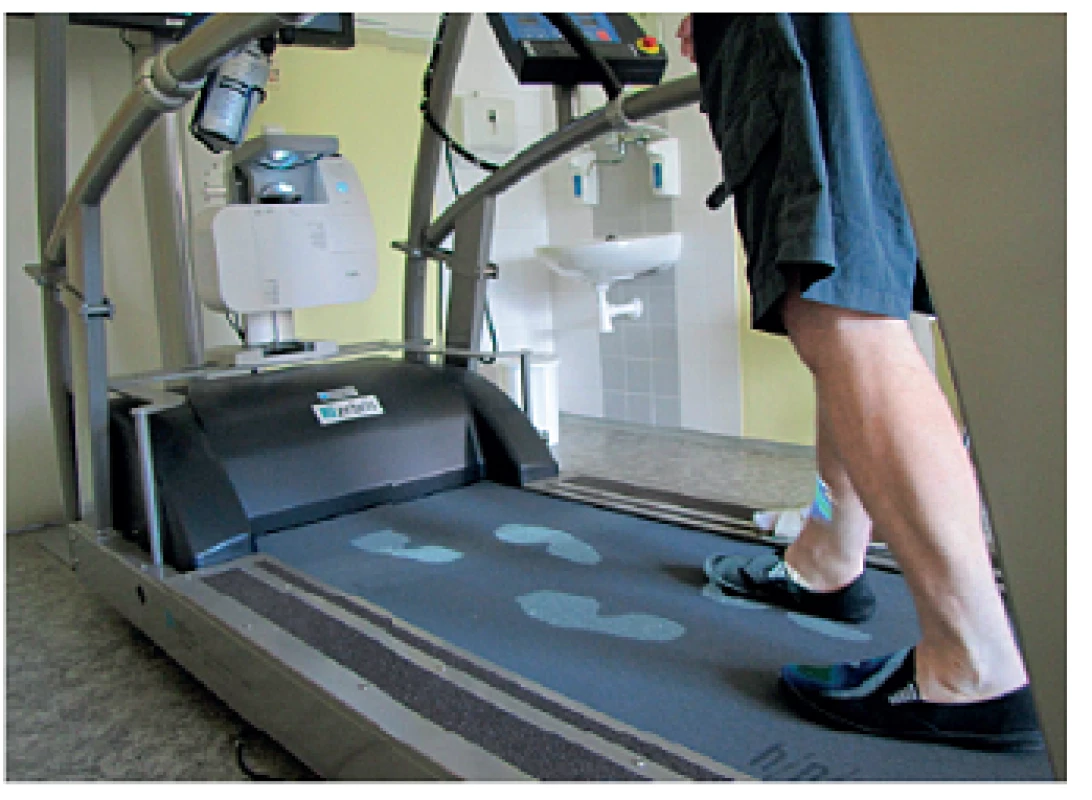
Příkladem tréninku chůze s využitím především vizuální zpětné vazby je přístroj HP Cosmos Zebris Treadmill FDM-T - představuje dynamický běžecký pás vybavený matricí senzorů tlaku s možností analýzy stoje i chůze. Data, která získáme, zahrnují doby jednotlivých krokových fází, rozložení zatížení na ploskách při klidném stoji i při chůzi, délku kroku, šířku kroku, úhel rotace chodidla, frekvenci a rychlost chůze, průmět těžiště do oporné báze v průběhu stoje i chůze a další (obr. 6).
6. Větší zatížení pat v klidném stoji u zdravého probanda, patrné je minimální kolísání průmětu těžiště do opěrné báze. 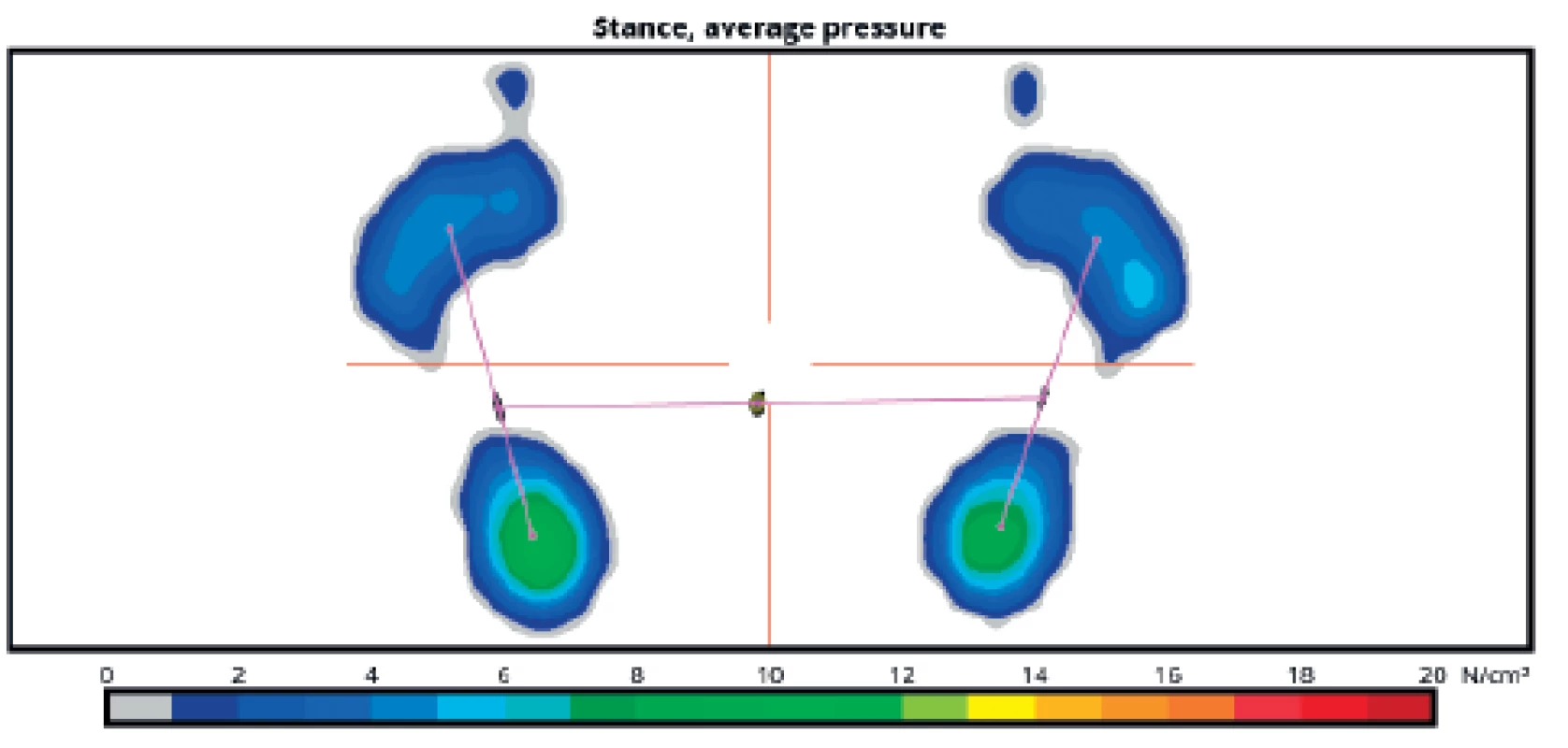
Průměty maximálního zatížení plosek během klidné chůze kopírují fyziologické odvíjení chodidla od podložky - začínají na patě a postupují přes laterální hranu chodidla k malíku a následně k palci, v případě průmětu těžiště do stojné báze obou dolních končetin vzniká linie tvaru motýlích křídel (obr. 7).
7. Fyziologický průmět těžiště do plosek nohou i do opěrné báze během chůze. 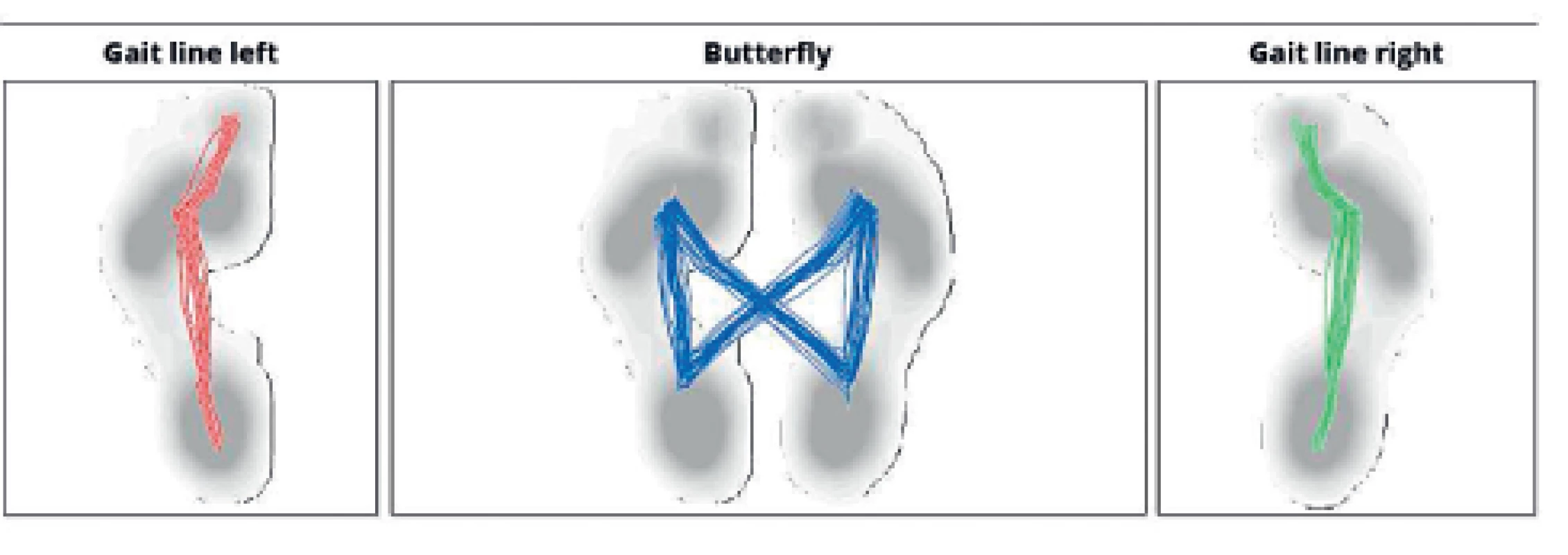
Díky možnosti ukládání dat lze přístroj využívat nejen k vlastnímu tréninku chůze, ale také k porovnávání naměřených dat získaných během rehabilitačního procesu. V případě zlepšování naměřených hodnot se jedná o prvek významně zvyšující motivaci pacienta k další spolupráci (24). Již při vstupním vyšetření je možno prostřednictvím vizuální zpětné vazby pacientovi poskytnout informace o nevhodném zatížení paretické nohy, což by sám o sobě nemusel dostatečně vnímat vzhledem k senzitivnímu postižení paretické strany, včetně nedostatečné aferentace z proprioreceptorů.
Analýza stoje
Na obrázku 8 je patrné srovnání parametrů analýzy klidného stoje u 56letého pacienta s levostrannou hemiparézou po ischemické cévní mozkové příhodě v povodí a. cerebri media vpravo. Při přijetí (levá část obrázku) je patrné velmi asymetrické rozložení zatížení na levé dolní končetině, kde prakticky chybí zatížení paty v důsledku levostranné hemiparézy. Již po 10 dnech intenzivní rehabilitace je viditelné významné zlepšení v rozložení zatížení paretické končetiny (pravá část obrázku). Stejný výsledek je patrný i na grafickém zobrazení (obr. 9), kde byl vstupní poměr zatížení přednoží: zánoží na LDK 100 : 0, kdežto v průběhu rehabilitace se změnil na 60 : 40. Z průmětu těžiště je patrná jeho původní výchylka ke zdravé DK, se zvýšenou oporou o LDK se již promítá více do středu opěrné báze, ale stále je patrné výrazné kolísání odpovídající ještě nedostatečné stabilitě stoje pacienta.
8. Porovnání analýzy stoje při přijetí pacienta (levá část) a v průběhu rehabilitace. 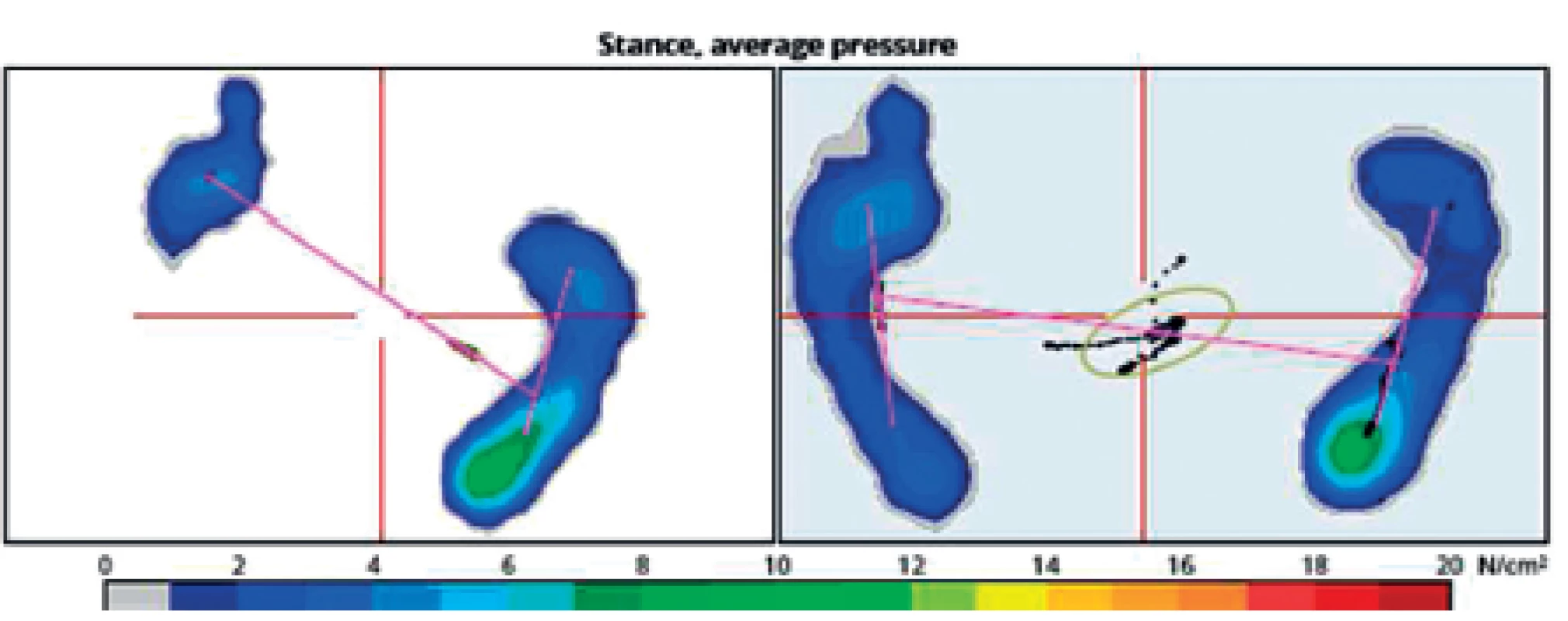
9. Grafické znázornění zatížení přední a zadní části nohy u pacienta s levostrannou hemiparézou. 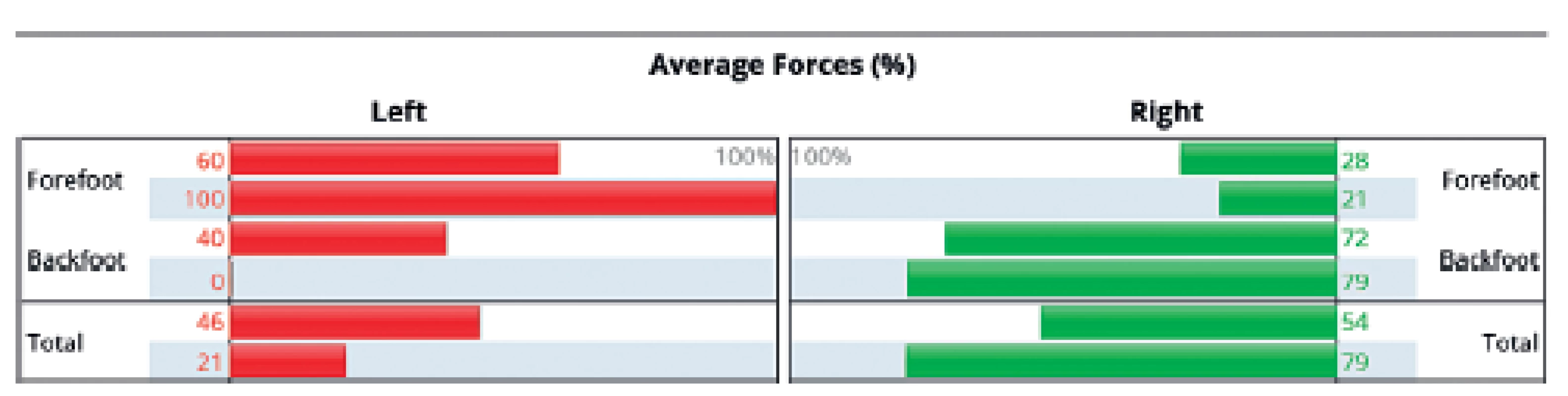
Analýza chůze
V rámci analýzy chůze lze hodnotit rozložení maximálních tlaků na ploskách, které by měly být největší na patě a přední části chodidla s poklesem v centrální části nohy. Obrázek 10 ukazuje průměty těžiště do báze plosky v průběhu chůze u pacienta s pravostrannou hemiparézou, kde je opět patrné chybějící zatížení paty s převahou došlapu přes přední část chodidla, což je zjevné i na chybějícím obrazu motýlích křídel.
10. Rozložení průmětů těžiště do chodidel v průběhu chůze pacienta s pravostrannou hemiparézou. 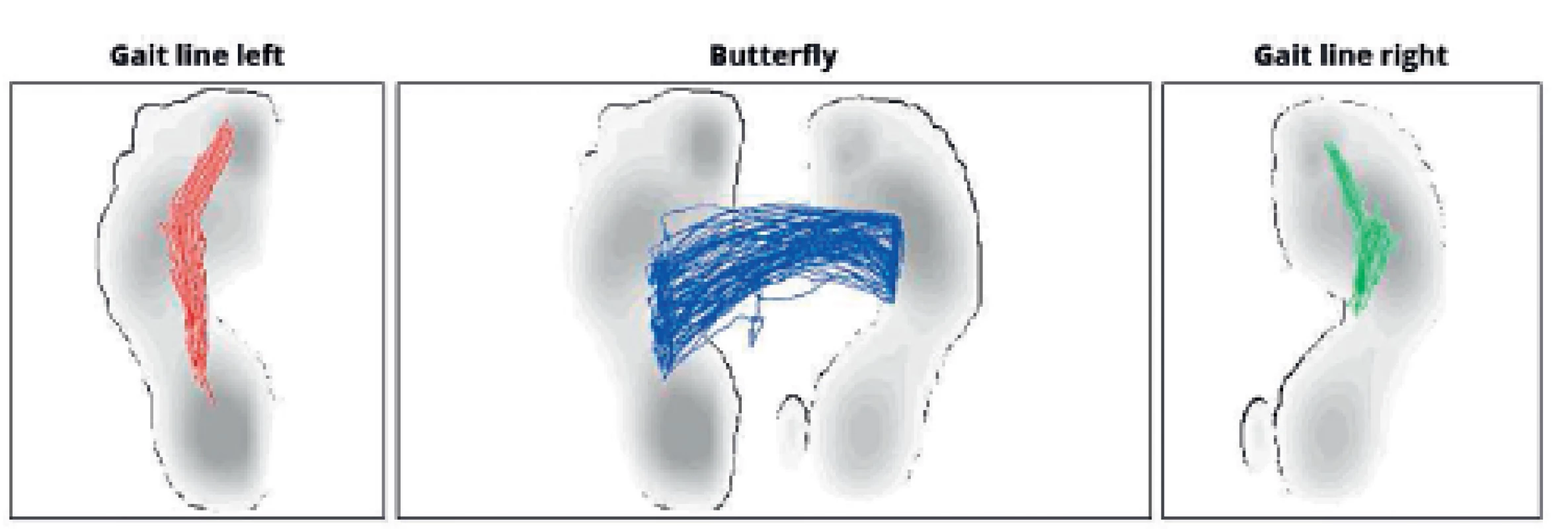
Na grafickém znázornění stojné fáze dolních končetin během chůze je zřetelně kratší doba stoje na paretické PDK oproti končetině zdravé, což je jedna z charakteristik chůze pacienta s hemiparézou, a zároveň je patrná tendence ke zvýšení symetričnosti chůze v průběhu rehabilitace (šedé řádky zahrnují kontrolní výsledky po 9 dnech). Opakovaným tréninkem se zvyšuje symetričnost chůze s vyšším zatížením paretické dolní končetiny (2) (obr. 11).
11. Analýza chůze u pacienta s pravostrannou hemiparézou. 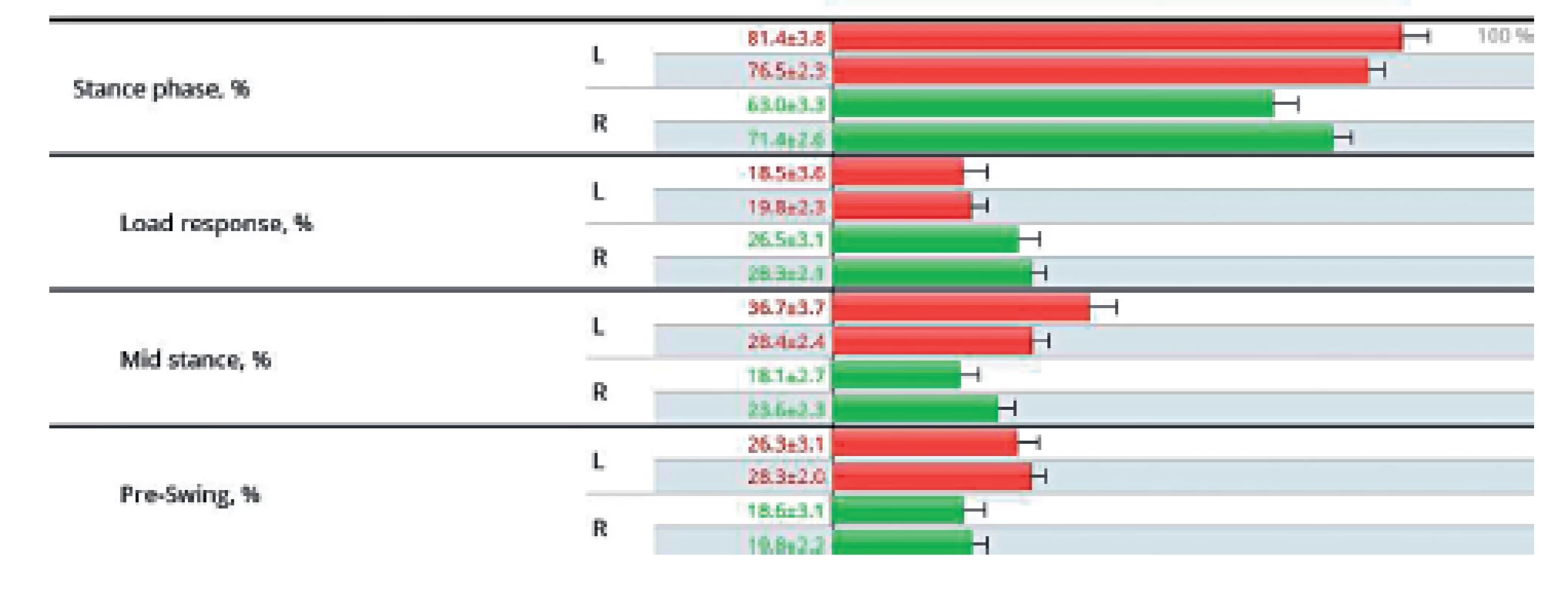
Trénink chůze
Při terapii pacientů s nedostatečnou stabilitou lze využít podpůrného závěsného aparátu (BWS, body weight support), který zvyšuje jistotu pacienta při chůzi. Jeho využitím se zmenšuje vertikální zatížení kolen pacienta a snižuje se riziko hyperextenze, která je u hemiparetických pacientů běžným jevem (11). Nácvik chůze s využitím BWS vede k efektivnějšímu zvýšení mobility než trénink bez odlehčení (10, 20, 29). Navíc snížení tělesné hmotnosti umožňuje selektivnější nácvik ideálního pohybového stereotypu bez nutnosti přenosu hmotnosti těla (31). Při tréninku chůze s využitím BWS došlo u probandů k prodloužení délky kroku o 14 % a rychlost chůze se zvýšila o 17 %, ale nezměnila se frekvence chůze. Tyto změny byly nejvýraznější při využití odlehčení hmotnosti o 10 %, při výraznějším odlehčení již zlepšení uvedených parametrů chůze nebylo tak výrazné (5).
Během tréninku chůze umisťuje pacient nohy co nejpřesněji na obrazy stop promítaných na plošinu (obr. 12). Lze nastavit požadované cílové parametry jako délku kroku, šířku kroku, rotaci chodidla, rychlost chůze apod. Následně lze opět graficky zpracovat procento úspěšnosti, neboli jak velkou plochu z promítaných stop pacient svým došlapem skutečně pokryl (obr. 13).
13. Procento pokrytí promítané plochy došlapem pacienta s pravostrannou hemiparézou. 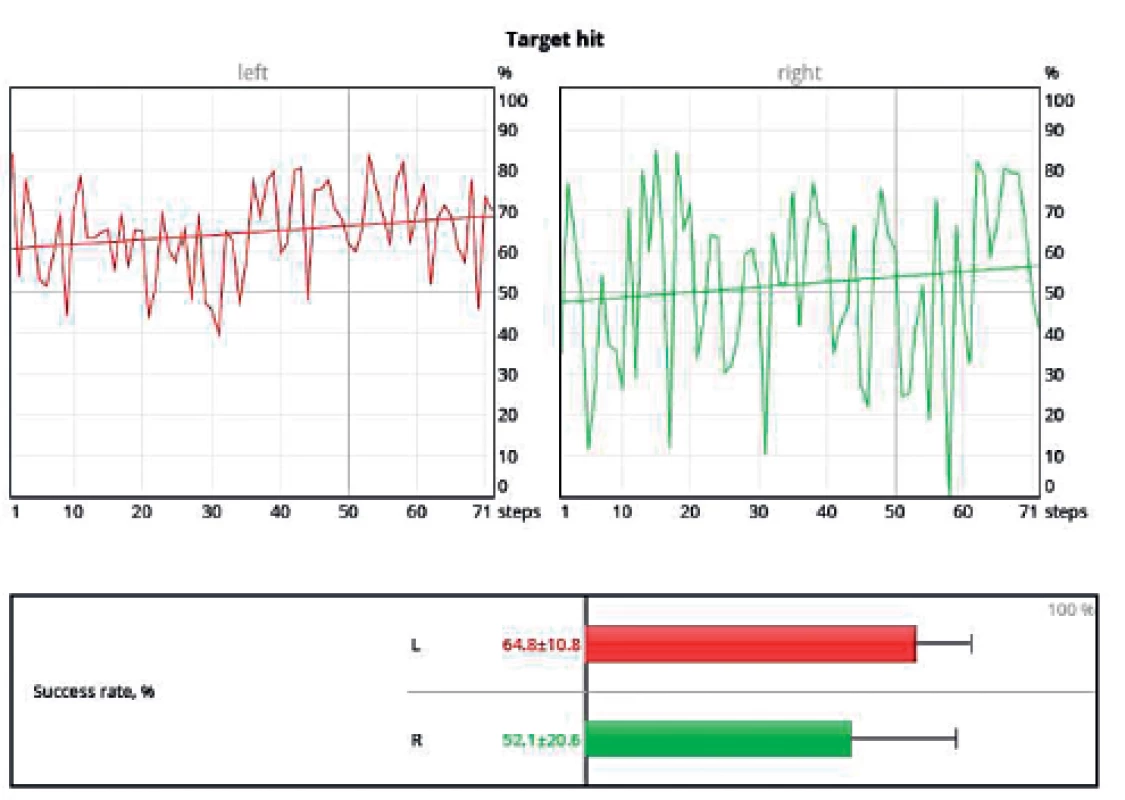
Další možností nácviku chůze je promítání virtuálního prostředí na obrazovku, kde pacient může sledovat své kroky v „terénu“ a překonávat zobrazené překážky. Pomocí akustické i vizuální zpětné vazby koriguje rychlost i směr chůze a rozložení silového zatížení na ploskách. Tato 3D zpětná vazba prostřednictvím virtuální reality usnadňuje motorické učení (14, 25) (obr 14).
14. Promítaná virtuální krajina v programu Forest Walk. 
Ke zlepšení stereotypu chůze při peroneální paréze u osob po CMP lze využít funkční elektrickou stimulaci (FES). Paréza peroneálního nervu vede k poklesu chodidla během švihové fáze kroku a následně k zakopávání či cirkumdukci. Řadou impulzů se vyvolává podráždění n. peroneus a následně tetanický stah m. tibialis ant. a dalších svalů anterolaterální skupiny na bérci, čímž dojde k dorzální flexi a everzi chodidla se zlepšením stereotypu chůze. Elektrostimulace ovlivňuje také aferentní vlákna periferního nervu a touto zpětnovazebnou informací dochází k facilitaci a přechodně lepšímu volnímu ovládání utlumených svalů (21). Je prokázán vyšší efekt kombinované terapie funkční elektrickou stimulací s využitím zpětné vazby oproti elektrostimulaci samotné (31).
V případě těžkých motorických postižení je možné využít i Lokomat. Jedná se o zařízení s řízenými robotickými ortézami, které v kombinaci s pohyblivým pásem a dynamickým systémem podpory těla umožňují nácvik chůze s téměř úplným vyloučením tělesné hmotnosti. Chůze je v tomto případě pasivním dějem, ale prostřednictvím proprioreceptorů získává centrální nervový systém pacienta zkušenost správného pohybu a dochází k reaktivaci lokomočních generátorů míchy a mezencefala. Nejvyšší efektivity dosahuje reedukace chůze u pacientů se středně těžkou parézou v časných fázích po iktu (12, 35). Zlepšuje se jejich koordinace pohybu, stabilita v solo stoji, rychlost chůze, reaktivita na zevní podněty i cílení pohybů (18). U chronických pacientů se středně těžkým až těžkým postižením chůze je oproti Lokomatu přínosnější kombinace několika standardně užívaných rehabilitačních konceptů založených na neurofyziologickém podkladě, kdy dochází k výraznějšímu zlepšení parametrů chůze (12).
DISKUSE
V rehabilitaci pacientů s poruchami chůze po prodělané cévní mozkové příhodě se využívá řada terapeutických postupů. Jejich množství nasvědčuje tomu, že žádná metoda není dokonalá a především, že je potřeba terapeutický přístup individualizovat přímo podle potřeb konkrétního pacienta. Dle celkového klinického stavu pacienta začínáme polohováním, správnou manipulací, pasivními pohyby v antispastických vzorcích a prevencí dekubitů a vzniku kontraktur. U nemocných s těžkým motorickým postižením nebo v akutních fázích po iktu, kdy pacient ještě není schopen vertikalizace, se využívají nejvíce fyzioterapeutické koncepty a metody jako Bobath koncept, proprioceptivní neuromuskulární facilitace, senzomotorická stimulace apod. Jakmile je pacient schopen vertikalizace, lze využít Balance Trainer k nácviku stability stoje a přenášení váhy na paretickou stranu. Po získání dostatečné stability ve stoji se začíná s nácvikem chůze. S výhodou se zařazuje trénink chůze na pohyblivém chodníku s využitím zpětné vazby ve formě vizualizace rozložení zátěže na ploskách dolních končetin i zobrazení stop v rámci krokového cyklu. Zpětná vazba představuje pro CNS důležitý impulz, který umožňuje lépe kontrolovat provádění pohybu. Zevní zpětná vazba dodávaná terapeutem nebo přístrojem může alespoň částečně nahradit insuficientní informace z receptorů vnitřní zpětné vazby, jež byly poškozeny iktem. Ukazuje se ale, že zpětná vazba by se neměla využívat při každé cvičební jednotce. Při jejím příliš častém využívání se na ní pacient stává „závislým“ a v konečném důsledku se může zhoršit jeho schopnost samostatné koordinace pohybů. S pomocí pohyblivého chodníku pacient trénuje chůzi po rovném podkladu bez překážek, může se tak plně soustředit jen na vlastní chůzi a využitím zpětné vazby je celý proces motorického učení a nácviku koordinace pohybů při chůzi intenzivnější. V rámci analýzy stoje a chůze daného pacienta lze získat údaje o délce kroku, délce dvojkroku, šířce kroku, délce jednotlivých fází krokového cyklu, frekvenci a rychlosti chůze, průmětu těžiště do opěrné báze atd. Objektivní zhodnocení těchto parametrů s možností srovnání výsledků po určitém čase intenzivní rehabilitace je pro pacienta, v případě zlepšení, motivujícím faktorem. Prostřednictvím projektoru je možné na pohyblivý pás promítat obrysy stop s předem nastavenými parametry chůze. Pacient je instruován k pokládání nohou na promítané stopy a získává tak vjem lepšího chůzového stereotypu. Prostřednictvím zpětné vazby tak získává další informace o prováděném pohybu, jeho přesnosti a koordinaci. Řada klinických studií prokazuje výraznější zlepšení parametrů chůze při rehabilitaci s využitím zpětné vazby než bez jejího zařazení do rehabilitačního programu.
Pohyblivý chodník je určen především pro počáteční fáze tréninku chůze, v případě nedostatečné stability pacienta je možné využít závěsného podpůrného systému, který pacienta zajistí ve vertikále. Významně se tak redukuje pocit strachu z pádu, který mnohdy vede k nežádoucímu zvýšení spasticity. Pohyblivý chodník negeneruje pohyby nohou, proto jeho použití předpokládá spontánní aktivitu korových i podkorových krokových center pacienta. Představuje idealizovaný umělý povrch, který nemůže pacienta plně připravit na chůzi ve venkovním prostředí. K nácviku plnohodnotné chůze je potřeba zařadit i trénink chůze v terénu, přes překážky, po schodech a v případě reziduálního motorického postižení s nedostatečnou stabilitou pacienta též nácvik chůze s využitím kompenzačních opěrných pomůcek.
Ke zlepšení stereotypu chůze při peroneální paréze u osob po CMP lze využít funkční elektrickou stimulaci k vyvolání dorzální flexe a everze chodidla se zmenšením cirkumdukce. Elektrostimulace ovlivňuje také aferentní vlákna periferního nervu a touto zpětnovazebnou informací dochází k facilitaci a zlepšení volního ovládání utlumených svalů. U těžce postižených pacientů neschopných samostatné chůze je možné využít Lokomat. V něm je pacient plně fixován a samotný přístroj generuje pohyby dolních končetin simulující chůzi. Pohyb je tak pro pacienta pasivní, ale prostřednictvím proprioceptivní zpětné vazby získává CNS informace o prováděném pohybu a usnadňuje se tak návrat volního ovládání chůze. Na druhou stranu u chronických pacientů po iktu se ukazuje přínosnější kombinace tradičních rehabilitačních konceptů v tréninku chůze než využití Lokomatu.
ZÁVĚR
Využití zpětné vazby v rehabilitaci pacientů s poruchami chůze po prodělané cévní mozkové příhodě prokazatelně zrychluje a zkvalitňuje rehabilitační proces, dosahuje se výraznějšího zlepšení parametrů chůze, krokového cyklu i stability při chůzi a ve stoji. Zpětná vazba nenahrazuje tradiční rehabilitační koncepty a metody a vždy je nutné ji využívat současně s klasickými postupy založenými na neurofyziologickém principu. Kombinace zpětné vazby a tréninku chůze na pohyblivém chodníku umožňuje pacientům nácvik správného stereotypu chůze po idealizovaném umělém povrchu dle předem nastavených parametrů (např. délka kroku, šířka kroku, rychlost a frekvence apod.). Zároveň je možné analyzovat tyto parametry u konkrétního nemocného v průběhu terapeutického procesu a získat objektivní zhodnocení efektivity rehabilitace. Terapeut tak získává účinný nástroj ke zvýšení motivace a zlepšení spolupráce pacienta. Metody zpětné vazby umožňují získat jednoznačná data potvrzující efektivitu terapie, což je v dnešní době evidence based medicine velmi podstatné.
Adresa ke korespondenci:
MUDr. Niko Burget
Rehabilitační oddělení KNTB, a.s.
Havlíčkovo nábřeží 600
762 75 Zlín
e-mail: niko.burget@
Sources
1. ALBERT, S. J., KESSERLING, J.: Neurorehabiliation of stroke. Journal of Neurology, 259, 2012, s. 817-832.
2. ARUIN, A. S. et al.: Compelled body weight shift approach in rehabilitation of individuals with chronic stroke. Top Stroke Rehabilitation, 19, 2012, 6, s. 556-563.
3. BANZ, R. et al.: Computerized visual feedback: an adjunct to robotic-assisted gait training. Physical Therapy, 88, 2008, 10, s. 1135-1145.
4. BELDA-LOIS, J. M. et al.: Rehabilitation of gait after stroke: a review towards a top-down approach. Journal of Neuroengineering and Rehabilitation, 66, 2011, 8.
5. BURGESS, J. K. et al.: Overground walking speed changes when subjected to body weight support conditions for nonimpairment and post stroke individuals. Journal of Neuroengineering and Reahabilitation, 6, 2010, 7.
6. DEIBERT, E. M., DROMERICK, A. W.: Motor restoration and spasticity management after stroke. Current Treatment Options in Neurology, 4, 2002, s. 427-433.
7. DOBBKIN, B. H., DORSCH, A.: New evidence for therapies in stroke rehabilitation. Cardiovascular Disease and Stroke, 15, 2013, s. 331-340.
8. ENG, J. J., TANG. P. F.: Gait training strategies to optimize walking ability in people with stroke: a synthesis of the evidence. Expert Review Neurotherapeutics, 10, 2007, 7, s. 1417-1436.
9. FERRANTE, S. et al.: A biofeedback cycling training to improve locomotion: A case series study based on gait pattern classification of 153 chronic stroke patients. Journal of Neuroengineering and Rehabilitation, 47, 2011, 8.
10. FORRESTER, L. W. et al.: Exercise-mediated locomotor recovery and lower-limb neuroplasticity after stroke. Journal of Rehabilitation Research and Development, 45, 2008, 2, s. 205-220.
11. HESSE, S.: Treadmill trainig with partial body weight support after stroke: a review. Neurorehbilitation, 23, 2008, s. 55-65.
12. Hidler, J. et al.: Multicenter randomized clinical trial evaluating the effectivnes of the Lokomat in subacute stroke. Neurorehabilitation and Neural. Repair., 25, 2009, 1, s. 5-13.
13. HUANG, H. et al.: Recent developments in biofeedback for neuromotor rehabilitation. Journal of Neuroengineering and Rehabilitation, 11, 2006, 3.
14. JOHNSON, M. J.: Recent trends in robot-assisted therapy environments to improve real-life functional performance after stroke. Journal of Neuroengineering and Rehabilitation, 29, 2006, 3.
15. KALVACH, P. a kol.: Mozkové ischemie a hemoragie. 3., přepracované a doplněné vydání. Praha, Grada Publishing, 2010, 456 s., ISBN 978-80-247-2765-3.
16. KERDONCUFF, V. et al.: Interest of visual biofeedback training in rehabilitation of balance after stroke. Annales de Réadaption et de Médecine Physique, 47, 2004, s. 169-176.
17. KOLÁŘ, P. et al.: Rehabilitace v klinické praxi. 1. vydání, Praha, Galén, 2009, 713 s., ISBN 978-80-7262-657-1.
18. KRISHNAN, CH. et al.: Active robotic training improves locomotor function in a stroke survivor. Journal of Neuroengineering and Rehabilitation, 57, 2012, 9.
19. LANGHORNE, P. et al.: Stroke rehabilitation. The Lancet, 377, 2011, s. 1693-1702.
20. Laufer, Y. et al.: The effect of treadmill training on the ambulation of stroke survivors in the early stages of rehabilitation: A randomized study. Journal of Rehabilitation Research and Development, 38, 2001, 1, s. 69-78.
21. LINDQUIST, A. R. R. et al.: Gait training combining partial body-weight support, a treadmill and functional electrical stimulation: effects on poststroke gait. Physical Therapy, 87, 2007, 9, s. 1144-1154.
22. LIPPERTOVÁ - GRÜNEROVÁ, M.: Neurorehabilitace. 1. vydání, Praha, Galén, 2005, 350 s., ISBN 80-7262-317-6.
23. LISINSKI, P. et al.: The body balance training effect on improvement of motor functions in paretic extremities in patients after stroke. A randomized, single blinded trial. Clinical Neurology and Neurosurgery, 114, 2012, s. 31-36.
24. LÜNENBURGER, L. et al.: Biofeedback for robotic gait rehabilitation. Journal of Neuroengineering and Rehabilitation, 1, 2007, 4.
25. MERIANZ, A. S. et al.: Virtual reality – augmented rehabilitation for patients following stroke. Physical Therapy, 82, 2002, 9, s. 898-915.
26. NEVŠÍMALOVÁ, S. et al.: Neurologie. 1. vydání, Praha, Galén, 2002, 368 s., ISBN 80-7262-160-2.
27. NICHOLS, D. S.: Balance retraining after stroke using force platform biofeedback. Physical Therapy, 77, 1997, 5, s. 553-558.
28. PEREZ, M. A. et al.: Changes in corticospinal drive to spinal motoneurons following visuo-motor skill learning in humans. The Journal of Physiology, 573, 2006, 3, s. 843-855.
29. SOUSA, C. O. et al.: The use of body weight support on ground level: an alternative strategy for gait training of individuals with stroke. Journal of Neuroengineering and Rehabilitation, 43, 2009, 6.
30. TATE., J. J., MILNER, C. E.: Real time kinematic, temporospatial and kinetic biofeedback during gait retraining in patients: a systematic review. Physical Therapy, 90, 2010, 8, s. 1123-1134.
31. TEASELL, R. W. et al.: Gait retraining post stroke. Top Stroke Rehabilitation, 10, 2003, 2, s. 34-65.
32. THAUT, M. H. et al.: Rhythmic auditory stimulation improves gait more than NDT/Bobath training in near-ambulatory patients early poststroke: A single-blind, randomized trial. Neurorehabilitation and Neural Repair, 21, 2007, 5, s. 455-460.
33. THAUT, M. H. et al.: Rhythmic facilitation of gait training in hemiparetic stroke rehabilitation. Journal of Neurological Science, 151, 1997, s. 207-212.
34. VAN VLIJET, P. M, et al.: Extrinsic biofeedback for motor learning after stroke: What is the evidence? Disability and Rehabilitation, 28, 2006, 13-14, s. 831-840.
35. WESTLAKE, K. P., PATTEN, C.: Pilot study of Lokomat versus manual-assisted treadmill training for locomotory recovery post-stroke. Journal of Neuroengineering and Rehabilitation, 18, 2009, 6.
36. Yavuzer, G. et al.: The effects of balance training on gait late after stroke: a randomized controlled trial. Clinical Rehabilitation, 20, 2006, s. 960-969.
37. ZIJLSTRA, A. et al.: Biofeedback for training balance and mobility tasks in older populatinos: a systematic review. Journal of Neuroengineering and Rehabilitation, 58, 2010, 7.
Labels
Physiotherapist, university degree Rehabilitation Sports medicine
Article was published inRehabilitation & Physical Medicine

2015 Issue 2-
All articles in this issue
- The Effect of Acral Coactivation Therapy on Expiratory Muscle Strength and Lower-chest-wall Motion
- Influence of Elastic Tape to Range of Motion During the Trunk Flexion
- Diagnostics and Basic Principles of Dysphagia Therapy after Resection of Oropharyngeal Region Tumors
- The Use of Biofeedback in Rehabilitation in Patients with Gait Disorders after Stroke
- Neuropathy of n. suprascapularis
- Fatigue Fracture in the Physiotherapist and Physician Practice
- Case Study of Patients with Parkinson’s Disease – Electromyographic Analysis of Walking in Various Environment: on Dry Land and in Water
- Rehabilitation & Physical Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fatigue Fracture in the Physiotherapist and Physician Practice
- The Effect of Acral Coactivation Therapy on Expiratory Muscle Strength and Lower-chest-wall Motion
- Diagnostics and Basic Principles of Dysphagia Therapy after Resection of Oropharyngeal Region Tumors
- The Use of Biofeedback in Rehabilitation in Patients with Gait Disorders after Stroke
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career