-
Medical journals
- Career
Preeklampsie dnes a zítra
: Karel Fousek
: Oddělení gynekologie a porodnictví, Městská nemocnice Ostrava, p. o.
: Prakt Gyn 2016; 20(3-4): 122-125
: Gynecology and Obstetrics
Preeklampsie je výhradně těhotenské onemocnění vznikající na podkladě defektní placentace. Ta způsobuje nerovnováhu antiangiogenních a proangiogenních látek jak v placentě, tak v krevním oběhu matky. V těle matky tak vzniká endoteliální dysfunkce, hypertenzní syndrom a řada navazujících stavů, které je možné diagnostikovat. Na základě těchto znalostí máme již v dnešní době efektivní screening preeklampsie v 1. trimestru těhotenství, který nám zároveň umožňuje nasadit účinnou prevenci jejího vzniku. Na druhou stranu však stále hledáme test, který by nám umožnil co nejefektivněji nejen diagnostikovat již probíhající preeklampsii, ale také stanovit riziko jejího vzniku v pozdějších fázích těhotenství. Velkou nadějí se v současnosti jeví bed-side test pomocí konžské červeně, tzv. Congo Red Dot Paper Test.
Klíčová slova:
ASA – konžská červeň – patofyziologie – preeklampsie – prevence – screeningÚvod
O preeklampsii (PE) bylo již ve všech odborných publikacích a periodicích napsáno mnohé a můžeme si být jistí, že ani do budoucna tomu nebude jinak. Jedná se přece jen o typicky těhotenské onemocnění s výskytem ve 2–8 % všech těhotenství [1], zatížené nejvyšší mateřskou i novorozeneckou morbiditou a mortalitou, u něhož neustále zjišťujeme, jak komplexní a závažné je. To z PE dělá objekt téměř nekonečného zájmu všech porodníků na celém světě. Přes veškerou vědeckou snahu však stále existuje mnoho otázek, které se kolem tohoto onemocnění, jeho vzniku, možností včasného odhalení a prevence, točí.
Tento článek má za úkol přiblížit současný a možná také budoucí přístup k PE právě v oblastech, které nás nejvíce tíží z klinického hlediska – screening (tedy včasné odhalení) a prevence (dostatečně včasná intervence s cílem minimalizovat či úplně potlačit její neblahé důsledky).
Patofyziologie preeklampsie
Základem léčby každého lidského onemocnění je co nejdokonalejší pochopení jeho vzniku a jeho patofyziologie. Jen to nám umožní cílit naše úsilí tím správným směrem a zasahovat v kritických bodech rozvoje daného onemocnění. Nejinak je tomu i u PE.
Jak je všeobecně známo, PE vzniká na podkladě narušené placentace, tedy nesprávné invaze trofoblastu do spirálních arterií deciduy. Konkrétně se jedná o druhou vlnu trofoblastické invaze v 16. až 20. týdnu těhotenství, při níž dochází k destrukci muskulární vrstvy spirálních arterií [2]. Tento moment je klíčový pro další rozvoj uteroplacentární cirkulace. „Správně obnažené“ spirální arterie jsou totiž schopny dilatace v pozdějších fázích těhotenství, čímž kryjí neustále narůstající požadavky vyvíjecího se plodu na dodávku kyslíku a dalších živin.
Pokud však k destrukci muskulární vrstvy spirálních arterií nedojde, ty se nemohou v dalších fázích gravidity dilatovat, rozvíjí se relativní ischemie placenty a vzniká tzv. placentární dysfunkce. Ta je charakterizována nadměrným uvolňováním antiangiogenních faktorů, jejichž hlavním zástupcem je solubilní fms-like tyrosinkinázový receptor 1 (sFlt-1). Ten za normálních okolností reguluje aktivitu proangiogenních faktorů, mezi které patří vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF) a placentární růstový faktor (placental growth factor – PLGF) [1,2]. Při rozvoji placentární dysfunkce, kdy dochází k převaze sFlt-1 nad VEGF a PLGF, je tento receptor také nadměrně uvolňován do krevního řečiště matky a v něm (spolu s dalšími látkami) způsobuje generalizovanou endoteliální dysfunkci.
Endoteliální dysfunkce v těle matky způsobuje řadu následků, které jsme již schopni odhalit a na jejich základě PE diagnostikovat [1]. Základním důsledkem endoteliální dysfunkce je hypertenze matky vznikající na podkladě dysregulace vazodilatace a vazokonstrikce v mateřském řečišti. Ta spolu s převahou antiangiogenních mediátorů dává vzniknout hypertenznímu syndromu se všemi jeho následky a projevy.
V ledvinách způsobuje hypertenzní syndrom matky tzv. glomerulární endoteliózu, která vede k narušené glomerulární filtraci, zvýšenému odpadu bílkovin do primární moči a jejich snížené resorpci v tubulech. Tím vzniká typická proteinurie. V játrech pak dochází k poškozování jaterních sinusoid s nekrózou hepatocytů různého rozsahu. To se projevuje elevací jaterních transamináz, otokem jater a bolestí v pravém hypochondriu. Nadměrná propustnost cév na podkladě endoteliální dysfunkce dále způsobuje řadu pozorovatelných následků, jako je zhoršené vidění, otoky končetin, příp. u nejtěžších stavů anasarka.
Pokud se vrátíme zpět k placentě a materno-fetální látkové výměně, logicky je i plod postižen vzniklou placentární dysfunkcí. A platí zde úměra, že čím dříve k rozvoji PE dojde, tím více je plod a jeho vývoj narušen. Typickým následkem je zpomalování růstu plodu, centralizace krevního oběhu a rozvoj oligohydramnia.
Časná vs pozdní preeklampsie
Přes tyto více či méně známé informace však stále naléhavěji vyvstává otázka, zda je tento patofyziologický mechanizmus podkladem PE v kterékoli fázi těhotenství. Jak známo, PE v klinické praxi dělíme podle 2 různých pohledů: buď z hlediska její klinické tíže (střední nebo těžká) [3] nebo podle fáze těhotenství, ve které vzniká (časná – do 34. týdne, pozdní – po 34. týdnu). A právě toto dělení podle stáří těhotenství se začíná ukazovat jako klíčové ve smyslu odlišné patofyziologie i dopadů na tělo matky.
Oproti časné formě je pozdní PE spojena s mírnějším klinickým průběhem na straně matky a je také spojena s podstatně menším poškozením vývoje plodu. Dále se odlišuje i horšími možnostmi screeningu [1,4] a výrazně menšími chronickými následky na straně matky (viz dále). Ženy s časnou PE – a především rekurentní časnou PE – vykazují známky perzistující systolické i diastolické dysfunkce myokardu a jsou obecně vystaveny vyššímu riziku kardiovaskulárních onemocnění v pozdějším věku [5].
Je tedy otázka, zda je pozdní PE „pouze“ mírnější formou časné PE s pouze mírně narušenou invazí trofoblastu do spirálních arterií deciduy nebo zda se jedná o samostatnou nozologickou jednotku s odlišnou patofyziologií a jen shodnými klinickými příznaky. Odpověď na tuto otázku nám pravděpodobně přinese až budoucnost.
Screening a prevence v 1. trimestru
V dnešní době můžeme pozorovat stále větší počet center nabízejících těhotným screening preeklampsie v rámci standardního prvotrimestrálního screeningu mezi 11.–14. týdnem těhotenství. V rámci něj jsou dopplerovsky vyšetřeny uterinní arterie, změřen krevní tlak těhotné dle předepsaného schématu, doplněna anamnéza rodinná, osobní i porodnická a laboratorně vyšetřen jeden z proangiogenních faktorů – PLGF (doplnění již vyšetřovaného PAPP-A). Tento screening je velmi dobře schopen odhalit rizikové těhotné z hlediska časné formy PE (a s tím spojené časné růstové restrikce plodu) s přesností 90–95 % s pouze 5–10% falešnou pozitivitou. Naproti tomu jen 45 % těhotných s rizikem pozdní PE je tímto testem zachyceno [1,4].
Přestože tento screeningový test není zdaleka tak rozšířen jako základní prvotrimestrální screening, jeho význam je nepopiratelný. Je totiž schopen identifikovat rizikové těhotné ještě v době, kdy můžeme účinně zasáhnout před samotným spouštěcím momentem vzniku PE. Jak bylo zmíněno výše, tím je 16.–20. týden těhotenství, kdy dochází k druhé vlně trofoblastické invaze. Proto v případě zahájení prevence před 16. týdnem jsme schopni snížit incidenci PE o více než 50 % a v případě časné PE dokonce o 80 %. Naproti tomu při zahájení po 19. týdnu již vznik PE prakticky neovlivníme [6,7].
Dnes již známou prevencí PE je podávání kyseliny acetylsalicylové (ASA) v dávce 100 mg p.o. 1krát denně, prevence by měla být zahájena co nejdříve po pozitivním screeningu. Ukončení užívání je pak v současné době rozebíranou otázkou. Minimální hranicí je 34. týden těhotenství, diskutuje se však spíše o 36. týdnu jako o vhodnějším termínu (období od 34.–36. týdne je bráno jako „šedá zóna“ mezi časnou a pozdní formou).
Další oblastí, v níž zatím nemáme úplně jasno, je denní dávka ASA. Dnes je standardně doporučována ASA v množství 100 mg denně, nicméně víme, že v naší populaci existuje velká část tzv. non-responderů na tuto dávku ASA [8]. U těchto žen by tak měla být doporučována ASA v dávce 150 mg denně. Zda však je toto množství stále bezpečné, účinné a vhodné k širokému uplatnění, je otázka, na kterou se nyní snaží nalézt odpověď studie ASPRE společnosti Fetal Medicine Foundation [9].
Screening a prevence ve 2. a 3. trimestru
Obecně lze říci, že v této oblasti zatím otázky převládají nad odpověďmi. Přestože se zkouší celá řada diagnostických metod, žádná z nich se zatím nedostala do běžné praxe.
Ve 2. trimestru jsou testovány tyto metody [1]:
- pulzatilní index (PI) uterinních arterií bez nebo s přítomností tzv. notchů (zářezů)
- laboratorně stanovený poměr sFlt-1 a PLGF
- vyšetřování dalších biochemických hodnot, jako je inhibin A, aktivin A, PAPP-A aj
Ve 3. trimestru je situace ještě méně jasná. Uvažuje se především o kombinaci těchto metod [1]:
- hodnocení PI v umbilikálních arteriích (jeho zvýšení)
- snížené PLGF
- hodnocení středního arteriálního tlaku matky
Byť je screening PE ve 2. a 3. trimestru detailně zkoumanou oblastí, má jedno zásadní omezení – rizikovým pacientkám v současnosti neumíme nabídnout nic jiného než sledování a včasnou korekci symptomů (především ve smyslu antihypertenzní medikace). Čas k efektivnímu zásahu z hlediska patofyziologie již vypršel.
Nicméně i vědomí, že je těhotná žena vysoce ohrožena rozvojem PE nám dává možnost upravit další management jejího těhotenství a v neposlední řadě nám poskytuje základnu k dalším studiím zaměřeným na co nejefektivnější léčbu PE v jejích iniciálních fázích.
Konžská červeň – nečekaný zachránce?
Vzhledem ke všem omezením dosavadních screeningových i diagnostických testů na PE je logické, že se vědci po celém světě neustále snaží nalézt takovou vyšetřovací metodu, která by splňovala několik základních kritérií – vysokou senzitivitu, specificitu, pokud možno také vysokou pozitivní i negativní prediktivní hodnotu a širokou dostupnost, nejlépe ve formě bed-side testu.
Do současné doby bylo s větším či menším úspěchem testováno mnoho takových metod, z nichž se naprostá většina orientuje na přítomnost, nepřítomnost či poměr anti - nebo proangiogenních faktorů v moči nebo séru. Je zde možné zmínit test založený na poměru sFlt-1/albumin v moči [2], poměr sFlt-1/PLGF v séru [1], poměr protein/kreatinin v moči aj. Žádný z nich se však zatím nedočkal širšího uplatnění.
Zlom v diagnostice i predikci PE však možná nastal nyní. Skupina vědců z Ohio State University totiž na výroční konferenci americké Society for Maternal Fetal Medicine v únoru 2016 prezentovala závěry své pilotní studie zaměřené na rychlý, tzv. point-of-care test, který spočíval v použití diagnostického „papírku“, napuštěného konžskou červení (Congo Red Dot Paper Test – CRDPT) [10].
Při konstrukci tohoto vyšetřovacího papírku vycházeli vědci z poznatku, že bílkoviny, které se dostávají do moči u žen s již rozvinutou nebo hrozící PE, mají charakteristicky změněnou konformaci. Tato odlišná prostorová struktura pak umožňuje reakci těchto bílkovin s konžskou červení, běžně dostupným barvivem histologických preparátů.
Kromě toho lékaři z Ohio State University již v minulosti s konžskou červení pracovali – avšak pouze laboratorně (v tab. „CRD test nitrocellulose“). Nyní však byl jejich cílem takový test, který by byl běžně dostupný, ihned připravený k použití – tak, jako již dnes máme k dispozici bed-side testy k průkazu předčasného odtoku plodové vody či rizika předčasného porodu.
1. Porovnání výsledků CRDPT s jinými dostupnými testy na preeklampsii 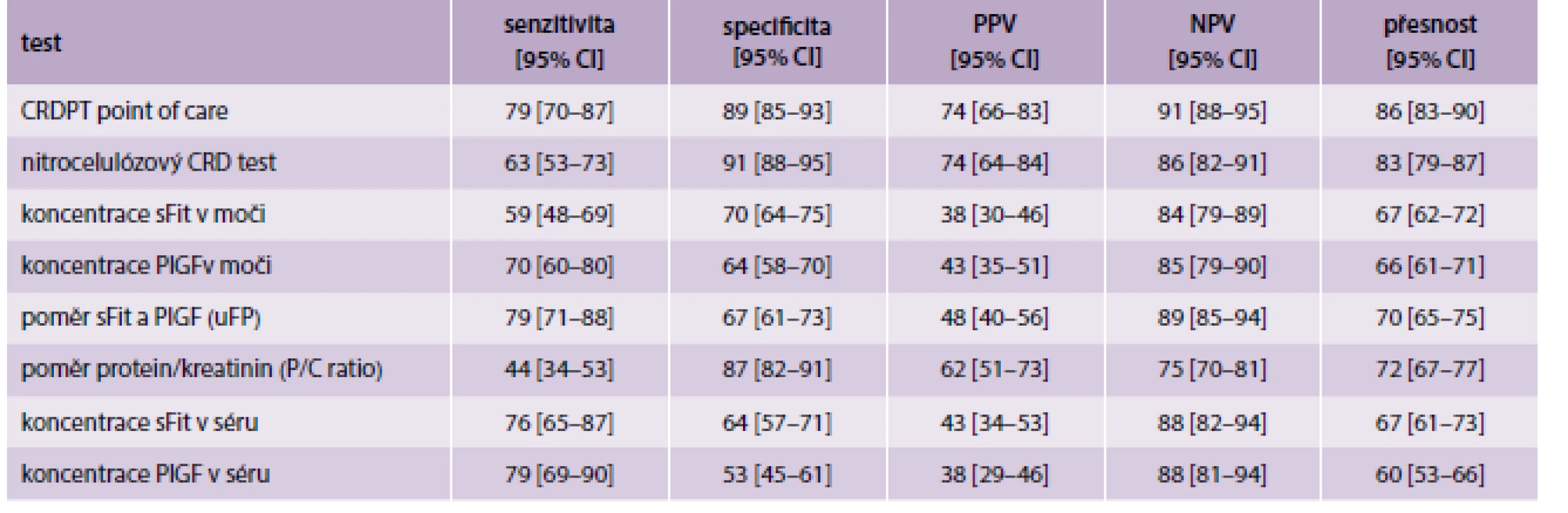
Do aktuálně citované studie bylo zahrnuto 346 těhotných jak se známkami PE, tak i bez nich. Od všech byla čerstvá moč nanesena na papírek napuštěný konžskou červení a výsledek byl následně zaslepeně porovnáván s výsledky získanými jinými dostupnými metodami diagnostiky a predikce PE. Těmi byly: koncentrace sFlt-1 a PLGF v moči nebo séru (a jejich poměr v moči – uFP), poměr protein/kreatinin v moči a zmíněný laboratorní test s konžskou červení na nitrocelulóze.
Jak je možné vyčíst z tab., CRDPT byl ve všech sledovaných parametrech nejlepší. Vztah senzitivity a specifity je následně graficky zobrazen na grafu.
1. Závislost senzitivity CRDPT na jeho specifitě 
Za zmínku rozhodně stojí vysoká negativní prediktivní hodnota CRDPT (91 %!) a zjištění, že mezi pozitivním „papírkovým“ testem a porodem byla latence v průměru 14 (4–35) dnů.
Protože je však tento test zatím pouze ve fázi klinického testování a patentové registrace, bude ještě nějakou dobu trvat, než se dostane do běžné klinické praxe. Zároveň byla tato studie publikována jako abstrakt z konference bez detailnějších informací, např. po jak dlouhou dobu je test schopen rozvoj PE vyloučit v případě negativity.
V případě, že i další výzkum a studie potvrdí výše uvedené parametry, dostaneme do rukou konečně nástroj, který splní požadavky jak screeningu (vznikne PE?), tak i diagnostiky (má daná těhotná PE?).
Závěr
Přes veškerý pokrok na poli ultrazvukové a laboratorní diagnostiky v posledních letech PE patří a dlouhou dobu ještě bude patřit mezi nejvážnější a nejčastější onemocnění v těhotenství. Již dnes jsme ale svědky úžasného pokroku v chápání její patofyziologie a klíčových momentů jejího rozvoje. Do budoucna tak můžeme očekávat, že bude kladen ještě větší důraz na odhalování prvotních vyvolávajících faktorů (genetika?, porucha lipidového metabolizmu?, vliv oxidativních pochodů?), na včasnější záchyt rizikových těhotných, na lepší management těchto žen i těch s již rozvinutou PE a na předcházení chronickým následkům v dalším životě žen s anamnézou PE.
Do té doby se však musíme spokojit s tím, co máme – rozhodně však toho není málo. I když v běžné české praxi nepoužíváme nejnovější diagnostické postupy, jako je stanovování sFlt1, PLGF nebo jejich poměrů (pro jejich ekonomickou náročnost), můžeme i v rámci naší praxe těhotným nabídnout službu, která má význam, je moderní a přináší hmatatelné výsledky. A tím je screening PE v 1. trimestru. Ano, toto vyšetření má svá omezení. Nic lepšího však v současné době nemáme k dispozici. Proto nabízejme toto vyšetření všem našim těhotným pacientkám a snažme se o co největší rozšíření tohoto screeningového programu.
Doručeno do redakce 5. 6. 2016
Přijato po recenzi 25. 8. 2016
MUDr. Karel Fousek
karel.fousek@mnof.cz
Oddělení gynekologie a porodnictví,
Městská nemocnice Ostrava, p.o.
www.mnof.cz
Sources
1. Leahomschi S, Calda P. Preeklampsie v těhotenství – predikce, prevence a další management. Čes Gynek 2014; 79(5): 356–362.
2. Norwitz E, Buhimschi, IA, Bhandari V et al.. Preeklampsie: screeningový test z moči. Gynekologie po promoci 2007; 7(4): 20–23.
3. Hájek Z, Čech E, Maršál K et al. Porodnictví. 3. ed. Grada Publishing: Praha 2014. ISBN 978–80–247–4529–9.
4. The Fetal Medicine Foundation. Advances in Fetal Medicine Course. London 2016. Dostupné z WWW: <https://fetalmedicine.org>.
5. Valensise H, Lo Presti D, Gagliardi G et al. Persistent Maternal Cardiac Dysfunction after Preeclampsia Identifies Patients at Risk for Recurrent Preeclampsia. Hypertension 2016; 67(4): 738–742.
6. Bujold E, Roberge S, Lacasse Y et al. Prevention of preeclampsia and intrauterine growth restriction with aspirin started in early pregnancy: a meta-analysis. Obstet Gynecol 2010;116(2 Pt 1): 402–414. Dostupné z DOI: <http://dx.doi.org/10.1097/AOG.0b013e3181e9322a>.
7. Roberge S, Villa P, Nicolaides K et al. Early Administration of Low-Dose Aspirin for the Prevention of Preterm and Term Preeclampsia: A Systematic Review and Meta-Analysis. Fetal Diagn Ther 2012; 31(3): 141–146. Dostupné z DOI: <http://dx.doi.org/10.1159/000336662>.
8. Caron N, Rivard GE, Michon N et al. Low-dose ASA response using the PFA-100 in women with high-risk pregnancy. J Obstet Gynaecol Can 2009; 31(11): 1022–1027.
9. The Fetal Medicine Foundation. Randomized Trials – ASPRE. London 2016. Dostupné z WWW: <https://fetalmedicine.org/research/randomized-trials/aspre-1>.
10. Rood K, Buhimschi CS, Dible T et al. 34: Point-of-care Congo Red Dot (CRD) Test for Antenatal Triage and Rapid Identification of Preeclampsia (PE). Am J Obstet Gynecol 2016; 214(Suppl 1): S24–S25. Dostupné z DOI: <http://dx.doi.org/http://dx.doi.org/10.1016/j.ajog.2015.10.058>.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2016 Issue 3-4-
All articles in this issue
-
Cardiovascular changes in pregnancy II.
Preeclampsia and its long-term consequences for mother and offspring - Conservative therapy of interstitial pregnancy with the use of methotrexate – case study
- Preeclampsia today and tomorrow
- Can semi-quantitative analysis of amniotic fluid glucose be useful in gynecology and obstetrics? A pilot study.
- Pain-free childbirth in 2016
- Fear of pregnant women
- Physiotherapy after gynecologic abdominal surgery
- Selected psychometric properties of the Czech Version of the FACT-B Scale (Version 4) for Measuring Quality of Life in Breast Cancer Patients
-
Cardiovascular changes in pregnancy II.
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Physiotherapy after gynecologic abdominal surgery
- Conservative therapy of interstitial pregnancy with the use of methotrexate – case study
- Preeclampsia today and tomorrow
- Pain-free childbirth in 2016
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

