-
Medical journals
- Career
Očkování žen proti lidským papilomavirům: výsledky studie v České republice (vstupní data)
Authors: Eva Hamšíková 1; Jana Šmahelová 1; Viera Ludvíková 1; Martina Saláková 1; Jana Rychlá 1; Jana Skřenková 2; Lukáš Rob 3; Ruth Tachezy 1
Authors‘ workplace: Oddělení experimentální virologie, NRL pro papilomaviry, Ústav hematologie a krevní transfuze, Praha 1; Gynekologicko-porodnická klinika, 1. LF UK a VFN, Praha 2; Gynekologicko-porodnická klinika, 2. LF UK a FN Motol, Praha 3
Published in: Prakt Gyn 2014; 18(4): 230-235
Category: Gynecology and Obstetrics
Overview
Vysoce rizikové typy lidských papilomavirů (HR-HPV) jsou kauzálně spojeny s karcinomem děložního hrdla (KDH) a částí dalších malignit. Současně dostupné HPV-vakcíny obsahují antigeny dvou HR HPV – HPV16 a HPV18 zodpovědných v ČR za více než 70% KDH. Cílem studie bylo sledování výskytu znaků HPV-infekce ve vakcinované populaci, detekce předchozí, současné a přetrvávající HPV-infekce a sledování vlivu vakcinace na následnou HPV-infekci a vznik atypických nálezů na děložním hrdle. Zde prezentujeme výsledky prevalence znaků HPV-infekce při vstupu do studie. Celkem jsme nalezli 37,4 % HPV-DNA-pozitivních jedinců, polovinu séropozitivních žen proti některému z testovaných antigenů a téměř čtvrtinu s protilátkami proti typům HPV16/18. Současnou/přetrvávající/předchozí infekci typy HPV16/18 jsme nalezli u 4,7 %/6,7 %/15,4 % žen. Snížením účinnosti vakcín proti HPV16/18 je v naší studii ohroženo 11,4 % sledovaných, s nejvyšším rizikem ve věkové skupině 24–26 let (22,6 %).
Klíčová slova:
HPV – HPV-DNA – infekce – protilátky – vakcinaceÚvod
Lidské papilomaviry (human papillomaviruses – HPV), malé, neobalené viry, provázejí člověka po celou dobu jeho vývoje. Prudký rozvoj jejich studia následoval po objevu dvou typů HPV – HPV16 a HPV18 v buňkách karcinomu děložního hrdla (KDH) [1,2], onemocnění, u kterého byla prokázána epidemiologickými studiemi v polovině minulého století souvislost se stylem sexuálního života. V současné době je jasné, že vysoko rizikové typy HPV (HR-HPV) jsou etiologickým faktorem velké většiny případů KDH, nemalého podílu nádorů v anogenitální oblasti člověka (karcinomy vulvy, vaginy, penisu, anu) a přibližně čtvrtiny nádorů v oblasti hlavy a krku, převážně v oblasti orofaryngu. Odhaduje se, že přibližně 5 % všech nádorových onemocnění člověka je vyvoláno HPV [3].
Nejčastěji nacházený typ HPV16 je v globálním měřítku zodpovědný za 62,6 %, následovaný typem HPV18 s 15,7 % a HPV45 s 5,5 % případů KDH [4]. Od roku 2006 a 2007 jsou dostupné preventivní HPV-vakcíny, které obsahují antigeny obou onkogenních typů HPV16 a HPV18 a jedna z nich dále antigeny dvou nízko rizikových (LR) typů – HPV6 a HPV11, zodpovědných za více než 90 % případů genitálních bradavic a prakticky všech případů rekurentní laryngeální papilomatózy, vzácného onemocnění charakterizovaného vysokou morbiditou.
Rozsáhlé klinické studie i následné sledování subjektů z těchto studií prokázaly, že obě vakcíny jsou bezpečné, vyvolávají tvorbu vysokých hladin protilátek proti antigenům obsaženým ve vakcínách a do určité míry i proti některým fylogeneticky příbuzným typům HPV a chrání příjemce, kteří jsou HPV-naivní v průběhu očkování, proti incidentní i persistentní HPV-infekci a před vznikem lézí s těmito typy asociovanými, a to až v horizontu 8 let [5]. V současné době jsou ukončeny hlavní klinické studie III. fáze s nonavalentní vakcínou firmy Merck Sharp & Dohme Corp., která kromě antigenů HPV-typů obsažených v kvadrivalentní vakcíně obsahuje ještě antigeny dalších 5 onkogenních typů – HPV31, 33, 45, 52 a 58. Pokud bude uvolněna pro komerční použití, měla by nonavalentní vakcína zabránit ve srovnání s vakcínou kvadrivalentní vzniku o téměř 20 % více případů KDH.
Určitou nevýhodou preventivních vakcín proti HPV je to, že jejich vysoká účinnost je prokazována u dívek a žen, které byly vakcinovány před zahájením pohlavního života. U těch, které již pohlavně žijí, je riziko incidentní či perzistentní infekce celým spektrem HPV-typů zvýšené. Bylo prokázáno, že účinnost vakcín v takové populaci žen je výrazně nižší. Promořenost populace HPV-infekcí významně ovlivňuje efektivitu vakcíny u sexuálně aktivních žen, přičemž procento žen ohrožených nulovou, či sníženou účinností vakcíny se mezi populacemi může lišit a dále se může měnit s časem, v závislosti na „proočkovanosti“ populace danou vakcínou. Sledování výše uvedených parametrů je tedy součástí epidemiologické surveillance HPV-infekcí v dané populaci.
Výsledky naší studie by měly sloužit jako podklady pro odbornou veřejnost. Zvláště důležité je, že tato studie je provedena na skutečné populaci, a reflektuje tedy skutečnou situaci v praktických podmínkách v České republice (ČR). Znalost rizika výskytu vakcinačních HPV-typů, především ve formě přetrvávající či současné infekce v dané populaci, poskytne informace lékařům, které umožní zkvalitnit management klientek podstupujících vakcinaci proti HPV. Zároveň díky standardizovaným postupům jsou výstupy této studie srovnatelné s dalšími studiemi z jiných zemí a populací. V neposlední řadě jsou výsledky této národní studie nezbytné pro rozhodovací proces o zavedení a optimalizace systémů prevence KDH v naší republice a další monitorování případných změn v prevalenci a distribuci HPV-typů v ČR v závislosti na zavádění a modifikaci programů primární a sekundární prevence KDH.
Jedním z konkrétních cílů naší studie bylo zjistit před podáním první dávky vakcíny výskyt typů HPV a prevalenci HPV-specifických protilátek v populaci dívek a žen, které se rozhodly pro individuální očkování proti HPV, dále zjistit výskyt předchozí, současné a přetrvávající infekce HR-typy HPV obsaženými ve vakcíně, neboť probíhající infekce může mít vliv na účinnost vakcinace. V průběhu sledování jsme zjišťovali novou nebo přetrvávající HPV-infekci, vyčištění infekce a akvírování dalšího typu/ů HPV, a to hlavně s ohledem na vakcinální typy HPV a změny v hladinách specifických protilátek vyvolaných aplikací vakcíny.
Materiál a metody
Sledovaná populace
Do studie jsme zahrnuli sexuálně aktivní dívky a ženy, které se v období 2007–2012 rozhodly pro očkování proti HPV vakcínou dle vlastního výběru. Před vstupem do studie podepsaly informovaný souhlas s účastí ve studii, u nezletilých byl informovaný souhlas podepsán zákonným zástupcem. Studie byla schválena Etickou komisí Ústavu hematologie a krevní transfuze.
Do studie celkem vstoupilo 256 dívek a žen ve věku 15–49 let (průměrný věk 23,3 roku), které jsme rozdělili do celkem 6 věkových skupin (15–17 let, 18–20 let, 21–23 let, 24–26 let, 27–30 let a více než 30 let). Před aplikací první dávky vakcíny byl všem zúčastněným odebrán vzorek krve na detekci protilátek proti HPV, stěr z děložního hrdla na detekci přítomnosti HPV-DNA a v případě, že nebyl k dispozici výsledek cytologického vyšetření mladší 3 měsíců, ještě stěr k cytologickému vyšetření.
Stejné odběry byly/budou opakovány 1 rok, 3 roky a 5 let po aplikaci poslední, 3. dávky vakcíny.
Stanovení HPV-DNA
Detekci HPV-DNA jsme prováděli pomocí polymerázové řetězové reakce (PCR) se směsí primerů BSGP5+ a BSGP6+ značených na 5´-konci biotinem, které generují 150pb amplikony z oblasti kapsidového genu L1 [6]. Přítomnost a integrita DNA byla ověřena amplifikací lidského beta-globinového genu s primery MS3/MS10bio. Pro určení genotypů HPV jsme použili metodu reverzní membránové hybridizace (RLB – reverse line blot), která umožňuje detekci 37 typů HPV a současně také stanovení vícečetných infekcí [7,8]. Typizaci vzorků negativních hybridizační metodou RLB, ale jasně pozitivních na gelu, jsme prováděli sekvenací. Všechny vzorky DNA byly zároveň vyšetřeny pomocí PCR s primery MY09/11 a HMB01, které amplifikují 450pb oblast L1 genu a umožňují detekci širokého spektra slizničních HPV typů [9]. Analýzu PCR produktů jsme prováděli elektroforézou na 3% agarózovém gelu. U vzorků s diskrepantním výsledkem, RLB hybridizační metodou negativní a MY09/11 HMB01 PCR-pozitivní, jsme typ HPV stanovovali sekvenací.
Stanovení protilátek proti HPV
Přítomnost specifických protilátek proti HPV jsme testovali pomocí testu ELISA [10,11]. Viru-podobné částice (virus-like particles – VLP), odvozené z HPV6, 11, 16, 18, 31 a 33, připravené z L1-kapsidového proteinu příslušného typu HPV v expresním systému rekombinantních bakulovirů a hmyzích buněk, jsme používali jako antigen. Jamky mikrotitračních destiček jsme potahovali purifikovanými VLP, blokovali bovinním sérovým albuminem a séra ředěná 1 : 25 jsme testovali vždy ve 2 jamkách. Navázané protilátky jsme detekovali konjugátem anti-lidského IgG s křenovou peroxidázou, reakci vizualizovali o–fenylendiaminem a absorbanci (optical density – OD) jsme měřili při 492 a 630 nm. Na každé destičce jsme testovali kontrolní pozitivní a negativní séra pro příslušný antigen. Mezní hodnotu OD, která oddělovala negativní a pozitivní séra, jsme počítali pro každou destičku zvlášť. Výsledky jsme vyjadřovali jako OD index, reprezentovaný podílem absorbance testovaného vzorku séra a mezní hodnotou pro danou destičku/antigen. Vzorky s výsledkem do 10 % nad hraniční hodnotu a přibližně čtvrtinu všech vzorků jsme testovali opakovaně. Pouze vzorky s opakovaným pozitivním výsledkem jsme považovali za reaktivní.
Výsledky
V tab. 1 jsou shrnuta data o přítomnosti HPV-DNA v jednotlivých věkových skupinách. V celém souboru jsme nalezli celkem 95/254 (37,4 %) HPV-DNA pozitivních dívek/žen, z toho 29/254 (11,3 %) bylo infikováno typy 16/18. HR-HPV-typy bylo infikováno 24,8 %, LR HPV typy 7,1% a LR a HR-HPV-typy 5,5 %. Prevalence HPV infekce stoupala s věkem, maximálních hodnot jak v případě jakéhokoliv typu HPV, tak HPV16/18 dosahovala ve věkové skupině 24–26 let a poté klesala. Ve skupině žen starších 30 let jsme nezjistili ani jednou infekci HPV16/18. Celkem jsme identifikovali 15 HR - a 12 LR-typů HPV, jejich distribuce je uvedena v tab. 2. Nejčastěji detekovaný byl HR-typ HPV16, dále LR-typ HPV42 a poté HR-typy HPV51, 56, 31, 33, 53, 18, 59, 66. U 24/95 (25,3 %) subjektů jsme detekovali současnou přítomnost více typů HPV (2 až 4 typy).
Table 1. Prevalence HPV-infekce u sexuálně aktivních dívek/žen 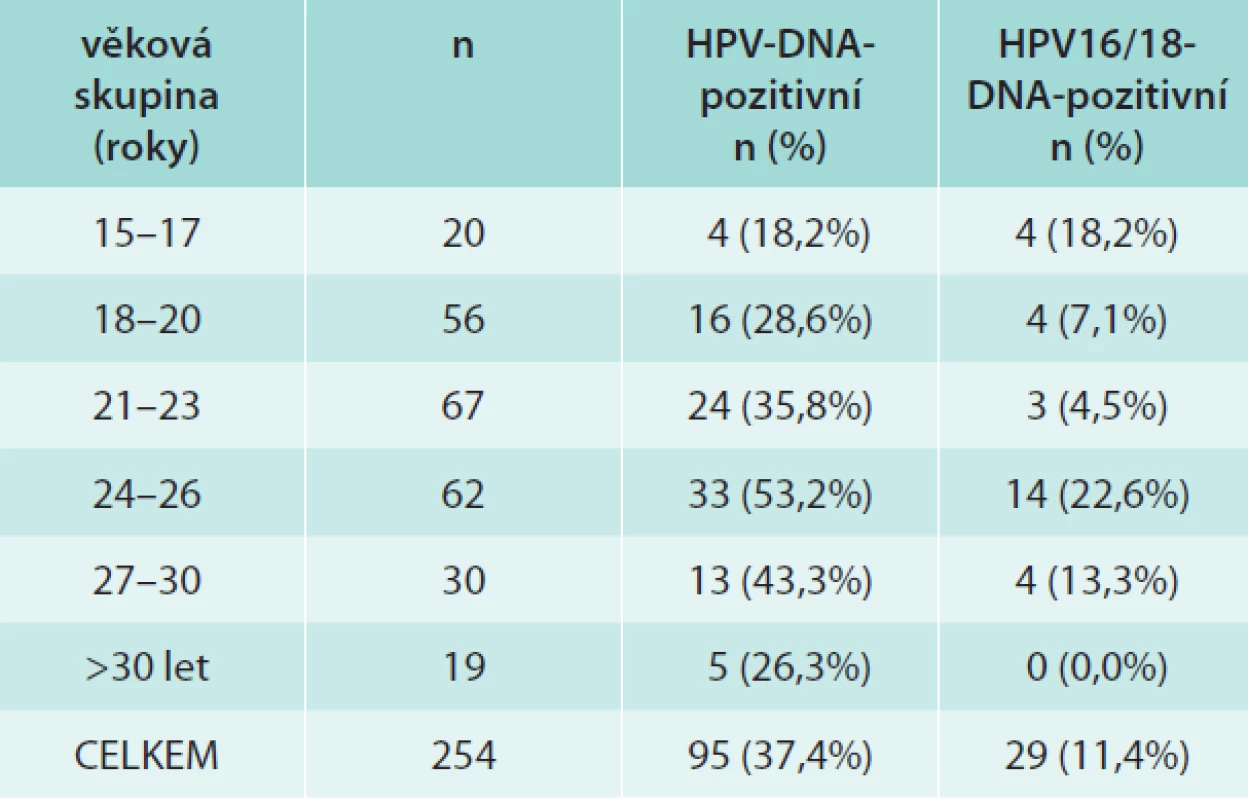
Table 2. Distribuce HPV-typů u dívek/žen 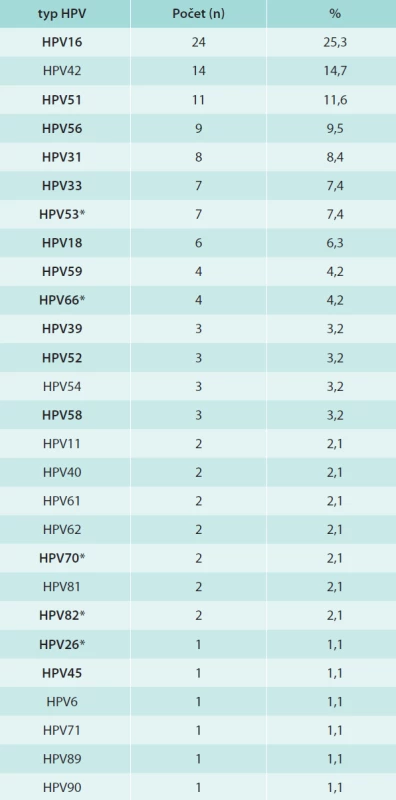
zvýrazněné vysoce rizikové HPV-typy *zvýrazněné pravděpodobně vysoce rizikové HPV-typy [12] Prevalence protilátek proti jednotlivým typům HPV (HPV6, 11, 16, 18, 31, 33) v celém souboru byla 31,3 %, 21,5 %, 17,6 %, 9,8 %, 15,2 % a 13,3 %. Protilátky proti kterémukoliv typu testovaných HPV jsme nalezli u poloviny žen, proti typu 6 a/nebo 11 u 32,0 %, proti typu 16 a/nebo 18 u 22,3 % a proti typům 6/11/16/18 u 44,9 % žen. Distribuce séropozitivních dívek/žen v jednotlivých věkových skupinách je znázorněna v grafu. Z grafu je patrná věková závislost prevalence protilátek proti HR-HPV na věku, přičemž séropozitivita roste s přibývajícím věkem a maximálních hodnot dosahuje u žen starších 30 let. Prevalence protilátek proti HPV16 a/nebo 18 byla ve skupině žen starších 30 let 52,6 %, proti vakcinálním typům HPV6/11/16/18 63,2 %. Ve skupině nejmladších dívek jsme v případě HPV18, 31 a 33 žádné protilátky nedetekovali. Naopak v případě LR typů HPV6 a/nebo HPV11 bylo nejvíce protilátek nalezeno v nejmladší věkové skupině (45,5 %) a nejméně u nejstarších žen (21,1 %), ale věková závislost byla mnohem méně patrná.
Graph 1. Prevalence protilátek proti HPV6, 11, 16, 18, 31, 33 v jednotlivých věkových skupinách 
Pro analýzu očekávané účinnosti vakcín proti vzniku HPV16/18 asociovaných lézí jsme definovali současnou, přetrvávající a předchozí infekci těmito typy HPV následovně: současná infekce je charakterizována přítomností HPV-DNA a nepřítomností typově-specifických protilátek (HPV-DNA+/Ab-), přetrvávající přítomností obou znaků infekce (HPV-DNA+/Ab+) a předchozí nepřítomností HPV-DNA a přítomností typově-specifických protilátek (HPV-DNA-/Ab+). V tab. 3 jsou uvedeny všechny 3 možnosti ve všech věkových skupinách. V celé sledované skupině jsme nalezli 4,7 % současně infikovaných, 6,7 % s přetrvávající infekcí a 15,4 % mladých žen, které infekci vyčistily. Celkem je tedy snížením účinnosti vakcín proti HPV16/18 ohroženo 11,1 % sledovaných žen. Současnou infekci jsme nejčastěji pozorovali u nejmladších dívek, přetrvávající infekci u mladých žen ve věku 24–26 let a předchozí infekci v nejstarší skupině žen (starších 30 let). Skupinou nejvíce ohroženou jsou již zmíněné ženy ve věku 24–26 let, z nichž téměř jedna čtvrtina byla infikována HPV16/18. Naopak u žen starších 30 let jsme nenašli infekci HPV16/18 ani v jednom případě.
Table 3. Současná, přetrvávající a předchozí infekce HPV16 a/nebo HPV18 v různých věkových skupinách 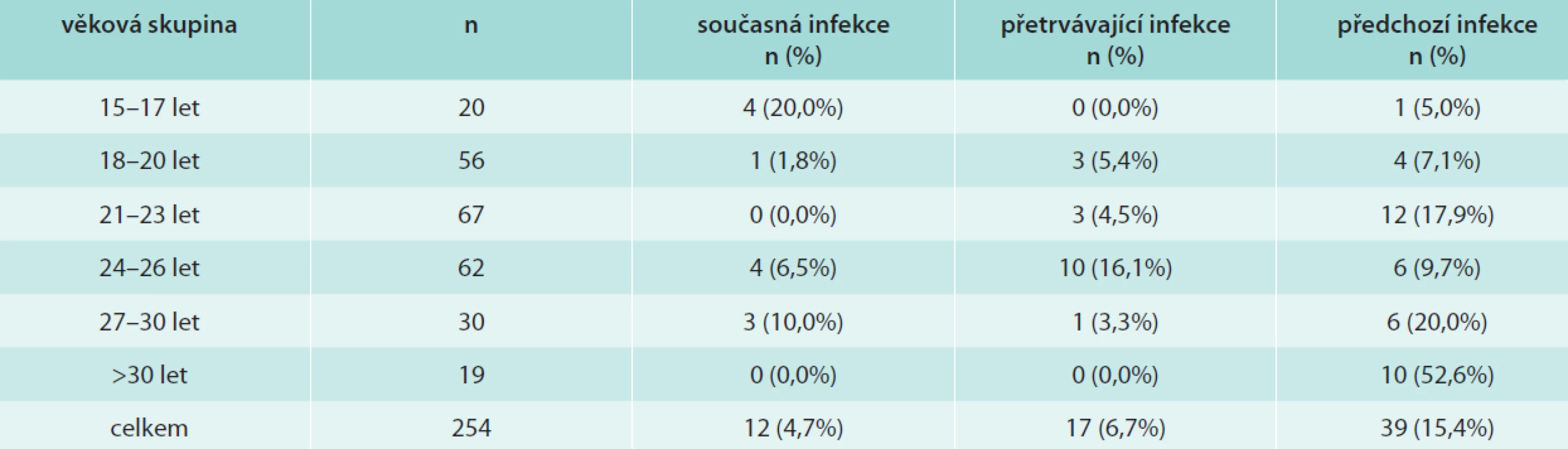
Diskuse
Papilomaviry jsou v současné době nejčastěji sexuálně přenosné virové agens. V průběhu života se až 80 % sexuálně aktivních osob setká alespoň 1krát s HPV infekcí. Od 70. let minulého století se dramaticky zvýšila incidence onemocnění spojených s HPV-infekcí [13,14]. Nárůst těchto nemocí je pravděpodobně následkem současné epidemie HPV-infekcí, která je podmíněna změnami v sexuálním chování člověka [15]. Zatímco přibližně 70 % případů KDH je asociováno s HPV16 a 18, u nádorů vyvolaných HPV v dalších anatomických lokalitách je toto procento vyšší [16]. V České republice jsme nalezli HPV16/18 v 76,0 % vzorků KDH a 33,0 %, 43,0 % a 71,0 % vzorků cervikální intraepiteliální neoplazie 1, 2 a 3 [17]. V případě HPV-pozitivních karcinomů tonzil, které jsou nejčastějšími nádory v oblasti orofaryngu, obsahovalo 94 % vzorků HPV16 [18]. Čtvrtina žen ve věku 14−79 let, které se účastní pravidelného screeningu pro prevenci KDH a mají normální cytologický nález, byla infikována HPV bez ohledu na typ. Typy HPV16/18 jsme identifikovali u 6,6 %, přičemž nejčastěji byla infekce HPV a HPV16/18 nalezena ve věkové skupině 21–25 let (40,8 % a 12,2 %) [8].
V naší současné studii jsme v celém souboru detekovali HPV-infekci bez ohledu na typ HPV ve 37,4 % a infekci typem HPV16/18 v 11,4 % případů. U mladých žen ve věku 21–26 let nalezli HPV-DNA a HPV16/18-DNA u 44,2 % a 13,2 %. Vyšší prevalence HPV-DNA v celém souboru je s největší pravděpodobností dána vyšším zastoupením mladších žen (průměrný věk 23,3 roku oproti 33,5 let ve studii [8]).
V naší nedávné studii týkající se určení prevalence protilátek proti HPV v obecné populaci České republiky [19] jsme ve skupině žen ve věku 6–76 let nalezli 23,8 %, 15,2 %, 14,5 %, 9,9 %, 16,4 % a 9,6% dívek/žen séropozitivních proti HPV6, 11, 16, 18, 31 a 33. Protilátky proti kterémukoliv typu HPV jsme detekovali u 44,9 %, proti HPV16 a/nebo 18 u 19,8 % a proti HPV6/11/16/18 u 37,4 % osob. Vyšší prevalence protilátek proti stejným antigenům v současné studii je zřejmě jako v případě molekulárně biologických nálezů dána odlišným věkovým zastoupením (23,3 roku oproti 30,4 let ve studii [19]).
Výsledky rozsáhlých klinických studií obou v současné době dostupných komerčních vakcín naznačily, že ženy v době aplikace vakcíny infikované některým z HPV typů obsažených ve vakcíně jsou ohroženy sníženou účinností vakcíny, neboť vakcíny jako preventivní nástroj ochrany před infekcí nejsou schopny příslušnou infekci vyčistit a zvláště v případě perzistující přítomnosti HPV hrozí ženě riziko vzniku onemocnění [5]. Protože jsme v rámci této studie měli k dispozici jak stěr z děložního hrdla na určení přítomnosti HPV-DNA, tak sérum ke zjištění přítomnosti specifických protilátek, mohli jsme určit skupinu žen/dívek, u které by mohla být účinnost vakcíny omezena. U osob, které nenesou žádné známky současné či minulé infekce vakcinálními typy HPV, především typy HPV16/18, by účinnost očkování měla být vysoká. Podobnou účinnost by měla mít vakcinace u žen, které jsou séropozitivní na typy HPV obsažené ve vakcíně, ale není u nich zjištěna přítomnost HPV-DNA. Nicméně je možné spekulovat, že v tomto případě by infekce teoreticky mohla být v latentním stadiu, v němž sice nejsme schopni její přítomnost detekovat, ale která se může kdykoliv reaktivovat. Nelze vyloučit, že při přechodu do proliferativní fáze by protilátky, indukované očkováním, mohly alespoň omezit šíření infekce. Nicméně infikované buňky nejsou protilátky schopny eliminovat. Další dvě možnosti jsou spojeny s přítomností HPV-DNA 16/18 ve stěru z děložního hrdla při normálním cytologickém nálezu. V prvém případě nejsou přítomny homologní protilátky proti HPV, což svědčí pro současnou infekci, se kterou se může imunitní systém vypořádat snáze, než ve druhém případě, v němž kromě HPV-DNA nacházíme i protilátky proti stejnému typu HPV. V tomto případě se pravděpodobně jedná o infekci přetrvávající v organizmu již delší dobu a tato perzistence zvyšuje jednoznačně pravděpodobnost vzniku či rozvoje onemocnění. Přestože není příliš pravděpodobné, že žena bude zároveň infikována oběma vysoko rizikovými typy HPV, a vakcína tedy bude účinná alespoň proti typu, který nebyl ve stěru detekován, bylo by vhodné v tomto případě ženy pečlivěji sledovat než v případech, ve kterých jsou pacientky HPV-DNA-negativní. Předběžné výsledky ze sledování pacientek v naší studii, infikovaných vakcinálními typy v době očkování, ukazují jednoznačně zvýšené riziko vzniku či progrese onemocnění u těchto žen.
V naší studii dívek/mladých žen, které se rozhodly pro očkování proti HPV, jsme nalezli celkem 4,7 % současně a 6,7 % perzistentně infikovaných vakcinálními typy HPV s nejvyšší prevalencí infekce ve věkové skupině 24–26 let se současnou infekcí u 6,5 % a přetrvávající u 16,1 %.
Před aplikací vakcíny není doporučována detekce a případně typizace přítomné HPV-infekce, a proto je nezbytné, aby lékaři informovali své pacientky o možném riziku snížené účinnosti očkování. Eventuální vznik onemocnění u cytologicky negativních žen totiž může být důsledkem infekce přítomné již v době očkování a neměl by být vysvětlován selháním vakcíny, která je preventivní, a tudíž je určena k zabránění vstupu infekce do organizmu.
Protože je KDH a další závažná onemocnění spojen i s dalšími typy HPV, které ve vakcínách obsaženy nejsou, je nutné, aby se i očkované ženy podrobovaly pravidelným preventivním prohlídkám. Určitou nadějí na rozšíření účinku HPV-vakcín je kandidátní nonavalentní vakcína, která kromě antigenů 4 typů HPV, obsažených v kvadrivalentní vakcíně, obsahuje antigeny dalších 5 HR-typů HPV. Klinické studie této vakcíny již byly dokončeny a očekává se, že by její aplikace mohla zabránit až 90 % případů KDH.
Poděkování
Za technickou podporu děkujeme Blance Langové. Za spolupráci při poskytnutí klinických materiálů děkujeme MUDr. Martině Hourové, MUDr. Anně Havránkové, MUDr. Renatě Kavanové, MUDr. Vítězslavovi Slavíkovi.
Práce byla podporována grantem IGA ČR NT/12373
Doručeno do redakce dne 8. 9. 2014
Přijato po recenzi dne 21. 10. 2014
RNDr. Eva Hamšíková
Eva.Hamsikova@uhkt.cz
RNDr. Eva Hamšíková
RNDr. Jana Šmahelová
RNDr. Viera Ludvíková
RNDr. Martina Saláková, Ph.D.
Mgr. Jana Rychlá
RNDr. Ruth Tachezy, Ph.D.
Ústav hematologie a krevní transfuze, Praze
www.uhkt.cz
MUDr. Jana Skřenková
www.vfn.cz
prof. MUDr. Lukáš Rob, CSc.
www.fnmotol.cz
Sources
1. Boshart M, Gissmann L, Ikenberg H et al. A new type of papillomavirus DNA, its presence in genital cancer biopsies and in cell lines derived from cervical cancer. EMBO J 1984; 3(5): 1151–1157.
2. Dürst M, Gissmann L, Ikenberg H et al. A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. Proc Natl Acad Sci USA 1983; 80(12): 3812–3815.
3. De Martel C, Ferlay J, Franceschi S et al. Global burden of cancers attributable to infections in 2008: a review and synthetic analysis. Lancet Oncol 2012; 13(6): 607–615.
4. Guan P, Howell-Jones R, Li N et al. Human papillomavirus types in 115,789 HPV-positive women: a meta-analysis from cervical infection to cancer. Int J Cancer 2012; 131(10): 2349–2359.
5. Schiller JT, Castellsague X, Garland SM. A review of clinical trials of human papillomavirus prophylactic vaccines. Vaccine 2012; 30(Suppl 5): F123-F138.
6. Schmitt M, Dondog B, Waterboer T et al. Homogeneous amplification of genital human alpha papillomaviruses by PCR using novel broad-spectrum GP5+ and GP6+ primers. J Clin Microbiol 2008; 46(3): 1050–1059.
7. van den Brule AJC, Pol R, Fransen-Daalmeijer N et al. GP5+/6+PCR followed by reverse line blot analysis enables rapid and high-throughput identification of human papillomavirus genotypes. J Clin Microbiol 2002; 40(3): 779–787.
8. Tachezy R, Smahelova J, Kaspirkova J et al. Human papillomavirus type-specific prevalence in the cervical cancer screening population of Czech women. PLoS One 2013; 8(11): e79156. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0079156>.
9. Tachezy R, Mikyskova I, Ludvikova V et al. Longitudinal study of patients after surgical treatment for cervical lesions: detection of HPV DNA and prevalence of HPV-specific antibodies. Eur J Clin Microbiol Infect Dis. 2006; 25(8): 492–500.
10. Smith EM, Ritchie JM, Pawlita M et al. Human papillomavirus seropositivity and risks of head and neck cancer. Int J Cancer 2007; 120(4): 825–832.
11. Hrbacek J, Urban M, Hamsikova E et al. Serum antibodies against genitourinary infectious agents in prostate cancer and benign prostate hyperplasia patients: a case-control study. BMC Cancer 2011; 11 : 53. Dostupné z DOI: <http://doi: 10.1186/1471–2407–11–53>.
12. Bernard HU, Burk RD, Chen Z et al. Classification of papillomaviruses (PVs) based on 189 PV types and proposal of taxonomic amendments. Virology 2010; 401(1): 70–79.
13. Nasman A, Attner P, Hammarstedt L et al. Incidence of human papillomavirus (HPV) positive tonsillar carcinoma in Stockholm, Sweden: an epidemic of viral-induced carcinoma? Int J Cancer 2009; 125(2): 362–366.
14. Brewster DH, Bhatti LA. Increasing incidence of squamous cell carcinoma of the anus in Scotland, 1975–2002. Br J Cancer 2006; 95(1):87–90.
15. de Sanjose S, Cortes X, Mendez C et al. Age at sexual initiation and number of sexual partners in the female Spanish population Results from the AFRODITA survey. Eur J Obstet Gynecol Reprod Biol 2008; 140(2): 234–240.
16. Crow JM. HPV: The global burden. Nature 2012; 488(7413): S2-S3.
17. Tachezy R, Smahelova J, Salakova M, et al. Human papillomavirus genotype distribution in Czech women and men with diseases etiologically linked to HPV. PLoS One 2011; 6(7): e21913. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0021913>.
18. Rotnaglova E, Tachezy R, Salakova M et al. HPV involvement in tonsillar cancer: Prognostic significance and clinically relevant markers. Int J Cancer 2011; 129(1): 101–110.
19. Hamsikova E, Ludvikova V, Stasikova J et al. Cross-sectional study on the prevalence of HPV antibodies in the general population of the Czech Republic. Sex Transm Infect 2013; 89(2): 133–137.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2014 Issue 4-
All articles in this issue
- Očkování žen proti lidským papilomavirům: výsledky studie v České republice (vstupní data)
- Management zjištění průchodnosti vejcovodů. Nově dostupná ambulantní metoda – hysterosalpingo-foam sonografie (HyFoSy)
- Čtvrtá generace folátů a perikoncepční péče
- Obezita a její vliv na sexuální poruchy žen
- Dienogest – spolehlivý progestin s unikátní přidanou hodnotou
- Klasifikace děložní myomatózy a její diagnostika ve vztahu k reprodukčním dysfunkcím
- Poskytování zdravotní péče ženám bez domova
- Perioperační péče na gynekologickém oddělení
- Cirkulující a extracelulární mikroRNA jako nové potenciální diagnostické markery pro gynekologické malignity
- Gastrointestinální a urologické komplikace hluboké infiltrující endometriózy: přehled a kazuistika
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dienogest – spolehlivý progestin s unikátní přidanou hodnotou
- Klasifikace děložní myomatózy a její diagnostika ve vztahu k reprodukčním dysfunkcím
- Management zjištění průchodnosti vejcovodů. Nově dostupná ambulantní metoda – hysterosalpingo-foam sonografie (HyFoSy)
- Perioperační péče na gynekologickém oddělení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

