-
Medical journals
- Career
Endovenózní ablace křečových žil – současný stav a přehled metod
Authors: R. Vlachovský 1,2; T. Novotný 1; R. Staffa 1; Z. Bednařík 3
Authors‘ workplace: II. chirurgická klinika, Centrum cévních onemocnění, Fakultní nemocnice u sv. Anny v Brně a Lékařská fakulta Masarykovy univerzity, Brno 1; VASCUMED centrum žilní chirurgie, Brno 2; I. ústav patologie Fakultní nemocnice u sv. Anny v Brně a Lékařská fakulta, Masarykova univerzita, Brno 3
Published in: Rozhl. Chir., 2022, roč. 101, č. 5, s. 200-210.
Category: Review
doi: https://doi.org/10.33699/PIS.2022.101.5.200–210Overview
Během posledních dvou dekád zaznamenala chirurgie povrchového žilního systému nebývalý rozmach. Tradiční chirurgické řešení (crossektomie a stripping) je v současnosti ve větší nebo menší míře nahrazováno novými méně invazivními nitrožilními metodami. Cílem našeho sdělení je podat aktuální přehled všech dostupných endovenózních metod (laser, radiofrekvence, pára, mechanicko-chemická ablace a žilní lepidlo) s popisem indikací, technikou provedení, mechanismem účinku a výsledky. Ve zkušených rukou jsou všechny nitrožilní techniky bezpečné a účinné, s dlouhodobými výsledky srovnatelnými s klasickou chirurgickou technikou.
Klíčová slova:
radiofrekvenční ablace – křečové žíly – ablace – laserová ablace
ÚVOD
Endovenózní metody ošetření křečových žil jsou zavedené alternativy ke klasickým otevřeným výkonům (vysoké ligaci a strippingu) na velké i malé saféně. Jejich hlavním cílem je zlepšit kvalitu života, snížit periprocedurální morbiditu, snížit míru komplikací a zkrátit délku pracovní neschopnosti. Ve 20. století byla otevřená klasická chirurgie zlatým standardem v léčbě varixů, ale jako taková měla a má některé nevýhody. Mezi ně patří pooperační bolestivost a otok, tvorba hematomů podél stripovaného úseku s rizikem hyperpigmentací, ranné infekce a parestézie, které jsou výsledkem poškození senzitivních kožních nervů [1,2].
Klasická operace jedné končetiny včetně strippingu vede k pracovní neschopnosti v délce 18–28 dnů, s mírou recidivy až 40 % po 5 letech a až 70 % po 10 letech [3]. Nevýhody klasické chirurgie popsané výše, spolu s faktem, že i extenzivní ligace safénofemorální junkce (SFJ) jen velmi málo ovlivňuje dlouhodobé výsledky a počet recidiv, jasně definovaly potřebu hledání nového a méně invazivního ošetření [4−5]. Není bez zajímavosti, že již v 50. letech 20. století čeští chirurgové publikovali práci, která využívala v rámci tehdejšího stavu poznání a technologické úrovně elektrokoagulaci při ošetření žil [6].
Mezi miniinvazivní metody řadíme endovenózní ošetření laserem (EVLA), radiofrekvenční ablaci (RFA) nebo ablaci pomocí páry, přičemž všechny tyto metody vyžadují lokální tumescentní anestezii. Mechano-chemická ablace a žilní lepidlo pak existují jako alternativní endovenózní metody bez nutnosti tumescence.
Cílem všech endovenózních ablačních technik je uzavřít insuficientní žilní segment, přičemž všechny výkony mohou být prováděny ambulantní formou. Ultrazvuk je nezbytný nejen při stanovení diagnózy, ale také periprocedurálně, neboť všechny výkony jsou prováděny pod jeho kontrolou.
Endovenózní termální ablace se podle většiny mezinárodních guidelines staly metodou volby pro ošetření insuficientních kmenových žil, následované netermálními technikami [7−8]. Zejména v dlouhodobějším horizontu se však zdá, že mezi různými léčebnými modalitami není ve výsledcích (účinnosti a nežádoucích účincích) žádný významný rozdíl [9−11]. Až na výjimky se v naší zemi endovenózní ošetření do národních doporučených postupů zatím nedostalo [12].
V tomto sdělení jsou popsány termální i netermální endovenózní techniky používané v léčbě insuficientních povrchových kmenových žil. Vedle praktických doporučení je cílem textu poskytnout také některé základní teoretické informace o mechanismech působení jednotlivých technik. V textu se záměrně nezabýváme ultrazvukem navigovanou pěnovou sklerotizaci a metodou HIFU (fokusovaný ultrazvuk vysoké intenzity).
METODY
1. Indikace a předoperační zhodnocení, duplexní mapování
Klíčovým patofyziologickým znakem chronického žilního onemocnění (CVD) je reflux, způsobený primárně inkompetencí chlopní a/nebo obstrukcí. Duplexní ultrazvukové vyšetření je zásadní nejen pro diagnostické účely (rozsah refluxu), ale také pro vytvoření terapeutického plánu.
Přítomnost relevantních symptomů a klinických známek CVD a refluxu v příslušném úseku povrchových žil jsou jasnou indikací k léčbě. Nitrožilní ošetření je možné u naprosté většiny kmenových insuficiencí velké a malé safény, přídatných safén a případně i perforátorů, a to nejen v případě primární operace, ale i v případě reoperací, pokud ultrazvukem prokážeme anatomicky vhodný a dostupný přímý úsek kmenové žíly. Nevhodné k endovenóznímu ošetření jsou přídatné safény s velmi krátkým intrafasciálním průběhem, nepříznivá anatomická situace v třísle reprezentovaná především masivní dilatací v junkci, přetrvávající pozánětlivé změny ve hlavních povrchových kmenech, extrémní tortuozita kmene žíly nebo uložení povrchových žil těsně pod kůží.
Duplexní ultrazvuk se stal referenčním standardem a základní vyšetřovací metodou pro hodnocení morfologie a hemodynamiky žilního systému dolních končetin. Informace získané duplexním ultrazvukem mají obvykle významný dopad na to, jaký typ léčby je pacientovi nabízen a který typ léčby je v daném případě považován za nejvhodnější.
Nedílnou součástí duplexního mapování žil by mělo být:
- vyšetření junkcí (kompetence, lokalizace a průměr);
- stanovení rozsahu refluxu v safénách a jejich průměry, vyšetření inkompetentních perforátorů (počet, lokalizace, průměr a funkce);
- vyšetření jiných relevantních žil, ve kterých prokazujeme reflux;
- popis zdroje plnění všech povrchových křečových žil, pokud tento není zřejmý z již popsaných žil;
- popis žil, které jsou hypoplastické, atretické, nepřítomné nebo byly odstraněny;
- popis stavu hlubokého žilního systému včetně funkce chlopní a známek proběhlé žilní trombózy [13].
Pokud je to možné, měl by být pacient vyšetřen vestoje, především proto, abychom mohli kvalitně zhodnotit povrchový žilní systém ve vzpřímené poloze a abychom případně nepřehlédli insuficientní úseky žil. Je nutné uvést délku insuficientního žilního segmentu a distální bod insuficience. U některých metod je vhodné měření průměru žíly v několika úrovních, abychom snadněji stanovili množství energie nutné k ošetření žíly.
Insuficientní úseky žil by měly být před výkonem vyznačeny na pacientově kůži a v jeho dokumentaci (Obr. 1). Tato informace je chirurgovou „mapou“, která ho provází a vede během celé operace.
Image 1. Insuficientní úseky žil vyznačené na kůži před operací
Fig. 1: Insufficient vein sections marked on the skin before surgery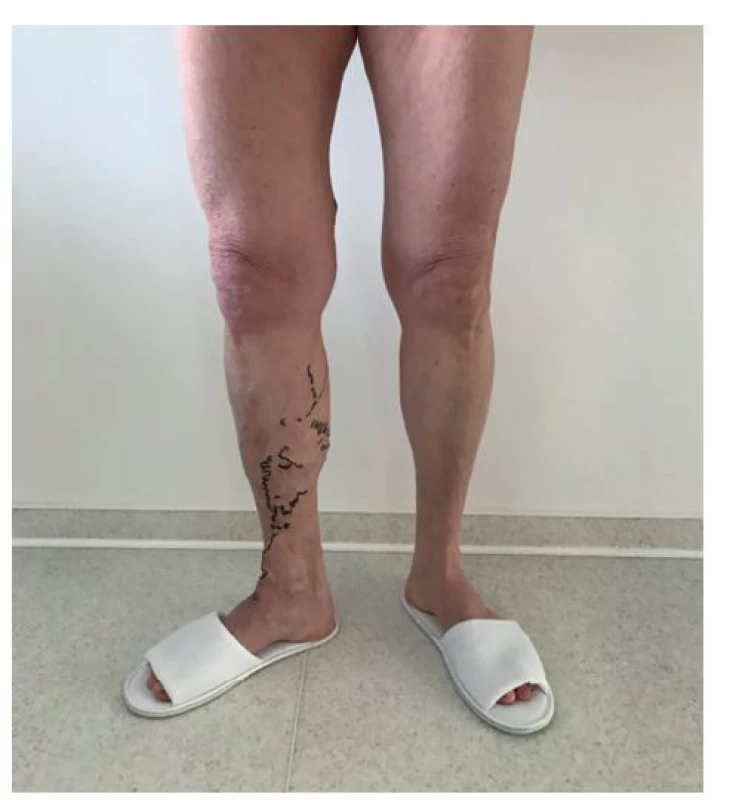
Posouzení hlubokého žilního systému je neméně důležité, neboť jeho postižení může mít zásadní vliv na povrchový žilní systém. Hluboký žilní systém je obvykle vyšetřován vleže na zádech, kdy cíleně hledáme možnou okluzi a/nebo insuficienci. Pokud je ve společné femorální žíle detekován kontinuální tok (bez respiračního ovlivnění) naznačující proximální obstrukci, doporučuje se rozšířit duplexní skenování i na pánevní žíly. Měly by být posouzeny také případné trombotické nebo posttrombotické změny v hlubokém žilním systému a jejich anatomické umístění. Obstrukce v hlubokém žilním systému může být kontraindikací pro intervenci na povrchovém žilním systému.
2. Endovenózní termální ablace
Endovenózní termální ablace zahrnuje EVLA, RFA a ablaci pomocí páry. V mnohých aspektech jsou všechny tyto metody podobné. Ideálně k nevratnému poškození žilní stěny vede intraluminální zahřátí stěny safén. Rozdíl je hlavně ve způsobu, jakým je tohoto zahřátí dosaženo, v použitých materiálech a typech katétrů. Předoperační zhodnocení (včetně duplexního mapování) a vlastní technika provedení včetně polohování pacienta, dezinfekce, katetrizace, tumescentní anestezie a pooperační péče jsou identické pro všechny tři léčebné modality.
3.1. Endovenózní laserová ablace (EVLA)
Technika
Existuje mnoho variací základní techniky, lišících se typem použitého laserového vlákna, katetrizačním vybavením a často také preferencemi operujícího chirurga. Pacient je umístěn v poloze na zádech, ošetřovaná dolní končetina je kompletně dezinfikována a chirurgicky zarouškována od třísla po kotník, stejně jako u klasické operace. Po uvedení pacienta do anti-Trendelenburgovy polohy je zajištěn přístup do žíly punkcí nejdistálnějšího segmentu s refluxem. Přes punkční jehlu je zaveden vodicí drát a pomocí skalpelu velikosti 11 je punkční otvor v kůži rozšířen na drobnou incizi. Po vodicím drátu je zaveden sheat s dilatátorem, přes nějž je pak zavedeno vlákno až do oblasti safenofemorální junkce (SFJ) a jeho pozice se ověří ultrazvukem.
Na druhu používaného laserového vlákna závisí i způsob zajištění žilního přístup. Při použití holých vláken (tzv. „bare fiber“) nebo vláken typu Tulip je nutno použít dlouhý zaváděcí katétr, aby se zabránilo perforacím žilní stěny a umožnilo se bezpečné zavedení laserového vlákna až do oblasti SFJ. Při použití radiálního vlákna nebo vlákna typu NeverTouch není použití takového zaváděcího katétru většinou nezbytné. V těchto případech lze po získání přístupu punkcí vložit pouze krátký sheat (šíře 5−7 Fr).
Umístění konce vlákna u SFJ a jeho posun v průběhu velké safény (VSM) je periprocedurálně kontrolován jednak ultrazvukem, ale také sledováním červeného signálního světla viditelného přes kůži, jež mizí při vstupu vlákna do společné femorální žíly (Obr. 2). Konec vlákna by měl být umístěn 1 cm distálně od SFJ a distálně od ústí vena epigastrica inferior. Mnozí chirurgové provádějí tzv. laserovou crossektomii, při které je radiální vlákno umístěno co nejblíže SFJ s cílem zabránit vytvoření otevřeného pahýlu, který by mohl napomáhat vzniku recidivy.
Image 2. Signální červené laserové světlo na konci laserového vlákna viditelné pod kůží v třísle
Fig. 2: Signal red laser light at the laser fiber tip visible under the skin in the groin
Pacient je poté umístěn do Trendelenburgovy polohy a kolem a podél ošetřované žíly se aplikuje tumescentní roztok (Obr. 3), umožňující ošetření v místní (tumescentní) anestezii. Instilace roztoku se provádí pod ultrazvukovou kontrolou obvykle proximálním směrem. Díky aplikaci tekutiny do fasciálního prostoru obklopujícího VSM (safénové oko) je dosaženo hydrodisekce perivenózní tkáně.
Image 3. Safénová fascie vyplněná tumescentním roztokem („safénové oko“)
Fig. 3: Saphenous fascia filled with the tumescent solution („saphenous eye“)
Při ošetření jedné končetiny se využije přibližně 300 až 400 ml tumescentního roztoku a použití infiltrační pumpy celý proces usnadňuje a urychluje.
Vlákno je zpětně vytahováno většinou dle daného kontinuálního protokolu. Rychlost posunu je mezi 0,5 až 2 milimetry za sekundu. Pokud se při zpětném tahu využívá pulzní protokol, objevují se mezi lokálně tepelně ošetřenými oblastmi místa bez tohoto ošetření. To může vést k nežádoucím lokálním perforacím a perivenózní tkáňové destrukci.
Měli bychom se vyhnout manuální kompresi ošetřeného úseku žíly během výkonu, protože tato komprese ještě potencuje přímý kontakt mezi vláknem a žilní stěnou, a tak zvyšuje riziko perforací (zejména při použití holých vláken).
Mechanismus účinku
Jakékoliv specifické laserové záření je monochromatické světlo dané vlnové délky vyjádřené v nanometrech (nm) od vysokých infračervených (10 600 nm) až po nízké ultrafialové (pod 420 nm) [14]. Laserové světlo je koherentní a monochromatické a je také kolimováno; světelné paprsky jsou paralelní, nerozbíhavé, na rozdíl od paprsků z konvenčních světelných zdrojů vyzařujících světlo ve všech směrech. Tato vlastnost umožňuje, aby byl laser účinnější než běžné světlo se stejnou energií.
Během interakce laserového záření s cílovou tkání dochází k fyzikálním procesům reflexe, rozptylu nebo absorpce, přičemž absorpce je primární biofyzikální proces, který umožňuje laseru působit potenciálně terapeuticky (nebo ničivě) na tkáň.
Mezi přirozeně se vyskytující chromofory v biologických tkáních patří melanin, hemoglobin, karotenoidy, proteiny a voda. Foton procházející tkání negeneruje žádný tkáňový účinek, dokud není absorbován chromoforem specifickým pro konkrétní vlnovou délku, což má za následek molekulární excitaci chromoforu do stavu vyšší energie. Deexcitace chromoforu uvolňuje tuto energii zpět do tkáně, což způsobuje tkáňové změny prostřednictvím fotochemických a fototermolytických procesů.
U nitrožilního laseru je převládajícím procesem selektivní fototermolýza spočívající v aplikaci specifické vlnové délky k zacílení na specifický chromofor, a představuje tak jedinečnou a velmi účinnou vlastnost laserové terapie.
Role různých vlnových délek
V literatuře se objevují termíny hemoglobin-specifické (HSLW) a voda-specifické (WSLW) laserové vlnové délky, což slouží k rozlišení mechanismů působení vlnových délek. Předpokládalo se, že WSLW využívající vodu jako chromofor vyvolávají intimální poškození tím, že se dominantně zaměřují na žilní stěnu (s vyšším obsahem vody) a že pouze vyšší vlnové délky způsobují tepelné poškození tímto způsobem; čím vyšší je vlnová délka, tím větší je afinita k absorpci vody.
Koncepce proměnlivé specifity chromoforů (hemoglobinu a vody) v závislosti na vlnové délce podnítila v minulosti několik studií zaměřených na vlnové délky. Nicméně na základě nových výsledků studií, znalosti téměř totožné optické extinkce pro krev i vodu a také situace, kdy optická extinkce je při vyšších vlnových délkách až pětkrát vyšší než u laserů pod 1000 nm, se dá konstatovat, že vyšší vlnové délky umožňují především dosáhnout větší selektivní destrukce žilní stěny s menší použitou energií, a tedy s méně pooperačními nežádoucími účinky.
Všechny vlnové délky jsou účinné, pokud jsou podávány při optimálním LEED (linear endovenous energy density) a výkonu. Platí, že čím nižší je vlnová délka, tím větší je afinita k hemoglobinu; tedy vyšší počet perforací a vyšší pravděpodobnost krátkodobých vedlejších účinků. Specifičnost pro absorpci vodou, kterou vykazují vlnové délky 1320, 1470 nebo 1940 nm, navíc naznačuje, že jejich interakce s endotelovými buňkami ve stěně žíly může být podobná mechanismu smršťování kolagenu pozorovanému při radiofrekvenčních zákrocích, a nabízí vysvětlení pro podobně nízkou míru vedlejších nežádoucích účinků pozorovaných u obou tepelných metod.
Histologické změny nastávající po endovenózní ablaci
Žíly odstraněné okamžitě po laserové ablaci vykazují známky nerovnoměrné destrukce žilní stěny s perforacemi a ulceracemi vznikajícími v důsledku přímého kontaktu mezi špičkou vlákna a žilní stěnou (Obr. 4). Vzorky žil odebrané jeden týden po operaci mají po svém obvodu buněčnou zánětlivou tkáň s novotvorbou malých cév a migrací fibroblastů a fagocytů [15].
Image 4. Histologické a histochemické vyšetření úseků VSM bez ošetření laserem (a,b,c) a po ošetření laserem (d,e,f)
a) Obraz venózní stěny s varikózní přeměnou. Hematoxylin-eosin, originální zvětšení 20x. b) Venózní stěna s pravidelnou kontinuální distribucí a organizací elastických vláken. Orcein, originální zvětšení 20x. c) Svalovina medie bez zřetelné disrupce, s adhezí hladkosvalových struktur. IHC SMA, originální zvětšení 20x. d) Obraz těžkých regresivních změn odpovídajícím „high-temperature damage“. Hematoxylin-eosin, originální zvětšení 20x. e) Regresivní změny se ztrátou intimy a disrupcí až ztrátou elastických vláken. Orcein, originální zvětšení 20x. f ) Rozsáhlá deplece svaloviny medie s její vakuolizací a úsekovou verifikací reziduálních hladkosvalových struktur. IHC SMA, originální zvětšení 20x.
Fig. 4: Histological and histochemical analysis of GSV sections without laser treatment (a,b,c) and after laser treatment (d,e,f)
a) Image of a venous wall with varicose transformation. Hematoxylin-eosin, original magnification 20×. b) Venous wall with regular continuous distribution and organization of elastic fibers. Orcein, original magnification 20x. c) Muscle layer of the media without disruption, with adhesion of smooth muscle structures. IHC SMA, original magnification 20x. d) Image of severe regressive changes corresponding to “high-temperature damage“. Hematoxylin-eosin, original magnification 20x. e) Regressive changes with loss of intima and disruption or loss of elastic fibers. Orcein, original magnification 20x. f ) Extensive depletion and vacuolation of the muscle layer of the media with focal verification of residual smooth muscle structures. IHC SMA, original magnification 20x.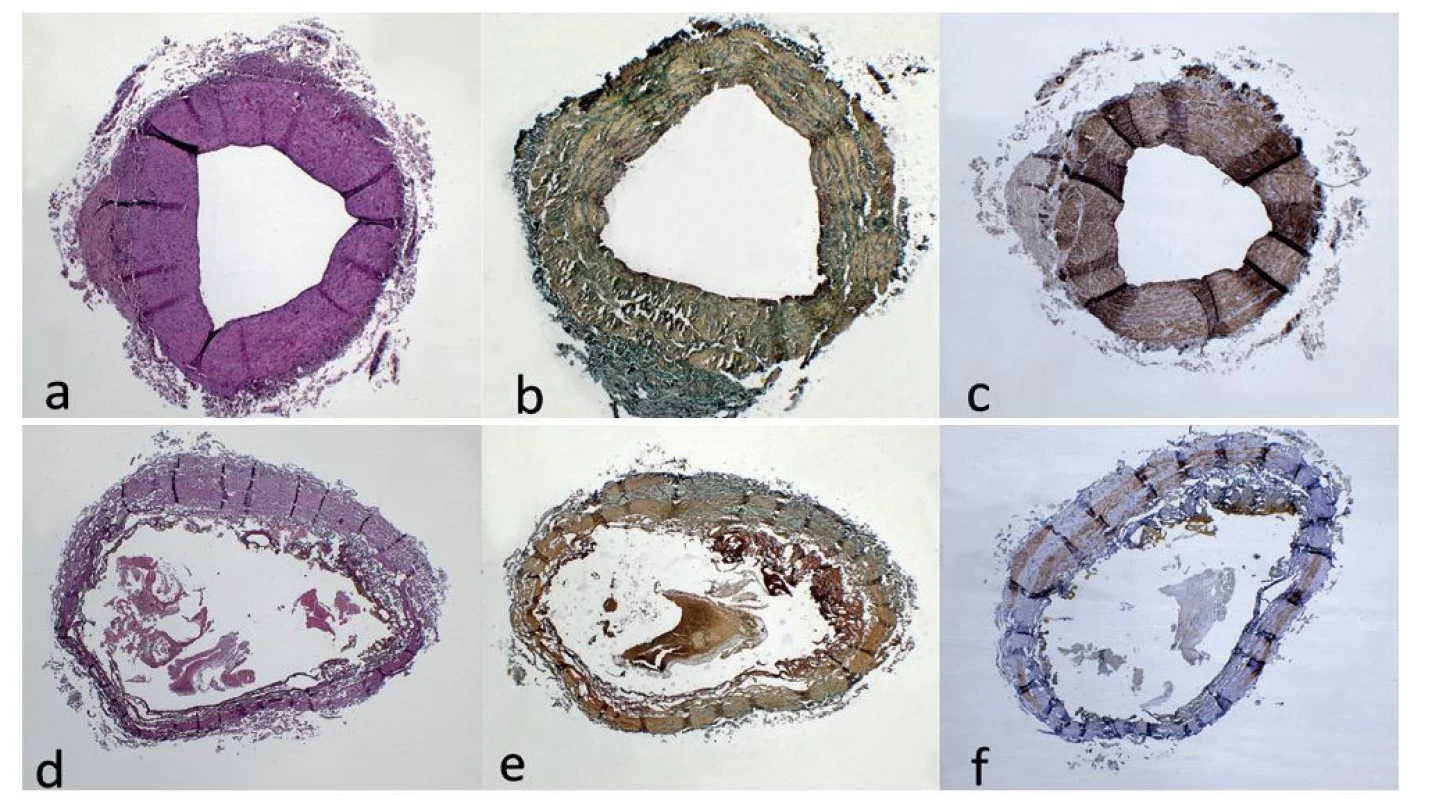
Tato nekroinflamatorní tkáň infiltruje stěnu žíly zvnějšku směrem dovnitř, žíly jsou tromboticky uzavřené. Úseky zničených částí žilní stěny obsahující nekrotické svalové buňky jsou rozloženy nerovnoměrně a tato destrukce je mnohem rozsáhlejší než ve vzorcích žil odebraných okamžitě po ošetření. Dva a tři týdny od operace jsou tyto peri - a intravenózní procesy velmi extenzivní. Zánětlivá tkáň postupně infiltruje žílu a přetváří destruovanou tkáň v jizvu.
Role intraluminální krve
Zpočátku se všeobecně akceptovalo, že intravaskulární krev hraje klíčovou roli v homogenní distribuci energie na žilní stěnu [16]. Emitovaná světelná energie měla být přednostně absorbována krví (lasery s nižší vlnovou délkou) a jako důsledek toho se tvořily bubliny páry, které měly přenášet tepelnou energii na žilní stěnu. Nicméně se ukázalo, že energie potřebná k vytvoření těchto bublin představuje pouze 1,6 % celkem dodané energie [17]. Pokud je žíla naplněna krví, je hlavní část emitované světelné energie absorbována krví, což vede k trombotické okluzi. Vstřebávání tohoto trombu během několika následujících měsíců může vést k případné pozdější rekanalizaci.
Naopak v histologické studii na zvířecím modelu a následně klinickými studiemi se potvrdila hypotéza, že množství intraluminální krve by mělo být co nejvíce minimalizováno [18]. Čím větší je objem intraluminální krve, tím menší množství energie ovlivňuje žilní stěnu [19].
Role různých typů vláken
Z technického pohledu má EVLA některé nevýhody, které jsou spojeny především s rigiditou tzv. holých vláken. Pokud je tento typ vlákna zaveden do safény, která má obvykle větve a tortuózní oblasti, má vlákno vždy tendenci zachovat si svůj rovný průběh. Jako důsledek tohoto a také díky větší poddajnosti žíly může špička vlákna často zasáhnout a poškodit žilní stěnu již při zavádění. Na perioperačním ultrazvuku můžeme často vidět, že se špička vlákna uvnitř žíly nejčastěji nachází v excentrické poloze s hrotem dotýkajícím se žilní stěny (Obr. 5). Tumescentní anestezie vyvolávající stlačení žíly kolem vlákna může tuto tendenci zmírnit.
Image 5. Laserové vlákno excentricky uložené v lumen žíly naléhající na přední stěnu VSM před SFJ
Fig. 5: Laser fiber eccentrically placed in the lumen of the vein adjacent to the anterior wall of the GSV in front of the SFJ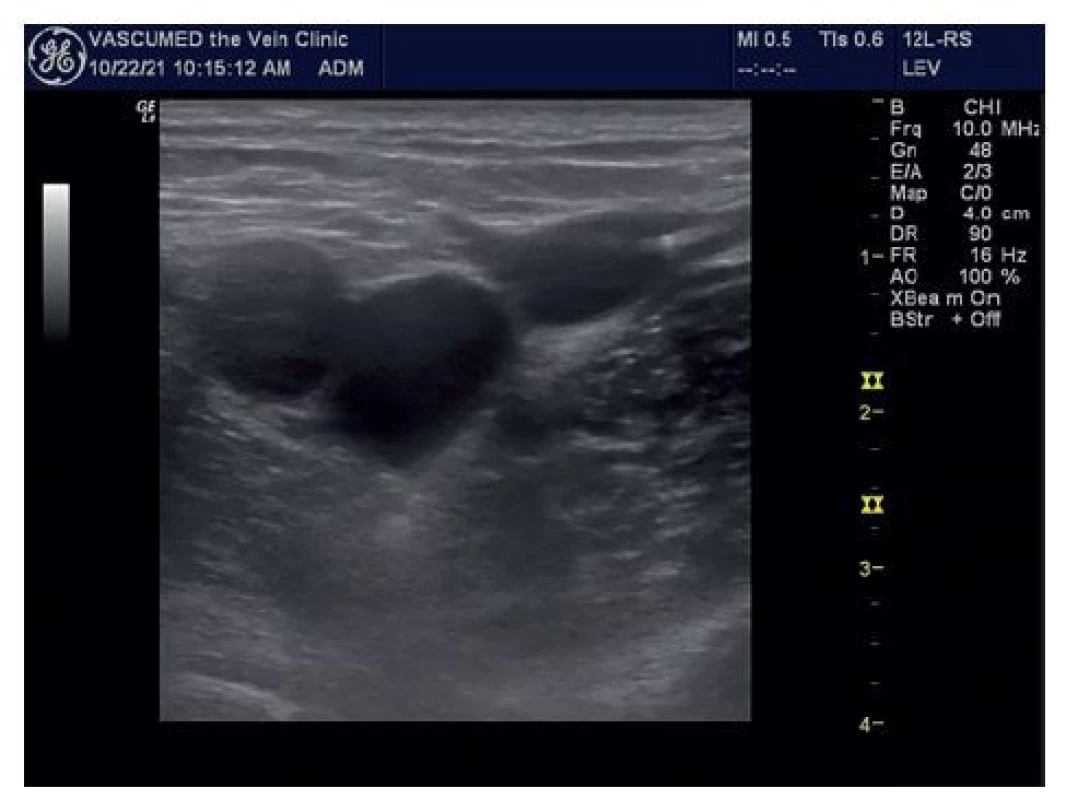
Přesto však zejména ve větších žílách zůstává špička vlákna v excentrické poloze. Když je pak za této situace dodávána energie na hrot vlákna, má přímý kontakt mezi vláknem a žilní stěnou za následek destrukci, ulceraci nebo perforaci, přičemž ostatní části žilní stěny nejsou více ovlivněny [20]. Následkem této nerovnoměrné distribuce energie mohou být pooperační ekchymózy, zánětlivé reakce a bolestivost [19]. Histologická studie prokázala, že omezení přímého kontaktu mezi špičkou vlákna a žilní stěnou a centrování špičky vlákna intraluminálně vedou k homogennější destrukci žilní stěny, méně perforacím a menšímu perivenóznímu poškození [20].
Objevily se nové typy vláken umožňující rovnoměrnější rozložení energie na žilní stěnu a nižší lokální zahuštění aplikované energie, s cílem předejít rozvoji výše zmiňovaných pooperačních komplikací. Tyto modifikace se týkaly například speciální povrchové úpravy špičky nebo mechanických úprav umožňujících centrování intraluminálně, nicméně v současnosti je dominantní a nejčastěji používané vlákno s radiální emisí záření (Obr. 6). Na distálním konci má křemíkovou špičku, která vyzařuje světlo radiálně, nikoliv frontálně. Výsledkem je přímé ozařování obvodu žilní stěny a významné snížení perforací žilní stěny, a tedy snížení nežádoucích účinků léčby. V posledních letech byla zavedena do běžné praxe radiálně emitující vlákna s dvojitým prstencem („ringem“), která by měla mít především díky rozložení aplikované energie na dvě místa ještě méně vedlejších účinků.
Image 6. Radiálně emitující laserové vlákno (ELVeS® Radial® 2ring) připravené před operací (publikováno se souhlasem firmy Biolitec)
Fig. 6: Radially emitting laser fiber (ELVeS® Radial® 2ring) prepared before surgery (published with permission from Biolitec)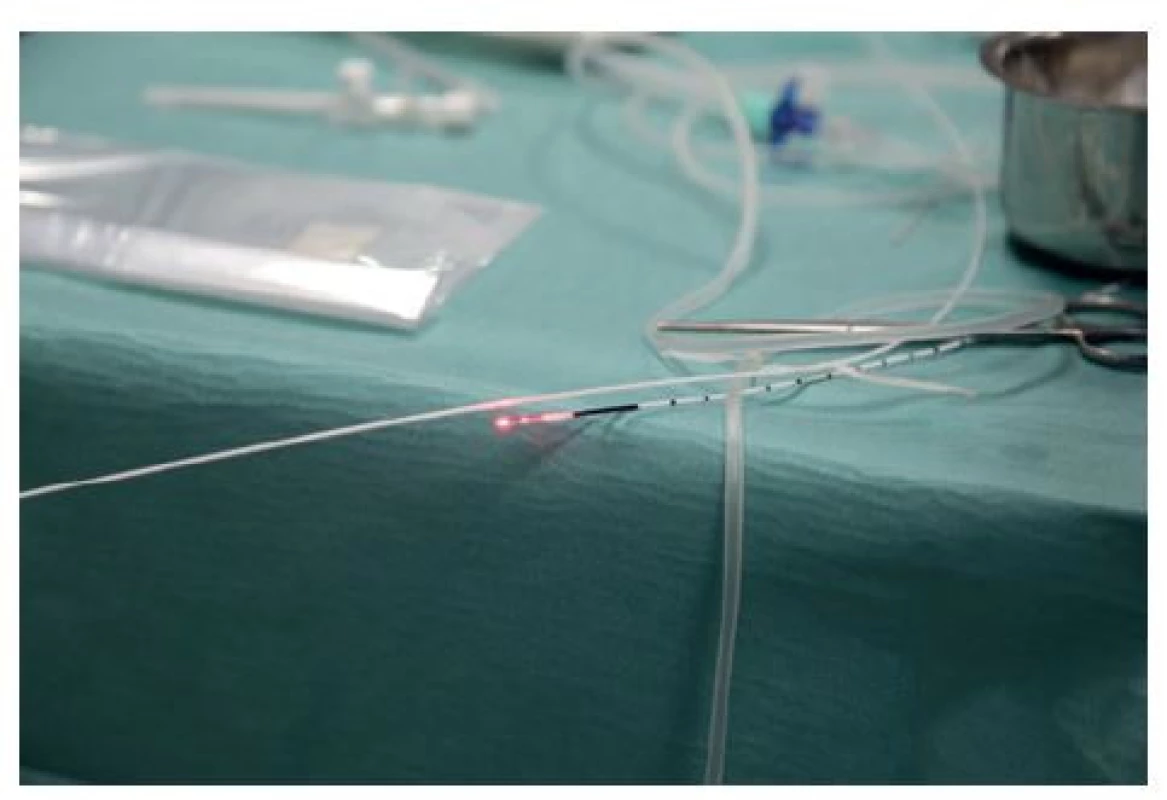
3.2. Radiofrekvenční ablace (RFA)
Další rozšířená endovenózní technika je založena na principu radiofrekvenčního proudu. První známé použití RFA bylo v roce 1931, kdy Krischner léčil touto technikou trigeminální neuralgii. Na konci 50. let byl díky práci Cosmana a Aronowa k dispozici první komerční radiofrekvenční přístroj. Originální radiofrekvenční endovenózní postup byl schválen Úřadem pro potraviny a léčiva USA (FDA) v březnu 1999 a v roce 2006 byly představeny další aplikace této metody.
Technika
Technika je velmi podobná jiným endovenózním termálním ablacím. Přístup do žíly je zajištěn opět punkčně a přes 7F sheat je zaveden katétr, který obsahuje na svém konci 7 cm dlouhý tepelný článek používaný pro segmentální ablaci. V tomto pracovním tepelném segment katétru se během 20sekundového cyklu generuje teplota 120 °C. Podél celého průběhu ošetřované žíly se aplikuje tumescentní anestezie. Katétr je po zavedení umístěn 2 cm distálně od SFJ. Každých 20 sekund je ošetřen nový 7cm segment safény, přičemž v nejproximálnějším segmentu (nejblíže junkci) proběhnou tyto cykly dva a tento proces se opakuje, dokud není celá insuficientní žíla ošetřena (Obr. 7). Katétry jsou k dispozici v délkách 60 cm a 100 cm, přičemž tepelný článek na jeho konci může mít délku 7 nebo 3 cm. Speciálně formovaný katétr pak existuje i pro ošetření insuficientních perforátorů.
Image 7. Schéma zavedeného radiofrekvenčního katétru s tepelným článkem (publikováno se souhlasem firmy Medtronic)
Fig. 7: Schematic of an inserted radiofrequency catheter with a thermal cell (published with permission from Medtronic)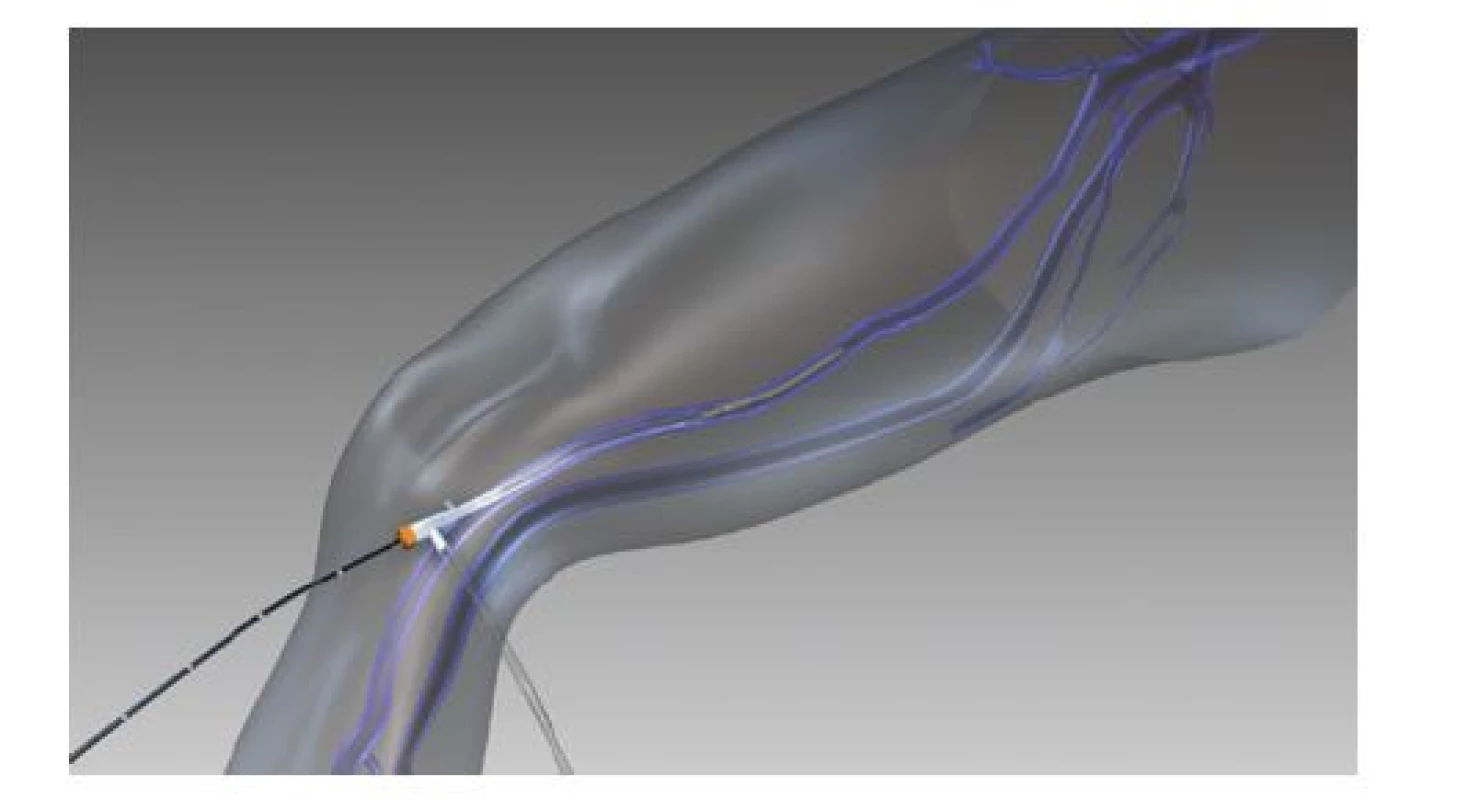
Kromě dominujícího radiofrekvenčního systému ClosureFast ™ (Medtronic, MI, USA) je méně využíván systém RFITT (radiofrequency induced thermotherapy) označovaný aktuálně jako Celon Precision od firmy Olympus (Olympus Surgical Technologies Europe, Hamburk, Německo), a systém EVRF (endovenous radiofrequency) od belgického producenta F Care Systems (F Care Systems, Antverpy, Belgie).
Mechanismus účinku
Nejnovější systém dodává energii z infračerveného spektra do žilní stěny přímým zahříváním tepelného článku na hrotu katétru radiofrekvenční energií.
Jakmile je žilní stěna teplem denaturována, postupně se kontrahuje kolem katétru. U radiofrekvenčního systému předchozí generace došlo v okamžiku smrštění a zhutnění tkáně v okolí tepelného článku k poklesu impedance, což snížilo tvorbu tepla – radiofrekvenční generátor byl naprogramován tak, aby se rychle vypnul v okamžiku nárustu impedance, čímž bylo zajištěno minimální zahřívání krve, ale účinné zahřívání žilní stěny. U současného systému je teplota jádra katétru trvale monitorována a dodávání energie je upraveno tak, aby udržovalo teplotu jádra na 120 °C. Teplo dodávané do žilní stěny způsobuje kontrakci žíly v ošetřované oblasti a katétr je ve 20sekundových krocích postupně po 7cm úsecích vytahován (s 0,5 cm přesahem), dokud není ošetřena celá délka žíly.
3.3. Parní ablace (SVS)
Technika
Třetí endovenózní tepelnou technikou je ablace pomocí páry. Systém „steam vein sclerosis“ (SVS), jak se tato technika správně nazývá, se skládá z parního generátoru, adaptéru a kompresoru. Technika je velmi podobná EVLA nebo RFA, i při této metodě se žilní endotel zahřívá pomocí endovenózního katétru.
Přístup do žíly se pod ultrazvukovou kontrolou zajistí pomocí kanyly o rozměru 16 G. Katétr uvolňující páru široký 1,2 mm je pak protažen přímo přes kanylu do žíly až do vzdálenosti cca 2–3 cm od SFJ. Není třeba používat vodicí drát, protože kovový katétr sám o sobě působí jako vodič [21]. Pacient je umístěn do Trendelenburgovy polohy a kolem žíly je aplikována tumescentní anestezie, podobně jako u EVLA nebo RFA.
Tepelná ablace se provádí aplikací čtyř až osmi impulzů v proximální části žíly následovanou dvěma až čtyřmi impulzy pro každý další žilní segment. Počet impulzů pro každý segment souvisí s průměrem žíly. Pokud je průměr žíly menší než 7 mm, jsou aplikovány dva impulzy na 1 cm délky žíly. Pokud je průměr větší, pak se aplikují tři nebo dokonce čtyři impulzy na 1 cm.
Mechanismus účinku
Na rozdíl od EVLA nebo RFA se u této metody dosahuje zahřátí žilní stěny vstřikováním páry. Pára je dodávána do žíly přes speciální katétr, který se skládá ze 60 cm dlouhé metalické části zakončené tupým hrotem se dvěma bočními otvory na špičce. Pára je natlakována do centrálního kanálu katétru, kde se ochlazuje na 120°C, což představuje skutečnou teplotu aplikované páry. Energie uvolněná během jednoho impulzu je v důsledku kondenzace a chlazení přibližně 60 J. V důsledku expanze páry je tato energie aplikována vždy na několika centimetrech délky žil. Více pulzů na 1 cm vede ke zvýšené absorpci energie na jednotku délky žíly (lineární hustota endovenózní energie, LEED) [21].
Zahřívání žilní stěny vede k tepelné destrukci srovnatelné s EVLA nebo RFA. Na histologických analýzách vidíme trombózu s rozsáhlou destrukcí žilní stěny, lze najít nekroinflamatorní proces stěny bohatý na zánětlivé buňky. Transmurální termoablace je charakterizována (a histologicky potvrzena) endoteliální destrukcí se zánětlivými změnami následovanými fibrózou, která se šíří médií až k adventicii, na většině histologických vzorků je zaznamenána také určitá destrukce perivenózní tkáně. Procesy v žilní stěně po SVS vykazují velmi podobné rysy s procesy v žílách ošetřených EVLA a RFA [22].
Jednou z výhod parní ablace je to, že katétr je drobný a flexibilní, což může usnadnit umístění do větví, tortuózních žil a perforátorů. Pára se uvolňuje ze dvou malých oblastí na špičce katétru, což umožňuje ošetření libovolné délky žíly [21]. Pára také vstupuje do některých kolaterálních žil nebo přítoků, což může vést k jejich smrštění a uzávěru.
3.4. Role tumescentní anestezie při endovenózních termálních výkonech
Endovenózní termální ablace vyžaduje tumescentní anestezii, která představuje aplikaci tekutiny s lokálním anestetikem podél ošetřované žíly pod ultrazvukovou kontrolou. Žíla by měla být touto kapalinou zcela obklopena (Obr 3). Tumescentní roztok obsahuje fyziologický roztok s malou koncentrací lokálního anestetika (většinou 1% lidocain), adrenalinu a bikarbonátu v různých poměrech. Adrenalin podporuje vazokonstrikci žíly a jeho použití by mělo snížit výskyt hematomů a hyperpigmentací [23]. Příměs bikarbonátu (HCO3) snižuje pálivý pocit při aplikaci lokální anestezie. Tím se snižuje množství anestetika nezbytného k získání adekvátního znecitlivění a urychluje se anestetický účinek. Pro zajištění bezpečnosti a bezbolestnosti celé procedury je nezbytná dobře zvládnutá a korektně provedená anestetická technika. Fasciální prostor naplněný tumescentním roztokem zabraňuje tepelnému poškození okolních struktur, vyvolává spasmus žíly a minimalizuje množství intraluminální krve. Díky tomuto spasmu je usnadněna absorpce energie přímo žilní stěnou. Tekutina kolem žíly chrání okolní tkáně před nežádoucím poškozením teplem a tímto způsobem zabraňuje destrukci perivenózní tkáně a perforacím žilní stěny. I histologicky bylo potvrzeno, že tumescentní tekutina má za následek také výrazně větší kolaps a spasmus žíly než při samostatném použití Trendelenburgovy polohy. Vyprázdněním žíly lze dosáhnout vyššího stupně destrukce žilní stěny a zabránit komplikacím, které jsou spojeny s destrukcí perivenózních tkání (včetně nervů) nebo s perforacemi žilní stěny [24].
3.5. Pooperační péče po endovenózních výkonech
V pooperačním období je doporučována komprese [8]. Pacienti by měli nosit elastická krátkotažná obinadla nebo punčochy 2. kompresní třídy po dobu nejméně jednoho týdne a běžnou pracovní činnosti zahájit co nejdříve. Pokud byla současně provedena i flebektomie, doporučuje se nošení punčoch na delší dobu (na dva týdny, často i déle).
Tromboprofylaxe může být podána rizikovým pacientům (žilní tromboembolismus v anamnéze, trombofilie, obezita, imobilizace, onkologičtí a starší pacienti). Každý pacient by měl být zhodnocen po stránce rizikových faktorů pomocí specifických skórovacích systémů, jako je například Caprini skóre [25]. Ambulantní provedení většiny endovenózních výkonů a časná, respektive okamžitá mobilizace významně snižuje riziko možných trombembolických komplikací.
3.6. Účinnost, bezpečnost a možné vedlejší účinky endovenózních termálních metod
Výborné klinické výsledky jsou známé po 4 až 5 letech a dlouhodobý efekt je zdokumentován po 10 i více letech. Několik studií prezentovalo výsledky s mírou okluze nad 94 % pro všechny endovenózní termální ablace [9,10,26,27]. Při srovnání návratnosti onemocnění (klinická recidiva i recidiva refluxu) s klasickým chirurgickým zákrokem (vysoká ligace a stripping) neuvádí většina studií významný rozdíl [7]. Celková účinnost a nižší morbidita vedou k narůstající popularitě a zvyšujícímu se počtu endovenózních výkonů oproti klasickým operacím.
Endovenózní termální metody jsou mnohem méně invazivní a mají nižší míru komplikací než klasické operace. Výkony jsou bezpečné, pacienty dobře snášené a mají dobré kosmetické výsledky.
Vedlejší účinky jsou vzácné a zahrnují tromboflebitidu (7 %), hyperpigmentace (5 %), parestezie (4−8 %), ekchymózy (0–7 %), pooperační bolest a termální poškození kůže [8]. Zřídka jsou pozorovány závažné komplikace. Hlášená incidence DVT se u endovenózních termálních výkonů pohybuje mezi 0,2 % až 1,3 %. Termální nitrožilní metody jsou u VSP spojeny s významně vyšší incidencí poškození nervů ve srovnání s VSM. Je to způsobeno blízkostí surálního nervu a VSP v distální části lýtka [28]. Proto je doporučováno zajištění žilního přístupu maximálně v polovině lýtka a vyhnout se distálnějšímu přístupu. Z podobného důvodu není u VSM doporučeno zajišťovat vstup do žíly distálněji než 10–15 cm pod koleno.
Rozvoj trombu v oblasti safenofemorální junkce (EHIT, endovenous heat induced thrombosis) je referován u omezeného počtu případů s frekvenci mezi 0,3 % až 7,8 % pacientů po endovenózních termálních výkonech. Pokud trombus zasahuje do VFC, doporučuje se antikoagulační léčba. Plicní embolie byla hlášena v 0 % až 3 % [7]. Rutinní použití farmakologické profylaxe však zůstává nejisté a jsou nutné další klinické studie.
4. Mechanicko-chemická ablace (MOCA)
Mechanicko-chemická ablace (MOCA, ClariVein®) byla vyvinuta s cílem minimalizovat nevýhody tepelného ošetření kmenových žil a ultrazvukem navigované sklerotizace (UGS) a zároveň ponechat veškeré výhody obou z těchto přístupů [29]. Výhodou tohoto kombinovaného přístupu je absence tumescentní anestezie, kdy se lokální anestetikum využívá pouze pro zajištění místa vpichu. Protože se nevyužívá tepelná energie, je dalším potenciálním přínosem této metody minimalizace rizika poškození senzitivních nervů. Ve srovnání s UGS by měla mít vyšší míru okluze. Indikace pro MOCA jsou podobné jako u endovenózní tepelné ablace.
Technika
Katétr ClariVein® obsahuje ve svém lumen rotující drát s disperzní špičkou, přičemž špička drátu vyčnívá o 2 cm a je lehce ohnutá. Malá kulička na špičce zvyšuje ultrasonografickou viditelnost a mechanicky poškozuje endoteliální vrstvu, a to nejen rotací, ale také disperzí sklerosantu do krevního řečiště a do žilní stěny (Obr. 8). Přístup do safény je zajištěn punkčně pod ultrazvukovou kontrolou pomocí 4 až 6 Fr mikropunkčního setu. Katétr je zaveden přes sheat a umístěn tak, aby byla jeho špička vzdálena 2 cm od safénofemorální junkce. Pak je katétr připojen k motorové hnací jednotce, čímž je odkryta rotující disperzní špička. Jakmile je ověřeno správné umístění konce rotujícího drátu (cca 2 cm od SFJ), je celý mechanismus po dobu několika sekund aktivován, čímž se vyvolá spasmus proximálního úseku žíly. Aktivovaný katétr s rotující špičkou je pak pomalu vytahován rychlostí přibližně 2 mm/s se současnou aplikací roztoku polidocanolu (Aethoxysklerol, Kreussler Pharma, Wiesbaden, Německo) nebo tetradecylsulfátu sodného (Fibrovein, STD Pharmaceutical Products, Hereford, Velká Británie). Množství a koncentrace použitého roztoku jsou dány jeho typem, ale take průměrem inkompetentní safény v blízkosti junkce a délkou ošetřovaného žilního segmentu [30].
Image 8. Katétr pro mechanicko-chemickou ablaci Clari- Vein® (publikováno se souhlasem firmy Merit Medical)
Fig. 8: ClariVein® mechanical-chemical ablation catheter (published with permission from Merit Medical)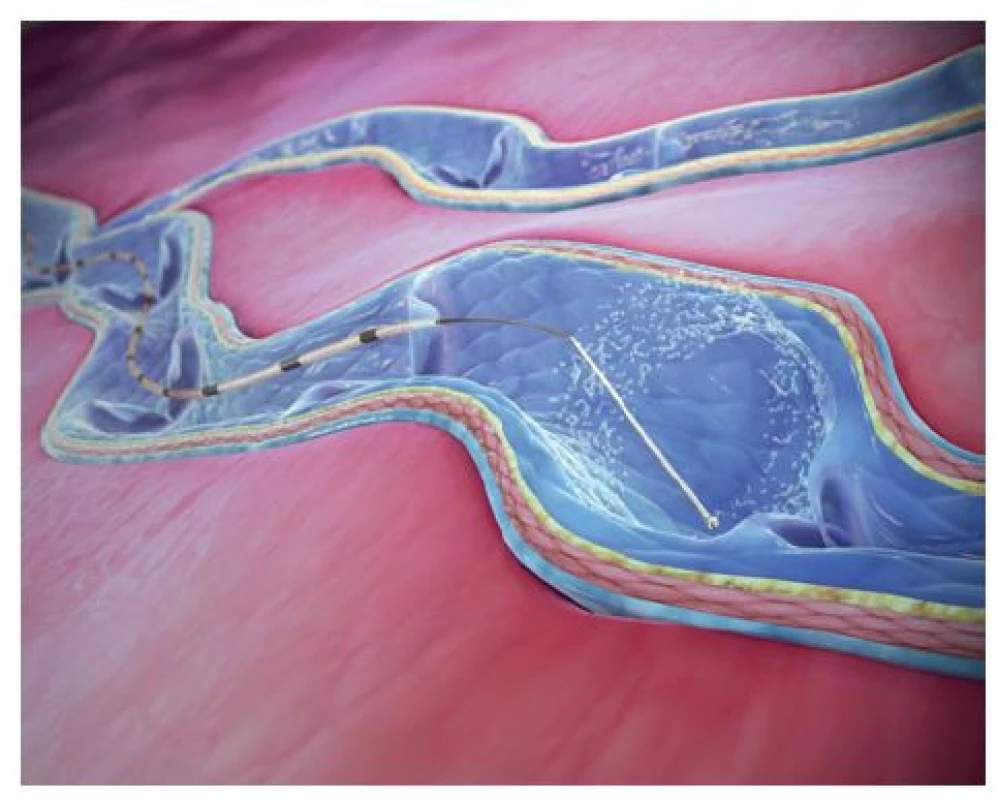
Mechanismus účinku
MOCA uzavírá žíly použitím intraluminálního drátu rotujícího rychlostí 3500 otáček za minutu. Špička drátu poškozuje intimu a způsobuje žilní spasmus, což zvyšuje účinnost sklerosantu. Tekutý sklerotizační roztok je vstřikován otvorem v blízkosti distálního konce katétru poblíž rotujícího drátu. Rotující disperzní špička drátu promíchává tekutinu v ošetřované žíle a zlepšuje její průnik do stěny, stejně tak povrchově poškozuje žilní intimu [29]. Tyto dvě modality, mechanická a chemická, umožňují dosáhnout žilní okluze.
Účinnost
Dle publikovaných studií je MOCA bezpečná a účinná metoda léčby insuficientních žilních kmenů. S velmi nízkou mírou komplikací může být použita pro léčbu VSM i VSP [30,31]. Po průměrném sledování 260 dnů od intervence byla při použití tetradecylsulfátu sodného publikována míra okluze VSM 96,7 % [32]. Souhrnné výsledky z různých studií udávají anatomický úspěch (okluzi žíly) po 6 a 12 měsících 94,7 %, respektive 94,1 % [33]. Všechny klinické studie ukazují na významné zlepšení kvality života ve VCSS (Venous Clinical Severity Score) a v dotazníku Aberdeen Varicose Vein Questionnaire (AVVQ).
Bezpečnost a možné vedlejší účinky
Nejčastěji referovanými komplikacemi u MOCA jsou indurace (12−18 %), tromboflebitida (2−13 %) a ekchymózy (8–10 %) [33]. Méně časté jsou hyperpigmentace (5 %) nebo hluboká žilní trombóza (0−1 %). Ve srovnání s použitím RFA se zdá, že MOCA je spojena s menší pooperační bolestí a rychlejším zotavením [32]. Výhodou u ošetření VSP je take omezení potenciálních neurologických komplikací, které jsou u klasické chirurgie relativně časté.
5. Ablace pomocí cyanoakrylátového žilního lepidla
Cyanoakrylát se v cévní chirurgii objevuje od poloviny šedesátých let 20. století, především v experimentech týkajících se cévních anastomóz a v léčbě aneuryzmat a arteriovenózních píštělí. V průběhu následujících desetiletí se objevily další aplikace využívající lepidlo při embolizaci cév včetně embolizace žil při syndromu pánevní kongesce. Nicméně až v posledních letech se s rozvojem ambulantních miniinvazivních metod v léčbě křečových žil začalo uvažovat i o cyanoakrylátu jako potenciální terapeutické možnosti v této indikaci. Je to zatím nejnovější technika, protože první publikované experimentální práce na animálních modelech jsou z roku 2011 [34].
Podobně jako u MOCA se jedná o netermální netumescentní techniku nezpůsobující typické komplikace spojené s tepelnou ablační technikou, jako je například poškození nervů. Protože metoda nevyžaduje tumescentní anestezii, má velký potenciál ve využití v ambulantní sféře.
Technika
Ošetření kmenové žíly pomocí cyanoakrylátového lepidla představuje obecně katétrovou endovenózní metodu, a proto jsou základní periprocedurální kroky pro zajištění přístupu stejné jako u jiných metod.
K punkčnímu přístupu má být zvolen úsek VSM za pečlivé ultrazvukové kontroly. Žíla by měla být klasicky kanylována v oblasti pod kolenem (lze přizpůsobit konkrétní anatomické situaci pacienta) a místo vpichu by mělo být znecitlivěno dříve, než se o přístup do žíly pokusíme. Po úspěšné ultrazvukem ověřené punkci žíly je přístup do ní zajištěn krátkým zaváděcím 7 Fr sheatem. Následně je zaveden dlouhý vodicí drát až k saphenofemorální junkci, přes který je zaveden modrý zaváděcí katétr a dilatátorem a následně také bílý aplikační katétr (Obr. 9). Za účelem zmírnění rizika vzniku trombu v blízkosti saphenofemorální junkce nebo rizika hluboké žilní trombózy by měl být konec katétru umístěn 5 cm od junkce.
Image 9. Aplikační pistole s katétrem k ošetření pomocí žilního lepidla (publikováno se souhlasem firmy Medtronic)
Fig. 9: Application gun with the catheter for treatment using the venous glue (published with permission from Medtronic)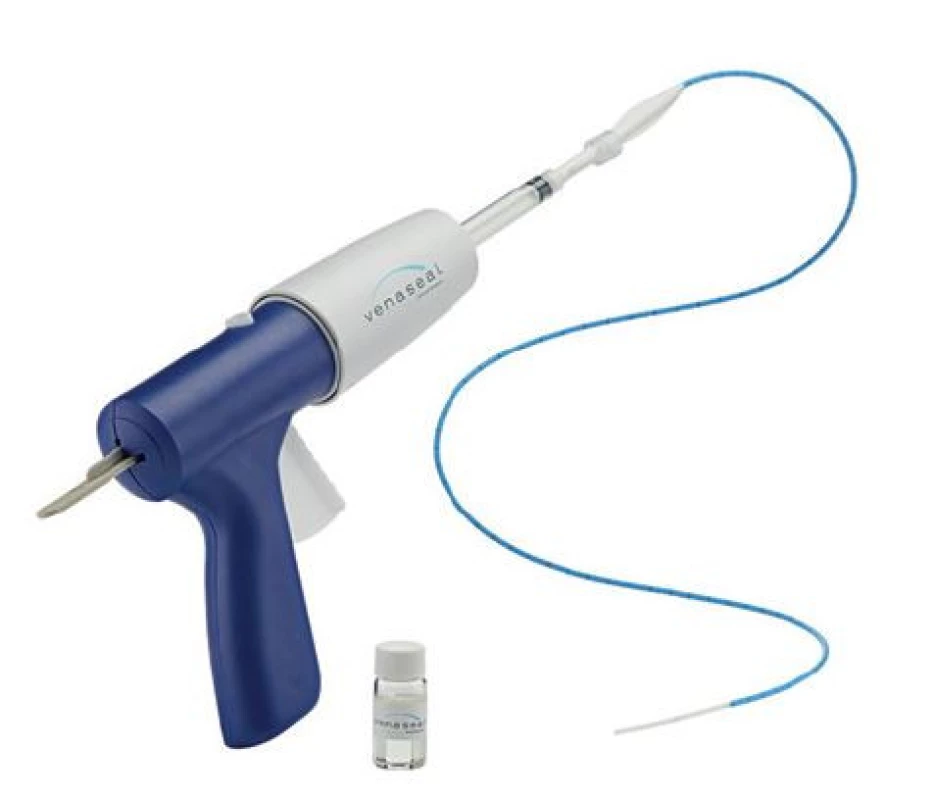
Po správném umístění aplikačního katétru by měl být pacient uložen do Trendelenburgovy pozice, abychom zajistili kolaps žíly kolem katétru, minimalizovali prostor mezi stěnou žíly a katétrem a zajistili přímý kontakt aplikovaného žilního lepidla s žilní stěnou.
Před aplikací cyanoakrylátu by měla být provedena komprese saphenofemorální junkce pomocí ultrazvukové sondy. Způsob aplikace žilního lepidla se liší v závislosti na použitém produktu a provádí se buď sekvenčně (např. VenaSeal®), nebo kontinuálně (např. VariClose®). Bez ohledu na použitou techniku by měl být na ošetřené segmenty bezprostředně po aplikaci vyvíjen tlak.
Mechanismus účinku
N-butyl-cyanoakrylát je cyanoakrylátový polymer používaný pro adhezivní uzávěr kmenů safén a má specifické vlastnosti týkající se rychlosti polymerizace a viskozity [35].
Tento produkt byl vytvořen za účelem rychlé polymerizace, která začíná v lumen žíly okamžitě po kontaktu polymeru s krví. Pokud je aplikován korektně, pak cíleně a okamžitě uzavírá ošetřovanou žílu. V krátkodobém horizontu je tato okluze způsobena samotným lepidlem, z dlouhodobého hlediska se objevuje zánětlivá reakce na přítomnost lepidla ve formě chronické fibrotické okluze.
Kromě velké rychlosti polymerizace se tato látka vyznačuje take vysokým stupněm viskozity. To je zvláště důležité, protože jakmile je polymer aplikován, zůstává na svém místě a zabraňuje jevům typu „wash out“ fenoménu [35].
I přes určitou míru reziduální pružnosti po procesu polymerizace by měl být používán pouze na intrafasciálních úsecích velké nebo malé safény. Při použití v epifasciálních segmentech nehrozí žádné poškození nervů, ale často se objevují lokální zánětlivé reakce a otok.
Účinnost
Účinnost ošetření pomocí cyanoakrylátu byla rozsáhle zkoumána v několika klinických studiích. Jediná dostupná randomizovaná studie je VeClose studie, ve které bylo 222 pacientů randomizováno buď k ošetření pomocí lepidla, nebo pomocí radiofrekvenční ablace. Ukázalo se, že anatomické výsledky nejsou horší než ve skupině s radiofrekvencí, přičemž u obou skupin byl 97% uzávěr při jednoročním sledování [35]. Tyto výsledky byly podpořeny několika dalšími klinickými studiemi, jako je například studie eSCOPE, kde byl uzávěr po roce v 93 % případů [36]. Nicméně v některých publikacích byla roční účinnost nižší a byla v nich nalezena korelace mezi anatomickým selháním a žílami s větším průměrem, což zdůrazňuje potřebu správného výběru pacientů [36,37].
Pokud jde o použití cyanoakrylátu mimo VSM, není k dispozici mnoho dat. Jedinou známou prospektivní studií na tomto specifickém poli byla studie WAVES, která studovala ošetření nejen velké safény (n= 48), ale také malé (n=8) a akcesorní safény (n=14). Tato studie uvádí 100% úspěšnost žilní okluze ve všech skupinách, ale významnou limitací je krátká doba sledování (1 měsíc) a malý počet pacientů [37]. Bez ohledu na výše uvedené se však pro ošetřování VSP žilní lepidlo běžně používá.
Kontraindikace a komplikace
Cyanoakrylát je absolutně kontraindikován u pacientů s anamnézou přecitlivělosti na tuto látku a také s anamnézou akutního žilního trombembolismu nebo sepse. Jako u jiných katétrových metod může být za relativní kontraindikaci považována také velká tortuozita žíly, protože ta může zabránit správnému proximálnímu umístění katétru. I když aktuálně nepředstavuje průměr žíly skutečnou kontraindikaci, je třeba brát v úvahu, že do většiny studií bezpečnosti a účinnosti byly zahrnuty pouze žíly nepřesahující 12 mm v průměru [35].
Pokud jde o komplikace výkonů, nejčastěji se vyskytuje postprocedurální flebitická reakce, která postihuje 4 až 20 % pacientů [36−38]. Hluboká žilní trombóza a plicní embolie jsou teoreticky možné komplikace, nicméně zmínky o nich v současné literatuře u tohoto typu ošetření žil nejsou. Infekce v místě vpichu nebo alergické reakce na aplikované lepidlo jsou spíše vzácnější [39].
ZÁVĚR
V současnosti máme k dispozici několik modalit nitrožilního ošetření křečových žil, ale hledání nejoptimálnější metody nadále pokračuje. Zatímco u termálních metod jsme pravděpodobně na technologickém a vývojovém maximu, na poli netermálních metod nás další vývoj zcela jistě čeká. V literatuře dostupné studie porovnávající různé možnosti invazivní léčby varixů neprokazují z dlouhodobého hlediska nadřazenost jedné techniky nad druhou, a to včetně klasické chirurgie. V reálné klinické praxi budou různí pacienti profitovat odlišně z různých metod a lze konstatovat, že aktuálně neexistuje žádná univerzální a nejlepší metoda ošetření křečových žil. Je především na chirurgovi, aby do svých terapeutických modalit zahrnul všechny dostupné techniky a zvolil a používal jednu nebo druhou v závislosti na konkrétním pacientovi a na jeho individuálních potřebách a očekávání.
Seznam zkratek:
CEAP − klinická, etiologická, anatomická a patofyziologická složka klasifikace CVD
CVD − chronické žilní onemocnění
EHIT − endovenous heat-induced thrombosis
EVLA − endovenózní laserová ablace
EVRF − endovenous radiofrequency
HIFU − fokusovaný ultrazvuk vysoké intenzity
HSLW − hemoglobin-specific laser wavelengths
MOCA − mechanicko-chemická ablace
RFA − radiofrekvenční ablace
RFITT − radiofrequency induced thermotherapy
SFJ − saféno-femorální junkce
VFC − vena femoralis communis
VSM − vena saphena magna
VSP − vena saphena parva
WSLW – water-specific laser wavelengths
Poděkování
Děkuji prof. MUDr. Markétě Hermanové, Ph.D., přednostce I. patologicko-anatomického ústavu LF MU a FN u sv. Anny v Brně, za spolupráci při zpracování a popisu histopatologických vzorků.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Robert Vlachovský, Ph.D.
II. chirurgická klinika LF MU a FN u sv. Anny v Brně
e-mail: robert.vlachovsky@fnusa.cz
ORCID ID 0000-0002-2899-3580
Sources
1. Bergan JJ, Kumins NH, Owens EL, et al. Surgical and endovascular treatment of lower extremity venous insufficiency. J Vasc Interv Radiol. 2002;13 : 563–568. doi:10.1016/s1051-0443(07)61648-0.
2. Vuylsteke ME, Klitfod L, Mansilha A. Endovenous ablation. Int Angiol. 2019;38(1):22−38. doi:10.23736/S0392 - 9590.18.04047-6.
3. Rautio T, Ohinmaa A, Perälä J, et al. Endovenous obliteration versus conventional stripping operation in the treatment of primary varicose veins: a randomized controlled trial with comparison of the costs. J Vasc Surg. 2002;35 : 958–965. doi:10.1067/mva.2002.123096.
4. Michaels JA, Campbell WB, Brazier JE, et al. Randomised clinical trial, observational study and assessment of cost-effectiveness of the treatment of varicose veins (REACTIV trial). Health Technol Assess 2006;10 : 1–196, iii–iv. doi:10.3310/ hta10130.
5. Campbell WB, Vijay Kumar A, Collin TW, et al. Randomised and economic analysis of conservative and therapeutic interventions for varicose veins study. The outcome of varicose vein surgery at 10 years: clinical findings, symptoms and patient satisfaction. Ann R Coll Surg Engl. 2003;85 : 52–57. doi:10.1308/003588403321001462.
6. Hejhal L, Firt P, Livora D. Endovascular electrocoagulation of superficial varices of leg. Rozhl Chir. 1959 Jun;38 : 418−425.
7. Wittens C, Davies AH, Bækgaard N, et al. ESVS Guidelines Committee. Editor’s choice – management of chronic venous disease: Clinical practice guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg. 2015;49 : 678–737. doi:10.1016/j. ejvs.2015.02.007.
8. Gloviczki P, Comerota AJ, Dalsing MC, et al. The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the Society for Vascular Surgery and the American Venous Forum. J Vasc Surg. 2011;53(Suppl): 2S–48S. doi:10.1016/j.jvs.2011.01.079.
9. Hamann SA, Giang J, De Maeseneer MG, et al. Editor’s choice – five year results of great saphenous vein treatment: A meta-analysis. Eur J Vasc Endovasc Surg. 2017;54 : 760–770. doi: 10.1016/j. ejvs.2017.08.034.
10. Argyriou C, Papasideris C, Antoniou GA, et al. The effectiveness of various interventions versus standard stripping in patients with varicose veins in terms of quality of life. Phlebology 2018;33 : 439 – 450. doi:10.1177/0268355517720307.
11. Siribumrungwong B, Noorit P, Wilasrusmee C, et al. A systematic review and meta-analysis of randomised controlled trials comparing endovenous ablation and surgical intervention in patients with varicose vein. Eur J Vasc Endovasc Surg 2012;44 : 214–223. doi:10.1016/j. ejvs.2012.05.017.
12. Karetová D, Vojtíšková J, Seifert B, et al. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Chronická žilní onemocnění. Centrum doporučených postupů, Společnost všeobecného lékařství ČLS JEP, Praha 2021.
13. De Maeseneer M, Pichot O, Cavezzi, et al. Union Internationale de Phlebologie. Duplex ultrasound investigation of the veins of the lower limbs after treatment for varicose veins − UIP consensus document. Eur J Vasc Endovasc Surg. 2011;42 : 89–102. doi:10.1016/j.ejvs.2011.03.013.
14. Zhang R, Verkruysse W, Aguilar G, et al. Comparison of diffusion approximation and Monte Carlo based finite element models for simulating thermal responses to laser irradiation in discrete vessels. Phys Med Biol. 2005;50 : 4075–4086. doi:10.1088/0031-9155/50/17/011.
15. Bush RG, Shamma HN, Hammond K. Histological changes occurring after endoluminal ablation with two diode lasers (940 and 1319 nm) from acute changes to 4 months. Lasers Surg Med. 2008;40 : 676 – 679. doi:10.1002/lsm.20722.
16. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28 : 596–600. doi:10.1046/j.1524-4725.2002.01309.x.
17. Desmyttere J, Grard C, Mordon SA. 2 years follow-up study of endovenous 980 nm laser treatment of the great saphenous vein: role of the blood content in the GSV. Med Laser Appl. 2005;20 : 283–289. doi:10.1016/j.mla.2005.08.003.
18. Vuylsteke M, Van Dorpe J, Roelens J, et al. Endovenous laser treatment: a morphological study in an animal model. Phlebology 2009;24 : 166–175. doi:10.1258/ phleb.2009.008070.
19. Pannier F, Rabe E, Rits J, et al. Endovenous laser ablation of great saphenous veins using a 1470 nm diode laser and the radial fibre – follow-up after six months. Phlebology 2011;26 : 35–39. doi:10.1258/ phleb.2010.009096.
20. Vuylsteke M, Van Dorpe J, Roelens J, et al. Intraluminal fibre-tip centring can improve endovenous laser ablation: a histological study. Eur J Vasc Endovasc Surg. 2010;40 : 110–116. doi:10.1016/j. ejvs.2009.09.013.
21. van den Bos RR, Milleret R, Neumann M, et al. Proof-of-principle study of steam ablation as novel thermal therapy for saphenous varicose veins. J Vasc Surg. 2011;53 : 181–186.
22. Thomis S, Verbrugghe P, Milleret R, et al. Steam ablation versus radiofrequency and laser ablation: an in vivo histological comparative trial. Eur J Vasc Endovasc Surg. 2013;46 : 378–382. doi:10.1016/j. ejvs.2013.06.004.
23. Keel D, Goldman MP. Tumescent anesthesia in ambulatory phlebectomy: addition of epinephrine. Dermatol Surg. 1999;25 : 371–372. doi:10.1016/j. jvs.2010.06.171.
24. Veverková L, Páč L, Kalač J, et al. Deset let endovenózní ablace varixů, úspěchy, neúspěchy a budoucnost. Rozhl Chir. 2014;93(2):57−62.
25. Caprini JA, Arcelus JI, Hasty JH, et al. Clinical assessment of venous thromboembolic risk in surgical patients. Semin Thromb Hemost. 1991;17 Suppl 3 : 304−312.
26. Rasmussen LH, Lawaetz M, Bjoern L, et al. Randomized clinical trial comparing endovenous laser ablation, radiofrequency ablation, foam sclerotherapy and surgical stripping for great saphenous varicose veins. Br J Surg. 2011;98 : 1079–1087. doi:10.1002/bjs.7555.
27. Honěk T, Honěk J, Horváth V, et al. Endovenózní laserová ablace vena saphena − střednědobé výsledky potvrzují trvalý uzávěr a možnost ošetřit více lézí během jednoho zákroku. Rozhl Chir. 2020;99(7):299−303. doi: 10.33699/ PIS.2020.99.7.299-303.
28. Doganci S, Yildirim V, Demirkilic U. Does puncture site affect the rate of nerve injuries following endovenous laser ablation of the small saphenous veins? Eur J Vasc Endovasc Surg. 2011;41 : 400–405. doi:10.1016/j.ejvs.2010.11.029. Epub 2010.
29. Elias S, Lam YL, Wittens CH. Mechanochemical ablation: status and results. Phlebology 2013;28(Suppl 1):10–4. doi:10.1177/0268355513477787.
30. Boersma D, van Eekeren RR, Werson DA, et al. Mechanochemical endovenous ablation of small saphenous vein insufficiency using the ClariVein (®) device: oneyear results of a prospective series. Eur J Vasc Endovasc Surg. 2013;45 : 299–303. doi:10.1016/j.ejvs.2012.12.004.
31. Vos CG, Ünlü Ç, Bosma J, et al. A systematic review and meta-analysis of two novel techniques of nonthermal endovenous ablation of the great saphenous vein. J Vasc Surg Venous Lymphat Disord. 2017;5 : 880–896. doi:10.1016/j. jvsv.2017.05.022.
32. Whiteley MS. Glue, steam and Clarivein – best practice techniques and evidence. Phlebology 2015;30(Suppl):24–28. doi:10.1177/0268355515591447.
33. van Eekeren RR, Boersma D, Konijn V, et al. Postoperative pain and early quality of life after radiofrequency ablation and mechanochemical endovenous ablation of incompetent great saphenous veins. J Vasc Surg. 2013;57 : 445–450. doi:10.1016/j.jvs.2012.07.049.
34. Almeida JI, Min RJ, Raabe R, et al. Cyanoacrylate adhesive for the closure of truncal veins: 60-day swine model results. Vasc Endovascular Surg. 2011;45 : 631 – 635. doi:10.1177/1538574411413938.
35. Morrison N, Gibson K, McEnroe S, et al. Randomized trial comparing cyanoacrylate embolization and radiofrequency ablation for incompetent great saphenous veins (VeClose). J Vasc Surg. 2015;61 : 985 – 994. doi:10.1016/j.jvs.2014.11.071.
36. Chan YC, Law Y, Cheung GC, et al. Predictors of recanalization for incompetent great saphenous veins treated with cyanoacrylate glue. J Vasc Interv Radiol. 2017;28 : 665–671. doi:10.1016/j. jvir.2017.01.011.
37. Gibson K, Ferris B. Cyanoacrylate closure of incompetent great, small and accessory saphenous veins without the use of post-procedure compression: initial outcomes of a post-market evaluation of the VenaSeal System (the WAVES Study). Vascular 2017;25 : 149–156. doi:10.1177/1708538116651014.
38. Almeida JI, Javier JJ, Mackay E, et al. First human use of cyanoacrylate adhesive for treatment of saphenous vein incompetence. J Vasc Surg Venous Lymphat Disord. 2013;1 : 174–180. doi:10.1016/j. jvsv.2012.09.010.
39. Lam YL, De Maeseneer M, Lawson J, et al. Expert review on the VenaSeal® system for endovenous cyano-acrylate adhesive ablation of incompetent saphenous trunks in patients with varicose veins. Expert Rev Med Devices 2017;14 : 755–762. doi:10.1080/17434440.2017.1378093.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 5-
All articles in this issue
- Od diagnostiky a léčby ke zdraví, chirurg by neměl stát opodál
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Poranění m. pectoralis major
- Redukce průtoku arteriovenózní fistule u pacientů po transplantaci ledviny
- Předoperační neselektivní podávání orálních nutričních doplňků pacientům podstupujícím elektivní kolorektální resekci – standard perioperační péče?
- První retransplantace plic s „ECMO bridge“ v České republice − kazuistika
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Poranění m. pectoralis major
- Endovenózní ablace křečových žil – současný stav a přehled metod
- Transversus abdominis release v řešení rozsáhlého chronického defektu střední čáry stěny břišní
- Apendikolit ako príčina neskorých komplikácií po apendektómii − kazuistika a prehľad literatúry
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

