-
Medical journals
- Career
Update podtlakové terapie pro rok 2021
Authors: R. Doležel; K. Menclová; P. Svoboda; Radek Pohnán
Authors‘ workplace: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy, Ústřední vojenská nemocnice Praha – Vojenská fakultní nemocnice
Published in: Rozhl. Chir., 2021, roč. 100, č. 5, s. 218-226.
Category: Review
doi: https://doi.org/10.33699/PIS.2021.100.5.219–227Overview
Podtlaková terapie (NPWT) je v klinické praxi 25 let. Celosvětově byla použita u více než 10 milionů ran. Repertoár výkonů podtlakové terapie stále roste. Původně jednoduchý výkon v sobě skrývá řadu úskalí a limitů a záleží na celé řadě klíčových detailů, aby byl mikrodeformační potenciál NPWT plně využit. V přehledu uvádíme patofyziologii, účinky a formy použití NPWT a přidáváme vlastní zkušenosti, tipy a návrh na využití podtlakové terapie během pandemie covid-19.
Klíčová slova:
enteroatmosférická píštěl – laparostoma – podtlaková terapie – infekce operační rány – covid-19 pandemie
ÚVOD
Využití subatmosférické, podtlakové terapie (negative pressure wound therapy – NPWT) datujeme v chirurgii od devadesátých let 20. století [1]. Kolem přelomu milénia se díky prospektivním randomizovaným studiím [2,3] NPWT etablovala do klinické praxe a dnes představuje pro řadu stavů (hluboké rány sterna, open - -abdomen, nehojící se rány) „zlatý standard“ léčby. Původně jednoduchý princip primárně odložené sutury s kontinuální drenáží a s odvodem infekčního materiálu mimo ránu na sebe nabalil řadu indikací a forem. Dnes patří NPWT k základnímu managementu komplikací, od prevence a kontroly infekcí v místě operačního výkonu (SSI – surgical site infection) přes drenáže infektů souvisejících se zlomeninami a ochranu štěpů a incizí až k uzávěrům laparotomie při břišních katastrofách či k řešení obtížně se hojících ran.
Náš přehledový článek rekapituluje specifika a pravidla podtlakové terapie, aby mohla být prováděna bezpečně a efektivně.
Názvosloví
V chirurgickém žargonu se názvy a zkratky pro podtlakovou terapii používají promiscue a nepřesně [4]. Za synonyma můžeme považovat: TPN – thérapie par pression négative, NPT – negative pressure therapy, NPWT – negative pressure wound therapy a VAC – vacuum assisted closure, (což je původně komerční název od firmy KCI, San Antonio, Tx, USA). Předpona i-NPWT znamená kombinaci podtlaku s instilací, tedy cíleným promýváním uzavřeného systému vhodným roztokem. Ci-NPWT (closure incision) se používá na již primárně uzavřenou incizi a má ryze preventivní charakter. V ambulancích se kromě konvenční NPWT využívají i jednorázové podtlakové bezkanystrové sety, značené s-NPWT (single-use) nebo také d-NPWT (disposable). Speciální podtypy NPWT zahrnují endoskopickou podtlakovou terapii (e-VAC), voštinovitě perforovaný foam k očistné instilaci (NPWT-i-VCC) atd. Přehled jednotlivých typů ukazují Tab. 1 a Schema 1.
Table 1. Typy podtlakové terapie
Tab. 1: Types of NPWT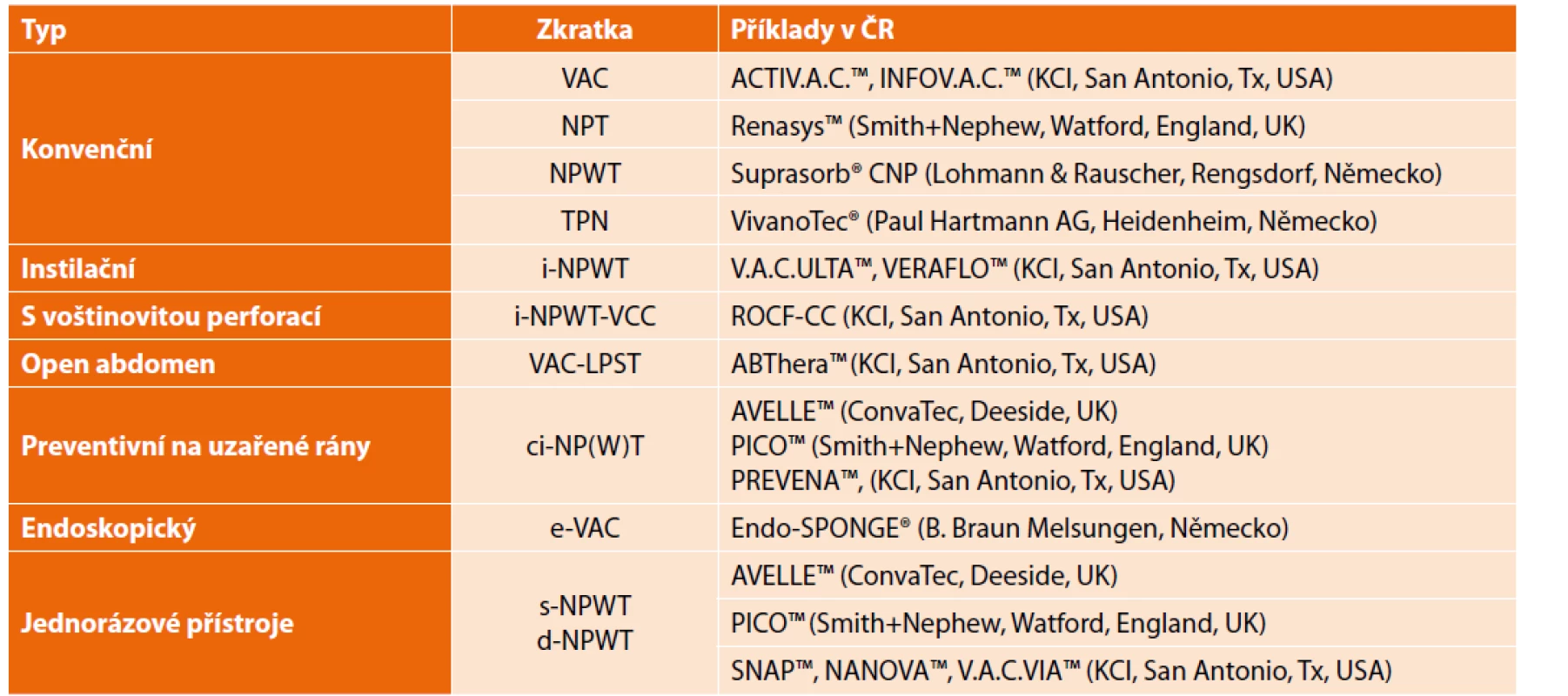
Poznámka: Firmy byly u jednotlivých typů seřazeny abecedně dle názvu produktu. Schema 1: Vztahy mezi uváděnými zkratkami tlakové terapie
Scheme 1: Relationships between the abbreviations of pressure therapy
Vysvětlivky: MPWT – mikrodeformační terapie ran, NPWT – podtlaková terapie ran, VAC – vakuem asistovaný uzávěr. Předpony: (ci-closure incision, d-disposable, e-endoscopic, i-instillation).
Legend: MPWT – micro deformative wound therapy, NPWT – negative pressure wound therapy, VAC – vacuum-assisted closure. Prefixes: (ci-closure incision, d-disposable, e-endoscopic, i-instillation).Materiál
Hermeticky uzavřený systém NPWT (VAC) se skládá: z krycí lepicí fólie s drenážním portem, z výplně, nejčastěji pěnové, či z vícevrstevné gázy (např. KerlixTM s polyhexanidem PHMB) a eventuálně z kontaktního drenážního filmu. Výplň přenáší odsavný (pod)tlak na kontaktní vrstvu rány. Pěnová výplň bývá zpravidla hydrofobní, antracitové barvy z polyuretanu. U instilací se používají výplně šedé, stříbrné či čisticí bílé. Bílý foam z polyvinylalkoholu je hydrofilní s póry 50−150 mikronů. Výplň je třeba chápat jako médium mezi odsavným kanystrem a kontaktní vrstvou rány. Bez podtlaku dokážou bakterie přerůst z rány do foamu a v jeho architektuře se pak rychle pomnožit. Následují je T lymfocyty, které ve foamu také nidují. Při instilaci je proto adekvátní časté promývání, tj. à 2−4 hodiny [5]. Jinak bychom hypoteticky mohli bakterie roznášet v celém systému. Odstrojování celého systému by měl šetrně provádět lékař, protože foam může obsahovat imunologicky vysoce aktivní tkáň.
Patofyziologie
NPWT je mechanická neinvazivní léčebná metoda, kdy k podpoře a urychlení hojení ran používáme subatmosférický tlak. NPWT působí na rány komplexně (Tab. 2), redukuje plochu rány kontrakcí okrajů, mikroa makrodeformací, stabilizuje mikroprostředí, redukuje matrixové metaloproteázy a zvyšuje mitogenní kinázy, kontinuálně mechanicky drénuje ránu a odvádí z ní exsudát i intersticiální tekutinu i nálož bakterií [6−8]. V okolí snižuje osmotický tlak, čímž lokálně zvyšuje průtok krve v kapilárách. Negativní tlak je pouze ve vztahu k atmosférickému tlaku, jinak jsou v systému sací tlakové gradienty pozitivní. Na rozhraní rány a foamu je tzv. kontaktní vrstva a sací tlak skrze foam působí na buňky mikrodeformačně. Při ideálním lokálním tlaku 8 až 12 mm Hg dochází k žádoucímu mikrostrečinku kontaktních buněk, které se natahují do pórů foamu [9]. Čím větší póry jsou (tradičně 400–600 mikronů), tím je vrůstání buněk výraznější a tvorba granulační tkáně postupuje rychleji [10]. Limitem vrůstání je lokální bolest. Změna mechanického napětí ovlivňuje tvorbu fenotypů fibroblastů a tím i produkci kolagenu a extracelulární hmoty, zvyšuje se lokální hladina MAP [11], VEGF, angiopoetinu - 2 a interleukinu-8 [12,13]. Na okolní tkáně (až do vzdálenosti 3 cm podkoží, respektive 1 cm svaloviny) působí tlakový gradient nepřímo tzv. endogenní drenáží. Prvních 10 minut po zapojení nastává odsátím edému reaktivní hyperemie. Toto překrvení ustává do 1 hodiny. Příliš vysoký tlakový gradient může vést k lokální tkáňové hypoperfúzi až k ischemii okolí rány. Žádoucí hypoperfúze je pouze na kontaktní vrstvě, jelikož stimuluje angiogenezi a reaktivní hyperemii v okolí. Prostý mechanický odtok intersticiální tekutiny, bohaté na prozánětlivé mediátory (elastázy, katepsiny, MMP 1 a 2 [13], zřejmě vede v časné fázi hojení rány k rychlejší tkáňové reparaci a angiogenezi [14].
Table 2. Působení NPWT na rány
Tab. 2: NPWT effects on wounds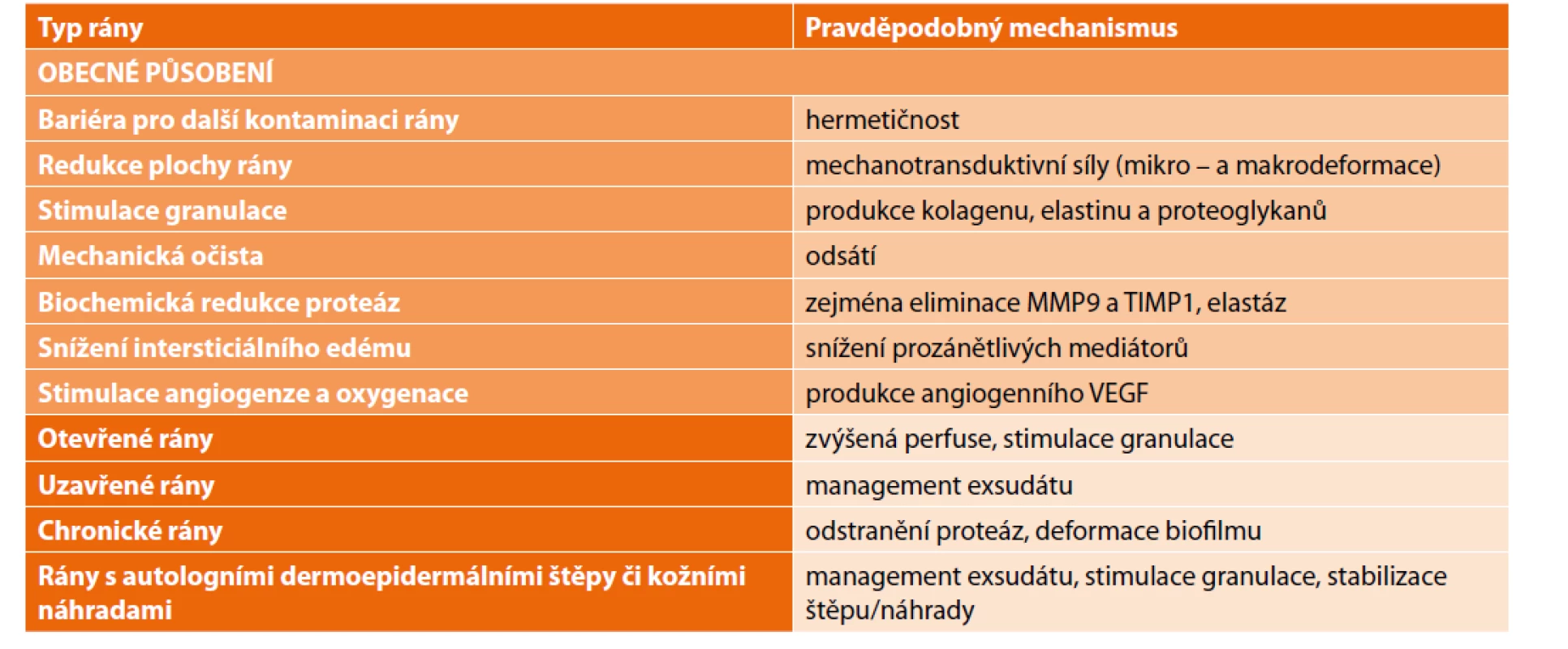
Instilační podtlaková terapie i-NPWT je oproti konvenčnímu podtlaku (NPWT) řádově účinnější (odhadem 80×) a dokáže zrychlit granulaci až o 43 % [15]. Je u ní vhodné použít kombinaci bílé a antracitové pěnové výplně. Nejvýhodnější je sendvičové zapojení 3 vrstev, přičemž kontaktní hydrofobní vrstva je voštinovitě vykrojená (tzv. VCC – vacuum cleaning closure). Díky velkým vykrojeným okům umožňuje dokonalý débridement tím, že odstraní hustý exsudát, fibrin a slough.
Ci-NPWT kontaktní vrstvu postrádá. Lepí se jako běžné krytí na již suturovanou ránu. Dokáže snižovat intersticiální edém, redukovat eventuální mrtvý prostor a přiblížit okraje rány [16]. Alternativně se používá jako tzv. „hranolková technika“, kdy se úzké hranoly foamu vkládají do podkoží mezi řídce založené stehy a nad kůží se propojí [17].
Někteří výrobci vlhkého krytí pravdivě poukazují na to, že jejich produkty dokážou např. svými absorpčními schopnostmi vyvinout ještě větší podtlakový gradient a NPWT překonat. Zde ale neplatí čím více, tím lépe! Například sací tlak u Redonova drénu začíná na cca -620 mm Hg, ale po načerpání 50−100 ml tekutiny gradient nekontrolovatelně klesá k 80−40 mm Hg. U NPWT je však tlak vždy konstantní, plně nastavitelný a v čase regulovatelný. Nižší hodnoty sacího tlaku mohou vést k netěsnostem a retencím tekutin, naopak přemrštěné hodnoty vytvářejí nechtěnou zónu ischemie a pacientovi přinášejí silnou bolest. Sací tlak 125 mm Hg dříve považovaný za optimum [1−3] je dnes spíše maximální hodnotou. Snížení ze 125 na 100 mm Hg má jen pozitivní účinky: lepší kontrakci, rychlost granulace i zvýšení regionálního krevního průtoku [15]. Chceme-li vybudovat granulační tkáň, musí být lokální tlak v kontaktní vrstvě kolem 10 mm Hg, proto volíme hodnoty mezi 80 až 125 mm Hg. Pracujeme-li v ischemickém terénu, např. u fascitidy, volíme nižší hodnoty tlaku kolem 50 mm Hg. Při drenáži rozsáhlých defektů na dolních končetinách (např. s KerlixemTM) nebo při Y zapojení by měl mít tlakový gradient alespoň 100 mm Hg. Přemostění (je-li žádoucí) by mělo být sestrojené pomocí oblepených foamů (nebo drénů) tak, abychom exsudátem nekontaminovali a neiritovali okolní kůži. U open-abdomen nepřekračujeme 85 mm Hg z obavy poškození útrob a možného vzniku enteroatmosférické píštěle (EAF). Při VAC laparostomatu (VAC-LPST) dochází díky dotyku ke změnám průtoku krve v kapilárách střevní stěny. Na zvířecím modelu se při 50 mm Hg průtok snížil o 35 % a při 125 mm Hg až o 60 % [18]. K drenáži dermoepidermálních štěpů a u open abdomen je vždy vhodné foam podložit drenážním filmem či silikonovou mřížkou, byť ztratíme působení na kontaktní vrstvu lůžka rány.
Medián intervalu výměny celého systému je nejčastěji 2−4 dny [15,19], někdy se jako indikátor k výměně používá fluorescenční obarvení bakterií [20].
Ošidné je působení NPWT na bakterie. Vakuum může svědčit anaerobům a gramnegativním bakteriím, ale i prosté odsávání vede ke snížení celkové nálože bakterií. NPWT bývá účinnější na grampozitivní bakterie a na nálože bakterií nad 106 CFU/gram [21,22]. Častější výměny foamu ve studiích nezlepšily dekontaminaci [15]. V metaanalýze z roku 2017 se vliv NPWT na bakterie neprokázal (některé studie ukázaly minimální schopnost bakteriostázy, jiné jen náhradu gramnegativních bakterií za grampozitivní [23]). Klinická studie z roku 2017 [24] ukázala, že po řádném débridementu došlo v ranách během jednoho NPWT cyklu k redukci bakterií z 89 % na 32 % (o 22 % u grampozitivních, o 21 % u fakultativních anaerobů, o 36 % u zlatého stafylokoka a o 24 % u pseudomonád). Výrazněji dekolonizovat rány dokážou i-NPWT s eliminací biofilmu až o 48 %, oproti jeho 14% nárůstu u konvenční NPWT [25]. Perioda výplachu však nesmí být delší než 4 hodiny [26].
NPWT zřejmě inhibuje bakteriální kolonizaci i tím, že urychluje průtok krve, zvyšuje procento kyslíku v tkáních a zlepšuje funkci neutrofilů a následnou odolnost vůči infekci pomocí mechanismu oxidačního vzplanutí [27]. Nedávná prospektivní randomizovaná studie ukázala, že nefermentativní gramnegativní bakterie se při NPWT významně eliminují, zatímco podíl Staphylococcus aureus se významně zvyšuje, což naznačuje různé účinky podtlaku na různé druhy bakterií [28]. In vitro umí NPWT komprimovat architekturu biofilmu, snížit jeho tloušťku i difuzní vzdálenost do tkání [29]. Zkoušejí se výplně impregnované stříbrem, PHMB, kyselinou boritou, ozonem atd., avšak zatím bez konkluzivních závěrů.
Léčba podtlakem je kontraindikovaná u maligních ran, neléčené osteomyelitidy, nespolupracujících pacientů a u prokázané anaerobní sněti, neúčinná je na eschary a suché gangrény. Ostatní kontraindikace jsou relativní, např. obnažené vulnerabilní tkáně. Věk není limitem [30], autoři mají vlastní zkušenosti s aplikací NPWT u nedonošeného novorozence (pro gastroschízu) i u anergických 95letých křehkých seniorů. V těchto extrémních případech musí být technika vždy maximálně šetrná (tzv. fyziologické operování) a nebolestivá, pacienti se musejí sledovat průběžně i mezi převazy.
Úskalí
Vulnerabilní struktury jako šlachy, cévy, nervy musíme před podtlakovou erozí chránit. Přestože dosud nebyl vědecky prokázán protektivní vliv drenážní fólie (v dutině břišní) na vznik EAF, my tuto fólii z logiky věci a dle doporučení výrobce vždy aplikujeme. Sací tlak musí být optimální k charakteru rány (Tab. 3); chybou je tlak příliš vysoký (>170 mm Hg, ale i příliš nízký <40 mm Hg). Pozor na krvácení při aplikaci dynamické sutury, které může celý odsavný systém zhatit. Přiblížení břišní fascie dynamickou suturou by nemělo být extrémní, nesmí totiž uzamknout část systému pod fascií, protože pak není drénovaná. Při odnímání foamu z rány by tekutý obsah neměl být zpětně vymačkán do rány a žádný díl foamu nesmí být v ráně ponechán (u nepravidelných defektů je lepší díly foamů sešít). NPWT (VAC) někdy může udržovat stav mitogenní sepse, přičemž nám de facto zkreslí racionální pohled na nezbytnou léčbu a pouze oddálí potřebný výkon (např. amputaci).
Table 3. Použití rozdílných hodnot podtlakové terapie
Tab. 3: Use of different values of NPWT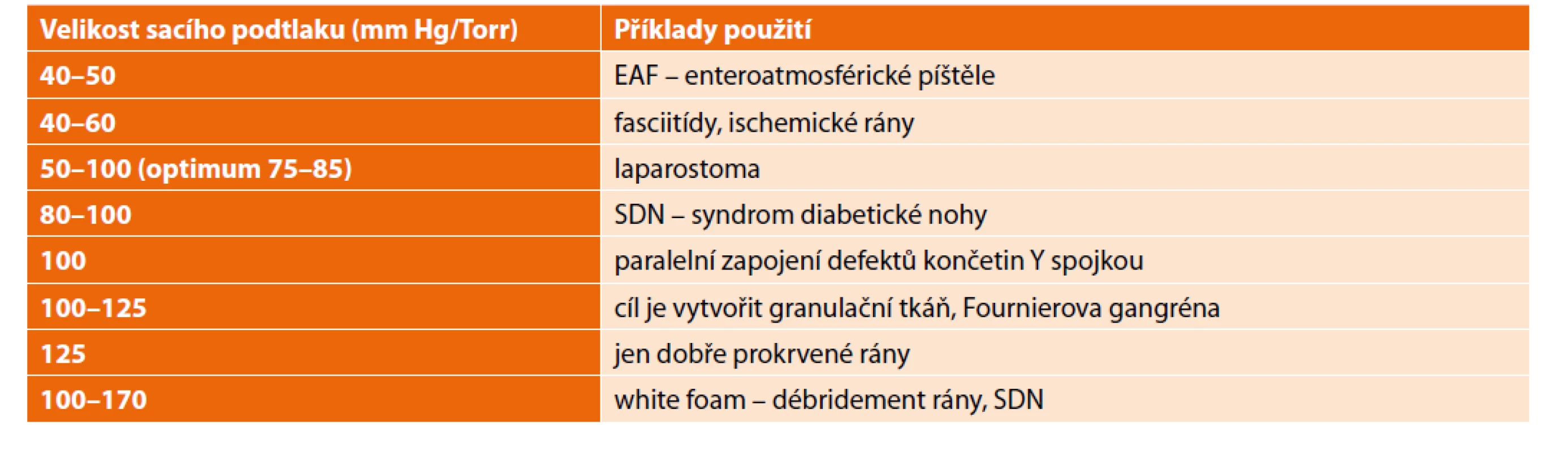
ci-NPWT
Closure incision-NPWT je hojně využíván v kardiochirurgii, ortopedii (u fraktur a artroplastik), v gynekologii, ale nalézá využití i v chirurgii (břišní, hrudní, vaskulární). V naší praxi ci-NPWT (včetně french-fry techniky) používáme zejména na pahýly po amputacích dolních končetin u vybraných rizikových pacientů nebo na rizikové operační rány. Ci-NPWT zvažujeme vždy při plastických operacích (modifikovaný Limberg, Karydakis) po ošetření abscedujícího pilonidálního sinu a na donorovou plochu po autotransplantaci dermoepidermálním štěpem. Ohledně ci-NPWT bylo dosud publikováno 44 randomizovaných studií (7447 pacientů) a dalších 89 trialů probíhá. Dle dostupných metaanalýz [31] ci - -NPWT evidentně redukuje SSI (se střední jistotou, znatelnější důkazy jsou pro hluboké infekce), neovlivňuje mortalitu ani vznik dehiscence rány (s nízkou jistotou) a v chirurgii je nákladově efektivní (v ortopedii u fraktur naopak není). Výhoda ci-NPWT nebyla dosud prokázána pro snížení rehospitalizací, reopearcí či pooperačních bolestí [32]. Obecně se předpokládá, že ci-NPWT vede ke snížení edému, laterální tenze a zmenšení mrtvého prostoru. Tím zabraňuje tvorbě seromu/hematomu a snižuje riziko dehiscence. Pro použití ci-NPWT je dnes konsenzuálně přijímán následující algoritmus viz Schema 2 [32] a Graf 1 [15].
Schema 2: Indikace pro použití ci-NPWT k prevenci SSI u primárně uzavřených ran
Scheme 2: Indications for ci-NPWT use to prevent SSI in primary closed wounds
Obtížně hojitelné defekty
Nehojící se rány (nepřesně též chronické) mohou nabýt takových rozměrů, že ztratí veškerý reepitelizační potenciál. Stagnují-li např. venózní bércové vředy 4 měsíce (v Německu) až 6 měsíců (ve Francii), jsou-li cirkulární nebo větší než 10 cm2, pak jsou po zvládnutí infekce indikovány k přeštěpování [33]. Podtlaková terapie se zde může uplatnit jak při přípravě defektu – dekolonizačně, tak i pooperačně ochranou vitality dermoepidermálního štěpu. Obecně zde volíme nižší tlaky a podložky (80 mm Hg), aby byl transudát efektivně odsát, ale zároveň, aby štěpem neprorostla hypergranulační tkáň. Obvykle samotný přenos autotransplantátu probíhá na sále v celkové anestezii. I v této fázi se již může uplatnit podtlaková terapie, konkrétně od roku 2015 pomocí systému CellutomeTM (KCI, San Antonio, Tx, USA, v ČR dosud není k dispozici). Jedná se o přenosný, miniinvazivní, ambulantní přístroj určený k odběru štěpů. Na kůži stehna se přes mřížku aplikuje podtlak 400 až 500 mm Hg na 45 minut, při které se bezbolestně skrze mřížku protáhnou mikrokupole (tzv. blistry), které po seříznutí můžeme aplikovat do defektu MEEK technikou [34]. Odpadá tím nutnost hospitalizace, riziko špatného hojení donorového defektu, což vídáme u velmi starých pacientů, i povinnost imobilizace dané končetiny [35].
VAC – laparostoma (VAC-LPST)
Samostatná kapitola je uzavření dutiny břišní pomocí NPWT při abdominálních katastrofách. Italští autoři srovnali 452 studií s 1225 pacienty [36]. Skupina uzavřená pomocí NPWT se signifikantně nelišila oproti skupině bez použití NPWT v úspěchu uzávěru fascie, ve 30denní pooperační morbiditě, v tvorbě EAF (2,1 % vs. 5,8 %), abscesů a ve výskytu krvácení. Naopak skupiny se lišily v pooperační mortalitě (28,5 % NPWT vs. 41,4 % non-NPWT) a v délce pobytu na JIP o 4,5 dne méně ve prospěch NPWT). U laparostomat existuje právem obávaná (iatrogenní) komplikace, zatížená vysokou mortalitou (40−70 %) – enteroatmosférická píštěl (EAF). U nemocných s EAF musíme současně řešit sepsi, nutri - ci, zjistit výšku a stupeň produkce píštěle, a především derivovat střevní výtok tak, aby nezatékal a nepůsobil zánět okolním tkáním s přechodem toxinů do systémové cirkulace. Výtok EAF může být nízký pod 200 ml/ den, střední nebo vysokoobjemový, nad 500 ml/den. Řešení včetně ošetřovatelské péče patří k nejnáročnějším v celé chirurgii, protože rozhraní vyhřeznuté sliznice se vzduchem (v okolí zpravidla s plastronem kliček) nenabízí žádný morfologický materiál k funkčnímu chirurgickému uzávěru. Tkáňová lepidla, přešívání píštělí, jejich resekce či transpozice muskulárním lalokem nevedou k řešení. Jako „přemosťující terapie“ se mohou dočasně použít srkavé drény (např. Foleyův katétr) či pracný Ring-VAC. Dosud nejúčinnější terapie se prokázala být kombinace NPWT s prefabrikovanými silikonovými okludéry, založená na původních metodách Govermana a Al Khouryho [37,38].
NPWT během pandemie (covid-19)
Pracovní skupina pro NPWT navrhla doporučení zdravotní péče, tj. prevenci, léčbu a organizaci pro chirurgické pacienty během pandemie covid-19, (Tab. 4 [39]). Prvořadým cílem je udržet volné kapacity personálu dui lůžek, tedy akcelerovat průchod pacientů chirurgickým pracovištěm neboli minimalizovat rehospitalizace a doby hospitalizací a také snížit počty ambulantních pacientů.
Table 4. Organizační návrh využití NPWT během pandemie covid-19.
Tab. 4: Proposal for organisation of care using NPWT during the COVID pandemic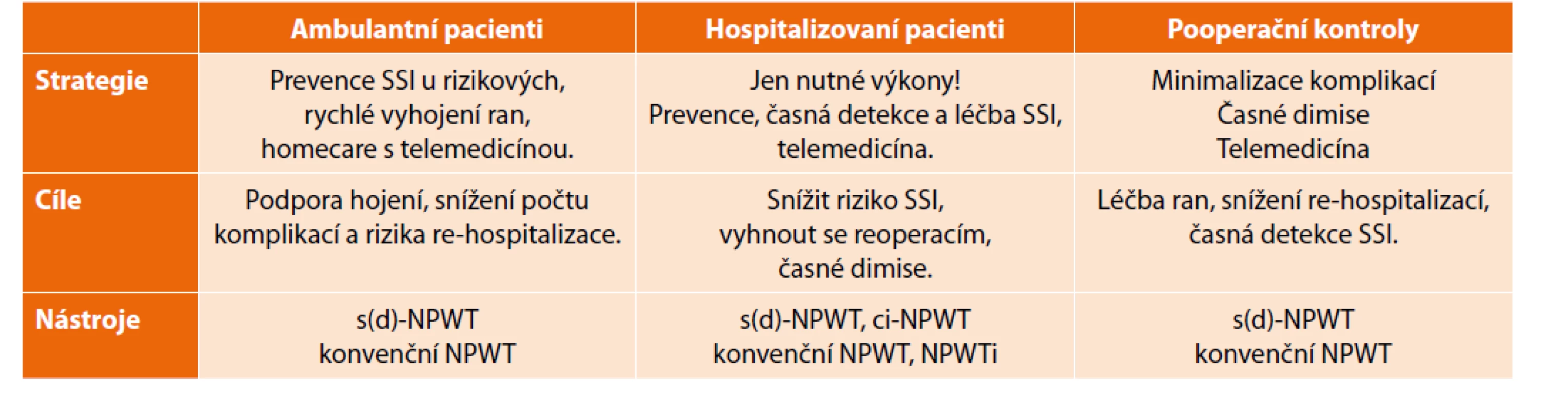
Plánované operanty doporučuje skupina k výkonu připravit (např. imunonutricí apod.) a stratifikovat je podle míry rizika předpokládaného komplikovaného průběhu (viz Graf 1). Exaktní výpočet predikující vznik SSI je dostupný na: https://riskcalculator.facs.org/Risk - Calculator/. U hospitalizovaných a již odoperovaných pacientů je nejdůležitější časná detekce komplikací a efektivní léčba SSI. Zde se uplatňují terapeutické principy podtlaku s tím, že pacienti mohou být propuštěni domů s naloženým NPWT setem.
Graph 1. Algoritmus pro užití ci-NPWT
Graph 1: Algorithm for the use of ci-NPWT
Ambulantní NPWT nám dává možnost zabezpečit vybrané pacienty bez nutnosti je hospitalizovat i možnost snížit frekvenci a počet ambulantních návštěv, aniž by tím utrpěla efektivita léčby. Po dimisi se dají ambulantně efektivně řešit pooperační dehiscence či infekce operační rány (povrchové, až hluboké) u pacientů bez známek sepse a bez nutnosti jejich znovupřijetí. Ambulantně můžeme využít jak (s)d-NPWT, s podporou granulační tkáně, angiogeneze a účinného odvedení exsudátu [40], tak i konvenční NPWT (s kódem 51850) u rizikových pacientů.
Naše zkušenosti
Na naší klinice používáme konvenční podtlakovou léčbu od roku 2008, systematicky od roku 2011. Za 10 let jsme provedli přes 3300 NPWT operací, s průměrným výkonem 350/rok, (poslední 3 roky). Od roku 2014 používáme s-NPWT ambulantně a od 2. pol. 2020 využíváme ambulantně i plnohodnotné kanystrové systémy. V naší praxi měníme systémy periodicky po třech dnech. U vysoce kontaminovaných ran (např. sterkorální peritonitidy) měníme systém zprvu po 2 dnech. Naopak u neinfikovaných ran interval prodlužujeme na 4 až 5 dní. Ci-NPWT, i-NPWT (vč. VCC), systém ABTheryTM či EndoSpongeTM používáme pouze ve vybraných případech. V loňském roce (2020) jsme provedli v rámci sekvenčního uzávěru dutiny břišní 145 NPWT laparostomat u 83 pacientů (ø 1,75 převazu na pacienta) a 66 podtlakových terapií do podkoží břišní stěny. Naše indikace k podtlakově kontrolovanému laparostomatu uvádíme v Tab. 5. U 3. a 4. stupně otevřeného břicha (dle Björcka, [41]) s konvenčním NPWT nevystačíme. Pozor je také třeba dát při abdominálním použití i-NPWT, která může při dlouhodobějším užití nechtěně působit jako peritoneální dialýza s vymytím klíčových minerálů. Při laparostomatu volíme sací tlak zpravidla 80 mm Hg. Je-li přítomná fasciitída s předpokládanou ischemií okrajů, snižujeme sací tlak na 50 mm Hg. K prevenci retrakce okrajů fascie sbližujeme okraje fascie dynamickou suturou. Pozor musíme dát na přehlédnutí krvácení během zavádění „gumiček“ i na to, aby všechny vrstvy foamu zůstaly v dotyku s celým systémem. Drobné krvácení podporované podtlakem může vést k prosycení foamu koaguly a ke ztrátě sací funkce. K prevenci dehiscence se dají použít (mimo dnes již překonaného Ventrofilu) i sofistikovanější systémy (např. ABRATM [42], VACWM – vacuum assisted wound closure with mesh mediated fascial traction [43]), které však u nás kvůli jejich ekonomické náročnosti nepoužíváme. Nemáme-li k dispozici ABTheruTM, substituujeme ji obalením a oblepením foamu do incizní fólie, kterou následně v požadovaném směru perforujeme, nebo vyvedeme Penrose drén do prostoru mezi dva pláty foamu. Odsavný drenážní port by u laparostomat měl být umístěn co nejblíže kaudálnímu pólu rány (nebo co nejdále od eventuální EAF). Aby se port po zapojení vpáčením nezdeformoval, je vhodné jej bezprostředně před jeho nalepením podložit „bolusem“ foamu do již nastřižené fólie. Nastřižení fólie pod portem by nemělo být větší než velikost 20korunové mince (ø 26 mm), ale také ne menší než ø 10 mm, aby mohly fungovat regulační kanálky.
Table 5. Indikace k založení NPWT (VAC) laparostoma
Tab. 5: Indications for NPWT (VAC) laparostomy
Vysvětlivky: IAP – intaabdominální tlak, WOPN – wall-off pancreatic necrosis NPWT používáme u flegmon syndromu diabetické nohy (SDN). Vředy bývají s převahou neuropatie či ischemie, proto optimálně volíme podtlak kolem 80 mm Hg. Je-li obnažený šlachový aparát, chráníme jej antiseptickým mastným tylem či bílým foamem. NPWT je vysoce účinný, ale nefunguje-li odsávání, může nedrénovanou oblast i výrazně (již za 4 hodiny) poškodit. Vzhledem k častému osídlení diabetických defektů gramnegativními bakteriemi a anaeroby střídáme sekvenci NPWT s lokální vlhkou terapií (superoxidové oplachy, GranuloxTM apod.), popř. s hyperbarickou oxygenoterapií (u stadií Wagner. 3+, či u TcPO2 <40 mm Hg). U SDN standardně nevyužíváme i-NPWT, protože vliv výplachů na hojení dosud pro SDN nebyl prokázán [44].
Praktické tipy
Konvenční systémy se dají opakovaně proplachovat podpichy do foamu s vhodným oplachovým roztokem (např. Actimaris, Aquitox, Betadine, Debriecasan, FR, Granudacyn, Lavanid, Nexodyn, Microdacyn, Octenilin (ne do dutinových), peroxid (pomalu!), Prontosan atd.). Proplachy nesmějí systém zničit, promývací doba by měla být alespoň několik minut a frekvence by neměla být delší než každé 4 hodiny.
Intermitentní mód používáme do ran, které chceme prokrvit a přegranulovat. Nepoužíváme jej do du - tin (peritonea). Nejčastěji střídáme 2 tlaky, např. 80 a 120 mm Hg. Rozdíl gradientu by neměl přesáhnout 40 mm Hg, protože pak bývá vnímán bolestivě. Doporučujeme intermitentní mód zapojovat vždy až první pooperační den, 24 hod. po konstrukci, abychom nenarušili hermetičnost systému. Vložením podložky (např. Atrauman Ag, Acticoat, HCel aj.) sice přidáme antiseptický prvek do rozhraní systému, ale výrazně zredukujeme granulační potenciál kontaktních buněk. Jako podložky se nehodí příliš mastné těsnicí síťky (např. Xeroform, Bactigras apod.). Tyto síťky bývají ale vhodné pod svrchní fólii tam, kde je potřeba ochránit fragilní kůži před macerací či iritací foamu.
Pro defekty v obtížném terénu (např. perineum, ruka, noha) si po odmaštění pokožky pomáháme nalepením proužků fólie do bezprostředního okolí defektu. Fólii nelepíme v celku, ale po úzkých pásech s cíleným vypínáním (ochranné podlepy odstraňujeme v pořadí 1−4 a 2−3). Nemáme-li záruku, že systém bude těsnit (např. v blízkosti stomií), předřazujeme před fólii aplikaci oboustranně lepicích pásků (Vivano Med Gel Strip, Paul Hartmann AG, Heidenheim, Německo) či systém utěsníme bariérou ze stomické pasty. Nohy i ruce např. s vyvázáním prstů lze utěsnit fóliemi slepenými k sobě (práce pro 4−6 rukou). Velice zdařilé a praktické jsou na končetiny objímající sáčky (např. EasyDress, Lohmann & Rauscher, Rengsdorf, Německo). Diskrétní, špatně detekovatelná netěsnost může být odhalena nalitím obarveného roztoku (metylenová modř, Betadine) přes svrchní fólii.
Vytvoříme-li sendvičový či přemostěný systém anebo participuje-li na léčbě více operatérů, je žádoucí zapsat počet kusů foamu do protokolu nebo k sobě jednotlivé komponenty sešít.
V provizorních podmínkách se dá dočasně sestrojit ci-dNPWT i bez přístroje (praktikováno autory např. v Afghánistánu). Po uzávěru rány čtverci a fólií (např. na kanyly) vpichem zahnuté jehly (těsně vedle fólie) odsajeme vzduch z prostoru čtverců např. 150ml výplachovou stříkačkou (JANETTE). Pak jehlu schodovitě pomalu vytáhneme, vpich přidržíme a eventuálně přelepíme. Stejně se dá aplikovat podtlaková terapie přes hadičku zavedenou např. do Mikuliczovy tamponády či pomocí 2 Redon drénů. Tyto podtlakové systémy jsou však vysloveně nouzové a měly by být použity jen v krajních situacích, např. kapacitních; nelze u nich totiž regulovat podtlak ani jej konstantně udržet v čase.
ZÁVĚR
E. Hemingway (1899−1961) pronesl: „Uchovejte si šarm i pod tlakem.“ Pro potřeby chirurgů v roce 2021 můžeme citát parafrázovat: „Uchovejte si šarm i s podtlakem.“. Podtlaková léčba dokáže v dobrých rukách prokazatelně snížit náklady na převazovou péči, zmenšit bolest i zkrátit dobu hospitalizace. Byť jsou podtlakové výkony dosud považovány za banální, k prvotřídní jakosti provedení je třeba dodržet celou plejádu algoritmů a pravidel. Pomoci nám může podlepení okrajů, přemostění, ochrana okolní kůže, cyklické proplachy a optimální nastavení přístroje. K dokonalosti se však každý musí „prolepit“ sám.
Seznam zkratek:
ACS − abdominal compartment syndrome
CFU − Colony Forming Units
EAF − enteroatmosférická píštěl
IAP − intra-abdominal pressure
MAP − mitogen activated protein-kinases
MMP − matrixové metaloproteázy
NPT − negative pressure therapy
NPWT − negative pressure wound therapy Mm Hg − milimetr rtuťového sloupce (1 mm Hg=1 Torr ≈ 133,322 Pa)
PHMB − polyhexa-methyl-biguanid
SDN − syndrom diabetické nohy
SSI − surgical site infection
TPN − thérapie par pression négative
VAC − vacuum assisted closure
VAC-LPST − vacuum assisted closure laparostomy
VEGF − vascular endothelial growth factor
WOPN − wall-off pancreatic necrosis
Podpořeno grantem IP MO 1012
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
Plk. MUDr. Radek Doležel, Ph.D.
Chirurgická klinika 2. LF UK a ÚVN – VFN v Praze
U voj. nemocnicie 1200
169 02 Praha
e-mail: dolezrad@uvn.cz
Sources
1. Argenta LC, Morykwas MJ. Vacuum-assisted closure: a new method for wound control and treatment: clinical experience. Ann Plast Surg. 1997;38(6):563−576. doi:10.1097/00000637-199706000 - 00002.
2. McCallon SK, Knight CA, Valiulus JP, et al. Vacuum-assisted closure versus saline - moistened gauze in the healing of postoperative diabetic foot wounds. Ostomy Wound Manage. 2000;46(8):28−32.
3. Joseph E, Hamori CA, Bergman S, et al. A prospective randomized trial of vacuum-assisted closure versus standard therapy of chronic nonhealing wounds. Wounds: A Compendium of Clinical Research and Practice 2000;12 : 60–67.
4. Bobkiewicz A, Banasiewicz T, Ledwosiński W, et al. Medical terminology associated with negative pressure wound therapy (NPWT). Under-standing and misunderstanding in the field of NPWT. Negative Pressure Wound Therapy 2014;1 : 69−73.
5. Mouës CM, Vos MC, van den Bemd GJ, et al. Bacterial load in relation to vacuum-assisted closure wound therapy: a prospective randomized trial. Wound Repair Regen. 2004;12(1):11−17. doi:10.1111/ j.1067-1927.2004.12105.x.
6. Zhang L, Weng T, Wu P, et al. The combined use of negative-pressure wound therapy and dermal substitutes for tissue repair and regeneration. BioMed Research International 2020;8824737. doi:10.1155/2020/8824737.
7. Banwell PE, Téot L. Topical negative pressure (TNP): the evolution of a novel wound therapy. J Wound Care 2003;12(1):22−28. doi:10.12968/jowc.2003.12.1.26451.
8. Šimek M, Bém R. Podtlaková léčba ran. Praha, Maxdorf 2013.
9. Saxena V, Hwang CW, Huang S, et al. Vacuum - assisted closure: microdeformations of wounds and cell proliferation. Plast Reconstr Surg. 2004;114(5):1086−1096; discussion 1097−1098. doi:10.1097/01. prs.0000135330.51408.97.
10. Borgquist O, Gustafsson L, Ingemansson R, et al. Micro - and macromechanical effects on the wound bed of negative pressure wound therapy using gauze and foam. Ann Plast Surg. 2010;64(6):789−793. doi:10.1097/ SAP.0b013e3181ba578a.
11. Kremers L, Kearns M, Hammon D, et al. Involvement of mitogen activated protein kinases (map kinases) in increased wound healing during sub-atmospheric pressure (SAP) treatment. Wound Repair and Regeneration 2003;11(5):009.
12. Shiu YT, Weiss JA, Hoying JB, et al. The role of mechanical stresses in angiogenesis. Crit Rev Biomed Eng. 2005;33(5):431−510. doi:10.1615/critrevbiomedeng.v33.i5.10.
13. Labler L, Rancan M, Mica L, et al. Vacuum - assisted closure therapy increases local interleukin-8 and vascular endothelial growth factor levels in traumatic wounds. J Trauma 2009;66(3):749−757. doi:10.1097/TA.0b013e318171971a.
14. Kairinos N, Solomons M, Hudson DA. Negative-pressure wound therapy I: the paradox of negative-pressure wound therapy. Plast Reconstr Surg. 2009;123(2):589−598. doi:10.1097/ PRS.0b013e3181956551.
15. Apelqvist J, Willy C, Fagerdahl AM, et al. EWMA document: Negative pressure wound therapy. J Wound Care 2017;26(Sup3): S1-S154. doi:10.12968/ jowc.2017.26.Sup3.S1.
16. Fowler AL, Barry MK. Closed incision negative pressure therapy for laparotomy wounds: A review. Clin Surg. 2018;3 : 2123.
17. Chopra K, Tadisina KK, Singh DP. The ‘French Fry’ VAC technique: hybridisation of traditional open wound NPWT with closed incision NPWT. Int Wound J. 2016;13(2):216−219. doi:10.1111/ iwj.12266.
18. Lindstedt S, Malmsjö M, Hlebowicz J, et al. Comparative study of the microvascular blood flow in the intestinal wall, wound contraction and fluid evacuation during negative pressure wound therapy in laparostomy using the V.A.C. abdominal dressing and the ABThera open abdomen negative pressure therapy system. Int Wound J. 2015;12(1):83−88. doi:10.1111/iwj.12056.1.
19. Shweiki E, Gallagher KE. Assessing a safe interval for subsequent negative pressure wound therapy change after initial placement in acute, contaminated wounds. Wounds 2013;25(9):263−271.
20. Raizman R. Fluorescence imaging guided dressing change frequency during negative pressure wound therapy: a case series. J Wound Care 2019 1;28(Sup9):S28 − S37. doi:10.12968/jowc.2019.28.Sup9. S28.
21. Lessing MC, James RB, Ingram SC. Comparison of the effects of different negative pressure wound therapy modes-continuous, noncontinuous, and with instillation-on porcine excisional wounds. Eplasty. 2013;13:e51.
22. Weed T, Ratliff C, Drake DB. Quantifying bacterial bioburden during negative pressure wound therapy: does the wound VAC enhance bacterial clearance? Ann Plast Surg. 2004;52(3):276−279; discussion 279−280. doi:10.1097/01. sap.0000111861.75927.4d.
23. Glass GE, Murphy GRF, Nanchahal J. Does negative-pressure wound therapy influence subjacent bacterial growth? A systematic review. J Plast Reconstr Aesthet Surg. 2017;70(8):1028−1037. doi:10.1016/j.bjps.2017.05.027.
24. Jentzsch T, Osterhoff G, Zwolak P, et al. Bacterial reduction and shift with NPWT after surgical debridements: a retrospective cohort study. Arch Orthop Trauma Surg. 2017;137(1):55−62. doi:10.1007/ s00402-016-2600-z.
25. Yang C, Goss SG, Alcantara S, et al. Effect of negative pressure wound therapy with instillation on bioburden in chronically infected wounds. Wounds 2017;29(8):240−246.
26. Matiasek J, Domig KJ, Djedovic G, et al. The effect of negative pressure wound therapy with antibacterial dressings or antiseptics on an in vitro wound model. J Wound Care 2017;26(5):236−242. doi:10.12968/jowc.2017.26.5.236.
27. Potter MJ, Banwell P, Baldwin C, et al. In vitro optimisation of topical negative pressure regimens for angiogenesis into synthetic dermal replacements. Burns 2008;34(2):164−174.
28. Schultz G, Bjarnsholt T, James GA, et al. Consensus guidelines for the identification and treatment of biofilms in chronic nonhealing wounds. Wound Repair and Regeneration 2017;25(5):744–757. doi:10.1111/wrr.12590.
29. Ngo QD, Vickery K, Deva AK. The effect of topical negative pressure on wound biofilms using an in vitro wound model. Wound Repair and Regeneration 2012;20(1):83–90. doi:10.1111/j.1524 - 475x.2011.00747.x.
30. Choi WW, McBride CA, Kimble RM. Negative pressure wound therapy in the management of neonates with complex gastroschisis. Pediatr Surg Int. 2011;27(8):907−911. doi:10.1007/ s00383-011-2868-6.
31. Norman G, Goh EL, Dumville JC, et al. Negative pressure wound therapy for surgical wounds healing by primary closure. Cochrane Database Syst Rev. 2020;5(5):CD009261. doi:10.1002/14651858.CD009261.pub5.
32. Willy C, Agarwal A, Andersen CA, et al. Closed incision negative pressure therapy: international multidisciplinary consensus recommendations. Int Wound J. 2017;14(2):385−398. doi:10.1111/ iwj.12612.
33. Gupta S. Optimal use of negative pressure wound therapy for skin grafts. Int Wound J. 2012;9 Suppl 1 : 40–47. doi:10.1111/j.1742-481X.2012.01019.x.
34. Quintero EC, Machado JFE, Robles RAD. Meek micrografting history, indications, technique, physiology and experience: a review article. J Wound Care 2018 Feb 1;27(Sup2):S12−S18. doi:10.12968/ jowc.2018.27.Sup2.S12.
35. Smith OJ, Edmondson SJ, Bystrzonowski N, et al. The CelluTome epidermal graft-harvesting system: a patient-reported outcome measure and cost evaluation study. Int Wound J. 2017;14(3):555−560. doi:10.1111/iwj.12644.
36. Cirocchi R, Birindelli A, Biffl WL, et al. What is the effectiveness of the negative pressure wound therapy (NPWT) in patients treated with open abdomen technique? A systematic review and meta-analysis. J Trauma Acute Care Surg. 2016 Sep;81(3):575−584. doi:10.1097/TA.0000000000001126.
37. Goverman J, Yelon JA, Platz JJ, et al. “Fistula VAC,” a technique for management of enterocutaneous fistulae arising within the open abdomen: report of 5 cases. J Trauma 2006;60(2):428−431; doi:10.1097/01.ta.0000203588.66012.c4.
38. Al-Khoury G, Kaufman D, Hirshberg A. Improved control of exposed fistula in the open abdomen. J Am Coll Surg. 2008;206(2):397−398. doi:10.1016/j.jamcollsurg. 2007.07.027.
39. Banasiewicz T, Becker R, Bobkiewicz A, et al. Prevention and therapy of acute and chronic wounds using NPWT devices during the COVID-19 pandemic, recommendation from The NPWT Working Group, Negative Pressure Wound Therapy Journal 2020;7(2):4−9. doi:10.18487/ npwtj.v7i2.58.
40. Meloni M, Izzo V, Vainieri E, et al. Management of negative pressure wound therapy in the treatment of diabetic foot ulcers. World J Orthop. 2015 18;6(4):387−393. doi:10.5312/wjo.v6.i4.387.
41. Björck M, Bruhin A, Cheatham M, et al. Classification- - important step to improve management of patients with an open abdomen. World J Surg. 2009;33(6):1154−1157. doi:10.1007/s00268-009-9996-3.
42. Mukhi AN, Minor S. Management of the open abdomen using combination therapy with ABRA and ABThera systems. Can J Surg. 2014;57(5):314−319. doi:10.1503/cjs.026613.
43. Kleif J, Fabricius R, Bertelsen CA, et al. Promising results after vacuum-assisted wound closure and mesh-mediated fascial traction. Dan Med J. 2012;59(9):A4495.
44. Lavery LA, Davis KE, La Fontaine J, et al. Does negative pressure wound therapy with irrigation improve clinical outcomes? A randomized clinical trial in patients with diabetic foot infections. Am J Surg. 2020;220(4):1076−1082. doi:10.1016/j.amjsurg.2020.02.044.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 5-
All articles in this issue
- Vojenská chirurgie ve vojenské nemocnici
- Miniinvazivní pankreatické resekce ve světle důkazů − state of the art
- Update podtlakové terapie pro rok 2021
- Roboticky asistovaná léčba rektálního karcinomu – výsledky nerandomizované studie
- 10 let laparoskopické tubulizace žaludku v Ústřední vojenské nemocnici Praha
- Posttraumatická interkostální plicní herniace – kazuistika
- Penetrující poranění břicha – vybrané kazuistiky
- Resekce hlavy pankreatu v terénu stenózy truncus coeliacus: kazuistika a přehled literatury
- The impact of the Covid-19 pandemic on hernia surgery in the University Hospital in the Czech Republic
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Update podtlakové terapie pro rok 2021
- Posttraumatická interkostální plicní herniace – kazuistika
- Penetrující poranění břicha – vybrané kazuistiky
- 10 let laparoskopické tubulizace žaludku v Ústřední vojenské nemocnici Praha
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

