-
Medical journals
- Career
Aorto-kavální píštěl – kazuistické sdělení
Authors: K. Houdek; J. Moláček; V. Třeška
Authors‘ workplace: Chirurgická klinika, Fakultní nemocnice a Lékařská fakulta v Plzni, Univerzita Karlova
Published in: Rozhl. Chir., 2020, roč. 99, č. 5, s. 236-238.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2019.98.5.236–238Overview
S výdutí břišní aorty může souviset aorto-kavální píštěl. Ta nemusí mít zcela specifické symptomy. Mezi nejčastější příznaky patří i ruptura výdutě břišní aorty. Tomu odpovídají akutní příznaky a naléhavost léčby. Článek popisuje případ 78letého pacienta s objemnou výdutí břišní aorty s aorto-kavální píštělí, která se prezentovala náhle vzniklou bolestí břicha, dušností, hypotenzí a projevy akutního srdečního selhání s přetížením pravého srdce. Pacientovi byla urgentně provedena resekce výdutě s transaortální suturou píštěle a náhradou aorty tubulární protézou. V průběhu operace proběhla úspěšně resuscitace a defibrilace pro fibrilační srdeční zástavu. Po operaci byl stav komplikován přetrvávající poruchou vědomí a myokardiální ischemií, což vyústilo v úmrtí pacienta pod obrazem kardiálního selhání 3 týdny po operaci. Autoři poukazují na závažnost situace, na různé aspekty a možnosti léčby tohoto onemocnění s nejistou prognózou a na důležitost multioborové spolupráce v celém procesu léčby včetně primární diagnostiky.
Klíčová slova:
aorto-kavální píštěl – stentgraft – chirurgická léčba
Úvod
Aorto-kavální píštěl je vzácná, ale bohužel s vysokou mortalitou. Její incidence se dle různých zdrojů pohybuje od 0,22 % do 10 % [1,3]. Nejčastěji se jedná o komplikaci aneuryzmatu břišní aorty [2,4,5]. Další možné příčiny aorto-kavální píštěle mohou být břišní trauma či iatrogenní poranění [6,8]. Možná je i vrozená aorto-kavální píštěl. Jen zřídka mohou být příčinou mykotická výduť např. při lues či poruchy pojivové tkáně [9]. Klinické příznaky nemusejí být zcela specifické. Projevy a jejich závažnost mohou do určité míry záviset i na rychlosti jejich rozvoje, resp. rychlosti rozvoje či progrese arterio-venózního zkratu a na místě jeho vytvoření, a to od zcela asymptomatických přes zvýšený pulzový tlak a známky žilní kongesce až po srdeční selhání včetně akutní břišní symptomatologie [6,7]. Často je popisována triáda bolesti břicha či zad, hmatná výduť a hrubý šelest v břiše [1,3,7]. Před rutinní diagnostikou pomocí CT angiografie nebylo jejich předoperační rozpoznání časté [2,6,10]. V diagnostice dominuje právě CT angiografické vyšetření provedené ve více fázích [10]. Diagnostika je možná i za pomoci duplexní sonografie, magnetické rezonance či digitální subtrakční angiografie [6,7]. Podezření na takovýto zkrat může vyslovit i kardiolog na základě echokardiografického vyšetření [11]. Ve srovnání s rupturou výdutě aorty jsou výsledky léčby pacientů s aorto-kavální píštělí horší. Dle rychlosti a přesnosti předoperační diagnostiky a dle zvoleného způsobu léčby se mortalita dle různých autorů pohybuje mezi 15 % až 100 % [6,7,12,14]. Terapie v současné době nabízí v zásadě 2 přístupy. Chirurgický otevřený a endovaskulární [6,7,12,14,17]. S ohledem na počty případů jsou metody reportovány spíše jako jednotlivá kazuistická sdělení nebo monocentrické výsledky na menším souboru pacientů. S ohledem na nižší výskyt, a tedy i menší zkušenosti s řešením této komplikace jsme se rozhodli pro prezentaci následující kazuistiky.
Kazuistika
78letý pacient byl přivezen na akutní příjem pro asi 3hodinovou anamnézu bolestí pravé poloviny břicha, ke kterým se přidala i výrazná bolest hlavy. Pacient udával i zvracení. V předchorobí léčený hypertonik. Při příjmu byl pacient alterovaný, ale při vědomí, komunikující, klidově dušný (dechová frekvence 22/min.) s hypotenzí 70/40 mmHg, tachykardií 105/min. Při klinickém vyšetření cyanotický se zvýšenou náplní žil v horní polovině těla. Na břiše s hmatnou, citlivou, pulzující rezistencí v epigastriu a s hmatnými oslabenými pulzacemi na femorálních tepnách. Na EKG byly patrné deprese ST ve svodech II, III, aVF, V2–V6. Bylo pokračováno v již zahájeném podávání farmakologické podpory oběhu a volumoterapii. Dle bedside echokardiografického vyšetření odhadovaná dobrá systolická funkce levé komory srdeční se susp. hypokinézou přední stěny a anterosepta. Pravá komora srdeční je dilatovaná. Perikard byla bez přítomného výpotku. Dle doplněného CT angiografického vyšetření (Obr. 1 a 2) bylo potvrzeno objemné subrenální aneuryzma aorty (průměr 11 cm) s přítomnou aorto-kavální píštělí bez jednoznačných známek ruptury. Z patologických hodnot ve vstupní laboratoři přítomna leukocytóza 20,8 109/l, hemoglobin 110 g/l, kreatinin 157 μmol/l, CK 4,24 μkat/l, myoglobin 2702 μg/l, troponin T hs 438 ng/l a NT pro BNP 2510 ng/l, D-Dimery nad 5 mg/l a známky acidózy. Stav byl uzavírán jako komplikované aneuryzma břišní aorty s aorto-kavální píštělí, známkami pravolevého zkratu a akutním cor pulmonale se sekundární myokardiální lézí a pacient byl z vitální indikace indikovaný k operačnímu výkonu. Operace byla vedena v celkové anestezii ze střední laparotomie. Peroperační nález potvrdil nález na CT – městnání na játrech, objemná subrenální výduť bez známek hematomu či krvácení v retroperitoneu. Při odhalování aorty a nasazování svorky v oblasti krčku subrenálně došlo u pacienta k srdeční zástavě na podkladě fibrilace komor. Nepřímou srdeční masáží a defibrilací 2 výboji se podařilo obnovit účinnou srdeční akci. Za heparinizace se podařilo dokončit resekci výdutě s přešitím asi 2 cm široké aorto-kavální píštěle přes stěnu vaku výdutě a segment nahradit tubulární protézou aorto-aortálně. Další průběh operačního výkonu již nebyl komplikován. Perioperační krevní ztráta byla 2000 ml a celková doba trvání výkonu 130 minut. Po operaci byl pacient předán do péče Kliniky anestezie, resuscitace a intenzivní medicíny, kde nadále vyžadoval farmakologickou podporu oběhu. Bezprostřední pooperační průběh nesvědčil pro chirurgickou komplikaci výkonu, stav neprogredoval do hepatorenálního selhávání, ale došlo k dalšímu vzestupu kardiospecifické laboratoře (troponin T hs 8000 ng/l, NT pro BNP nad 35 000 ng/l). Kontrolní echokardiografické vyšetření prokázalo akinezu hrotu levé komory, apikální 1/2 anterosepta, apikální 1/2 přední stěny, apikální 1/2 zadní stěny s EF 30–35 %. Bylo pokračováno v podávání 250 mg i.v. formy kyseliny acetylsalicylové + nízkomolekulárního heparinu (Fraxiparine 0,6 ml 2× denně s.c.). Pacient byl postupně odtlumen, ale budil se do neklidu bez jednoznačné neurologické lateralizace či motorického deficitu. V dalších pooperačních dnech byla zahájena enterální nutrice a duální antiagregační terapie v kombinaci Tikagrelor + i.v. forma kyseliny acetylsalicylové (prokázaná neúčinná antiagregační léčba v monoterapii). V dalších dnech byl pacient opakovaně kontrolován kardiologem a bylo doplněno koronarografické vyšetření s nálezem difuzního aterosklerotického stenotického postižení (významné na RIA, RMS I, RMS II i ACD). V dalším průběhu nedošlo k rozvoji chirurgické komplikace, rána byla zhojena per primam intentionem a pacient dobře toleroval enterální příjem. U nemocného však nadále přetrvával psychomotorický neklid s poruchou vědomí a nutnost oběhové a ventilační podpory s nejistým výhledem na reparaci poruchy vědomí a s nejistou prognózou. Proto nebyl indikovaný k aortokoronárním bypassům a byl přeložen 18. pooperační den na Anesteziologicko-resuscitační oddělení v místě bydliště. Pacientův celkový stav a neurologický deficit (porucha vědomí) se však ani nadále nezlepšovaly a pacient po dalším týdnu zemřel pod obrazem progredujícího kardiálního selhání.
Image 1. CT angiografie, axiální řez Žlutá šipka − vena cava inferior, červená šipka − aorto-kavální píštěl, modrá šipka - aneuryzma subrenální aorty.
Fig. 1: CT angiography, axial cross-section Yellow arrow − vena cava inferior, red arrow − aorto-caval fistula, blue arrow - infrarenal aortic aneurysm.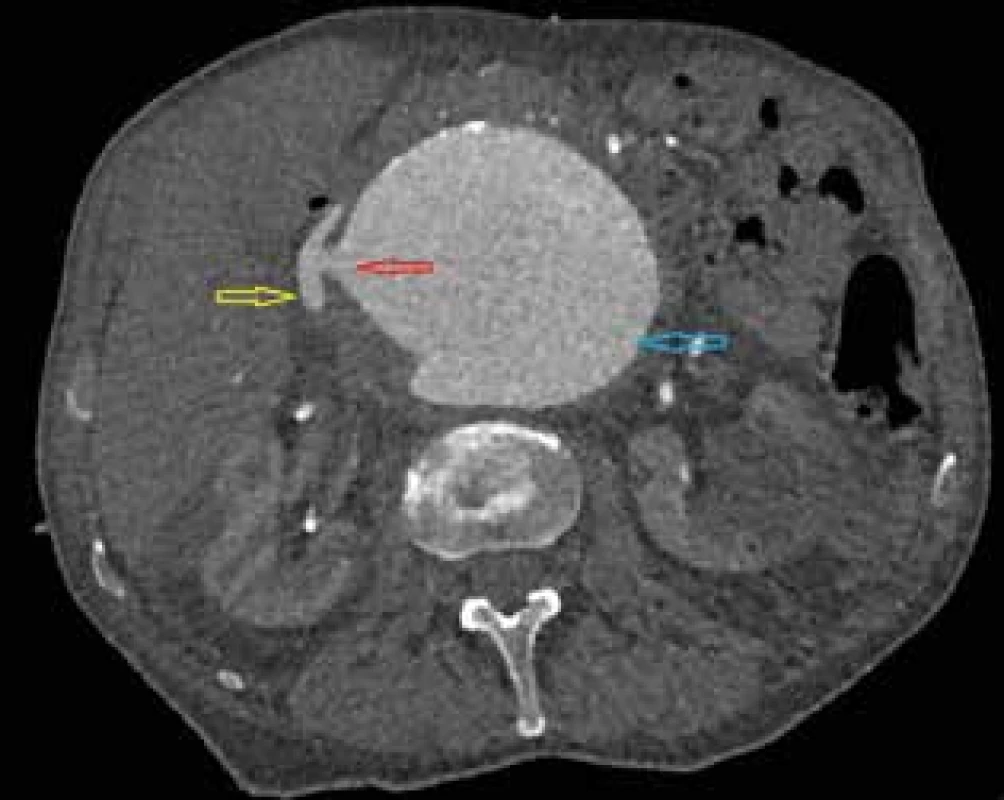
Image 2. CT angiografie, koronární řez Žlutá šipka - vena cava inferior, červená šipka − aorto-kavální píštěl, modrá šipka − aneuryzma subrenální aorty.
Fig. 2: CT angiography, frontal cross-section Yellow arrow − vena cava inferior, red arrow − aorto-caval fistula, blue arrow − infrarenal aortic aneurysm.
Diskuze
Námi zvolený postup si kladl za cíl v první době řešit příčinu vzniklého stavu i s vědomím vysokého rizika kardiálních komplikací. Celkový stav pacienta nedovoloval odklad výkonu. Resekce výdutě aorty s transaortální suturou píštěle, resp. stěny dolní duté žíly je zcela ve shodě s dostupnou literaturou [6,7,10,12,13]. Pokud operatér před samotným výkonem zná anatomické poměry a komplikující stavy a onemocnění, může snížit rizika komplikací, jako je větší krevní ztráta nebo při široké píštěli například i možnost plicní embolizace částí trombu z vaku výdutě. Menší riziko kardiálních komplikací by jistě představovalo radiointervenční řešení [17], které je na našem pracovišti trvale dostupné. Anatomické uspořádání a konfigurace aorty a výdutě však neumožňovaly použití nám v danou chvíli dostupných materiálů (stentgraftů). Endovaskulární techniky a přístupy mohou být použity k definitivnímu řešení, ale i jen jako určitý druh paliativního řešení (bridging) k zvládnutí akutního stavu a přípravě pacienta k definitivnímu řešení. Jako zcela dostačující a s minimálním rizikem vzniku endoleaku II. typu se jeví použití samotného aortálního stentgraftu [15,16]. Je možné i jeho použití v kombinaci s pokusy o uzavření píštěle okludery [17,18]. Možná je implantace stentgraftu i do dolní duté žíly [19]. Otázkou při tomto použití však zůstává udržitelnost dlouhodobé průchodnosti stentgraftu [20]. Na našem pracovišti s tímto řešením zkušenosti nemáme.
Závěr
Aorto-kavální píštěl se může projevit stejnými symptomy jako ruptura výdutě břišní aorty, pravostranné srdeční selhání či jiné akutní stavy. Rychlost a dostupnost CT vyšetření v dnešní době zlepšuje možnosti předoperační diagnostiky a na jejím základě zlepšuje i plánování léčebné strategie. V léčbě je možné použít otevřený i endovaskulární přístup. Obě léčebné modality mohou mít své výhody i rizika. Z již uvedených důvodů (jednotlivá kazuistická sdělení, menší soubory pacientů, monocentrické studie) nejsme schopni posoudit, který přístup by měl být upřednostněn. Vždy bude záviset především na možnostech a zkušenostech každého pracoviště. Včasná a správně cílená a vedená léčba může snižovat rizika a zlepšovat prognózu pacientů. V případě akutních stavů rozhoduje především časový faktor a neodkladnost řešení. Současná přítomnost výdutě a aorto-kavální píštěle se známkami srdeční nedostatečnosti z přetížení srdce má horší prognózu pro nemocné a vyžaduje multidisciplinární přístup po celou dobu léčby.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Karel Houdek, Ph.D.
Chirurgická klinika, Fakultní nemocnice Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: houdekk@fnplzen.cz
Sources
- Miani S, Giorgetti PL, Arpesani A, et al. Spontaneous aorto-caval fistulas from rupured abdominal aortic aneurysms. Eur J Vasc Surg. 1994;8(1):36−40. doi: 10.1016/s0950-821x(05)80117-3.
- Schmidt R, Bruns C, Walter M, et al. Aorto-caval fistula - an uncommon complication of infrarenal aortic aneurysms. Thorac Cardiovasc Surg. 1994;42(4):208−211. doi: 10.1055/s-2007-1016489.
- Potyk DK, Guthrie CR. Spontaneous aortocaval fistula. Ann Emerg Med. 1995;25(3):424−427 D. doi: 10.1016/s0196-0644(95)70305-5.
- McKeown BJ, Rankin SC. Aortocaval fistulae presenting with renal failure: CT diagnosis. Clin Radiol. 1994;49(8):570−572. doi: 10.1016/s0009-9260(05)82940-x.
- Iriz E, Ozdogan ME, Erer D, et al. A giant aortocaval fistula due to abdominal aortic aneurysm. Int J Cardiol. 2006;10;112(3):e78−e80. doi: 10.1016/j.ijcard.2006.03.075.
- Cinara IS, Davidovic LB, Kostic DM, et al. Aorto-caval fistulas: a review of eighteen years experience. Acta Chir Belg. 2005;105(6):616−620. doi: 10.1080/00015458.2008.11679788.
- Leigh-Smith S, Smith RC. Aorto caval fistula - the „bursting heart syndrome“. J Accid Emerg Med. 2000;17 : 223−225. doi:10.1136/emj.17.3.223.
- Fujisawa Y, Kurimoto Y, Morishita K, et al. Aortocaval fistula after endovascular stent-grafting of abdominal aortic aneurysm. J Cardiovasc Surg. 2009;50(3).387−389 PMID: 18948877.
- Alexander JJ, Imbembo AL. Aorta-vena cava fistula. Surgery 1989;105(1):1−12 PMID: 2643193.
- Gedvilas D, Argatu D, Lukosevicius S, et al. Aorto-caval fistula clinically presenting as left renal colic. Findings of mulislice computed tomography. Medicina (Kaunas) 2008;44(8):619−622 PMID:18791339.
- Abreo G, Lenihan DJ, Nguyen P, et al. High-output heart failure resulting from a remote traumatic aorto-caval fistula: diagnosis by echocardiography. Clin Cardiol. 2000;23(4):304−306. doi: 10.1002/clc.4960230419.
- Davidovic LB, Kostic DM, Cvetkovic SD et al. Aorto-caval fistulas. Cardiovasc Surg. 2002;10(6):555−660. doi:10.1016/s0967-2109(02)22106-0.
- Ghilardi G, Scorza R, Bortolani E, et al. Rupture of abdominal aortic aneurysms into the major abdominal veins. J Cardiovasc Surg. 1993;34(1):39−47 PMID: 8482703.
- Calligaro KD, Savarese RP, DeLaurentis DA. Unusual aspects of aortovenous fistula associated with ruptured abdominal aortic anuerysms. J Vasc Surg. 1990;12(5):586−590. doi:10.1067/mva.1990.23414.
- Mitchel ME, McDaniel HB, Rushton FW. Endovascular repair of a chronic aortocaval fistula using a thoracic aortic endoprosthesis. Ann Vasc Surg. 2009;23(1):150−152. doi:10.1016/j.avsq.2007.10.007.
- Liu M, Wang H. Endovascular stent-graft repair of spontaneous aorto-caval fistula secondary to a ruptured abdominal aortic aneurysm: An emergency management of hostile anatomy. SAGE Open Medical Case Reports 2016;18(4):1−4. doi:10.1177-2050313X166.46526.
- Rapacciuolo A, DeAngelis MC, di Pietro D, et al. Percutaneous treatment of a aorto-caval fistula in a old high risk patient. BMC Surg. 2012;12 Suppl 1:S32. doi:10.1186/1471-2482-12-S1-S32.
- Godart F, Haulon S, Houmany M, et al. Transcatheter closure of aortocaval fistula with teh amplatzer dusct occluder. J Endovasc Ther. 2005;12(1):134−137.doi:10.1583/04-1332.1.
- Silveira PG, Cunha JR, Lima GB, et al. Endovascular treatment of ruptured abdominal aortic aneurysm with aortocaval fistula based on aortic and inferior vena cava stent-graft placement. Ann Vasc Surg. 2014;28(8):1933.e1−5. doi:0.1016/j.avsq.2014.06.073.
- Melas N, Saratzis A, Saratzis N. Inferior vena cava stent-graft placement to treat endoleak associated with an aortocaval fistula. J Endovasc Ther. 2011;18(2):250−254. doi: 10.1583/10-3296.1.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 5-
All articles in this issue
- Manažment liečby dehiscencie pažerákovej anastomózy po ezofagektómii pre karcinóm pažeráka
- Časné komplikace u operací pupečních a epigastrických kýl
- Chirurgická léčba zlomenin krční páteře v terénu ankylozující spondylitis: zadní stabilizace s užitím navigace založené na intraoperačním CT zobrazení
- Uroteliální karcinomy horních močových cest – naše zkušenosti
- “Maximálna” miniinvazívna tymektómia u pacientov s netymomatóznou myasténiou gravis – krátkodobé výsledky za obdobie 10 rokov – retrospektívna štúdia
- Nitrobřišní absces při salmonelóze − kazuistika
- Aorto-kavální píštěl – kazuistické sdělení
- Covidí příležitost
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Časné komplikace u operací pupečních a epigastrických kýl
- Uroteliální karcinomy horních močových cest – naše zkušenosti
- Manažment liečby dehiscencie pažerákovej anastomózy po ezofagektómii pre karcinóm pažeráka
- Nitrobřišní absces při salmonelóze − kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

