-
Medical journals
- Career
Maligní onemocnění po transplantaci plic
Authors: M. Švorcová 1; J. Havlín 1; J. Vachtenheim 1; J. Kolařík 1; J. Pozniak 1; J. Šimonek 1; J. Burkert 2; R. Lischke 1
Authors‘ workplace: III. chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 1; Klinika kardiovaskulární chirurgie 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 2
Published in: Rozhl. Chir., 2020, roč. 99, č. 10, s. 447-455.
Category: Original articles
Overview
Úvod: Transplantace plic se stala úspěšnou život zachraňující metodou léčby u pacientů v terminálním stadiu plicních onemocnění. S narůstajícími zkušenostmi se zlepšují dlouhodobé výsledky přežívání po transplantaci plic v letech 2010 až 2019. Maligní nádory zaujímají třetí místo příčiny úmrtí zejména mezi 5. a 10. rokem po transplantaci plic. Mezi rizikové faktory vzniku zhoubných nádorů patří zejména vysoké dávky imunosuprese, věk, infekce způsobená onkogenními viry a kouření.
Metody: Retrospektivně byl zhodnocen soubor všech pacientů, kteří podstoupili transplantaci plic v období 2010 až 2019. Primárním cílem bylo zjistit incidenci, typ a lokalizaci maligních nádorů, čas od diagnózy nádoru, dobu přežití a příčinu úmrtí u pacientů s maligním nádorem po transplantaci plic.
Výsledky: V letech 2010–2019 bylo na III. chirurgické klinice 1. LF UK a FN Motol provedeno celkem 308 transplantací plic. Nově vzniklý nádor po transplantaci plic byl diagnostikován u 32 pacientů, u pěti pacientů byl nádor prokázán v explantované plíci. Nejčastějším typem tumoru v našem souboru byl plicní nádor u 13 (37 %) pacientů, kožní nemelanomové nádory u 6 (17 %) a lymfoproliferativní onemocnění u 4 (12,5 %) pacientů. Zastoupení ostatních typů malignit bylo nízké. Průměrná doba přežití pacientů od stanovení diagnózy nádorového onemocnění byla 152 dní.
Závěr: Celoživotní podávání imunosupresivní terapie u pacientů po transplantaci plic hraje klíčovou roli v prevenci vzniku rejekce, ale zároveň představuje rizikový faktor pro rozvoj nádorového onemocnění. Podstata onkologické léčby nádorů po transplantaci spočívá v redukci imunosupresivní terapie v kombinaci s chirurgickou resekcí u solidních tumorů a ostatními typy protinádorové terapie. Onkologická screeningová vyšetření by měla být prováděna v pravidelných intervalech jako prevence včasného záchytu jakéhokoliv nádoru.
Klíčová slova:
Lung transplantation – solid organ tumors – immunosuppressive therapy – posttransplant lymphoproliferative disease
Úvod
V České republice se transplantace plic provádí na III. chirurgické klinice 1. LF UK a Fakultní nemocnice Motol od roku 1997. Do roku 2019 bylo provedeno celkem 454 transplantací plic (74 % oboustranných, 24 % jednostranných transplantací plic, 1 % retransplantací a 1 % transplantace bloku srdce a plíce (Graf 1).
Graph 1. Počet transplantací plic a typ transplantace na III. chirurgické klinice 1. LF UK a FN Motol, 1997–2019
Graph 1: Number and types of lung transplantation procedures at the 3rd Department of Surgery, 1st Faculty of Medicine, Charles University and University Hospital Motol, 1997–2019
Vysvětlivky: HLTx – kombinovaná transplantace srdce a plic; RETx – retransplantace plic; DLTx – oboustranná transplantace plic; SLTx – jednostranná transplantace plic.
Notes: HLTx – heart and lung transplantation, RETx – lung retransplantation; DLTx – double lung transplantatioin; SLTx – single lung transplantation.Transplantace plic je jedinou dostupnou léčebnou metodou u pacientů v konečném stadiu plicního onemocnění, u kterých byly vyčerpány konzervativní léčebné možnosti. Technické pokroky v odběru plicního štěpu a jeho implantace, perioperační péče a rozvoj imunosuprese zlepšily významně přežívání pacientů. Medián přežití pacientů transplantovaných v České republice se v současné době pohybuje kolem 6 let, což odpovídá datům z Mezinárodního registru pro transplantace srdce a plic (The International Society for Heart and Lung transplantation ISHLT). Z Grafu 2 je patrné zlepšení krátkodobého i dlouhodobého přežití transplantovaných pacientů v našem centru v poslední dekádě.
Graph 2. Celkové přežití pacientů po transplantaci plic, III. chirurgická klinika, 1. LF UK a FN Motol, 2010–2019.
Graf 2: Overall long-term survival of patients after lung transplantation, 3rd Surgery Department, 1st Faculty of Medicine, Charles University and Motol University Hospital, 2010–2019
Hlavní limitací dlouhodobého přežívání je chronická dysfunkce štěpu, infekce, nádorové onemocnění a ostatní komorbidity [1,2]. Nejčastější interní komorbiditou po transplantaci plic je arteriální hypertenze, která se rozvine u více než 80 % pacientů po transplantaci plic do 5 let. Renální selhání I.–IV. stupně, hyperlipidemie a diabetes mellitus se objevují v 62 %, 52 % a 34 % pacientů [3,4]. Přestože jsou kardiovaskulární choroby častější po transplantaci plic ve srovnání se zdravou populací, zaujímají až čtvrtou příčinu úmrtí. U neimunosuprimovaných jedinců se riziko rakoviny zvyšuje s věkem. Po 50. roce je riziko vzniku maligního onemocnění kolem 6 %, po 60. roce již 14 % [5]. Prevalence maligních nádorů po transplantaci plic je vyšší, kolem 18 % v pěti letech po transplantaci plic, zejména v důsledku imunosuprese, a představuje tak třetí nejčastější příčinu úmrtí po transplantaci plic.
Objev imunosupresivní terapie byl klíčový pro rozvoj transplantační medicíny. Se zavedením imunosupresní terapie se zlepšilo dlouhodobé přežívání pacientů po transplantaci, zvláště v kombinaci s kalcineurinovými inhibitory. Imunosupresivní léčba po transplantaci plic je založená na trojkombinaci kalcineurinových inhibitorů, inhibitorů buněčného cyklu a kortikosteroidů. První dvě skupiny léků z tohoto režimu jsou potenciálně proonkogenní. Vztah mezi kortikosteroidy a vznikem nádorů dosud nebyl prokázán. Patofyziologicky se na vzniku nádorů podílejí zejména indukční imunosuprese, dlouhodobé užívání imunosuprese (udržovací imunosuprese) a virové infekce. Kožní nemelanomové nádory a potransplantační lymfoproliferativní onemocnění (PTLD) jsou nejčastějšími typy zhoubného bujení po transplantací solidních orgánů [6,7,8].
Metody
Retrospektivně byl zhodnocen soubor všech pacientů, kteří podstoupili transplantaci plic v letech 2010–2019 na III. chirurgické klinice I. LF UK a Fakultní nemocnice Motol. Primárním cílem bylo zjistit incidenci, typ a lokalizaci maligních nádorů, čas stanovení nádoru od transplantace, dobu přežití a příčinu úmrtí u pacientů s maligním nádorem po transplantaci plic. Všichni pacienti před zařazením na čekací listinu měli provedená preventivní screeningová vyšetření. Byli sledováni v předtransplantační ambulanci s aktualizací celkového stavu každé tři měsíce a aktualizací předtransplantačních vyšetření včetně onkologických screeningových vyšetření jednou ročně.
U všech pacientů po transplantaci plic byla udržovací imunosupresivní terapie v první linii založena na trojkombinaci kalcineurinový inhibitor (tacrolimus nebo cyklosporin A), inhibitor buněčného cyklu (mykofenolát mofetil) a kortikosteroidy. Potransplantační onkoscreening absolvovali pacienti jedenkrát ročně. Onkologická screeningová vyšetření zahrnovala CT plic, sonografii břicha, otorinolaryngologické, oční, nefrologické, gynekologické a urologické vyšetření 1× ročně. Vyšetření dermatologem bylo prováděno jednou za šest měsíců. Ženy nad 40 let věku byly pravidelně sledovány mamograficky a u všech mužů byl pravidelně prováděn odběr prostatického specifického antigenu (PSA).
К výpočtům byl použit statistický software Statistica 13.5. Data byla analyzována standardními metodami deskriptivní statistiky. Pro porovnání skupin byl u diskrétních veličin použit chi-kvadrát test, pro spojité veličiny t-test nebo Mann-Whitneyho pořadový test. К odhadu křivek přežívání byla použita Kaplan-Meierova metoda, jejich shoda byla testována log-rank testem. Výsledky testů byly označeny jako signifikantní při dosažení hladiny významnosti menší než 5 %.
Výsledky
V letech 2010–2019 bylo provedeno na III. chirurgické klinice 1. LF UK a FN Motol celkem 308 transplantací plic, z toho 262 (86 %) oboustranných, 39 (12 %) jednostranných, čtyři retransplantace a tři pacienti podstoupili kombinovanou transplantaci bloku srdce a plic. Průměrný věk dárce celého souboru byl 42,9 roku (± 15,6 roku). U pacientů, u kterých jsme prokázali zhoubné onemocnění, byl průměrný věk dárce nesignifikantně vyšší 47,6 roku (± 15,6). Statisticky významně vyšší (p=0,002) byl však průměrný věk příjemce s prokázanou malignitou 58,3 roku (± 10,7) ve srovnání s průměrným věkem příjemce celého souboru 50,5 (± 15,4). Nejčastějšími indikacemi k transplantaci plic byly: idiopatický plicní proces IPP (39 %), chronická obstrukční plicní nemoc CHOPN (38 %) a cystická fibróza CF (17 %). Mezi ostatní méně zastoupené diagnózy patřily lymfangioleiomyomatóza LAM a primární plicní hypertenze PAH. Tři pacienti byli retransplantováni pro progredující chronickou rejekci na podkladě obliterující bronchiolitidy (Tab. 1).
Table 1. Souhrn transplantovaných pacientů
Tab. 1: Summary of transplant recipients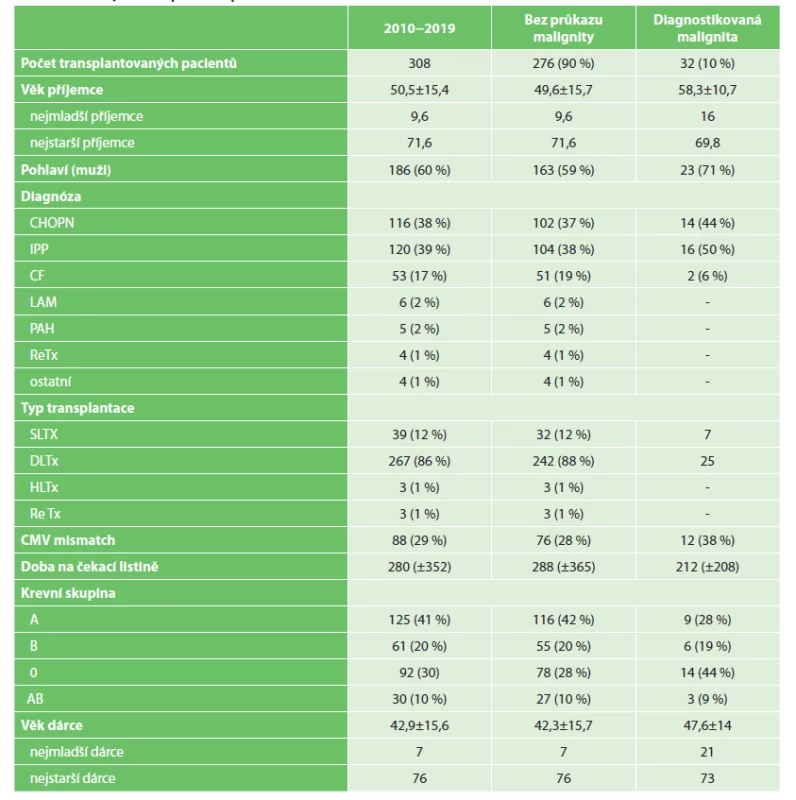
Nádorové onemocnění bylo diagnostikováno celkem u 32 (10 %) pacientů, s jasnou převahou mužského pohlaví, n=23 (71 %). V 50 % byl nádor prokázán u pacientů, kteří byli transplantování pro idiopatický plicní proces, ve 44 % pro chronickou obstrukční plicní nemoc. U ostatních transplantovaných pacientů s méně zastoupenými diagnózami malignita prokázána v daném období nebyla. U jednostranných transplantací plic se maligní nádor vyvinul v 18 %, dvakrát více než u oboustranných transplantací plic.
Z celkového počtu 32 pacientů bylo diagnostikováno celkem 35 nádorů (Tab. 2). U pěti pacientů byl nádor prokázán v explantované plíci příjemce. U jednoho dárce byl při odběru zjištěn plicní nádor pravé plíce, s ohledem na urgentní stav příjemce byla využita a transplantovaná levá plíce bez tumoru. Pacient aktuálně žije tři roky po transplantaci bez známek maligního postižení. Nově vzniklý nádor po transplantaci plic byl diagnostikován u 27 pacientů. Tři pacienti rozvinuli duplicitní tumor.
Table 2. Přehled pacientů po transplantaci plic s maligním nádorem, III. chirurgická klinika 1. LF UK a FN Motol, 2010–2019
Tab. 2: Summary of transplanted patients with malignant tumors at the 3rd Department of Surgery, 1st Faculty of Medicine, Charles University and University Hospital Motol, 2010–2019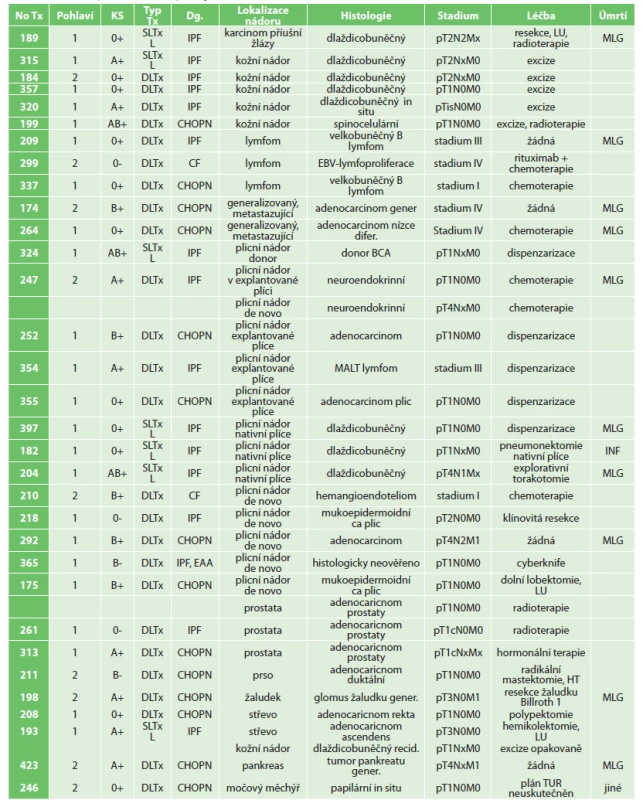
Vysvětlivky: Dg – diagnóza, pro kterou byl pacient transplantován (IPF – idiopatická plicní fibróza, CHOPN – chronická obstrukční plicní nemoc, CF – cystická fibróza); INF – infekce; KS – krevní skupina; LU – lymfadenektomie; MALT – mucosa associated lymfatic tissue; MLG – malignita; No Tx – pořadové číslo transplantace pacienta; pohlaví: 1 – muž, 2 – žena; TUR – transuretrální resekce; Typ Tx – typ transplantace: DLTx – double lung transplantation (oboustranná transplantace plic); SLTx – single lung transplantation (jednostranná transplantace plic), L – levá plíce.
Notes: Dg – diagnosis leading to transplantation (IPF – idiopatic pulmonary fibrosis, CHOPN – chronic obstructive pulmonary disease, CF – cystic fibrosis); gender: 1 – male, 2 – female; INF – infection; KS – bloodgroup; LU – ymphadenectomy; MALT – mucosa associated lymphatic tissue; MLG – malignancy; No Tx – number of transplanted patient; TUR – transurethral resection of bladder; Typ Tx – type of transplantation: DLTx – double lung transplantation, SLTx – single lung transplantation, L – leftside (lung).Nejčastějším typem nádoru v našem souboru byl maligní plicní nádor. U pěti pacientů byl nádor prokázán v explantované plíci příjemce, u čtyř pacientů ve stadiu T1a u jednoho pacienta jako oboustranný MALT-lymfom. U pacienta s histologicky neuroendokrinním tumorem v explantované plíci došlo k relapsu neuroendokrinního tumoru v transplantované plíci po šesti měsících, zemřel tři roky po transplantaci. Bronchogenní karcinom v transplantované plíci se nově vytvořil u dalších 5 pacientů po oboustranné transplantaci plic (1,8 %) a u 3 pacientů po jednostranné transplantaci plic v nativní plíci. Chirurgickou léčbu podstoupili dva pacienti po oboustranné transplantaci plic a jeden pacient po jednostranné transplantaci plic. Stereotakticky byl ozářen jeden pacient s neověřeným progredujícím PET-pozitivním ložiskem plic. Pacientka s hemangioendoteliomem plic byla léčena chemoterapií s kompletní remisí a aktuálně žije velmi aktivním způsobem života sedm let po transplantaci. Dva pacienti v pokročilém stadiu karcinomu plic zemřeli relativně záhy po stanovení maligního nádoru plic. U všech pacientů jsme redukovali imunosupresivní terapii.
Další nejčastější skupinou nádorů v našem souboru byly kožní nemelanomové n=6 (17,1 %) a lymfoproliferativní nádory n=3 (8,5 %). Zastoupení ostatních typů malignit bylo nízké a jsou shrnuty v Grafu 3 a Tab. 2. Zhoubné onemocnění se rozvinulo v průměru 1124 dní (3 roky a 1 měsíc) po transplantaci. V prvním roce po transplantaci plic bylo časně diagnostikováno sedm nádorů (kožní nemelanomový nádor, karcinom pankreatu, žaludku, karcinom nativní plíce, diseminace neuroendokrinního tumoru z explantované plíce a nediferencovaný generalizovaný nádor). Všichni tito pacienti, kromě jedné pacientky, byli starší 60 let. Osm měsíců po transplantaci plic propukla EBV asociovaná potransplantační lymfoproliferace u 16leté dívky s cystickou fibrózou. Byla zaléčena dle protokolu R-CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednison) s kompletní remisí. Současně byla redukována imunosuprese.
Graph 3. Typy nádorů po transplantaci plic.
Graf 3: Types of tumors after lung transplantation.
Nádorové onemocnění v našem souboru bylo prokázáno v prvním roce po transplantaci plic u 2,2 %, v druhém až pátém roce ve 3,8 % a po pěti letech v 3,5 %. Z celkového počtu 32 pacientů s prokázanou malignitou po stanovení nádoru zemřelo 12 (38 %) pacientů, z toho deset pacientů v přímé souvislosti s maligním onemocněním. Průměrná doba přežití pacientů od stanovení diagnózy nádorového onemocnění činila 152 dní (17 až 655 dní).
Diskuze
Nádorové onemocnění po transplantaci plic je pozdní komplikací. Věk je jedním z hlavních rizikových faktorů zhoubného bujení. Incidence malignit je 2–4× větší u transplantovaných příjemců než ve stejném věku u neimunosuprimovaných jedinců [9]. V našem souboru byla prokázána statisticky vyšší incidence nádorů u starších pacientů, než byl průměrný věk všech příjemců.
Rozvoj malignit u solidních orgánů po transplantaci je ale zejména spojen s dlouhodobou expozicí imunosupresivních léků, kumulací jejich nežádoucích účinků a jejich kancerogenní toxicity. K dalším rizikovým faktorům patří kouření dárce či příjemce a onkogenní viry [10]. Podle ISHLT registru se maligní nádory vyskytují po transplantaci plic u 3,5 % v prvním roce, 12,6 % v 5 letech a u 28,1 % v 10 letech [11]. Incidence nádorů v našem souboru je v porovnání se světovými daty nižší, což si vysvětlujeme včasným zahájením preventivního onkoscreeningu záhy po transplantaci, pravidelnými kontrolami, dobrou spoluprací s našimi pacienty a relativně dobrou dostupností vyšetřovacích metod.
Všichni pacienti po transplantaci plic byli léčeni trojkombinací kalcineurinových inhibitorů, mykofenolátem mofetilu a kortikosteroidů. U tacrolimu a cyclosporinu se popisuje vyšší incidence kožních a lymfoproliferativních nádorů, způsobené indukcí produkce cytokinů, které podporují kancerogenezi jako transforming growth factor a vaskulární endoteliální růstový faktor [9]. Inhibují také schopnost opravy DNA řetězce, což může mít za následek rakovinné bujení. Azathioprin vykazuje větší incidenci skvamózních karcinomů. Některé práce uvádějí kanceroprotektivní účinek mykofenolátu. Řada autorů též ukazuje protinádorový efekt skupiny imunosupresivních léků zvaných mTOR inhibitory (sirolimus a everolimus), díky přímé inhibici buněčné replikace, indukci apoptózy a inhibici IL 10 [12,13,14,15,16]. Nové perspektivy a snížení rizika maligního zvratu u pacientů po transplantaci ledvin představuje belatacept [17], u plic zatím tento vliv nebyl prokázán. Vzhledem k tomu, že většina pacientů byla léčena stejnou trojkombinací imunosupresivních léků, za pravidelných kontrol hladin tacrolimu, nelze jednoznačně říci, který z uváděných léků je více kancerogenní. Při zjištění nádorového onemocnění u pacienta po transplantaci plic a současně výměna calcineurinového inhibitoru za mTOR inhibitor vedla v našem souboru k častějšímu propuknutí rejekce. Proto vhodnější kombinací se nám jeví redukce dávky kalcineurinového inhibitoru (CNI), případně kombinace CNI a mTOR inhibitoru s vysazením mykofenolátu a snížením dávky kortikosteroidů.
Incidence nonmelanomových kožních tumorů po transplantaci je popisována 65–250× vyšší než u zdravé populace. Hlavním rizikovým faktorem je imunosuprese v kombinaci se známým rizikovým faktorem, jako je ultrafialové záření, které indukuje mutaci supresorového genu p53 [18,19]. Ducloux a spol. demonstrují korelaci mezi nízkým titrem CD4 lymfocytů a výskytem kožních karcinomů [20]. Vyšetření dermatologem je doporučováno jednou za 6 měsíců, s včasnou kožní excizí premaligních lézí. V případě melanomu je vhodná imunoterapie a léčba interferonem. Podle Gjersvika mTOR inhibitory jsou asociovány s nižším rizikem kožní rakoviny [21]. V souboru našich pacientů převládal v 83 % dlaždicobuněčný karcinom v raném stadiu. Všichni pacienti s kožním nádorem podstoupili radikální excizi. Ve všech případech se jednalo o muže staršího věku, s primární diagnózou IPP, což dokládá i Garetova práce, která uvádí, že vyšší riziko potransplantačních zhoubných kožních lézí je spojováno s vyšším věkem, bílou rasou, mužským pohlavím a stavem po transplantaci hrudních orgánů [21].
Potransplantační lymfoproliferativní onemocnění (PTLD) je další vážnou komplikací po transplantaci plic a je často asociováno s Epstein Bar virem (EBV). EBV je gamma herpes virus, který byl v roce 1964 izolován z buněk Burkittova lymfomu. Má velkou adherenci k B lymfocytům. U imunokompetentních osob je většinou asymptomatický. Naopak u imunosuprimovaných pacientů může způsobit maligní lymfoproliferaci B buněk, která může vzniknout po primární EBV infekci nebo reaktivací předchozí EBV infekce v kterémkoliv orgánu. Incidence PTLD závisí na transplantovaném orgánu a předchozím styku s EBV, pohybuje se až kolem 20 % [23]. Proto všichni pacienti našeho souboru jsou při každé kontrole testováni na průkaz virové DNA EBV metodou PCR. Optimální léčba PTLD není jasně definovaná pro nedostatek randomizovaných studií. Proto British Commitee for Standards in Haematology (BCSH) a British Transplantation Society (BTS) vytvořily doporučení pro management PTLD u dospělých po transplantaci solidních orgánů. Vždy by měla být redukována imunosupresivní léčba na nejnižší tolerovatelnou mez (většinou o 25 až 50 % výchozí hodnoty), a to pod dohledem transplantačního specialisty tak, aby byla zachována funkce transplantovaného orgánu. Pacienti s nedostatečnou odpovědí na redukci imunosuprese by měli být léčeni rituximabem v monoterapii nebo v kombinaci s chemoterapií založenou na antracyklinech (v kombinaci s rituximabem u B-lymfoproliferací). U mladých pacientů v dobré kondici může být zvažována i terapie vysokodávkovaným methotrexátem. V podpůrné léčbě při probíhající chemoterapii je doporučeno profylaktické podávání G-CSF, antibiotik, antivirotik a antimykotik. Ostatní léčebné postupy (EBV-specifické cytotoxické T-lymfocyty, antivirotika s arginin butyrátem, interferon alfa či intravenózní imunoglobuliny, adoptivní buněčná imunoterapie) nejsou doporučeny mimo užití v rámci klinických studií [24] a vyžadují další studie v prevenci a léčbě PTLD [25,26]. Mezi méně časté hematologické malignity po transplantaci patří leukemie, lymfomy a mnohočetný myelom [27].
Specifickou skupinou nádorů jsou samotné plicní nádory po transplantaci plic. Kouření dárce/příjemce je hlavní rizikový faktor vzniku plicního karcinomu. Tumory plic mohou být diagnostikovány v explantované plíci příjemce, mohou být přenesené z dárcovské plíce, nebo vznikají de novo v kterémkoliv roce v transplantované plíci po oboustranné transplantaci plic nebo nativní plíci u jednostranné transplantace plic. Ve skutečnosti, je-li prokázán plicní či jiný tumor dárce při odběru během makroskopického zhodnocení či perfuze štěpu, všechny potenciálně transplantovatelné orgány jsou kontraindikovány k odběru. K přenosu malignity transplantovaným orgánem dochází velmi vzácně. Nicméně nedostatek orgánů k transplantacím vede k rozšíření indikačních kritérií zemřelých dárců orgánů a v současné době jsou akceptováni dárci s některými primárními tumory mozku, diferencovanými karcinomy kůže, karcinomy in situ (hrdla děložního u žen, tlustého střeva klasifikované A podle Duke) a anamnézou malignity s 5–10letou remisí s výjimkou karcinomu prsu, melanoblastomu a sarkomů měkkých tkání. Výjimku může tvořit i urgentní stav příjemce, což byl případ našeho pacienta, nebo nádor, který během odběru nebyl diagnostikován [28]. Plicní nádor potvrzený v explantované plíci příjemce přirozeně vzbuzuje obavu potenciální rekurence po transplantaci. Na druhou stranu explantovaná plíce je svým způsobem radikálně odstraněna v časném stadiu nádorového onemocnění. Prognostickým faktorem může být případná pokročilost nádoru v lymfatických uzlinách, kdy lymfadenektomie není běžně součástí transplantace plic. Několik autorů retrospektivně zhodnocovalo CT nálezy před transplantací plic. Pouze několik málo případů budilo podezření na možný tumor nativní plíce. U většiny pacientů CT nálezy odpovídaly nespecifickým změnám, s různými známkami plicní infekce nebo konsolidace, zejména u pacientů s idiopatickou plicní fibrózou [3,29].
Bronchogenní karcinom nativní plíce po jednostranné transplantaci plic je pozorován u 5–10 % příjemců. Riziko je 6× vyšší než u pacientů po oboustranné transplantaci plic [3,30]. Plicní tumor po oboustranné transplantaci plic se vyvine u 1–2 % příjemců, což se shoduje i s našimi výsledky. Optimální léčbou bronchogenních karcinomů po transplantaci plic je radikální resekce (lobektomie) s lymfadenektomií, pokud jsou dostatečné spirometrické plicní funkce (FEV1 a FVC>50 % náležitých hodnot) a pokud to dovoluje celkový stav pacienta. Histologicky se neliší od plicních nádorů u neimunosuprimovaných pacientů.
Předtransplantační vyšetření zahrnuje RTG a CT plic. Aktualizace funkčních vyšetření plic a celkového stavu pacientů na čekací listině probíhá každé 3 měsíce v předtransplantační ambulanci a aktualizace CT 1x ročně. Průměrná čekací doba k transplantaci plic na čekací listině se v našem souboru pohybuje mezi 4–6 měsíci, ale zvláště pacienti malé postavy, s „malými plícemi“ v důsledku restriktivních onemocnění plic, čekají podstatně déle pro nedostatek vhodných dárců. Zde se zvyšuje možné riziko vzniku dosud nezachyceného karcinomu, zejména plicního. Na druhou stranu díky pravidelnému screeningu byly plicní nádory u našich pacientů podchyceny v raném stadiu T1–2 v 78 %.
Jedním z dalších rizikových faktorů, který je asociován s vyšším výskytem maligních onemocnění, je skupina onkogenních virů. Kromě již zmiňovaného Epstein-Barr viru uvádí několik studií vyšší incidenci nádoru u cytomegaloviru (CMV) a hepatitidy C viru [31]. V naší studii tato souvislost nebyla sledována.
Incidence kolorektálního karcinomu a ostatních solidních nádorů břišních orgánů (žlučník, slinivka) je dle literatury relativně nízká, stejně tak i v našem souboru. Merchea a spol. poukazují na častější přítomnost kolorektálního karcinomu v pravé části kolon. Podle studie z roku 2015 mají lidé s krevní skupinou A vyšší riziko onemocnění rakoviny žaludku, což se potvrdilo i u jednoho pacienta v našem souboru. U krevní skupiny A je častější výskyt některých karcinomů, a to zejména tlustého střeva, dělohy a vaječníků. U krevní skupiny AB jsou zase častější nádory slinných žláz a chronická leukemie [32]. Management a guidelines v léčbě maligních nádorů u pacientů po transplantaci plic nebyly dosud stanoveny. Vycházejí z obecných doporučení a referencí jednotlivých typů nádorů a jsou individualizovány s ohledem na celkovou anamnézu pacienta po transplantaci plic, jeho komorbidity, medikaci, vitalitu a celkovou prognózu.
Závěr
Celoživotní podávání imunosupresivní terapie u pacientů po transplantaci plic hraje klíčovou roli v prevenci vzniku rejekce, ale zároveň představuje rizikový faktor pro rozvoj nádorového onemocnění. Malignity po transplantaci plic jsou ve většině případů pozdní komplikací. Incidence nádorů po transplantaci plic je 2–4x větší než u zdravých jedinců ve stejném věku. Kožní nemelanomové nádory a potransplantační lymfoproliferativní onemocnění jsou nejčastějšími typy zhoubného bujení po transplantací solidních orgánů. Zastoupení ostatních typů nádorů se v jednotlivých centrech liší. Po zjištění maligního onemocnění se doporučuje snížení intenzity imunosupresivní terapie. Konverze na mTOR inhibitory je stále předmětem diskuze. Radikální resekce solidních tumorů je doporučována, stejně tak jako u netransplantovaných pacientů. Onkologická léčba včetně chemoterapie po chirurgické resekci by měla být modelována s ohledem na imunosupresivní léčbu tak, aby se předešlo komplikacím a nežádoucím účinkům. Preventivní onkologický screening každého pacienta po transplantaci plic v pravidelných intervalech, minimálně však jednou ročně, vede k prevenci vzniku a časnému záchytu maligního onemocnění.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Monika Švorcová
III. chirurgická klinika 1. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: Monika.Svorcova@fnmotol.cz
Sources
- Costa J, Benvenuto LJ, Sonett JR. Long-term outcomes and management of lung transplant recipients. Best Pract Res Clin Anaesthesiol. 2017;31(2):285–297. doi:10.1016/j.bpa.2017.05.006.
- Der Hovanessian A, Wallace WD, Lynch JP 3rd, et al. Chronic lung allograft dysfunction: Evolving concepts and therapies.Semin Respir Crit Care Med. 2018;39(2):155–171. doi:10.1055/s-0037-1618567.
- Olland AB, Falcoz PE, Santelmo N, et al. Primary lung cancer in lung transplant recipients. Ann Thorac Surg. 2014;98(1):362–371. doi:10.1016/j.athoracsur.2014.04.014.
- Yusen RD, Edwards LB, Kucheryavaya AY, et al. The registry of the International Society for Heart and Lung Transplantation: Thirty-second official adult lung and heart-lung transplantation report 2015; Focus theme: Early graft failure. J Heart Lung Transplant. 2015;34(10):1264–1277. doi:10.1016/j.healun.2015.08.014.
- Siegel RL, Miller KD, Jemal A. Cancer statistics 2020. CA Cancer J Clin. 2020;70(1):7–30. doi:10.3322/caac.21590.
- De Rosa N, Paddon VL, Liu Z, et al. Nonmelanoma skin cancer frequency and risk factors in Australian heart and lung transplant recipients. JAMA Dermatol. 2019;155(6):716–719. doi:10.1001/jamadermatol.2018.4789.
- Howard MD, Su JC, Chong AH. Skin cancer following solid organ transplantation: A review of risk factors and models of care. Am J Clin Dermatol. 2018;19(4):585–597. doi:10.1007/s40257-018-0355-8.
- Tanaka S, Chen-Yoshikawa TF, Hijiya K, et al. Characteristics of postoperative malignancies after lung transplantation. Kyobu Geka 2016;69(11):935–939.
- Pillai AA. Management of de novo malignancies after liver transplantation. Transplant Rev. (Orlando) 2015;29(1):38–41. doi:10.1016/j.trre.2014.11.002.
- Buell JF, Gross TG, Woodle ES. Malignancy after transplantation. Transplantation 2005;80(2 Suppl):S254–S264. doi:10.1097/01.tp.0000186382.81130.ba.
- Christie JD, Edwards LB, Aurora P, et al. The registry of the International Society for Heart and Lung Transplantation: Twenty-sixth official adult lung and heart-lung transplantation report 2009. J Heart Lung Transplant 2009;28(10):1031–1049. doi:10.1016/j.healun.2009.08.004.
- Kahan BD, Yakupoglu YK, Schoenberg L, et al. Low incidence of malignancy among sirolimus/cyclosporine-treated renal transplant recipients. Transplantation 2005;80(6):749–758. doi:10.1097/01.tp.0000173770.42403.f7.
- Pascual J, Fernández AM, Marcén R, et al. Conversion to everolimus in a patient with arterial hypertension and recurrent cutaneous neoplasia – a case report. Nephrol Dial Transplant. 2006;21 Suppl3:iii38–iii41. doi:10.1093/ndt/gfl299.
- Fernández A, Marcén R, Pascual J, et al. Conversion from calcineurin inhibitors to everolimus in kidney transplant recipients with malignant neoplasia. Transplant Proc. 2006;38(8):2453–2455. doi:10.1016/j.transproceed.2006.08.016.
- Chiurchiu C, Carreño CA, Schiavelli R, et al. Results of the conversion to everolimus in renal transplant recipients with posttransplantation malignancies. Transplant Proc. 2010;42(1):277–279. doi:10.1016/j.transproceed.2009.11.017.
- Gutierrez-Dalmau A, Campistol JM. Immunosuppressive therapy and malignancy in organ transplant recipients: a systematic review. Drugs 2007;67(8):1167–1198. doi:10.2165/00003495-200767080-00006.
- Marcén R. Immunosuppressive drugs in kidney transplantation: impact on patient survival, and incidence of cardiovascular disease, malignancy and infection. Drugs 2009;69(16):2227–2243. doi:10.2165/11319260-000000000-00000.
- Euvrard S, Kanitakis J, Claudy A. Skin cancers after organ transplantation. N Engl J Med. 2003;348(17):1681–1691. doi:10.1056/NEJMra022137.
- Ingvar A, Smedby KE, Lindelöf B, et al. Immunosuppressive treatment after solid organ transplantation and risk of post-transplant cutaneous squamous cell carcinoma. Nephrol Dial Transplant. 2010;25(8):2764–2771. doi:10.1093/ndt/gfp425.
- Ducloux D, Carron PL, Rebibou JM, et al. CD4 lymphocytopenia as a risk factor for skin cancers in renal transplant recipients. Transplantation 1998;65(9):1270–1272. doi:10.1097/00007890-199805150-00022.
- Gjersvik P, Helsing P, Holdaas H, et al. Immunsuppressive legemidler og utvikling av hudkreft etter organ transplantasjon [Immunosuppressive drugs and the development of skin cancer after organ transplantation]. Tidsskr Nor Laegeforen 2012;132(18):2064–2068. doi:10.4045/tidsskr.12.0389.
- Garrett GL, Blanc PD, Boscardin J, et al. Incidence of and risk factors for skin cancer in organ transplant recipients in the United States [published correction appears in JAMA Dermatol. 2017;153(3):357]. JAMA Dermatol 2017;153(3):296–303. doi:10.1001/jamadermatol.2016.4920.
- Martinez OM, Krams SM. The immune response to Epstein Barrvirus and implications for posttransplant lymphoproliferative disorder. Transplantation 2017;101(9):2009–2016. doi:10.1097/TP.0000000000001767.
- Parker A, Bowles K, Bradley JA, et al. Management of post-transplant lymphoproliferative disorder in adult solid organ transplant recipients – BCSH and BTS Guidelines. Br J Haematol. 2010;149(5):693–705. doi:10.1111/j.1365-2141.2010.08160.x.
- Singavi AK, Harrington AM, Fenske TS. Post-transplant lymphoproliferative disorders. Cancer Treat Res. 2015;165 : 305–327. doi:10.1007/978-3-319-13150-4_13.
- Hirama T, Tikkanen J, Pal P, et al. Epstein-Barr virus-associated smooth muscle tumors after lung transplantation. Transpl Infect Dis. 2019;21(3):e13068. doi:10.1111/tid.13068.
- Dharnidharka VR. Comprehensive review of post-organ transplant hematologic cancers. Am J Transplant. 2018;18(3):537–549. doi:10.1111/ajt.14603.
- Desai R, Collett D, Watson CJ, et al. Estimated risk of cancer transmission from organ donor to graft recipient in a national transplantation registry. Br J Surg. 2014;101(7):768–774. doi:10.1002/bjs.9460.
- de Perrot M, Fischer S, Waddell TK, et al. Management of lung transplant recipients with bronchogenic carcinoma in the native lung. J Heart Lung Transplant. 2003;22(1):87–89. doi:10.1016/s1053-2498(02)00446-1.
- Dickson RP, Davis RD, Rea JB, et al. High frequency of bronchogenic carcinoma after single-lung transplantation. J Heart Lung Transplant. 2006;25(11):1297–1301. doi:10.1016/j.healun.2006.09.009.
- Merchea A, Shahjehan F, Croome KP, et al. Colorectal cancer characteristics and outcomes after solid organ transplantation. J Oncol. 2019;5796108. doi:10.1155/2019/5796108.
- Ewald DR, Sumner SC. Blood type biochemistry and human disease. Wiley Interdiscip Rev Syst Biol Med. 2016;8(6):517–535. doi:10.1002/wsbm.1355.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 10-
All articles in this issue
- Využití mimotělních podpor v hrudní chirurgii
- Pooperační chylothorax − souhrnné sdělení
- Léčba insuficience hrudní anastomózy po Ivor Lewis ezofagektomii
- Maligní onemocnění po transplantaci plic
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Problematika plicních metastáz při pseudomyxomu peritonea – kazuistika a přehled literatury
- Plicní arteriovenózní malformace řešená videoasistovanou torakoskopickou lobektomií
- Minimalizace a maximalizace v hrudní chirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pooperační chylothorax − souhrnné sdělení
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Maligní onemocnění po transplantaci plic
- Využití mimotělních podpor v hrudní chirurgii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

