-
Medical journals
- Career
Využití retrosternálně uloženého kolon v náhradě jícnu
Authors: Č. Neoral; R. Aujeský; R. Vrba; M. Stašek
Authors‘ workplace: I. Chirurgická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc
Published in: Rozhl. Chir., 2018, roč. 97, č. 7, s. 301-308.
Category: Review
Overview
porovnáváme výhody a nevýhody jednotlivých technických možností náhrady jícnu. Podrobněji je rozebrána a dokumentována technika provedení operace s preferencí využití vaskulárního svazku a. colica sinistra a retrosternální lokalizace koloplastiky. Dále uvádíme časné i pozdní komplikace včetně možností jejich řešení. Závěrem konstatujeme, že v případě nemožnosti využití žaludečního konduitu je tlusté střevo bezpečnou náhradou s uspokojivými časnými i dlouhodobými výsledky.
Klíčová slova:
náhrada jícnu interpozicí kolon – komplikace náhrady jícnu – technika interpozice kolon pro náhradu jícnu – koloplastika – chirurgická náhrada jícnu
Úvod
Rekonstrukce jícnu je integrální součástí operačního výkonu pro benigní i maligní onemocnění. Její kvalita a technika je rozhodující z hlediska krátkodobých i dlouhodobých výsledků a kvality života. Komplikace rekonstrukce jícnu jsou významnou součástí morbidity a mají podíl na mortalitě operačního výkonu. Navzdory značnému rozšíření gastroplastiky jako metody první volby zůstává znalost a technické zvládnutí koloplastiky nezbytnou alternativou u vybraných nemocných. Předmětem sdělení je shrnutí současných postupů v indikaci koloplastiky pro náhradu jícnu.
Historie
Historie koloplastiky se datuje k roku 1911, kdy nezávisle referují Vulliet a Kelling o ezofagoplastice pomocí segmentu kolon [1,2]. V Římě v roce 1944 poprvé popisuje použití příčného tračníku k intratorakální ezofagoplastice Egidi, později intrapleurální polohu pro umístění štěpu u svých pacientů popisuje Sandblom (1948). Dlužno podotknout, že tlusté střevo k plastice použili již v letech 1921 Lundblat a 1926 Zaayer. Plastiku však vedli podkožně, resp. antetorakální cestou, a použili techniku, kterou původně pro plastiku tenkým střevem popsali Vulliet (1911), Kelling (1914) a později Judin (1944). Retrosternálně ukládají transplantát Javid (1954), Dale a Sherman (1954) a Belsey (1965). V této době jsou zdůrazňovány velké výhody použití tlustého střeva jako náhrady jícnu, především spolehlivé cévní zásobení a možnost uvolnění dostatečně dlouhého štěpu, což umožňuje do této doby vzácné jednodobé operace. Francouzští autoři Orsoni a Toupet (1950) a Lemaire a Rudler (1951) poprvé k ezofagokoloplastice využívají u antetorakální cesty nejen štěpu z příčného, ale i sestupného tračníku, a Rudler používá levé i pravé kolon u 28 nemocných s mortalitou 8/28 případů. V roce 1959 je to Belsey, který obhajuje náhradu jícnu levým kolon pro jeho robustnější cévní stopku a méně cévních variací [3]. Ve druhé polovině 50. let se objevuje již nepoměrně větší počet prací, které popisují prakticky celou šíři dodnes prováděných a na jednotlivých pracovištích více či méně preferovaných typů a způsobů jak exstirpace, tak náhrady ezofagu. Přitom jde o jedno-, dvou-, ale i trojdobé výkony. Počet peroperačních a pooperačních komplikací se stejně jako počet úmrtí snižoval a nakonec se ustálil na dnešních průměrně udávaných počtech.
V tehdejším Československu byl průkopníkem transtorakálních ezofagoplastik a v roce 1949 o nich referuje 1. přednosta olomoucké chirurgické kliniky prof. Rapant. Ve svých pracích postupně popisuje prakticky všechny typy plastik a použití jednotlivých orgánů k náhradě jícnu [4,5,6,7,8,9]. Je přesvědčen, že je stále vzdálen vytyčeného cíle, jakým je i z funkčního hlediska dokonalá náhrada jícnu. Tvrdí, že chce-li chirurg zodpovědně řešit náhradu jícnu, musí se podřídit nejen podstatě onemocnění, ale i individuální anatomické situaci a habitu, zvážit celkový stav operovaného a přihlížet jak k prognóze základního onemocnění, tak k perioperační morbiditě a mortalitě. Tento poznatek, plně platný do dnešní doby, má takřka zákonitý závěr v tom, že takové řešení bezpodmínečně vyžaduje, aby chirurg ovládal celou strategii chirurgické náhrady jícnu a neomezil se na jednu přístupovou cestu, na jediný taktický postup, stejně jako na jediný orgán, použitelný k plastice.
Indikace náhrady jícnu tlustým střevem
Vývoj indikací pro koloplastiku prošel významnými změnami. Koloplastika se v první polovině 20. století stala metodou volby pro náhradu jícnu [10]. Široké uplatnění měla u nemocných s indikacemi paliativní terapie u lokálně pokročilých tumorů jícnu a ezofagokardiální junkce v rámci bypassových operací, které byly v této indikaci prakticky zcela opuštěny. Počet indikací následně významně poklesl díky standardizaci použití gastroplastiky.
Současné indikace zahrnují tyto základní situace [11]: 1) nemožnost použití žaludku jako náhrady, 2) nutnost resekce žaludku z onkologické indikace, 3) snaha zachovat žaludek pro zlepšení funkčních výsledků, 4) speciální indikace v pediatrii [12,13]. Konkrétní shrnutí indikací zobrazuje Tab. 1.
Table 1. Indikace náhrady jícnu tlustým střevem
Tab. 1: Indications of esophageal replacement with the large intestine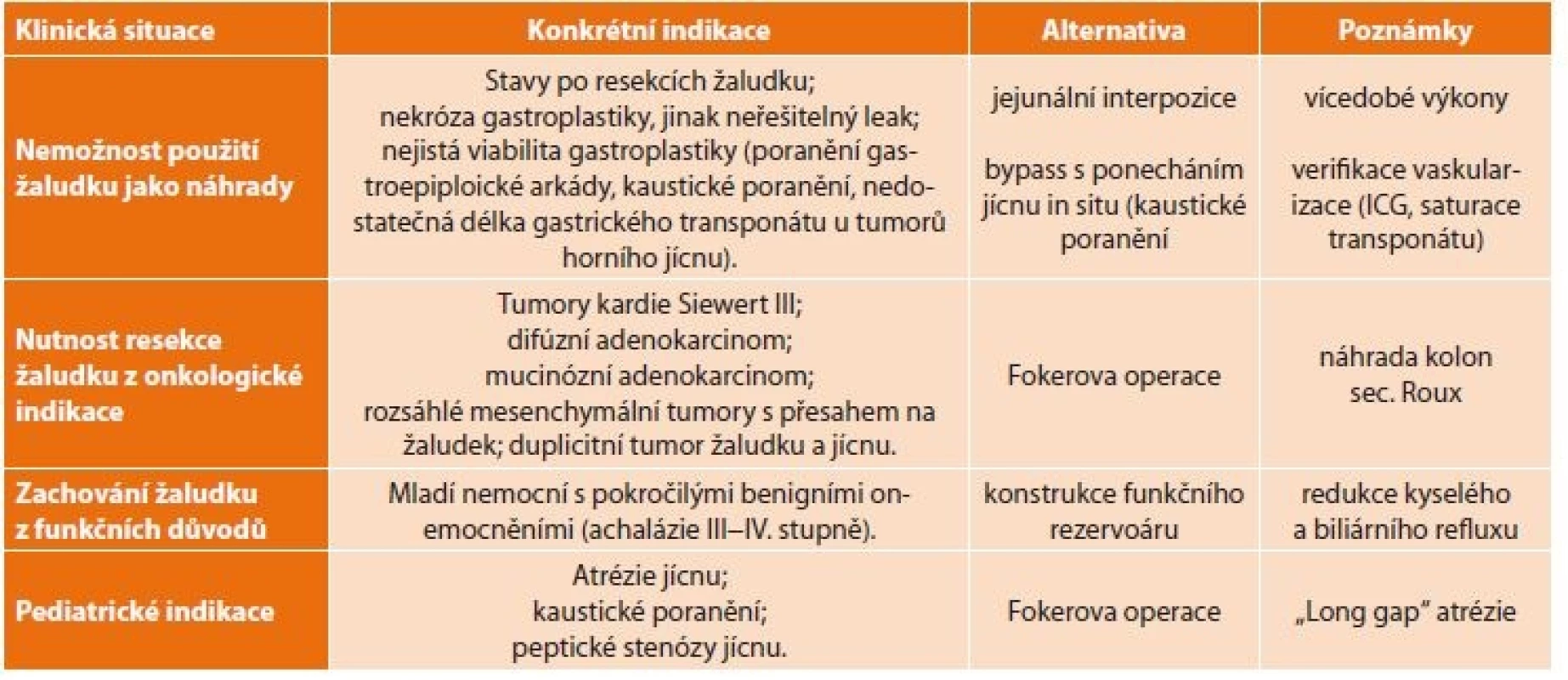
Důležitými faktory v rozhodovacím algoritmu [11] jsou znalosti výhod a rizik vyplývajících z rozhodnutí pro jednotlivé alternativy rekonstrukce jícnu (Tab. 2).
Table 2. Výhody a nevýhody jednotlivých typů náhrady jícnu
Tab. 2: Advantages and disadvantages of individual types of esophageal replacement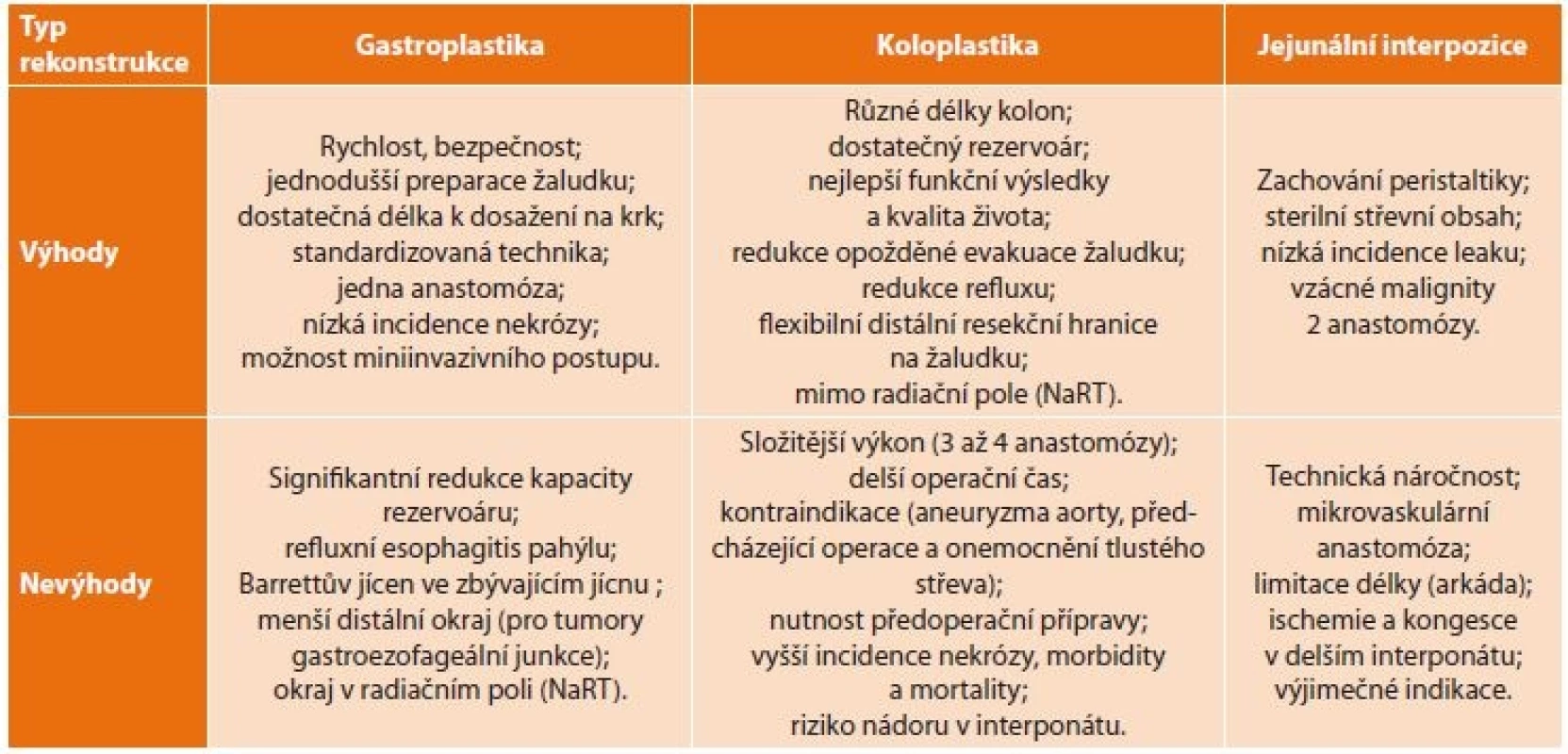
Příprava před operačním výkonem
Kolonoskopie by měla být součástí předoperačního zhodnocení před rekonstrukčními výkony na jícnu u pacientů starších 45 let, symptomatických nemocných a pacientů s arteriosklerózou. Hlavním účelem je verifikace prekanceróz a tumorů, divertikulózy a případných zánětlivých a trofických změn. Doporučenou metodou pro zhodnocení cévního zásobení střeva je CT či MR angiografie, zvláště u pacientů s anamnézou předchozího chirurgického výkonu na břiše v blízkosti velkých cév či na aortě a podezření na střevní klaudikace [14].
Nezbytnou součástí předoperačního období je nutriční a případně imunologická příprava.
Samozřejmou součástí bezprostřední předoperační přípravy je antegrádní či retrográdní příprava tlustého střeva a antibiotická profylaxe, optimálně cílená dle předoperačních kultivačních nálezů sputa. Je třeba kompenzovat a stabilizovat onemocnění, která jsou hlavními rizikovými faktory pooperačních komplikací (diabetes, kardiovaskulární onemocnění, CHOPN) [15].
Taktika a technika výkonu
Výkon je prováděn v celkové anestezii v poloze na zádech, v případě ezofagektomie s nutným hrudním přístupem v pronační či v litotomické poloze na levém boku s následným přemístěním nemocného do polohy na zádech po ukončení hrudní fáze výkonu. V tomto případě volíme selektivní intubaci.
Přístup [16,17,18] je ovlivněn fázemi operačního výkonu. V případě indikace ezofagektomie může být resekční fáze zahájena laparoskopicky s transhiatálním uvolněním jícnu či pravostrannou torakoskopií nebo torakotomií. Zvláště v případě kaustických poranění však může být ezofagektomie velmi náročná a riziková a v takovém případě se můžeme rozhodnout pro bypassový výkon s ponecháním stenotického jícnu in situ při vědomí určitého rizika rozvoje karcinomu v ponechaném jícnu. U některých benigních onemocnění lze uvažovat o zachování obou bloudivých nervů.
U plánovaných operací nejčastěji zahajujeme výkon cestou střední laparotomie, případně příčné laparotomie v epigastriu. V případě řešení zejména peroperačních (masivní krvácení, poranění cévního zásobení gastroplastiky, perforace jícnu s mediastinitidou apod.) a pooperačních komplikací (závažný leak s mediastinitidou, nekróza gastroplastiky) je třeba zvažovat vícedobý výkon s dočasným založením cervikální ezofagostomie a gastrostomie, případně jejunostomie. Valná většina výkonů je však ukončena v jedné době.
Nejčastějším umístěním ezofagokoloplastiky je retrosternální prostor. Náhrada jícnu je vedena prostorem vzdáleným od oblasti základního onemocnění a lze ji provést bez hrudního přístupu. Případná pooperační radioterapie u maligního onemocnění vede též k preferenci retrosternálního uložení náhrady. Dalšími alternativami jsou možné umístění v zadním mediastinu (je-li prováděna ezofagektomie), jako ultimum refugium lze použít subkutánní prostor. V případě plánované hrudní anastomózy lze umístit koloplastiku intrapleurálně.
Při rozhodování o tom, zda využít gastroplastiku či koloplastiku, jsme většinou ovlivněni celkovým stavem a konstitučním typem nemocného. Žaludek k náhradě jícnu použijeme v tom případě, kdy nám jeho délka zaručuje dobrou vitalitu proximálního konce tubusu a navíc umožňuje konstrukci anastomózy bez napětí. Tyto zásady by při užití celého žaludku jako náhrady (před zavedením náhrady dlouhým žaludečním tubusem) prakticky nebylo možno zaručit, a proto bylo historicky více užíváno tlusté střevo. Dnes je indikace retrosternální plastiky pomocí kolon z výše uvedených důvodů méně častá.
Po ohledání dutiny břišní a zejména zhodnocení stavu příčného tračníku (cévního zásobení, stavu středního a levého kolického svazku) s užitím prosté diafanoskopie (Obr. 1) vybíráme nejvhodnější použitelný úsek. Při zhodnocení ozřejmujeme zejména topografický vztah cévní stopky k operované krajině, její kvalitu, strukturu a uspořádání kolaterál, umožňující co nejlepší rozvinutí tlustého střeva ve své nové lokalizaci. Lze volit mezi interponáty z pravého i levého kolon (Tab. 3) [19]. I na našem pracovišti jsme v průběhu historie použití koloplastiky sledovali určitý vývoj, v určitém údobí jsme často používali distální ileum s kolon. Jako optimální úsek však nyní nejčastěji užíváme příčný tračník s částí sestupného tračníku a na místo původně užívané výživné stopky střední kolické tepny nyní preferujeme kolickou tepnu levou. Za irelevantní považujeme okolnost, je-li transponát situován izo - či anizoperistalticky. Určitý vliv na výběr tedy mají i zvyklosti na daném pracovišti.
Image 1. Zhodnocení stavu příčného tračníku – viditelné větvení a. colica media, anastomosis magna a a. colica sinistra
Fig. 1: Assessment of transverse colon status – visible branches of medial colic artery, anastomosis magna and left colic artery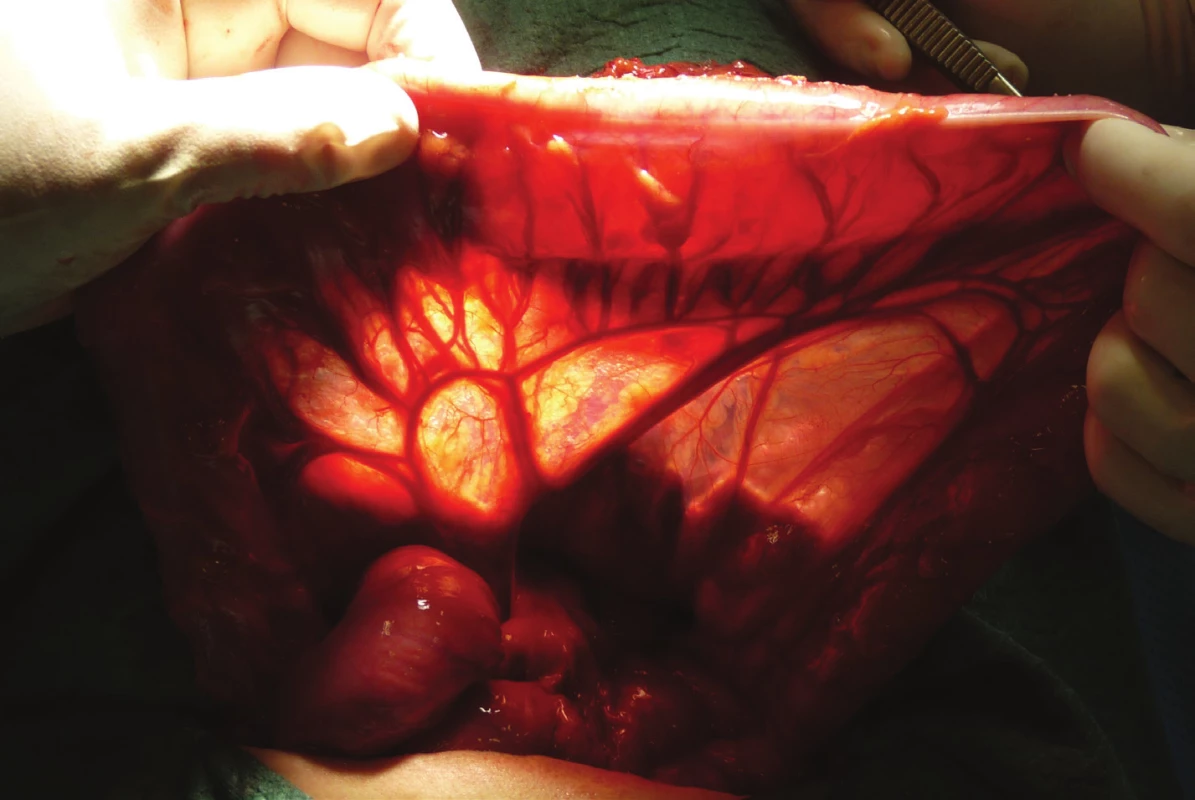
Table 3. Rozdíly v užití koloplastiky z pravé a levé části tlustého střeva
Tab. 3. Differences in the use of coloplasty from the right and left part of the colon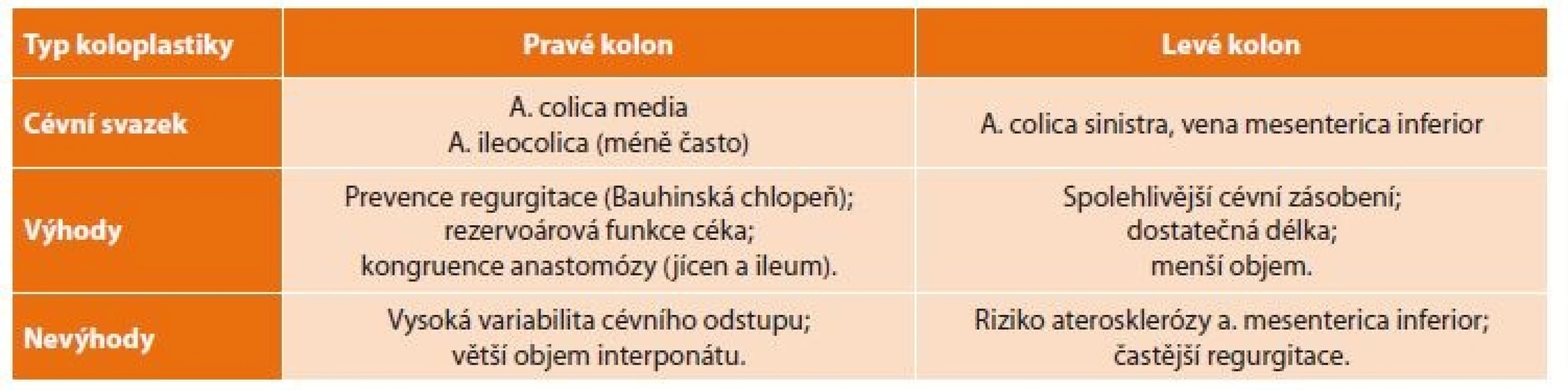
Je provedena omentektomie a skeletizace střeva s ponechaným výživným cévním svazkem a arkádou. Kvalita výživy střeva je ověřena naložením svorek na kmen a spojky, které budou podvázány (Obr. 2). Alternativou je i verifikace pomocí perfuze ICG. Následně jsou tyto cévy podvázány (Obr. 3) a pomocí bužie je naměřen úsek tlustého střeva plánovaného k náhradě (Obr. 4, 5).
Image 2. Ověření vitality střevní stěny po naložení cévních svorek na větve a. colica media, které budou podvázány
Fig. 2: Validation of the vitality of the intestinal wall after loading of the vascular clamps onto the branches of the middle colic artery to be tied up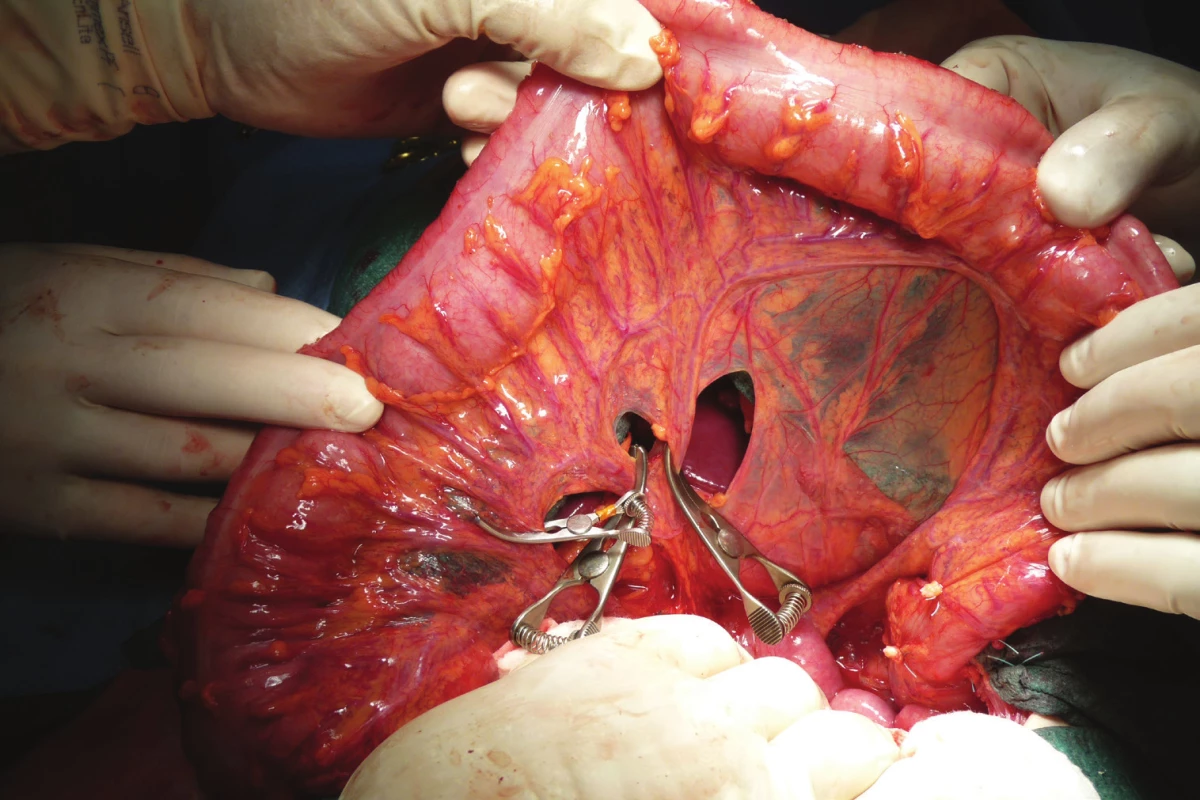
Image 3. Ligatura větví a. colica media s přerušením aborální části kolon
Fig. 3: Ligature of branches of the middle colic artery with discission of the aboral part of the colon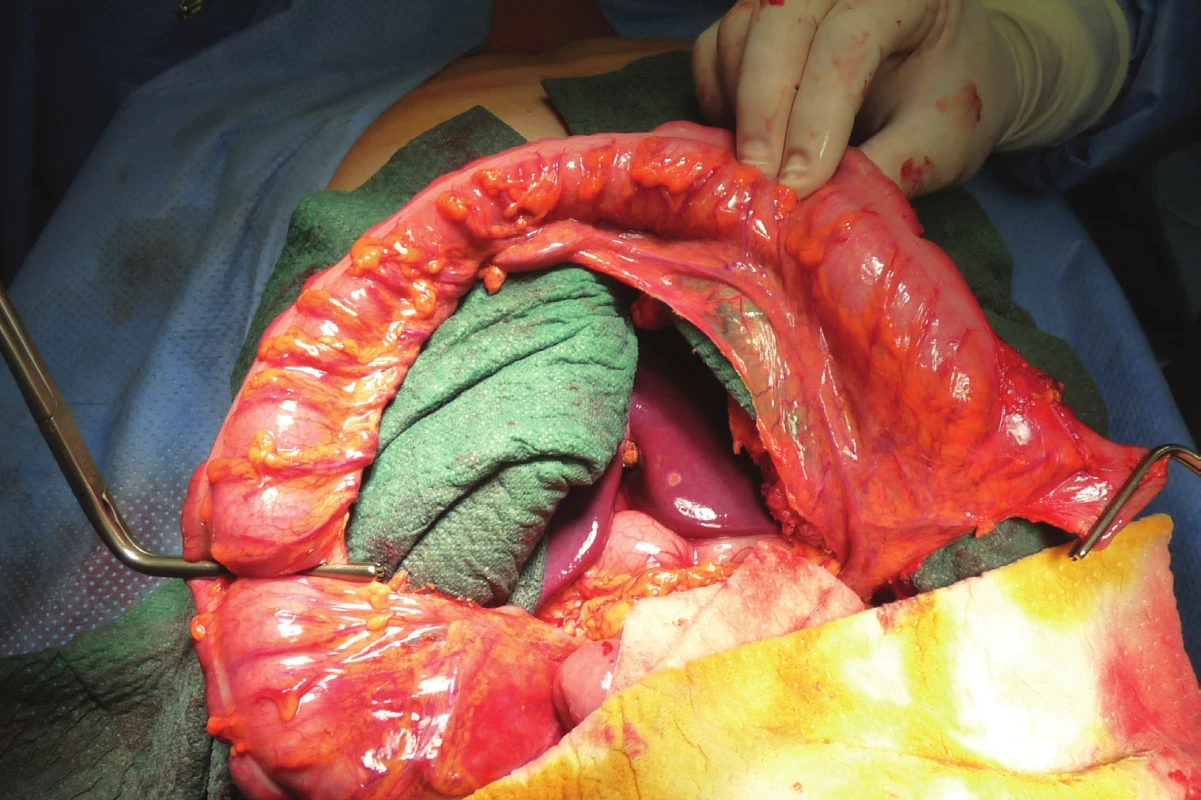
Image 4. Bužie k měření délky kolického interponátu
Fig. 4: A bougie used to measure the length of the colonic interponate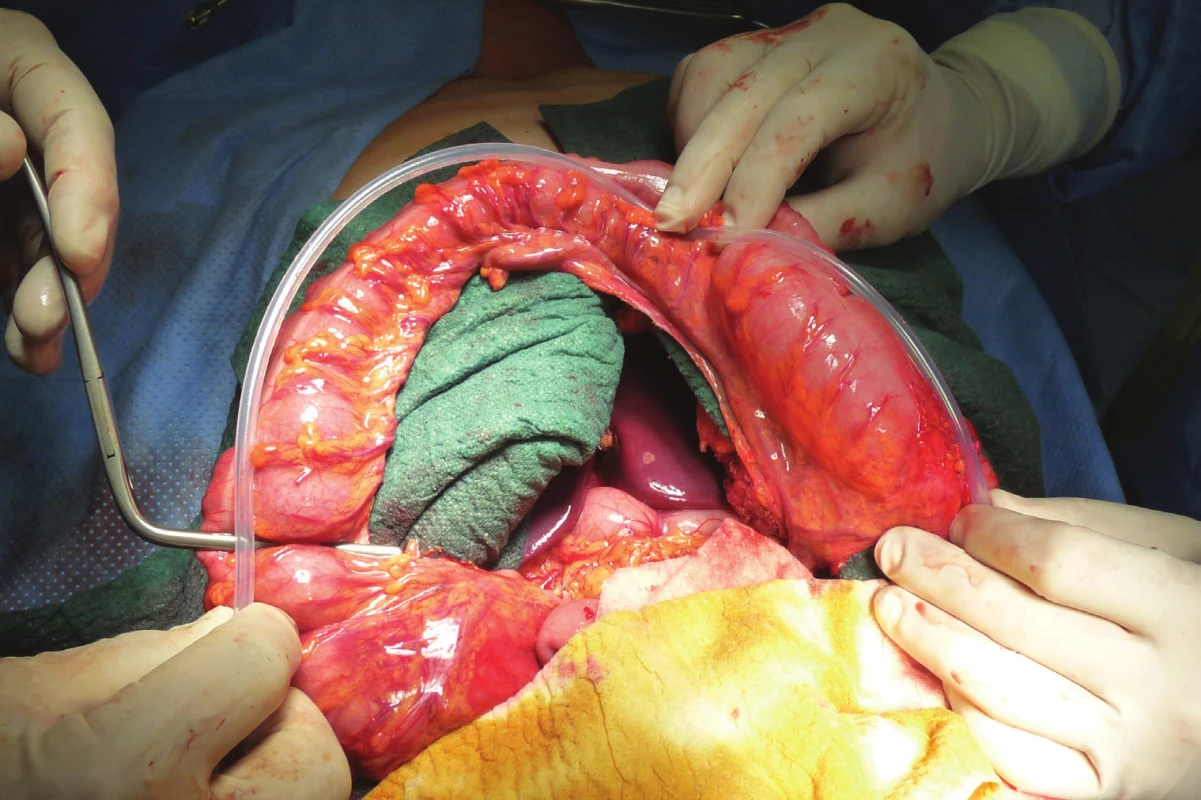
Image 5. Interponát přiložený presternálně
Fig. 5: An interponate attached presternally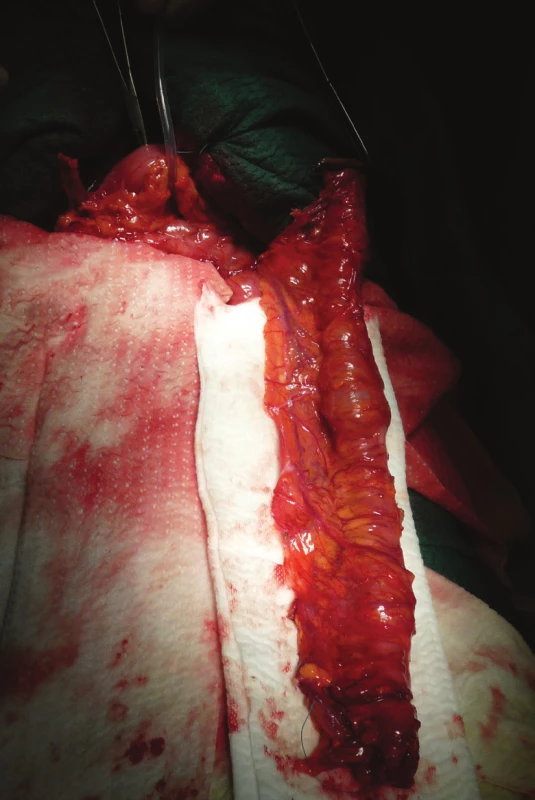
Střevo je přerušeno a okraje ošetřeny jodovou dezinfekcí. Retrogastricky je vytvořen přes omentální burzu prostor, kterým je protaženo střevo s cévní stopkou. Následně si z krční incize a laparotomie pomocí prstů a tamponů vytváříme retrosternálně prostor, kterým je kolon protaženo do krční oblasti [20]. V případě stísněného prostoru v oblasti manubrium sterni je třeba dbát na to, aby transponát nebyl stlačen ani za cenu vzácně vynucené resekce sternoklavikulárního skloubení. Je konstruována anastomóza s krčním jícnem, v případě patologických změn až na aditus laryngeální (Obr. 6). Jako nejvhodnější se nám jeví jednovrstevná anastomóza end-to-side, u anastomózy s faryngem dáváme přednost side-to-side spojení [21]. Někteří autoři [22,23] v této fázi přidávají cévní anastomózy na podvázané tepny a žíly k zlepšení žilní drenáže a podpoře arteriálního zásobování (v případě pravého kolon v. ileocolica k v. jugularis anterior či externa, arteriální anastomózy u pravého kolon mezi a. ileocolica a a. thoracica interna a u levého kolon pahýl a. sigmoidea na a. thyreoidea superior či a. facialis), nicméně s podstatným prodloužením výkonu. Poté je aborální část kolon anastomozována se žaludkem (Obr. 7), respektive v případě jeho odstranění s duodenem. Délka cévního svazku určuje nejvhodnější lokalizaci anastomózy kolotransponátu s přední stěnou žaludeční. Výkon je vždy, pokud mohl být žaludek ponechán, doplněn pyloroplastikou, resp. pyloromyotomií. Zakládáme 1–2 silastikové drény nitrobřišně (subhepaticky, vlevo subfrenicky, případně do malé pánve) a Redonův drén ke krční anastomóze.
Image 6. Anastomóza krčního jícnu a interponátu kolon protaženého retrosternálně z laterální krční incize
Fig. 6: Anastomosis of the cervical esophagus and colonic interponate drawn back from the lateral cervical incision retrosternally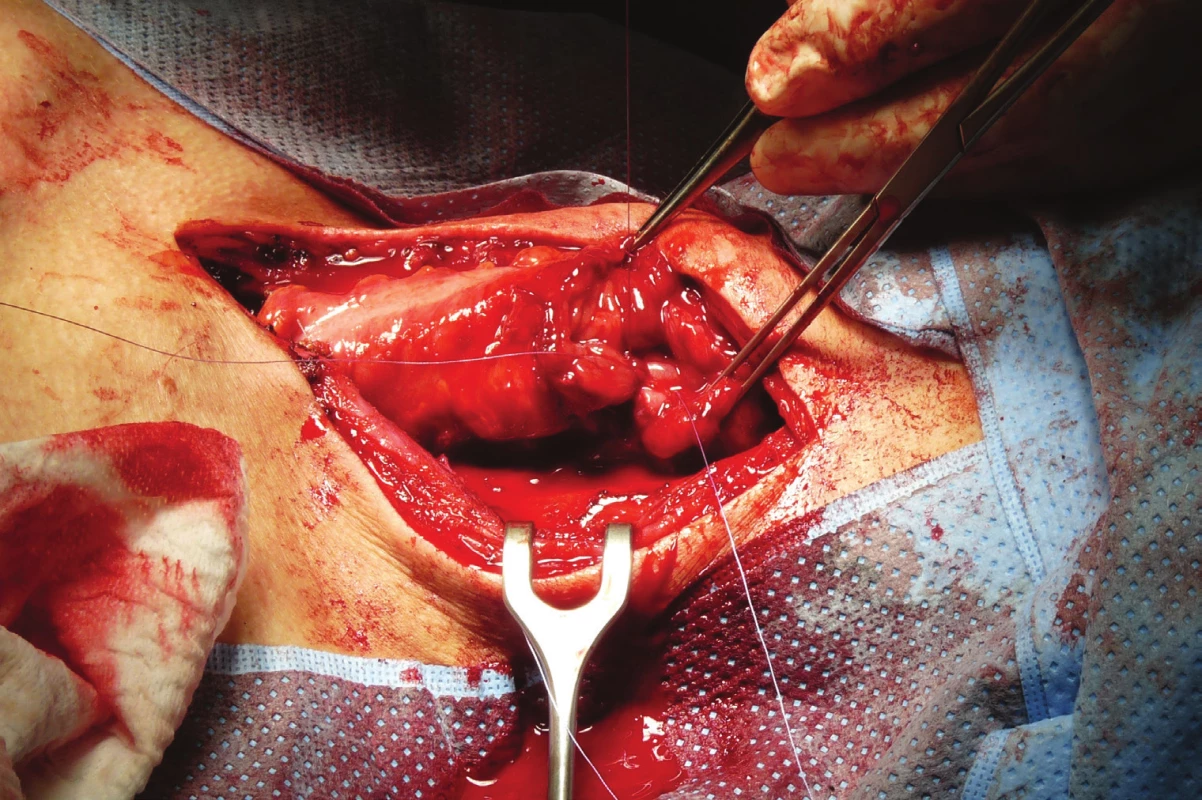
Image 7. Anastomóza aborální části kolon s přední stěnou žaludku
Fig. 7: Anastomosis of the aboral part of the colon with the front wall of the stomach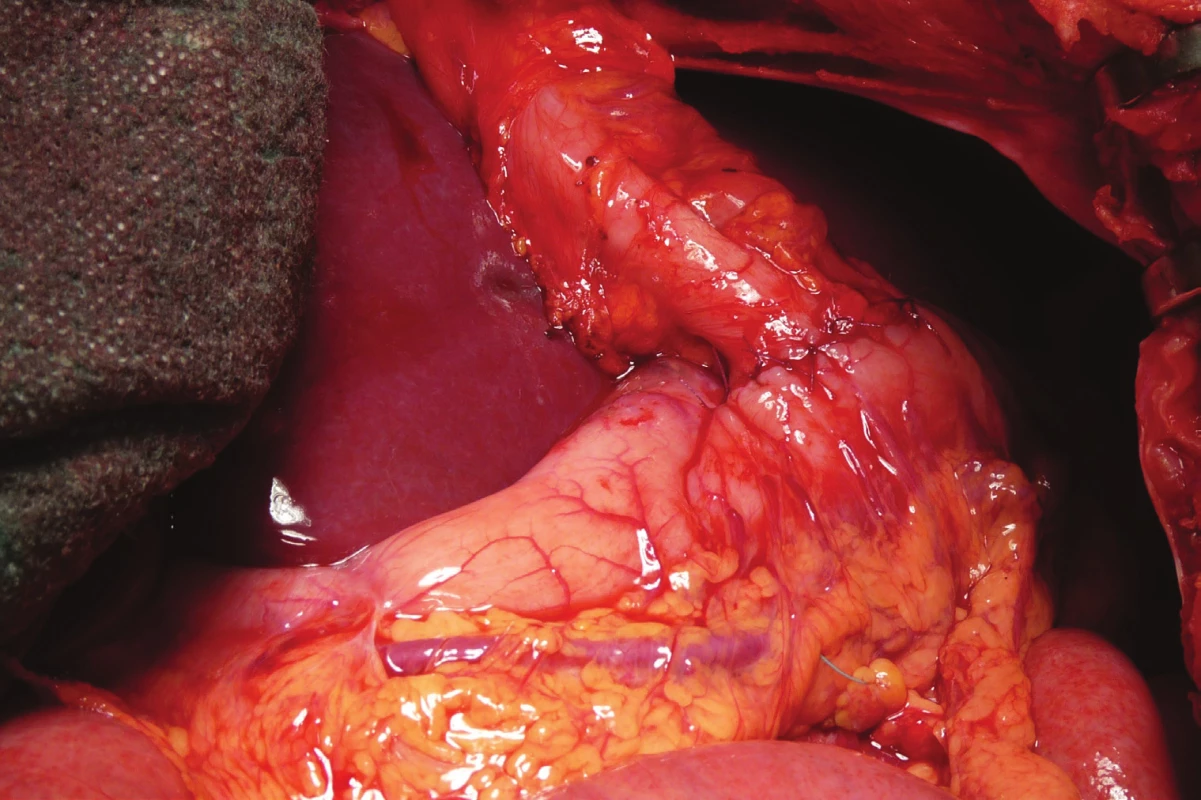
Pooperační péče
Pooperační péče na jednotce intenzivní péče při nekomplikovaném průběhu trvá 5–7 dnů. Antibiotická profylaxe je minimálně jednodenní, často však zvažujeme ponechání terapeutického podání antibiotik s korekcí dle mikrobiologických nálezů. Pooperační invazivní ventilaci ponecháváme co nejkratší dobu, nejčastěji v režimu C-PAP. Drény odstraňujeme při absenci krvácení a poklesu sekrece alespoň pod 200 ml (břišní drén) a 50 ml (krční Redonův drén). Zahajujeme časnou pooperační enterální výživu cestou nazojejunální sondy či založené nutritivní jejunostomie s postupnou eskalací v kombinaci s parenterální výživou. Samozřejmá je pooperační dechová a kondiční rehabilitace. Verifikaci anastomózy pomocí RTG polykacího aktu s vodným kontrastem provádíme 5. až 7. pooperační den (Obr. 8a,b).
Obr. 8a: RTG polykacího aktu 7. pooperační den – retrosternální uložení kolon
Fig. 8a: X-ray barium swallow on the 7th postoperative day − retrosternal placement of the colon
Obr. 8b: RTG polykacího aktu kolického konduitu s anastomózou k aditus laryngealis. 
Krátkodobé výsledky
Literární hodnocení krátkodobých výsledků a perioperační morbidity a mortality shrnuje Tab. 4. Problémem hodnocení je retrospektivní povaha studií, které jsou rozloženy do delšího časového údobí, často nedostatečně definované technické rozdíly v jednotlivých studiích a nesourodý způsob hodnocení stupně anastomotického leaku. Významný je také rozdíl v incidenci leaku u subkutánně uloženého transponátu (až 46,4 %), který je ovšem většinou provázen nízkou mortalitou, případně transponátu v zadním mediastinu (leak v 17,5−30,2 %, mortalita 2,5−16,3 %) ve srovnání s retrosternální lokalizací (leak rate 8,8−12,6 %, mortalita 0−9 %). I zkušenosti našeho pracoviště dosahují uvedeného rozmezí s 30denní mortalitou 6,7 % [24].
Table 4. Hodnocení krátkodobých výsledků a perioperační morbidity a mortality (volně dle Watanabeho)
Tab. 4: Evaluation of short-term outcomes and perioperative morbidity and mortality (according to Watanabe)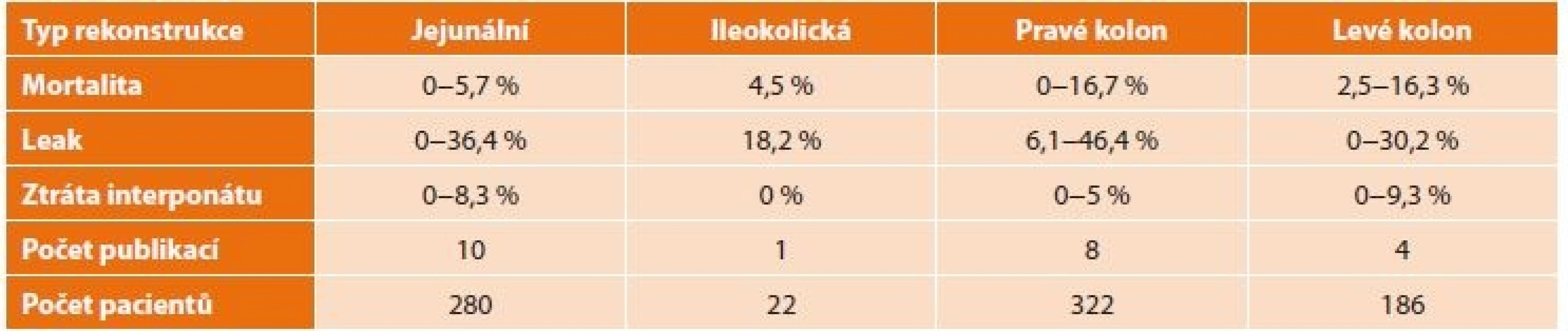
Přes uvedené výhrady k literárním údajům lze považovat ischemii transponátu a leak za hlavní faktory morbidity a mortality. Projevují se zpravidla známkami sepse. Diagnózu lze upřesnit dle použitého lůžka transponátu prostým rozpuštěním krční incize, provedením CT břicha a hrudníku (s nálezem úniku kontrastu, bublinek plynu, případně kolekce v mediastinu či kolem anastomózy), případně využitím endoskopie, která je nejspolehlivější v rozlišení prostého leaku od nekrózy koloplastiky [25].
V případě nekrózy kolotransponátu je potřebným postupem chirurgická revize s resekcí nekrotické tkáně, založením cervikální ezofagostomie a snahou o zachování konduitu, případně s jeho přemístěním intraabdominálně či subkutánně se slepým uzávěrem jeho horní části. Ve druhé době po zvládnutí sepse lze přistoupit k rekonstrukci s užitím volného jejunálního štěpu.
V případě menších leaků se zpravidla lze spokojit s drenáží, cílenou antibiotickou terapií a odložením perorální realimentace. Případnou enterokutánní píštěl lze následně řešit suturou, eventuálně krytou svalovým lalokem (m. pectoralis major).
Mezi běžně sledované obtíže v pooperačním období dále patří dysfagie, průjem, reflux a dumping syndrom, které zpravidla spontánně ustupují.
Dlouhodobé výsledky
Z dlouhodobého hlediska je průchodnost kolického interponátu pacienty hodnocena kladně a nabízí dlouhodobou průchodnost s rizikem stenózy anastomózy dosahujícím 0–40 %, která je zpravidla vyřešena balonovou dilatací. Redundance koloplastiky je udávána též s incidencí 0–40 %, význam pro reintervence však zůstává nejasný [26]. Chronické aspirace bývají udávány v 10 % případů. Vzácnými komplikacemi jsou pak kolokutánní či kolobronchiální píštěle. V rámci surveillance jsou indikovány pravidelné endoskopické kontroly pro jisté riziko vzniku polypů a dokonce nádorů v koloplastice.
Kvalita života bývá hodnocena jako dobrá [27,28,29], jako hlavní dlouhodobé funkční obtíže bývají udávány biliární či kyselý reflux. Reference o dlouhodobých výsledcích jsou i z tohoto důvodu rozporné, od velmi dobrých (většina referovaných prací) až po málo uspokojivé.
Závěr
Náhrada jícnu tlustým střevem je standardizovaný, byť méně často prováděný výkon, jehož technické zvládnutí by mělo být součástí repertoáru pracovišť zabývajících se jícnovou chirurgií. Navzdory jistým literárním rozporům považujeme za nejvhodnější použití příčného a levého tračníku se stopkou na a. colica sinistra s retrogastrickým a retrosternálním uložením. Pro variabilitu indikací a anatomických podmínek je však třeba technicky ovládat i ostatní možnosti včetně případné interpozice volného jejunálního štěpu (zvláště při potřebě krátkého interponátu). Navzdory referované morbiditě a mortalitě a technické náročnosti lze při správném výběru nemocných dosáhnout bezpečného provedení výkonu s velmi dobrým výhledem na dlouhodobou funkci transponátu. Vzhledem k povaze literárních referencí je třeba zvážit podrobné zhodnocení ve formě prospektivně vedeného multicentrického registru včetně hodnocení kvality života.
Seznam zkratek
NaRT − neoadjuvatní radioterapie
ICG – zobrazení pomocí indocyaninové zeleně
C-PAP – kontinuální pozitivní tlak dýchacích cest
CHOPN – chronická obstrukční plicní nemoc
CT – počítačová tomografie
MR – magnetická rezonance
Práce je věnována památce prof. MUDr. Jiřího Králíka, CSc., emeritního přednosty I. Chirurgické kliniky FN Olomouc.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Stašek
I. chirurgická klinika LF UP a FN Olomouc
e-mail: martin.stasek@fnol.cz
Sources
- Vulliet H. De l´oesophagoplastic et de ses diverses modifications. Semin Med 1911;31 : 529−30.
- Kelling G. Ösophagoplastik mit Hilfe des Querkolon. Zentralbl Chir 1911;38 : 1209−1
- Fraštacký Š. Hrubé črevo ako transplantát. SAV Bratislava 1962 : 39−42.
- Rapant V, Hromada J. Palliative anastomosis in the treatment of corrosive stenosis of the esophagus. J Thor Surg 1950;20 : 45
- Rapant V. Intrathorakální ezofagogastroanastomóza v chirurgii korosivních stenos jícnu. Acta Univ Palac Olomoucis 1956;11 : 21
- Rapant V. Dnešní stav a perspektiva chirurgické náhrady jícnu. Acta Univ Palac Olomoucis 1963;32 : 195–202.
- Rapant V. K problematice paliativních výkonů u karcinomu jícnu. Rozhl Chir 1964;43 : 65.
- Rapant V, Pěgřim R, Mareš J. Die Technik der Tunnelierung des Retrosternalraumes bei der retrosternalen Speiseröhreplastik. Thor Vasc Chir 1964;11 : 631.
- Rapant V, Hirsch A, Králík J, a spol. Technické a taktické prvky rozhodující o bezprostředních a pozdních výsledcích retrosternální plastiky jícnu tlustým střevem. Brat lek Listy 1965;45 : 457.
- Thomas P, Fuentes P, Giudicelli R, et al. Colon interposition for esophageal replacement: current indications and long-term function. Ann Thorac Surg 1997;64 : 757−64.
- Gust L, Outtara M, Coosemans W, et al. European perspective in thoracic surgery – eso-coloplasty: when and how? J Thorac Dis 2016;8(suppl.4):S387−S398.
- Spitz L. Esophageal replacement: overcoming the need. J Pediatr Surg 2014;49 : 849−52.
- Gallo G, Zwaveling S, Groen H, et al. Long-gap esophageal atresia: a meta-analysis of jejunal interposition, colon interposition, and gastric pull-up. Eur J Pediatr Surg 2012;22 : 420−5.
- Schröder W, Zähringer M, Stippel D, et al. Does celiac trunk stenosis correlate with anastomotic leakage of esophagogastrostomy after esophagectomy? Dis Esophagus 2002;15 : 232−6.
- Briel JW, Tamhankar AP, Hagen JA, et al. Prevalence and risk factors for ischemia, leak, and stricture of esophageal anastomosis: gastric pull-up versus colon interposition. J Am Coll Surg 2004;198 : 536−41; discussion 541−2.
- Rice TW. Right colon interposition for esophageal replacement. Op Tech Thor Cardiovasc Surg 1999;3 : 210−21.
- DeMeester TR. Esophageal replacement with colon interposition. Operative Techniques in Cardiac & Thoracic. Surgery. A Comparative Atlas 1997;2 : 73−86.
- DeMeester SR: Colonic interposition for benign disease. Op Tech in Thor Cardiovasc Surg 2006;232−49.
- Watanabe M, Mine S, Nishida K, et al. Reconstruction after esophagectomy for esophageal cancer patients with a history of gastrectomy. Gen Thorac. Cardiovasc Surg 2016;64 : 457−63.
- Oida T, Mimatsu K, Kano H, et al. Anterior vs. posterior mediastinal routes in colon interposition after esophagectomy. Hepatogastroenterology 2012;59 : 1832−4.
- Gust L, Ouattara M, Coosemans W, et al. Hand-sewn cervical eso-colic anastomosis. Asvide 2016. Available from: http://www.asvide.com/articles/969
- Kesler KA, Pillai ST, Birdas TJ, et al. Supercharged isoperistaltic colon interposition for long-segment esophageal reconstruction. Ann Thorac Surg 2013;95 : 1162-8; discussion 1168−9.
- Saeki H, Morita M, Harada N, et al. Esophageal replacement by colon interposition with microvascular surgery for patients with thoracic esophageal cancer: the utility of superdrainage. Dis Esophagus 2013;26 : 50−6.
- Neoral Č, Aujeský R, Král V. Esophageal replacement using large intestine – experience wwith 109 cases. Rozhl Chir 2010;89 : 740−5.
- de Delva PE, Morse CR, Austen WG Jr, et al. Surgical management of failed colon interposition. Eur J Cardiothorac Surg 2008;34 : 432−7; discussion 437.
- Strauss DC, Forshaw MJ, Tandon RC, et al. Surgical management of colonic redundancy following esophageal replacement. Dis Esophagus 2008;21:E1−5.
- Greene CL, DeMeester SR, Augustin F, et al. Longterm quality of life and alimentary satisfaction after esophagectomy with colon interposition. Ann Thorac Surg 2014;98 : 1713–9; discussion 1719−20.
- Cense HA, Visser MR, van Sandick JW, et al. Quality of life after colon interposition by necessity for esophageal cancer replacement. J Surg Oncol 2004;88 : 32−8.
- Králík J, Aujeský R, Folprecht M, et al. Dlouhodobé vyhodnocení kolon jako náhrady jícnu (retrosternální ezofagokoloplastika). Čs Gastroent Výž 1993;47 : 243−7.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 7-
All articles in this issue
- Využití retrosternálně uloženého kolon v náhradě jícnu
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
- Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
- Hybridní torakoskopická resekce jícnu pro karcinom – retrospektivní analýza a srovnání s transhiatální ezofagektomií
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití retrosternálně uloženého kolon v náhradě jícnu
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

