-
Medical journals
- Career
Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
Authors: M. Stašek; R. Aujeský; R. Vrba; J. Chudáček; L. Bébarová; M. Gregořík; Dušan Klos; Č. Neoral
Authors‘ workplace: 1. chirurgická klinika Lékařské fakulty Univerzity Palackého Fakultní nemocnice Olomouc
Published in: Rozhl. Chir., 2018, roč. 97, č. 7, s. 349-353.
Category: Case Report
Overview
Úvod:
Leak po ezofagektomii se vyskytuje v 1−30 % případů a je důležitým faktorem pooperační morbidity a mortality s podílem na 40 % pooperačních úmrtí. Endoskopická vakuová terapie (EVAC) je vedle terapie stenty, klipy a chirurgické terapie novou endoskopickou terapeutickou možností.
Kazuistika:
72letá polymorbidní pacientka s adenokarcinomem distálního jícnu Siewert II (T1b, N0, M0) byla indikována k resekci horní části žaludku a dolního hrudního jícnu z laparotomie a torakotomie s rekonstrukcí 2staplerovou ezofagogastroanastomózou. 12. pooperační den byl na CT prokázán leak 3. stupně s propagací do pravé pleurální dutiny. Při endoskopii byl nalezen defekt zaujímající 30 % cirkumference, s dutinou o velikosti 7x3x3 cm. Vzhledem k morfologii úniku bylo rozhodnuto o založení EVAC. Léčba EVAC byla použita ve 12 sezeních s 3 až 4denními odstupy v celkové délce trvání 40 dní. Celkem bylo indikováno 5 extraluminálních a 7 intraluminálních aplikací s podtlakem 100−125 mmHg. Stav byl komplikován globálním respiračním selháním pro těžkou pneumonii. Arteficiální ventilace byla ukončena 58. pooperační den. Pacientka byla propuštěna do rehabilitačního zařízení 90. pooperační den. Kontrola 3 měsíce po dimisi potvrzovala uspokojivé funkční výsledky s plnou realimentací.
Závěr:
Terapie komplikací nitrohrudních anastomóz po ezofagektomii směřuje k redukci invazivity a větší implementaci endoskopických metod. Použití EVAC je přes své nedostatky spojené s nutností opakované aplikace bezpečnou a vysoce účinnou léčebnou alternativou i u rozsáhlých defektů anastomózy. Její další využití, indikace a poměr k dalším léčebným metodám vyžadují další studium.
Klíčová slova: endoskopická vakuová terapie − netěsnost jícnu (jícnový leak) – komplikace ezofagektomie – intraoperační endoskopie
Úvod
Leak po ezofagektomii se vyskytuje v 1−30 % případů (medián 10 %) [1] a je významným faktorem pooperační morbidity a mortality s významným podílem na 40 % pooperačních úmrtí [2]. S rozvojem endoskopických metod dochází k rozšíření indikací endoskopické terapie anastomotických komplikací. Zejména možnost zavedení stentů, endoskopických klipů a v tomto sdělení zmíněná endoskopická vakuová terapie (EVAC) a jejich konkrétní indikace nabízejí zajímavé možnosti a léčebné výsledky jsou při relevantním použití slibné.
Kazuistika
72letá pacientka byla vyšetřována pro refluxní obtíže a dysfagii s nálezem adenokarcinomu distálního jícnu a kardie Siewert II v terénu hiátové hernie. Nález byl potvrzen endoskopicky a histologicky. Endosonograficky byl hodnocen jako T1b−T2, na PET/CT s pouze mírně zvýšenou akumulaci glukózy ve stěně kardie bez jiných ložiskových změn.
Pacientka prodělala léčbu bronchogenního adenokarcinomu plíce (EGFR negativní, ypR0 ypN1 ypMX, angioinvaze), u kterého byla po neoadjuvantní terapii CBDCA + Navelbin ve 4 cyklech indikována horní lobektomie s mediastinální lymfadenektomií a angioplastikou s následnou adjuvantní terapií. Další komorbidity zahrnují CHOPN II. stupně, aortální stenózu (ejekční frakce 45 %) a ischemickou chorobu srdeční, embolizaci plicnice s následnou antikoagulací, centrální mozkovou příhodu s levostrannou hemiparézou. Pacientka podstoupila hysterektomii a opakované operace páteře. Medikovala betablokátory, anxiolytika, antihypertenzivní terapii, omeprazol, perorální antidiabetika a antikoagulancia.
Byla indikována primární chirurgická terapie. Pro peroperačně nehmatný tumor byla provedena intraoperační ezofagogastroskopie s lokalizací nádoru a následně z laparotomie resekce horní části žaludku a abdominální partie jícnu s D2 lymfadenektomií a extramukózní pyloroplastikou. Pozitivní horní resekční linie při kryostatovém histologickém vyšetření si vyžádala rozšíření resekce na dolní partii hrudního jícnu z pravostranné torakotomie s obnovou pasáže ezofagogastroanastomózou, konstruovanou cirkulárním a lineárním staplerem.
Po časné extubaci byla zahájena parenterální výživa, pro významnou elevaci CRP byla 2. pooperační den provedena negativní zkouška leaku s metylenovou modří se zahájením antibiotické terapie (tazobactam + flukonazol), následný RTG jícnu 4. pooperační den neprokazuje únik z anastomózy. 7. pooperační den byla zahájena perorální realimentace, pro přetrvávající vysokou hladinu CRP bylo 11. pooperační den indikováno CT hrudníku s nálezem kavity v oblasti anastomózy s propagací do pravé pleurální dutiny se suspektní komunikací s anastomózou. Proto bylo u nemocné 12. pooperační den indikováno založení nutritivní jejunostomie. Zároveň byla provedena gastroskopie, prokazující defekt zaujímající 30 % anastomózy s dutinou o velikosti 7x3x3 cm. Vzhledem k morfologii úniku bylo indikováno založení EVAC. Následující den se rozvinula respirační insuficience na podkladě těžké pneumonie vyžadující arteficiální ventilaci (režim C-PAP) a vazopresorickou terapii. Postupně došlo k regresi plicních zánětlivých změn, nicméně weaning se nedařil a 24. pooperační den byla založena tracheostomie. Vyšetření CT provedené 26. pooperační den prokázalo regresi velikosti dutiny se zavedenou houbičkou (Obr. 1). Weaning byl úspěšný až 58. pooperační den, kdy byla ukončena i terapie EVAC, dle CT byl popsán reziduální ohraničený leak cca 28x6 mm a zánětlivé parametry se normalizovaly. Byla zahájena postupná perorální realimentace. Terapie EVAC byla použita celkově v 12 sezeních s odstupy 3–4 dnů v celkové délce trvání 40 dní (Obr. 2−5). Výkon byl v 5 případech kombinovaný, a to s nutritivní jejunostomií, založením tracheostomie, výměnami tracheostomie 2x, bronchoskopií. Při šestém sezení byla vzhledem k redukci perianastomotické dutiny extraluminální aplikace houbičky (velikost použité houbičky 1x1x4 cm) převedena na intraluminální. Byl aplikován podtlak 100−125 mmHg. Při aplikaci jsme začínali diagnostickou endoskopií s extrakcí houbičky, kontrolou dutiny s odběrem kultivace, extrakcí případných uvolněných nekróz, zbytků a cizích těles a laváží mediastina. Následně byla jícnem zavedena převlečná hadice (overtube) do kavity či lumina jícnu, kterou jsme pomocí aplikátoru nebo endoskopu zavedli houbičku, vždy s následnou endoskopickou kontrolou uložení. Při uspokojivé poloze byla po zahájení podtlaku převlečná hadice extrahována i s endoskopem a sonda protažena nosním průduchem.
Image 1. CT hrudníku – EVAC in situ v dutině paravertebrálně vpravo
Fig. 1: Chest CT – EVAC in situ in the right paravertebral cavity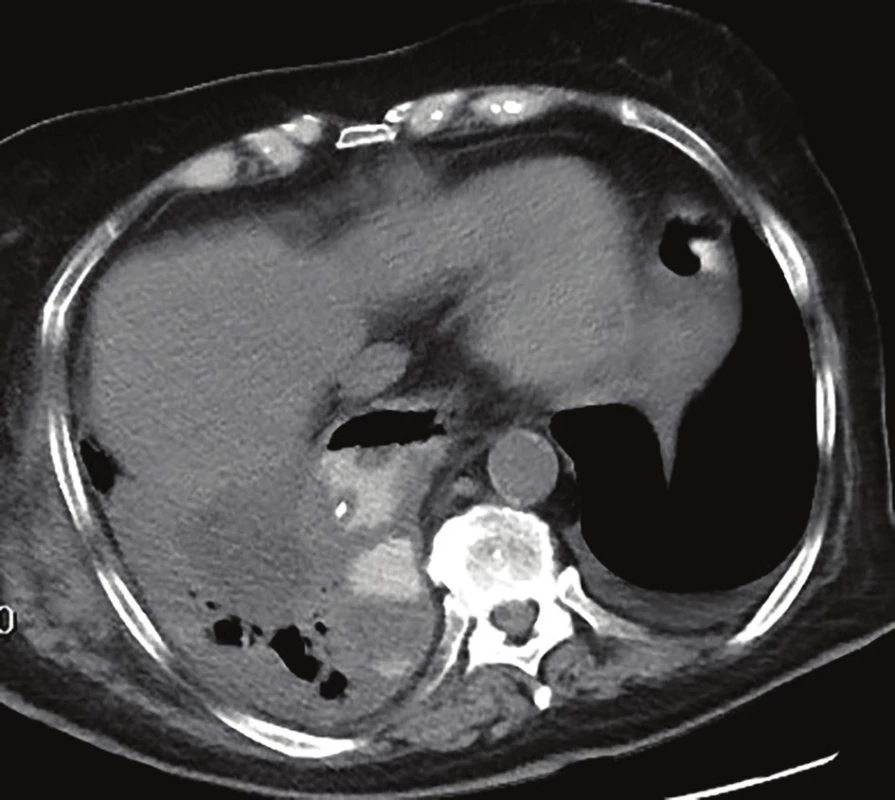
Image 2. Stav před zahájením EVAC – nekróza a zbytky stravy
Fig. 2: Status prior to EVAC initiation – necrosis and food remnants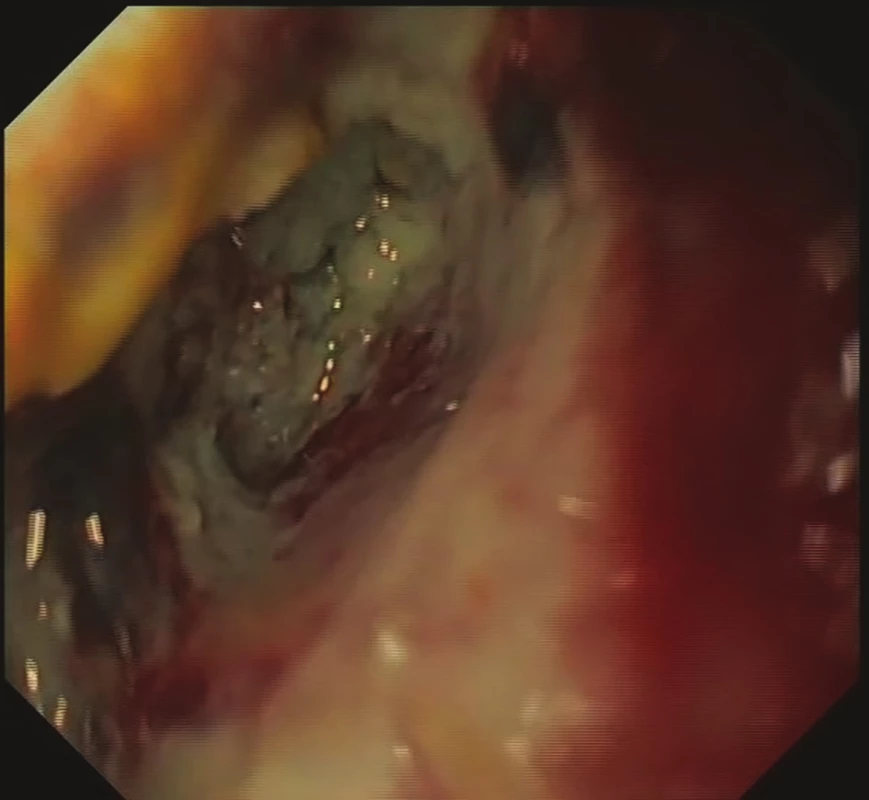
Image 3. 7. den EVAC – odlučující se nekrózy, formující se granulační tkáň
Fig. 3: EVAC, day 7 – necrosis, granulation tissue formation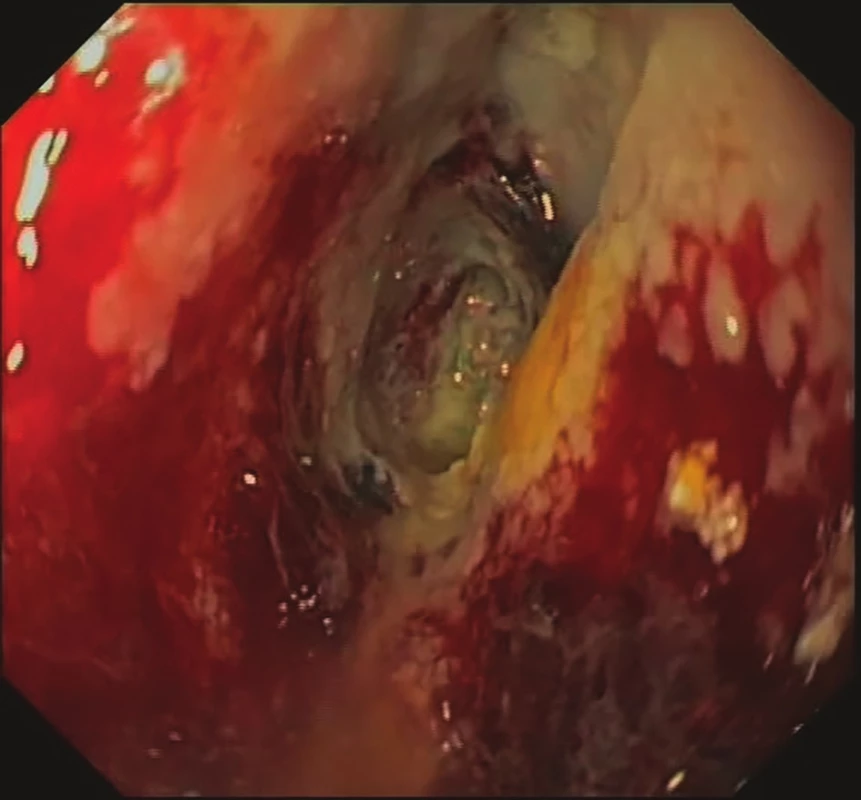
Image 4. 12. den EVAC − granulující tkáň mediastina
Fig. 4: EVAC, day 12 − mediastinal granulation tissue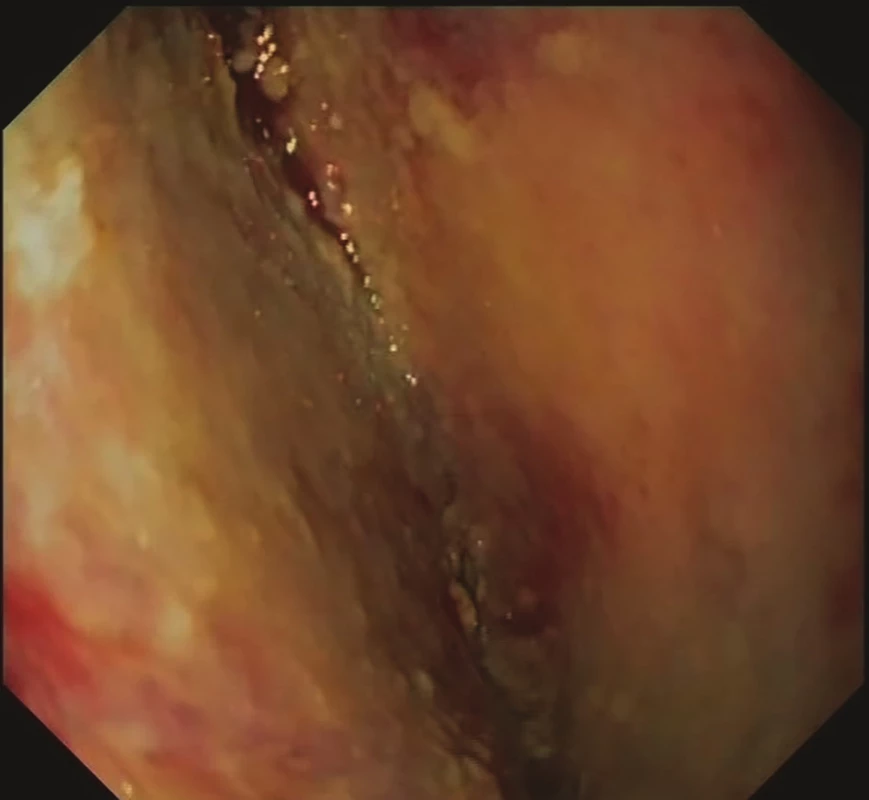
Image 5. 21. den EVAC− mediastinální granulace, regrese velikosti leaku, konverze k intraluminální EVAC Fig. 5: EVAC, day 21 – mediastinal granulation, regression
of the leak size, conversion to intraluminal EVAC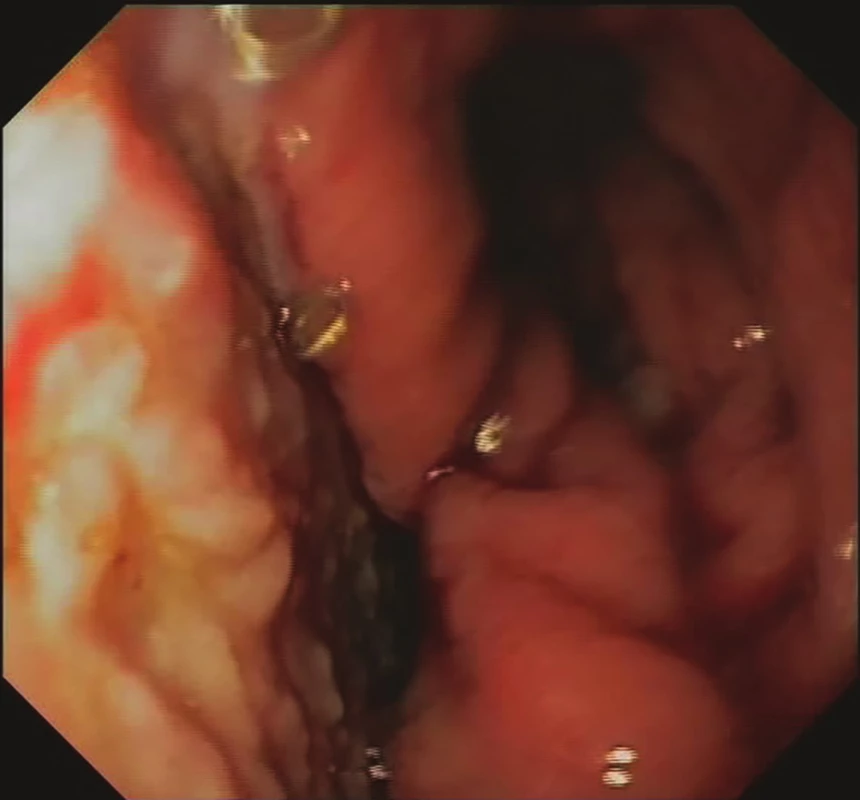
Kultivace sputa z mediastina potvrzovaly postupně nálezy ESBL pozitivní Klebsiella pneumoniae, Pseudomonas aeruginosa, Candida parapsilosis, Proteus sp. V průběhu terapie byla indikována cílená antibiotická terapie dle kultivace.
Pacientka byla po 3měsíční hospitalizaci přeložena na rehabilitaci. RTG před dimisí neprokazovalo leak (Obr. 6). 3 měsíce od dimise je nemocná schopna chůze o holi, bez polykacích obtíží, se stabilní hmotností. Další onkologická terapie nebyla indikována.
Image 6. Výsledný RTG jícnu s kontrastem zobrazující malý pseudodivertikl anastomózy, bez prokazatelného leaku
Fig. 6: The final radiographic contrast study depicting a small pseudodiverticulum in the anastomosis site, without demonstrable leakage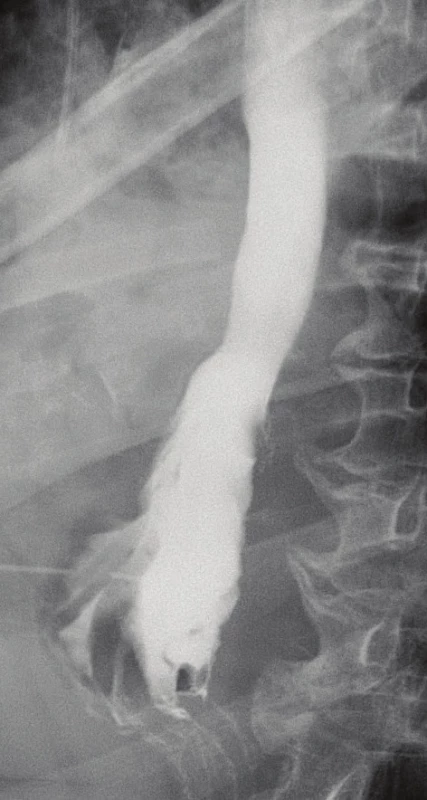
Diskuze
Diagnostika leaku a jeho závažnosti po ezofagektomii je postavena na hodnocení projevů sepse a radiologickém či endoskopickém zhodnocení se zaměřením na verifikaci viability konduitu a posouzení ohraničení a rozsahu leaku. Za nejpřesnější vyšetření je považováno CT s perorálním kontrastem, méně přesný je kontrastní RTG jícnu, který může selhat až v 50 % při iniciálním pooperačním vyšetření [3]. Pro posouzení viability anastomózy je nejpřínosnější endoskopie, která upřesňuje i rozsah a přístupnost kavity.
Schuchert klasifikuje leaky do 4 stupňů [4], kdy 1. stupeň představuje pouze radiologický leak, 2. stupeň leak menší než 10 % s lokalizovaným výpotkem či kolekcí, který může vyžádat cílenou drenáž, 3. stupeň s 10–50% disrupcí anastomózy a perianastomotickým abscesem, který může být nejvhodnějším pro endoskopickou intervenci, a 4. stupeň, který je představován nekrózou anastomózy s její praktickou separací, vyžadující chirurgickou terapii.
Chirurgická terapie [5] je indikována u velkých leaků, zpravidla z důvodu ischemie anastomózy, neohraničených leaků a při symptomatice těžké sepse a MODS. Její součástí je debridement, revize anastomózy, uzávěr defektu, cílená drenáž, dle individuálního nálezu pak resekce ischemického segmentu s případnou diverzí. Letalita chirurgické terapie dosahuje až 50 %.
Při manifestaci leaku lze použít kombinaci endoskopické diagnostiky a chirurgického výkonu. Tento postup má význam zejména u stavů, kde chirurgická a endoskopická terapie jsou léčebnými alternativami, a v případě indikace aditivního výkonu (tracheostomie, drenáž, revize rány, zajištění nutričního vstupu). Endoskopické metody léčby zahrnují především zavedení stentu, ošetření klipy a EVAC (Tab. 1).
Table 1. Výhody a nevýhody endoskopických terapeutických metod
Tab. 1: Advantages and disadvantages of endoscopic therapeutic methods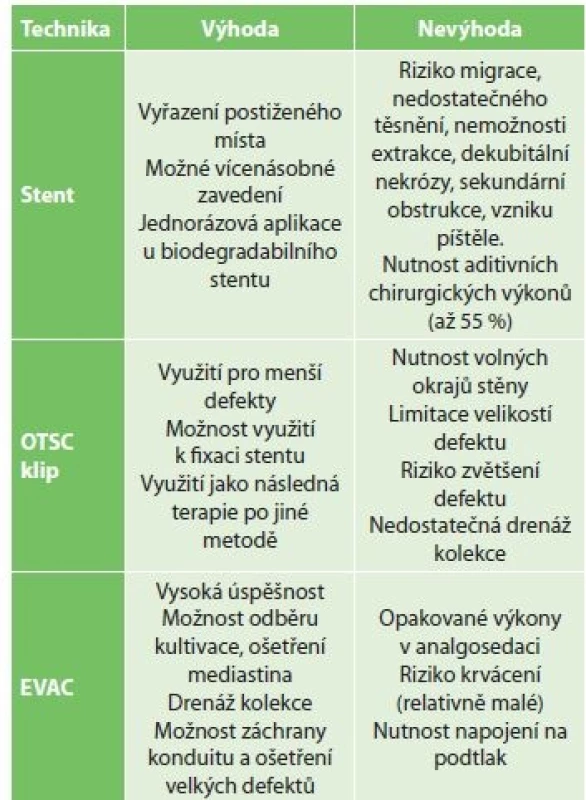
Vysvětivky: EVAC – endoskopická vakuová terapie, endoscopicvacuumassistedclosure; OTSC – Over-the-scopeclip Zavedení jícnového stentu, jako patrně nejrozšířenější intraluminální technika, vykazuje relativně vysokou úspěšnost, nicméně dle většiny studií má významné limitace. Tuebergen [6] udává úspěšnost zhojení leaků v 85 %, mortalitu 15 % a 29 % signifikantních komplikací u relativně malých leaků (1−22 mm, medián 5 mm). Van Boeckel [7] udává komplikace v souvislosti s aplikací stentů ve 34 % a celkovou mortalitu 13 %. Celkově lze očekávat úspěšnost funkčního zavedení stentu ve 40−80 % s nutností ponechání stentu minimálně 2−6 týdnů. Při perifokálních kolekcích je nutno kombinovat terapii stentem s aditivními výkony (drenáže, případně rozsáhlejší intervence při sepsi). K dislokaci stentů dochází až ve 40 % případů, další rizika představují rozvoj striktury, dekubit a vrůst stentu do stěny, vznik fistulace (aorta, trachea, bronchy).
Další možností ošetření píštělí jícnu je jejich uzávěr OTSC klipy (over-the-scope clip, Ovesco Endoscopy AG, Tübingen, Německo) [8,9]. Dostupnost a publikované zkušenosti z této metody činí alternativu řešení peroperačně a časně pooperačně diagnostikovaných defektů, zejména ezofagojejunální anastomózy. Mohou se též stát závěrečným řešením v případě předchozí úspěšné aplikace jiné metody (EVAC, stent apod.).
Při hodnocení výsledků aplikace OTSC klipů u anastomotických komplikací je udávána úspěšnost 68 % [9]. Jejich hlavní limitací je velikost defektu a potřeba pohyblivých okrajů rány. Uzávěr defektu OTSC klipy neumožňuje drenáž perifokálních kolekcí do lumina. Klipování je obtížné v jícnu a zejména u krčních anastomóz.
Princip EVAC (endoskopické vakuové terapie, endoscopic vacuum assisted closure) [10] spočívá v intrakavitární či intraluminální aplikaci polyuretanové houbičky, napojené na generátor podtlaku (používaný podtlak je 80−125 mmHg). Napomáhá aktivnímu odsávání, progresi granulací, redukci množství infekčních agens, postupné redukci objemu píštěle. Zavedení lze provést po zachycení do kleští za přídatný steh, tlakem endoskopu, případně prostřednictvím převlečné hadice (overtube). Velikost houbičky lze upravit dle velikosti kavity a defektu. Endoskopicky je možné provést laváž a nekrektomii, odstranění cizích těles (stehy, zbytky stravy, svorky) a odebrat kultivaci. Po zahájení terapie EVAC lze očekávat zvýšení zánětlivých parametrů, které je zpravidla přechodné, a je tedy nutné sledovat jejich dynamiku. V průběhu užívání EVAC je vždy potřebné zvažovat možnost konverze intrakavitární aplikace na intraluminální. Nelze vyloučit indikaci dalších aditivních výkonů, minimálně intervenčních (CT navigované drenáže kolekcí apod.), případně chirurgických (založení tracheostomie, jejunostomie, ošetření ranných či dutinových komplikací ve smyslu empyému či nitrobřišních kolekcí). Výslednou reziduální píštěl lze řešit klipy. Terapii lze zpravidla ukončit při rozměru leaku 1x2 cm, pochopitelně při dosažení vitální granulující tkáně. Doporučené jsou endoskopické kontroly do dohojení v intervalech 1−2 týdnů.
Použití EVAC je v publikovaných studiích spojeno s úspěšností 90 % při délce trvání léčby průměrně 17 dní (11−36) a intervalech výměn 3−5 dnů a délce sledování 235 dnů (106−383) [11]. K selhání EVAC tedy dochází v méně než 10 % případů, letalita dosahuje v souborech bez selekce anastomotického leaku a perforací 0−6 % s příčinou zejména v komplikacích přidružených onemocnění. Z úmrtí spojených s EVAC bylo příčinou krvácení z aortoezofageální píštěle či komunikace s jinou velkou mediastinální cévou, dosud sledované u 3 pacientů [12]. Z tohoto důvodu je doporučováno po prvním zavedení EVAC provést CT hrudníku a zhodnotit vztah leaku k magistrálním cévám. EVAC lze kombinovat s chirurgickou terapií, zejména u pozdě diagnostikovaných nebo rozsahem velkých defektů, a i v této situaci lze u většiny nemocných dosáhnout zachování kontinuity jícnu a konduitu.
Čtyři studie porovnávají EVAC se zavedením stentu. Sledovaná letalita byla v případě chirurgické léčby 50 %, při použití stentu 17 % a při použití EVAC 12 % [13]. Úspěšnost použití je udávána v 84,4−100 % u EVAC a 54−63,6 % u stentů, se srovnatelnou mortalitou a vyšší incidencí striktur ve skupině stentů [14,15].
Výskyt pozdních komplikací je nízký, stenózy jsou sledovány pouze v 7,7 % [12]. Nevýhodami postupu jsou nutnost opakovaných výměn v intervalech 3–5 dnů a opakované analgosedace či anestezie. Pro terapii akutních dehiscencí anastomózy bez nekrózy konduitu tedy můžeme uvažovat o EVAC jako potenciální metodě první volby.
Závěr
Vývoj terapie komplikací nitrohrudních anastomóz po ezofagektomii směřuje k redukci invazivity a větší implementaci endoskopických metod, které nabízejí řešení i u rozsáhlých defektů. Použití endoskopické vakuové terapie je, přes své nedostatky spojené s nutností opakované aplikace, bezpečnou a vysoce účinnou alternativou, jejíž další využití, indikace a poměr k dalším léčebným možnostem (chirurgická léčba, zavedení stentu, endoskopické klipování, radiologicky navigovaná drenáž) jsou dále ověřovány.
Seznam zkratek
CBDCA – karboplatina
C-PAP – continuous positive airway pressure – kontinuální pozitivní přetlaková ventilace
CRP − C-reaktivní protein
CT − počítačová tomografie
EGFR – epidermal growth factor receptor – receptory pro epidermální růstový faktor
ESBL – extended-spectrum beta-lactamase – beta laktamáza s rozšířeným spektrem
EVAC − endoskopická vakuová terapie, endoscopic vacuum assisted closure
CHOPN − chronická obstrukční plicní nemoc
OTSC – Over-the-scope clip, Ovesco klip
PET/CT – pozitronová emisní tomografie/počítačová tomografie
RTG − rentgen
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Stašek
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: martin.stasek@email.cz
Sources
1. Dent B, Griffin SM, Jones R, et al. Management and outcomes of anastomotic leaks after oesophagectomy. Br J Surg 2016;103 : 1033−8.
2. Rizk NP, Bach PB, Schrag D, et al. The impact of complications on outcomes after resection for esophageal cancer and gastroeseophageal junction carcinoma. J Am Coll Surg 2004;198 : 42–50.
3. Schuchert MJ, Abbas G, Nason KS, et al. Impact of anastomotic leak on outcomes after transhiatal esophagectomy. Surgery 2010;148 : 831−8; discussion 838−40.
4. Nederlof N, de Jonge J, de Vringer T, et al. Does routine endoscopy or contrast swallow study after esophagectomy and gastric tube reconstruction change patient management? J Gastrointest Surg 2017;21 : 251−8.
5. Crestanello JA, Deschamps C, Cassivi SD, et al. Selective management of intrathoracic anastomotic leak after esophagectomy. J Thorac Cardiovasc Surg 2005;129 : 254−60.
6. Tuebergen D, Rijcken E, Mennigen R, et al. Treatment of thoracic esophageal anastomotic leaks and esophageal perforations with endoluminal stents: efficacy and current limitations. J Gastrointest Surg 2008;12 : 1168–76.
7. van Boeckel PG, Sijbring A, Vleggaar FP, et al. Systematic review: temporary stent placement for benign rupture or anastomotic leak of the oesophagus. Aliment Pharmacol Ther 2011;33 : 1292–1301.
8. Haito-Chavez Y, Law JK, Kratt T, et al. International multicenter experience with an over-the-scope clipping device for endoscopic management of GI defects (with video). Gastrointest Endosc 2014;80 : 610−22.
9. Mennigen R, Senninger N, Laukoetter MG. Novel treatment options for perforations of the upper gastrointestinal tract: Endoscopic vacuum therapy and over-the scope clips. World J Gastroenterol 2014;20 : 7767−76.
10. Wedemeyer J, Schneider A, Manns MP, et al. Endoscopic vacuum-assisted closure of upper intestinal anastomotic leaks. Gastrointest Endosc 2008;67 : 708–11.
11. Kuehn F, Loske G, Schiffmann L, et al. Endoscopic vacuum therapy for various defects of the upper gastrointestinal tract. Surg Endosc 2017;31 : 3449–58.
12. Laukoetter MG, Mennigen R, Neumann PA, et al. Successful closure of defects in the upper gastrointestinal tract by endoscopic vacuum therapy (EVT): a prospective cohort study. Surg Endosc 2017;31 : 2687−96.
13. Schniewind B, Schafmayer C, Voehrs G, et al. Endoscopic endoluminal vacuum therapy is superior to other regimens in managing anastomotic leakage after esophagectomy: a comparative retrospective study. Surg Endosc 2013;27 : 3883–90.
14. Brangewitz M, Voigtländer T, Helfritz FA, et al. Endoscopic closure of esophageal intrathoracic leaks: stent versus endoscopic vacuum-assisted closure, a retrospective analysis. Endoscopy 2013;45 : 433–8.
15. Mennigen R, Harting C, Lindner K, et al. Comparison of endoscopic vacuum therapy versus stent for anastomotic leak after esophagectomy. J Gastrointest Surg 2015;19 : 1229–35.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2018 Issue 7-
All articles in this issue
- Využití retrosternálně uloženého kolon v náhradě jícnu
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Úspěšná terapie leaku 3. stupně po ezofagektomii s hrudní anastomózou s použitím endoskopické vakuové terapie – kazuistika
- Výsledky minimálně invazivní ezofagektomie pro karcinom jícnu provedené po ischemickém conditioningu žaludku
- Hybridní torakoskopická resekce jícnu pro karcinom – retrospektivní analýza a srovnání s transhiatální ezofagektomií
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Využití retrosternálně uloženého kolon v náhradě jícnu
- Profylaktická ligace ductus thoracicus v prevenci chylothoraxu po resekci jícnu
- Karcinom jícnu – výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc
- Stav chirurgické léčby karcinomu žaludku a gastroezofageální junkce v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

