-
Medical journals
- Career
Diagnostika časného karcinomu pankreatu a prekurzorových lézí
Authors: M. Hrůzová 1; B. Bunganič 1; J. Csomor 1; M. Zavoral 1; F. Bělina 2; L. Habartová 3; V. Setnička 3
Authors‘ workplace: Interní klinika 1. LF Univerzity Karlovy a Ústřední vojenská nemocnice Praha přednosta: prof. MUDr. M. Zavoral, PhD. 1; Chirurgická klinika 2. LF Univerzity Karlovy a Ústřední vojenská nemocnice Praha přednosta: prof. MUDr. M. Ryska, CSc. 2; Ústav analytické chemie, Vysoká škola chemicko-technologická v Praze vedoucí pracoviště: prof. RNDr. Š. Urban, CSc. 3
Published in: Rozhl. Chir., 2017, roč. 96, č. 9, s. 369-374.
Category: Review
Overview
Karcinom pankreatu je malignom se značně nepříznivou prognózou; 5leté přežití nepřesahuje 6 %. Jedinou šancí pacientů na delší přežívání je časná diagnóza ve stadiu onemocnění, kdy je možné provést kurabilní resekční výkon. Časná diagnóza karcinomu pankreatu se přes moderní diagnostické metody příliš nedaří. Navíc i v případě časné detekce je dlouhodobé přežívání pacientů stále neuspokojivé. Přitom již na počátku onkogeneze dochází na úrovni biomolekul ke změnám, které mohou být za využití speciálních metod detekovatelné. Tyto metody mají potenciál detekovat dostatečně specifický biomarker časného karcinomu pankreatu. Na Interní klinice 1. LF UK a ÚVN – Vojenské fakultní nemocnice Univerzity Karlovy v Praze ve spolupráci s Ústavem analytické chemie Vysoké školy chemicko-technologické v Praze byla provedena pilotní studie s využitím metod molekulové spektroskopie. Spektroskopicky byla porovnávána plazma pacientů s karcinomem pankreatu a plazma zdravých kontrol. Molekulová spektroskopie ukázala signifikantní rozdíly mezi oběma skupinami, což je ilustrováno v popise výsledků studie. Tato metoda může být tedy vhodným nástrojem umožňujícím objev specifického biomarkeru časného karcinomu pankreatu. Získané výsledky vedou k zamyšlení nad praktickým přínosem všech potenciálních biomarkerů. Může nastat situace, kdy daný biomarker bude u pacienta pozitivní, ale na dosud dostupných zobrazovacích metodách nebude přítomen žádný přesvědčivý morfologický korelát. S tím je spojená i otázka, zda lze jen na základě pozitivity tohoto biomarkeru indikovat resekční výkon a eventuálně, jaký zvolit typ výkonu.
Klíčová slova:
karcinom pankreatu – časná detekce – spektroskopie – pankreatektomieÚvod
Prognóza pacientů s karcinomem pankreatu (KP) je ve velké většině případů infaustní. Diagnostikována jsou především stadia II, III a IV a radikální chirurgické odstranění nádoru je možné pouze u 15–20 % případů [1]. Radikální resekce je nadále jedinou možností, jak zvýšit naději na přežití, a význam nabývá zejména u časného KP. Jak se však ukazuje, přes poznání časných symptomů a rozvoje zobrazovacích metod je detekce časného karcinomu obtížná a je spíše věcí náhody. Ani pacienti s malým tumorem o velikosti 1–2 cm nedosahují přes radikální resekční výkon významného přežití [1]. Důvodem je brzké metastazování, kdy i takto malé tumory mají v době diagnózy 80% pravděpodobnost generalizace [2]. Intenzivně jsou proto hledány nové biomarkery, které by umožnily diagnostikovat onemocnění ještě dříve, a to ve stadiu lokalizovaného neinvazivního karcinomu – „carcinoma in situ“. Další možnost, jak pozitivně ovlivnit prognózu, je identifikovat prekurzory karcinomu pankreatu. Mezi ně patří pankreatická intraepiteliální neoplazie (PanIN-3 léze) a intraduktální papilární mucinózní neoplazie (IPMN) s dysplazií vysokého stupně.
Průběh onkogeneze
Onkogeneze u KP probíhá postupnou transformací výchozí buňky. Jedná se o letitý proces, kdy přes prekurzorovou lézi vzniká postupně léze invazivní [3]. Vzniká tak dostatečně dlouhé diagnostické okno pro zachycení prekurzorových lézí.
Prvotní změny se odehrávají na molekulární a posléze na buněčné úrovni. Během onkogeneze se v klíčových molekulách, jakými jsou například proteiny v krevní plazmě, mění relativní zastoupení jednotlivých typů sekundárních struktur (α-helix, β-skládaný list, neuspořádané segmenty) [4,5]. Se změnou struktury a konformace molekul dochází například ke změnám torzních úhlů peptidové vazby, což se projevuje rozdíly v rotačních a vibračních stavech sledovaných molekul. Tyto změny lze zaznamenat metodami molekulové spektroskopie, především Ramanovou a infračervenou (IČ) spektroskopií, stejně tak jako pokročilejšími chiroptickými technikami, a to elektronovým cirkulárním dichroismem (ECD) a Ramanovou optickou aktivitou (ROA). Výhodou těchto metod je možnost vyšetřit plazmu jako celek a následným porovnáním spektrální odpovědi zdravých jedinců a pacientů s karcinomem pankreatu určit klíčové typy molekul, kterých se tyto konformační změny týkají. Kombinací výše uvedených spektroskopických metod a jejich využitím při porovnání plazmy zdravých jedinců a pacientů s karcinomem pankreatu lze odhalit potenciální biomolekuly klíčové v kancerogenezi a v kombinaci s metabolomickou analýzou je i přesně definovat.
Metody vibrační a chiroptické spektroskopie – princip
Obecnou podstatou spektroskopických metod je interakce elektromagnetického záření a studované látky s cílem využít pozorovaných jevů (absorpce, emise, rozptyl) za účelem její identifikace, studia její struktury a konformace nebo stanovení její koncentrace [6,7].
Podle použitého typu interagujícího záření jsou spektroskopické metody klasifikovány na metody pracující s nepolarizovaným či polarizovaným zářením. Z nepolarizovaných metod se jedná například o Ramanovu a infračervenou spektroskopii. Obě tyto metody umožňují sledovat strukturu a konformaci molekul prostřednictvím specifických funkčních skupin. Naproti tomu ECD a ROA, jakožto polarizované techniky, využívají kruhově polarizovaného záření a umožňují sledovat projevy optické aktivity chirálních molekul. Zatímco ECD umožňuje studium konformace chirálních molekul prostřednictvím projevu chromoforů, ROA se zaměřuje na konkrétní vazby jednotlivých funkčních skupin a strukturní detaily [8].
Pilotní studie – molekulárně spektroskopická analýza krevní plazmy
Kombinace výše uvedených metod byla použita v pilotní studii, kdy byla provedena spektroskopická analýza plazmy pacientů s karcinomem pankreatu a zdravých kontrolních jedinců. Bylo porovnáváno 10 pacientů s KP a 23 zdravých kontrol [9]. Po statistickém zpracování získaných spektrálních dat metodou lineární diskriminační analýzy a následné křížové validaci vytvořeného klasifikačního modelu bylo prokázáno, že s vysokou specificitou i senzitivitou se významně liší spektrální odezva pro krevní plazmu kontrolní skupiny a pacientů s karcinomem pankreatu (Graf 1, Tab. 1) [9].
Graph 1. Grafické znázornění výsledku lineární diskriminační analýzy pro kombinaci chiroptických metod (ECD, ROA) a konvenční Ramanovy spektroskopie v analýze krevní plazmy pacientů s karcinomem pankreatu (KP) a kontrolních jedinců; převzato z [9] Graph 1: Graphical representation of the results of linear discriminant analysis for the combination of chiroptical methods (ECD, ROA) and conventional Raman spectroscopy in the analysis of blood plasma of patients with pancreatic cancer (PC) and of the control group; adapted from [9] ![Grafické znázornění výsledku lineární diskriminační analýzy pro kombinaci chiroptických metod (ECD, ROA) a konvenční Ramanovy spektroskopie v analýze krevní plazmy pacientů s karcinomem pankreatu (KP) a kontrolních jedinců; převzato z [9]
Graph 1: Graphical representation of the results of linear discriminant analysis for the combination of chiroptical methods (ECD, ROA) and conventional Raman spectroscopy in the analysis of blood plasma of patients with pancreatic cancer (PC) and of the control group; adapted from [9]](https://pl-master.mdcdn.cz/media/image/15511bbab05b75345d6fcd3f12a9f2d6.jpg?version=1537792568)
Table 1. Konfuzní matice výsledků křížové validace matematického modelu pro diskriminaci vzorků krevní plazmy pacientů s karcinomem pankreatu a kontrolních jedinců; převzato z [9] Tab. 1: Confusion matrix of cross-validation results of the mathematical model for the discrimination of blood plasma samples from patients and from the control group; adapted from [9] ![Konfuzní matice výsledků křížové validace matematického modelu pro diskriminaci vzorků krevní plazmy pacientů s karcinomem pankreatu a kontrolních jedinců; převzato z [9]
Tab. 1: Confusion matrix of cross-validation results of the mathematical model for the discrimination of blood plasma samples from patients and from the control group; adapted from [9]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cd59ee0b3830cc052f68aa6b9e637f43.png)
Molekulová spektroskopie – závěry pilotní studie
Pilotní studie prokázala, že využitím kombinace výše uvedených spektroskopických metod pro analýzu krevní plazmy lze rozlišit pacienty s karcinomem pankreatu od kontrolní skupiny s vysokou senzitivitou i specificitou. Šlo o pacienty s diagnózou pozdního KP verifikovanou cytologicky/histologicky pomocí endoskopické ultrasonografie s odběrem aspirační biopsie tenkou jehlou (EUS s FNA) a nález byl také zobrazen počítačovou tomografií (CT).
Pokud má být na výsledky spektrální analýzy krevní plazmy pohlíženo jako na možný biomarker časného karcinomu pankreatu, je zapotřebí prokázat stejnou specificitu i senzitivitu i u časného invazivního KP a premaligních lézí, tedy především intraduktální papilární mucinózní neoplazie (IPMN) a pankreatické intraepiteliální neoplazie (PanIN). Tyto premaligní léze jsou asymptomatické a konvenčními zobrazovacími metodami nerozeznatelné, proto jsou předmětem výzkumu nové metody, jak tyto léze diagnostikovat.
Další biomarkery časného karcinomu pankreatu
Jak bylo zdůrazněno, prekurzorové léze karcinomu pankreatu jsou zcela bezpříznakové, a proto jsou v klinické praxi diagnostikované spíše náhodně. Tyto léze jsou blíže zkoumány na transgenních krysích modelech, u kterých je metodou genové manipulace vyvolána mutace H - nebo K-genu (Hras250 nebo Kras327). Mutace vede k rozvoji duktálního adenokarcinomu pankreatu, který je histopatologicky velmi podobný karcinomu pankreatu u lidí. Modely tak mohou být používány k ověření možnosti detekce biomarkerů časného KP [10]. Už v roce 2009 byly u transgenních krys s pouze malou mikroskopickou lézí duktálního adenokarcinomu prokázány signifikantně zvýšené hodnoty erc/mesothelinu, a to ještě před rozvojem makroskopické léze [11]. Vývoj transgenního modelu rozpoutal rozsáhlý výzkum v této oblasti a postupně jsou objevovány další potenciálně klíčové biomarkery [12,13].
Vytvořené modely také prokázaly, že se na molekulární úrovni neliší pouze zdravé subjekty a premaligní léze. Odlišnosti lze pozorovat i mezi vlastní prekurzorovou lézí a invazivním karcinomem [14]. Tkáň pankreatu krys s duktálním karcinomem i s PanIN lézemi byla analyzována pomocí 1H nukleární magnetické rezonance (NMR). Spektroskopická odezva tkáně modelů s PanIN a modelů s KP se významně lišila. Tyto změny odpovídaly například methioninu, který byl zvýšen u PanIN, ale snížen u KP [14].
Tyto studie byly provedeny na předem definovaných a geneticky mutovaných laboratorních modelech, což umožnilo jasné odlišení jednotlivých skupin a jejich vzájemné porovnání.
Význam zobrazovacích metod v diagnostice časného karcinomu pankreatu
Zobrazovací metody a přesvědčivá dokumentace nádoru jsou jedním z hlavních kritérií ovlivňujících indikaci resekčního výkonu v rámci multioborového indikačního semináře. Diagnostika časného karcinomu znamená detekci nádorů o velikosti 1–2 cm, bez cévní invaze, kdy je šance na 5leté přežití oproti pozdějším stadiím KP mnohem vyšší [15].
Ideálním diagnostickým cílem je karcinom „in situ“, neinvazivní stadium KP. Je menší než 0,5 cm a na zobrazovacích metodách jej lze diagnostikovat pouze nepřímo na základě sekundárních změn na vývodech – dilatace či nerovného průběhu pankreatického vývodu, fokálních změn parenchymu apod. [16]. V situaci, kdy existuje klinické či laboratorní podezření na KP, ale CT nezachytí nádorovou masu, je EUS vyšetření nadmíru přínosné [17]. EUS superiorita byla opakovaně prokázána; ve vybraných metaanalýzách dosahovala senzitivita 94–99 % oproti CT, kdy senzitivita byla 84–89 % [18].
Studie [19–23] provedené na skupinách rizikových pacientů, kteří byli pravidelně sledováni pomocí EUS a u kterých byla na základě EUS suspektního nálezu indikována pankreatektomie, jsou uvedeny v Tab. 2.
Table 2. Přehled výsledků prospektivních studií zaměřených na skríning KP pomocí EUS u nemocných s genetickými syndromy Tab. 2: Summary of outcomes of prospective studies focused on PC screening using EUS in patients with genetic syndromes 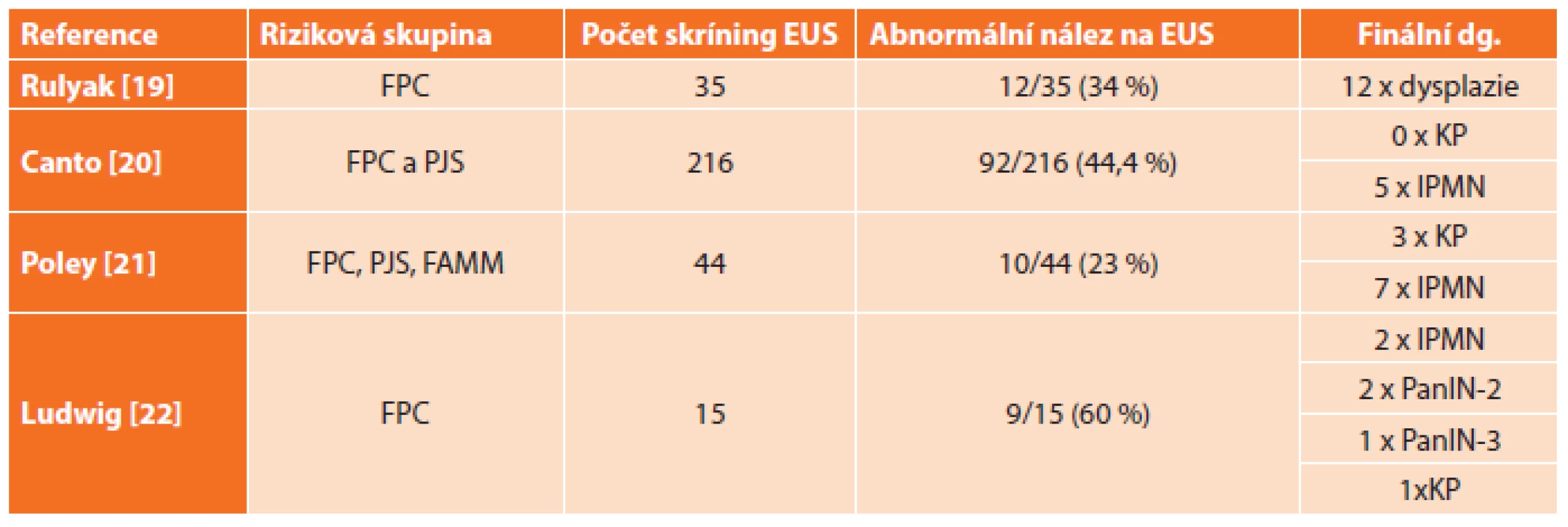
Vysvětlivky: FPC − familiární karcinom pankreatu, PJS − Peutz-Jeghers syndrom, FAMMM − familiární atypický mnohočetný kožní melanom Efektivní léčba časného karcinomu pankreatu – pankreatektomie podle EUS?
V případě rizikové skupiny pacientů s genetickou zátěží zahrnující pacienty s prvostupňovými příbuznými s familiárním výskytem karcinomu pankreatu a s dalšími nádorovými syndromy (Peutzův-Jeghersův syndrom, familiární adenomatózní polypóza, familiární atypický mnohočetný melanom, hereditární pankreatitida a další) lze citovat několik studií, ve kterých na základě abnormálního nálezu na EUS byla u pacientů provedena pankreatektomie [19–22]. U více než 50 % rizikových pacientů byl nakonec nález v resekátu benigní, jak ukazuje Tab. 2.
Efektivní léčba karcinomu pankreatu – resekce pankreatu podle rizikového faktoru?
Co se týče sporadického karcinomu pankreatu, příkladem efektivity diagnostiky karcinomu pankreatu u rizikové skupiny může být Onomichi projekt [23] založený na spolupráci mezi japonskými praktickými lékaři a specialisty. Praktičtí lékaři v tomto projektu odesílali ke specializovanému vyšetření průběžně v letech 2007–2013 pacienty, které označili za rizikové. Jednalo se o pacienty s recentně diagnostikovaným diabetem mellitem spojeným s úbytkem hmotnosti či s dyspepsií, pacienty s atakou akutní pankreatitidy nejasné etiologie, pacienty se zvýšenou hodnotou amyláz či CA19-9 a pacienty s nejasným či náhodným nálezem na zobrazovacích metodách. Celkově bylo na základě některého z těchto rizikových faktorů specialistou vyšetřeno 4969 pacientů. Z nich 4157 poté podstoupilo CT, 2303 MR a 1692 EUS. Ve výsledku z celkového počtu vyšetřených pacientů byl KP diagnostikován u 338 lidí. Ze všech KP bylo 13 ve stadiu carcinoma in situ a 26 ve stadiu Ia nebo Ib.
Efektivní léčba karcinomu pankreatu – preventivní/profylaktická resekce pankreatu?
Příkladem čistě profylaktické pankreatektomie je kazuistika dvou sourozenců, bratra a sestry trpících kongenitální jaterní fibrózou se silně pozitivní rodinnou onkologickou anamnézou [24]. Ti, přestože CT neukázalo žádné ložisko na pankreatu, pouze dilataci choledochu při základní chorobě, podstoupili z vlastní vůle pankreatektomii – sestra duodenopankreatektomii ve 48 letech, bratr v 50 letech totální pankreatektomii. U obou resekátů nebyl nalezen karcinom, nicméně byly zachyceny četné multifokální léze PanIN-2.
Komplikace resekce pankreatu
Pankreatektomie je výkon technicky náročný s určitou perioperační mortalitou a morbiditou, která se liší nejen podle typu výkonu a indikace operace, ale také dle zkušeností pracoviště. Bezprostřední hospitalizační mortalita u pacientů operovaných pro maligní tumor se u parciálních pankreatických resekcí na specializovaných pracovištích pohybuje mezi 2–4 % [25,26]. Vyšší, přibližně dvojnásobná mortalita je udávaná u pacientů, kteří postoupili totální pankreatektomii [25]. Soubor Hartwiga a spoluautorů uvádí 7,8% mortalitu [27], Johnston a kolektiv v populační studii National Cancer Database udávají 9,3% mortalitu do 30. pooperačního dne [28]. Na druhé straně je totální pankreatektomie indikována pouze u 10–12 % resekcí pro maligní onemocnění pankreatu [29].
Celkové procento pooperačních komplikací se v literatuře udává v rozmezí 28–40 % [30] nebo 32−54 % [27], přičemž chirurgické komplikace jsou řešeny u 25−37 % a interní u 15−37 % operovaných [25, 27].
Nejčastější orgánovou komplikací, která se u pacientů vyskytuje, a to ve 12 %, je respirační selhání [30]. Z lokálních komplikací je to především pankreatická píštěl, jejíž incidence se udává 10–30 % a je vyšší u multiviscerálních resekcí [31]. Naopak po totální pankreatektomii riziko pankreatické píštěle nehrozí [25]. U totální pankreatektomie i pankreatoduodenektomie jsou dalšími možnými komplikacemi prodloužená doba vyprazdňování žaludku (téměř 20 % pacientů), nitrobřišní a rané infekce u 18 % a pooperační krvácení u 7 % nemocných [25].
Metabolické komplikace resekce, zejména hyperglykemie a rozvoj diabetes mellitus, nepatří k bezprostředním komplikacím operačního výkonu, nicméně mají značný vliv na pooperační kvalitu života pacientů. Asi u 60 % nemocných je porucha glukózové tolerance jedním z příznaků rozvoje karcinomu pankreatu a zhruba ve 20 % případů po resekčním výkonu vznikne diabetes. U totální pankreatektomie je diabetes přirozeným následkem operačního řešení a je nutno pooperační péči koordinovat i s diabetologem [25].
Kvalita života pacientů ověřovaná dotazníky se po totální pankreatektomii v porovnání s parciálním resekčním výkonem neliší [32]. Nestabilní hladiny glykemie s nutností případné hospitalizace, snížená hodnota albuminu a významný váhový úbytek v souvislosti s operací i se základním onemocněním jsou nejčastějšími faktory poklesu kvality života [33].
Příslibem do budoucnosti se zdá být méně invazivní laparoskopická technika (duodenopankreatektomie nebo distální pankreatektomie), která dle dosavadních výsledků může zkrátit dobu hospitalizace, urychlit obnovu pasáže i celkovou rekonvalescenci a má sníženou incidenci krvácivých komplikací [34]. Pouze riziko pankreatické píštěle není při laparoskopickém přístupu nižší než při otevřené operaci [35].
Diskuze
V uvedené pilotní studii [9] byly spektroskopické odpovědi plazmy pacientů jasně odlišné od odpovědí zdravé kontrolní skupiny. Dalším navazujícím rozborem, a zejména metabolomickou analýzou, by tak v budoucnu mohlo být možné identifikovat klíčové molekuly, ve kterých byly obě skupiny diferentní. Díky tomu se zde naskýtá možnost přesně definovat tyto molekuly jako biomarkery specifické pro KP.
Jak už bylo zmíněno, ve studii se jednalo o pacienty s pokročilým KP. Je tak otázkou, zda by stejně výrazné spektroskopické rozdíly vykazovala i plazma pacientů s časnými stadii KP. Pouze výzkum u této skupiny pacientů, ať už spektroskopickými či jinými metodami, může vést k detekci specifického biomarkeru časného KP. To v praxi bude velmi těžké, neboť diagnostika těchto lézí je spíše náhodná, a proto i počet těchto pacientů je velmi malý.
Se stejným problémem se jistě budou potýkat i jakékoliv jiné další studie zaměřené na tuto problematiku. Jak ve sdělení uvádíme, jistě velký krok kupředu znamenal vývoj transgenních krysích modelů časného KP. Není ale ani zdaleka jisté, zda zjištěné závěry mohou být platné i u jiných živočišných druhů, tzn. u lidí.
Určitým východiskem, jak definovat časný biomarker KP, může být zaměření výzkumu na rizikové skupiny KP. V případě metod molekulové spektroskopie je zátěž pro zkoumanou skupinu minimální, jedná se pouze o běžný odběr krve. Problémem zůstává identifikace rizikové skupiny. V případě familiárního KP situaci v našich podmínkách ztěžuje absence českého registru pacientů s rodinným výskytem KP. Sporadický KP je v otázce definice rizikové skupiny ještě komplikovanější. Časné symptomy jsou obskurní a i v případě výskytu známé varovné kombinace nově diagnostikovaného diabetu nebo jeho dekompenzace, váhového úbytku a dyspepsií stále vázne včasné odesílání těchto pacientů lékaři primární péče do specializovaných center.Nicméně i v případě dobré spolupráce mezi praktickými lékaři a specialisty při zaměření se na přítomnost rizikových faktorů nejsou výtěžnost a záchyt časného KP vysoké. V uvedeném Onomichi projektu [23] byl KP diagnostikován u 338 z celkového počtu 4696 pacientů odeslaných do specializovaného centra, tzn. u 6,80 % vyšetřených jedinců. Časný KP byl zjištěn u 39 pacientů. Z celkového počtu odeslaných se jednalo o 0,78 % pacientů. Je zřejmé, že rozpoznávání rizikových symptomů má svůj význam, v detekci časného KP však nestačí.
Co se týče pankreatektomie, není sporu, že jde o výkon náročný, zatížený rizikem komplikací lišících se podle typu výkonu. V případě kurativy resekabilních nádorů je to však jediné nejúčinnější řešení, které lze pacientům v současnosti nabídnout, a benefit tak převažuje nad riziky. Pokud by však žádnými zobrazovacími metodami nebyl prokázán přesvědčivý morfologický nález, přesvědčivý benefit je sporný, nicméně rizika zůstávají.
Smysluplným cílem efektivní diagnostiky je pouze časný invazivní karcinom či resekabilní nádor, IPMN s dysplazií vysokého stupně a PanIN-3 léze. Význam ostatních lézí je nejasný, neboť léze PanIN-1 a PanIN-2 jsou přítomny i u zdravých jedinců a pacientů s chronickou pankreatitidou. V tomto případě podstoupená pankreatektomie pacienta zatěžuje riziky z komplikací výkonu, zatímco přínos je nevýznamný.
Závěr
Pouze časná diagnostika KP ve stadiu 0, Ia a Ib následovaná radikální resekcí je jedinou možností, jak zlepšit celkové přežití a pozitivně ovlivnit prognózu nemocných. Současné diagnostické možnosti jsou nedostačující, pacienti jsou v době diagnózy při manifestaci symptomů již z větší části v pokročilejším stadiu onemocnění, což znemožňuje radikální výkon. Doposud rovněž v klinické praxi neexistuje žádný biomarker časného KP, který by byl dostupný, specifický a použitelný jako screeningové vyšetření.
Nadále lze očekávat rychlý vývoj a pokrok na poli detekce biomarkeru časného KP. Molekulová spektroskopie je v tomto ohledu potenciálně slibnou metodou. Její účinnost je nutné ověřit v dalších klinických studiích zahrnujících také pacienty s méně pokročilými stadii KP.
Pokud má být jakýkoliv potenciální biomarker použitelný v praxi, bude zapotřebí jej kombinovat s dostupnými nástroji, tzn. se zobrazovacími metodami a se znalostmi rizikových faktorů KP.
Zásadním úkolem lékařů tak stále zůstává vyhledávání rizikových skupin pacientů, u kterých pravidelné vyšetření pankreatu může odhalit časnou nádorovou lézi.
Vývoj nových, přesnějších a specifických biochemických metod v kombinaci s časnou indikací zobrazovacích metod a s rozvojem méně invazivních operačních technik zůstane tak i nadále výzvou ve zlepšení péče o pacienty s nádory pankreatu.
Seznam zkratek
KP – karcinom pankreatu
PanIN – pankreatická intraepiteliální neoplazie
IPMN – intraduktální papilární mucinózní neoplazie
IČ – infračervená
ECD – elektronový cirkulární dichroismus, electroniccicular dichroism
ROA – Ramanova optická aktivita, Raman optical activity
EUS – endoskopická ultrasonografie
FNA – fine needle aspiration, tenkojehlová aspirace
CT – computed tomography, počítačová tomografie
NMR – nukleární magnetická rezonance
FPC – familiární karcinom pankreatu, familial pancreatic carcinoma
PJS – Peutz-Jeghers syndrom
FAMMM – familiární atypický mnohočetný kožní melanom, familial atypical multiple mole melanoma syndrome
Práce byla podpořena grantem AZV, reg. č. 16-31028A a grantem Ministerstva obrany MO1012. Studie byla také podpořena účelovou podporou na specifický vysokoškolský výzkum MŠMT, č. 20-SVV/2017, Operačním programem Praha – Konkurenceschopnost, č. CZ.2.16/3.1.00/21537 a /24503, a Národním programem udržitelnosti, č. LO1601 – 43760/2015.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Bohuš Bunganič
Interní klinika 1. LF Univerzity Karlovy a ÚVN
U Vojenské nemocnice 1200
162 00 Praha 6
e-mail: bohus.bunganic@uvn.cz
Sources
1. Trends in SEER incidence and U.S. mortality using the Joinpoint Regression Program, 1975–2011 with up to five Joinpoints, 1992–2011 with up to three Joinpoints, both sexes by race/ethnicity [online]. Available from https://seer.cancer.gov/archive/csr/1975_2011/results_merged/sect_22_pancreas.pdf.
2. Haeno H, Gonen M, Davis MB, et al. Computational modeling of pancreatic cancer reveals kinetics of metastasis suggesting optimum treatment strategies. Cell 2012;148 : 362–75.
3. Yachida S, Jones S, Bozic I, et al. Distant metastasis ocurs late during the genetic evolution of pancreatic cancer. Nature 2010;467 : 1114–7.
4. Tatarkovič M, Miškovicová M, Šťovíčková L, et al. The potential of chiroptical and vibrational spectroscopy of blood plasma for the discrimination between colon cancer patients and the control group. Analyst 2015;140 : 2287–93.
5. Šťovíčková L, Tatarkoviš M, Logerová H, et al. Identification of spectral biomarkers for type 1 diabetes mellitus using the combination of chiroptical and vibrational spectroscopy. Analyst 2015;140 : 2266–72.
6. Moravec Z, Košařová V. Molekulová spektroskopie [online] Available from http://www.sci.muni.cz/chemsekce/frvs2011/pdf/mol-spec.pdf.
7. Wagnière GH. On the interaction of light with molecules: Pathways to the theoretical interpretation of chiroptical phenomena. In: Berova N, Polavarapu PL, Nakanishi K, at al. Comprehensive chiroptical spectroscopy. New Jersey, USA, Hoboken 2012 : 3–35.
8. Tatarkovič M, Synytsya A, Šťovíčková L, et al. The minimizing of fluorescence background in Raman optical activity and Raman spectra of human blood plasma. Anal Bioanal Chem 2015;407 : 1335–42.
9. Bunganič B, Šťovíčková L, Tatarkovič M, et al. Molekulárně spektroskopická analýza krevní plazmy – cesta k diagnostice karcinomu pankreatu? Gastroent Hepatol 2015;69 : 518–24.
10. Fukamachi K, Tanaka H, Hagiwara Y, et al. An animal model of preclinical diagnosis of pancreatic ductal adenocarcinomas. Biochem Biophys Res Commun 2009;390 : 636–41.
11. Itzkowitz SH, Kim YS. New carbohydrate tumor markers. Gastroenterology 1986;90 : 491–4.
12. Shounak M, Suresh TCH, David AA. Molecular detection of pancreatic neoplasia: Current status and future promise. World J Gastroenterol 2015;21 : 11387–95.
13. Kaur S, Kumar S, Momi N, et al. Mucins in pancreatic cancer and its microenvironment. Nat Rev Gastroenterol Hepatol 2013;10 : 607–20.
14. Wen S, Li Z, Feng J, et al. Metabonomic changes from pancreatic intraepithelial neoplasia to pancreatic ductal adenocarcinoma in tissues from rats. Cancer Sci 2016;107 : 836–45.
15. Kenner BJ, Chari ST, Maitra A, et al. Early detection of pancreatic cancer − a defined future using lessons from other cancers: A white paper. Pancreas 2016;45 : 1073–9.
16. Brune K, Abe T, Canto M, et al. Multifocal neoplastic precursor lesions associated with lobular atrophy of the pancreas in patients having a strong family history of pancreatic cancer. Am J Surg Pathol 2006;30 : 1067–76.
17. Krishna SG, Rao BB, Ugbarugba E, et al. Diagnostic performance of endoscopic ultrasound for detection of pancreatic malignancy following an indeterminate multidetector CT scan: a systemic review and meta-analysis. Surg Endosc 2017; [Epub ahead of print].
18. Tamm EP, Loyer EM, Faria SC, et al. Retrospective analysis of dual-phase MDCT and follow-up EUS/EUS-FNA in the diagnosis of pancreatic cancer. Abdom Imaging 2007;32 : 660–7.
19. Rulyak SJ, Brentnall TA. Inherited pancreatic cancer: Surveillance and treatment strategies for affected families. Pancreatology 2001;1 : 447–85.
20. Canto MI, Hruban RH, Fishman EK, et al. American Cancer of the Pancreas Screening (CAPS) Consortium. Frequent detection of pancreatic lesions in asymptomatic high-risk individuals. Gastroenterology 2012;142 : 796–804.
21. Poley JW, Kluijt I, Gouma DJ, et al. The yield of first-time endoscopic ultrasonography in screening individuals at a high risk of developing pancreatic cancer. Am J Gastroenterol 2009;104 : 2175–81.
22. Ludwig E, Olson SH, Bayuga AS, et al. Feasibility and yield screening in relatives from familial pancreatic cancer families. Am J Gastroenterol 2011;106 : 946–54.
23. Hanada K, Okayaki A, Hirano N, et al. Diagnostic strategies for early pancreatic cancer. J Gastroenterol 2015;50 : 147–54.
24. Iskandar EM, Wayne GM, Steele GJ. Familial pancreatic cancer. The case for prophylactic pancreatectomy in lieu of serial screening and shared decision making. Case Rep Oncol Med 2014; Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4258333/.
25. Ryska M, Rudiš J. Totální pankreatektomie u maligního onemocnění slinivky břišní – od historie k dnešku. Rozhl Chir 2016; 95 : 345–9.
26. Almond M, Roberts KJ, Hodson J, et al. Changing indications for a total pancreatectomy: perspectives over a quarter of a century. HPB 2015;17 : 416−21.
27. Hartwig W, Gluth A, Hinz U, et al. Total pancreatectomy for primary pancreatic neoplasms. Ann Surg 2015;261 : 537−46.
28 Johnston WC, Hoen HM, Cassera MA, et al. Total pancreatectomy for pancreatic ductal adenocarcinoma: review of the National Cancer Data Base. HPB 2016;18 : 21−8.
29. Ryska M. Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu. Gastroent Hepatol 2016;70 : 408−12.
30. Murphy MM, Knaus WJ, NG SC, et al. Total pancreatectomy: a national study. HPB : The Official Journal of the International Hepato Pancreato Biliary Association 2009;11 : 476–82.
31. Čečka F, Jon B, Šubrt Z, et al. Pankreatická píštěl – Definice, rizikové faktory a možnosti léčby. Rozhl Chir 2013;92 : 77−84.
32. Watanabe Y, Ohtsuka T, Matsunage T, et al. Long-term outcomes after total pancreatectomy: special reference to survivors´ living conditions and quality of life. World J Surg 2015;39 : 1231−9.
33. Epelboym I, Winner M, DiNorcia J, et al. Quality of life in patients after total pancreatectomy is comparable with quality of life in patiens who undergo a partial pancreatic resection. JSR 2014;187 : 189−96.
34. Boggi U, Amorese G., Vistoli F, et al. Laparoscopic pancreaticoduodenectomy: A systematic literature review. Sugical Endoscopy 2015;29 : 9–23.
35. Čečka F, Ferko A, Jon B, et al. Laparoskopická resekce pankreatu v experimentu a klinické praxi. Rozhl Chir 2011;90 : 194−9.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 9-
All articles in this issue
- Současné využití a budoucnost kapslové kolonoskopie
- Diagnostika časného karcinomu pankreatu a prekurzorových lézí
-
Hamartomy dutiny břišní a retroperitonea
– souhrnné sdělení doplněné kazuistikou - Omentum majus a mliečne škvrny ako významná súčasť imunitného systému
- Pneumoperitoneum po kolonoskopii – „to cut or not to cut“
- Prudké krvácení při portální hypertenzi − endoskopické, chirurgické, nebo intervenční řešení?
- Kombinace endoskopické slizniční resekce a transmurální resekce v léčbě lokálních reziduálních neoplazií tračníku − popis dvou případů
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue-
Hamartomy dutiny břišní a retroperitonea
– souhrnné sdělení doplněné kazuistikou - Pneumoperitoneum po kolonoskopii – „to cut or not to cut“
- Současné využití a budoucnost kapslové kolonoskopie
- Diagnostika časného karcinomu pankreatu a prekurzorových lézí
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

