-
Medical journals
- Career
Současné možnosti ovlivnění infekce v místě operačního výkonu
Authors: F. Bělina
Authors‘ workplace: Chirurgická klinika 2. LF a ÚVN, Ústřední vojenská nemocnice, Praha přednosta: prof. MUDr. M. Ryska, CSc.
Published in: Rozhl. Chir., 2017, roč. 96, č. 5, s. 189-196.
Category: Review
Overview
Infekce související s operačním výkonem, označovaná termínem infekce v místě operačního výkonu (IMOV), je nejčastější nozokomiální infekcí (HAIs – Health-Care Associated Infections) na chirurgických pracovištích. Přestože ve většině případů jí lze účinně předcházet, je stále spojena s významnou morbiditou a mortalitou, prodlouženou či opakovanou hospitalizací a vysokými ekonomickými náklady na léčbu. Z těchto důvodů má pro prevenci IMOV zásadní význam dodržování postupů a doporučení, jejichž význam byl ověřen v četných studiích na podkladě evidence based medicine (EBM). Tyto postupy a klinická doporučení zasahují do všech etap perioperační péče a týkají se předoperační přípravy nemocného, průběhu výkonu a pooperační péče. Účinně snížit riziko pooperačních infekčních komplikací znamená zavést tyto ověřené principy a postupy do každodenní praxe a péče o každého chirurgického pacienta. Neoddělitelnou součástí těchto opatření jsou průběžná kontrola dodržování těchto postupů, edukace personálu, sledování incidence IMOV na pracovišti s pravidelným hodnocením a prezentací výsledků.
Klíčová slova:
infekce v místě operačního výkonu – incidence – rizikové faktory – prevence – doporučené postupyÚVOD
Infekce v souvislosti s chirurgickým výkonem, nověji označovaná termínem infekce v místě operačního výkonu (IMOV), patří dnes mezi nejčastější nozokomiální infekce (HAIs – Health-Care Associated Infections), která významným způsobem ovlivňuje morbiditu a mortalitu chirurgických nemocných. Většina IMOV nemusí vždy znamenat závažné ohrožení nemocného, nicméně více než třetina úmrtí u chirurgických nemocných je v současné době v přímé souvislosti s pooperační infekční komplikací. IMOV významným způsobem prodlužuje dobu hospitalizace, zvyšuje nároky na odbornou péči a náklady na léčbu. Zhoršuje celkovou kvalitu života chirurgických nemocných se všemi sociálními a ekonomickými aspekty. Uvedená práce si neklade za cíl v celé šíři obsáhnout problematiku pooperačních infekčních komplikací a jejich léčbu a rovněž blíže nezohledňuje specifickou problematiku jednotlivých chirurgických oborů a konkrétních rizikových skupin nemocných. Sdělení by mělo být stručným shrnutím současných poznatků o příčinách a rizikových faktorech, které se podílejí na vzniku IMOV s uvedením nejdůležitějších obecných opatření v perioperačním období, která riziko IMOV snižují.
Definice
Původní označení „ranná infekce“ pro pooperační chirurgickou komplikaci byla nahrazena termínem „infekce v místě operačního výkonu“ (IMOV). V zahraniční literatuře je označována termínem „ surgical site infection“ (SSI) [1]. IMOV je zpravidla nejčastěji definována jako infekce vznikající do 30 dnů v místě a v souvislosti s chirurgickým výkonem. Většina IMOV se klinicky manifestuje mezi 5. a 10. pooperačním dnem, není ale ojedinělé, že se některé IMOV mohou projevit později, mnohdy až po propuštění nemocného do ambulantní péče. Termín IMOV přesněji vyjadřuje charakter komplikace, která může zahrnovat širokou škálu komplikací od povrchní infekce kůže a podkoží až po závažnou, život ohrožující hlubokou infekci tělních dutin a orgánů, často spojenou s projevy sepse a multiorgánového selhání.
Patogeneze
Rozvoj infekce v místě operačního výkonu závisí na bakteriální kontaminaci v průběhu operace, množství a virulenci mikroorganismů a vlastní obranné imunitní reakci organismu. Ve většině případů jsou vyvolávající příčinou endogenní patogeny, které se do rány dostávají z kůže či z orgánů v průběhu operačního výkonu (nejčastěji z gastrointestinálního, urogenitálního nebo biliárního traktu).
Z patogenů jsou nejčastěji prokázány Staphylococcus aureus (30,4 %), koaguláza-negativní stafylokoky (11,7 %), Escherichia coli (9,4 %), Enterococcus faecalis (5,9 %), Pseudomonas aeruginosa (5,5 %) a Enterobacter (4,0 %). Související závažnou problematikou je narůstající antimikrobiální rezistence těchto patogenů [2]. Méně častým zdrojem IMOV je kontaminace exogenní infekcí v průběhu operace personálem, nástroji či při otevřeném poranění. Zcela vzácně může infekce vzniknout hematogenní cestou ze vzdáleného ložiska.
Incidence
V současné době je IMOV nejčastější nozokomiální infekcí u chirurgických nemocných a rovněž komplikací spojenou s největšími ekonomickými náklady na léčbu. Nicméně je uváděna poměrně značná variabilita incidence v závislosti na operačním oboru, charakteru výkonu (elektivním či akutním), regionu a typu pracoviště. Obecně je u chirurgických nemocných po nitrobřišním výkonu IMOV prokázána u 11,2 až 20 % nemocných s pravidelně nejvyšší kumulativní incidencí po výkonech v kolorektální oblasti [3−6]. Rovněž se udává, že více než 70 % úmrtí u chirurgických nemocných je v menší či větší míře v přímé souvislosti s pooperačními infekčními komplikacemi [7]. Je odhadováno, že až 60 % uváděných IMOV lze při dodržování doporučených postupů předejít [8–10].
Klasifikace
Podle závažnosti se IMOV dělí na 3 stupně: povrchní (postihující kůži a podkoží), hlubokou (zasahující fascii +/ - svalovou vrstvu) a orgánovou (postihující orgánovou dutinu a orgány). Schéma klasifikace IMOV je uvedeno na obrázku (Obr. 1). Superficiální infekce tvoří většinu IMOV (asi v 45 až 47 %), hluboká infekce v místě operační rány (23 až 35 %). Nejméně je zastoupena infekce orgánů a přilehlého tělního prostoru, která tvoří asi 18 až 30 % IMOV [11]. Jedná se o nejzávažnější typ pooperační infekce spojený s rozvojem septického stavu a v praxi nejčastěji způsobený insuficiencí anastomózy nebo sutury trávicí trubice [12].
Image 1. Schéma klasifikace IMOV [11] Fig. 1: Schema of classification SSI [11] ![Schéma klasifikace IMOV [11]
Fig. 1: Schema of classification SSI [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/2548f6976f813e587c93e99a23542185.jpg)
Rizikové faktory
U každého nemocného podstupujícího operační výkon jsou v menší či větší míře přítomny rizikové faktory, které se mohou podílet na rozvoji pooperační infekční komplikace. Riziko vzniku IMOV narůstá s počtem a závažností těchto faktorů či při jejich vzájemné kombinaci. Incidence infekce narůstá při výkonech se zvýšeným rizikem endogenní kontaminace (například při operaci v oblasti kolorektální, žlučových cest a urogenitální…) a exogenní kontaminace (například při dlouhotrvajících operacích či při ošetřování otevřených poranění…). Jedním z užívaných dělení operačních ran je podle závažnosti kontaminace na 4 stupně: rána čistá, čistá – kontaminovaná, kontaminovaná a špinavá. Toto dělení a charakteristika ran jsou uvedeny v tabulce (Tab. 1).
Table 1. Dělení a charakteristika operačních ran Tab. 1: Classification and characteristics of surgical wounds 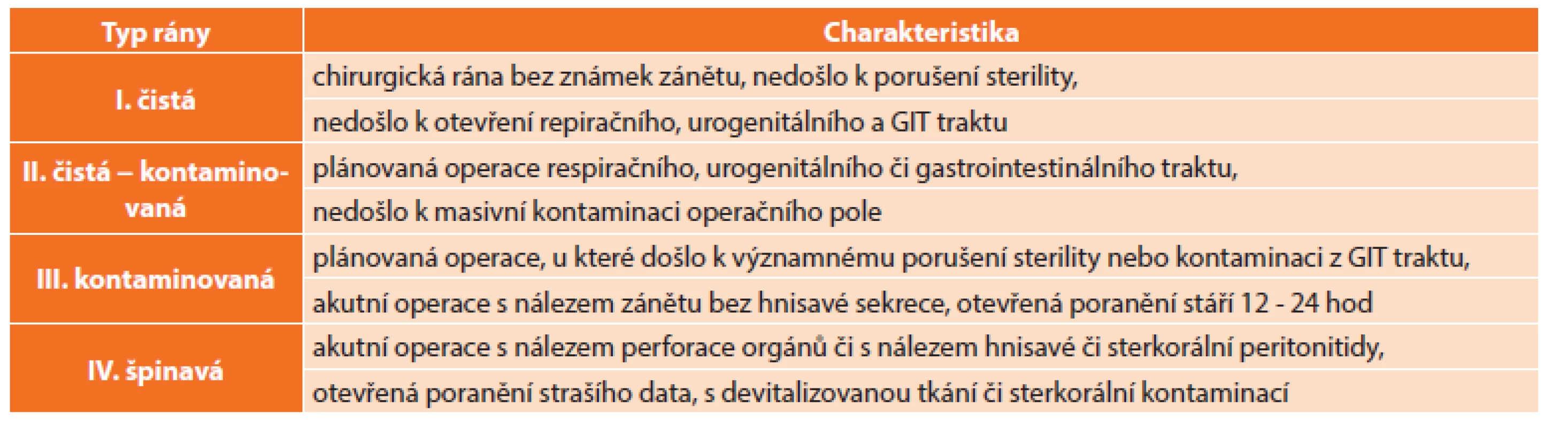
Riziko infekce rovněž narůstá u stavů, které přímo ovlivňují a oslabují celkovou či lokální imunitní obranou reakci organismu (věk, komorbidita nemocného, anemie, imunosupresivní léčba, malnutrice, přítomnost devitalizované tkáně, cizí těleso…). Pro přehlednost lze faktory zvyšující riziko IMOV rozdělit na: lokální (např. stupeň kontaminace operační rány, virulence a množství patogenu), faktory působící v perioperačním období (před operací, v průběhu operace či po operaci) a faktory ze strany nemocného. Přehled nejdůležitějších faktorů, které se mohou podílet na rozvoji IMOV, je uveden v Tab. 2.
Table 2. Faktory ovlivňující rozvoj IMOV Tab. 2: Risk factors for SSI 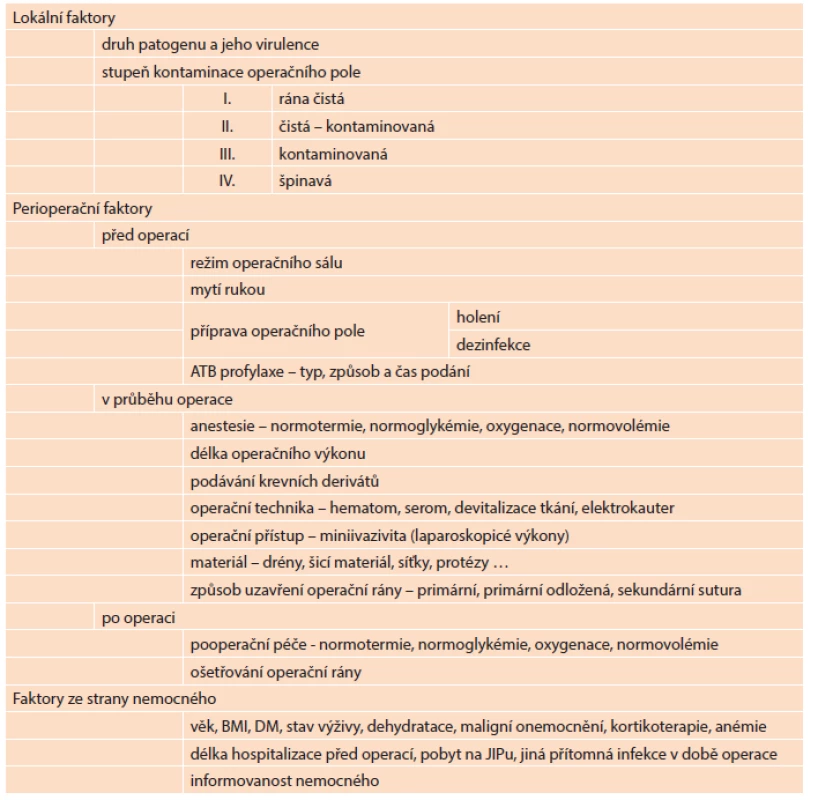
Hodnocení stupně rizika
Ve snaze objektivizovat riziko vzniku infekční komplikace v souvislosti s operačním výkonem vznikla řada skórovacích systémů a rizikových skóre, která zohledňují různá hlediska a charakteristiky (typ operační rány a operace, délku výkonu, komorbiditu, ASA skóre, laboratorní hodnoty a další faktory). Například:
Rizikové skóre podle druhu operační rány
Definice rány riziko vzniku IMOV
- I. rána čistá 1–5 %
- II. rána čistá – kontaminovaná 3–11 %
- III. rána kontaminovaná 10–17 %
- IV. špinavá >30 %
1985 – SENIC (Study on the Efficacy of Nosocomial Infection Control) risk index
(břišní operace, délka operace >2 hod., kontaminovaná či špinavá rána, >2 diagnózy) [13],
1991 − NNIS (National Nosocomial Infections Surveillance System) risk index
(délka operačního výkonu, stupeň kontaminace rány 3. nebo 4., ASA skóre >3) [14],
2007 – NSQIP (National Surgical Quality Improvement Project)
(charakteristika pacienta, laboratorní hodnoty, charakteristika operace) [15].
Nicméně objektivní hodnocení stupně rizika IMOV v klinické praxi je problematické pro její multifaktoriální příčinu vzniku a výraznou heterogenitu nemocných a chirurgických výkonů. V současné době není k dispozici dostatečně objektivní a přesný skórovací systém, který by stanovil riziko a charakter pooperační infekční komplikace u konkrétního nemocného s ohledem na jeho specifické rizikové faktory a druh operačního výkonu.
Možnosti ovlivnění rizika a incidence IMOV v perioperačním období
Z výše uvedeného vyplývá, že patogeneze IMOV je ovlivňována celou řadou celkových a lokálních faktorů, které se různě významnou měrou podílejí na rozvoji pooperační infekční komplikace. Část z uvedených faktorů nelze účinně ovlivnit či eliminovat (např. věk a komorbiditu nemocného, diagnózu a pokročilost onemocnění, urgentnost výkonu apod.). Na druhé straně je zde řada dalších významných faktorů, které jsou ovlivnitelné a vhodným opatřením a dodržením určených klinickými postupů lze riziko a incidenci IMOV významně snížit. Tyto postupy a doporučení vycházejí z recentních literárních studií a údajů ověřených na principu EBM a v literatuře jsou shrnuty v řadě klinických quidelines [1,3,16−18].
Doporučení před operací
Screening bacilonosičů a eradikace Staphylococcusaureus (MSSA – Methicillin senzitivních a MRSA – Methicillin rezistentních)
Je doporučena předoperační eradikace u prokázaných bacilonosičů Staphylococcus aureus intranasální aplikací 2% Mupirocinu zejména u ortopedických a kardiochirurgických nemocných. Eradikace je rovněž doporučena u rizikových nemocných v ostatních chirurgických oborech, u kterých je předoperačně prokázáno bacilonosičství [10,18,19].
Zákaz kouření
Je doporučeno před plánovaným výkonem přerušit kouření minimálně na 4 týdny.
Délka hospitalizace před výkonem
S délkou hospitalizace před operačním výkonem, zejména na JIP či ARO, narůstá riziko vzniku IMOV. Pokud je to možné, je doporučeno omezit délku hospitalizace před operací na minimum.
Nutriční příprava
Význam perioperační nutriční podpory u rizikových, malnutričních a zejména onkologických nemocných a její ovlivnění pooperační morbidity a mortality byl opakovaně prokázán [20] a konkrétní doporučení jsou zpracována v řadě guidelines odborných společností (ERAS, ESPEN, IASMEN) [21−23].
U většiny chirurgických nemocných je nutné před operací předejít hladovění. Je tolerováno hladovění maximálně 6 hodin a žíznění 2 hodiny před operací. Z hlediska prevence IMOV je doporučeno podávat enterální nutriční podporu před plánovaným výkonem. Význam předoperačního rutinního podávání parenterální výživy u nerizikových skupin chirurgických nemocných ve snaze snížit riziko IMOV se neprokázal [18].
Vysazení imunosupresivní léčby
Dle většiny doporučených postupů u nemocných s imunosupresivní léčbou (autoimunitní onemocnění, orgánové transplantace…) není nutné tuto medikaci před plánovanou operací přerušovat. Vysazení imunosupresivní léčby před operací nesnižuje riziko IMOV [18,24,25].
Antibiotická profylaxe
Podávání antibiotické (ATB) profylaxe je jednoznačně doporučeným postupem při ovlivnění incidence IMOV. Ve snaze o maximální využití efektu je však nutné dodržet stanovené zásady její aplikace. Správným podáním ATB profylaxe lze předejít až 40–60 % IMOV. Naopak při nedodržování stanovených principů podávání ATB profylaxe se může riziko IMOV paradoxně zvýšit [26]. Je důležité striktně rozlišovat zásady terapeutického a profylaktického podávání ATB [1].
ATB profylaxe je indikována u chirurgického výkonu s vyšším rizikem infekce (hepatopankreatobiliární chirurgie, kolorektální chirurgie, otevřená poranění…) či u chirurgického výkonu s nízkým rizikem infekce, ale závažnými důsledky při vzniku infekce (stent, cévní protéza, umělá srdeční chlopeň, kloubní náhrady…).
Volba ATB – baktericidní, intravenózní, selektivní podle typu a charakteru výkonu a mikrobiologické situace na pracovišti.
Čas podání je zpravidla doporučován 30−60 min. před začátkem operace (kožní incizí). Čas podání by měl záviset na farmakodynamice ATB tak, aby bylo dosaženo nejvyšší sérové koncentrace ATB v okamžiku začátku operace. Je doporučeno opakovat další dávku po 3−4 hod. v závislosti na farmakodynamice ATB, délce operace či vyšších krevních ztrátách v průběhu výkonu. Je nutné dodržet ukončení podávání ATB profylaxe do 24 hod. od operace (u kardiochirurgických výkonů do 48 hod.) [27−29].
Mechanická příprava střeva (MPS)
Izolovaná příprava střeva bez podávání ATB nesnižuje incidenci IMOV a její rutinní provádění není doporučeno. Pokud je prováděna mechanická příprava střeva u elektivních operací v kolorektální oblasti, je doporučena v kombinaci s perorálním podáváním ATB [30, 31]. Přestože se neprokázalo významné snížení incidence IMOV ani dehiscencí střevní anastomózy po MPS, není dosud mezi chirurgickými pracovišti i jednotlivými chirurgy jednotný názor na její provádění [32]. Někde je indikována u všech plánovaných výkonů, jinde není prováděna vůbec. Většina pracovišť provádí MPS elektivně u levostranných resekcí kolon a u výkonů na rektu.
Úprava vnitřního prostředí
V rámci předoperační přípravy je důležitá kontrola vnitřního prostředí s rehydratací nemocného a úpravou anemie.
Koupel před výkonem
Je doporučena koupel či sprchování nemocného v den operace či den před výkonem. Použití speciálních antimikrobiálních přípravku či mýdla není nezbytné [33].
Příprava operačního pole
Nedoporučuje se holit operační pole den před operací. Tento postup zvyšuje riziko a incidenci IMOV. Pokud je to nezbytné, pak je doporučeno použití střihacího strojku s nástavcem na jedno použití v den výkonu. Stříhání má být prováděno mimo operační trakt [34].
Pro přípravu operačního pole je doporučen antiseptický roztok Chlorhexidine Gluconate + Isopropyl alcohol (Hibistat) či alkoholový roztok + Povidone – iodine (Betadine, Pyodine, Wokadine). Vodné roztoky jsou ve srovnání s alkoholovými méně účinné [35,36].
Mytí rukou
Zásadní předpoklad pro prevenci IMOV je dodržování stanoveného postupu při mytí a dezinfekci rukou před operací s použitím antimikrobiálního mýdla a dezinfekčního roztoku [37−39].
Doporučení v průběhu operace
Oxygenace
V prevenci IMOV má jednoznačně význam dostatečná oxygenace tkání, která závisí na dodávce kyslíku, perfuzi tkání a normotermii. Dostatečné oxygenace a utilizace kyslíku v tkáních v průběhu celkové anestezie lze kromě jiného dosáhnout i zvýšenou inspirační frakcí O2 (FiO2) a inhalací kyslíkovou maskou v pooperačním období. Nezbytnou součástí oxygenace je dostatečná volumoterapie, udržení tělesné teploty a kontrola glykemie [10,30,40]. Je však třeba mít na paměti možný toxický vliv na plicní epitel při dlouhodobější aplikaci vyšší frakce inspirovaného O2 [41].
Tělesná teplota
V patogenezi IMOV při hypotermii hraje roli periferní vazokonstrikce, snížená perfuze a hypoxie tkání v místě operačního pole s poruchou funkce fagocytů a neutrofilních leukocytů. Kromě zvýšeného rizika IMOV má hypotermie negativní vliv i na srdeční činnost, ovlivňuje metabolismus léčiv, způsobuje koagulopatii a zvyšuje spotřebu krevních derivátů. Je proto doporučeno zahřívání nemocného v perioperačním období s udržením centrální tělesné teploty >36 st. C (vyhřívané podložky a přikrývky, ohřev intravenózních roztoků, nastavení teploty na operačním sále atd.) [42−45].
Normovolemie
Optimální a cílené nastavení parenterálního příjmu tekutin má na jedné straně předejít tzv. „over-load“ efektu, na druhé straně by nemělo dojít k projevům hypovolemie. Společně s dostatečnou oxygenací a normotermií má management parenterálního podávání roztoků v průběhu operace a v pooperačním období vliv nejenom na incidenci IMOV, ale i na celkový pooperační průběh [46−50].
Normoglykemie
K redukci rizika IMOV je doporučen monitoring sérové hladiny glukózy k zabránění excesivních výkyvů (hypoglykemie x hyperglykemie) v perioperačním období. Většího ovlivnění incidence IMOV bylo dosaženo při kontrole a udržení normoglykemie jak v průběhu vlastního výkonu, tak i v pooperačním období. Sledování je doporučeno u diabetiků i u nemocných bez diabetu. Ve většině doporučených postupů je u diabetiků doporučeno udržování hladiny glykemie <11 mmol/l. Nicméně je nutné konstatovat, že v praxi je striktní korekce perioperační glykemie pracná, nákladná a často i riziková z hlediska možné hypoglykemie. Rovněž není doporučena rutinní aplikace inzulinu k úpravě hyperglykemie, především u nemocných bez diabetu a nerizikových skupin nemocných, u kterých lze tolerovat vyšší hladiny glykemie [51−55].
Ochrana okrajů operační rány – „plastic wound protector“ (PWP)
Ve srovnání s tradičními postupy je při používání PWP popisován pozitivní efekt na incidenci IMOV u abdominálních otevřených výkonů. V některých guidelines je jeho používání doporučováno, nicméně jeho využívání v širším měřítku je omezeno především ekonomickými aspekty a také poměrně nižší kvalitou průkaznosti na podkladě EBM [56−58].
Chirurgická taktika a technika
Délka operačního výkonu a jeho charakter (urgentní nebo elektivní operace) přímo ovlivňují incidenci a riziko infekční pooperační komplikace. Chirurgická taktika a technika operování jsou dalšími z klíčových faktorů, které se podílejí na konečném výsledku operace. Na rozdíl od délky a typu výkonu je jejich objektivní hodnocení či měření obtížné. Není však pochyb o tom, že chirurgická technika a taktika se bezprostředně odráží na pooperačním průběhu a incidenci komplikací včetně IMOV. Princip tzv. fyziologického operování zahrnuje šetrné zacházení s tkáněmi, pečlivou hemostázu, zabránění hypotermie a ischemie tkání, uvážlivé používání elektrokoagulace apod. Současným trendem je omezení používání pojistných drénů, upřednostnění uzavřeného systému drenáže a včasné odstraňování drénů. Je doporučeno při uzávěru operační rány využívat primární, primárně odložené či sekundární sutury. V indikovaných případech je vhodné při uzávěru rány využívat systém s aktivním odsáváním (V.A.C.). U šicího materiálu s antiseptickým účinkem nebyl jednoznačně prokázán jeho efekt na snížení incidence IMOV a doporučení k jeho používání se liší podle jednotlivých guidelines [59,60].
Režim operačního sálu
Je striktně doporučeno dodržovat a kontrolovat režim a zásady asepse a antisepse na operačním sále (ventilace, pohyb personálu a nemocných, dezinfekce povrchů, sterilizace nástrojů…) [61].
Doporučení po operaci
Pooperační péče
Kontrola a udržování adekvátní hydratace, vyhnout se hypotermii, udržovat normoglykemii a oxygenoterapie v pooperačním období má význam z hlediska snížení rizika pooperačních komplikací včetně IMOV.
Převaz
Je doporučeno provádět první převaz a výměnu obvazu operační rány do 24−48 hod. po operaci za sterilních kautel, ránu očistit sterilním roztokem a krýt sterilním obvazem. Po 48 hodinách lze ránu sprchovat vodou.
Edukace nemocného
Je důležité poskytnout nemocnému informace o charakteru výkonu, péči o operační ránu a riziku pooperačních komplikací. Informovat nemocného o počátečních projevech a příznacích komplikací, možnostech jejich řešení a důležitosti včasného vyhledání odborného ošetření.
Sledování výskytu IMOV na pracovišti
Důležitou součástí snahy o snížení rizika IMOV je sledování výskytu infekčních pooperačních komplikací. Sběr dat lze provádět A) přímo či B) kombinací nepřímých metod.
A) Prospektivní průběžné sledování výskytu infekčních komplikací na pracovišti je nejpřesnější, ale rovněž i nejnáročnější způsob.
B) Nepřímé metody sledování a sběru dat jsou nejčastější metodou vycházející z kombinací:
- hlášení komplikací (lékaři a střední zdravotní personál)
- počet a důvod opakované hospitalizace
- příčiny reoperací a operačních revizí
- sledování počtu jednotlivých diagnóz a počtu prováděných výkonů
- šetření jednotlivých závažných případů IMOV (mikrobiolog a epidemiolog)
- celkový počet IMOV s jednotnou klasifikací (klinik, mikrobiolog a epidemiolog).
Shromážděná data by měla být po zpracování a analýze (klinik, mikrobiolog a epidemiolog) prezentována formou auditu či společných klinických seminářů. Tato sledování umožňují průběžně vyhodnocovat epidemiologickou situaci, zjišťovat a odhalovat rizikové faktory a příčiny IMOV. Následně provedená opatření v klinické praxi mohou zpětně vést k redukci výskytu IMOV na pracovišti (např. změna v předoperační přípravě nemocného, změna ATB profylaxe, odhalení nedostatků v dodržování zásad asepse a antisepse a změna režimu na oddělení, operačním sále, nedostatečná edukace zdravotního personálu či nemocných atd.). Se zkracující se dobou pooperační hospitalizace u řady chirurgických výkonů se časná pooperační péče a sledování přesouvají do ambulantní sféry a domácího ošetřování. Tím narůstá i podíl IMOV, které se projeví až po propuštění nemocného. Tato skutečnost přináší větší nároky na ošetřovatelskou péči v ambulantní sféře a rovněž na úroveň edukace nemocného či jeho rodinných příslušníků. Informovanost nemocného o možných pooperačních komplikacích a jejich příznacích po propuštění do domácí péče má zásadní význam pro časnou diagnostiku a včasné řešení pooperační infekční komplikace [62].
ZÁVĚR
Infekce v místě operačního výkonu má multifaktoriální příčinu, na jejímž vzniku a patogenezi se mohou podílet typ, množství a virulence patogenu, imunitní stav a komorbidita nemocného, druh a urgence operačního výkonu, průběh anestezie a pooperační péče. Některé příčiny IMOV mohou být specifické pro konkrétního nemocného a konkrétní operační výkon. V řadě recentních klinických prací byly definovány a potvrzeny jednotlivé faktory, které větší či menší měrou ovlivňují riziko vzniku IMOV. Tyto poznatky jsou přehledně zpracovány a tvoří základ doporučených postupů (guidelines), ve kterých jsou stručně uvedeny ověřené postupy a opatření v jednotlivých obdobích před, v průběhu a po operaci. Základním cílem těchto doporučených postupů je snížit riziko a incidenci IMOV. Jak bylo uvedeno v úvodu, práce si neklade za cíl zpracovat v celé šíři uvedenou problematiku, jejíž rozsah by přesáhl rámec sdělení. Snahou autora je upozornit na širokou škálu faktorů a skutečností, které se mohou podílet na vzniku IMOV. Ve sdělení jsou stručně shrnuty současné poznatky o vzniku IMOV s uvedením obecných preventivních opatření v perioperačním období, která riziko IMOV snižují. Účinně ovlivnit incidenci pooperačních infekčních komplikací znamená zavést tyto ověřené principy a postupy v každodenní praxi a u každého chirurgického nemocného. Závěrem je třeba zdůraznit, že neoddělitelnou součástí těchto opatření je průběžná kontrola jejich dodržování, edukace personálu, sledování incidence IMOV na pracovišti s pravidelným hodnocením a prezentací výsledků.
Seznam zkratek
ASA American Society of Anesthesiologists
EBM Evidence-Based Medicine
ERAS Enhanced Recovery After Surgery
ESPEN Society for Perioperative Care, European Society for Clinical Nutrition and Metabolism
HAIs Health-Care Associated Infections
IASMEN International Association for Surgical Metabolism and Nutrition
IMOV Infekce v místě operačního výkonu
MRSA Methicillin rezistentní Staphylococcus aureus
MSSA Methicillin senzitivní Staphylococcus aureus
MPS Mechanická příprava střeva
NNIS National Nosocomial Infections Surveillance System
NSQIP National Surgical Quality Improvement Project
PWP Plastic Wound Protector
SENIC Study on the Efficacy of Nosocomial Infection Control
VAC Vacuum-Assisted Closure
Podpořeno MO 1012
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
doc. MUDr. František Bělina
Chirurgická klinika 2. LF a ÚVN,
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: frantisek.belina@uvn.cz
Sources
1. Mangram AJ, Horan TC, Pearson ML, et al. Guideline for prevention of surgical site infection, 1999. Centers for Disease Control and Prevention (CDC) Hospital Infection Control Practices Advisory Committee. Am J Infect Control 1999;27 : 97−132; quiz 133-4; discussion 96.
2. Sievert DM, Ricks P, Edwards JR, et al. Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009−2010. Infect Control Hosp Epidemiol 2013;34 : 1−14.
3. Anderson DJ, Kaye KS, Classen D, et al. Strategies to prevent surgical site infections in acute care hospitals. Infect Control Hosp Epidemiol 2008;29 Suppl 1:S51−61.
4. Yokoe DS, Anderson DJ, Berenholtz SM, et al. A compendium of strategies to prevent healthcare-associated infections in acute care hospitals: 2014 updates. Infect Control Hosp Epidemiol 2014;35 Suppl 2:S21−31.
5. Anderson DJ, Pyatt DG, Weber DJ, et al. Statewide costs of health care-associated infections: estimates for acute care hospitals in North Carolina. Am J Infect Control 2013;41 : 764−8.
6. Zimlichman E, Henderson D, Tamir O, et al. Health care-associated infections: a meta-analysis of costs and financial impact on the US health care system. JAMA Intern Med 2013;173 : 2039−46.
7. Mangram AJ, Horan TC, Pearson ML, et al. Guideline for prevention of surgical site infection, 1999. Hospital Infection Control Practices Advisory Committee. Infect Control Hosp Epidemiol 1999;20 : 250–78; quiz 279−80.
8. Meeks DW, Lally KP, Carrick MM, et al. Compliance with guidelines to prevent surgical site infections: As simple as 1-2-3? Am J Surg 2011;201 : 76−83.
9. Umscheid CA, Mitchell MD, Doshi JA, et al. Estimating the proportion of healthcare-associated infections that are reasonably preventable and the related mortality and costs. Infect Control Hosp Epidemiol 2011;32 : 101−14.
10. Anderson DJ, Podgorny K, Berrios-Torres SI, et al. Strategies to prevent surgical site infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014;35 Suppl 2:S66−88.
11. Horan TC, Gaynes RP, Martone WJ, et al. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol 1992;13 : 606−8.
12. Gurlich R, Adamkova V, Ulrych J, et al. [Basic principles of diagnosis and treatment of secondary peritonitis - recommendations of experts with the support of SIS.] Czech, Rozhl Chir 2014;93 : 334−48,350−2.
13. Haley RW, Culver DH, Morgan WM, et al. Identifying patients at high risk of surgical wound infection. A simple multivariate index of patient susceptibility and wound contamination. Am J Epidemiol 1985;121 : 206−15.
14. Martone WJ, Nichols RL. Recognition, prevention, surveillance, and management of surgical site infections: introduction to the problem and symposium overview. Clin Infect Dis 2001;33 Suppl 2:S67−8.
15. Neumayer L, Hosokawa P, Itani K, et al. Multivariable predictors of postoperative surgical site infection after general and vascular surgery: results from the patient safety in surgery study. J Am Coll Surg 2007;204 : 1178−87.
16. Yokoe DS, Anderson DJ, Berenholtz SM, et al. Introduction to “A compendium of strategies to prevent healthcare-associated infections in acute care hospitals: 2014 updates”. Infect Control Hosp Epidemiol 2014;35 Suppl 2:S1−5.
17. Bratzler DW, Hunt DR. The surgical infection prevention and surgical care improvement projects: national initiatives to improve outcomes for patients having surgery. Clin Infect Dis 2006;43 : 322−30.
18. Global Guidelines for the Prevention of Surgical Site Infection. Geneva 2016.
19. Bode LG, van Rijen MM, Wertheim HF, et al. Long-term mortality after rapid screening and decolonization of staphylococcus aureus carriers: Observational follow-up study of a randomized, placebo-controlled trial. Ann Surg 2016;263 : 511−5.
20. Havel E. [When a surgical patient needs parenteral nutrition.], Czech, Rozhl Chir 2013;92 : 368–72.
21. Guidelines for Perioperative Care in Elective Colonic Surgery: Enhanced recovery after surgery (ERASR) society recommendations. World J Surg 2013;37 : 259−84.
22. Lassen K, Coolsen MM, Slim K, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced recovery after surgery (ERAS(R)) society recommendations. World J Surg 2013;37 : 240−58.
23. Braga M, Ljungqvist O, Soeters P, et al. ESPEN Guidelines on Parenteral Nutrition: surgery. Clin Nutr 2009;28 : 378−86.
24. Bafford AC, Powers S, Ha C, et al. Immunosuppressive therapy does not increase operative morbidity in patients with Crohn’s disease. J Clin Gastroenterol 2013;47 : 491−5.
25. Waterman M, Xu W, Dinani A, et al. Preoperative biological therapy and short-term outcomes of abdominal surgery in patients with inflammatory bowel disease. Gut 2013;62 : 387−94.
26. Classen DC, Evans RS, Pestotnik SL, et al. The timing of prophylactic administration of antibiotics and the risk of surgical-wound infection. N Engl J Med 1992;326 : 281−6.
27. Antimicrobial prophylaxis in surgery. Med Lett Drugs Ther 2001;43 : 92−7.
28. Anderson DJ. Prevention of surgical site infection: beyond SCIP. AORN J 2014;99 : 315−9.
29. Bratzler DW1, Houck PM; Surgical Infection Prevention Guidelines Writers Workgroup. Antimicrobial prophylaxis for surgery: an advisory statement from the National Surgical Infection Prevention Project. Clin Infect Dis 2004;38 : 1706−15.
30. Leaper D, Burman-Roy S, Palanca A, et al. Prevention and treatment of surgical site infection: summary of NICE guidance. BMJ 2008;337:a1924.
31. Leaper DJ, Edmiston CE. World Health Organization: global guidelines for the prevention of surgical site infection. J Hosp Infect 2017;95 : 135−6.
32. Eskicioglu C, Forbes SS, Fenech DS, et al. Preoperative bowel preparation for patients undergoing elective colorectal surgery: a clinical practice guideline endorsed by the Canadian Society of Colon and Rectal Surgeons. Can J Surg 2010;53 : 385−95.
33. Owens P, McHugh S, Clarke-Moloney M, et al. Improving surgical site infection prevention practices through a multifaceted educational intervention. Ir Med J 2015;108 : 78−81.
34. Tanner J, Woodings D, Moncaster K. Preoperative hair removal to reduce surgical site infection. Cochrane Database Syst Rev 2006, available from: https://www.ncbi.nlm.nih.gov/pubmed/16625596.
35. Maiwald M, Chan ES. The forgotten role of alcohol: a systematic review and meta-analysis of the clinical efficacy and perceived role of chlorhexidine in skin antisepsis. PLoS One 2012;7:e44277, available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3434203/
36. Darouiche RO, Wall MJ, Jr., Itani KM, et al. Chlorhexidine-alcohol versus povidone-Iodine for surgical-site antisepsis. N Engl J Med 2010;362 : 18−26.
37. WHO Guidelines on Hand Hygiene in Health Care: First global atient safety challenge clean care Is safer care. Geneva 2009.
38. Tanner J. Surgical hand antisepsis: the evidence. J Perioper Pract 2008; 18 : 330−4,339.
39. Tanner J, Dumville JC, Norman G, et al. Surgical hand antisepsis to reduce surgical site infection. Cochrane Database Syst Rev 2016, available from: https://www.ncbi.nlm.nih.gov/pubmed/26799160
40. Qadan M, Akca O, Mahid SS, et al. Perioperative supplemental oxygen therapy and surgical site infection: a meta-analysis of randomized controlled trials. Arch Surg 2009;144 : 359−66; discussion 366–7.
41. Meyhoff CS, Jorgensen LN, Wetterslev J, et al. Increased long-term mortality after a high perioperative inspiratory oxygen fraction during abdominal surgery: follow-up of a randomized clinical trial. Anesth Analg 2012;115 : 849−54.
42. Qadan M, Gardner SA, Vitale DS, et al. Hypothermia and surgery: immunologic mechanisms for current practice. Ann Surg 2009;250 : 134−40.
43. Wong PF, Kumar S, Bohra A, et al. Randomized clinical trial of perioperative systemic warming in major elective abdominal surgery. Br J Surg 2007;94 : 421−6.
44. Kurz A, Sessler DI, Lenhardt R. Perioperative normothermia to reduce the incidence of surgical-wound infection and shorten hospitalization. Study of Wound Infection and Temperature Group. N Engl J Med 1996;334 : 1209−15.
45. Melling AC, Ali B, Scott EM, et al. Effects of preoperative warming on the incidence of wound infection after clean surgery: a randomised controlled trial. Lancet 2001;358 : 876−80.
46. Scheeren TW, Wiesenack C, Gerlach H, et al. Goal-directed intraoperative fluid therapy guided by stroke volume and its variation in high-risk surgical patients: a prospective randomized multicentre study. J Clin Monit Comput 2013;27 : 225−33.
47. Benes J, Chytra I, Altmann P, et al. Intraoperative fluid optimization using stroke volume variation in high risk surgical patients: results of prospective randomized study. Crit Care 2010;14:R118.
48. Vermeulen H, Hofland J, Legemate DA, et al. Intravenous fluid restriction after major abdominal surgery: a randomized blinded clinical trial. Trials 2009;10 : 50.
49. Mayer J, Boldt J, Mengistu AM, et al. Goal-directed intraoperative therapy based on autocalibrated arterial pressure waveform analysis reduces hospital stay in high-risk surgical patients: a randomized, controlled trial. Crit Care 2010;14:R18.
50. Pearse R, Dawson D, Fawcett J, et al. Early goal-directed therapy after major surgery reduces complications and duration of hospital stay. A randomised, controlled trial [ISRCTN38797445]. Crit Care 2005;9:R687−93.
51. Ata A, Lee J, Bestle SL, et al. Postoperative hyperglycemia and surgical site infection in general surgery patients. Arch Surg 2010;145 : 858−64.
52. Jacobi J, Bircher N, Krinsley J, et al. Guidelines for the use of an insulin infusion for the management of hyperglycemia in critically ill patients. Crit Care Med 2012;40 : 3251−76.
53. Kotagal M, Symons RG, Hirsch IB, et al. Perioperative hyperglycemia and risk of adverse events among patients with and without diabetes. Ann Surg 2015;261 : 97−103.
54. Kao LS, Phatak UR. Glycemic control and prevention of surgical site infection. Surg Infect (Larchmt) 2013;14 : 437−44.
55. Umpierrez GE, Hellman R, Korytkowski MT, et al. Management of hyperglycemia in hospitalized patients in non-critical care setting: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2012;97 : 16−38.
56. Edwards JP, Ho AL, Tee MC, et al. Wound protectors reduce surgical site infection: a meta-analysis of randomized controlled trials. Ann Surg 2012;256 : 53−9.
57. Mihaljevic AL, Schirren R, Ozer M, et al. Multicenter double-blinded randomized controlled trial of standard abdominal wound edge protection with surgical dressings versus coverage with a sterile circular polyethylene drape for prevention of surgical site infections: a CHIR-Net trial (BaFO; NCT01181206). Ann Surg 2014;260 : 730−7; discussion 737−9.
58. Gheorghe A, Roberts TE, Pinkney TD, et al. The cost-effectiveness of wound-edge protection devices compared to standard care in reducing surgical site infection after laparotomy: an economic evaluation alongside the ROSSINI trial. PLoS One 2014, available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3991705/
59. Surgical site infection: Prevention and treatment of surgical site infection. London 2008.
60. Anderson DJ, Podgorny K, Berrios-Torres SI, et al. Strategies to prevent surgical site infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol 2014;35 : 605−27.
61. Crolla RM, van der Laan L, Veen EJ, et al. Reduction of surgical site infections after implementation of a bundle of care. PLoS One 2012;7:e44599.
62. Prospero E, Cavicchi A, Bacelli S, et al. Surveillance for surgical site infection after hospital discharge: a surgical procedure-specific perspective. Infect Control Hosp Epidemiol 2006;27 : 1313−7.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 5-
All articles in this issue
- Malígny fibrózny histiocytóm ako raritná príčina akútnej končatinovej ischémie
- Thorakoskopická epikardiální ablace fibrilace síní systémem COBRA Fusion jako první část hybridního výkonu
- Autologní kranioplastika deponovanou kostní ploténkou v podkoží mezogastria
- Kombinované řešení časné tracheobronchopleurální píštěle po pravostranné sleeve pulmektomii
- Leiomyóm vena iliaca externa
- Současné možnosti ovlivnění infekce v místě operačního výkonu
- Kolorektální karcinom u seniorů – děláme to dobře?
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Autologní kranioplastika deponovanou kostní ploténkou v podkoží mezogastria
- Současné možnosti ovlivnění infekce v místě operačního výkonu
- Malígny fibrózny histiocytóm ako raritná príčina akútnej končatinovej ischémie
- Thorakoskopická epikardiální ablace fibrilace síní systémem COBRA Fusion jako první část hybridního výkonu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

