-
Medical journals
- Career
Překvapivý histologický nález v resekátu omenta pro uskřinutou pupeční kýlu
Authors: M. Ševčíková; P. Hladík; R. Lischke
Authors‘ workplace: III. chirurgická klinika 1. LF Univerzity Karlovy a FN Motol, Praha přednosta: prof. MUDr. R. Lischke, Ph. D.
Published in: Rozhl. Chir., 2017, roč. 96, č. 12, s. 517-520.
Category: Case Report
Overview
Úvod:
Gastrointestinální stromální tumor, GIST, je nejčastějším mezenchymálním tumorem trávicí soustavy. Nejčastěji vyrůstá ze žaludku či tenkého střeva a je asymptomatický. Základní a jedinou kurativní terapií je snaha o R0 resekci.
Při neoadjuvantní či adjuvantní terapii, nebo je-li nález shledán jako inoperabilní, je na základě molekulární podstaty GISTů od roku 2000 indikována terapie inhibitorem tyrozinkináz – imatinib.Kazuistika:
Kazuistika popisuje pacientku, která byla dlouhodobě bez klinických obtíží, dokud se nedostavila akutně s bolestí břicha pro uskřinutou pupeční kýlu. Byla provedena resekce uskřinutého omenta a plastika břišní stěny. Omentum bylo odesláno na definitivní histologické vyšetření. To však popsalo blíže nespecifický sarkom. Následně provedené CT vyšetření břicha odhalilo objemnou tumorovou masu v dutině břišní a v malé pánvi. Multidisciplinárním týmem Fakultní nemocnice v Motole jsme pacientku indikovali k pokusu o radikální exstirpaci tumoru. Byla provedena omentektomie, resekce jejuna, hysterektomie, pravostranná adnexektomie, nízká přední resekce rekta a omfalektomie. Výsledek definitivní histologie byl s nálezem maligní GIST, c kit pozitivní, high risk, vycházející z jejuna.Klíčová slova:
GIST − gastrointestinální stromální tumor − KIT − imatinibÚVOD
Ačkoli je gastrointestinální stromální tumor (GIST) vzácným nádorem, je nejčastějším mezenchymálním tumorem trávicí soustavy. Původně se charakterizoval jako mezenchymální nádor, který nemá typický charakter leiomyomů ani schwannomů. Ultrastruktura GISTů obsahuje prvek autonomního nervového systému (Cajalovy buňky) i hladké svaloviny [1]. Předpokládá se tedy, že GISTy vznikají buď z buněk Cajalových, nebo ze společného prekurzoru Cajalových buněk a hladkého svalu [2]. Cajalovy buňky jsou součástí myenterického plexu a podílejí se na řízení motility GIT [1]. GISTy se nejčastěji vyskytují v žaludku (65 %) a na tenkém střevě (25 %) Raritně se nacházejí i na tlustém střevě, rektu, jícnu, popř. omentu [2,3,4,5,6]. GISTy představují pouze 1−3 % nádorů žaludku a cca 20 % nádorů tenkého střeva. U nádorů konečníku a rekta nejde ani o 1 %. V klinickém obraze se ze 36 % projevuje bolestí břicha. Dále pacienti popisují zhoršení celkového stavu (24 %), dyspepsie (16 %), krvácení z GIT, které může vést k sekundární anemii [1,3,7]. Obvykle jsou symptomatické GISTy větší než 6 cm [1]. Nejčastějším místem metastáz jsou játra, peritoneum a retroperitoneum. Biologické chováni GISTů může být benigní či maligní. Malignita se hodnotí velikostí tumoru, mitotickou aktivitou, počtem nekróz a hemoragií.
Typický věk, kdy je diagnostikován GIST, je kolem 60 let [1,3]. Dle pohlaví mírně převažují muži nad ženami. Vzácně může být GIST součástí dědičných onemocnění – Von Recklinghausenovy choroby, Carneyho triády (žaludeční GIST, paragangliom, plicní chondrom) nebo syndromu Carney-Strakatis (GIST žaludku, extraadrenální paragangliom, chybí plicní chondrom) [8]. Národní onkologický registr v USA v roce 1995 vydal, že incidence GISTu se nachází v rozmezí 500–600 nových případů za rok [3].
Diagnostika
Základem diagnostiky je CT či NMR s kontrastem. Endoskopie je nápomocná při diagnostice GISTu jícnu či tlustého střeva. Endosonografické vyšetření může odhalit, zda masa primárně vyrůstá ze stěny žaludku či ze stěny tenkého střeva. Punkce se obvykle neprovádí, může způsobit rupturu nádoru a vést k peritoneální diseminaci či k výraznému krvácení. Indikována je při hraniční operabilitě nádoru u pacientů, kteří by mohli těžit z léčby imatinibem [1].
Molekulární podstata
V patogenezi GISTů je nejčastěji mutace v KIT (CD 117). Poprvé ji popsal Hirota a kolektiv, v Japonsku roku 1998 [9]. Jde o receptor pro cytokin SCF (Stem Cell Factor, růstový faktor žírných buněk). Výsledkem mutace je aktivace tyrozinkinázové části KIT, jež vede k autofosforylaci, která inhibuje apoptózu a naopak indukuje zvýšenou proliferaci buněk. Mutace tohoto genu je prokázána zhruba u 97 % případů [2]. Druhou nejčastější mutací je mutace PDGFRA, tedy receptoru alfa pro cytokin PDGF (Plateled Derived Growth Factor). Tato mutace byla objevena v roce 2003. Protože v obou případech jde o receptory s tyrozinkinázovou aktivitou, jsou GISTy senzitivní na terapii pomocí inhibitoru tyrozinkinázové aktivity – imatinib. Terapie byla zavedena do klinické praxe roku 2000 − pouze 2 roky po objevení mutace v KIT [1].
Terapie
Jediná kurativní léčba je RO resekce. Nejčastějším operačním výkonem je nástěnná resekce žaludku či segmentální resekce tenkého střeva. GISTy obvykle vytěsňují sousední tkáně bez toho, aby je infiltrovaly. Pokud však sousední tkáně odpreparovat nelze, je doporučena en block resekce [1]. Základní technikou je opatrná chirurgická exstirpace tumoru od okolních tkání a zamezení ruptury tumoru. Při ruptuře či krvácení z tumoru je velmi vysoké riziko lokální recidivy popř. peritoneálních metastáz [1]. Podle studie American College of Surgeons Oncology Group z roku 2012 má pacient s rupturou pouzdra a výronem tumoru do okolí horší prognózu než pacient s R1 resekcí [9]. Protože GIST jen velmi vzácně metastazuje do lymfatických uzlin (1 až 4 %), lymfadenektomie se rutinně neprovádí. K šíření dochází výhradně implantačními metastázami nebo hematogenně [1,15]. GISTy je možno operovat i laparoskopicky. První zmínka o této technice je z roku 1999. Obecně se doporučuje laparoskopická resekce u tumorů do 5 cm [1]. GISTy jsou rezistentní vůči chemo i radioterapii. Vzhledem k molekulární podstatě GISTů lze jistého úspěchu dosáhnout inhibitorem tyrozinkináz – imatinib. Je-li tumor lokálně pokročilý či inoperabilní, doporučuje se neoadjuvantní terapie imatinibem po dobu 3 až 12 měsíců [10,15]. Negativní resekční okraj dle mikroskopického vyšetření lze nalézt v 70−95 %. Pokud je u pacienta odhalena recidiva, je až z 50 % v místě resekce. Popřípadě je již i v játrech či na peritoneu. Nejčastěji se recidiva objeví do 2–3 let od primární resekce a 5leté přežití se pohybuje okolo 50 %. Metastázy do plic a kostí se obvykle objevují později [1,5,11]. Při chirurgicky neřešitelných nálezech se doporučuje doživotní terapie imatinibem, většinou dávkou 400 mg/den. Podle studie Joensuu a kolektiv u pacientů s metastatickým postižením u GISTu z roku 2001 je 70% šance na přežití 2 let při léčbě imatinibem a 50 % pacientů bude po dvou letech bez známek progrese [13]. Účinek terapie se stanovuje v pravidelných intervalech dle CT a FDG-PET.
Registr v České republice
Institut biostatistiky a analýz při Masarykově univerzitě v Brně sbírá epidemiologická data od pacientů diagnostikovaných od 1. ledna 2000 ze 13 pracovišť na území České republiky a na Slovensku. Registr je volně přístupný na webové stránce http://www.gist.registry.cz. Po odborné stránce je garantován Českou onkologickou společností ČLS JEP. Následující data se týkají pouze registru České republiky.
K listopadu 2016 čítá registr na 1172 osob. 1095 pacientů má kompletně vyplněné údaje pro registr. Průměrný věk v době diagnózy je 61 let a z 52,8 % je pacientem muž. 67 % pacientů již má klinické příznaky, nejčastěji bolesti břicha. Většinovou lokalizací GISTu je žaludek (48,5 %), druhou jejunum (14,4 %). 73,9 % pacientů mělo v době diagnózy nález lokálně resekabilní. Četnost tumoru podle jeho největšího rozměru je rozdělená do tří téměř stejných skupin po jedné třetině, a to 2 až 5 cm, 5 až 10 a více než 10 cm. 88,1 % pacientů má nález molekuly CD 117 – mutace KIT. 66,6 % pacientů registru zatím žije. Celkové 5leté přežití je 77,4 %. 91,9 % pacientů podstoupilo operaci. Imatinibem, v 95 % dávkou 400 mg/den, bylo či je léčeno 55,9 % pacientů. U 15 % z nich se vyskytovaly nežádoucí účinky systémové léčby. Nejčastěji šlo o retenci tekutin, hematotoxicitu, nefrotoxicitu, krvácení do GIT, nauzeu a vomitus. Průměrná doba paliativní terapie byla 26,7 měsíce. 5leté přežití při metastatickém postižení a paliativní terapii imatinibem je 56,1 %. Medián přežití je 70 měsíců [14].
KAZUISTIKA
58letá pacientka byla operována na jiném pracovišti akutně v prosinci 2016 pro uskřinutou pupeční kýlu. V minulosti podstoupila L-adnexektomii pro cystu vaječníku a laparoskopickou cholecystektomii. Jinak se pacientka s ničím neléčila, léky trvale neužívala. Alergii negovala. Byla odeslána ambulantním chirurgem pro bolesti v místě pupeční jizvy (po portu po laparoskopické operaci) a v levém podbřišku. Subjektivně udávala dlouhodobé pobolívání břicha a asi týden bolestivou rezistenci v pupku. Rezistence nešla reponovat a byla popsána jako v.s. hematom. V den návštěvy nemocnice se bolesti výrazně zhoršily.
V prosinci byla provedena akutní rutinní operace pro uskřinutou pupeční kýlu. Defekt ve fascii byl 3 centimetry v průměru, kýlní vak byl popsán s prosvítajícím hematomem. Po otevření vaku byl jeho obsahem hematom s nekrotickou hmotou, susp. inkarcerovaný praeperitoneální lipom, popř. omentum. Obsah kýlního vaku byl odeslán na definitivní histologické vyšetření. Pooperační průběh byl bez komplikací. Pacientka byla propuštěna. Překvapivý byl však nález definitivního histologického vyšetření, které popsalo část „uskřinutého omenta“ jako sarkom blíže neurčitého typu. Konkrétně maligní tumor mezenchymové histogeneze bez specifické morfologie a imunotypu. Původně zvažovaný melanom nebyl potvrzen, imunofenotypizací byl vyloučen lymfom i nádory epitelové či neuroektodermové diferenciace.
Pacientka absolvovala CT vyšetření břicha s nálezem rozsáhlé expanze v dutině břišní a malé pánvi nasedající na dělohu s cévním zásobením z a. et v. lienalis (Obr. 1, Obr. 2). Dále byl popsán rozsáhlý tumor dělohy s myomatózou. Fundus dělohy zvětšen útvarem barevných kontur bez infiltrace okolí 12x10x8 cm. Při dorzálním okraji oválná kalcifikace 14 mm a vlevo nasedající dorzálně 2 ložiska velikosti 3 cm. CT vyšetření plic bylo s přiměřeným nálezem. Totální koloskopie do céka taktéž s normálním nálezem. Doplněno bylo i gynekologické vyšetření.
Image 1. CT břicha s nálezem expanze v dutině břišní s cévním zásobením z a. et v. lienalis Fig. 1: CT of the abdomen with a finding of expansion in the abdominal cavity with vascular supply from the splenic artery and vein 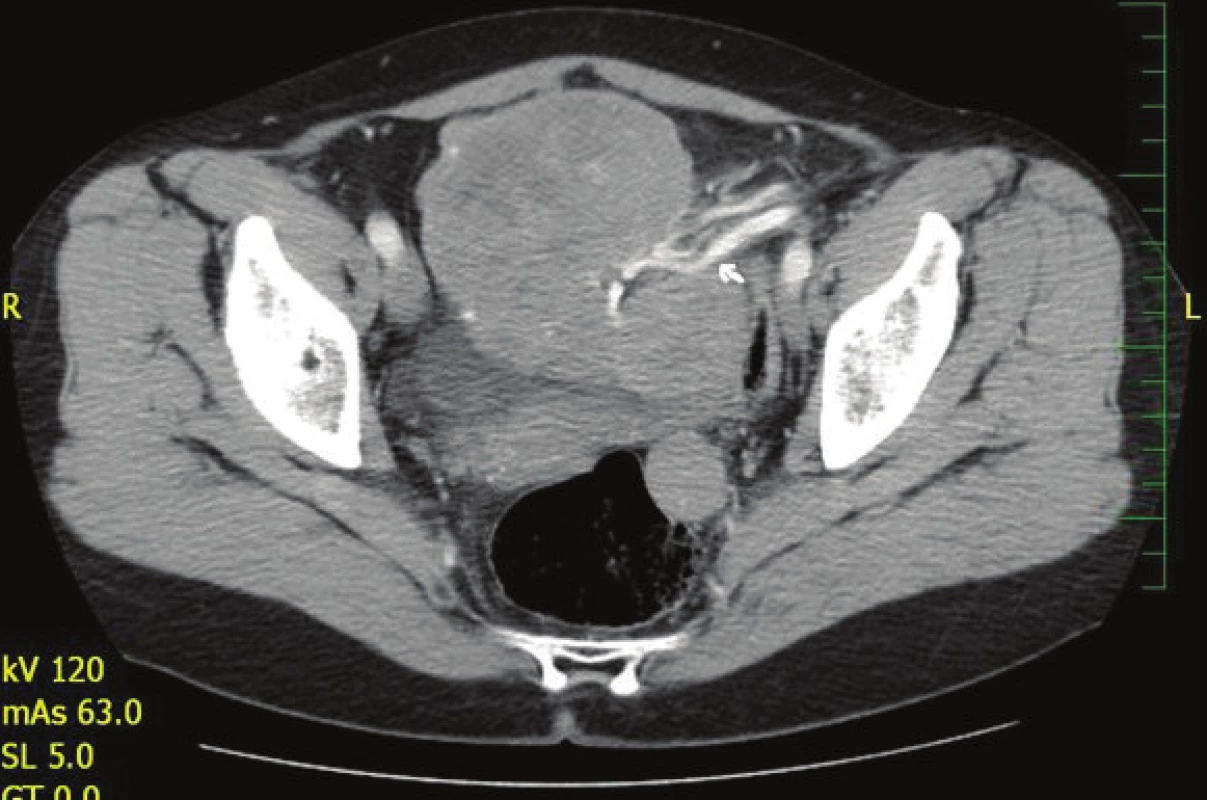
Image 2. CT břicha s nálezem expanze v dutině břišní a malé pánvi Fig. 2: CT of the abdomen with a finding of expansion in the abdominal cavity and small pelvis 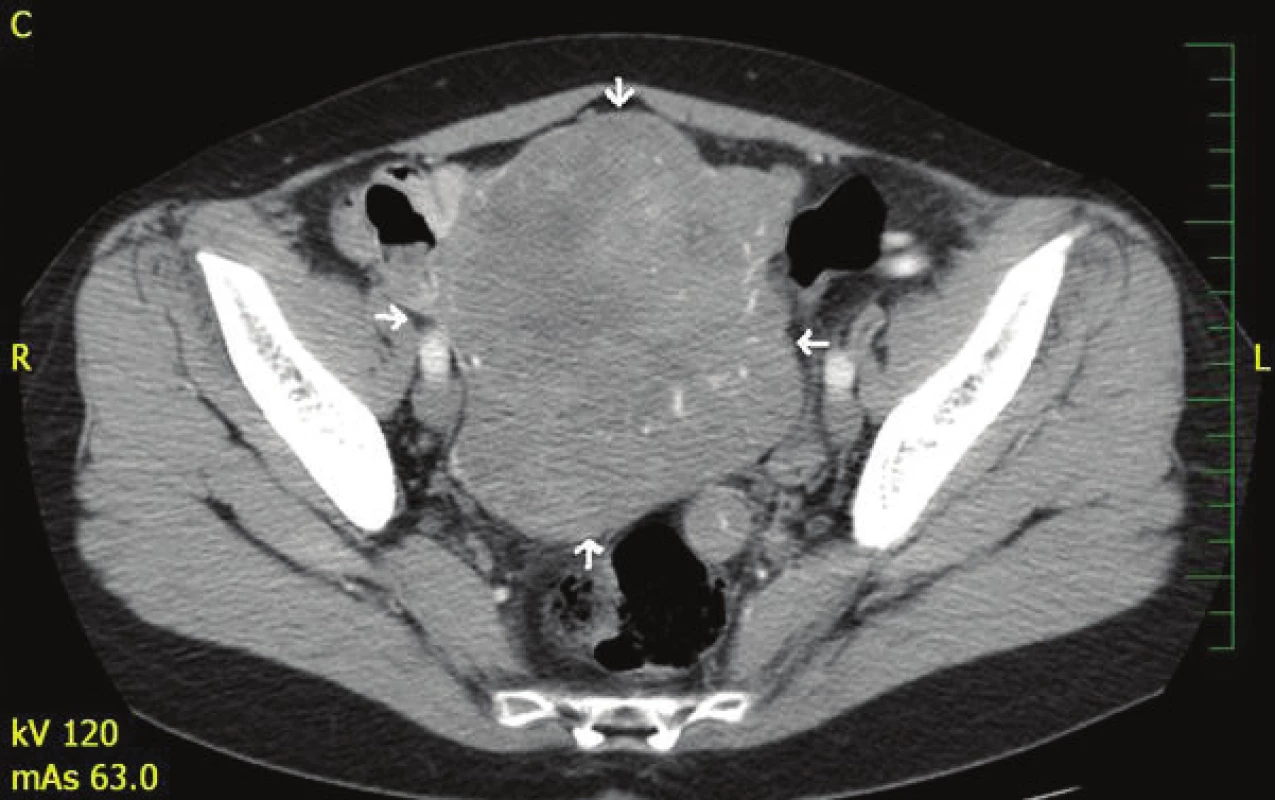
Pacientka byla klinicky bez obtíží, bolesti neměla a byla odeslána ke konzultaci v lednu 2017 na naši sarkomovou ambulanci. Prezentovali jsme následně pacientku na onkoboardu FN Motol. Zde se sešel multidisciplinární tým (chirurg, radiolog, onkolog) a pacientku jsme indikovali k pokusu o radikální exstirpaci tumoru dutiny břišní a malé pánve a k umbilektomii ve spolupráci s gynekologem.
V únoru 2017 jsme pacientku přijali k operaci. Nejdříve po domluvě s urology proběhlo zastentování obou ureterů. Cystoskopicky bylo patrné na ventrální straně močového měchýře vpáčení tumoru. Začali jsme operaci střední laparotomií a excizí pupku spolu s urachem. Dutina břišní byla bez výpotku, bez známek diseminace, játra byla palpačně bez metastáz. Z malé pánve se do dutiny břišní propagoval měkkotkáňový křehký tumor, bez pouzdra, charakteru rybího masa. Infiltroval omentum, ze kterého vedla cévní stopka na levé straně tumoru. Tumor infiltroval také první kličku jejuna, rektum, dělohu a pravá adnexa (stp. AE l sin.) Dále jsme nalezli metastatické ložisko retroperitoneálně za cékem v oblasti ovarických cév velikosti 7x6x5 cm. Tuto metastázu jsme spolu s peritoneem a po podvazu ovarických cév excidovali. Peroperačně jsme poslali LU z omenta na histologické vyšetření, bylo bez nádoru. Fibrotický pruh vycházející z tumoru již však byl s potvrzením susp. maligních buněk. Dále jsme pokračovali provedením omentektomie, resekcí první kličky jejuna, kterou jsme ponechali na preparátu. Střevo jsme sešili end-to-end pokračujícím PDS stehem v jedné vrstvě. Poté jsme přerušili lig. teres uteri l dx, mobilizovali pravý a levý ureter a uvolnili pravá adnexa. Tumor byl velmi křehký. Po jeho částečném uvolnění byla patrná infiltrace do dělohy a do rekta. Přerušili jsme vasa rectalis superior, předělili sigma, dokončili mobilizaci rekta. Gynekolog provedl subcervikální hysterektomii a po přerušení rekta v distální třetině Contour staplerem jsme vyjmuli preparát. Po kontrole hemostázy jsme konstruovali kolorektoanastomózu end-to-end cirkulárním staplerem. Dutinu břišní jsme řádně vypláchli, do malé pánve zavedli silikonový drén zprava. Po kontrole materiálu jsme uzavřeli laparotomii v anatomických vrstvách. Dále jsme provedli plastiku neoumbiliku. Pooperační průběh byl klidný. Pro pokles v krevním obraze podány krevní deriváty. Nadále byla pacientka bez chirurgických či interních komplikací. 7. pooperační den jsme pacientku propustili do ambulantní péče.
Za týden se pacientka dostavila ke kontrole. Nadále byla bez klinických obtíží, bez celkových příznaků, pasáž v normě, rána se hojila primárně. Extrahovali jsme stehy. Definitivní výsledek histologického vyšetření byl zhodnocen jako gastrointestinální stromální tumor (GIST) vycházející z jejuna, velikosti nad 10 cm, c kit pozitivní, high risk. Vzhledem k velikosti, proliferační aktivitě, hemoragiím a nekrózám byl hodnocen jako maligní. Byla zjištěna generalizace v podobě drobných uzlovitých ložisek na povrchu pravého ovaria, v měkkých tkáních v jeho blízkosti a v měkkých tkáních resekovaného pupku s urachem.
Pacientku jsme odeslali na onkologickou kliniku k adjuvantní terapii a dispenzarizaci.
V dubnu 2017 podstoupila vyšetření PET CT, které bylo bez známek recidivy tumoru či metastáz. Pacientce byla indikována 3letá terapie imatinibem 400 mg/den.
Zatím naše poslední kontrola pacientky proběhla v květnu 2017. Pacientka užívá imatinib, cítí se dobře, bolesti břicha neguje. Rektoskopie do 12 cm, v 9 cm anastomóza bez jasné infiltrace. Byla provedena biopsie bez známky recidivy.
Riziko relapsu dle ESMO guidelines vydaných roku 2012 [15] je u pacientky více než 90 %. Hodnotí maximální rozměr tumoru, který je více než 10 cm, mitotický index, který je více než 5, a původ GISTu, v tomto případě jejunum.
DISKUZE
GIST je vzácný nádor trávicího traktu. Je však nejčastějším mezenchymovým nádorem. Je řazen mezi sarkomy měkkých tkání. Nejčastěji vyrůstá ze stěny žaludku nebo tenkého střeva. Jeho incidence ve světě i v České republice v posledních letech stoupá. Klinicky se může projevovat bezpříznakově, nebo např. bolestí břicha či krvácením do GIT. Často se diagnostikuje náhodně, např. při laparotomii nebo sonografickém vyšetření z jiného důvodu. Jediná kurativní metoda léčby je chirurgická R0 resekce. Při neoadjuvantní či adjuvantní terapii, nebo je-li nález shledán jako inoperabilní, je na místě systémová léčba inhibitorem tyrozinkinázové aktivity – imatinib. Vzhledem k tomu, že GISTy jsou velmi často silně vaskulární, bylo navrženo použití inhibitorů VEGF, jako jsou bevacizumab a sunitinib, které inhibují kromě KIT a PDGFR i VEGF. Dále je ve výzkumu inhibitor KIT druhé generace, zejména se schopností inhibovat KIT navzdory sekundárním mutacím KIT. Další výzkumy jsou jistě potřeba. Například co nejvíce zefektivnit a časově rozložit neoadjuvantní terapii u primárně inoperabilních či hůře chirurgicky přístupných tumorů.
ZÁVĚR
Většina praktických lékařů, chirurgů, patologů a onkologů se za celou svou profesní kariéru setká s GISTem vzácně, popřípadě vůbec ne. Špatně stanovená diagnóza může zpozdit léčbu, popřípadě již i úplně znemožnit jedinou kurativní, a to chirurgickou R0 resekci. Pacienti by měli být posíláni do specializovaných center, která mají s diagnostikou a léčbou tohoto typu sarkomu nejvíce zkušeností.
MZ ČR – RVO, FN v Motole 00064203
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martina Ševčíková
III. chirurgická klinika 1. LF UK a
FN Motol
V Úvalu 84
156 00 Praha 5
e-mail: martina.sevcikova@fnmotol.cz
Sources
1. Gold JS, Dematteo RP. Combined surgical and molecular therapy: the gastrointestinal stromal tumor model. Annals of surgery 2006;244 : 176−84.
2. Thomas RM, Sobin LH. Gastrointestinal cancer. Cancer 1995;75(suppl 1):154–70.
3. Smolarek S, Pomeroy E, Kinnarney F, et al. Laparoscopic resection of large gastric gastrointestinal stromal tumours. Wideochir Inne Tech Maloinwazyjne 2016; 11 : 31–7.
4. Mucciarini C, Rossi G, Bertolini F, et al. Incidence and clinicopathologic features of gastrointestinal stromal tumors. A population-based study. BMC Cancer 2007;20 : 230.
5. DeMatteo RP, Lewiss JJ, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Annals of surgery 2000;231 : 51−8.
6. Poveda A, Rivera F, Martín J. Spanish Group for Sarcoma Research (GEIS) SEOM (Spanish Society of Clinical Oncology) guidelines for gastrointestinal stromal sarcomas (GIST). Clinical and translational oncology 2012;14 : 536−40.
7. Gaal J, Stratakis CA, Carney JA, et al. SDHB immunohistochemistry: a useful tool in the diagnosis of Carney-Stratakis and Carney triad gastrointestinal stromal tumors. Mod Pathol 2011;24 : 147–151.
8. Hirota S, Isozaki K, Moriyama Y, et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science 1998; 279 : 577–80.
9. McCarter MD, Antonescu CR, Ballman KV, et al. American College of Surgeons Oncology Group (ACOSOG), Intergroup Adjuvant GIST Study Team. Microscopically positive margins for primary gastrointestinal stromal tumors: analysis of risk factors and tumor recurrence. J Am Coll Surg 2012;215 : 53–9
10. Bareck E, Ba-Ssalamah A, Brodowicz T, et al. Gastrointestinal stromal tumors: diagnosis, therapy and follow-up care in Austria. Wien Med Wochenschr 2013;163 : 137–52
11. Pierie J-PEN, Choudry U, Muzikansky A, et al. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg 2001;136 : 383–9.
12. Agaimy A, Wunsch PH. Lymph node metastasis in gastrointestinal stromal tumours (GIST) occurs preferentially in young patients ≤40 years: an overview based on our case material and the literature. Langenbecks Arch Surg 2009;394 : 375–81
13. Joensuu H, Roberts PJ, Sarlomo-Rikala M, et al. Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor. N Engl J Med. 2001;344 : 1052–6
14. Analýza registru GIST k 1. 11. 2016. ReGISTer: GIST 217. Available from: http://gist.registry.cz/index.php?pg=analyzy--analyza-registru-gist-k-1-11-2016
15. The ESMO / European Sarcoma Network Working Group. Gastrointestinal stromal tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Annals of Oncology 2012; 23 (suppl_7):vii49-vii55.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 12-
All articles in this issue
- Ruptury bránice
- Poranění hrudníku u dětí s polytraumatem
-
Assessment of thoracic trauma at the 1st Department of Surgery in Brno
(1 January 2011 – 31 December 2015) - Překvapivý nález při revizi hrudníku pro střelné poranění – kazuistika
- Myxoidní liposarkom v břišní dutině − kazuistika
- Překvapivý histologický nález v resekátu omenta pro uskřinutou pupeční kýlu
- Plicní kontuze
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Plicní kontuze
- Ruptury bránice
- Myxoidní liposarkom v břišní dutině − kazuistika
- Poranění hrudníku u dětí s polytraumatem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

