-
Medical journals
- Career
Myxoidní liposarkom v břišní dutině − kazuistika
: J. Cagaš; J. Korbička; A. Geršlová; T. Vystrčilová
: I. Chirurgická klinika LF Masarykovy univerzity a FN u sv. Anny v Brně přednosta: prof. MUDr. I. Čapov, CSc.
: Rozhl. Chir., 2017, roč. 96, č. 12, s. 514-516.
: Case Report
Úvod:
Liposarkom patří mezi měkkotkáňové tumory. Nejčastěji je lokalizován v měkkých tkáních na končetinách, může se však vzácně vyskytovat i v tělesných dutinách. Prognóza tumoru je závislá na lokalizaci a stupni diferenciace tumoru.Kazuistika:
Pacient po revizi a debulkingu myxoidního liposarkomu indikován k revizi pro recidivu, respektive perzistenci s progresí. Byla provedena laparotomie, znovu debulking včetně resekce rekta s koloanální anastomózou a protektivní ileostomií. Pooperačně příznivý průběh, v dalším sledování na zobrazovacích metodách opět recidiva.Závěr:
Myxoidní liposarkom je vzácným nádorem, při radikálním odstranění s relativně dobrou prognózou, v případě raritního intraperitoneálního uložení je však prakticky neřešitelným problémem.Klíčová slova:
liposarkom − debulking − recidivaÚVOD
Liposarkom vycházející z tukové tkáně je řazen mezi neobvyklé měkkotkáňové tumory. Ve dvou třetinách případů se tento tumor objevuje ve svalové tkáni, přičemž často imituje benigní vzhled jako většina měkkotkáňových nádorů. Prognóza je závislá především na lokalizaci a na histologických charakteristikách tumoru. Liposarkomy se mohou nacházet i v dutině břišní a dosahovat značných rozměrů. Dobře diferencované liposarkomy metastazují poměrně pozdě. Mohou však dediferencovat v pleomorfní sarkom, který ale již rychle zakládá metastázy, především plicní. Myxoidní variata liposarkomu je charakterizována cytogeneticky translokací FUS-CHOP t (12;16) (q13;p11.2) a o něco nižší malignitou. Recentně byly popsány i jiné chromozomální aberace, tyto jsou však identifikovatelné jen u méně než 5 % všech myxoidních liposarkomů – např. DDIT-EWSR1 t (12;22) (q13;q12) nebo t(2;4) (q23;p14) [1].
KAZUISTIKA
Pacient, muž, ročník 1961, byl po revizi a debulkingu v prosinci 2013 na jiném pracovišti pro primární tumorózní infiltraci v malé pánvi. Histologicky vyšel dobře diferencovaný myxoidní liposarkom, dle kontrolních zobrazovacích vyšetření však došlo k progresi tumoru v malé pánvi cca 12x10x10 cm v těsném kontaktu se semennými váčky, prostatou i rektální ampulí. K progresi došlo za cca 6 měsíců od primárního debulkingu. Vzhledem k rozsahu infiltrátu byla provedena radiofrekvenční ablace 6/2014, pacient byl bez výraznějších klinických obtíží. V dalším průběhu se objevil infiltrát v jizvě po původní operaci, byl exstirpován v srpnu 2015, histologicky znovu zjištěn myxoidní liposarkom (Obr. 1). Dle kontrolního MRI malé pánve a břicha v říjnu 2015 zjištěn téměř stacionární nález v malé pánvi, avšak došlo k rozsevu tumoru po dutině břišní, zjištěna vícečetná ložiska mezi kličkami, na peritoneu, mezenteriu i ve stěně břišní. Pacient byl i nadále bez klinických obtíží, bez poruchy pasáže. Vzhledem k rozsahu nálezu byla indikována operační revize s debulkingem jako ultimum refugium a provedena v listopadu 2015 s vícečetnými exstirpacemi tumorózních infiltrátů. Celkem šlo o 19 ložisek včetně resekátu v oblasti rekta s totální mezorektální excizí, koloanální anastomózou, apendektomií a protektivní ileostomií (Obr. 2−6). Po výkonu byl pacient stabilizován, ileostoma funkční, břicho měkké, prohmatné, dietní zátěž zvládal, rána se zhojila per primam. Pacient byl propuštěn 8. pooperační den do ambulantní péče. Histologicky byl ve všech infiltrátech potvrzen myxoidní liposarkom, operační revize byla však jen charakteru debulkingu, ve vícečetných ložiscích dosahovala infiltrace okraje resekátu. Pacient však stále neměl žádné klinické potíže ani poruchy pasáže. Na kontrolním CT břicha v lednu 2016 byla zjištěna opětovně ložiska ve stěně břišní a infiltrát presakrálně 50x19 mm. Zvažovanou okluzi ileostomie jsme pro nález na CT odložena. Pacient je dále na pracovišti pravidelně sledován se záměrem případné revize při vzniku obstrukce trávicího traktu či jiných příznaků expanzivního růstu.
1. Infiltrát v jizvě po předchozí laparotomii Fig. 1: Infiltrate in the scar after previous laparotomy 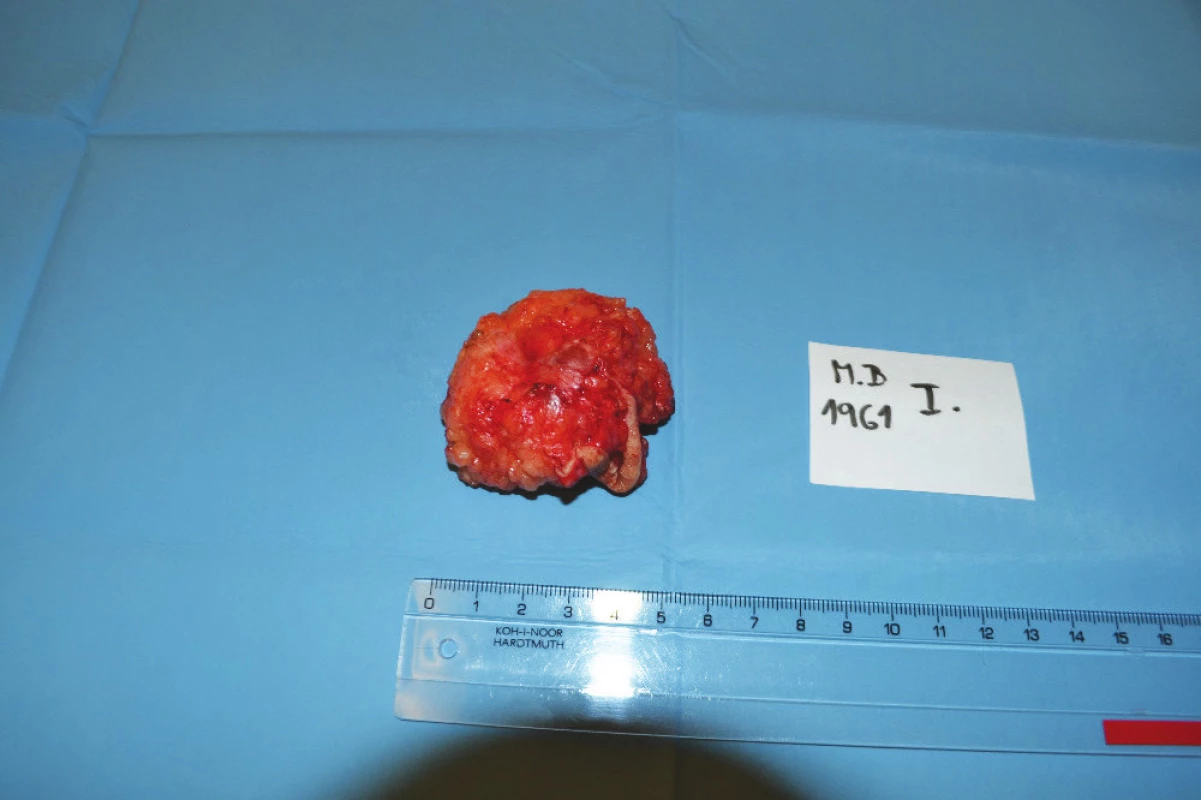
2. Infiltrát mezenteria Fig. 2: Mesenterial infiltrate 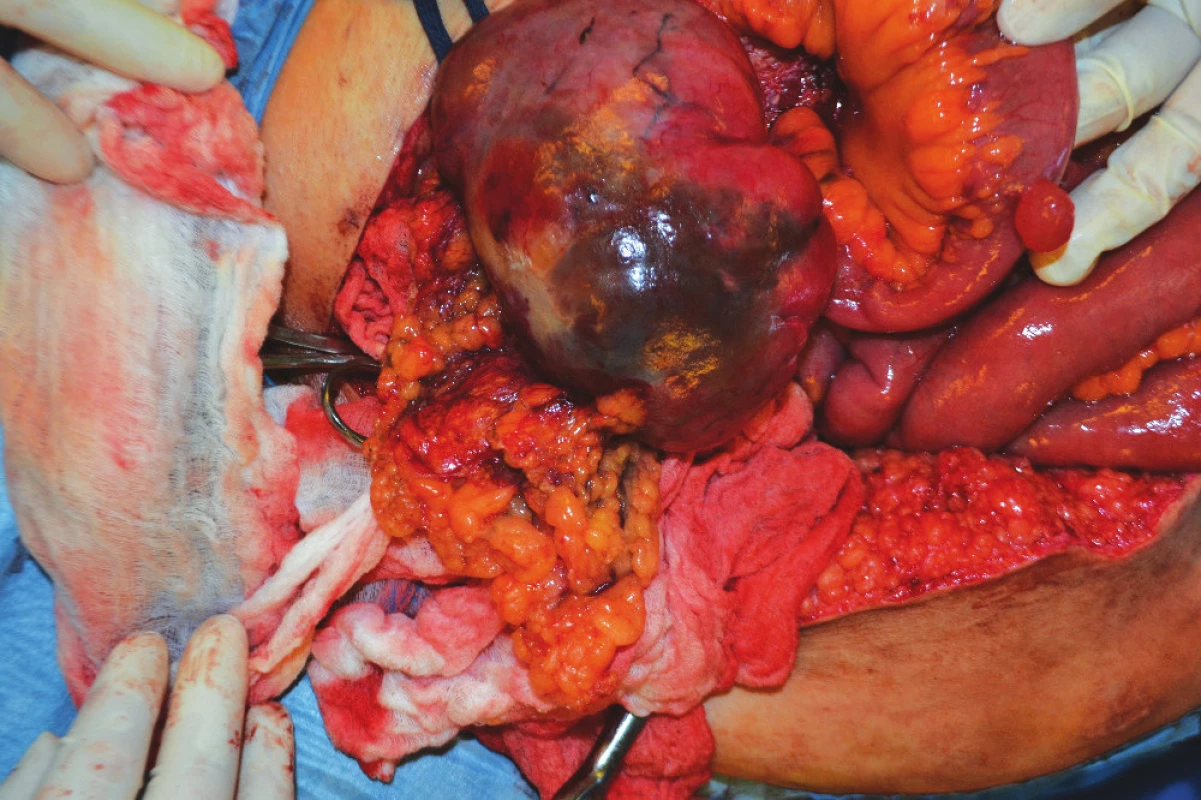
3. Infiltrát mezenteria po exstirpaci Fig. 3: Mesenterial infiltrate after removal 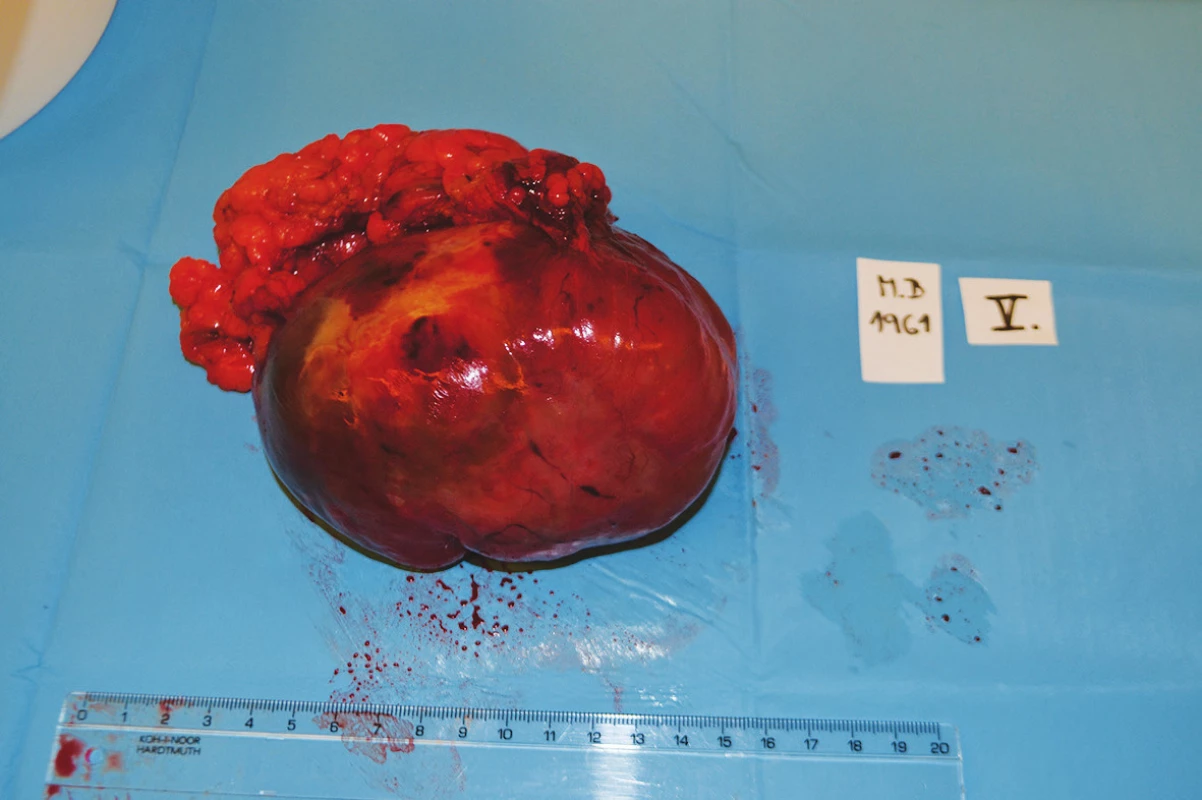
4. Jiný mezenteriální infiltrát po debulkingu Fig. 4: Another mesentarial infiltrate after removal 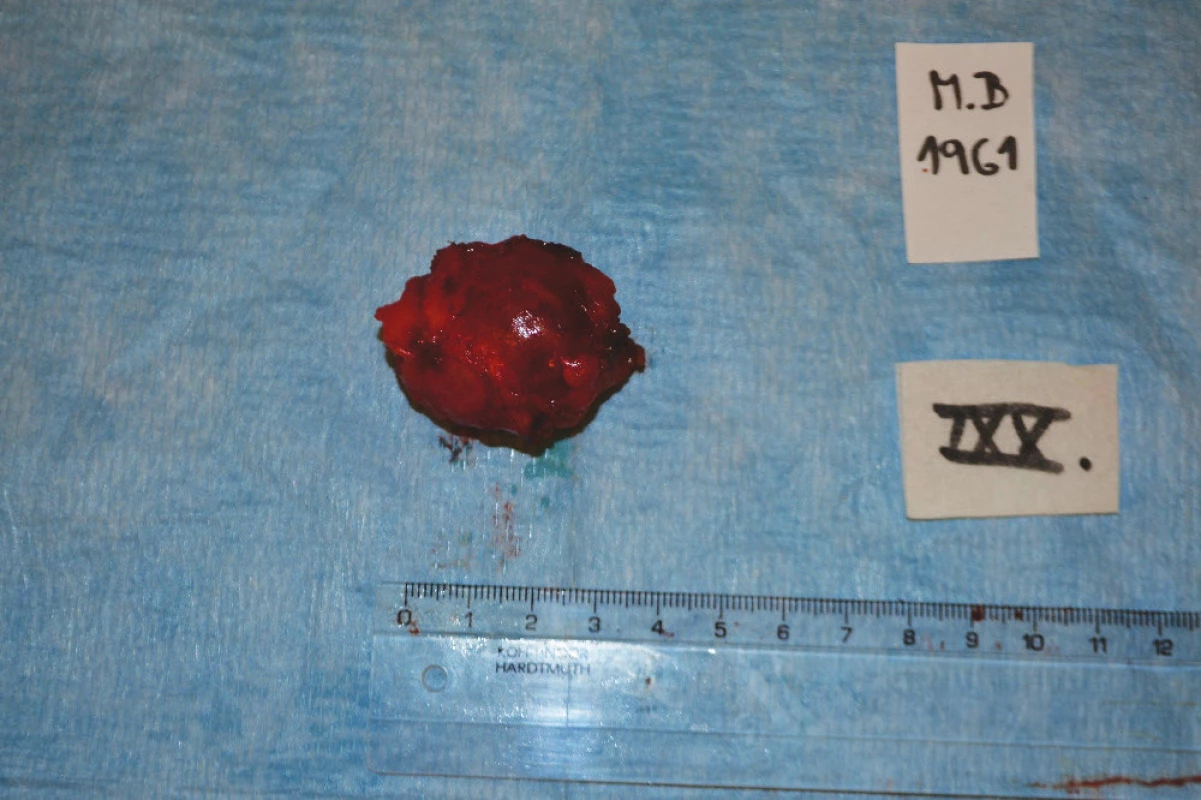
5. Infiltráty mezenteriální a peritoneální Fig. 5: Mesenterial and peritoneal infiltrates 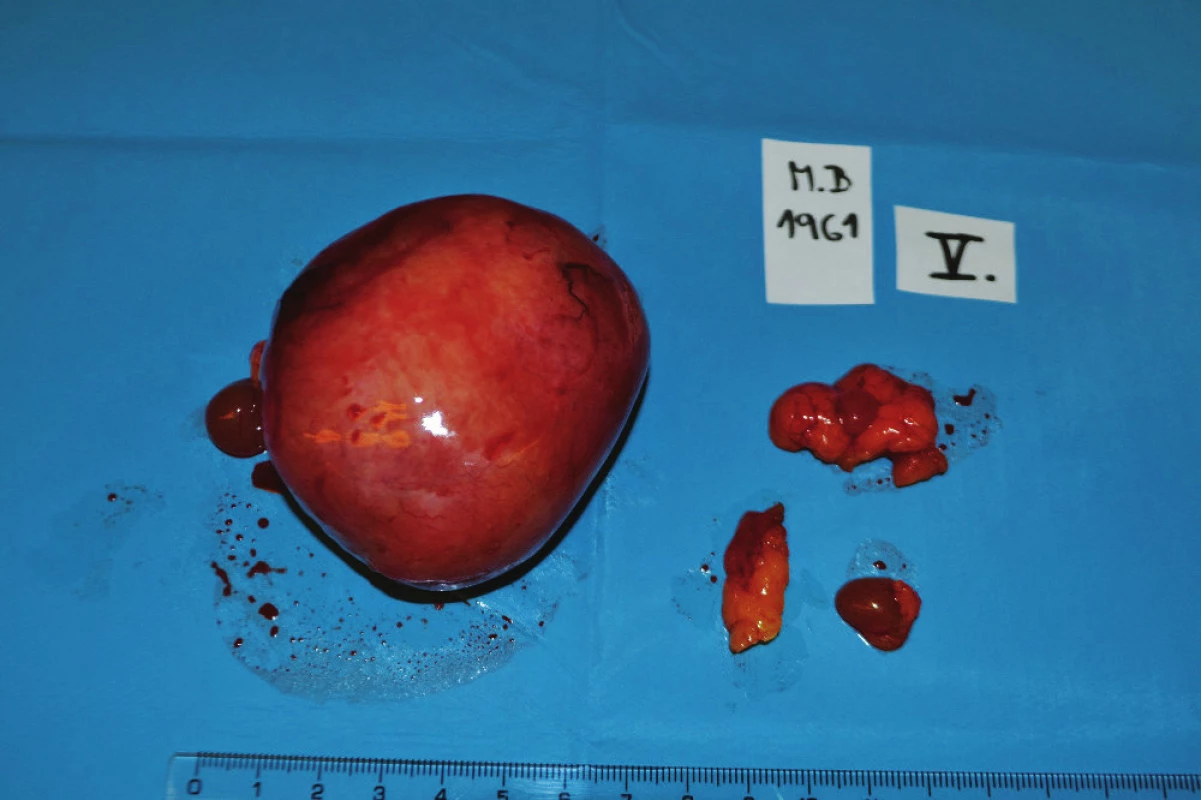
6. Resekát rekta Fig. 6: Rectal specimen 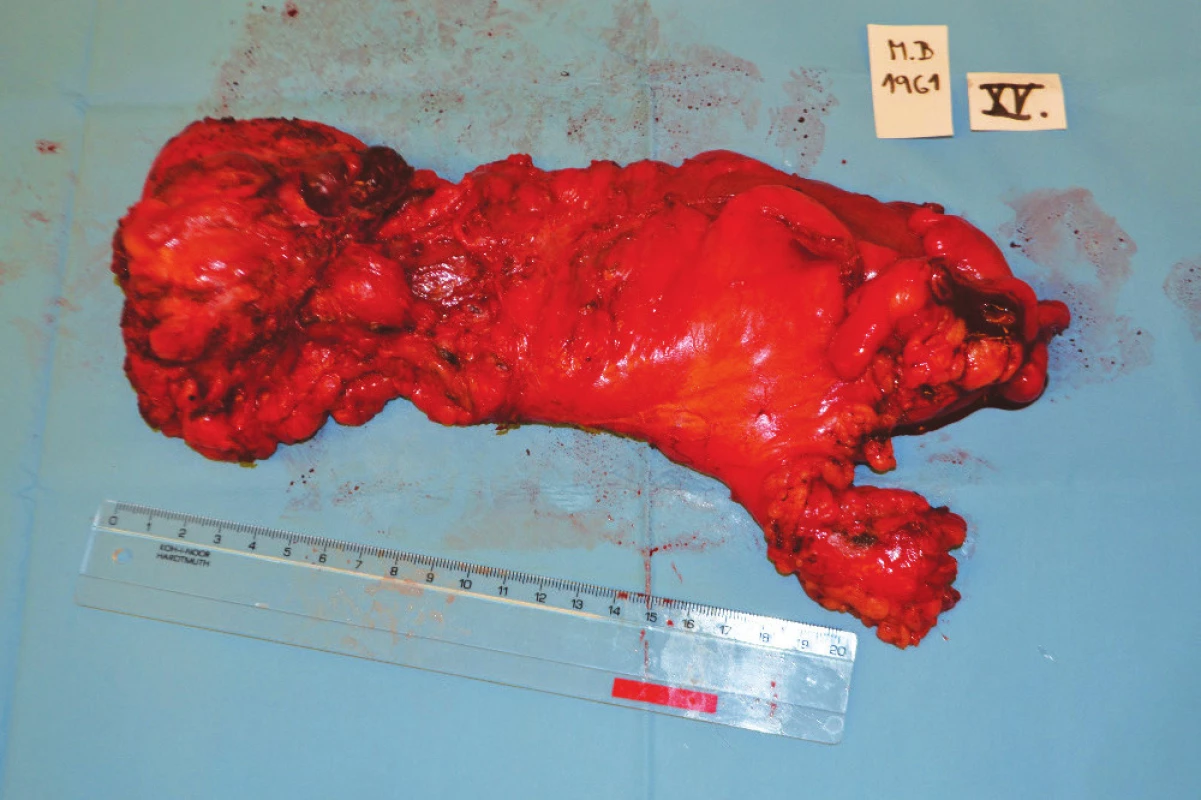
DISKUZE
Myxoidní liposarkom a kulatobuněčný liposarkom představují stejnou jednotku, neboť sdílejí tentýž genetický defekt – tedy translokaci 12;16 (FUS-CHOP). Myxoidní liposarkom může obsahovat rozdílné zastoupení kulatých buněk a dle tohoto se liší svou prognózou [2]. Stále není konsenzus ohledně procentuálního podílu kulatých buněk, což by pomohlo gradingu tumoru, avšak každý myxoidní liposarkom s podílem kulatých buněk vyšším než 10 % by měl vzbudit výraznou pozornost kvůli možnosti metastazování [2,3]. Myxoidní liposarkom se objevuje především ve stehně asi ve dvou třetinách případů, vzácně pak v retroperitoneu nebo v měkkých tkáních. Pro podobnost s nezhoubnými tumory je nutná přesná radiologická diagnostika infiltrátu. Histologická verifikace by měla být primárně prováděna pod navigací ultrazvuku či CT, v případě nedostupnosti ložiska pak chirurgickou cestou. U ložisek lokalizovaných periferně a v měkkých tkáních je třeba myslet na lokální recidivy v punkčním kanále či v jizvě po biopsii s nutností tyto excidovat při definitivní operaci s kurativním záměrem. Měkkotkáňové tumory často svým růstem roztlačením okolích měkkých tkání tvoří jakousi pseudokapsulu, je však chyba spokojit se s prostou enukleací tumoru pro téměř jistou lokální recidivu. I po radikálním odstranění tumoru spolu s fasciálním pouzdrem svalové skupiny je nutná adjuvantní radioterapie, respektive brachyterapie přímo v lůžku tumoru, v případě hlouběji uložených struktur, popřípadě ložisek v těsné blízkosti nervově cévních svazků je však nutno zvažovat amputaci. Lokální recidiva při prosté excizi je udávána mezi 50−93 % a liší se dle jednotlivých typů nádorů [4]. Obecně jsou sarkomy radiorezistentní a radiorezistence narůstá se snižujícím se gradingem. Chemoterapie je vzhledem k chemorezistenci spíše doplňkovou metodou a je předmětem klinických studií. U končetinových tumorů ji lze aplikovat i intraarteriálně. Nejčastěji užívanými preparáty jsou doxorubicin s ifosfamidem, dvojkombinace je účinnější než doxorubicin v monoterapii [5,6,7]. Radikální odstranění liposarkomu bývá problematické v případě tumorů lokalizovaných v tělesných dutinách. Důsledkem jsou lokální recidivy či perzistence tumoru s nutností opakovaných chirurgických intervencí a debulkingů. Kurativní resekce tak často nebývá možná. Jsou však recentně popsány i úspěchy s cílenou postoperační, frakcionovanou radioterapií, tzv. helikální tomoterapií. Technika se jeví efektivnější než radioterapie celé peritoneální dutiny jak v efektivitě a účinku na metastatické léze, tak v menším měřítku manifestace nežádoucích účinků konvenční radioterapie [8]. Po operaci je nutné pravidelné sledování nejméně v půlročních intervalech u pacientů s kurativním výkonem, v případě debulkingu pak častěji. Vzhledem k raritě liposarkomů a ještě větší vzácnosti myxoidních liposarkomů se v literatuře objevují spíše kazuistiky, nikoliv soubory pacientů. Celkově literatura uvádí 80% pětileté přežití a 50% desetileté, je však ovlivněno především kvalitou a radikalitou excize [9,10].
Závěr
Myxoidní liposarkom je vzácným nádorem, při radikálním odstranění s relativně dobrou prognózou, v případě raritního intraperitoneálního uložení je však prakticky neřešitelným problémem.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Jan Cagaš
Brechtova 10
638 00 Brno
e-mail: jancagas@gmail.com
Sources
1. Kiyani A, Heerema NA, Mayerson NL, et al. Novel clonal t(2;4) (q23;p14) secondary cytogenetic abnormality in a primary myxoid liposarcoma. Appl Immunohistochem Mol Morphol 2015;23 : 538−40.
2. Fletcher CDM. Will we ever reliably predict prognosis in a patient with myxoid and round cell liposarcoma? Adv Anat Pathol 1997;4 : 108−13.
3. Guillou L, Coindre JM. Grade histopronostique des sarcomes des tissus mous de l`adulte. Ann Pathol 1998;18 : 473−80.
4. Dujardin F, Debled M, Guillemet C, et al. Prise en charge des tumeurs des parties molles de l’appareil locomoteur de l’adulte. Rev Chir Orthop 2006;92 : 637−50.
5. Kollar A, Benson C. Current management options for liposarcoma and challenges for the future. Expert Rev Anticancer Ther 2014;14 : 297−306.
6. Judson I, Verweij J, Gelderblom H, et al. Doxorubicin alone versus intensified doxorubicin plus ifosfamide for first-line treatment of advanced or metastatic soft-tissue sarcoma: a randomised controlled phase 3 trial. Lancet Oncol 2014;15 : 415–23.
7. Eilber FC, Eilber FR, Eckardt J, et al. The impact of chemotherapy on the survival of patients with high-grade primary extremity liposarcoma. Ann Surg 2004;240 : 686–95.
8. Choi Ch, Park JH, Lee ChG, et al. Succesful salvage treatment of myxoid liposarcoma with multiple peritoneal seeding using helical tomotherapy-based intraperitoneal radiotherapy: a case report. BMC Res Notes 2015;8 : 179.
9. Kilpatrick SE, Doyon J, Choong PFM, et al. The clinicopathologic spectrum of myxoid and round cell liposarcoma. Cancer 1996;77 : 1450–8.
10. Loubignac F, Bourtoul Ch, Chapel F. Myxoid liposarcoma: a rare soft-tissue tumor with a misleading benign appearance. World J Surg Oncol 2009;7 : 42.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 12-
All articles in this issue
- Ruptures of the diaphragm
- Chest injuries in polytraumatized children
-
Assessment of thoracic trauma at the 1st Department of Surgery in Brno
(1 January 2011 – 31 December 2015) - Surprising findings during thoracic revision due to gunshot injury – a case report
- Myxoid liposarcoma localised in the peritoneal cavity − case report
- Surprising histological findings on the resected specimen of the omentum due to a strangulated umbilical hernia
- Pulmonary contusion
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pulmonary contusion
- Ruptures of the diaphragm
- Myxoid liposarcoma localised in the peritoneal cavity − case report
- Chest injuries in polytraumatized children
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

