-
Medical journals
- Career
Smíšený adenoneuroendokrinní karcinom (MANEC) gastrointestinálního traktu
Authors: R. Šefr 1; L. Němec 1; P. Fabian 2; L. Fiala 1
Authors‘ workplace: Klinika operační onkologie Masarykova onkologického ústavu Brno a LF Masarykovy univerzity přednosta: doc. MUDr. R. Šefr, Ph. D. 1; Oddělení onkologické patologie, Masarykův onkologický ústav Brno primář: MUDr. P. Fabian, Ph. D. 2
Published in: Rozhl. Chir., 2017, roč. 96, č. 1, s. 41-44.
Category: Case Report
Overview
Smíšený adenoneuroendokrinní karcinom (MANEC) gastrointestinálního traktu je vzácným nádorem tvořeným adenokarcinomem a neuroendokrinním karcinomem. Recentně byl definován Světovou zdravotnickou organizací v roce 2010. Může se vyskytovat v různých úrovních zažívacího traktu od jícnu přes žaludek, tračník až po appendix. Biologické chování MANEC je špatně předvídatelné a prognóza zejména u pokročilých případů nepříznivá. Nebezpečí onemocnění také spočívá v možnosti imitace „prostého“ karcinomu. Ve světové literatuře je referováno řádově o desítkách případů, nejčastěji ve formě kazuistik.
První kazuistika pojednává o 47letém muži s dyspepsií, u něhož byl primárně diagnostikován adenokarcinom žaludku. Ve druhém případě šlo o incidentální nález MANEC v appendixu 69leté nemocné po operaci pro gynekologickou malignitu. U obou pacientů bylo onemocnění lokalizováno a podstoupili radikální chirurgický výkon.
Léčba MANEC není dosud standardizována, ale je doporučován agresivní léčebný postup. Pacienti mohou profitovat z multimodální protinádorové léčby.Klíčová slova:
smíšený adenoneuroendokrinní karcinom – MANEC – karcinom žaludku – karcinom appendixuÚvod
Smíšený adenoneuroendokrinní karcinom (MANEC) je relativně vzácně se vyskytující nádor sestávající ze složky adenokarcinomu a neuroendokrinního karcinomu, z nichž každá se podílí minimálně 30 % na objemu nádoru. Takto jej nově definuje World Health Organization (WHO) od roku 2010. Předchozí definice WHO hovořila o nádorech sestávajících z adenokarcinomu a neuroendokrinního nádoru jako o smíšených exokrinních-endokrinních nádorech.
V současné době v literatuře najdeme většinově pouze kazuistiky s tímto typem nádoru lokalizovaným na různých úrovních zažívacího traktu, jícnem počínaje a tračníkem konče [1,2].
Nejčastější výskyt byl zaznamenán v appendixu, publikované kazuistiky dále hovoří o jícnu, žaludku, duodenu, slinivce, žlučových cestách, tenkém a tlustém střevě i o neznámém origu v gastrointestinálním traktu [3,4].
Jeden z prvních souborů celkem 46 pacientů s MANEC byl publikován recentně [3]. Šlo o retrospektivní analýzu 15letého období včetně zhodnocení nálezů patologem, a to i druhých čtení z jiných institucí než autorského kolektivu.
Zde uvádíme dva případy smíšeného adenoneuroendokrinního karcinomu žaludku a appendixu s upozorněním na tuto nosologickou jednotku s nutností její agresivní léčby.
Kazuistika 1
Muž, 47 let, bez přidružených onemocnění, bez váhového úbytku; pro přechodnou dyspepsii provedena gastroskopie v regionálním zdravotnickém zařízení s nálezem lokalizované slizniční nerovnosti a hyperemie průměru 12 mm v oblasti žaludečního těla; byla provedena biopsie. Histologický popis: v intramukózní lokalizaci zastiženy struktury adenokarcinomu, orientačně G3, v terénu těžké aktivní chronické gastritidy s pokročilou atrofií, intestinální metaplazií a low-grade dysplazií v diagnostických mikroexcizích gastrické sliznice.
Pacient byl v srpnu 2015 odeslán s výše uvedeným nálezem do MOÚ, kdy byla provedena stagingová endosonografie stěny – výše popsaná léze infiltruje submukózu, bez perigastrické lymfadenopatie. Stagingové CT břicha neprokázalo uzlinové, jaterní či jiné vzdálené metastázy.
Iniciální diagnóza: G3 adenokarcinom žaludku, cT1b N0M0.
Komisí digestivní onkologie byl indikován primární resekční výkon, který byl proveden dne 23. 9. 2015 – totální gastrektomie, D2 lymfadenektomie, cholecystektomie, založení výživné jejunostomie.
7. pooperační den bylo provedeno CT s perorálně podanou kontrastní látkou, byla potvrzena suficience ezofagojejunoanastomózy. Pacient byl postupně zatížen stravou, kterou dobře toleroval, pasáž gastrointestinálním traktem se obnovila, operační rána se zhojila primárně.
Definitivní histologie resekátu (Obr. 1): intramukózní adenoneuroendokrinní karcinom (MANEC) žaludku, pT1a pN0 M0, G3, bez metastáz v mízních uzlinách (0/18), bez angioinvaze. Resekční linie bez nádorové infiltrace. Těžká chronická gastritis, HP negativní (Obr. 2, 3).
Image 1. Preparát žaludku s infiltrací adenoneuroendokrinním karcinomem Fig. 1: Gastric specimen – infiltration with mixed adenoneuroendocrine carcinoma 
Image 2. Skupina karcinomových buněk (uprostřed) ve sliznici žaludeční Originální zvětšení 200x, HE (hematoxylin, eosin). Fig. 2: Group of cancer cells (in the middle) in gastric mucosa Original magnification 200x, HE (haematoxylin, eosin 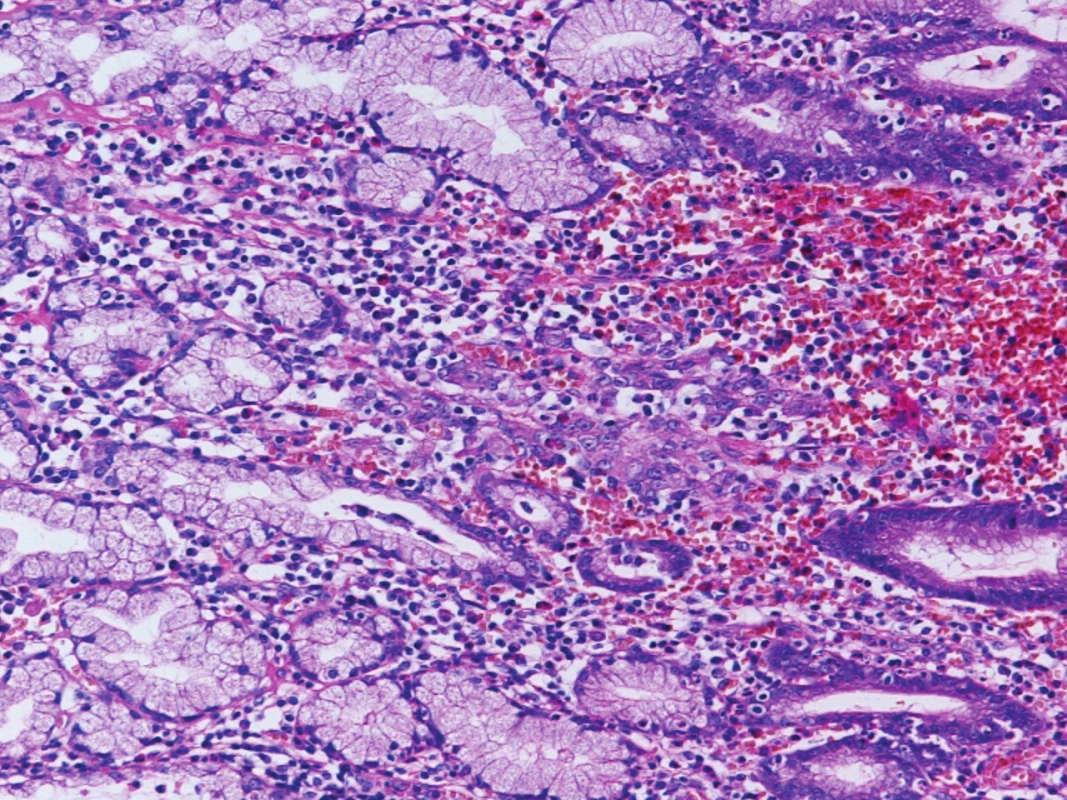
Image 3. Infiltrující karcinomové struktury ve sliznici žaludeční - v imunohistochemickém průkazu cytokeratinů Originální zvětšení 100x Fig. 3: Infiltrating carcinoma structures in gastric mucosa – immunohistochemical cytokeratins evidence Original magnification 100x 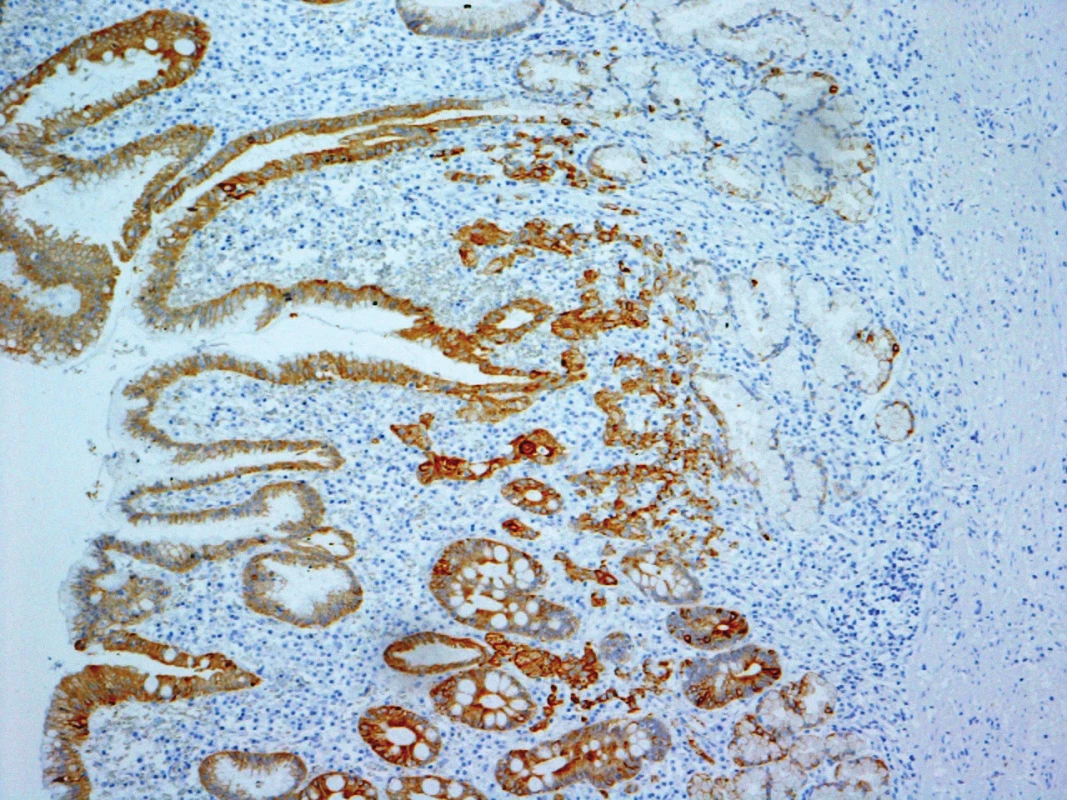
Adjuvantní léčba indikována nebyla. Pacient je dispenzarizován v onkologické ambulanci MOÚ, dochází do nutriční poradny, poslední kontrola v září 2016 – trvá remise onemocnění.
Kazuistika 2
Žena, lékařka, 69 let, s anamnézou hypertenze, ve 48 letech věku podstoupila hysterektomii pro descenzus dělohy. Od ledna 2015 opakovaně nachlazená, dušná, celkově slabá, pro tyto obtíže byla praktickým lékařem opakovaně léčena antibiotiky. Bolesti ani váhový úbytek neudávala.
V dubnu 2015 byl proveden RTG plic s nálezem bilaterálního fluidothoraxu, ultrazvuk dutiny břišní s nálezem ascitu. Provedeno CT břicha – popsána hepatomegalie, drobné jaterní cysty, cholecystolithiáza, infiltrativní změny omenta a peritonea a expanzní proces levého ovaria (tumor průměru 4 cm).
Pacientka byla odeslána do MOÚ, kde byl za hospitalizace evakuován fluidothorax (700 ml, cytologicky bez přítomnosti maligních buněk) a pod CT provedena biopsie omenta. Histologické hodnocení: metastáza nemucinózního ovariálního karcinomu, v. s. serózní ovariální karcinom. Z nádorových markerů byl pozitivní CA125 : 2 971 kU/l.
Iniciální diagnóza: karcinom ovaria cT3c NX M1
Zahájena byla systémová léčba – chemoterapie v režimu docetaxel/karboplatina s plánovaným restagingem po 3 cyklech. Průběh tří cyklů chemoterapie byl bez komplikací.
Dne 25. 6. 2015 bylo provedeno restagingové CT: regrese fluidothoraxu, ascitu i infiltrace omenta a peritonea, pouze diskrétní rezidua infiltrace pod břišní stěnou vlevo v mezogastriu, regrese expanze levého ovaria – průměr ložiska nyní 10 mm. Na játrech stacionární drobné cystické léze.
Byla indikována operační revize s perspektivou radikálního resekčního výkonu, operace byla provedena dne 9. 7. 2015 (onkogynekologický tým MOÚ), peroperační nález: dutina břišní bez ascitu, pravé ovarium atrofické vel. 1x1 cm, levé ovarium vel. 2x1 cm, s adherencí k pánevnímu peritoneu, appendix délky 8 cm, klidný. Parietální i viscerální peritoneum bez infiltrativních změn. Byla provedena bilaterální adnexektomie, pánevní a paraaortální lymfadenektomie, appendektomie a subtotální omentektomie.
Pooperační průběh byl bez komplikací, pouze s prolognovanou lymfatickou sekrecí z břišního drénu (do 12. pooperačního dne, kdy byl drén extrahován), pacientka byla 13. pooperační den propuštěna do domácí péče.
Histologie: adnexa atrofická, s rozsáhlými reparativními změnami, v levé tubě reziduální karcinom, odpovídající dříve diagnostikovanému seróznímu ovariálnímu karcinomu. Grade pro proběhlou terapii nebyl stanovený. Obraz subtotální regrese, TRG2 (Mandard). Zastiženo celkem 39 LU, bez malignity (0/39), ypT2a ypN0. Omentum s reparativními změnami, bez malignity. Laváž bez průkazu neoplazie. Apendix (Obr. 4) s reparativními změnami a zastiženým smíšeným adenoneuroendokrinním karcinomem (MANEC), zcela ojediněle infiltrujícím subserózu, bez zjevné angioinvaze, ypT3 (Obr. 5, 6). Velikost nelze jednoznačně stanovit, odhadem 10–20 mm. Resekční okraj intaktní.
Image 4. Preparát appendixu Fig. 4: Appendix specimen 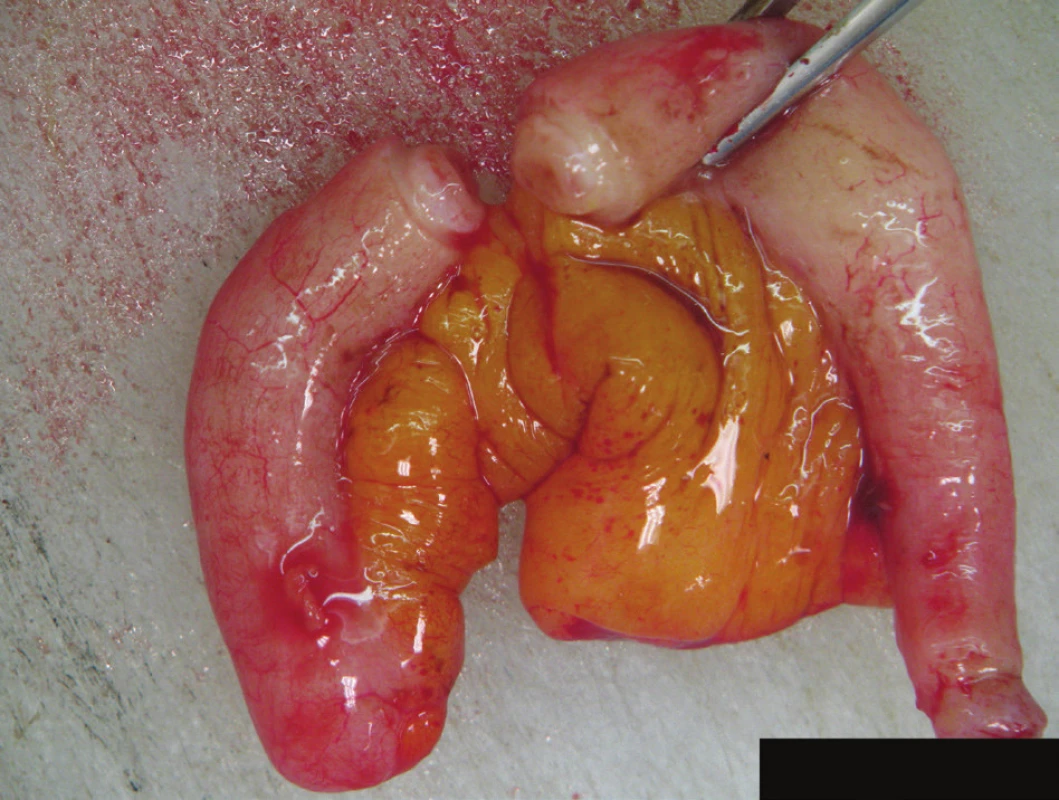
Image 5. Trabekulární a tubulární struktury karcinomu infiltrující muscularis propria apendixu Originální zvětšení 100x, HE (hematoxylin, eosin). Fig. 5: Trabecular and tubular carcinoma structures infiltrating muscularis propria layer of the appendix Original magnification 100x, HE (haematoxylin, eosin). 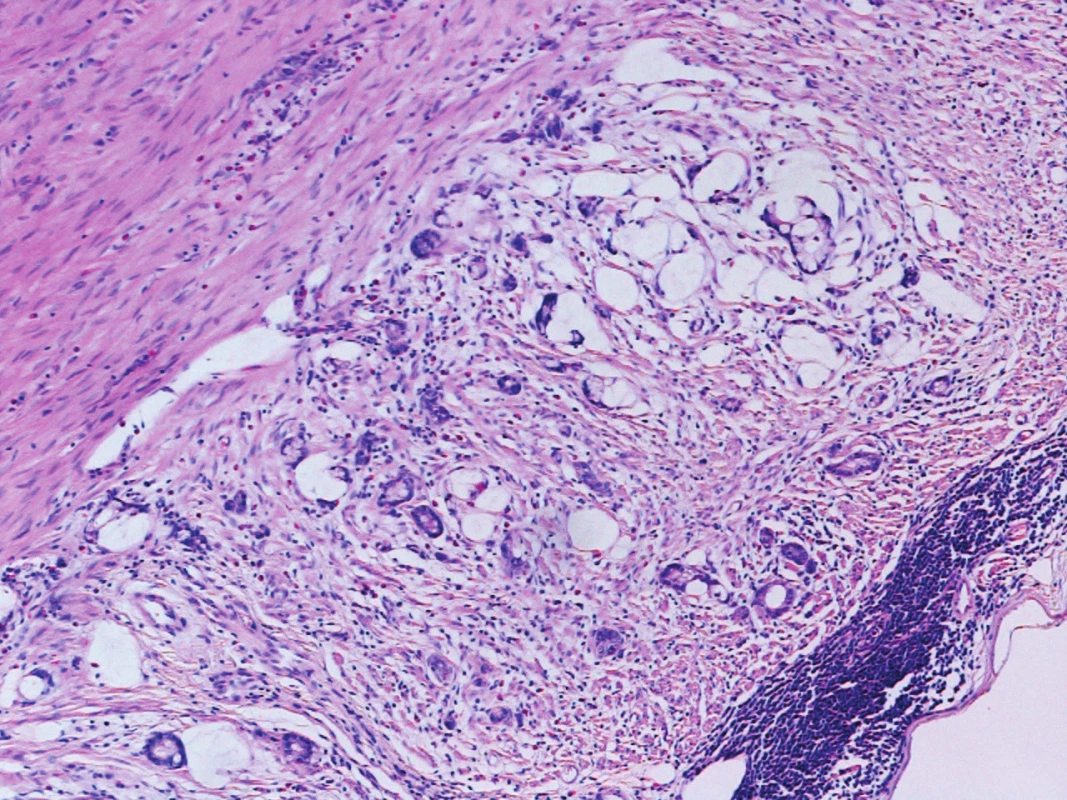
Image 6. Pozitivita nádorových buněk v imunohistochemickém průkazu Chromograninu A (Originální zvětšení 400x) Fig. 6: Tumour cells positivity based on immunohistochemical analysis of chromogranin A (Original magnification 400x) 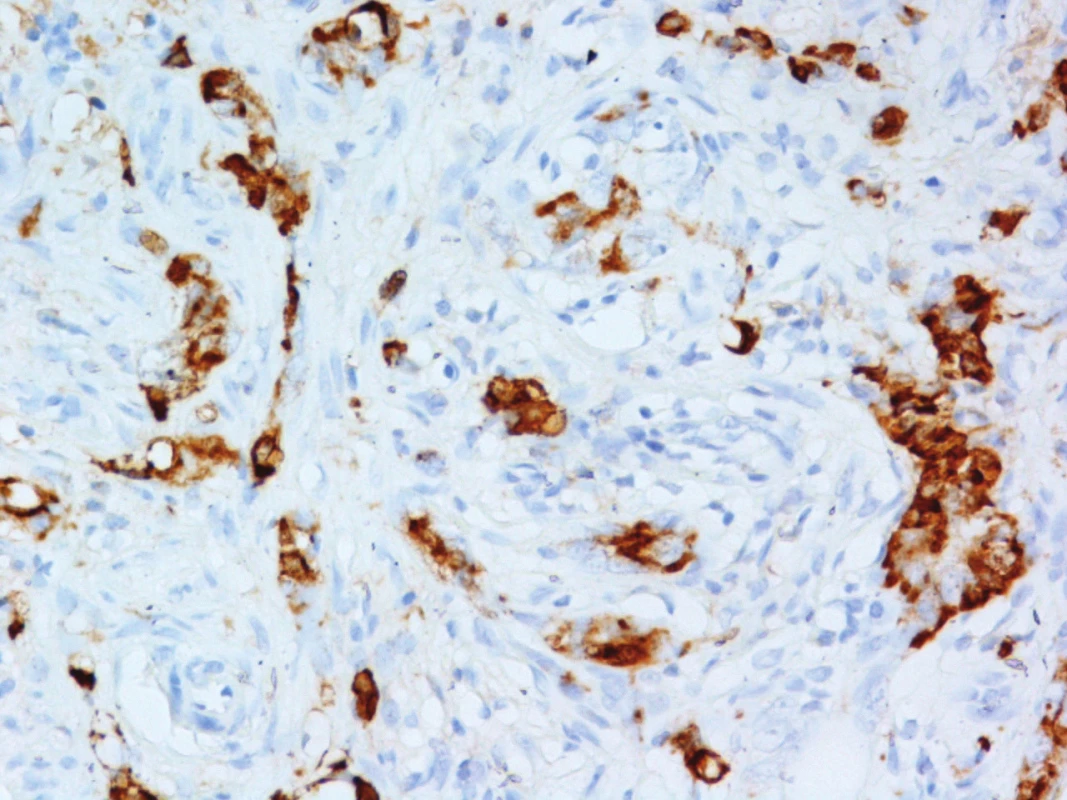
Pooperačně pacientka podstoupila další 3 cykly chemoterapie ve stejném režimu, vzhledem k histologickému nálezu na appendixu byla Komisí digestivní onkologie doporučena radikalizující operace. Doplněna byla také koloskopie – s negativním nálezem.
Dne 30. 9. 2016 pacientka v MOÚ podstoupila radikalizujíci operaci v rozsahu pravostranné hemikolektomie (onkochirurgický tým), pooperační průběh byl bez komplikací.
Histologické hodnocení střevního resekátu: bez nálezu rezidua neoplazie v pravostranné hemikolektomii. Mízní uzliny negativní (0/10). Bez nálezu onkologicky suspektních buněk v cytologii z dutiny břišní.
Pacentka je dispenzarizována v onkologické ambulanci MOÚ, poslední kontrola v listopadu 2016 – trvá remise onemocnění.
Diskuze
Smíšený adenoneuroendokrinní karcinom se vyvinul do dnešní podoby klasifikace od roku 1924, kdy byl poprvé popsán Cordierem [5]. Poslední WHO klasifikace MANEC z roku 2010 je založena na stupni buněčné diferenciace, proliferační aktivity a objemu jednotlivých složek nádoru [6].
MANEC je považován za rychle rostoucí nádor, jenž frekventně invaduje do lymfatického a cévního řečiště a zakládá metastázy uzlinové a jaterní, a to i v časném stadiu onemocnění, což je dáno jeho agresivním biologickým chováním. Karcinogeneze MANEC zůstává nejasná. V případě postižení žaludku je vysoce pravděpodobně spjata s výskytem neuroendokrinního karcinomu, jenž v 70 % případů měl komponentu adenokarcinomu [7]. Je to právě neuroendokrinní složka, která bývá až v 90 % případů špatně diferencovaná, s vyšším stupněm proliferace. Agresivita nádoru je závislá na jeho endokrinní komponentě, a to i bez ohledu na objem jejího zastoupení [8].
Průměrné celkové přežití od stanovení diagnózy bylo popsáno 21 měsíců na malém souboru 30 pacientů [9]. U pacientů s metachronním metastatickým onemocněním v této skupině byl medián do relapsu onemocnění 11,7 měsíce. Nemocní léčení kombinovanou léčbou chirurgickou a systémovou chemoterapií a/nebo radioterapií z multimodální léčby významně profitovali, kdy celkové přežití bylo 44,5 měsíce versus samotná léčba chirurgická 16,9 měsíce (p=0,047).
V případě žaludeční lokalizace bývá zpravidla nádor diagnostikován z iniciální biopsie jako adenokarcinom, což může vést i k méně radikální intervenci, zejména v případech tzv. early gastric cancer [10]. Složka adenokarcinomu obvykle odpovídá slizničním změnám, submukózní infiltrace pak obsahuje neuroendokrinní komponentu tumoru. Podobně tomu bylo i v kazuistice 1, kdy nádor žaludku byl externě zhodnocen jako adenokarcinom s nízkým stupněm diferenciace, proto byl volen agresivnější chirurgický postup. Teprve definitivní histologické vyšetření explantátu odhalilo MANEC v terénu těžké chronické gastritidy, bez metastáz v mízních uzlinách.
I u drobných nádorů MANEC žaludku bývá doporučována totální gastrektomie, a to i jako druhý výkon po předchozí endoskopické intervenci (submukózní resekci). Sakatani takto referuje o 8mm nádoru, považovaném iniciálně za adenokarcinom podobně jako Fukuba o nádoru průměru 5 mm [7, 10].
Ve druhém případě byl zjištěn MANEC appendixu jako incidentální nález po gynekologické operaci. Primární MANEC appendixu je považován za velmi vzácný a udávaná frekvence výskytu se pohybuje mezi 0,9−1,4 % nálezů všech histologicky vyšetřovaných appendixů [11]. Vzhledem ke klasifikaci ypT3 byla indikována radikalizující operace v rozsahu pravostranné hemikolektomie a odběr cytologie z dutiny břišní. Všechny odebrané materiály již byly histologicky negativní včetně vyšetření mízních uzlin. Vzhledem k nálezům a odpovídající terapii očekáváme u obou pacientů dobrou prognózu, přesto je namístě obezřetná dispenzarizace.
Optimální léčebná strategie není pro MANEC jednoznačně stanovena, agresivnější složka nádoru by měla být hlavním cílem terapie [12]. Obecně platí, že pro léčbu lokoregionálního onemocnění je základem radikální chirurgický výkon. U metastatického onemocnění pak systémová paliativní chemoterapie. Zdá se, že prognóza onemocnění je také závislá na jeho lokalizaci, kdy MANEC žaludku má příznivější průběh než v situacích, kdy origo nádoru je kolorektální [12].
Závěr
Ve dvou kazuistikách je popsán vzácný typ smíšeného adenoneuroendokrinního karcinomu podle definice WHO z roku 2010. Literární údaje jsou zatím kusé, nejčastěji právě ve formě kazuistik. Vzhledem k biologickému chování nádoru vyžaduje lokalizované onemocnění agresivní chirurgický přístup podložený rozhodnutím multidisciplinárního indikačního týmu, protože pacienti mohou profitovat z multimodální protinádorové léčby. Problémem může být časná diagnostika nebo skutečnost, že MANEC imituje „prostý“ adenokarcinom.
Podpořeno MZ ČR - RVO (MOÚ, 00209805).
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Doc. MUDr. Roman Šefr, Ph.D.
Klinika operační onkologie MOÚ a LF MU Brno
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: sefr@mou.cz
Sources
1. Acosta AM, Wiley EL. Primary biliary mixed adenoneuroendocrine carcinoma (MANEC): A short review. Arch Pathol Lab Med 2016;140 : 1157−62.
2. Kadhim MM, Jespersen ML, Pilegaard HK, et al. Mixed adenoneuroendocrine carcinoma is a rare but important tumour found in the oesophagus. Case Rep Gastrointest Med 2016;2016 : 9542687.
3. Brathwaite S, Rock J, Yearsley MM, et al. Mixed adeno-neuroendocrine carcinoma: An aggressive clinical entity. Ann Surg Oncol 2016;23 : 2281−6.
4. Max N, Rothe A, Langner C. Mixed adenoneuroendocrine carcinoma of the ampulla of Vater: A case report. Mol Clin Oncol 2016;5 : 95−8.
5. Cordier R. Les cellules argentaffines dans les tumeurs intestinales. Arch Int Med Exp 1924;1 : 59.
6. Bosman FT, Carneiro F, Hruban RH, et al. WHO classification of tumours of the digestive system. 4th ed. Lyon, IARC Press 2010 : 64−8.
7. Fukuba N, Yuki T, Ishihara S, et al. Gastric mixed adenoneuroendocrine carcinoma with a good prognosis. Intern Med 2014;53 : 2585−8.
8. Gurzu S, Kadar Z, Bara T, et al. Mixed adenoneuroendocrine carcinoma of gastrointestinal tract: report of two cases. World J Gastroenterol 2015;21 : 1329−33.
9. Apostolidis L, Bergmann F, Jaeger D, et al. Treatment outcomes of patients with mixed adenoneuroendocrine carcinoma (MANEC). J Clin Oncol 2015; 33 (suppl abstr e15187).
10. Sakatani A, Shinzaki S, Hayashi Y, et al. A case of gastric mixed adenoneuroendocrine carcinoma with difficulty in diagnosis before endoscopic submucosal dissection. Nihon Shokakibyo Gakkai Zasshi 2016;113 : 1909−15 (abstract).
11. Connor SJ, Hanna GB, Frizelle FA. Appendiceal tumors: retrospective clinicopathologic analysis of appendiceal tumors from 7,970 appendectomies. Dis Colon Rectum 1998;41 : 75−80.
12. Koshy R, Allam H. Gastric mixed adeno-neuroendocrine carcinoma (MANEC) – A case & review. Eur J Surg Oncol 2014;40 : 156.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 1-
All articles in this issue
- Skúsenosti s liečbou hepatoblastómu u najmenších detí – využitie predoperačnej 3D virtuálnej analýzy MeVis pri resekciách pečene
- Vnitřní kýla jako příčina ileu tenkého střeva
- Multiorgánová chirurgická resekce pro rozsáhlý lymfom dutiny břišní
- Smíšený adenoneuroendokrinní karcinom (MANEC) gastrointestinálního traktu
- Kolorektální karcinom − význam lokalizace primárního nádoru
- Iatrogénne lézie žlčových ciest vyžadujúce chirurgickú rekonštrukciu − prezentácia a klasifikácia poranení, spôsob rekonštrukcie, hodnotenie výsledkov
- Použitie podtlakovej terapie pri fixácii meshovaných voľných kožných transplantátov
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vnitřní kýla jako příčina ileu tenkého střeva
- Kolorektální karcinom − význam lokalizace primárního nádoru
- Iatrogénne lézie žlčových ciest vyžadujúce chirurgickú rekonštrukciu − prezentácia a klasifikácia poranení, spôsob rekonštrukcie, hodnotenie výsledkov
- Skúsenosti s liečbou hepatoblastómu u najmenších detí – využitie predoperačnej 3D virtuálnej analýzy MeVis pri resekciách pečene
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

