-
Medical journals
- Career
Splenóza ako zriedkavá príčina bolestí brucha
: M. Smolár; J. Lúčan; I. Dedinská; M. Hošala; Ľ. Laca
: Chirurgická klinika a Transplantačné centrum, UN Martin prednosta: prof. MUDr. Ľ. Laca, PhD.
: Rozhl. Chir., 2016, roč. 95, č. 4, s. 168-171.
: Case Report
Úvod:
Splenóza predstavuje autotransplantáciu tkaniva sleziny do atypických miest v brušnej dutine, hrudníku alebo iných častiach organizmu.Kazuistika:
Autori popisujú prípad splenózy u 35 ročnej ženy, ktorá bola hospitalizovaná s bolesťami brucha, a u ktorej bola pred 19 rokmi vykonaná splenektómia pre traumatickú ruptúru s implantáciou časti sleziny do omenta. Pre intenzívne ťažkosti bola indikovaná chirurgická revízia. Histopatológ potvrdil diagnózu splenózy v exstirpovanom tkanive.Záver:
Napriek upusteniu od autotransplantácie tkaniva sleziny po splenektómii sa môže chirurg stále stretnúť s diagnózou splenózy u pacientov po traumatických ruptúrach sleziny. Každý náhodný nález splenózy pri inej operácii je vhodné histologizovať.Kľúčové slová:
splenóza – splenektómia − bolesti brucha − scintigrafiaÚvod
Splenóza je autotransplantácia tkaniva sleziny na atypické miesto. Podľa inej definície ide o implantáciu a následný rast slezinného tkaniva ako následok disrupcie sleziny po operácii alebo traume. Najčastejším miestom splenózy je brušná dutina alebo malá panva. Zriedkavo sa vyskytuje aj intratorakálne, subkutánne, intrahepatálne a intrakraniálne.
Implantáty slezinnej pulpy vyzerajú ako červeno-modré uzlíky na peritoneu, omente a mezentériu. Morfologicky sa podobajú na multifokálnu pelvickú endometriózu.
Heterotopická autotransplantácia tkaniva sleziny do dutiny brušnej bola v nedávnej minulosti pomerne častou metódou slúžiacou na zachovanie funkcie sleziny po vynútenej, či plánovanej splenektómii. Kým v pediatrickej chirurgii implantácia tkaniva sleziny má stále svojich zástancov, v chirurgii dospelých bola táto metóda postupne vytlačená zavedením vakcinácie polyvalentným purifikovaným polysacharidom Streptococcus pneumoniae ako formou prevencie pred infekciou spôsobenou rôznymi sérotypmi pneumokoka, vrátane ochrany pacienta pred fulminantnou postsplenektomickou sepsou – OPSI (Overwhelming Postsplenectomy Infection).
Napriek upusteniu od využívania metódy autotransplantácie tkaniva sleziny do peritoneálnej dutiny sa môže chirurg aj dnes stretnúť s pacientom so splenózou. Splenóza je vo väčšine prípadov asymptomatická, no v poslednom období pribúdajú práce popisujúce rôzne intraabdominálne problémy spojené so splenózou – od abdominalgií, krvácanie, cez subileózne stavy až po diferenciálno-diagnostické ťažkosti pri imitácii tumorov v rôznych častiach brušnej dutiny, hrudníka a malej panvy [1,2,3].
Koncepcia autotransplantácie tkaniva sleziny vznikla na základe náhodných nálezov spontánne implantovaných častí tkaniva pri pitve, resp. relaparotómii u pacientov po traumatickej ruptúre tohto orgánu [4,5]. Klinickej aplikácii autotransplantácie predchádzali rôzne experimentálne práce na zvieratách s rôznymi výsledkami. Kým niektorí autori jednoznačne potvrdili efekt splenózy pri ochrane pred pneumokokovou infekciou na zvieracom modeli [6,7], iní vo svojich experimentoch nezistili žiadny protektívny účinok autotransplantovaného tkaniva po podaní bakteriálnej nákazy [8, 9, 10]. Protichodné závery rôznych štúdií viedli k postupnému upúšťaniu od autotransplantácie tkaniva sleziny, čo bolo podporené aj zavedením vakcinácie v predoperačnom (elektívne splenektómie), resp. včasnom pooperačnom období (neplánované splenektómie – trauma, iatrogénne poškodenie). Navyše pri traumatických ruptúrach sleziny u pacientov s polytraumou pri vitálnom ohrození pacienta je v dnešnej dobe plne uprednostňovaná koncepcia „damage control surgery“, ktorá nedáva priestor na predlžovanie operácie, ktoré môže ohroziť pacienta pri spornom benefite.
Kazuistika
Na naše pracovisko bola v júli 2013 prijatá 35ročná pacientka s mesačnou anamnézou bolestí brucha v ľavom mezo-hypogastriu, ktoré sa tri dni pred hospitalizáciou vystupňovali a donútili pacientku vyhľadať lekársku pomoc. Bolesti boli trvalého charakteru, sprevádzané subfebrilnými teplotami. V predchorobí (jún 2013) pacientka prekonala ľahkú infekciu respiračného traktu spojenú aj s opakovanými hnačkovitými stolicami. Z chirurgickej anamnézy bol relevantný údaj o splenektómii v roku 1994 pre ruptúru pri autonehode s následnou implantáciou tkaniva sleziny do omentum majus. V roku 1997 jej bola urobená klasická appendektómia pre flegmonózny zápal s koprostázou a v roku 1998 laparoskopická revízia malej panvy pre pretrvávajúce bolesti s negatívnym výsledkom.
Pri vstupnom fyzikálnom vyšetrení bola ľavá časť brucha výrazne bolestivá, subjektívne bol nález hodnotený ako lokálna iritácia peritonea. Peristaltika bola dobre počuteľná. V laboratórnom vyšetrení bola zistená mierna zápalová aktivita (leukocyty 12,4.109/l, C-reaktívny proteín 39,2 mg/l). Ostatné parametre boli vo fyziologických medziach.
Ultrasonografický nález potvrdil v ľavej časti brucha malý tumorózny útvar, ktorý imponoval ako abscesové ložisko. Vzhľadom na údaj o splenektómii a následnej implantácii tkaniva sleziny do veľkej predstierky v minulosti, gynekologickú diagnostickú laparoskopiu a súčasne nejednoznačný ultrasonografický nález sme v rámci diferenciálnej diagnostiky doplnili vyšetrenie počítačovou tomografiou.
Kontrastné CT vyšetrenie potvrdilo v celom bruchu i v panve viaceré homogénne sa sýtiace ložiská s hladkými kontúrami (v ľavom subfréniu 42x24 mm, subhepatálne vľavo 13x12 mm, juxtagastricky 13x6 mm, dve ložiská v prednej axilárnej čiare tesne pod brušnou stenou 13x5 mm a 19x14 mm, parakolicky vľavo 8x5 mm, pod brušnou stenou v úrovni umbilika 11x19 mm). Najväčšie ložisko bolo detegované v súlade s klinickým nálezom bolesti v ľavom hypogastriu. Dosahovalo veľkosť 55mm /LL/x27mm /AP/x45mm /CC/, bolo homogénne pri natívnom aj postkontrastnom vyšetrení, malo zvlněný povrch (Obr. 1). Žiadne z popísaných ložísk nejavilo známky infiltrácie okolitých štruktúr, napriek tesnej blízkosti viacerých orgánov.
1. Nález homogénneho ložiska v ľavom hypochondriu (splenóza) – v červenom krúžku Fig. 1: Finding of a homogeneous deposit in the left hypochondrium (splenosis) – in the red circle 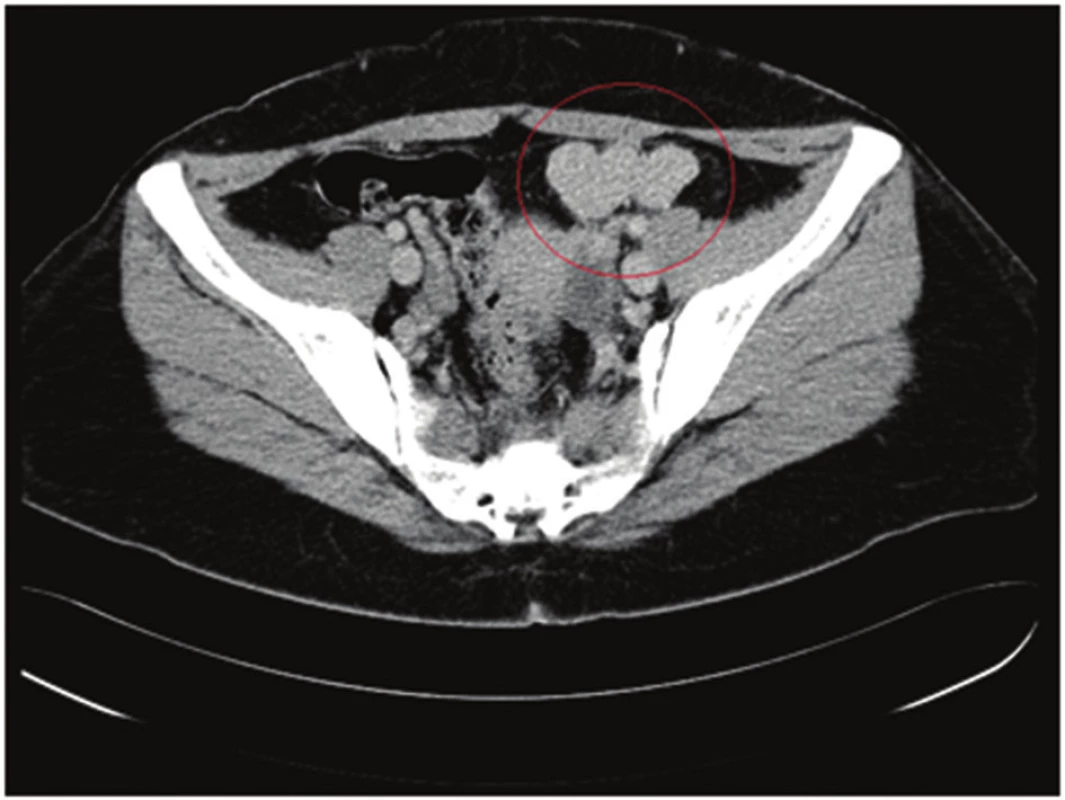
Po skompletizovaní pomocných vyšetrení a zhodnotení klinického nálezu sme, s predpokladanou diagnózou splenózy, indikovali operačnú revíziu. Vzhľadom na predchádzajúcu polytraumu, appendektómiu a laparoskopickú revíziu malej panvy sme sa rozhodli pre laparotómiu.
Operačná revízia potvrdila mnohopočetnú splenózu. Rešpektujúc klinický nález a výsledky CT sme odstránili najväčšie ložisko v omente, ktoré bolo pravdepodobne vytvorené implantáciou zbytku sleziny pri prvej operácii. V resekovanej časti veľkej predstierky sme našli ešte tri drobné ložiská a z prednej brušnej steny sme odstránili ešte dve samostatné tkanivá ektopickej sleziny (Obr. 2).
2. Odstránená časť omenta s implantovaným tkanivom sleziny a dve samostatné ložiská Fig. 2: Removed part of the omentum with implanted splenic tissue and two separate deposits 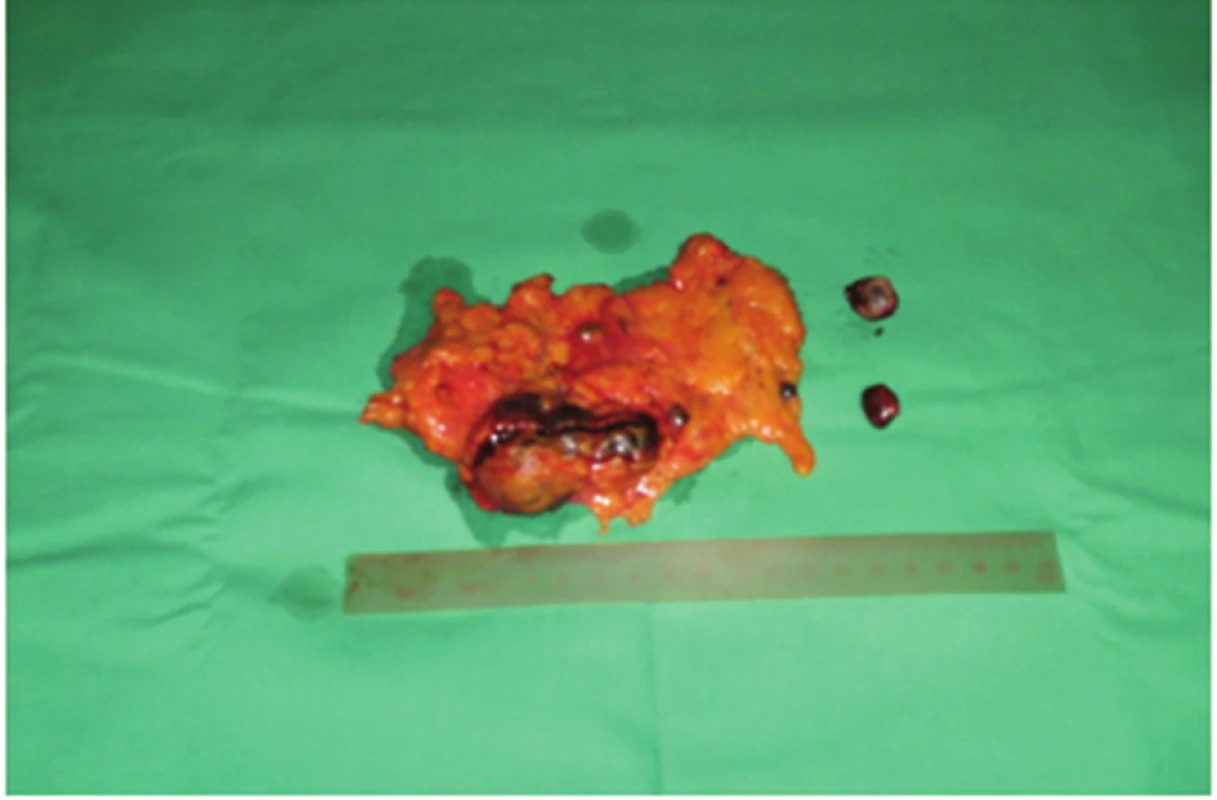
Operačný výkon prebehol štandardným spôsobom, bez komplikácií a pacientka bola demitovaná do domácej starostlivosti na 3. pooperačný deň. Histologické vyšetrenie potvrdilo lienálny parenchým v odstránených útvaroch s dominujúcou kongestívnou až prekrvácanou červenou pulpou. V bielej pulpe chýbali centrálne arterioly, čo podporilo klinickú diagnózu splenózy.
V ďalšom období bola pacientka vyšetrovaná gastroenterológom pre dyspepsie a bolesti v epigastriu, avšak po preliečení gastritídy, lokalizovanej v antrálnej časti žalúdka, spôsobenej infekciou Helicobacter pylori už bola bez ťažkostí.
Diskusia
Koncepcia splenózy, ako autotransplantácie slezinného tkaniva je výsledkom práce viacerých autorov, ktorí vypracovali techniku operácie, zaoberali sa miestom aplikácie tkaniva, veľkosťou implantátov ako aj overovaním viability implantovaných častí sleziny, či sledovaním komplikácií spojených s implantáciou [11,12,13,14,15].
V súčasnosti je splenóza najčastejšie výsledkom traumatickej ruptúry sleziny so spontánnou implantáciou rozdrveného parenchýmu v peritoneálnej dutine, avšak môže sa vyskytnúť aj po elektívnych operáciách sleziny, či pri iatrogénnom poškodení pri operácii žalúdka, ľavej obličky a nadobličky alebo kolónu [3]. Aj keď presná prevalencia pacientov so splenózou nie je známa, Müller a Ruthlin v roku 1995 vo svojej prospektívnej štúdii založenej na ultrasonografickom monitorovaní pacientov po traumatickej splenektómii zistili jej prítomnosť až u jednej tretiny [16]. V štúdiách s využitím presnejších zobrazovacích metód je výskyt splenózy uvádzaný v rozmedzí 16–67 % [17].
Časový interval medzi traumatickou, resp. elektívnou splenektómiou a následnou abdominálnou či pelvickou splenózou je v priemere 10 rokov s intervalom od 5 mesiacov do 32 rokov [18]. U našej pacientky bola operácia urobená po 19 rokoch od autoimplantácie, avšak ťažkosti pre ktoré bola pacientka operovaná na gynekológii už 4 roky po autonehode mohli súvisieť práve so splenózou.
Peroperačná implantácia tkaniva sleziny do omenta sa síce dnes už prakticky nevykonáva, relatívne vysoký výskyt spontánnej splenózy nás však núti v indikovaných prípadoch (údaj o traume brucha, resp. splenektómii) myslieť pri diferenciálnej diagnostike aj na túto možnosť. Klinicky nemá splenóza sa môže manifestovať abdominálnou alebo pelvickou bolesťou pri infarkte tkaniva, intestinálnou obštrukciou spôsobenou kompresiou čreva či gastrointestinálnym krvácaním [19]. Zväčšenie tkaniva môže byť často v príčinnej súvislosti s prekonanou infekciou [3,20]. Údaj o respiračnej infekcii a hnačkách u našej pacientky mesiac pred hospitalizáciou len podporuje túto hypotézu.
Závažnejšie diferenciálno-diagnostické problémy môže vytvárať extraabdominálna (najčastejšie hrudník), či intraparenchýmová lokalizácia splenózy. Kým v prvom prípade ide o následok traumy s poškodenou bránicou, resp. torakofrenolaparotómie, v druhom prípade je predpoklad poškodenia parenchýmu a inokulácia makroskopického tkaniva sleziny, resp. krvi obsahujúcej bunky pulpy do orgánu. Takto inkorporované splenické tkanivo môže imitovať nádor pankreasu [21], tumor pečene [22], či gastrointestinálny stromálny tumor (GIST) [23,24]. Pelvická lokalizácia často imituje endometriózu, či malígne ochorenie [25,26]. Takto diagnosticky problematické lokalizácie vyžadujú komplexnejší diagnostický proces, avšak nezriedka sa definitívna diagnóza potvrdí až pri explorácii, resp. pri histologickom vyšetrení.
Pri podozrení na splenózu zohrávajú kľúčovú úlohu v diagnostike zobrazovacie vyšetrenia. Laboratórne výsledky sú nešpecifické a bez morfologického korelátu len ťažko prispejú k definitívnej diagnóze. Okrem počítačovej tomografie (CT) je neinvazívnou diagnostickou modalitou s najlepšou senzitivitou a špecificitou v súčasnosti nukleárna scintigrafia. V minulosti používaný 99mTc-sulfurový koloid, ktorý bol predominantne vychytávaný retikuloendoteliálnym systémom pečene (len 10 % koloidu bolo vychytávaného slezinou [27], je v súčasnosti nahrádzaný použitím 99mTc -tepelne denaturovanými erytrocytmi (RBC), či indiom značenými doštičkami (111In-labeled platelets), ktoré majú podstatne väčšie vychytávanie splenickým tkanivom (až 90 %), čím dosahujú vysokú mieru špecificity [28]. Navyše použitie RBC je dostatočne senzitívne aj pri diagnostike malých ložísk a pri diferencovaní tkanív pri prekrývaní sa pečene a sleziny [29].
Ak je diagnóza splenózy potvrdená zobrazovacími metódami a pacient má niektorý z vyššie uvedených príznakov, je chirurgická intervencia opodstatnená. Rovnako je indikovaná pri diagnostických pochybnostiach, hlavne pri imitácii malígnych novotvarov. Asymptomatická splenóza nevyžaduje terapiu, avšak náhodný nález pri operácii je vhodné histologizovať [25].
Záver
Splenóza je pomerne zriedkavý stav, vo väčšine prípadov asymptomatický. Pri klinickej manifestácii v bruchu, malej panve, hrudníku, či v iných častiach organizmu si vyžaduje pozorný prístup. V celom diagnostickom procese je kľúčová informácia o splenektómii. Celá diagnostika sa stáva cielenou až v momente, keď lekár na spomínanú diagnózu myslí, a týmto smerom zameria aj použitie zobrazovacích modalít. Metódou voľby je CT vyšetrenie, pri diagnostických pochybnostiach je indikované použitie nukleárnej scintigrafie. Náhodný nález splenózy pri operácii z inej indikácie a následné histologické vyšetrenie môže zmierniť diagnostickú neistotu v budúcnosti a prispieť k správnemu manažmentu pacientovho stavu.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise.
MUDr. Marek Smolár, PhD, MPH,
Chirurgická klinika a Transplantačné centrum, UN Martin
Kollárova 2
036 01 Martin
e-mail: smoly2002@hotmail.com
Sources
1. Boudová L, Kazakov DV, Zahálka M, et al. Splenóza v podkoží břišní stěny. Rozhl Chir 2006;85 : 477−80.
2. Thourani VH, Sharma J, Duarte IG, et al. Intrathoracic splenosis. The Annals of Thoracic Surgery 2005;80 : 1934−6.
3. Palkar S. Splenosis presenting as pelvic pain. Bombay Hospital Journal 2001;43 : 434−6.
4. Fleming C, Dickson FR, Harrison EG Jr. Splenosis – Autotransplantation of splenic tissue. Am J Med 1976;61 : 414−9.
5. Nielsen JL, Ellegaard J, Hansen HH. Detection of splenosis and ectopic spleens. Scand J Haematol 1981;27 : 51−6.
6. Likhite VV. Opsonin and leukophilic gamma-globulin in chronically splenectomised rats with and without heterotropic autotransplanted splenic tissue. Nature 1975;253 : 742–4.
7. Seufert RM. Die Milztransplantation − Standortbestimmung. Chirurg 1986;57 : 182.
8. Weis SM, Rossato FE, Stewart E. Splenic autotransplant function in experimental bacteremia. Surg Forum 1979;30 : 30−2.
9. Schwartz AD, Dadash-Zadeh M, Goldstein R, et al. Antibody response to intravenous immunization following splenic tissue autotransplantation in Sprague-Dawley rats. Blood 1977;49 : 779−83.
10. Oakes DD., Froehlich JP., Charters AC. Intraportal splenic autotransplantation in rats: Feasibility and effectiveness. J Surg Res 1982;32 : 7−14.
11. Belko I, Hromec A, Jakubovský J, et al. Slezina. 1. vydanie Martin, Osveta 1992 : 1−252.
12. Schnorrer M. Slezina. In: Černý J. Špeciálna chirurgia 2 - Chirurgia brušných orgánov a retroperitonea. 2. vydanie Martin, Osveta 1996 : 342−65.
13. Meissner K, Meiser G. Die heterotope Autotransplantation von Milzpulpa nach irreparabler Milzruptur. Acta Chirurgica Austriaca 1983;15 : 87−92.
14. Vobořil Z. Autotransplantace sleziny (Experimentální chirurgická část). Rozhl Chir 1986;65 : 500−7.
15. Boernemisza G, Tarsoly E, Mikó I, et al. Partial experimental autotransplantation of the spleen. Acta Chir Hung 1986;27 : 79−86.
16. Müller U, Röthlin M. Splenic neoformation following trauma-induced splenectomy—diagnosis and function. Swiss Surgery 1995 : 230–5.
17. di Costanzo GG, Picciotto FP, Marsilia GM, et al. Hepatic splenosis misinterpreted as hepatocellular carcinoma in cirrhotic patients referred for liver transplantation: report of two cases. Liver Transplantation 2004;10 : 706–9.
18. Berman AJ, Zahalsky MP, Okon SA, et al. Distinguishing splenosis from renal masses using ferumoxide-enhanced magnetic resonance imaging. Urology 2003;62 : 748x-748xii.
19. Younan G, Wills E, Hafner G. Splenosis: A rare etiology for bowel obstruction - A case report and review of the literature. Case Rep Surg 2015; http://dx.doi.org/10.1155/2015/890602.
20. Al-Ahmadi M, Brundage S, Brody F, et al. Splenosis of the mesoappendix: case report and review of the literature. J R Coll Surg Edinb 1998;43 : 200−2.
21. Pachowicz M, Mocarska A, Starosławska E, et al. Accessory spleen mimicking pancreatic tumour: evaluation by 99mTc-labelled colloid SPECT/CT study. Report of two cases and a review of nuclear medicine methods utility. Folia Morphol (Warsz) 2015;74 : 532−9.
22. Třeška V, Skalický T, Chudáček Z, et al. Splenóza jater u nemocného po operaci maligního seminomu. Rozhl Chir 2005;84 : 452−5.
23. Yang K, Chen XZ, Liu J, et al. Splenosis in gastric wall mimicking gastrointestinal stromal tumor. Endoscopy 2013;45 Suppl 2 UCTN:E82-3.
24. Li B, Huang Y, Chao B, et al. Splenosis in gastric fundus mimicking gastrointestinal stromal tumor: a report of two cases and review of the literature. Int J Clin Exp Pathol 2015;8 : 6566−70.
25. Fremont RD, Rice TW. Splenosis: A review. South Med J 2007;100 : 589−93.
26. Gerber D, Frey MK, Caputo TA. Pelvic splenosis misdiagnosed as a uterine sarcoma. Gynecol Oncol Rep 2015;12 : 1−2.
27. Rosenberg RJ, Sziklas JJ, Rich DA. Dual radionuclide subtraction imaging of the spleen. Semin Nucl Med 1985;15 : 299−304.
28. Gunes I, Yilmazlar T, Sarikaya T, et al. Scintigraphic detection of splenosis: Superiority of tomographic selective spleen scintigraphy. Radiology 1994;49 : 115−7.
29. Sty JR, Conway JJ. The spleen: development and functional evaluation. Semin Nucl Med 1985;15 : 276−98.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2016 Issue 4-
All articles in this issue
- Skin and soft tissue infections (SSTIs)
- Kidney donors after circulatory death (DCD) – single centre experience
- Current status regarding surgical treatment of pancreatic cancer in the Czech Republic
- Predictive and prognostic factors of gastric cancer
- Pedal bypass using venous allograft
- Bouveret syndrome: a case report and literature review
- Splenosis as a rare cause of abdominal pain
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Skin and soft tissue infections (SSTIs)
- Splenosis as a rare cause of abdominal pain
- Kidney donors after circulatory death (DCD) – single centre experience
- Bouveret syndrome: a case report and literature review
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

