-
Medical journals
- Career
Plicní metastázy – dvanáctileté zkušenosti s chirurgickou léčbou
Authors: J. Vodička 1; V. Špidlen 1; V. Šimánek 1; J. Šafránek 1; J. Fichtl 1; P. Mukenšnabl 2; M. Roušarová 3
Authors‘ workplace: Chirurgická klinika, Lékařská fakulta v Plzni, Univerzita Karlova v Praze, Fakultní nemocnice v Plzni, přednosta: Prof. MUDr. V. Třeška, DrSc. 1; Šiklův patologicko-anatomický ústav, Lékařská fakulta v Plzni, Univerzita Karlova v Praze Fakultní nemocnice v Plzni, přednosta: Prof. MUDr. M. Michal 2; Národní onkologický registr, Fakultní nemocnice v Plzni, vedoucí lékař: MUDr. M. Roušarová 3
Published in: Rozhl. Chir., 2014, roč. 93, č. 4, s. 194-201.
Category: Original articles
Podpořeno Institucionálním grantem FN Plzeň číslo 96-44.
Overview
Úvod:
Radikální chirurgická léčba vybraných sekundárních plicních nádorů je dnes všeobecně přijatým terapeutickým postupem, který prokazatelně prodlužuje dlouhodobé přežívání takto postižených při akceptabilní perioperační morbiditě a mortalitě. Cílem práce je retrospektivní analýza souboru nemocných operovaných pro plicní metastázy různých nádorů v dvanáctiletém období.Materiál a metodika:
V letech 2001–2012 bylo na pracovišti autorů operováno 159 nemocných se sekundárními plicními nádory, z toho 80 mužů, medián věku byl 65 let. U 112 pacientů (70,4 %) se jednalo o solitární metastázy, u zbývajících pak o vícečetné, 24 nemocných (15,1 %) mělo postižení oboustranné, 6 pacientů (3,8 %) mělo již recidivu metastatického postižení po jeho předchozí radikální operaci. Nejčastěji byly diagnostikovány metastázy kolorektálního karcinomu (75 osob – 47,2 %). Medián bezpříznakového období od operace primárního nádoru činil v souboru 27 měsíců.Výsledky:
Celkem bylo provedeno 166 jednostranných (87,4 %) a 24 oboustranných operačních výkonů v jedné či ve dvou dobách (12,6 %). Nejčastějším typem operace byly precizní laserové excize (59 výkonů – 31,1 %). Celkem bylo radikálně resekováno 296 metastáz, 13 bylo ošetřeno radiofrekvenční ablací. Perioperační morbidita dosáhla 13,2 %, letalita byla nulová. Po metastazektomii dosud přežívá 90 operovaných (56,6 %), medián přežití je 44 měsíců. Tříleté přežití v souboru činilo souhrnně 59 %, pětileté pak 39 %. Pro kohortu nemocných s metastázami kolorektálního karcinomu je statisticky významným faktorem ovlivňujícím jejich přežití počet metastáz, kdy pacienti s 2 a více metastázami kolorektálního karcinomu mají 2,7krát vyšší riziko úmrtí. 68 pacientů (42,8 %) žije po metastazektomii bez progrese nemoci, medián disease free intervalu je 29 měsíců. Bez známek recidivy či progrese nemoci žilo 3 roky od metastazektomie celkem 43 % pacientů, 5 let pak 27 %. Pacienti s dvěma a více metastázami jakéhokoli nádoru mají 2,1krát vyšší riziko progrese nemoci, v případě kolorektálního karcinomu je toto riziko 2,3krát vyšší.Závěr:
Dosažené výsledky potvrzují pozitivní roli plicní metastazektomie v léčbě diseminovaného nádorového onemocnění. Rozhodujícím prognostickým faktorem ovlivňujícím jak dlouhodobé přežití operovaných, tak jejich DFI, je počet metastáz.Klíčová slova:
plicní metastáza – metastazektomie – kolorektální karcinom – laser – lymfadenektomieÚVOD
Hematogenní plicní metastázy jsou obecně považovány za známku pokročilé generalizace maligního onemocnění. Až třetina zhoubných nádorů metastazuje do plic, přičemž u většiny z nich jsou plíce dokonce prvým místem diseminace. Nicméně u významné části nemocných se postižením plic proces metastazování zastaví či zbrzdí, a právě tito pak mohou profitovat z radikální metastazektomie. Chirurgická léčba sekundárních plicních nádorů je považována, na rozdíl od ostatních léčebných modalit, za potenciálně kurativní a je dnes všeobecně přijatým terapeutickým postupem [1–3]. Cílem následující studie je retrospektivní analýza souboru nemocných operovaných pro plicní metastázy různých primárních nádorů v dvanáctiletém období.
MATERIÁL A METODIKA
Soubor pacientů
V letech 2001–2012 jsme chirurgicky léčili 159 nemocných se sekundárními plicními nádory. Soubor tvořilo 80 mužů (50,3 %) a 79 žen (49,7 %) průměrného věku 63 let při krajních hodnotách 27 a 80 let (medián 65 let). Ve skupině mužů byl průměrný věk 63,7 roku (medián 66,5; interval 27–80), ve skupině žen 62,4 roku (medián 65; interval 28–80). U 112 pacientů (70,4 %) se jednalo o solitární metastázy, u zbývajících pak o vícečetné, 24 nemocných (15,1 %) mělo postižení oboustranné. Šest pacientů (3,8 %) bylo operováno pro recidivu metastatického postižení plic. Procentuální zastoupení jednotlivých primárních maligních nádorů s plicními metastázami ukazuje Tab. 1. 114 nemocných (71,7 %) podstoupilo před metastazektomií adjuvantní onkologickou léčbu radikálně chirurgicky léčeného primárního nádoru.
Table 1. Zastoupení primárních maligních nádorů s plicními metastázami Tab. 1: Primary malignant tumours with pulmonary metastases 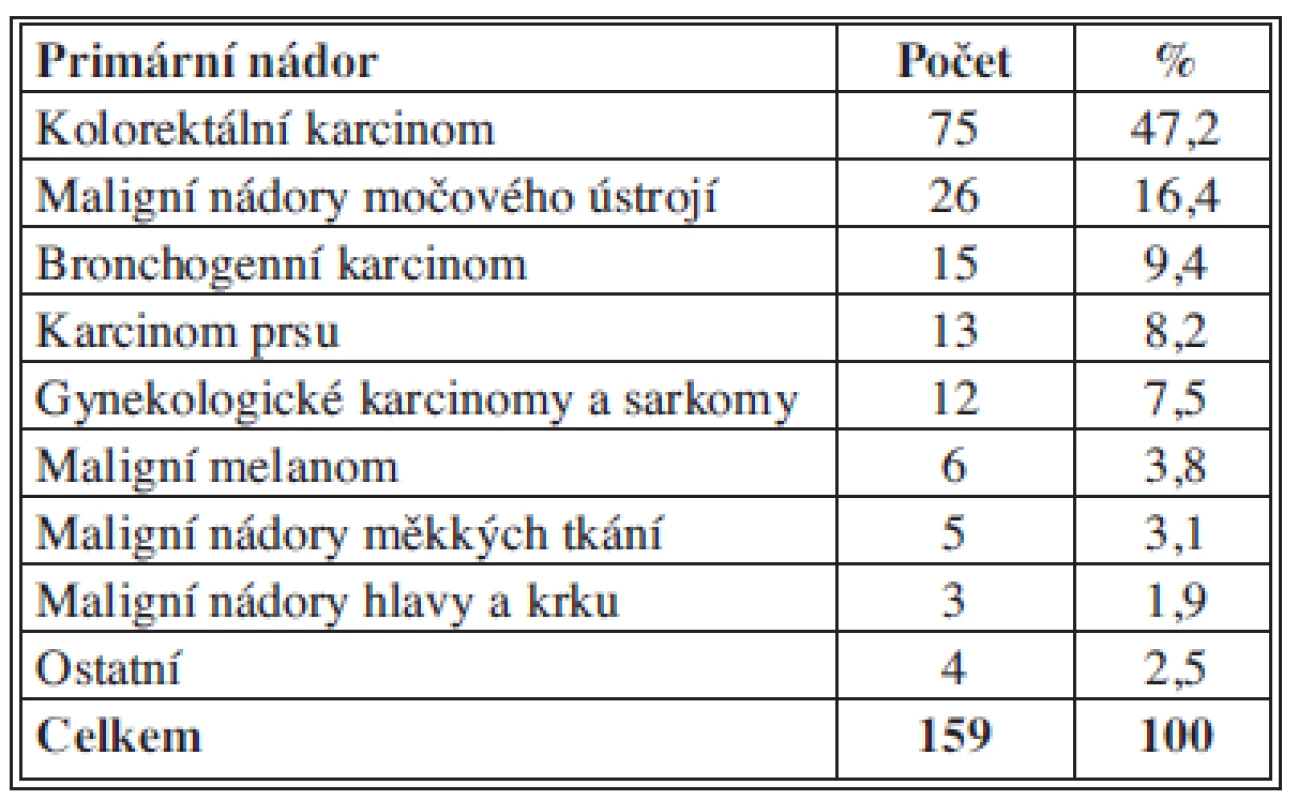
Indikační kritéria
K metastazektomii byli indikováni výhradně pacienti, u kterých byl primární zhoubný nádor radikálně odstraněn, dále nebyly přítomny jiné extrapulmonální metastázy, vyjma resekabilních jaterních, plicní metastázy se jevily dle předoperačních vyšetření radikálně odstranitelné co do počtu i lokalizace, nemocný byl schopen výkonu v celkové anestezii a potenciální benefit operace převyšoval její rizika. U vícečetného postižení jsme si a priori nestanovovali maximální možný počet odstranitelných metastáz, rozhodovali jsme se individuálně, případ od případu. Předoperačně prokázané nádorové postižení nitrohrudních lymfatických uzlin (LU) bylo kontraindikací operace.
Metody operační léčby
Operačním přístupem byla buď posterolaterální torakotomie, či videotorakoskopie. Rozsah výkonu se odvíjel od lokalizace a počtu resekovaných ložisek. Za dostatečné z hlediska onkologické radikality jsme považovali odstranění metastázy s bezpečnostním lemem 10 mm zdravé tkáně po obvodě ložiska. Konkrétními typy prováděných výkonů byly v případě otevřených operací anatomické plicní resekce, jež zahrnovaly segmentektomie, lobektomie, bilobektomie a pneumonektomie, dále neanatomické plicní resekce, tj. klínovité, a precizní laserové excize pomocí Nd:YAG laseru MY 40 1.3 o vlnové délce laserového paprsku 1318 nm. Během miniinvazivních operací jsme metastatická ložiska odstraňovali klínovitou resekcí pomocí endostaplerů. Radikálně chirurgicky neodstranitelná ložiska jsme ošetřovali radiofrekvenční ablací (RFA) transkutánně pod CT kontrolou.
Statistická analýza
V uvedeném souboru jsme sledovali především celkové přežití, resp. disease free interval (DFI) jak od operace primárního nádoru, tak po metastazektomii, a jejich vztah k věku pacienta, typu operačního výkonu, výskytu komplikací, délce hospitalizace a k počtu, velikosti a histologickému typu metastáz. Statistická analýza byla provedena s užitím softwarů Statistica (StatSoft, Inc., 2013) a SAS (SAS Institute Inc., Cary, NC, USA). Pro měřené parametry v celém souboru a v jednotlivých skupinách byly počítány základní statistické údaje. Vliv jednotlivých proměnných na délku přežití, resp. DFI byl zkoumán užitím Kaplan-Meierovy metody odhadu distribuční funkce přežití, resp. DFI. Rozdíly v celkovém přežití a DFI mezi zkoumanými skupinami byly testovány pomocí tzv. Log-rank testu a Coxova regresního modelu.
VÝSLEDKY
Chirurgická léčba
Všichni nemocní v souboru podstoupili chirurgickou léčbu plicních metastáz, která zahrnovala 166 jednostranných (87,4 %) a 24 oboustranných operačních výkonů (12,6 %). Ty byly prováděny u 2 nemocných (1,3 %) v jedné době a u 22 ve dvou dobách (13,8 %). Celkem tedy bylo provedeno 190 zákroků u 159 nemocných. Operačním přístupem byla při těchto zákrocích sedmkrát (3,7 %) videotorakoskopie, u 172 případů (90,5 %) posterolaterální torakotomie a 11krát (5,8 %) jsme provedli transparietální RFA. Konkrétní typy a počty operačních výkonů ukazuje Graf 1. Anatomické plicní resekce zahrnovaly 6 segmentektomií, 43 lobektomií, 4 bilobektomie a 2 pneumonektomie. Celkem bylo radikálně resekováno 296 metastáz, dalších 13 jsme ošetřili radiofrekvenční ablací. Nejvyšší počet ložisek odstraněných u jednoho operovaného byl osmnáct. Velikost metastáz se pohybovala v rozmezí 1–120 mm při mediánu 20 mm, přičemž 89,7 % odstraněných metastáz mělo největší průměr větší než 10 mm, 52,3 % větší než 20 mm, 31 % větší než 30 mm a 12,9 % větší než 40 mm. Definitivní pooperační histologie potvrdila u všech odstraněných ložisek předoperační předpoklad metastázy příslušného primárního maligního nádoru.
Graph 1. Typy a počty operačních výkonů Graph 1: Types and numbers of procedures Poznámky: APR (anatomical pulmonary resection) – anatomické plicní resekce, KR (wedge pulmonary resection) – klínovité plicní resekce, Laser (precise laser excision) – precizní laserové excize, RFA (radio-frequency ablation) – radiofrekvenční ablace, VATS (videothoracoscopic and video-assisted resection) – videotorakoskopické a videoasistované resekce 
Součástí 114 operací (60 %) byl odběr hilových a mediastinálních LU, v 70 případech formou samplingu, u 44 nemocných byla provedena ipsilaterální systematická mediastinální lymfadenektomie (SMLA). Patnáctkrát (13,2 % provedených odběrů) byly v odstraněných LU prokázány metastázy stejného histologického typu jako v plicních ložiscích, z toho šestkrát v uzlinách hilových a devětkrát v uzlinách mediastinálních.
Peroperační rušivou příhodu jsme neměli, pooperační morbidita dosáhla 13,2 % (21 pacientů), přičemž nejčastěji jsme se potýkali s pneumotoraxem (přesněji řečeno pooperačním nedorozvinutím plíce) a zánětlivými plicními komplikacemi. Sedmkrát (4,4 %) jsme byli nuceni řešit tyto nežádoucí příhody reoperací, kterou byla vždy drenáž příslušné pleurální dutiny. V souvislosti s operačním výkonem nikdo z nemocných v intervalu třiceti dnů nezemřel. Průměrná doba pooperační hospitalizace činila 7 dnů. 91 pacientů (57,2 %) podstoupilo po metastazektomii další onkologickou léčbu.
Sledování souboru, statistické hodnocení
Sledování souboru pro potřeby statistického hodnocení bylo ukončeno k 30. 6. 2013, medián sledování činil 24 měsíců. Medián disease free intervalu od operace primárního nádoru bez rozdílu jeho typu byl v souboru 27 měsíců. Pro tento parametr jsme prokázali statisticky významný faktor histologického typu primárního nádoru (Log-Rank test: p-value = 0,0046).
K datu ukončení sledování přežívalo 90 operovaných (56,6 %), medián přežití činil 44 měsíců. Z 6 pacientů s diseminací metastatického ložiska do LU plicního hilu zemřeli 4 nemocní, z 9 operovaných s postižením ipsilaterálních LU mediastina zemřelo 6 nemocných. Tříleté přežití v souboru činilo souhrnně 59 %, pětileté pak 39 % (Graf 2), ve skupině kolorektálního karcinomu 58 %, resp. 45 %, a ve skupině renálních karcinomů 57 %, resp. 49 %. Pro kohortu všech pacientů nebyl nalezen žádný statisticky významný faktor, který by ovlivňoval celkové přežití, pro kohortu nemocných s metastázami kolorektálního karcinomu je jediným statisticky významným faktorem jejich počet. Pacienti s 2 a více metastázami kolorektálního karcinomu mají 2,7krát vyšší riziko úmrtí (Log-Rank test: p-value = 0,0055; Cox Hazard model: p-value = 0,0077).
Graph 2. Celkové přežití po metastazektomii Graph 2: Overall survival after the resection of metastases 
68 pacientů (42,8 %) žije po metastazektomii bez progrese nemoci, medián DFI je v tomto případě 29 měsíců. Bez známek recidivy či progrese nemoci žilo 3 roky od metastazektomie celkem 43 % pacientů, 5 let pak 27 % (Graf 3). V kohortě pacientů s metastázami kolorektálního karcinomu je to 42,5 %, resp. 28,1 %, v kohortě nemocných s metastázami renálního karcinomu je to 45,8 %, resp. 39,3 %. Pacienti s dvěma a více metastázami jakéhokoli nádoru mají 2,1krát vyšší riziko progrese nemoci (statisticky významné; Log-Rank test: p-value = 0,0006; Cox Hazard model: p-value = 0,0008; Graf 4). Nemocní s dvěma a více metastázami kolorektálního karcinomu mají 2,3krát vyšší riziko progrese nemoci (statisticky významné; Log-Rank test: p-value = 0,0061; Cox Hazard model: p-value = 0,0080; Graf 5), při 3 a více metastázách je riziko 2,7krát vyšší (statisticky významné; Log-Rank test: p-value = 0,0215; Cox Hazard model: p-value = 0,0280).
Graph 3. Disease free interval po metastazektomii Graph 3: Disease-free interval after the resection of metastases 
Graph 4. Závislost DFI po metastazektomii na počtu metastáz bez rozdílu typu nádoru Graph 4: Dependence of DFI after the resection of metastases on a number of metastases regardless of the type of tumour 
Graph 5. Závislost DFI po metastazektomii na počtu metastáz kolorektálního karcinomu Graph 5: Dependence of DFI after the resection of metastases on the number of colorectal cancer metastases 
DISKUZE
K radikální chirurgické léčbě sekundárních plicních nádorů jsou v současné době standardně indikováni nemocní, u kterých je primární zhoubný nádor radikálně odstraněn, resp. je pod kontrolou, nejsou přítomny jiné extrapulmonální metastázy (vyjma resekabilních, zpravidla jaterních), počet a lokalizace metastáz umožňuje jejich radikální odstranění a potenciální přínos pro pacienta převýší rizika operace [4–6]. Důležitou podmínkou je i schopnost pacienta podstoupit resekční výkon z hlediska stavu jeho plicních funkcí a únosnosti k celkové anestezii. Paliativní metastazektomie jsou prováděny vzácně např. při rozpadu objemné nekrotické metastázy, jejím prorůstání do hrudní stěny provázeném výraznými bolestmi, významné hemoptýze nebo syndromu za stenózou [7]. Při zvažování metastazektomie je nutné brát v úvahu i odpověď na případnou předcházející chemoterapii (adjuvantní léčbu). Pokud i přes její podání dochází k progresi nemoci ve smyslu nárůstu především počtu a také velikosti plicních ložisek, pak by neměla být chirurgická léčba indikována, neboť prognóza těchto pacientů není dobrá. Stejně tak by neměli být operováni pacienti s předoperačně prokázaným postižením hilových a mediastinálních LU [8,9]. K diskuzi je v tomto případě podání neoadjuvantní léčby, po které by při pozitivní odpovědi následovala v druhé době metastazektomie. Nelze-li neoadjuvantní léčbu podat, měli by být postižení indikováni již v prvé době k metastazektomii, při níž však musí být provedena SMLA [10]. Za diskutabilní pro horší prognózu jsou některými považovány metastazektomie synchronních, objemných (>3 cm), vícečetných, resp. oboustranných metastáz, při krátkém DFI od operace primárního nádoru a při elevaci onkomarkerů [9,11,12]. Náš přístup je v tomto směru aktivnější, zásadními kritérii pro indikaci metastazektomie jsou pro nás absence nádorového postižení nitrohrudních lymfatických uzlin, pozitivní odpověď na případnou předchozí onkologickou léčbu, možnost dosažení R0 resekce a funkční únosnost pacienta k operaci. Paliativní metastazektomii jsme v uvedeném období neprováděli.
Stále kontroverzní je otázka operačního přístupu při metastazektomii, a to především z důvodu absence palpačního vyšetření plíce při miniinvazivních výkonech, která může být příčinou možného přehlédnutí předoperačně neidentifikovaných lézí. Část studií dokládá stejné či podobné výsledky stran přežití nemocných a četnosti recidiv metastáz jak po výkonech provedených miniinvazivní technikou (videotorakoskopie, videoasistované výkony), tak po operacích cestou torakotomie [6,13,14]. Svoji argumentaci tito autoři podporují jednak odkazem na vysokou citlivost moderních CT přístrojů, jež jsou schopny detekovat léze o velikosti pouhého 1 milimetru, jednak v případě jednostranných výkonů faktem, že na neoperované straně se chirurg stejně musí spolehnout na výsledek předoperačních zobrazovacích vyšetření [10,15]. Proti tomu stojí např. práce Eckardta a spol., Cerfolia a spol. či Jaraba a spol., jež poukazují na vysoký počet ložisek, která při srovnávacích studiích nebyla předoperačně identifikována CT či PET/CT vyšetřením nebo nebyla nalezena během miniinvazivní operace [16–18]. Eckardt a spol. uvádějí v souboru 37 pacientů předoperační CT identifikaci 55 ložisek, při miniinvazivní operaci jich však nalezli pouze 51 a při následné torakotomii naopak 84. Z navíc nalezených 29 ložisek pak bylo 7 maligních, tj. každé čtvrté [16]. Cerfolio a spol. nalezli další, předoperačně CT nebo PET/CT neodhalená ložiska, u každého pátého z jimi sledovaných 152 nemocných, Jarabo učinil obdobnou zkušenost u 18 % výkonů [17,18]. Z domácího písemnictví je třeba zmínit práci Horáka a spol., kteří při porovnání předoperačních CT a peroperačních palpačních nálezů nalezli při 77 výkonech dalších 60 ložisek, z kterých 55 byly metastázy, všechny o velikosti do 5 mm [19]. Druhostranná explorace dle CT nepostižené plíce není u jednostranných výkonů i přes výše uvedená zjištění doporučována, neboť nezlepšuje prognózu operovaných. Doporučeno je kontrolní CT vyšetření v odstupu 3 měsíců a případná kontralaterální operace [19]. Náš přístup je v tomto směru konzervativní, preferujeme metastazektomii z torakotomie, což nakonec odráží i velmi malý počet miniinvazivních výkonů ve sledovaném souboru (4 %). Podle našeho mínění, v souhlase s Yanem a Pfannschmidtem, lze akceptovat miniinvazivní přístup jen u vybraných jedinců se solitárními metachronními periferními metastázami při DFI v řádu let po primární operaci, které byly diagnostikovány pomocí moderních CT přístrojů o vysoké citlivosti, kdy je pravděpodobnost existence dalšího skrytého ložiska nejmenší [9,20]. V případě oboustranných plicních metastáz je otázkou, zdali je řešit v jedné či ve dvou dobách. Podle našeho názoru je třeba vzít v úvahu především dva faktory, a to jednak celkový stav pacienta, jednak počet odstraňovaných ložisek. U starších nemocných s vyšším operačním rizikem a případně s více metastázami, kterých je ostatně většina, dáváme přednost operaci ve dvou dobách, u mladších v dobré kondici a při menším počtu ložisek lze provést oboustranný zákrok v jedné době. V našem souboru jsme takto postupovali u dvou nemocných, v prvém případě byla provedena bilaterální videotorakoskopie, v druhém pak na jedné straně torakotomie a na druhé miniinvazivní operace. Obecně bychom považovali při současných oboustranných výkonech za výhodnější přístup separátními torakotomiemi než sternotomií či clamshell torakotomií, které jednak ztěžují metastazektomie v dorzálních partiích plic a jednak limitují provedení SMLA [10].
Zásadním požadavkem je vždy dosažení resekce R0, neúplné resekce mají výrazně horší prognózu a neměly by být prováděny [21]. Standardním výkonem jsou v chirurgii plicních metastáz limitované neanatomické resekce (wedge neboli klínovité, staplerem či technikou na svorce) či precizní laserové excize. Tyto výkony maximálně šetří zdravý plicní parenchym, což nelimituje při rekurenci onemocnění případné reoperace, které jsou také doporučovány, neboť prokazatelně zlepšují přežití [1,2,22,23]. Pro potlačení rizika lokální recidivy metastázy je důležitý určitý bezpečnostní lem makroskopicky zdravé tkáně po obvodě ložiska odstraněný spolu s ním. Welter v této souvislosti zkoumal 17 metastáz odstraněných u 10 pacientů. Celkem identifikoval 205 satelitních maligních buněk u 16 ze 17 hodnocených metastáz ve střední vzdálenosti 0,99Ī0,85 mm (0,06–6,4 mm) od maligního uzlu. Bezpečnostní lem by tak dle jeho názoru měl být u malých ložisek alespoň 3 mm, u větších 8–10 mm [24]. Rozsáhlejší výkony typu lobektomií či dokonce pneumonektomií nepřinášejí lepší dlouhodobé přežívání, z hlediska morbidity jsou výsledky dokonce horší [25]. Navíc limitují případné reoperace při novém výskytu metastáz z důvodu nedostatečné reziduální funkční plicní kapacity. Přesto mají v chirurgii plicních metastáz své místo, ale pouze u ložisek centrálních či vícečetných, kdy výkon menšího rozsahu není technicky proveditelný či nezaručuje potřebnou onkologickou radikalitu [25]. Právě centrální lokalizace metastázy či jejich větší počet jsou důvodem relativně vysokého počtu anatomických plicních resekcí v našem souboru (29 %). Není-li z nějakého důvodu možné provést radikální resekci metastatického ložiska, lze jej ošetřit radiofrekvenční ablací, při které dáváme přednost transparietálnímu provedení pod CT kontrolou [6,26]. Bargellini a spol. sice udávají trvalý efekt RFA u 85–90 % provedených výkonů a pětileté přežití nemocných s takto ošetřenými plicními metastázami 45 % [27], nicméně naše zkušenosti tak pozitivní nejsou, neboť v našem souboru zemřelo již 7 z 11 pacientů po RFA, přičemž jsme nedosáhli pětiletého přežití. Proto považujeme RFA ve srovnání s metastazektomií, která má potenciálně kurativní efekt, jednoznačně za metodu paliativní. Indikujeme ji tak u pacientů s malými ložisky (velikost léze je hlavní rizikový faktor její recidivy, tj. selhání metody), kteří již nemohou nebo nechtějí podstoupit další torakotomii.
Frekvence postižení hilových a mediastinálních LU nádorovou diseminací je při plicních metastázách popisována v rozmezí 8 až 47 %, s prokazatelně horším přežíváním, které nedosahuje pěti let [10,21,28–30]. Při takto vysokém procentu by měla být SMLA standardně prováděna za účelem zpřesnění stagingu, resp. volby adjuvantní onkologické léčby, zejména, je-li citlivost předoperačního CT, resp. PET/CT vyšetření k odhalení nádorového postižení LU pouhých 35 % [1,10,20,21,28–30]. Vliv provedení SMLA na dlouhodobé přežití je však stále diskutabilní, a to i v případě postižení LU nádorovou diseminací [10,21]. V našem souboru zemřelo již 10 z 15 nemocných s prokázaným nádorovým postižením nitrohrudních LU, což potvrzuje horší prognózu takto postižených. U námi provedených 44 SMLA bylo postižení LU prokázáno v 5 případech (1x LU hilové, 4x LU mediastinální), přičemž 4 pacienti již zemřeli, ale na druhou stranu zemřelo i 7 pacientů, u nichž nebyly LU postiženy. Výsledky stran přežití operovaných jsou tedy, byť se jedná o malé počty, poměrně rozporuplné.
Pětileté přežití nemocných po plicních metastazektomiích se podle různých pramenů značně liší, pochopitelně v závislosti na řadě faktorů, přičemž se pohybuje v řádu desítek procent. Například Pfannschmidt a Hornbech uvádějí pětileté přežití po plicních metastazektomiích světlobuněčného renálního karcinomu 35,5–51,4 %, kolorektálního karcinomu 39,1–67,8 %, sarkomů měkkých tkání 21,7–52 %, osteosarkomů 38–49,7 %, melanomu 25 % a nonseminomatózních nádorů ze zárodečných buněk 79–94 % [7,14]. Naproti tomu pětileté přežívání neléčeného metastatického postižení nedosahuje 5 % [1]. Toto srovnání je více než výmluvné a zcela jednoznačně odráží pozitivní vliv metastazektomie na dlouhodobé přežívání nemocných. Za významné prognostické faktory ovlivňující dlouhodobé přežití jsou většinově považovány následující – histologie primárního nádoru, doba výskytu metastázy ve vztahu k primárnímu nádoru (synchronní v. metachronní), délka DFI po operaci primárního nádoru, R0 resekce metastázy, počet a velikost metastáz, stav nitrohrudních LU [2,6,7,10,12,18,22,31–33]. Pro kolorektální karcinom je to navíc tumor rekta, hladina karcinoembryonálního antigenu (CEA) před a 1 měsíc po metastazektomii a historie jaterních metastáz [12,18,32,33]. Některé práce dále zmiňují vliv výskytu metastáz i přes adjuvantní chemoterapii po chirurgické léčbě primárního nádoru, existence mimoplicních metastáz, nízkého věku a mužského pohlaví pacienta [3,22,34]. Nejlepší výsledky stran dlouhodobého přežití tak můžeme očekávat u metastáz solitárních, metachronních, malé velikosti, při DFI >1 rok od resekce primárního nádoru, R0 resekci metastáz, absenci postižení nitrohrudních LU, dobře diferencovaných nádorů, resp. karcinomu tračníku, konvenčního renálního karcinomu a některých sarkomů, u kolorektálního karcinomu pak i při normální hladině CEA před metastazektomií a absenci jaterních metastáz.
Riziko recidivy plicních metastáz po radikální metastazektomii nejvíce negativně ovlivňují DFI do 1 roku od řešení primárního nádoru, CEA ≥5 ng/l před metastazektomií, velikost největší metastázy >3 cm, oboustranné metastázy a historie mimoplicních metastáz [3,12,22].
Následná chemoterapie po metastazektomii prokazatelně prodlužuje přežívání [31]. Naopak efekt neoadjuvantní chemoterapie před metastazektomií je sporný, v Liově souboru 70 pacientů s inoperabilními metastázami umožnilo její podání následnou resekci jen u 4 z nich (5,7 %) [35].
V našem souboru se při hodnocení faktorů ovlivňujících dlouhodobé přežití objevil jediný statisticky významný, kterým byl ve skupině metastáz kolorektálního karcinomu jejich počet. Stejný faktor se pak ukázal významným i v případě DFI, a to jak v celém souboru, tak opět v kohortě metastáz kolorektálního karcinomu. Vzhledem k tomu, že jsme obdobný výsledek zaznamenali při analýze téhož problému již před 3 roky, považujeme faktor počtu metastáz pro dlouhodobé přežití nemocných, resp. DFI po metastazektomii za velice významný.
ZÁVĚR
Radikální metastazektomie, jakožto potenciálně kurativní metoda, nepochybně prodlužuje přežívání nemocných s plicními metastázami. Optimálními kandidáty metastazektomie jsou pacienti s malým počtem metachronních metastáz při dlouhém bezpříznakovém období po léčbě primárního nádoru. Ostatní případy by měly být posuzovány individuálně. K operaci by neměli být indikováni pacienti s nádorovou diseminací do nitrohrudních LU a s progresí nemoci i přes podanou onkologickou léčbu. Zásadní je dosažení R0 resekce při maximální snaze o šetření zdravé plicní tkáně, které umožní v případě recidivy onemocnění znovu operační řešení, jež je většinově doporučováno. SMLA by měla být nedílnou součástí každé plicní metastazektomie. Pro optimální výsledky léčby by pacienti se sekundárními plicními nádory měli být soustřeďováni do specializovaných center poskytujících komplexní onkologickou péči.
Doc. MUDr. Josef Vodička, Ph.D.
Radyňská 248
332 02 Starý Plzenec
e-mail: vodicka@fnplzen.cz
Sources
1. Čapov I, Doležel J, Vlček P, et al. Opakované plicní resekce v chirurgii plicních metastáz. Rozhl Chir 2013;92 : 694–698.
2. Salah S, Watanabe K, Park JS, et al. Repeated resection of colorectal cancer pulmonary oligometastases: pooled analysis and prognostic assessment. Ann Surg Oncol 2013;20 : 1955–1961.
3. Kim CH, Huh JW, Kim HJ, et al. Factors influencing oncological outcomes in patients who develop pulmonary metastases after curative resection of colorectal cancer. Dis Colon Rectum 2012;55 : 459–464.
4. Skalický T, Třeška V, Špidlen V, et al. Chirurgická léčba jaterních a plicních metastáz kolorektálního karcinomu. Rozhl Chir 2010;89 : 253–255.
5. Třeška V, Vodička J, Špidlen V, et al. Jaterní a plicní metastázy kolorektálního karcinomu – zkušenosti Chirurgické kliniky FN v Plzni. Rozhl Chir 2013;92 : 488–493.
6. Zisis C, Tsakiridis K, Kougioumtzi I, et al. The management of the advanced colorectal cancer: management of the pulmonary metastases. J Thorac Dis 2013;5:S383–S388.
7. Pfannschmidt J, Egerer G, Bischof M, et al. Surgical intervention for pulmonary metastases. Dtsch Arztebl Int 2012;109 : 645–651.
8. Internullo E, Cassivi SD, Van Raemdonck D, et al. ESTS Pulmonary Metastasectomy Working Group. Pulmonary metastasectomy: a survey of current practice amongst members of the European Society of Thoracic Surgeons. J Thorac Oncol 2008;3 : 1257–1266.
9. Yano T, Shoji F, Maehara Y. Current status of pulmonary metastasectomy from primary epithelial tumors. Surg Today 2009;39 : 91–97.
10. Doležel J, Jedlička V, Peštál A, et al. Chirurgická léčba plicních metastáz. Rozhl Chir 2012;91 : 563–567.
11. García-Yuste M, Cassivi S, Paleru C. The number of pulmonary metastases: influence on practice and outcome. J Thorac Oncol 2010;5:S161–163.
12. Hwang MR, Park JW, Kim DY, et al. Early intrapulmonary recurrence after pulmonary metastasectomy related to colorectal cancer. Ann Thorac Surg 2010;90 : 398–404.
13. Chao YK, Chang HC, Wu YC, et al. Management of lung metastases from colorectal cancer: video-assisted thoracoscopic surgery versus thoracotomy—a case-matched study. Thorac Cardiovasc Surg 2012;60 : 398–404.
14. Hornbech K, Ravn J, Steinbrüchel DA. Outcome after pulmonary metastasectomy: analysis of 5 years consecutive surgical resections 2002–2006. J Thorac Oncol 2011;6 : 1733–1740.
15. Nakajima J, Murakawa T, Fukami T, et al. Is thoracoscopic surgery justified to treat pulmonary metastasis from colorectal cancer? Interact Cardiovasc Thorac Surg 2008;7 : 212–216.
16. Eckardt J, Licht PB. Thoracoscopic versus open pulmonary metastasectomy: a prospective, sequentially controlled study. Chest. 2012;142 : 1598–602.
17. Cerfolio RJ, Bryant AS, McCarty TP, et al. A prospective study to determine the incidence of non-imaged malignant pulmonary nodules in patients who undergo metastasectomy by thoracotomy with lung palpation. Ann Thorac Surg 2011;91 : 1696–1700.
18. Jarabo JR, Fernández E, Calatayud J, et al. More than one pulmonary resections or combined lung-liver resection in 79 patients with metastatic colorectal carcinoma. J Surg Oncol 2011;104 : 781–6.
19. Horák P, Pospíšil R, Polouček P. Přednosti klasického operačního přístupu v chirurgické léčbě plicních metastáz. Rozhl Chir 2011;90 : 162–165.
20. Pfannschmidt J, Dienemann H. Current surgical management of pulmonary metastases. Zentralbl Chir 2009;134 : 418–424.
21. Renaud S, Falcoz PE, Olland A, et al. Should mediastinal lymphadenectomy be performed during lung metastasectomy of renal cell carcinoma? Interact Cardiovasc Thorac Surg 2013;16 : 525–528.
22. Chen F, Sakai H, Miyahara R, et al. Repeat resection of pulmonary metastasis is beneficial for patients with colorectal carcinoma. World J Surg 2010;34 : 2373–2378.
23. Park JS, Kim HK, Choi YS, et al. Outcomes after repeated resection for recurrent pulmonary metastases from colorectal cancer. Ann Oncol 2010;21 : 1285–1289.
24. Welter S, Theegarten D, Trarbach T, et al. Safety distance in the resection of colorectal lung metastases: a prospective evaluation of satellite tumor cells with immunohistochemistry. J Thorac Cardiovasc Surg 2011;141 : 1218–1222.
25. Čapov I, Doležel J, Vlček P, et al. Je oprávněné provedení pneumonektomie v léčbě plicních metastáz? Rozhl Chir 2011;90 : 631–633.
26. Ding JH, Chua TC, Glenn D, et al. Feasibility of ablation as an alternative to surgical metastasectomy in patients with unresectable sarcoma pulmonary metastases. Interact Cardiovasc Thorac Surg 2009;9 : 1051–1053.
27. Bargellini I, Bozzi E, Cioni R, et al. Radiofrequency ablation of lung tumours. Insights Imaging 2011;2 : 567–576.
28. Szöke T, Kortner A, Neu R, et al. Is the mediastinal lymphadenectomy during pulmonary metastasectomy of colorectal cancer necessary? Interact Cardiovasc Thorac Surg 2010;10 : 694–698.
29. Kudelin N, Bölükbas S, Eberlein M, et al. Metastasectomy with standardized lymph node dissection for metastatic renal cell carcinoma: an 11-year single-center experience. Ann Thorac Surg 2013;96 : 265–270.
30. Doležel J, Jedlička V, Peštál A, et al. Četnost metastatického postižení mediastinálních uzlin během plicní metastazektomie. Rozhl Chir 2011;90 : 653–655.
31. Brandi G, Derenzini E, Falcone A, et al. Adjuvant systemic chemotherapy after putative curative resection of colorectal liver and lung metastases. Clin Colorectal Cancer 2013;12 : 188–194.
32. Gonzalez M, Poncet A, Combescure C, et al. Risk factors for survival after lung metastasectomy in colorectal cancer patients: a systematic review and meta-analysis. Ann Surg Oncol 2013;20 : 572–579.
33. Salah S, Watanabe K, Welter S, et al. Colorectal cancer pulmonary oligometastases: pooled analysis and construction of a clinical lung metastasectomy prognostic model. Ann Oncol 2012;23 : 2649–2655.
34. Cho S, Song IH, Yang HC, et al. Prognostic factors of pulmonary metastasis from colorectal carcinoma. Interact Cardiovasc Thorac Surg 2013;17 : 303–307.
35. Li WH, Peng JJ, Xiang JQ, et al. Oncological outcome of unresectable lung metastases without extrapulmonary metastases in colorectal cancer. World J Gastroenterol 2010;16 : 3318–3324.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 4-
All articles in this issue
- Chirurgická léčba rektokély – mnoho technik, málo jednoznačných závěrů
- Plicní metastázy – dvanáctileté zkušenosti s chirurgickou léčbou
- Pilotní studie: korekce levátorového hiátu anální páskou jako chirurgická metoda léčby střevní inkontinence
- Dlouhodobé výsledky po klasických plastikách malých pupečních kýl
- Endometrióza hrubého čreva – kazuistika
- Těžká akutní pankreatitida – řešení komplikací kombinací miniinvazivních přístupů
- Komplikace hemoroidů
- Akutní periproktální abscesy
- Poranění anorekta
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní periproktální abscesy
- Chirurgická léčba rektokély – mnoho technik, málo jednoznačných závěrů
- Komplikace hemoroidů
- Plicní metastázy – dvanáctileté zkušenosti s chirurgickou léčbou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

