-
Medical journals
- Career
Pozdní selhání endovaskulárního řešení aneuryzmatu subrenální aorty – diagnostika a léčba
Authors: B. Čertík 1; V. Třeška 1; F. Šlauf 2; R. Šulc 1; M. Čechura 1; J. Moláček 1
Authors‘ workplace: Chirurgická klinika FN Plzeň-Lochotín, přednosta: Prof. MUDr. V. Třeška DrSc. 1; Klinika zobrazovacích metod FN Plzeň-Lochotín, přednosta: Prof. MUDr. B. Kreuzberg CSc. 2
Published in: Rozhl. Chir., 2013, roč. 92, č. 8, s. 443-449.
Category: Original articles
Overview
Úvod:
V dnešní době existují dvě možnosti řešení výdutí břišní aorty. Otevřená resekce, která patří bezesporu mezi velké operační výkony, a endovaskulární řešení, které představuje menší operační zátěž pro nemocného. Při dlouhodobém sledování nemocných po endovaskulárním řešení bylo prokázáno pozdní selhání v 7–17 % případů. Pozdní výskyt endoleaků a migrace stentgraftů jsou vysvětlovány změnou anatomie aneuryzmatu a z toho vyplývající změnou mechanického tlaku na stentgraft. Pokud nelze tyto stavy řešit endovaskulárním postupem, představují pro cévního chirurga technickou výzvu.Materiál a metodika:
V našem sdělení na základě 5 kazuistik upozorňujeme na možné pozdní komplikace EVAR a řešení jednotlivých stavů.Závěr:
Do budoucna je nutno počítat s tím, že pokud není prokázaný endoleak, neznamená to, že se nemůže v průběhu let objevit a masivně plnit vyřazené aneuryzma s nebezpečím jeho ruptury. Reoperace otevřenou cestou je nepochybně náročným výkonem, nicméně je možná i u nemocných, kterým primárně byl z hlediska polymorbidit indikován EVAR.Klíčová slova:
aneuryzma břišní aorty – stentgraft – endoleakÚvod
V dnešní době existují dvě možnosti řešení výdutí břišní aorty (AAA). Otevřená resekce (OpenResection – OR), která patří bezesporu mezi velké operační výkony, a endovaskulární řešení (EndoVascular Aneurysm Repair – EVAR), které představuje menší operační zátěž pro nemocného.
Přestože byl první stentgraft do AAA zaveden již v roce 1991 a v uplynulých 20 letech lze celosvětově pozorovat obrovský zájem o EVAR, nelze EVAR využít k řešení všech AAA. Omezení EVAR je dáno jednak přístupovou cestou k zavedení stentgraftu, tzn. nálezem na pánevním řečišti a morfologií výdutě, především nálezem v oblasti proximálního krčku AAA. Navíc více než 20leté zkušenosti s EVAR prokázaly, že se nejedná o metodu postrádající komplikace. Vlastní zákrok EVAR je provázen nižší perioperační morbiditou a mortalitou ve srovnání s OR, na druhou stranu je však EVAR zatížen vyšším počtem možných komplikací. Kromě malého procenta výskytu komplikací, které jsou společné pro obě metody řešení AAA, se u EVAR bohužel ve vysokém procentu vyskytují specifické komplikace označované jako endoleaky (únik krve do vyřazené výdutě) [1,2].
Endoleak I. typu (proximální či distální) a endoleak III. typu při rozpojení komponent stentgraftu znamenají ve své podstatě selhání EVAR a trvá nadále hrozba ruptury výdutě. Metodou první volby řešení endoleaku I. typu je remodelace stentgraftu v místě aktivní fixace pomocí angioplastického balonku. Při perzistenci endoleaku je druhou možností prodloužení stentgraftu korekční extenzí. Pokud by hrozilo překrytí odstupů renálních tepen, lze použít ke korekci nekrytý Palmazův stent. Endoleak III. typu také vyžaduje bezprostřední korekci, nejčastěji endovaskulárně překrytím komponent pomocí extenze. V případě selhání endovaskulárního řešení a při perzistenci proximálního nebo distálního endoleaku I. typu a endoleaku III. typu je nutná konverze na OR [3,4].
Endoleaky II., IV. a V. typu jsou méně nebezpečné, často se spontánně uzavřou, ale při dlouhodobém přetrvávání endoleaků a především při symptomatologii z AAA či nárůstu průměru výdutě vyžadují další řešení, případně až konverzi na OR. U endoleaků II. typu je také popisována možnost otevřené nebo laparoskopické ligace vyživujících cév nebo jejich endovaskulární embolizace [5,6].
V nízkém procentu případů se vyskytuje selhání celého procesu EVAR (technické obtíže s průchodem pánevním řečištěm, perforace pánevního řečiště, špatné zakotvení stentgraftu apod.), kdy je nutné ihned konvertovat na OR.
Mezi častější komplikace po EVAR ve srovnání s OR patří dále končetinová ischemie, která se vyskytuje především po technicky obtížném zavádění stentgraftů přes výrazně vinuté pánevní řečiště. Časný i pozdní výskyt končetinové ischemie v důsledku periferní embolizace nebo trombózy pánevního řečiště byl prokázán po EVAR v 2 % případů [7,8].
Indikace k EVAR je proto doporučována při příhodné morfologii pánevního řečiště a vlastní výdutě především pro nemocné nevhodné k OR a nemocné vysokého věku. Z celkového počtu elektivně řešených AAA získává EVAR celosvětově převahu nad OR, u nemocných vysokého věku nad 85 let dosahuje 70% zastoupení [9,10].
Na našem pracovišti používáme EVAR od roku 2001. Pro EVAR se rozhodujeme u nemocných převážně vysokého věku anebo se závažnějším interním onemocněním. Indikaci k EVAR navrhuje cévní chirurg, intervenční radiolog na základě grafického vyšetření (CTA – angiografie computerovou metodou) potvrdí nebo vyloučí technickou schůdnost EVAR. Po definitivní indikaci k EVAR intervenční radiolog zodpovídá za zhotovení stentgraftu a jeho zavedení, cévní chirurg zajišťuje přístup k zavedení stentgraftu. V případě komplikací (časných i pozdních), které nelze řešit endovaskulárně, rozhoduje o dalším postupu cévní chirurg. Na našem pracovišti prozatím dáváme přednost otevřené resekci a náhradě AAA (přibližně v poměru 4 : 1). Důvodem našeho postupu jsou kvalitní krátkodobé (mortalita < 4 %) a dlouhodobé výsledky po resekci AAA.
V našem sdělení chceme na základě 5 kazuistik upozornit na možné pozdní komplikace EVAR a řešení jednotlivých stavů.
Kazuistika 1
75letá nemocná přijata pro asymptomatické AAA o průměru 5 cm. Vzhledem ke kardiální anamnéze – námahová angina pectoris po kardiologické intervenci na koronárních tepnách – byla indikována k EVAR.
Dne 5. 10. 2005 byl nemocné zaveden bifurkační stentgraft (Talent, Medtronic AVE inc., Holandsko).
Již během výkonu bylo zjištěno zalomení pravé nožičky stentgraftu a vyřešeno zavedením samoexpandibilního stentu. Při kontrolní angiografii computerovou tomografií (CTA) jsme diagnostikovali endoleak I. typu a restenózu na pravé nožičce (Obr. 1).
Image 1. CTA obraz proximálního endoleaku I. typu Fig. 1: CTA image of the proximal type I endoleak 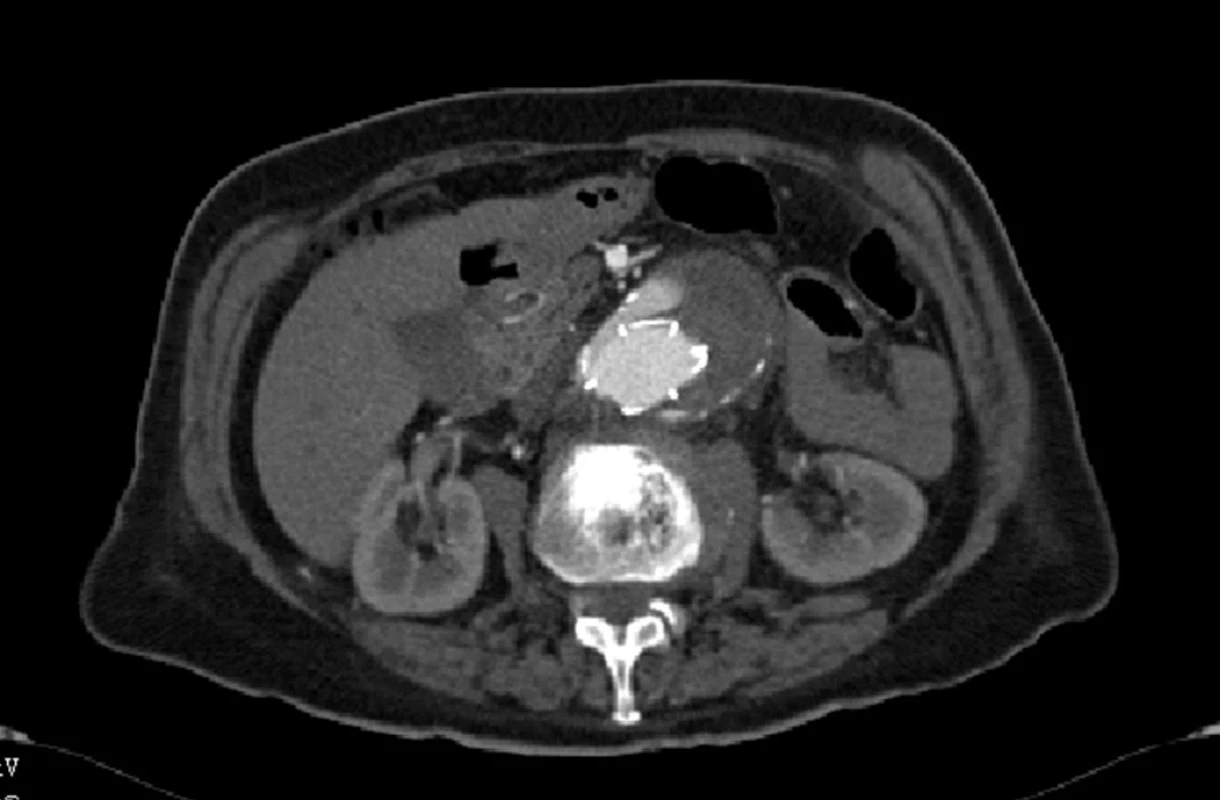
Dne 12. 10. 2005 byla provedena remodelace proximálního ukotvení stentgraftu a zaveden do pravé nožičky Expres LDstent (Boston Scientific, USA). Při další kontrole jsme již proximální endoleak nezaznamenali, přetrvával pouze endoleak II. typu z dolní mezenterické tepny a jedné lumbální tepny vlevo. Až do kontroly v roce 2008 byl stav stacionární, vak bez progrese, endoleak II. typu se při grafických kontrolách zmenšil, až vymizel (Obr. 2).
Image 2. Kontrolní CTA 2008 bez průkazu endoleaku Fig. 2: A control CTA 2008 without any evidence of an endoleak 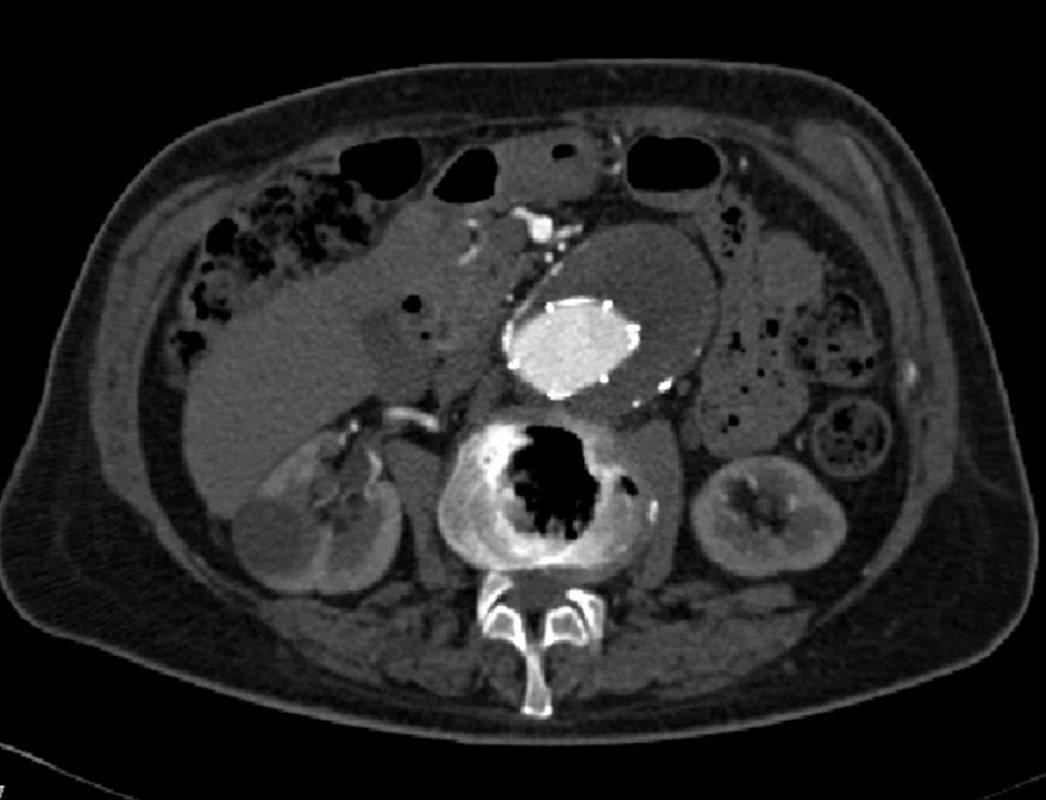
V roce 2009 jsme však prokázali při CTA kontrole významnou progresi šíře vaku (za rok o více než 1 cm) a opět se objevil endoleak pravděpodobně II. typu.
Nemocnou jsme prozatím neindikovali k otevřenému chirurgickému řešení a rozhodli o dalším sledování vývoje vaku. S odstupem 6 měsíců došlo k další progresi velikosti vaku o 1 cm a tentokrát se na CTA zobrazil i endoleak I. typu (Obr. 3).
Image 3. Významná progrese šíře aneuryzmatu, pozdní proximální endoleak I. typu Fig. 3: A significant progression of the width of the aneurysm, a late proximal type I endoleak 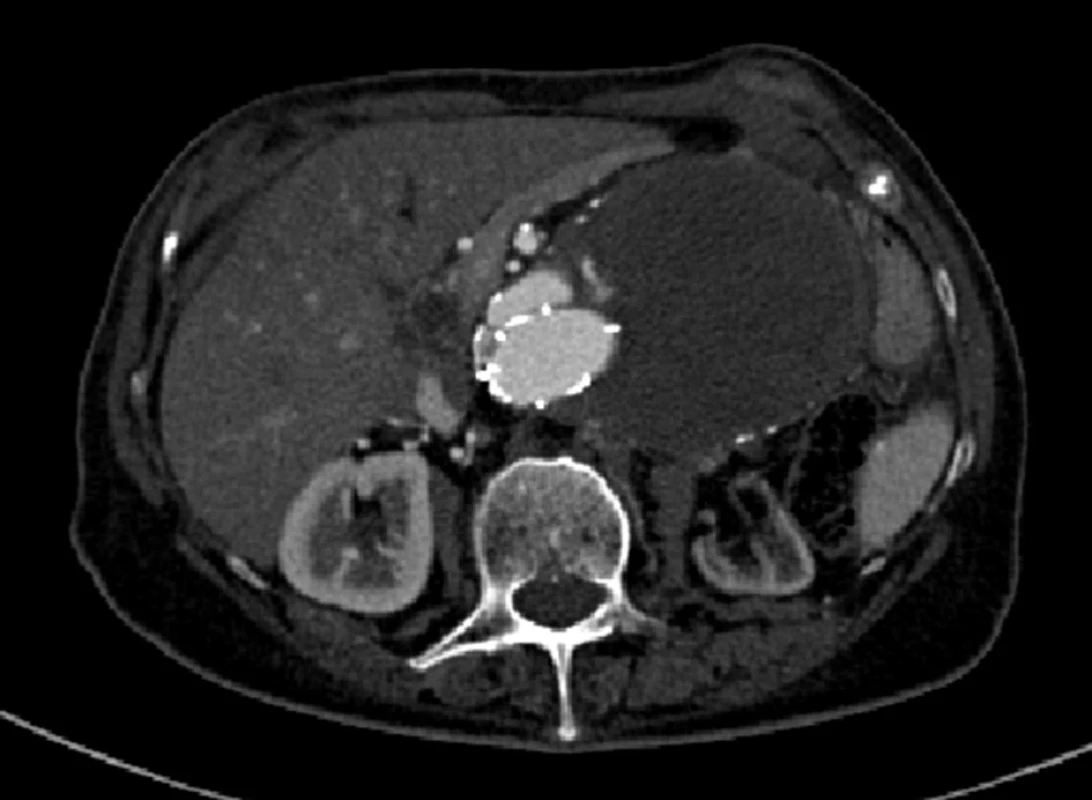
U nemocné byly vyčerpány všechny možnosti endovaskulárního řešení a vzhledem k vysokému riziku ruptury rostoucí výdutě jsme rozhodli o otevřeném řešení z vitální indikace. Velkou výduť jsme resekovali, nahradili tubulární protézou, kterou jsme anastomozovali end to end s distální částí stentgraftu (Obr. 4).
Image 4. Resekce proximální části stentgraftu s využitím jeho distální části Fig. 4: A resection of the proximal stentgraft using its distal portion 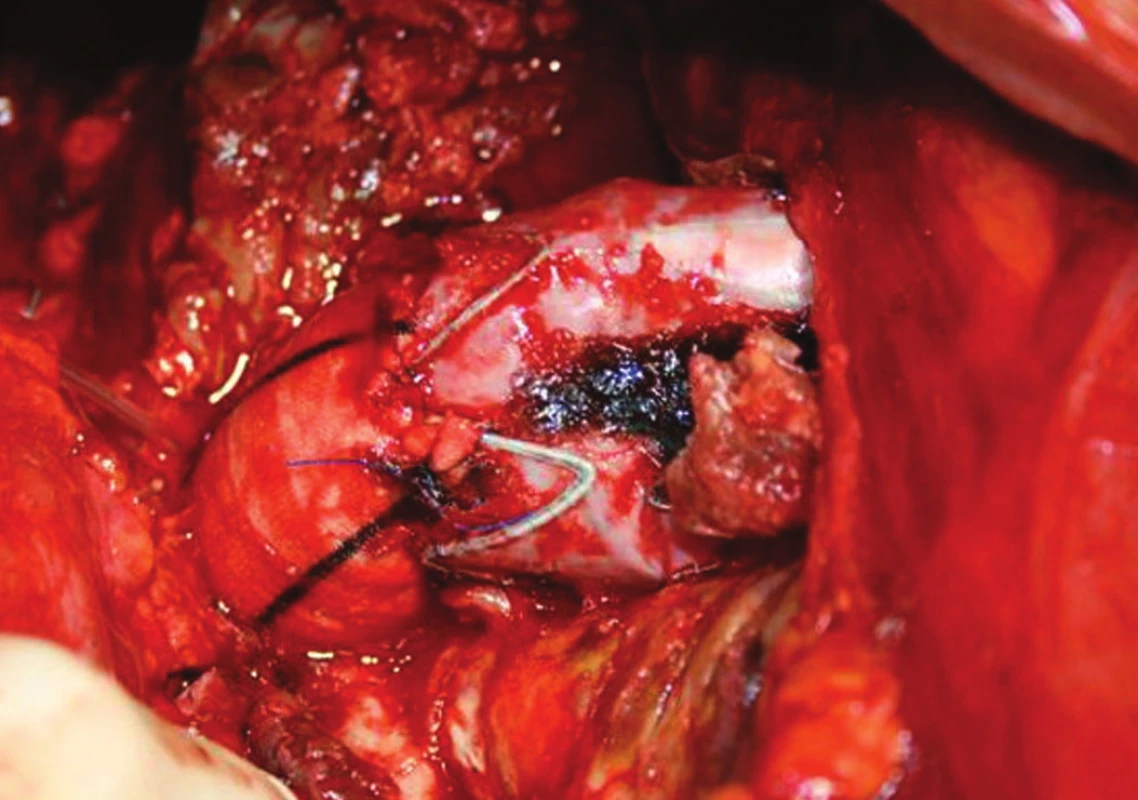
Pooperační průběh byl komplikován krvácením z retroperitonea z oblasti pankreatu. Při reoperaci jsme nález řešili distální pankreatektomií a tamponádou retroperitonea, kterou jsme odstranili po 48 hodinách. Nemocná zůstala na umělé plicní ventilaci 5 dnů, v dalším průběhu již nedošlo k závažným komplikacím. Nemocná byla propuštěna do domácí péče 30 dní po reoperaci.
Kazuistika 2
80letá nemocná přijata pro symptomatické AAA velikosti 5 cm. Vzhledem k vysokému věku a kardiálnímu nálezu – po opakovaných infarktech myokardu – indikována k EVAR.
Dne 27. 11. 2001 byl nemocné zaveden bifurkační stentgraft (Zenith Cook Medical inc., Dánsko).
Při kontrolním CTA jsme prokázali proximální endoleak I. typu, který byl dne 11. 12. 2001 řešen zavedením proximální extenze. Při dalších kontrolách byl nález příznivý, žádný endoleak jsme již neprokázali až do roku 2010.
Dne 5. 5. 2010 bylo nemocné pro silné bolesti břicha provedeno kontrolní CTA, kde jsme prokázali nový proximální endoleak I. typu a zatékání krve do původně vyřazeného vaku (Obr. 5, 6).
Image 5. CTA obraz proximálního endoleaku I. typu Fig. 5: CTA image of the proximal type I endoleak 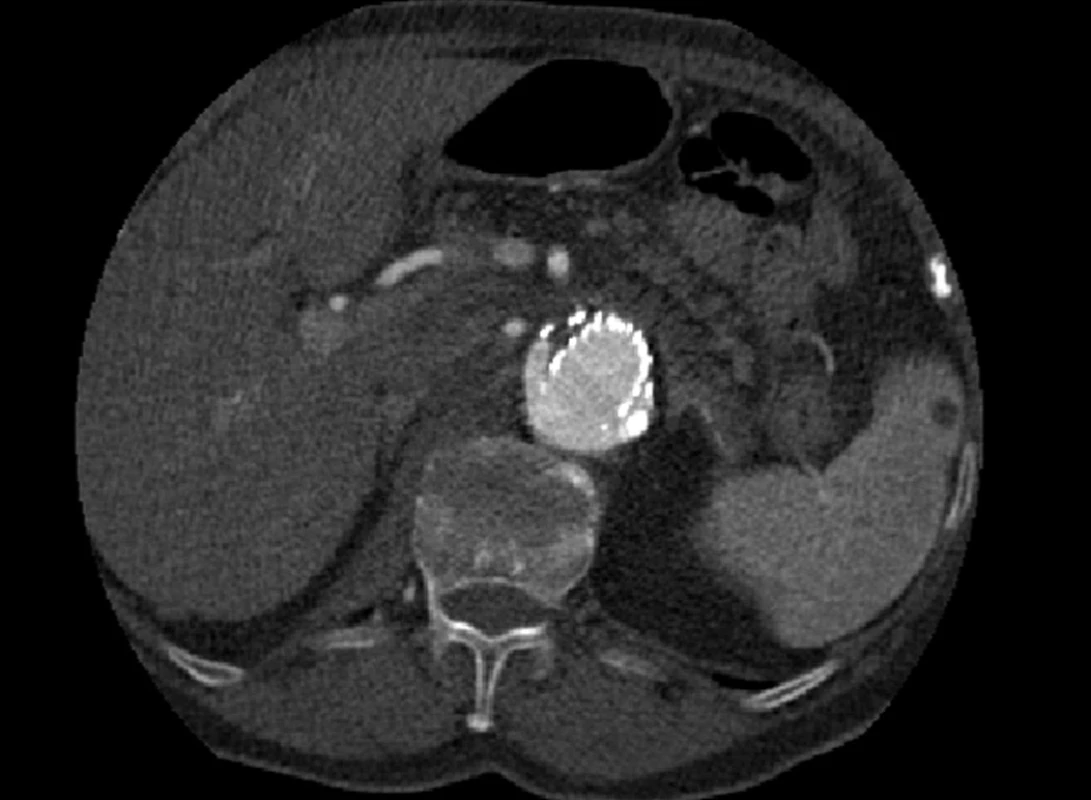
Image 6. CTA obraz masivního endoleaku Fig. 6: CTA image of a massive endoleak 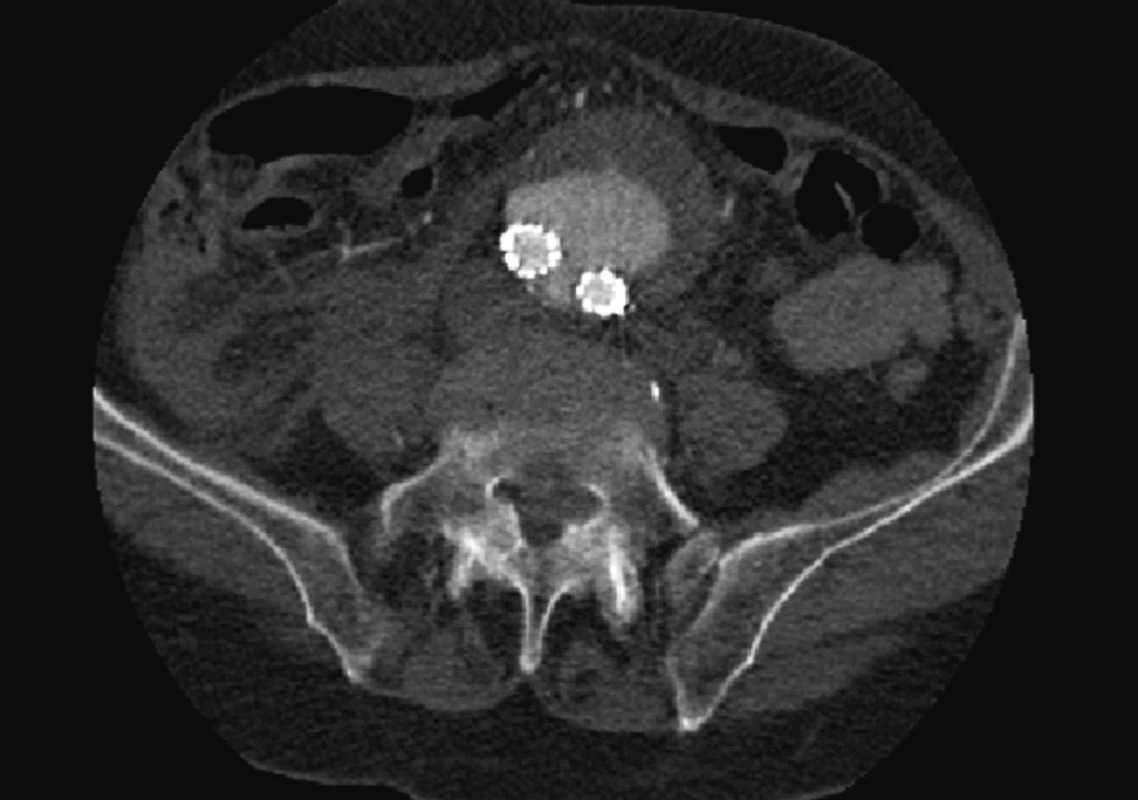
Nemocnou jsme z vitální indikace operovali, provedli resekci prokrvácené výdutě s extrakcí stentgraftu a nahradili bifurkační protézou. Přes příznivé první pooperační dny, kdy byla nemocná již extubována a nebylo známek žádné pooperační komplikace, došlo u nemocné 4. pooperační den ke kardiálnímu selhání, které se nepodařilo zvládnout.
Kazuistika 3
64letý nemocný přijat pro asymptomatické AAA o průměru 6 cm. Vzhledem k obezitě a interním komorbiditám (chronická plicní choroba, tachyarytmie) – indikován k EVAR.
Dne 19. 11. 2008 byl nemocnému zaveden bifurkační stentgraft (Talent, Medtronic AVE inc., Holandsko).
Při kontrolním CTA jsme prokázali distální endoleak I. typu v oblasti pravé nožičky, který se při další kontrole nezobrazil, proto bylo postupováno konzervativně.
Dne 8. 6. 2010 byl nemocný akutně vyšetřen pro bolesti v levé bederní krajině a zjištěna ruptura vaku při znovuobjevení distálního endoleaku I. typu pravé nožičky stentgraftu (Obr. 7).
Image 7. CTA obraz distálního endoleaku I.typu pravé nožičky s rupturou vaku do levého retroperitonea Fig. 7: CTA image of the distal type I endoleak of aright leg with a rupture into the left retroperitoneum 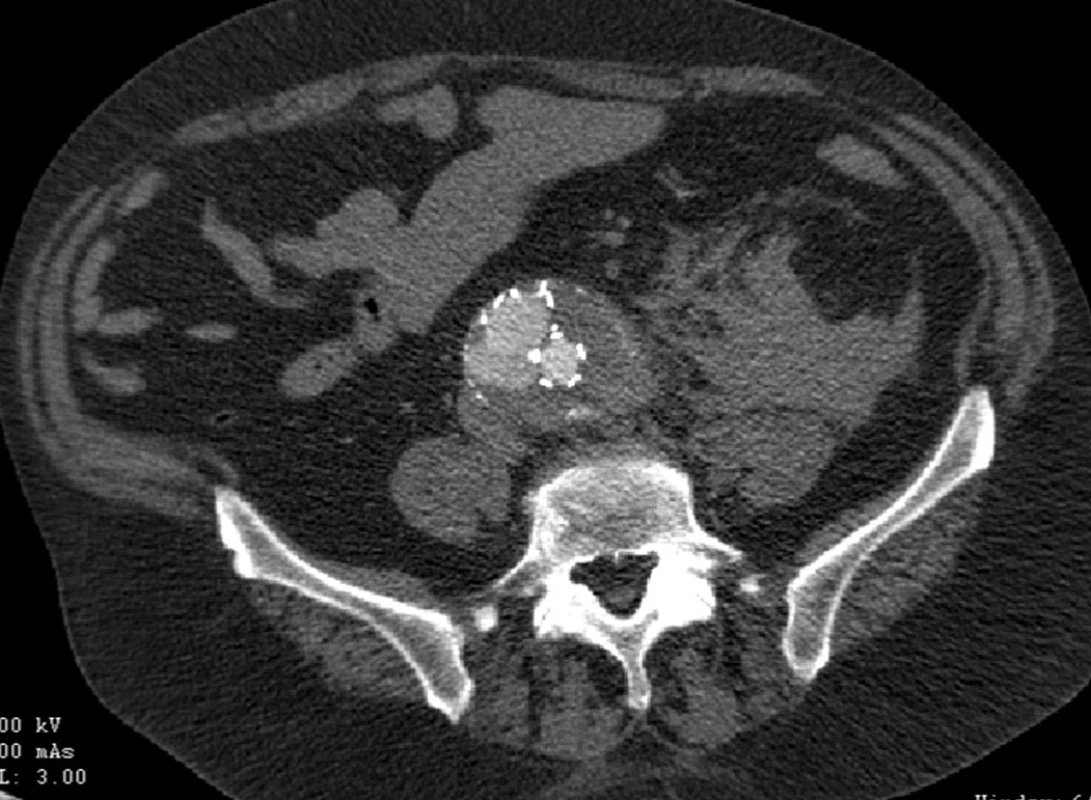
Nemocného jsme akutně operovali, rupturovanou výduť jsme resekovali a po extrakci stentgraftu aorto-aortálně nahradili.
Nemocného jsme po 14 dnech propustili v pořádku do domácí péče.
Kazuistika 4
81letá nemocná přijata pro asymptomatické AAA průměru 7 cm, vzhledem k věku indikována k EVAR.
Dne 28. 2. 2007 byl nemocné zaveden bifurkační stentgraft (Talent, Medtronic AVE inc., Holandsko). Při kontrolním CTA jsme prokázali distální endoleak I. typu v oblasti pravé nožičky (Obr. 8).
Image 8. CTA obraz distálního endoleaku I. typu pravé nožičky stentgraftu Fig. 8: CTA image of the distal type I endoleak of a right leg of the stent graft 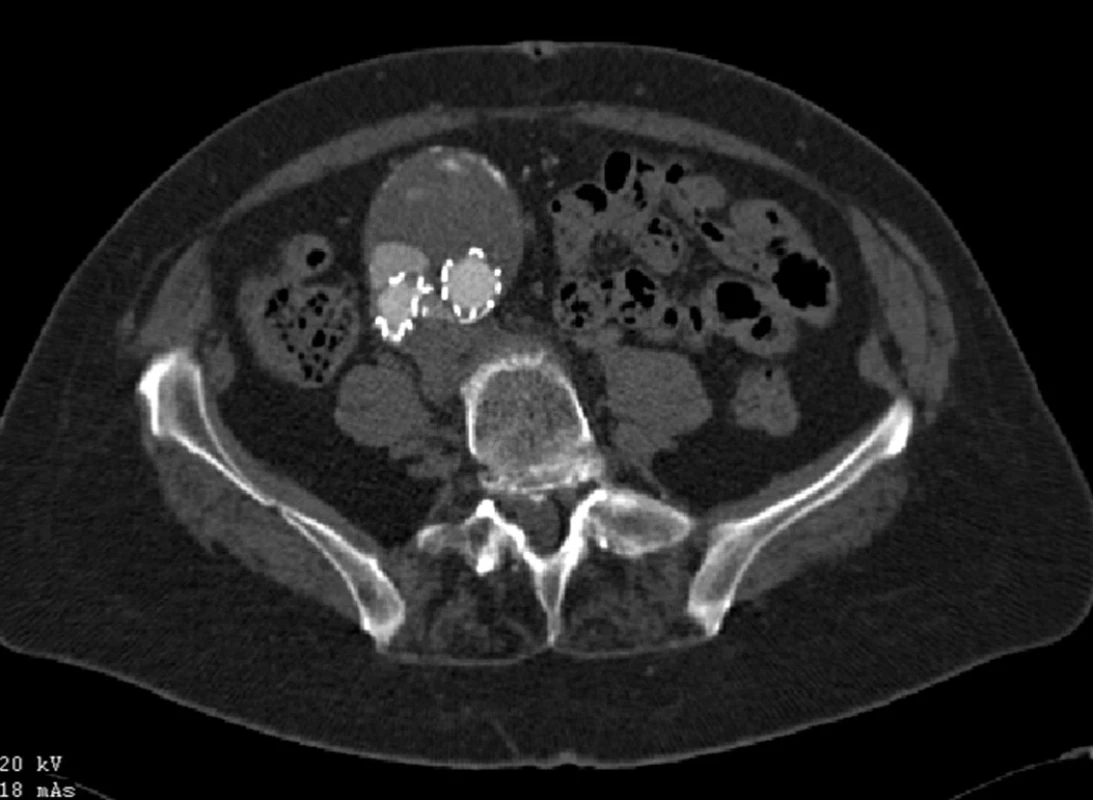
V květnu 2007 byl nález řešen zavedením extenze do pravé nožičky stentgraftu. Při další CTA kontrole jsme prokázali opět distální endoleak I. typu, tentokrát v oblasti levé nožičky stentgraftu (Obr. 9).
Image 9. CTA obraz distálního endoleaku I. typu levé nožičky stentgraftu Fig. 9: CTA image of the distal type I endoleak of a left leg of the stent graft 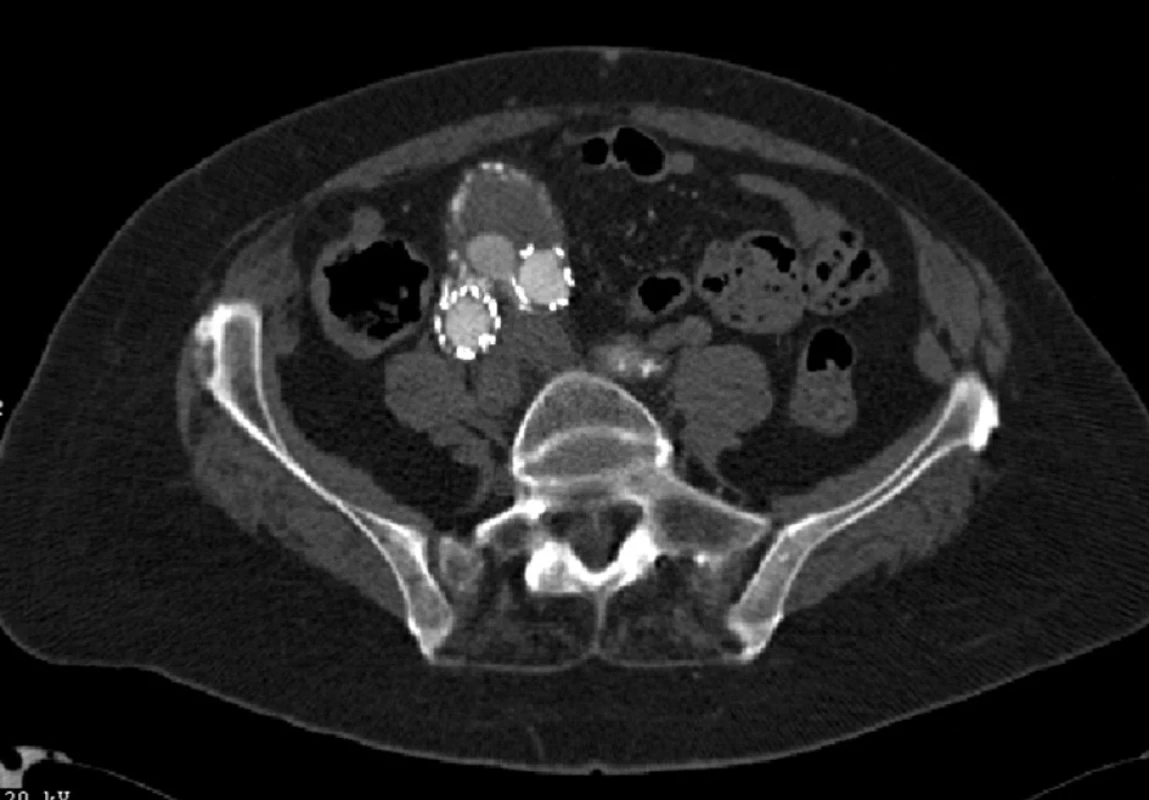
V říjnu 2007 byl nález řešen zavedením extenze do levé nožičky stentgraftu.
Při dalších CTA kontrolách zůstával trvale endoleak II. typu až do roku 2011, kdy jsme prokázali významnou progresi velikosti vaku při možném i proximálním endoleaku I. typu.
Vzhledem k rostoucí výduti s opětovným leakem jsme nemocnou indikovali k otevřené resekci. Resekovali jsme výduť, stentgraft i extenze jsme extrahovali a založili aortobiilickou náhradu (Obr. 10,11,12).
Image 10. Extrakce stentgraftu, subdiafragmaticky naložená aortální svorka Fig. 10: An extraction of the stentgraft, a subdiaphragmatic laden aortic clamp 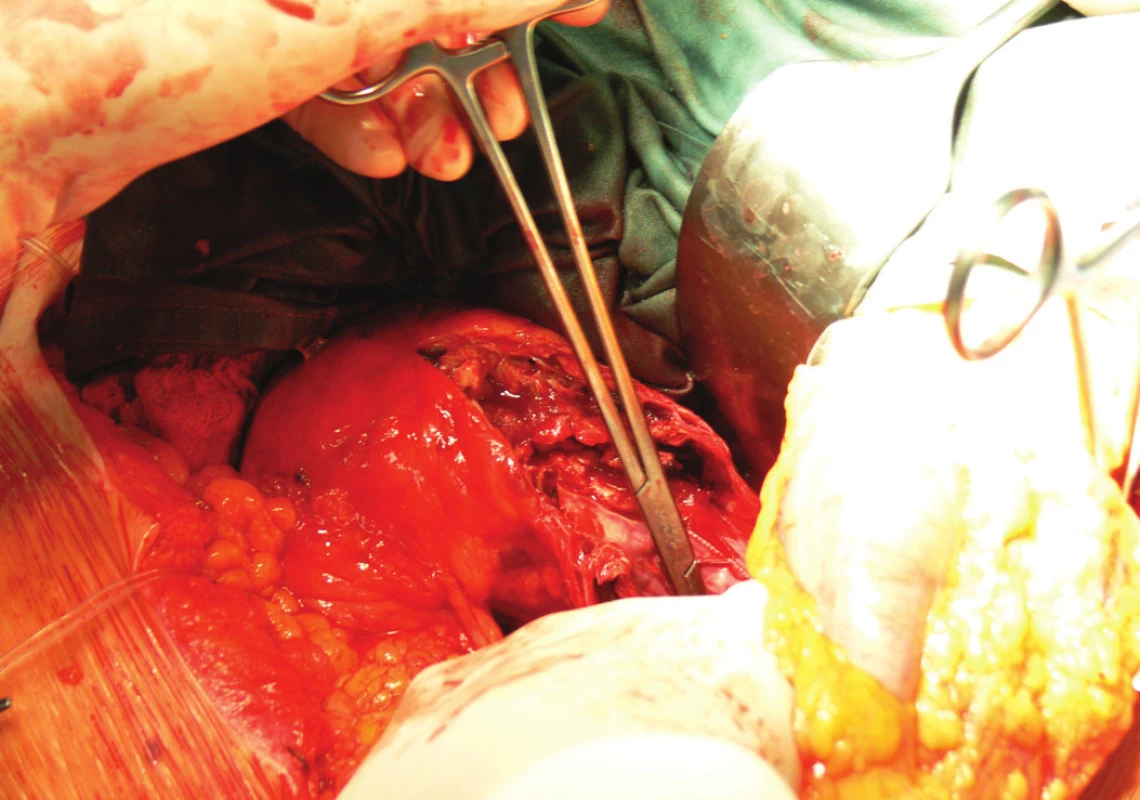
Image 11. Odstraněný stentgraft včetně extenzí Fig. 11: Removed stentgraft including extensions 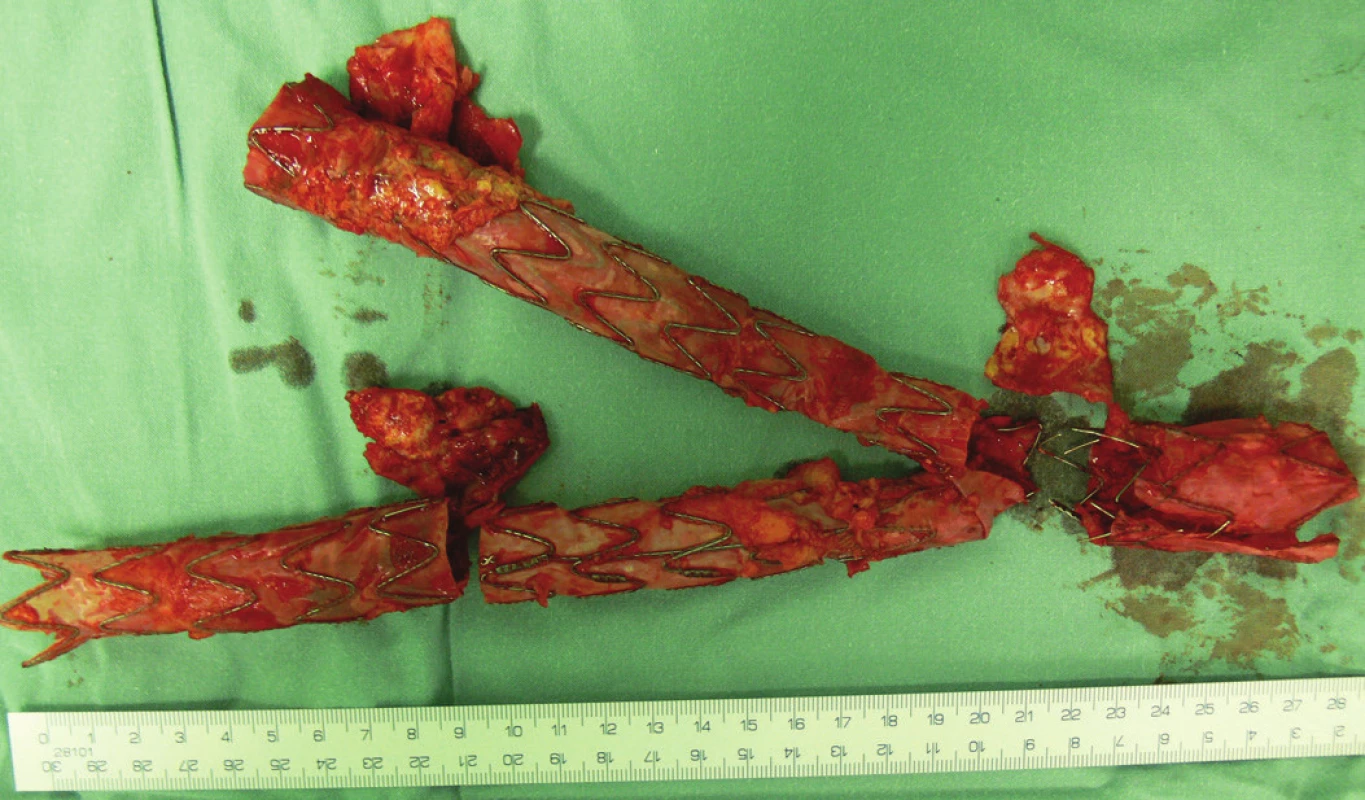
Image 12. Aortobiilická náhrada, v nástěnném trombu patrný kanál po endoleaku Fig. 12: Aortobiiliac replacement, in wall thrombus visible channel for endoleak 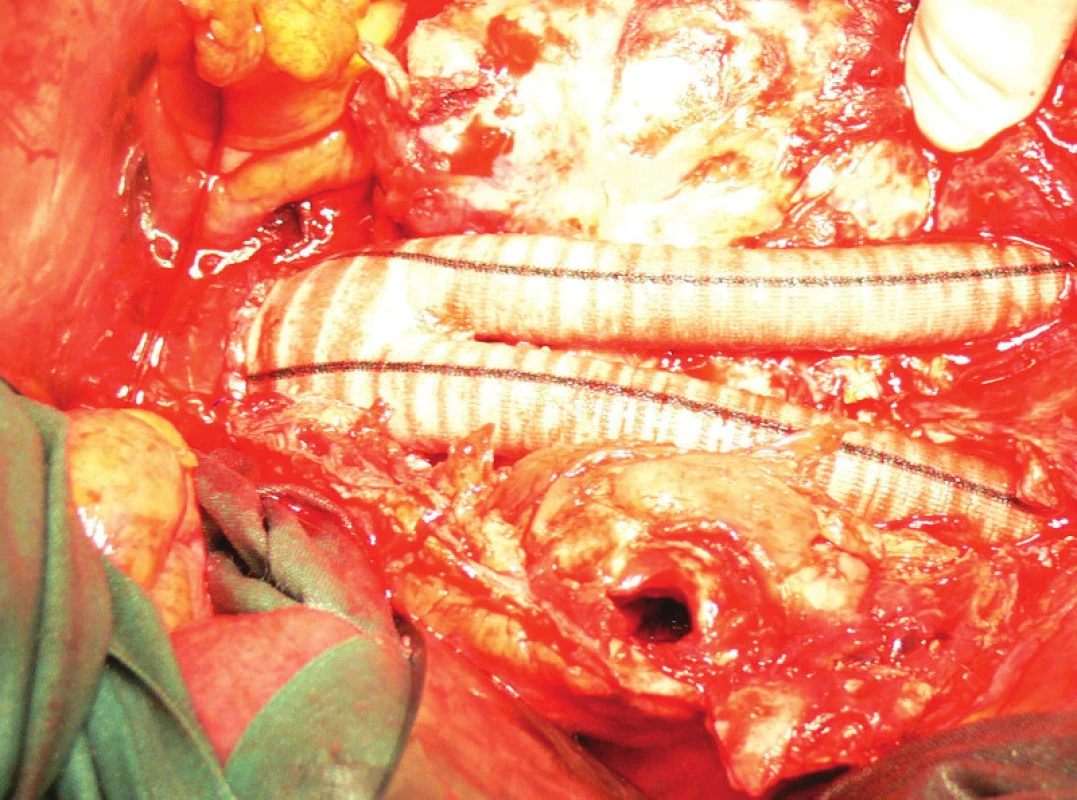
Po 3týdenní pooperační péči jsme nemocnou propustili v pořádku do domácí péče.
KaZuistika 5
75letá nemocná přijata pro asymptomatické rostoucí AAA o průměru 5 cm. Vzhledem k věku indikována k EVAR.
Dne 19. 4. 2011 byl nemocné zaveden bifurkační stentgraft (Zenith Cook Medical inc., Dánsko).
Po nekomplikovaném výkonu jsme prokázali na kontrolním CTA pouze nevýznamný endoleak II. typu cestou dolní mezenterické tepny, ale pravděpodobně zde byl přítomný i endoleak III. typu. Prozatím rozhodnuto o konzervativním postupu (Obr. 13).
Image 13. CTA obraz endoleaku II. typu a možná i III. typu Fig. 13: CTA image of type II endoleak and possibly type III. endoleak 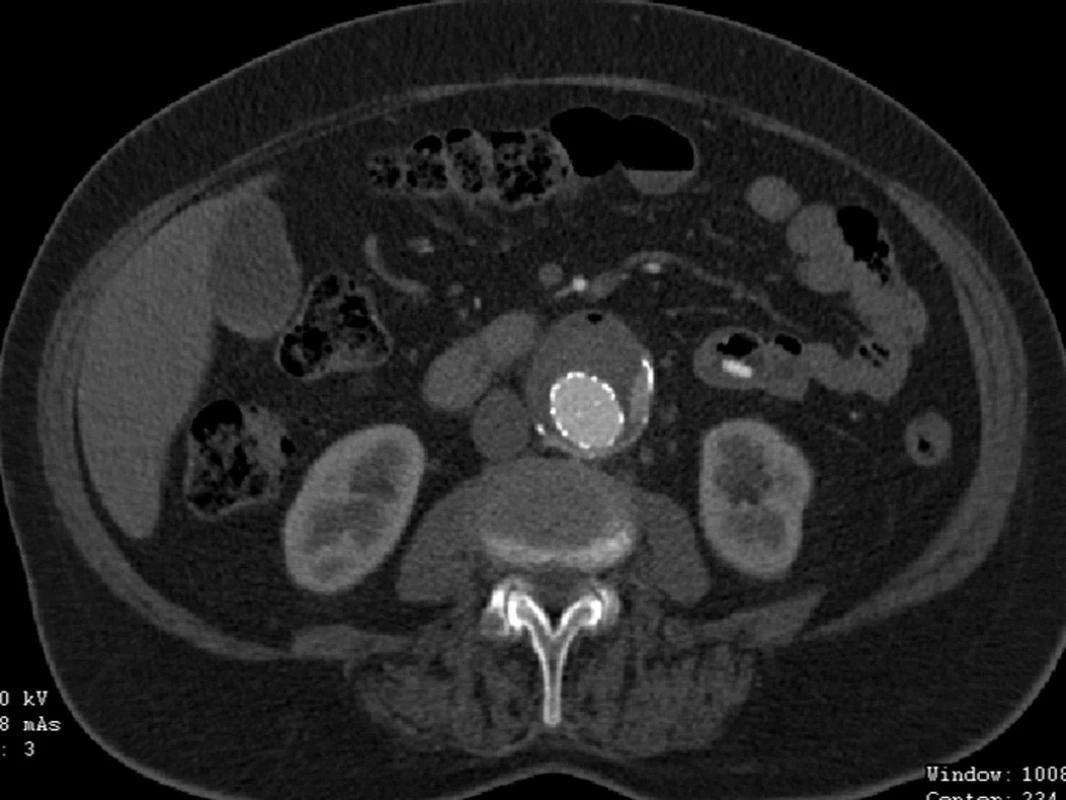
V srpnu 2011 byla nemocná přijata zpět na naši kliniku pro známky embolizace do periferních tepen pravé dolní končetiny a na kontrolním CTA jsme prokázali endoleak III. typu v napojení nožiček na tělo stentgraftu a intraluminálně v graftu přítomný nástěnný trombus, který byl zdrojem embolizace do podkolenní tepny vpravo (Obr. 14, 15).
Image 14. CTA obraz embolie do podkolenní tepny vpravo Fig. 14: CTA image embolism in the right popliteal artery 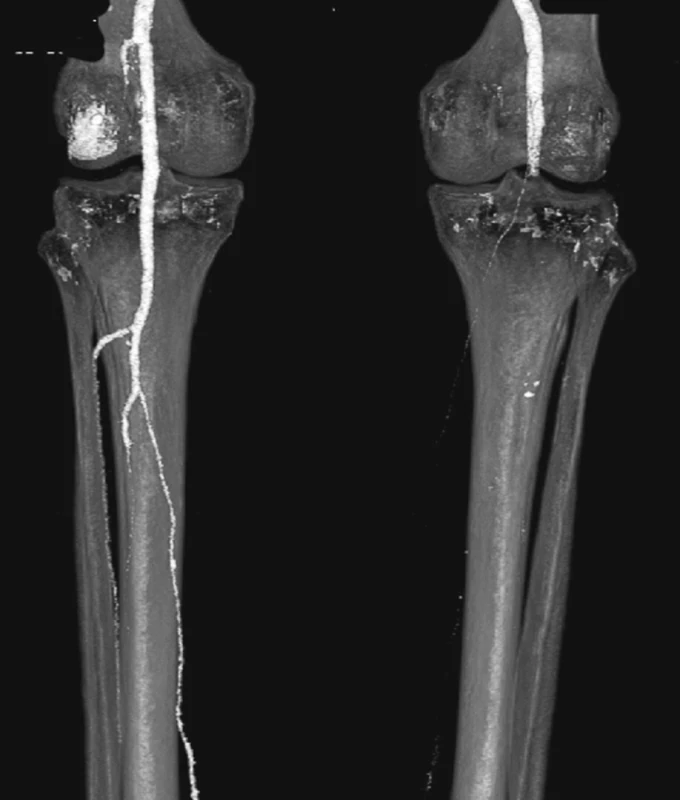
Image 15. CTA obraz endoleaku III. typu Fig. 15: CTA image type III endoleak 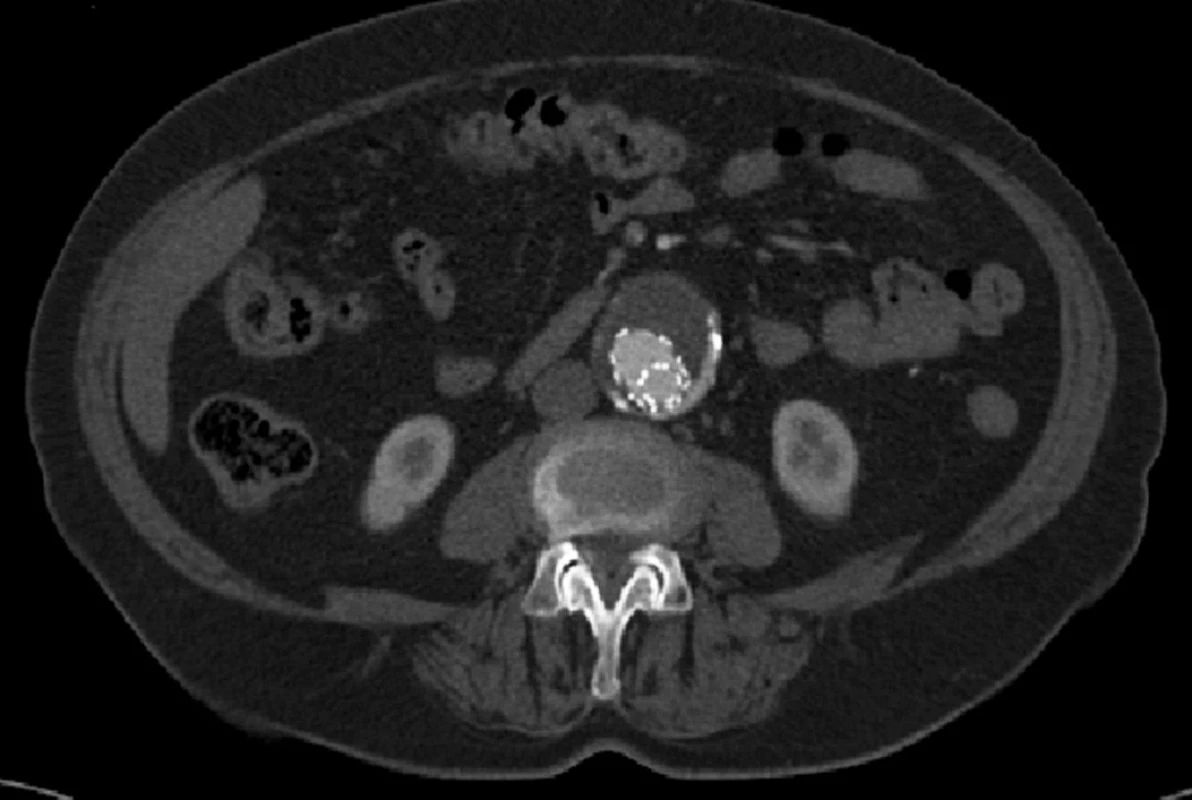
Nemocnou jsme po přípravě operovali, otevřeně jsme resekovali výduť, extrahovali stentgraft a po embolektomii z periferie tepen pravé dolní končetiny založili bifurkační náhradu. Po 2týdenní pooperační péči jsme nemocnou propustili v pořádku do domácí péče (Obr. 16, 17).
Image 16. Extrahování stentgraftu Fig. 16: Extracting the stentgraft 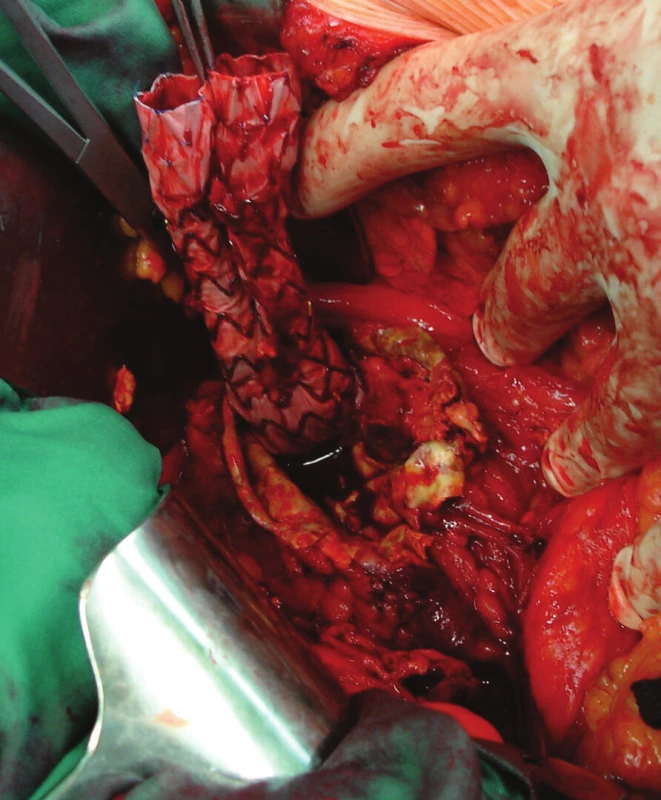
Image 17. Nástěnný trombus uvnitř stentgraftu Fig. 17: Wall thrombus within the stentgraft 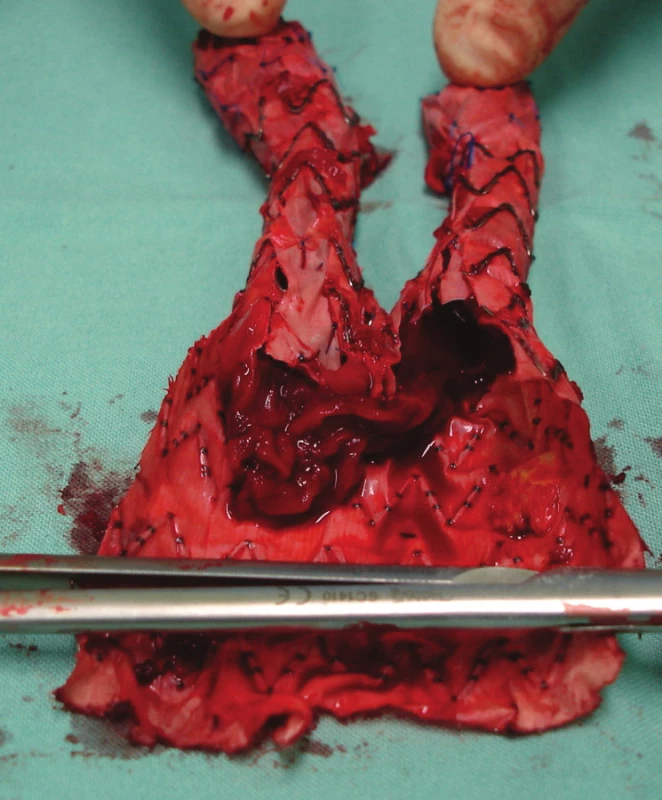
Diskuze
Při dlouhodobém sledování nemocných po EVAR byl prokázán pozdní výskyt endoleaků v 7–17 % případů (měsíce až roky od zavedení stentgraftu v případech, kde předchozí grafická vyšetření žádný z endoleaků neprokázala). Dokonce byly prokázány i migrace stentgraftů (posun graftu z původní polohy o více než 10 mm) v závislosti na typu aktivní fixace od 0–7 % případů v průběhu jednoho a více roků. Pozdní výskyt endoleaků a migrace stentgraftů jsou vysvětlovány změnou anatomie aneuryzmatu a z toho vyplývající změnou mechanického tlaku na stentgraft. Řadu z nich nelze řešit endovaskulárním postupem a představuje pro cévního chirurga technickou výzvu [11,12,13,14,15,16,17].
Hlavním problémem při následné otevřené reoperaci je zajistit místo k bezpečnému naložení proximální svorky, protože zavedený stentgraft je proximální částí fixován v oblasti renálních tepen, nebo dokonce přesahuje svou nekrytou částí vysoko do viscerálního segmentu aorty. Extrakce vlastního stentgraftu je velice obtížná, především tam, kde po letech je fixační zóna pevně do stěny vtlačená, nebo dokonce fixační háčky stěnou aorty prostupují. Vždy zde hrozí vysoké riziko poškození aortální stěny a odstupujících viscerálních větví až do technicky neřešitelných stavů.
Naše kazuistiky jsou dokladem komplexnosti této problematiky s využitím endovaskulárních technik a po vyčerpání všech možností pak nutností otevřeného operačního řešení. Při otevřené resekci při selhání stentgraftu jsme ve většině případů museli svorkovat aortu subdiafragmaticky a po resekci výdutě s extrakcí proximální porce stentgraftu jsme mohli svorku přesunout subrenálně. Při extrakci proximálního úseku stengraftu, jehož nekrytá část byla zakotvena vysoko přes ústí renálních tepen, jsme použili Listonovy kleště k přeštípání fixačních háčků. Distální komponenty (nožičky) jsme většinou extrahovali z pánevních tepen bez obtíží, v jednom případě jsme využili distální úsek těla stengraftu k našití cévní náhrady.
Závěr
Otázkou zůstává, jak často a jak dlouho sledovat nemocné po EVAR z hlediska možných dlouhodobých komplikací [18]. Zda jsme schopni skutečně graficky postihnout všechny endoleaky a správně je interpretovat. Rozhodně je do budoucna nutno počítat s tím, že pokud není prokázaný endoleak, neznamená to, že se nemůže v průběhu let objevit a masivně plnit vyřazený vak s nebezpečím jeho ruptury. V našem případě k tomu došlo ve druhé kazuistice po 9 letech od zavedení stentgraftu. Reoperace otevřenou cestou je pak nepochybně náročným výkonem. Nicméně je možná i u nemocných, kterým primárně bylo z hlediska polymorbidit indikováno zavedení stentgraftu. Rozhodně však tyto výkony patří do specializovaných cévních center s komplexními zkušenostmi v endovaskulární i otevřené léčbě AAA.
Doc. MUDr. Bohuslav Čertík, Ph.D.
Valcha E1713
301 00 Plzeň
e-mail: certik@fnplzen.cz
Sources
1. Mutirangura P, Kruatrachue C, Ophasanond P, Chaiyasoot W, Ruangsetakit C, et al. Sermsathanasawadi N, Chinsakchai K, Phongraweewan O. Endovascular abdominal aortic aneurysm repair in high risk patients: outcomes of management. Journal of the Medical Association of Thailand 2007;90 : 2080–9.
2. Prinssen M, Verhoeven EL, Buth J, Cuypers PW, van Sambeek MR, et al. Dutch Randomized Endovascular Aneurysm Management (DREAM) Trial Group. A randomized trial comparing conventional and endovascular repair of abdominal aortic aneurysms. New England Journal of Medicine 2004;351 : 1607–18.
3. Buth J, Harris PL, van Marrewijk C, Fransen G. The significance and management of different types of endoleaks. Seminars in Vascular Surgery 2003;16 : 95–102.
4. van Marrewijk CJ, Fransen G, Laheij RJ, Harris PL, Buth J. EUROSTAR Collaborators. Is a type II endoleak after EVAR a harbinger of risk? Causes and outcome of open conversion and aneurysm rupture during follow-up. European Journal of Vascular & Endovascular Surgery 2004;27 : 128–37.
5. Baum RA, Carpenter JP, Golden MA, Velazquez OC, Clark TW, et al. Treatment of type 2 endoleaks after endovascular repair of abdominal aortic aneurysms: comparison of transarterial and translumbar techniques. Journal of Vascular Surgery 2002;35 : 23–9.
6. Ho P, Law WL, Tung PH, Poon JT, Ting AC, et al Laparoscopic transperitoneal clipping of the inferior mesenteric artery for the management of type II endoleak after endovascular repair of an aneurysm. Surgical Endoscopy 2004;18 : 870.
7. Schermerhorn ML, O’Malley AJ, Jhaveri A, Cotterill P, Pomposelli F, et al. Endovascular vs. open repair of abdominal aortic aneurysms in the Medicare population. New England Journal of Medicine 2008;358 : 464–74.
8. Carroccio A, Faries PL, Morrissey NJ, Teodorescu V, Burks JA, et al. Predicting iliac limb occlusions after bifurcated aortic stent grafting: anatomic and device-related causes. Journal of Vascular Surgery 2002;36 : 679–84.
9. Traul D, Street D, Faught W, Eaton M, Castillo J, et al. Endoluminal stent-graft placement for repair of abdominal aortic aneurysms in the community setting. Journal of Endovascular Therapy 2008;15 : 688–94.
10. Schwarze ML, Shen Y, Hemmerich J, Dale W. Age-related trends in utilization and outcome of open and endovascular repair for abdominal aortic aneurysm in the United States, 2001–2006. Journal of Vascular Surgery 2009;50 : 722–729.
11. Stelter W, Umscheid T, Ziegler P. Three-year experience with modular stent-graft devices for endovascular AAA treatment. Journal of Endovascular Surgery 1997; 4 : 362–9.
12. Dattilo JB, Brewster DC, Fan CM, Geller SC, Cambria RP, et al. Clinical failures of endovascular abdominal aortic aneurysm repair: incidence, causes, and management. Journal of Vascular Surgery 2002;35 : 1137–44.
13. Wyss TR, Brown LC, Powell JT, Greenhalgh RM. Rate and predictability of graft rupture after endovascular and open abdominal aortic aneurysm repair: data from the EVAR Trials. Annals of Surgery 2010;252 : 805–12.
14. Peterson BG, Matsumura JS, Brewster DC. Makaroun MS. Excluder Bifurcated Endoprosthesis Investigators. Five-year report of a multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysms. Journal of Vascular Surgery 2007;45 : 885–90.
15. Abraham CZ, Chuter TA, Reilly LM, Okuhn SP, Pethan LK, et al. Abdominal aortic aneurysm repair with the Zenith stent graft: short to midterm results. Journal of Vascular Surgery 2002;36 : 217–25.
16. Carpenter JP. Endologix Investigators. Midterm results of the multicenter trial of the powerlink bifurcated system for endovascular aortic aneurysm repair. Journal of Vascular Surgery 2004;40 : 849–59.
17. Tonnessen BH. Sternbergh 3rd, WC. Money SR. Mid - and long-term device migration after endovascular abdominal aortic aneurysm repair: a comparison of AneuRx and Zenith endografts. Journal of Vascular Surgery 2005;42 : 392–401.
18. Corriere MA, Feurer ID, Becker SY, Dattilo JB, Passman MA, et al. Endoleak following endovascular abdominal aortic aneurysm repair: implications for duration of screening. Annals of Surgery 2004;239 : 800–7.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 8-
All articles in this issue
- Intramurálna disekcia pažeráka
- Informovaný souhlas
- Právo na ochranu soukromí
- Lege artis
- Práce pod odborným dohledem
- Obskurní krvácení do zažívacího traktu
- Změny chirurgické techniky při řešení Pectus excavatum v letech 1991–2012
- Jak jsou dodržovány postupy moderní perioperační péče (Enhanced Recovery After Surgery) na chirurgických pracovištích v ČR – výsledky národní ankety
- Pozdní selhání endovaskulárního řešení aneuryzmatu subrenální aorty – diagnostika a léčba
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Práce pod odborným dohledem
- Jak jsou dodržovány postupy moderní perioperační péče (Enhanced Recovery After Surgery) na chirurgických pracovištích v ČR – výsledky národní ankety
- Informovaný souhlas
- Lege artis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

