-
Medical journals
- Career
Pankreatická píštěl – definice, rizikové faktory a možnosti léčby
: F. Čečka 1; B. Jon 1; Z. Šubrt 1,2; A. Ferko 1
: Chirurgická klinika Fakultní nemocnice Hradec Králové a Lékařské Fakulty UK v Hradci Králové přednosta kliniky: prof. MUDr. A. Ferko, CSc. 1; Katedra válečné chirurgie, Fakulta vojenského zdravotnictví, Univerzita Obrany Brno vedoucí katedry: doc. MUDr. L. Klein, CSc. 2
: Rozhl. Chir., 2013, roč. 92, č. 2, s. 77-84.
: Review
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00179906.
Pankreatická píštěl je poměrně častou komplikací po resekci pankreatu. Její incidence se udává mezi 10 a 30 %. Rozdíly incidence mezi jednotlivými studiemi jsou dány především rozdílnými definicemi píštěle. Pankreatická píštěl podle ISGPF je definována jako výdej jakéhokoliv měřitelného množství tekutiny peroperačně zavedenými drény (nebo drény perkutánně zavedenými následně po operaci) po třetím pooperačním dnu, pokud je koncentrace amyláz v tekutině alespoň 3krát vyšší, než je normální sérová koncentrace. Pankreatická píštěl se dělí do 3 stupňů podle klinické závažnosti (A, B, C).
Jsou známé tři různé kategorie rizikových faktorů pro vznik pankreatické píštěle:
související s onemocněním pankreatu, související s pacientem a související s operačním výkonem. Většinu rizikových faktorů vzniku pankreatické píštěle nelze ovlivnit před operací ani během operace. Možnosti prevence vzniku pankreatické píštěle jsou v zásadě dvě: farmakologická intervence (podání somatostatinu nebo jeho derivátů) a technické modifikace ošetření zbytkového parenchymu pankreatu. Z dosažitelné literatury vyplývá, že rutinní podání somatostatinu nebo jeho derivátů u všech operací pankreatu není doporučeno. Spíše je vhodné jeho selektivní podání v případech, kdy je vyšší riziko vzniku pankreatické píštěle. Druhou možností snížení četnosti pankreatické píštěle jsou různé modifikace ošetření zbytkového parenchymu po resekci pankreatu. Většina studií, které testovaly různé způsoby ošetření, byla retrospektivních s nižším stupněm průkaznosti. Dobře vedených randomizovaných studií bylo pouze několik a většina z nich neprokázala výraznou výhodu určité techniky nad jinou. Ukázalo se, že z velké části záleží na zkušenostech centra a především individuálních zkušenostech chirurga, který resekci pankreatu provádí.
Terapie pankreatické píštěle se řídí klinickou závažností. Ve většině případů se postupuje konzervativně. V případech, kdy je nutná reoperace, jsou možné dvě strategie: chirurgická otevřená drenáž kolekcí nebo dokončení pankreatektomie. V minulosti bylo preferováno dokončení pankreatektomie, které je však technicky velmi náročné, je zatíženo vysokou morbiditou a letalitou. V současnosti se většina autorů přiklání k chirurgické drenáži. Tento postup je technicky méně náročný, má nižší letalitu, je zachována endokrinní funkce pankreatu a ve většině případů stav nevyžaduje další reoperace.Klíčová slova:
pankreatická píštěl – definice pankreatické píštěle – rizikové faktory – terapie pankreatické píštěleÚvod
Pankreatická píštěl (pancreatic fistula – PF) je poměrně častou komplikací po resekci pankreatu. V různých souborech se udává incidence od 10 % až do 30 % [1–3]. Různá incidence je dána především různou definicí píštěle. I ve stejném souboru pacientů je při použití různých definic velice rozdílná incidence pankreatické píštěle [4,5]. PF je také nejzávažnější příčinou pooperační morbidity. Ve většině případů není píštěl život ohrožující komplikace, nicméně prodlužuje dobu hospitalizace, zvyšuje náklady na léčbu a u maligních chorob oddaluje adjuvantní léčbu [5]. Díky pokroku v chirurgii, novým operačním technikám, novým materiálům, zlepšené pooperační péči a moderním miniinvazivním metodám se podařilo snížit letalitu po resekcích pankreatu, nicméně morbidita zůstává vysoká a pankreatická píštěl zůstává závažným problémem [2]. Naprostá většina PF vzniká po resekcích pankreatu, ale může vzniknout i v jiných případech, např. po traumatech, při iatrogenním poranění pankreatu během operace okolních orgánů, jako komplikace akutní pankreatitidy atd. Cílem této práce je shrnout recentní poznatky o pankreatické píštěli, její definici, rizikových faktorech a možnostech léčby zejména po resekcích pankreatu jako hlavní příčině PF.
Pankreatická píštěl
1. Příčina a definice pankreatické píštěle
Exokrinní sekrece ze zbytkového parenchymu pankreatu způsobuje PF. Proto se sekrece tekutiny bohaté na amylázy považuje za vymezující znak pro PF [6]. Příčinou PF je porucha hojení pankreatiko-gastro, pankreatiko-jejuno anastomózy nebo leak z parenchymu pankreatu při poruše sutury parenchymu, např. po levostranné resekci pankreatu, centrální resekci nebo enukleaci. Pankreatická šťáva je bohatá na proteázy, ty po aktivaci způsobují natrávení peripankreatické tkáně a její destrukci. Po další autodestrukci peripankreatické a retroperitoneální tkáně se mohou vytvořit peripankratické tekutinové kolekce, nitrobřišní nebo retroperitoneální abscesy. Dalšími nálezy mohou být hrudní výpotky, zpomalená obnova pasáže nebo zpomalené vyprazdňování žaludku [2].
Je velmi obtížné porovnávat frekvence PF v jednotlivých studiích, protože jednotliví autoři používají různé definice PF, viz Tab. 1 [7]. V první řadě je nutné používat jednotnou terminologii. V literatuře se objevují následující termíny: pankreatická píštěl, pankreatický leak, fokální pooperační pankreatitida, dehiscence pankreatiko-jejuno anastomózy nebo netěsnost anastomózy. Tyto výrazy jsou často zaměňovány a nepřesně používány. V současné době většina autorů doporučuje používat termín pankreatická píštěl (pancreatic fistula – PF) [4].
1. Různé definice pankreatické píštěle Tab. 1: Various definitions of pancreatic fistula 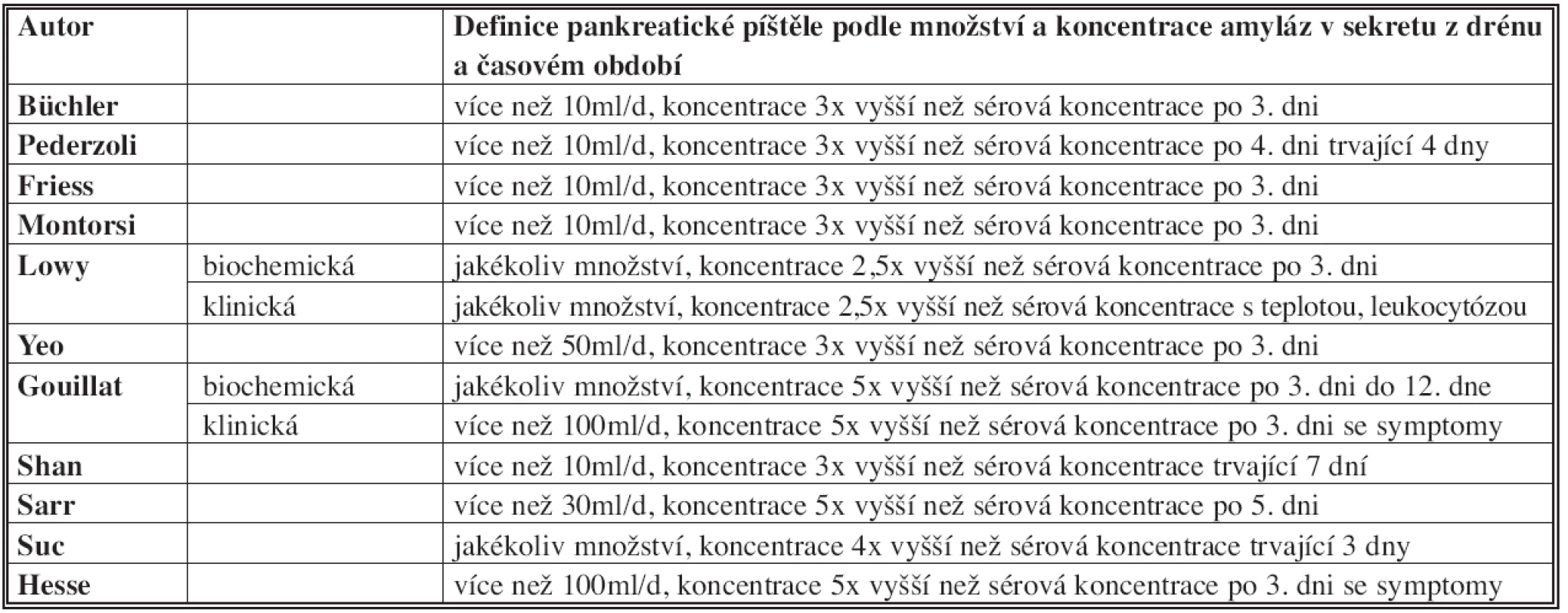
Většina definic pankreatické píštěle se opírá o množství sekretu z peroperačně uložených drénů a obsahu amyláz v tomto sekretu. Bassi v literatuře identifikoval 26 různých definic PF, které se lišily v množství sekretu, obsahu amyláz a časování (tj. kolikátý pooperační den píštěl vznikla a kolik dní trvala) [4]. Autoři poté na souboru 242 pacientů použili různé definice PF a frekvence PF se pohybovala v rozmezí 9,9 % až 28,5 % u identického souboru pacientů [4].
Kromě množství sekretu a koncentrace amyláz je další důležitou otázkou klinický význam PF. Lowy byl mezi prvními, kdo použil výraz klinicky významná PF, což definoval jako výdej tekutiny bohaté na amylázy ve spojení s leukocytózou, febriliemi, sepsí a nutností perkutánní drenáže tekutinových peripankreatických kolekcí. Biochemickou PF definoval jako sekreci z drénů s vyšším obsahem amyláz, která je asymptomatická a zpravidla ustane samovolně [8].
Až v roce 2005 vznikla a byla publikována jednotná definice PF podle ISGPF [6]. International Study Group for Pancreatic Fistula (ISGPF) tvořilo 37 světových expertů z 15 zemí, kteří na základě svých znalostí a zkušeností určili novou, univerzálně použitelnou definici PF. Tato definice je v současné době široce akceptována a používána [5].
PF podle ISGPF je definována jako výdej jakéhokoliv měřitelného množství tekutiny peroperačně zavedenými drény (nebo drény perkutánně zavedenými následně po operaci) po třetím pooperačním dnu, pokud je koncentrace amyláz v tekutině 3krát vyšší, než je normální sérová koncentrace. Zobrazovací metody nejsou k diagnóze pankreatické píštěle nutné. Dále se PF dělí do 3 stupňů klinické závažnosti podle těchto faktorů: celkový stav pacienta, nutnost specifické léčby, výsledky zobrazovacích metod, nutnost ponechání drenáže déle než 3 týdny, známky infekce, nutnost další hospitalizace, sepse, reoperace a úmrtí (Tab. 2).
2. Rozdělení klinické závažnosti pankreatické píštěle podle ISGPF [6] Tab. 2: The characteristics of clinical severity of pancreatic fistula by ISGPF [6] ![Rozdělení klinické závažnosti pankreatické píštěle podle ISGPF [6]
Tab. 2: The characteristics of clinical severity of pancreatic fistula by ISGPF [6]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/51318f1f53bfa5767cc82bcf7d6081cb.png)
* doplňková nebo totální parenterální výživa, antibiotika, deriváty somatostatinu PF stupně A je také označována jako přechodná PF, nemá žádné klinické důsledky a nevyžaduje jinou než standardní pooperační péči. Jedná se pouze o přechodnou zvýšenou koncentraci amyláz v drénech. Tato píštěl samovolně odezní nejpozději do 3 týdnů.
PF stupně B vyžaduje změnu léčby pacienta, obvykle částečnou enterální nebo parenterální výživu. Peroperačně zavedené drény jsou ponechány nebo jsou perkutánně zavedeny nové drény k drenáži peripankreatických tekutinových kolekcí. Nemocní jsou zpravidla hospitalizováni na standardním oddělení.
PF stupně C vyžaduje intenzivní péči. Pacienti mají totální enterální nebo parenterální výživu. Peripankreatické tekutinové kolekce musejí být drénovány. Zhoršení stavu nemocných spolu se sepsí nebo selháním orgánů může vyžadovat reoperaci. Pooperační letalita v této skupině je vysoká.
Stupeň PF je možné určit až po dokončení léčby. Použití jednotné definice PF umožní porovnat výsledky operací pankreatu v jednotlivých centrech specializovaných na pankreatickou chirurgii. Definice PF podle ISGPF umožňuje také vymezit a zhodnotit klinickou závažnost [5].
2. Rizikové faktory vzniku pankreatické píštěle
Jsou známé různé rizikové faktory pro vznik PF. Tyto faktory se dají rozdělit do tří základních skupin: I. související s onemocněním pankreatu, II. související s pacientem, III. související s operačním výkonem.
I. Faktory související s onemocněním pankreatu
Hlavním rizikovým faktorem pro vznik PF je struktura pankreatické tkáně. Křehká a měkká struktura pankreatu, tzv. „soft pancreas“, je predisponujícím faktorem vzniku PF [9]. Lin et al. popsali vztah struktury pankreatické tkáně a vznikem PF u téměř 2000 pacientů po parciální duodenopankreatektomii. V této studii bylo riziko vzniku PF u „soft pancreas“ 22,6 % a bylo desetkrát vyšší než u pacientů se středním nebo tuhým pankreatem [10]. Dalším významným rizikovým faktorem je průměr pankreatického vývodu. Malý nedilatovaný pankreatický vývod (do 3 mm) je rizikovým faktorem pro vznik PF. U pacientů s nedilatovaným pankreatickým vývodem je riziko vzniku PF 22 %, u pacientů s dilatovaným vývodem je to pouze 7 %. Dalším rizikovým faktorem může být diagnóza, pro kterou se resekce pankreatu provádí. Karcinomy Vaterské papily a distálního choledochu, intraduktální papilární mucinózní neoplázie, nádory duodena a benigní endokrinní nádory mají vyšší riziko vzniku PF [10].
II. Faktory související s pacientem
Faktory související s pacientem mohou také být považovány za riziko zvýšené frekvence vzniku PF. Vyšší riziko vzniku pankreatické píštěle bylo zjištěno u pacientů nad 70 let [11], u mužů [10], u pacientů s ischemickou chorobou srdeční [10], cukrovkou [12] a u pacientů obézních [13]. Dalším rizikovým faktorem je doba trvání obstrukčního ikteru, nikoliv absolutní hodnota bilirubinu [14].
III. Faktory související s léčbou
Do rizikových faktorů vzniku PF souvisejících s léčbou patří především technické modifikace operační techniky a farmakologické intervence, které jsou zmíněny v další části. Faktorem souvisejícím s léčbou je i neoadjuvantní chemoradioterapie. Cheng ukázal, že neoadjuvantní chemoradioterapie snižuje frekvenci PF [15]. To je pravděpodobně způsobeno snížením exokrinní funkce pankreatu po radioterapii. Mezi ovlivnitelné faktory související s léčbou patří především peroperační krevní ztráta [12]. Na několika retrospektivních studiích bylo prokázáno, že vyšší krevní ztráta souvisí s vyšším rizikem vzniku PF [12,16]. Kleeff dále na souboru 302 pacientů s levostrannou resekcí pankreatu ukázal, že pacienti s multiviscerální resekcí (resekce pankreatu a současně i jiného orgánu) mají vyšší riziko vzniku PF než pacienti, kteří podstoupili pouze resekci pankreatu [16].
3. Možnosti prevence vzniku pankreatické píštěle
Vznik pooperační pankreatické píštěle má důsledky klinické (zvyšuje letalitu, prodlužuje hospitalizaci, vyžaduje použití dalších vyšetřovacích a léčebných postupů, může způsobit život ohrožující komplikace, oddaluje adjuvantní léčbu u maligních chorob), ale rovněž ekonomické (zvyšuje náklady na léčbu) [5]. Proto je důležité se u pacientů pokusit snížit riziko vzniku PF. Možnosti prevence vzniku PF jsou v zásadě dvě: farmakologická intervence a technické modifikace ošetření zbytkového parenchymu pankreatu.
I. Farmakologické postupy
Myšlenka farmakologické intervence k prevenci vzniku pooperační PF byla poprvé popsána v roce 1979. Klempa a kol. popsali snížení četnosti pooperačních komplikací při peroperačním podání infuze somatostatinu [17]. Somatostatin je hormon skládající se ze 14 aminokyselin. Jedná se o potentní inhibitor sekrece v celém gastrointestinálním traktu. Snižuje endokrinní i exokrinní sekreci pankreatu a prokrvení pankreatu. Dále redukuje motilitu gastrointestinálního traktu a sekreci žaludečních šťáv. Podle původní teorie podání somatostatinu sníží objem exokrinní sekrece z pankreatu a navíc sníží obsah pankreatických enzymů v sekretu. Tímto mechanismem sníží riziko vzniku PF.
Nicméně biologický poločas somatostatinu je velmi krátký, pouze několik minut, proto je nutné podávat somatostatin v kontinuální infuzi. Syntetický analog somatostatinu oktreotid byl vyvinut tak, aby měl delší biologický poločas než původní nativní hormon. Biologický poločas oktreotidu je 90 až 120 minut a umožňuje frakcionované subkutánní podávání. Oktreotid má podobný mechanismus účinku a podobný klinický účinek jako somatostatin [18].
Klinický účinek oktreotidu byl studován v několika randomizovaných studiích [8,9,19–24]. Nicméně výsledky těchto studií jsou nejednoznačné a často i protichůdné. To je způsobeno tím, že studie mají různou metodologii, byly do nich zařazeny různé operační výkony, pacienti s různými diagnózami, oktreotid byl podáván v různém dávkování, začátek podávání byl před operací, během operace nebo až po operaci, byly použity různé definice pooperačních komplikací a v neposlední řadě různé definice pankreatické píštěle. Proto je nutné pečlivě analyzovat a interpretovat dosažené výsledky, abychom dosáhli validních závěrů. V Tab. 3 jsou shrnuty výsledky randomizovaných studií s více než 50 pacienty, které studovaly účinek oktreotidu na prevenci vzniku PF po operacích na pankreatu [7].
3. Výsledky randomizovaných studií testování oktreotidu ke snížení frekvence pankreatické píštěle Tab. 3: The results of randomized trials testing octreotide to reduce the frequency of pancreatic fistula 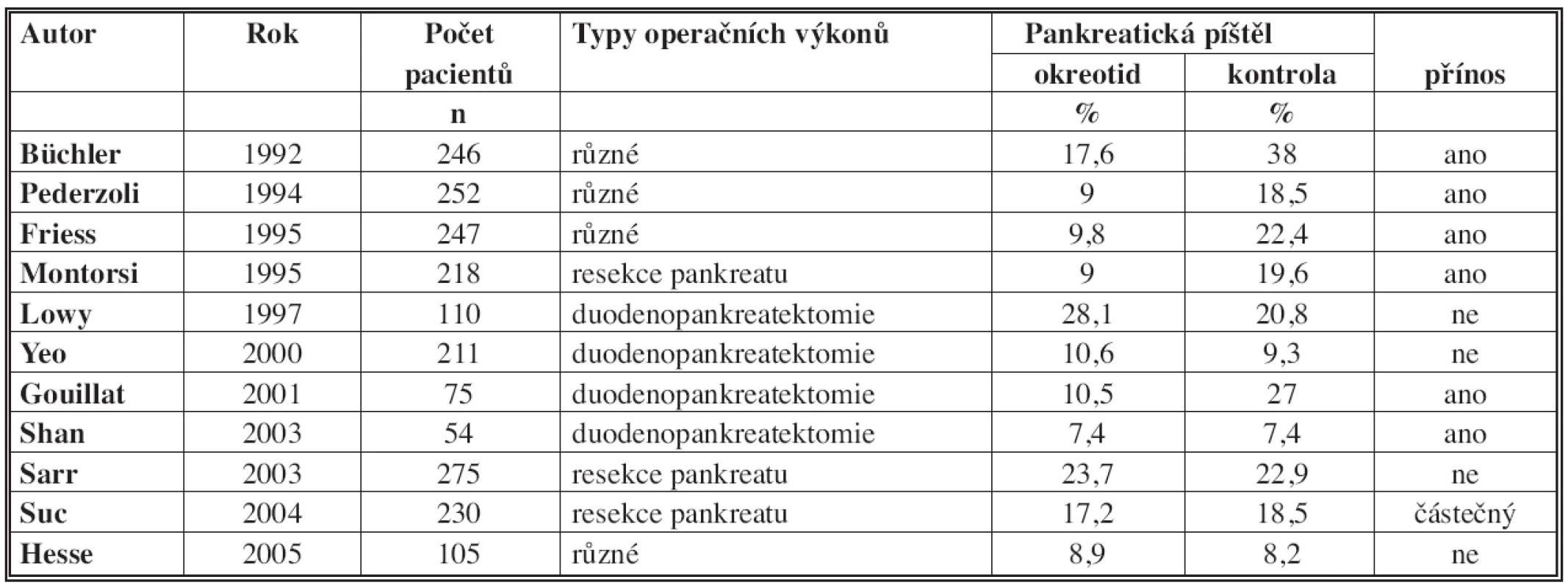
Různé: parciální duodenopankreatektomie, levostranná resekce pankreatu, enukleace, pankreatiko-jejuno anastomózy Resekce pankreatu: parciální duodenopankreatektomie, levostranná resekce pankreatu Porovnávání uvedených randomizovaných studií je velmi problematické vzhledem k dříve uvedeným rozdílům. Proto je nutné dostupná data pečlivě analyzovat a interpretovat a použít deskriptivní statistické metody porovnání studií. Na základě dostupných informací z uvedených randomizovaných studií je možné dosáhnout těchto závěrů [7]:
- Rutinní podání oktreotidu u všech operací pankreatu není doporučeno. Spíše je vhodné jeho selektivní podání v následujících případech, kdy je vyšší riziko vzniku PF.
- Oktreotid může významně snížit četnost PF u resekce pankreatu v centrech, kde se provádí menší počet těchto výkonů, zvláště pokud je četnost PF vyšší.
- Je doporučeno podání oktreotidu u pacientů s rizikovou strukturou pankreatu, tzv. „soft pancreas“, a pokud je průměr hlavního pankreatického vývodu menší než 3 mm. Na druhou stranu podání oktreotidu po operacích pro chronickou pankreatitidu nemá žádný přínos.
- Okterotid je vhodné podávat po levostranných resekcích pankreatu, centrálních resekcích a enukleacích, u kterých je vyšší riziko vzniku píštěle.
- Žádná studie neprokázala, že začátek podávání oktreotidu 1 hodinu před zahájením operace přináší lepší výsledky, než když je oktreotid podán během operace nebo až po operaci. Nicméně někteří autoři doporučují zahájit jeho podávání již 1 hodinu před operací, aby se snížila sekrece pankreatických enzymů už během operace.
- Žádná studie neprokázala, že podávání somatostatinu je výhodnější než podávání oktreotidu, ale léčba somatostatinem je mnohem nákladnější než podávání oktreotidu.
- Podávání somatostatinu a jeho derivátů nesníží letalitu po resekci pankreatu.
II. Technické modifikace ošetření zbytkového parenchymu pankreatu
Způsob ošetření zbytkového parenchymu pankreatu a jeho modifikace byly extenzivně studovány s cílem snížení četnosti PF. Tyto chirurgické postupy můžeme rozdělit na ošetření pahýlu pankreatu po parciální duodenopankreatektomii a uzávěr pahýlu pankreatu po levostranné resekci pankreatu.
Způsoby ošetření pahýlu pankreatu po parciální duodenopankreatektomii
Celkem bylo popsáno přibližně 80 různých možností rekonstrukce při parciální duodenopankreatektomii [25]. Následující modifikace ošetření pahýlu pankreatu patří mezi nejčastěji diskutované. Dosud nebyl vysloven jednoznačný konsenzus, který způsob ošetření pahýlu pankreatu je optimální.
Pankreatiko-gastro anastomóza a pankreatiko-jejuno anastomóza jsou dvě hlavní možnosti implantace pankreatu po parciální duodenopankretektomii. Pankreatiko-jejuno anastomóza je mezi chirurgy oblíbenější než pankreatiko-gastro anastomóza a je prováděna asi v 80 % případů. Metaanalýzu a systematický souhrn o výsledcích rekonstrukcí pomocí těchto dvou anastomóz publikovala skupina z Heidelbergu v roce 2007 [26]. Autoři do studie zahrnuli 3 randomizované studie a 13 nerandomizovaných studií. V závěru uvádějí, že oba postupy přinášejí stejné výsledky a ani jedna z těchto metod rekonstrukce není výhodnější než druhá [26].
Byl publikován nespočet modifikací pankreatiko-jejuno anastomózy, např. modifikace end-to-end, end-to-side, teleskopická anastomóza, anastomóza na separátní Roux-Y kličku jejuna [27]. Nejčastější dva typy anastomózy jsou muko-mukózní anastomóza a teleskopická anastomóza. Několik retrospektivních studií ukázalo, že muko-mukózní anastomóza je výhodnější a přináší nižší četnost vzniku PF [28]. Nicméně jediná prospektivní randomizovaná studie neukázala přínos muko-mukózní anastomózy [29].
Někteří autoři doporučují umístit plastový stent do pankreatiko-jejuno anastomózy pro vnitřní nebo zevní drenáž exokrinní pankreatické sekrece. Tito autoři udávají, že je možné přesněji a snadněji umístit stehy při konstrukci pankreatiko-jejuno anastomózy. Dále že odklonění pankreatické šťávy od anastomózy sníží riziko PF [30], naopak jiné práce ukazují, že umístění stentu do anastomózy nemá žádný přínos a nesnižuje frekvenci PF [31]. Doposud není jednoznačný konsenzus, zda je vhodné zavádět stent do anastomózy, dvě dosud publikované randomizované studie měly odlišné výsledky [30,31].
Další možností je umístění tenkého drénu do anastomózy, který je připojen na stálý podtlak. V retrospektivní studii autoři porovnávali skupinu pacientů bez drenáže (n=35) a skupinu pacientů se zavedeným drénem do pankreatiko-jejuno anastomózy, který byl připojen na podtlak (n=41). Ve skupině s podtlakovou drenáží měli autoři méně případů pooperačního krvácení (p=0,012), méně pankreatických píštělí (p=0,018) a méně biliárních leaků (p=0,014) [32].
Možnosti uzávěru pahýlu pankreatu u levostranné resekce pankreatu
Levostranná resekce pankreatu je výkon méně častý než parciální duodenopankreatektomie, protože léze v těle a kaudě pankreatu jsou méně časté než v hlavě, navíc maligní nádory v této lokalizaci bývají častěji lokálně pokročilé a inoperabilní. Ve velkých retrospektivně hodnocených souborech pacientů jsou nejčastěji zmiňované dvě techniky ošetření zbytkového parenchymu pankreatu: ruční přešití pahýlu pankreatu po ostrém přerušení skalpelem a přerušení pankreatu staplerem [16,33–35]. Zatímco ve dvou studiích byla incidence pankreatické píštěle vyšší po přerušení pankreatu staplerem než po ošetření pahýlu manuální suturou [16,35], v dalších dvou studiích nebyl zjištěn rozdíl ve výskytu píštěle při různých způsobech ošetření pahýlu pankreatu [33,34]. V recentní randomizované multicentrické studii se při porovnání obou technik také nezjistil rozdíl výskytu pooperační PF (stapler 32 % a manuální ošetření 28 %; OR 0,84, 95 % CI 0,53–1,33; p=0,56) [36].
Laparoskopická levostranná resekce pankreatu je považována za technicky proveditelnou a bezpečnou metodu. Pacienti mají menší krevní ztrátu, kratší dobu hospitalizace, rychlejší rekonvalescenci a rychlejší návrat perorálního příjmu [37–39]. Při laparoskopické levostranné resekci pankreatu se k transekci pankreatu nejčastěji používá endoskopický lineární stapler, ostatní techniky jsou méně časté [40,41]. Frekvence pankreatické píštěle po laparoskopické a otevřené resekci byla ve dvou největších srovnávacích studiích stejná (18 % vs. 11 %, P = 0,1 a 17 % vs. 17 %, P > 0,99) [37,39], nicméně v recentní metaanalýze byla po laparoskopické operaci dokonce nižší [38].
Dosud nebyl ustanoven platný konsenzus, která technika k ošetření zbytkového parenchymu po resekci pankreatu je optimální. Většina výše zmiňovaných studií byla retrospektivních kohortních; tyto studie mají menší stupeň průkaznosti.
Z randomizovaných studií pouze několik prokázalo výhodu určité techniky nad jinou a i těchto případech jsou výsledky protichůdné [42,43]. Většina z dobře vedených randomizovaných studií neprokázala výraznou výhodu jedné techniky nad druhou [29,31,36,44–46].
Kromě použité techniky z velké části záleží na zkušenostech centra a především individuálních zkušenostech chirurga, který resekci pankreatu provádí. V jedné studii autoři porovnávali frekvenci PF u zkušených pankreatických chirurgů (více než 50 duodenopankreatektomií) a u méně zkušených. Frekvence píštěle byla nižší u zkušených chirurgů (10 % vs. 20 %, p = 0,03). Dále autoři porovnávali frekvenci píštěle u chirurgů podle počtu provedených výkonů za rok (více než 20 duodenopankreatektomií za rok a méně než 20). Dle výsledků této studie neměl počet výkonů za rok vliv na frekvenci píštěle (11 % vs. 12 %, p= 0,60) [47].
4. Možnosti léčby pankreatické píštěle
Pro úspěšnou léčbu pooperační PF je nutné píštěl rozpoznat co nejdříve. Pokud má pacient po operaci náhle bolesti v epigastriu, teploty, tachykardii, laboratorně leukocytózu, elevaci CRP, nález volné tekutiny v dutině břišní, peripankreatických kolekcí nebo fluidothoraxu při zobrazovacích metodách, je nutné pomýšlet na pankreatickou píštěl a zahájit adekvátní terapii. Pankreatická píštěl podle definice ISGPF je diagnostikována při vyšší koncentraci amyláz v tekutině odváděné drény založenými peroperačně nebo po operaci. Terapie je ve většině případů konzervativní, řídí se klinickou závažností píštěle a rychlostí vývoje septických známek [48].
Pankreatická píštěl stupně A je klinicky nezávažná, nemá žádný klinický dopad a neprodlužuje hospitalizaci [5]. Při terapii je dostačující pravidelná kontrola koncentrace amyláz v sekretu z drénů. Drény je možné odstranit při poklesu množství sekrece a/nebo koncentrace amyláz v sekretu, což bývá zpravidla nejpozději do 3 týdnů po operaci [2].
Pankreatická píštěl stupně B vyžaduje změnu terapie, která je však stále konzervativní. Zpravidla je dostačující vynechání perorálního příjmu potravy, je nasazena parenterální nebo enterální výživa a antibiotika, případně deriváty somatostatinu [2]. Je důležité manipulovat s peroperačně zavedenými drény tak, aby nedocházelo ke vzniku peripankreatických kolekcí, případně musejí být perkutánně zavedeny nové drény do peripankreatických tekutinových kolekcí. Chirurgická revize není u píštěle stupně B indikována.
Pankreatická píštěl stupně C je klinicky nejzávažnější, pacienti zpravidla vyžadují intenzivní péči, mají sepsi a selhání jednoho nebo více orgánů. Klinický stav vyžaduje chirurgickou revizi [6,48]. Při reoperaci jsou možné dvě strategie: chirurgická otevřená drenáž kolekcí nebo dokončení pankreatektomie [3,49,50]. V minulosti bylo preferováno dokončení pankreatektomie z důvodu kompletního odstranění zdroje sepse. Nicméně tento postup je technicky velmi náročný, ve většině případů vyžaduje splenektomii, někdy dokonce i totální gastrektomii. Další nevýhodou je endokrinní insuficience s těžko korigovatelným diabetem a letalita, která dosahovala až 80 % [51]. V současnosti se většina autorů přiklání k chirurgické drenáži dutiny břišní [3,49]. Tento postup je technicky méně náročný, má nižší letalitu, je zachována endokrinní funkce pankreatu a ve většině případů nevyžaduje další reoperace. Podle některých autorů by dokončení pankreatektomie již nemělo být považováno za metodu volby při řešení závažné pankreatické píštěle [1].
PF po levostranné resekci pankreatu je zpravidla méně závažná, ale může být dlouhotrvající. Bylo prokázáno, že zavedení stentu do hlavního pankreatického vývodu může přispět ke zhojení PF po levostranné resekci [52]. Na druhou stranu preventivní aplikace stentu před operací nesníží četnost PF po levostranné resekci pankreatu [53].
Závažnou komplikací po resekci pankreatu může být také pozdní krvácení z viscerálních cév. Pozdní krvácení není častou komplikací, vyskytuje se v 1–12 % po resekcích pankreatu. Jedná se však o závažnou komplikaci, letalita dosahuje až 30 % [54]. Různá incidence je dána mimo jiné také různými definicemi pozdního krvácení. Skupina ISGPS (International Study Group for Pancreatic Surgery) navrhla novou definici, která je založena na době začátku krvácení, lokalizaci a závažnosti krvácení [55]. Pozdní krvácení po resekci pankreatu je ve většině případů způsobeno právě pankreatickou píštělí, nejčastěji se vyskytne 13 až 27 dní po primární operaci [56]. V terapii jako metoda volby je doporučována angiografie s embolizací krvácející cévy. Chirurgická explorace a hemostáza se doporučuje až jako poslední možnost u pacientů, u kterých selhaly ostatní možnosti léčby [54].
Závěr
Radikální resekce pankreatu je jedinou modalitou, která signifikantně prodlužuje přežívání nemocných s nádory pankreatu. Pankreatická píštěl (PF) je závažnou komplikací po těchto operacích [57]. PF prodlužuje hospitalizaci, zvyšuje náklady na léčbu a způsobuje odložení zahájení adjuvantní chemoterapie u maligních onemocnění pankreatu. Pro porovnání jednotlivých metod léčby a výsledků mezi jednotlivými autory nebo centry je nutné používat jednotnou definici PF. Definice píštěle podle ISGPF se ukazuje jako univerzální a platná definice. Většina rizikových faktorů vzniku PF je neovlivnitelných. V rámci prevence píštěle je možné v určitých případech použít deriváty somatostatinu. Další možností je použití různých technik ošetření zbytkového parenchymu pankreatu, ovšem dosud není platný konsenzus, která technika je optimální. Za důležitý faktor se považují individuální zkušenosti chirurga a centra, kde se operace provádí. Při léčbě pankreatické píštěle dominuje konzervativní postup. Reoperace je nutná pouze u klinicky nejzávažnějšího stupně píštěle. I v tomto případě je preferována drenáž před dokončením pankreatektomie.
MUDr. Filip Čečka, Ph.D
Chirurgická klinika FN Hradec Králové
Sokolská 581, 500 05 Hradec Králové
e-mail: filip.cecka@seznam.cz
Sources
1. Buchler MW, Wagner M, Schmied BM, Uhl W, Friess H, Z’graggen K. Changes in morbidity after pancreatic resection: toward the end of completion pancreatectomy. Arch Surg 2003;138 : 1310–1314.
2. Butturini G, Daskalaki D, Molinari E, Scopelliti F, Casarotto A, Bassi C. Pancreatic fistula: definition and current problems. J Hepatobiliary Pancreat Surg 2008;15 : 247–251.
3. Haddad LB, Scatton O, Randone B, et al. Pancreatic fistula after pancreaticoduodenectomy: the conservative treatment of choice. HPB (Oxford), 2009;11 : 203–209.
4. Bassi C, Butturini G, Molinari E, et al. Pancreatic fistula rate after pancreatic resection. The importance of definitions. Dig Surg 2004;21 : 54–59.
5. Pratt WB, Maithel SK, Vanounou T, Huang ZS, Callery MP, Vollmer CM, Jr. Clinical and economic validation of the International Study Group of Pancreatic Fistula (ISGPF) classification scheme. Ann Surg 2007;245 : 443–451.
6. Bassi C, Dervenis C, Butturini G, et al. Postoperative pancreatic fistula: an international study group (ISGPF) definition. Surgery 2005;138 : 8–13.
7. Čečka F, Jon B, Šubrt Z, Ferko A. The effect of somatostatin and its analogs in the prevention of pancreatic fistula after elective pancreatic surgery. Eur Surg 2012;44 : 99–108.
8. Lowy AM, Lee JE, Pisters PW, et al. Prospective, randomized trial of octreotide to prevent pancreatic fistula after pancreaticoduodenectomy for malignant disease. Ann Surg 1997;226 : 632–641.
9. Yeo CJ, Cameron JL, Lillemoe KD, et al. Does prophylactic octreotide decrease the rates of pancreatic fistula and other complications after pancreaticoduodenectomy? Results of a prospective randomized placebo-controlled trial. Ann Surg 2000;232 : 419–429.
10. Lin JW, Cameron JL, Yeo CJ, Riall TS, Lillemoe KD. Risk factors and outcomes in postpancreaticoduodenectomy pancreaticocutaneous fistula. J Gastrointest Surg 2004;8 : 951–959.
11. Matsusue S, Takeda H, Nakamura Y, Nishimura S, Koizumi S. A prospective analysis of the factors influencing pancreaticojejunostomy performed using a single method, in 100 consecutive pancreaticoduodenectomies. Surg Today 1998;28 : 719–726.
12. Cheng Q, Zhang B, Zhang Y, et al. Predictive factors for complications after pancreaticoduodenectomy. J Surg Res 2007; 139 : 22–29.
13. Gaujoux S, Cortes A, Couvelard A, et al. Fatty pancreas and increased body mass index are risk factors of pancreatic fistula after pancreaticoduodenectomy. Surgery 2010;148 : 15–23.
14. Yeh TS, Jan YY, Jeng LB, et al. Pancreaticojejunal anastomotic leak after pancreaticoduodenectomy—multivariate analysis of perioperative risk factors. J Surg Res 1997;67 : 119–125.
15. Cheng TY, Sheth K, White RR, et al. Effect of neoadjuvant chemoradiation on operative mortality and morbidity for pancreaticoduodenectomy. Ann Surg Oncol 2006;13 : 66–74.
16. Kleeff J, Diener MK, Z’graggen K, et al. Distal pancreatectomy: risk factors for surgical failure in 302 consecutive cases. Ann Surg 2007;245 : 573–582.
17. Klempa I, Schwedes U, Usadel KH. Prevention of postoperative pancreatic complications following duodenopancreatectomy using somatostatin. Chirurg 1979;50 : 427–431.
18. Lamberts SW, Van Der Lely AJ, De Herder WW, Hofland LJ. Octreotide. N Engl J Med 1996;334 : 246–254.
19. Buchler M, Friess H, Klempa I, et al. Role of octreotide in the prevention of postoperative complications following pancreatic resection. Am J Surg 1992;163 : 125–130.
20. Friess H, Beger HG, Sulkowski U, et al. Randomized controlled multicentre study of the prevention of complications by octreotide in patients undergoing surgery for chronic pancreatitis. Br J Surg 1995;82 : 1270–1273.
21. Hesse UJ, De Decker C, Houtmeyers P, et al. Prospectively randomized trial using perioperative low dose octreotide to prevent organ related and general complications following pancreatic surgery and pancreatico-jejunostomy. Acta Chir Belg 2005;105 : 383–387.
22. Montorsi M, Zago M, Mosca F, et al. Efficacy of octreotide in the prevention of pancreatic fistula after elective pancreatic resections: a prospective, controlled, randomized clinical trial. Surgery 1995;117 : 26–31.
23. Pederzoli P, Bassi C, Falconi M, Camboni MG. Efficacy of octreotide in the prevention of complications of elective pancreatic surgery. Italian Study Group. Br J Surg 1994;81 : 265–269.
24. Suc B, Msika S, Piccinini M, et al. Octreotide in the prevention of intra-abdominal complications following elective pancreatic resection: a prospective, multicenter randomized controlled trial. Arch Surg 2004;139 : 288–294.
25. Shrikhande SV, Qureshi SS, Rajneesh N, Shukla PJ. Pancreatic anastomoses after pancreaticoduodenectomy: do we need further studies? World J Surg 2005;29 : 1642–1649.
26. Wente, MN, Shrikhande, SV, Muller, MW, et al. Pancreaticojejunostomy versus pancreaticogastrostomy: systematic review and meta-analysis. Am J Surg, 2007;193 : 171–183.
27. Sutton CD, Garcea G, White SA, et al. Isolated Roux-loop pancreaticojejunostomy: a series of 61 patients with zero postoperative pancreaticoenteric leaks. J Gastrointest Surg 2004;8 : 701–705.
28. Murakami Y, Uemura K, Hayashidani Y, et al. No mortality after 150 consecutive pancreatoduodenctomies with duct-to-mucosa pancreaticogastrostomy. J Surg Oncol 2008;97 : 205–209.
29. Bassi C, Falconi M, Molinari E, et al. Duct-to-mucosa versus end-to-side pancreaticojejunostomy reconstruction after pancreaticoduodenectomy: results of a prospective randomized trial. Surgery 2003;134 : 766–771.
30. Poon RT, Fan ST, Lo CM, et al. External drainage of pancreatic duct with a stent to reduce leakage rate of pancreaticojejunostomy after pancreaticoduodenectomy: a prospective randomized trial. Ann Surg 2007;246 : 425–433.
31. Winter JM, Cameron JL, Campbell KA, et al. Does pancreatic duct stenting decrease the rate of pancreatic fistula following pancreaticoduodenectomy? Results of a prospective randomized trial. J Gastrointest Surg 2006;10 : 1280–1290.
32. Kim Z, Kim J, Min JK, et al. Negative pressure external drainage of the pancreatic duct in pancreaticoduodenectomy. Hepatogastroenterology 2010;57 : 625–630.
33. Ferrone CR, Warshaw AL, Rattner DW, et al. Pancreatic fistula rates after 462 distal pancreatectomies: staplers do not decrease fistula rates. J Gastrointest Surg 2008;12 : 1691–1697.
34. Nathan H, Cameron JL, Goodwin CR, et al. Risk factors for pancreatic leak after distal pancreatectomy. Ann Surg 2009;250 : 277–281.
35. Reeh M, Nentwich MF, Bogoevski D, et al. High surgical morbidity following distal pancreatectomy: still an unsolved problem. World J Surg 2011;35 : 1110–1117.
36. Diener MK, Seiler CM, Rossion I, et al. Efficacy of stapler versus hand-sewn closure after distal pancreatectomy (DISPACT): a randomised, controlled multicentre trial. Lancet 2011;377 : 1514–1522.
37. Kooby DA, Gillespie T, Bentrem D, et al. Left-sided pancreatectomy: a multicenter comparison of laparoscopic and open approaches. Ann Surg 2008;248 : 438–446.
38. Nigri GR, Rosman AS, Petrucciani N, et al. Metaanalysis of trials comparing minimally invasive and open distal pancreatectomies. Surg Endosc 2011;25 : 1642–1651.
39. Vijan SS, Ahmed KA, Harmsen WS, et al. Laparoscopic vs open distal pancreatectomy: a single-institution comparative study. Arch Surg 2010;145 : 616–621.
40. Mabrut JY, Fernandez-Cruz L, Azagra JS, et al. Laparoscopic pancreatic resection: results of a multicenter European study of 127 patients. Surgery, 2005;137 : 597–605.
41. Song KB, Kim SC, Park JB, et al. Single-center experience of laparoscopic left pancreatic resection in 359 consecutive patients: changing the surgical paradigm of left pancreatic resection. Surg Endosc 2011;25 : 3364–3372.
42. Chou FF, Sheen-Chen SM, Chen YS, Chen MC, Chen CL. Postoperative morbidity and mortality of pancreaticoduodenectomy for periampullary cancer. Eur J Surg 1996;162 : 477–481.
43. Berger AC, Howard TJ, Kennedy EP, et al. Does type of pancreaticojejunostomy after pancreaticoduodenectomy decrease rate of pancreatic fistula? A randomized, prospective, dual-institution trial. J Am Coll Surg 2009;208 : 738–747.
44. Bassi C, Falconi M, Molinari E, et al. Reconstruction by pancreaticojejunostomy versus pancreaticogastrostomy following pancreatectomy: results of a comparative study. Ann Surg 2005; 242 : 767–771.
45. Duffas JP, Suc B, Msika S, et al. A controlled randomized multicenter trial of pancreatogastrostomy or pancreatojejunostomy after pancreatoduodenectomy. Am J Surg 2005;189 : 720–729.
46. Yeo CJ, Cameron JL, Maher MM, et al. A prospective randomized trial of pancreaticogastrostomy versus pancreaticojejunostomy after pancreaticoduodenectomy. Ann Surg 1995;222 : 580–588.
47. Schmidt CM, Turrini O, Parikh P, et al. Effect of hospital volume, surgeon experience, and surgeon volume on patient outcomes after pancreaticoduodenectomy: a single-institution experience. Arch Surg 2010;145 : 634–640.
48. Loveček M, Neoral Č, Klos D, et al. Chirurgie karcinomu pankreatu na I. chirurgické klinice FN Olomouc. Rozhl Chir 2010; 89 : 731–739.
49. Dellaportas D, Tympa A, Nastos C, et al. An ongoing dispute in the management of severe pancreatic fistula: Pancreatospleenectomy or not? World J Gastrointest Surg 2010;2 : 381–384.
50. Shrikhande SV, D’Souza MA. Pancreatic fistula after pancreatectomy: evolving definitions, preventive strategies and modern management. World J Gastroenterol 2008;14 : 5789–5796.
51. Gueroult S, Parc Y, Duron F, Paye F, Parc R. Completion pancreatectomy for postoperative peritonitis after pancreaticoduodenectomy: early and late outcome. Arch Surg 2004;139 : 16–19.
52. Grobmyer SR, Hunt DL, Forsmark CE, Draganov PV, Behrns KE, Hochwald SN. Pancreatic stent placement is associated with resolution of refractory grade C pancreatic fistula after left-sidedpancreatectomy. Am Surg 2009;75 : 654–657.
53. Frozanpor F, Lundell L, Segersvärd R, Arnelo U. The effect of prophylactic transpapillary pancreatic stent insertion on clinically significant leak rate following distal pancreatectomy: results of a prospective controlled clinical trial. Ann Surg 2012;255 : 1032–1036.
54. Schäfer M, Heinrich S, Pfammatter T, Clavien P-A. Management of delayed major visceral arterial bleeding after pancreatic surgery. HPB 2011;13 : 132–138.
55. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH) – An International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery 2007;142 : 20–25.
56. Roulin D, Cerantola Y, Demartines N, Schäfer M. Systematic Review of delayed postoperative hemorrhage after pancreatic resection. J Gastrointest Surg 2011;15 : 1055–1062.
57. Ryska M. Radikalita resekčního výkonu u nemocných s karcinomem pankreatu z pohledu prodloužení života a jeho kvality. Rozhl Chir 2010; 89 : 725–730.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 2-
All articles in this issue
- Pancreatic fistula – definition, risk factors and treatment options
- The benefit of the da Vinci robotic system in abdominal oncosurgery – our preliminary results
- Laparoscopic repair of incisional hernias – our first experience
- Chest wall haemorrhage as a complication of anticoagulation treatment – a case study
- Bilateral perinatal torsion of spermatic cord – a case report and literature review
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pancreatic fistula – definition, risk factors and treatment options
- Bilateral perinatal torsion of spermatic cord – a case report and literature review
- Laparoscopic repair of incisional hernias – our first experience
- Chest wall haemorrhage as a complication of anticoagulation treatment – a case study
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

