-
Medical journals
- Career
Opakované operace pro karcinom příštítného tělíska
: P. Libánský 1; J. Tvrdoň 1; P. Broulík 2; J. Kubinyi 3; M. Fialová 1; S. Adámek 1; R. Lischke 1
: III. chirurgická klinika 1. LF UK a FN Motol Praha, přednosta: Prof. MUDr. R. Lischke, Ph. D. 1; III. interní klinika 1. LF UK a VFN Praha, přednosta: Prof. MUDr. Š. Svačina, DrSc., MBA 2; Ústav nukleární medicíny 1. LF UK a VFN Praha, přednosta: Prof. MUDr. M. Šámal, DrSc. 3
: Rozhl. Chir., 2012, roč. 91, č. 11, s. 601-607.
: Original articles
Úvod:
Karcinom příštítných tělísek je vzácná příčina primární hyperparatyreózy, která se vyskytuje v 1 % příčin primární hyperparatyreózy.Materiál a metodika:
Tento článek zahrnuje současný pohled do literatury a tři ilustrující případy, které jsou prezentovány formou kazuistiky.Výsledky:
Karcinom příštítných tělísek není obvykle detekován před operací. Příznaky jsou podobné benigní příčině primární hyperparathyreózy. Pacienti s karcinomem příštítného tělíska mají většinou vyšší hladinu vápníku v séru a vyšší hladinu parathormonu. Zobrazovací techniky, jako jsou sonografie a 99mTc sestamibi scintigrafie, pomohou lokalizovat patologicky zvětšené tělísko, ale nejsou schopny odlišit maligní onemocnění. Aspirace tenkou jehlou není doporučována pro možné riziko lokální metastázy tumoru. Radikální excize tumoru s ypsilaterálním odstraněním štítné žlázy představuje standardní léčbu. Lokální recidiva je častá.Závěr:
Karcinom příštítného tělíska je velmi vzácné onemocnění a měl by být operován ve specializovaném centru.Klíčová slova:
primární hyperparatyreóza – paratyroidektomie – karcinom příštítného tělískaÚvod
Karcinom příštítného tělíska je velmi vzácný, ale o to závažnější příčina primární hyperparatyreózy (pHPT). Primární hyperparatyreóza představuje hyperfunkci jednoho nebo více zvětšených příštítných tělísek, která vede ke zvýšené produkci parathormonu (PTH), na kterém závisí hladina kalcia a fosfátu v séru. Jde o poruchy kalciového, fosfátového a kostního metabolismu, které vedou zejména k biochemickému, renálnímu a kostnímu syndromu. Příčinou primární hyperparatyreózy je nejčastěji adenom, jednoho anebo více příštítných tělísek, méně často hyperplazie a zřídka karcinom, jehož výskyt se udává okolo 1 %. Klinicky je předoperačně obtížné diferenciálně diagnosticky odlišit karcinom příštítného tělíska od adenomu či hyperplazie příštítných tělísek. K předoperačním lokalizačním metodám u vyšetření pro primární hyperparatyreózu patří sonografie krku, scintigrafické vyšetření, zejména SPECT/CT, v případě neúspěchu CT vyšetření a NMR. Při primární operaci karcinomu příštítných tělísek je třeba provést „en bloc“ resekci společně s odstraněním ypsilaterálního laloku štítné žlázy. Pacienti s karcinomem příštítného tělíska jsou často opakovaně operováni pro recidivu onemocnění. Při operaci se popisuje šedobílá barva a větší fixace k okolním tkáním. Úmrtí je nejčastěji způsobeno nekontrolovatelnou hyperkalcemií, která vede k renálnímu selhání, arytmiím srdce či pankreatitidě.
Materiál a metodika
Článek je prezentován formou kazuistiky. Pro diagnózu primární hyperparatyreózy bylo provedeno na III. chirurgické klinice 1. lékařské fakulty Univerzity Karlovy 1486 operací včetně reoperací v letech 1994 až 2012, tj. v rozmezí 16 let. Mezi těmito operacemi bylo 12 operací pro karcinom příštítného tělíska při primární hyperparatyreóze, včetně reoperací. Těchto 12 operací, včetně reoperací, bylo provedeno u 3 pacientů. U všech těchto pacientů bylo vyšetřeno patologicky zvětšené příštítné tělísko na Patologicko-anatomickém ústavu 2. lékařské fakulty ve Fakultní nemocnici Motol. Tito pacienti byli dále sledováni ve spolupráci s III. interní klinikou 1. lékařské fakulty Všeobecné fakultní nemocnice v průběhu následujících 8 let.
1. Základní údaje o pacientech s diagnózou karcinomu paratyroidey Tab. 1: Basic data on patients with the diagnosis of parathyroid carcinoma 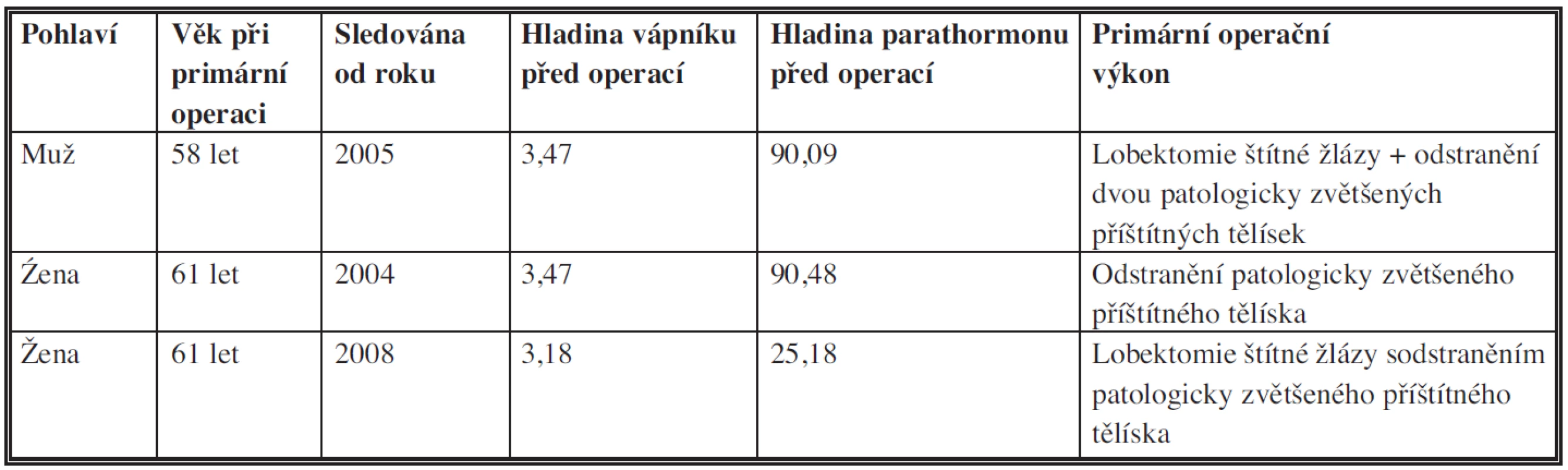
Výsledky
Demografické, biochemické a patologické výsledky našich pacientů jsou prezentovány v tabulce 1. Skupinu tvoří tři pacienti – muž a dvě ženy, průměrného věku při primární operaci 60 let. V době analýzy všichni tři pacienti jsou naživu a jsou průměrně 6 let po stanovení diagnózy.
Kasuistika 1
58letý muž s kostním a renálním syndromem indikován k operaci pro primární hyperaparatyreózu s patologicky zvětšeným tělískem za pravým lalokem štítné žlázy dle sonografického a CT vyšetření. Předoperačně hladina parathormonu byla 90,09 pg/ml, hladina Ca 3,23 mmol/l. Při primární operaci provedena pravostranná lobektomie štítné žlázy s odstraněním 2 patologických zvětšených tělísek. Pooperačně pokles hladiny Ca na 2,05 mmol/l. Pooperační průběh bez komplikací, přechodné parestezie dobře reagovaly na p.o. podávání Ca effervescens tbl. Pacient propuštěn do domácího ošetřování 4. pooperační den. Definitivní histologický nález byl překvapující: karcinom paratyroidey a adenom paratyroidey.
Za 48 měsíců po primární operaci vzestup hladiny kalcia 3,1 mmol/l, iPTH 23,83 pmol/l, dle MIBI lokalizace v dolním mediastinu vpravo, indikován k reoperaci. Provedena sternotomie, thymektomie, pooperačně hladina kalcemie 2,92 mmol/l, iPTH 21,54 pmol/l. Bez výrazného poklesu hladiny vápníku. Doplněno CT vyšetření, kde popisováno patologicky zvětšené příštítné tělísko v místě původního karcinomu. Provedena revize krku, peroperačně nalezen karcinom. Pooperační průběh bez komplikací, pokles hladiny sérového vápníku do normálních hodnot.
58 měsíců po primární operaci opětovný vzestup hladiny kalcia a parathormonu, provedeno SPECT/CT, scintigraficky byla pozitivní 3 ložiska. Prvé ložisko v laterálním pólu jizvy subkutánně, které bylo hmatné, další ložisko při levém dolním pólu štítné žlázy a poslední v místě původního karcinomu, dorzálně od a. carotis com. l. dx. Pacient byl indikován k reoperaci a peroperačně potvrzena metastáza v podkoží, provedena levostranná lobektomie štítné žlázy a částečná resekce recidivy karcinomu dorzálně od a. car. comm. l. dx. pro jeho infiltraci jícnu. Pooperačně pokles parathormonu do normálních hodnot, normalizace hladiny kalcia. Pooperační průběh byl komplikován oboustrannou parézou nervus laryngeus recurrens, pacient opakovaně vyšetřen na ORL s dostatečnou dýchací štěrbinou. Vzhledem k infiltraci jícnu pacient podstoupil ozáření krku – radioterapii. Následně pro respirační insuficienci bylo nutné provést tracheostomii s jednostrannou ablací hlasivky.
76 (1/2012) měsíců po primární operaci je uvažováno o uzavření tracheostomatu.
Kasuistika 2
61letá žena s GIT syndromem (cholecystolithiasis, VCHGD) s primární hyperparatyreózou se sonograficky a scintigraficky patologicky zvětšeným tělískem vlevo dole. Předoperační hladina PTH 90,48 pg/ml, předoperační hladina Ca 3,47 mmol/l. Provedeno odstranění patologického příštítného tělíska. Pooperační průběh bez komplikací, propuštěna do domácího ošetřování 4. pooperační den. Histologicky adenokarcinom příštítného tělíska.
Po 2 měsících hladina sérového kalcia 2,33 mmol/l a hladina parathormonu iPTH 27,64 mmol/l. MIBI popisuje drobné ložisko vlevo, CT vyšetření ani PET neprokázaly recidivu onemocnění, indikována k reoperaci – en bloc resekci. Provedena revize krku vlevo s levostrannou lobektomií štítné žlázy. Histologicky popsána recidiva karcinomu v cévní stopce a. thyroidea inf.
Další sledování pacientka odmítla s tím, že neměla ani nemá žádné obtíže.
Nyní je (1/2012) 84 měsíců po primární operaci, dle ústního sdělení praktického lékaře poslední hladina vápníku byla před rokem v normě.
Kasuistika 3
61letá pacientka s asymptomatickou primární hyperparatyreózou (před operací pro cholecystolithiasis zjištěna hyperkalcemie) s patologicky zvětšeným tělískem uloženým v pravém laloku štítné žlázy dle USG, MIBI a CT. Předoperačně hladina PTH 25,18 mmol/l, hladina vápníku v krvi 3,18 mmol/l. Pro intratyroideální uložení patologicky zvětšeného příštítného tělíska provedena pravostranná lobektomie štítné žlázy. Další patologicky zvětšené tělísko nebylo peroperačně nalezeno. Pooperačně bez komplikací, histologicky karcinom, vzhledem k lobektomii nebyl nutný další výkon. Pooperačně hladina kalcia 2,22 mmol/l.
22 měsíců po první operaci hladina celkového vápníku 3,15 mmol/l, provedeno SPECT/CT, kde popsána recidiva v oblasti odstraněného pravého laloku štítné žlázy. Provedena resekce lůžka v místě lokální recidivy, debulking. Pooperačně pokles hladiny vápníku na 2,74 mmol/l.
28 měsíců po primární operaci vzestup hladiny celkového vápníku na 3,28 mmol/l, opět revidována a proveden debulking, pooperačně téměř bez poklesu hladiny vápníku.
32 měsíců po primární operaci stále přetrvává hladina vápníku kolem 3 mmol/l, provedena radionavigovaná operace – pouze debulking, pokles hladiny vápníku na 2,84 mmol/l. Operace byla komplikována peroperačním krvácením z v jugularis int. l. dx. Pooperačně bez komplikací, propuštěna v dobrém stavu do domácího ošetřování.
44 měsíců po primární operaci opět vzestup hladiny celkového vápníku na 3,3 mmol/l, intaktní parathormon má hodnotu 37,21 pmol/l. Revidována a odstraněna recidiva v místě lůžka s resekcí stěny v. jugularis int. – pooperačně bez poklesu hladiny vápníku, dle kontrolního SPECT/CT recidiva za pravým sternoklavikulárním skloubením, tato recidiva odstraněna ze sternotomie – pooperačně hladina vápníku 3,09 mmol/l, iPTH 17,17 pmol/l. Pacientku čeká další scintigrafické vyšetření a pravděpodobně další operační revize.
1. Hyperplastické příštítné tělísko vpravo dole, hodnoceno jako adenom příštítného tělíska, indikováno k operaci Fig. 1: Hyperplastic parathyroid gland on the right at the bottom, classified as parathyroid adenoma, indicated for surgery 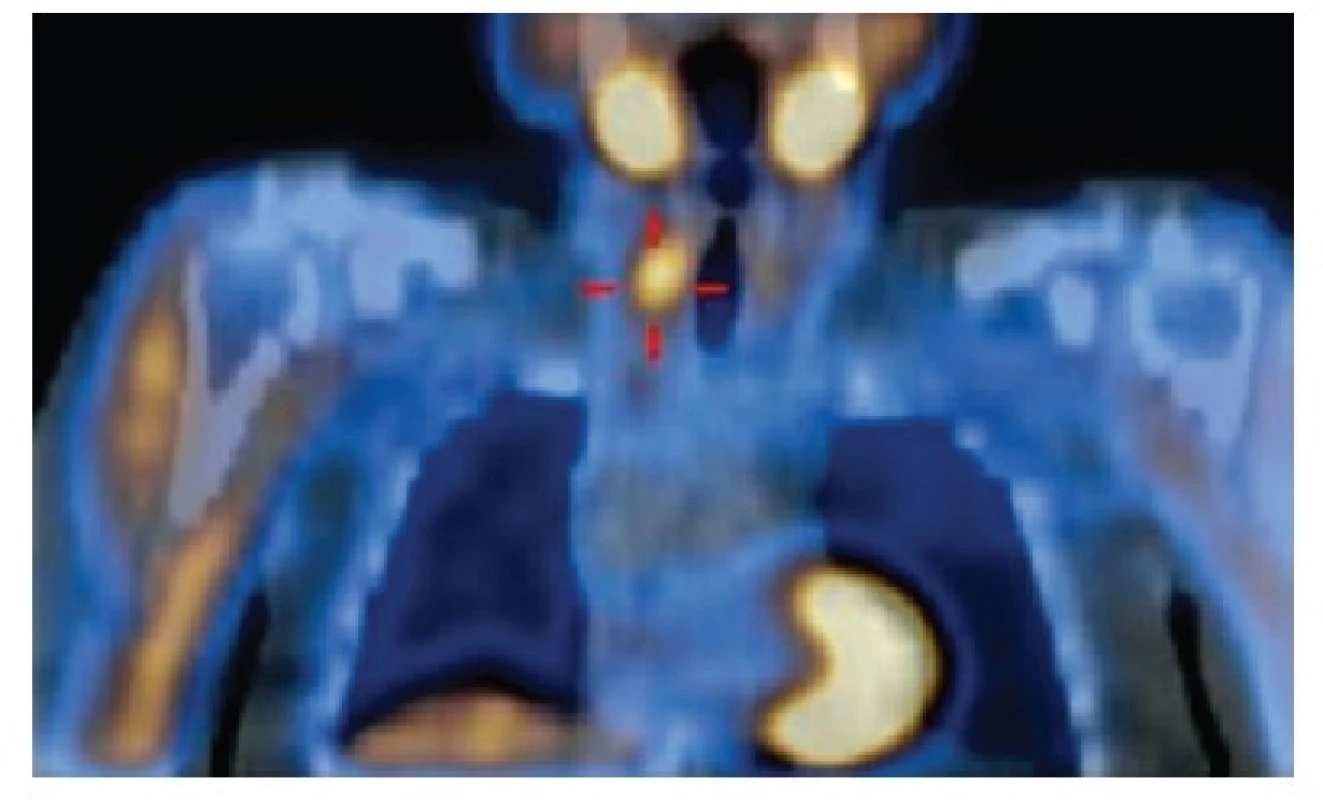
2. Reoperace u téže pacientky jako na Obr. 1 – recidiva jednak na krku, jednak v horním mediastinu s nutností parciální podélné sternotomie Fig. 2: Reoperation in the same patient as in Fig. 1 – recurrence in the neck and in the upper mediastinum with the necessity of partial longitudinal sternotomy 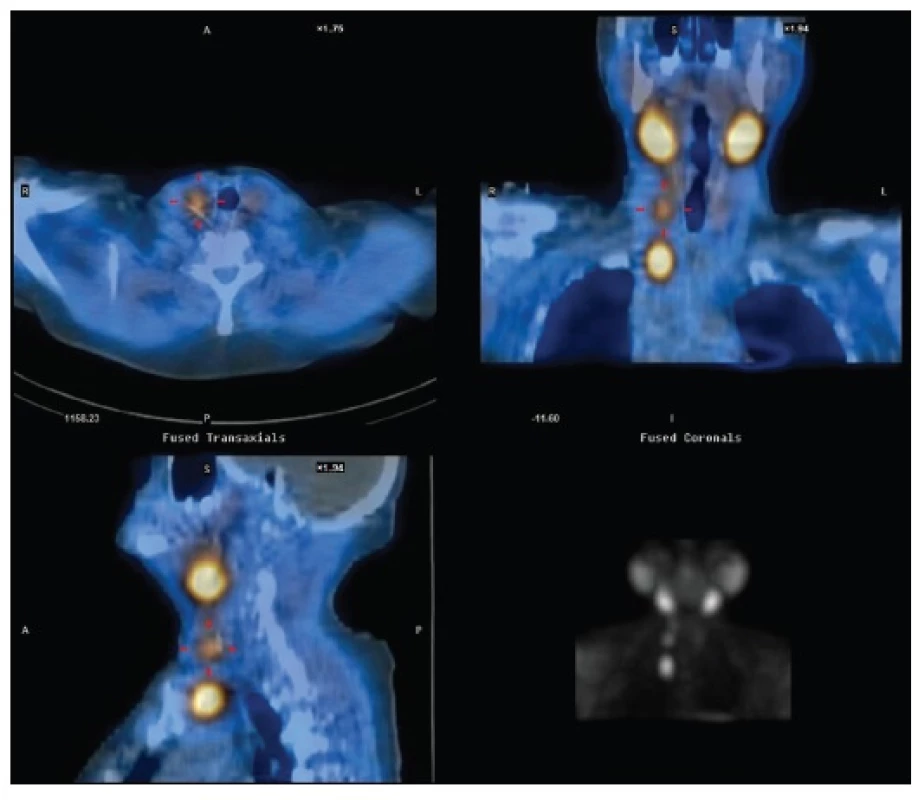
3. Preparát u téže pacientky po odstranění tumoru z parciální podélné sternotomie Fig. 3: Tumour in the same patient after being removed from the partial longitudinal sternotomy 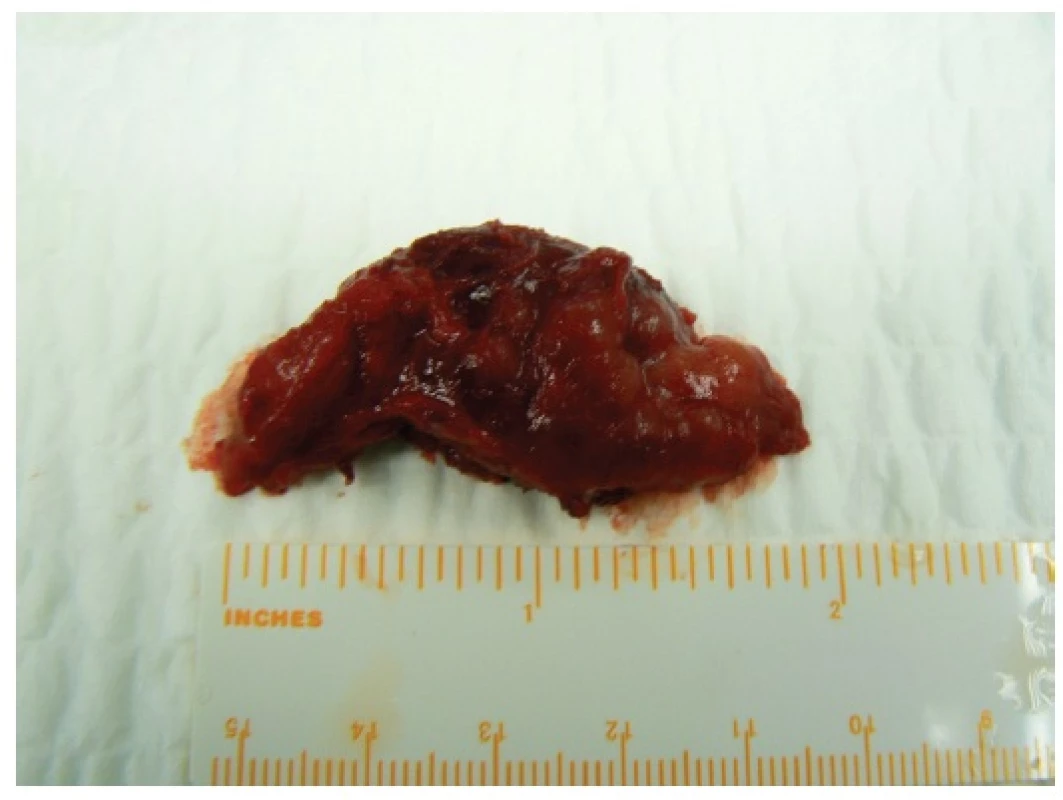
Diskuse
Karcinom příštítného tělíska je velmi vzácné onemocnění, ale o to závažnější příčina primární hyperaparatyreózy. Jako příčina primární hyperparatyreózy se udává okolo 1 %, například Wang and Gaz mezi 1200 pacienty nalezl 28 pacientů, tj. 2,3 % [1]. Sandelin et al. 1991 nalezli mezi 1650 pacienty 6 pacientů s ca příštítných tělísek, tj. 0,3 % [2]. U nás jsou popisovány případy výskytu karcinomu příštítných tělísek, a to více než v 1 % [3, 4]. Různou incidenci mezi jednotlivými centry je možno vysvětlit různými histologickými kritérii pro karcinom příštítného tělíska v jednotlivých centrech [5]. Prevalence karcinomu příštítného tělíska je 0,005 % všech karcinomů [6].
Z hlediska genetického se může karcinom příštítného tělíska vyskytovat solitárně v rámci izolované familiární hyperparatyreózy nebo jako součást mnohočetné endokrinní neoplazie typu 1 (MEN-1) [7]. Centrální roli v molekulární patogenezi karcinomu příštítných tělísek hraje mutace tumor-supresorového genu hrpt2 (cdc73) [8, 9]. Byly nalezeny i jiné změny: mutace men1 genu, LOH v oblasti genu pro retinoblastom, nadexprese cyklinu D1 [10]. V historii některých pacientů je ozáření na oblast krku [11]. Z 1486 pacientů z našeho souboru z let 1994–2012 jsme nepozorovali souvislost radiační zátěže u adenomů, natož v našich 3 případech karcinomů příštítného tělíska [12, 13]. Někteří autoři, stejně jako my, popisují zvýšený simultánní výskyt karcinomu a adenomu příštítných tělísek (21,6 %), tak jako i v našem souboru [14, 15].
Je zajímavé, že zatímco u adenomu příštítného tělíska jsou zřetelně více postiženy ženy, u karcinomu příštítného tělíska je poměr mužů a žen 1 : 1. Hundahl et al. (studie výskytu karcinomu příštítných tělísek v USA) uvádí 286 pacientů s karcinomem příštítného tělíska, jejichž poměr je 1 : 1, průměrného věku 55 let (v rozmezí 14–88 let). V této studii nebyl pozorován žádný rozdíl v oblasti rasy, národnosti či bydliště [6]. Wang and Gaz (1985) uvádí 28 pacientů s karcinomem příštítného tělíska také s rovností obou pohlaví, průměrného věku 45 let [1]. Dle Clarka a Duha je věkový vrchol diagnostiky v 5. dekádě života, pacienti s karcinomem příštítného tělíska jsou tedy o něco mladší než pacienti s benigní primární hyperparatyreózou [5]. Nejsou známá žádná preventivní opatření [16].
Klinicky je nemožné předoperačně rozlišit mezi těžkou benigní primární hyperparatyreózou a karcinomem. Klinická symptomatologie je shodná s projevy hyperkalcemie, u pacientů s karcinomem příštítných tělísek bývá rozvoj symptomatologie obvykle prudší než u benigního podkladu nemoci. Projevy souvisejí s ledvinovými kameny, bolestí demineralizovaného skeletu, patologickými frakturami, gastroduodenální vředovou nemocí, pankreatitidou anebo hyperkalcemickou krizí [17]. Primární diagnostika karcinomu příštítných tělísek dle klinického obrazu je tedy velmi obtížná a mnohdy je možná pouze na základě histologického nálezu. Také u našich pacientů jsme neměli předoperačně podezření na možný karcinom příštítného tělíska.
Určitým vodítkem může být zřetelně vyšší hladina vápníku a parathormonu, někdy i palpační nález na krku. Předoperační vyšší hladina vápníku není spojena s větší mortalitou, ale je spojena s podezřením na karcinom [14]. U mnohých pacientů s karcinomem příštítných tělísek je udáván hmatný tumor na krku [17]. Asi 10 % pacientů má hormonálně nefunkční karcinom příštítného tělíska [18].
U našich 3 pacientů jsme pozorovali vyšší hladinu kalcemie i vyšší hladinu parathormonu. V našem souboru jsme později ve 2 případech pozorovali palpačně rezistenci odpovídající metastáze karcinomu příštítného tělíska.
Pacienti obvykle podstupují základní zobrazovací vyšetření, kterými jsou v našich podmínkách sonografické a scintigrafické vyšetření. Sonografické vyšetření je základním lokalizačním vyšetřením patologicky postižených příštítných tělísek, které také přispívá k indikaci výkonu na štítné žláze. Na druhém místě je scintigrafické vyšetření, nejlépe tzv. SPECT/CT. Pokud jsou tato vyšetření v korelaci, považujeme lokalizační vyšetření za dostatečná. Jiná situace je u reoperací, kde se snažíme tkáň příštítného tělíska ještě potvrdit dalšími vyšetřeními, jako jsou MRI či CT vyšetření. CT vyšetření nám také pomáhá lokalizovat vzdálené metastázy a znázornit infiltraci orgánu tumorem. Pro reoperace pro karcinom příštítného tělíska se udávala senzitivita předoperačních vyšetření 69 % u USG, 67 % u CT vyšetření, 93 % u NMR a 79 % u scintigrafických metod (nikoliv samotného SPECT/CT) [19]. Není doporučována tzv. aspirace tenkou jehlou (FNAB), neboť pokud by bylo předoperační podezření na karcinom, je pravděpodobnost pozitivity nízká a hrozí rozsev nemoci [7, 20]. U našich pacientů doporučujeme před každou reoperací provedení SPECT-CT v kombinaci s MRI [21].
Definitivním potvrzením diagnózy bývá často až histologické vyšetření resekátu. Žádná jiná z metod nedokáže jednoznačně rozlišit benigní a maligní hyperplazii příštítných tělísek. Jednoznačnou známkou malignity tumoru příštítné žlázy je přítomnost lymfatických metastáz, jde ale o relativně vzácný nález. Známky malignity jsou: vaskulární a extrakapsulární invaze s propagací do periparatyroidní tukové tkáně nebo do sousedního parenchymu štítné žlázy (perineurální invaze je téměř vždy odrazem karcinomu příštítného tělíska), mitotické figury a buněčné atypie, molekulárně genetické markery (nepřítomnost parafibrominu – produktu hrpt2 genu, zvýšená exprese pgp 9.5) [22]. Dle jejich přítomnosti je nádor hodnocen jako: adenom, atypický adenom, adenom se suspektními rysy, adenokarcinom. Biologické chování atypického adenomu a adenomu se suspektními rysy je nejisté. Karcinom je rozdělen silnými, hustě vazivovými, provazcovitými, bezbuněčnými septy na jednotlivé menší úseky. Výskyt nekrotické tkáně uvnitř tumoru nasvědčuje malignímu charakteru [23]. Makroskopicky je typický svou velikostí (Hundahl et al. udává průměr 3 cm), hmotností nad 1 g, tuhou konzistencí, šedobílou barvou a větší infiltrací do okolí tkáně [6, 24]. Na řezu je typický slaninový vzhled, bělavá barva, laločnatost.
Ani v sedmé edici TNM klasifikace maligních nádorů UICC nebyla stanovena klasifikace nádorů příštítných tělísek [25]. Příčinou je celosvětově nízká incidence a zatím nepotvrzená prognostická významnost velikosti nádoru a postižení lymfatických uzlin. Nemoc bývá klasifikována jako lokalizovaná (postižení příštítných tělísek a eventuálně invaze do okolní tkáně), nebo jako metastatická (přítomnost lymfadenopatie anebo vzdálených metastáz – nejčastěji v plících, skeletu, játrech, perikardu nebo slinivce).
Léčba karcinomu příštítného tělíska je v 90 % případech chirurgická, někteří pacienti podstoupili i radioterapii [6].
Pro operaci byla stanovena následující pravidla: Primární operace je rozhodující pro adekvátní lokální excizi. Nádor by měl být odstraněn v bloku s ypsilaterální lobektomií štítné žlázy. Toto někteří autoři popírají. V případě neprorůstání nádoru do štítné žlázy není nutná lobektomie štítné žlázy [14, 26]. Při operaci by se měl operatér vyvarovat ruptury pouzdra. To je důležité, neboť není systémová onkologická léčba karcinomu příštítného tělíska. Peroperační biopsie je nutná, neboť ta může vést k první diagnóze karcinomu příštítného tělíska. Pokud bychom byli schopni spolehlivě peroperačně stanovit diagnózu karcinomu příštítného tělíska, bylo by namístě v takovém případě provést ipsilaterální lobektomii štítné žlázy v bloku s příštítným tělískem a modifikovanou krční lymfadenektomii – pro rizika tohoto výkonu je tento postup bez jasné diagnózy karcinomu neodůvodněný [27].
Tuhost a fixaci do okolí jsme u našich 3 pacientů u primární operace nepozorovali. Tuhé uzly spolu s rezistencí odpovídající metastáze v postižené uzlině jsme pozorovali u reoperací.
Peroperační biopsii provádíme vždy a úspěšnost operace bývá v současné době potvrzena intraoperačním stanovením poklesu hladiny intaktního parathormonu. Soloranzo et al. udává, že po „en bloc“ resekci karcinomu příštítného tělíska je pokles iPTH o 50 % ze základní hladiny předpokladem 6měsíční normokalcemie [28]. Při reoperaci je rovněž možné peroperačně užít techniku radionavigace spojenou se scintilační sondou za účelem lokalizace tkáně recidivujícího tumoru [29].
Není systémová onkologická léčba karcinomu příštítného tělíska. Karcinom příštítného tělíska není radiosenzitivní, a radioterapie je proto indikována po operaci pro recidivu jako jedna z posledních, vesměs paliativních možností, jak oddálit další recidivu, spojenou s hyperkalcemií. Někteří autoři předpokládají, že radioterapie může být nápomocná proti opětovnému růstu nádoru [30]. V našem souboru jsme ošetřovali pacienta, který prodělal radioterapii. Tento pacient měl opakovaně operace pro recidivu karcinomu příštítného tělíska (včetně tracheostomie). V literatuře se udává omezený účinek chemoterapie, zejména syntetických estrogenů, 5-fluorouracilu, cyklofosfamidu a látek obsahujících dakarbazin [31]. Bylo popsáno užití imunoterapie v podobě imunizace lidským, modifikovaným lidským a bovinním PTH peptidem, stimulujícím produkci protilátek proti lidskému parathormonu [32].
Za základ pooperační dispenzarizace považujeme pravidelné sledování hodnot sérového kalcia. Při zvažování výkonu stanovujeme rovněž hladinu intaktního parathormonu jako výchozího předoperačního parametru.
Pacienti s karcinomem příštítného tělíska jsou opakovaně operováni pro recidivy onemocnění. Perzistující či recidivující onemocnění se objevuje v 50 % případů [18]. Recidiva se udává v průběhu 33 měsíců (od 1 do 228 měsíců) [33]. Pokud jsou metastázy, bývají endokrinně aktivní a jsou činěny pokusy o jejich odstranění ve snaze snížit produkci parathoromonu [13]. Chirurgická excize lokálních i vzdálených metastatických lézí je nejefektivnější metodou [2]. Z hlediska taktiky výkonu je nutné zhodnotit dosažitelnost recidivující tkáně z krčního přístupu či nutnost sternotomie. S každou další reoperací stoupá procento pooperačních komplikací (60 %), paresa nervus laryngeus recurrens dosahuje až 38 % [14].
Úmrtí je nejčastěji způsobeno nekontrolovatelnou hyperkalcemií, která vede k renálnímu selhání, arytmiím srdce či pankreatitidě [14, 25, 34]. Proto je nutné opakované chirurgické řešení, debulking endokrinně aktivní tkáně. Symptomatická léčba hyperkalcemie je zaměřena na tři oblasti: péči o dostatečnou hydrataci, kalcimimetika (Cinacalcet) a bisfosfonáty [35].
Prognosticky vykazují muži horší prognózu. Dalšími nepříznivými prognostickými markery jsou nižší věk diagnózy, histopatologicky stupeň dediferenciace a počet mitóz, přítomnost vaskulární invaze, postižení lymfatických uzlin, genetické změny nádorových buněk, neradikální chirurgický výkon (včetně en bloc resekce lymfatických uzlin) [33].
U pacientů s karcinomem příštítného tělíska se pětileté přežití pohybuje od 50–70 %, např. v americké studii 286 pacientů s karcinomem příštítného tělíska se udává pětileté přežití u 85,5 % a desetileté přežití u 49,1 % pacientů [6]. Udávaná průměrná doba přežití je různá od jednoho měsíce od 20 let, např. Harari (43leté sledování u 37 pacientů) udává průměrnou dobu přežití 14,3 roku [14], ale ve většině studií doba přežití činí 6–7 let [36]. Obvykle nedochází k vyléčení, nemoc recidivuje u 2/3 pacientů po chirurgické léčbě, někdy i v odstupu 30 let.
Závěr
Karcinom příštítného tělíska se vyskytuje vzácně, ale je jedním z důvodů pro to, aby operace příštítných tělísek byly prováděny ve specializovaných centrech. Předoperačně je velmi těžké odlišit benigní hyperparatyreózu od maligního onemocnění, lze předpokládat vyšší hladinu vápníku. Peroperační nález šedobílého tuhého patologicky zvětšeného tělíska, které je spojeno s předoperační vyšší hladinou vápníku a parathormonu, by měl chirurga vést k tomu, aby odstranil příštítné tělísko „en bloc“. Při operaci je nutné se vyvarovat ruptury pouzdra. Při potvrzení karcinomu příštítného tělíska lze předpokládat nutnost opakovaných chirurgických intervencí. Při opakovaných chirurgických revizích je nutno využít všechny možnosti předoperačních lokalizačních vyšetření včetně SPECT/CT, NMR a USG. Chirurgická resekce recidivy onemocnění včetně metastatických lézí je nejkurativnější metodou. Každá další reoperace zvyšuje počet komplikací, a to zejména poranění nervus laryngeus recurrens. V případě inoperabilních nálezů existuje paliativní léčba hyperkalcemie pomocí kalcitomimetik. Prognóza onemocnění je velmi dobrá, pacienti dlouho přežívají po primární operaci.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL)
MUDr. Petr Libánský, Ph.D.
III. chirurgická klinika 1. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5 Motol
e-mail: petr.libansky@lf1.cuni.cz
Sources
1. Wang CA, Gaz RD. Natural history of parathyroid carcinoma. Diagnosis, treatment, and results. Am J Surg 1985;149(4):522–7.
2. Sandelin K, Thompson NW, Bondeson L. Metastatic parathyroid carcinoma: dilemmas in management. Surgery 1991;110(6): 978–86; discussion 986–8.
3. Jakoubková S, Vokurka J, Čáp, J, Ryska A. Parathyroid carcinoma: Clinical presentation and treatment. International Congress Series 2003;1240 : 991–5.
4. Linhartová M, Starý K. Karcinom příštítného tělíska – současný pohled. In Sborník abstrakt XXXII. Endokrinologické dny s mezinárodní účastí. Český Krumlov 2009 : 50.
5. Sandelin K. Parathyroid carcinoma in Clark O, Duh Q. Textbook of endocrine surgery. Philadelphia, W.B. Saunders 1997 : 277–283.
6. Hundahl SA, Fleming ID, Fremgen AM, Menck HR. Two hundred eighty-six cases of parathyroid carcinoma treated in the U.S. between 1985-1995: a National Cancer Data Base Report. The American College of Surgeons Commission on Cancer and the American Cancer Society Cancer 1999;86(3):538–44.
7. Kassahun WT, Jonas S. Focus on parathyroid carcinoma. Int J Surg 2011;9(1):13–9. Epub 2010 Sep 30. Review.
8. Carpten JD, Robbins CM, Villablanca A, Forsberg L, Presciuttini S, Bailey-Wilson J, Simonds WF, Gillanders EM, Kennedy AM, Chen JD, Agarwal SK, Sood R, Jones MP, Moses TY, Haven C, Petillo D, Leotlela PD, Harding B, Cameron D, Pannett AA, Höög A, Heath H, James-Newton LA, Robinson B, Zarbo RJ, Cavaco BM, Wassif W, Perrier ND, Rosen IB, Kristoffersson U, Turnpenny PD, Farnebo LO, Besser GM, Jackson CE, Morreau H, Trent JM, Thakker RV, Marx SJ, Teh BT, Larsson C, Hobbs MR. HRPT2, encoding parafibromin, is mutated in hyperparathyroidism-jaw tumor syndrome. Nat Genet 2002;32(4):676–80. Epub 2002 Nov 18.
9. DeLellis RA. Parathyroid carcinoma: an overview. Adv Anat Pathol 2005;12(2):53–61. Review.
10. Sharretts JM, Simonds WF. Clinical and molecular genetics of parathyroid neoplazma. Best Pract Res Clin Endocrinol Metab 2010;24(3):491–502. Review.
11. Christmas TJ, Chapple CR, Noble JG, Milroy EJ, Cowie AG. Hyperparathyroidism after neck irradiation. Br J Surg 1988; 75(9):873–4.
12. Adámek S, Libánský P, Naňka O, Šedý J, Pafko P. Surgical Therapy of Primary Hyperparathyroidism and it’s Complications. Experience with 453 Patients. Zentralbl Chir 2005;130 : 109–113.
13. Adámek S, Beneš E, Naňka O. Epidemiologie a etiologie primární hyperparathyreózy. In Primární hyperparathyreóza, Praha, Galén 2006 : 202.
14. Harari A, Waring A, Fernandez-Ranvier G, Hwang J, Suh I, Mitmaker E, Shen W, Gosnell J, Duh QY, Clark O. Parathyroid carcinoma: a 43-year outcome and survival analysis. J Clin Endocrinol Metab 2011;96(12):3679-86. Epub 2011 Sep 21.
15. Goldfarb M, O’Neal P, Shih JL, Hartzband P, Connolly J, Hasselgren PO. Synchronous parathyroid carcinoma, parathyroid adenoma, and papillary thyroid carcinoma in a patient with severe and long-standing hyperparathyroidism. Endocr Pract 2009; 15(5):463–8.
16. Shane E. Clinical review 122: parathyroid carcinoma. The Journal of Clinical Endocrinology & Metabolism 2001; 86 : 485–493
17. Kulkarni PS, Parikh PM. The carcinoma of parathyroid gland. Indian J Cancer 2004;41(2):51–9.
18. Wei CH, Harari A. Parathyroid carcinoma: update and guidelines for management. Curr Treat Options Oncol 2012;13(1):11–23. doi:10.1007/s11864-011-0171-3.
19. Kebebew E, Arici C, Duh QY, Clark OH. Localization and reoperation results for persistent and recurrent parathyroid carcinoma. Arch Surg 2001;136(8):878–85.
20. Agarwal G, Dhingra S, Mishra SK, Krishnani N. Implantation of parathyroid carcinoma along fine needle aspiration track. Langenbecks Arch Surg 2006;391(6):623–6.
21. Libánský P, Broulík P, Křížová H, Naňka O, Pozniak J, Šedý J. The role of preoperative and postoperative localization methods in primary hyperparathyroidism. DMEV 2006;2 : 78–82.
22. Smith JF, Coombs RR. Histological diagnosis of carcinoma of the parathyroid gland. J Clin Pathol 1984;37(12):1370–8.
23. Thompson LD. Parathyroid carcinoma. Ear Nose Throat J 2009;88(1):722–4.
24. Chiofalo MG, Scognamiglio F, Losito S, Lastoria S, Marone U, Pezzullo L. Huge parathyroid carcinoma: clinical considerations and literature review. World J Surg Oncol 2005;3 : 39.
25. Sobin LH. TNM klasifikace zhoubných novotvarů. 7. vydání. Praha, Ústav zdravotnických informací a statistiky České republiky 2011 : 88–92. ISBN 978-80-904259-6-5.
26. Owen RP, Silver CE, Pellitteri PK, Shaha AR, Devaney KO, Werner JA, Rinaldo A, Ferlito A. Parathyroid carcinoma: a review. Head Neck 2011;33(3):429–36. doi: 10.1002/hed.21376. Review. No abstract available.
27. Ippolito G, Palazzo FF, Sebag F, De Micco C, Henry JF. Intraoperative diagnosis and treatment of parathyroid cancer and atypical parathyroid adenoma. Br J Surg 2007;94(5):566–70.
28. Solórzano CC, Carneiro-Pla DM, Lew JI, Rodgers SE, Montano R, Irvin GL. Intra-operative parathyroid hormone monitoring in patients with parathyroid cancer. Ann Surg Oncol 2007; 14(11):3216–22. Epub 2007 Sep 6.
29. Dudešek B, Gatěk J, Duben J, Bakala J, Hnátek L, Hasa E, Musil T. Mini-invasive radiation-navigated parathyreoidectomy – MIRP. Rozhl Chir 2004;10 : 498–502.
30. Digonnet A, Carlier A, Willemse E, Quiriny M, Dekeyser C, de Saint Aubain N, Lemort M, Andry G. Parathyroid carcinoma: a review with three illustrative cases. J Cancer 2011;2 : 532–7. Epub 2011 Oct 27.
31. Bukowski RM, Sheeler L, Cunningham J, Esselstyn C. Successful combination chemotherapy for metastatic parathyroid carcinoma. Arch Intern Med 1984;144(2):399–400.
32. Betea D, Bradwell AR, Harvey TC, Mead GP, Schmidt-Gayk H, Ghaye B, Daly AF, Beckers A. Hormonal and biochemical normalization and tumor shrinkage induced by anti-parathyroid hormone immunotherapy in a patient with metastatic parathyroid carcinoma. J Clin Endocrinol Metab 2004;89(7):3413–20.
33. Sandelin K, Auer G, Bondeson L, Grimelius L, Farnebo LO. Prognostic factors in parathyroid cancer: a review of 95 cases. World J Surg 1992;16 : 724–31.
34. Givi B, Shah JP. Parathyroid carcinoma. Clin Oncol (R Coll Radiol). 2010;22(6):498–507. Epub 2010 May 26.
35. Silverberg SJ, Rubin MR, Faiman C, Peacock M, Shoback DM, Smallridge RC, Schwanauer LE, Olson KA, Klassen P, Bilezikian JP. Cinacalcet hydrochloride reduces the serum calcium concentration in inoperable parathyroid carcinoma. J Clin Endocrinol Metab 2007;92(10):3803–8. Epub 2007 Jul 31.
36. Captur G, Grimaud LM, Betts A, Degaetano J, Attard A, Vassallo J. Parathyroid carcinoma: clinical course, diagnosis and management. Malta Med J 2010;22 : 25–30.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 11-
All articles in this issue
- Vascular reconstructions infections in the aortofemoral region
- Repeated surgery for parathyroid carcinoma
- The importance of endosonography in preoperative management of patients with pancreatic head carcinoma
- The value of intraoperative ultrasonography in parathyroid surgery
- Postoperative pancreatic fistula management by gastrofistuloanastomosis – a set of case reports
- The NanoKnife and two successful cases of intracavitary irreversible electroporation of main bronchus tumours
- Current microsurgical and neurointerventional therapy of cerebral aneurysms
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Repeated surgery for parathyroid carcinoma
- Current microsurgical and neurointerventional therapy of cerebral aneurysms
- The NanoKnife and two successful cases of intracavitary irreversible electroporation of main bronchus tumours
- Postoperative pancreatic fistula management by gastrofistuloanastomosis – a set of case reports
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

