-
Medical journals
- Career
Ischemická kolitída po operáciách pre AAA
Authors: R. Necpal; V. Šefránek; R. Slyško; J. Tomka
Authors‘ workplace: Klinika cievnej chirurgie, Národný ústav srdcových a cievnych chorôb v Bratislave, Slovenská republika, prednosta kliniky: prof. MUDr. Vladimír Šefránek, Ph. D.
Published in: Rozhl. Chir., 2011, roč. 90, č. 1, s. 31-36.
Category: Monothematic special - Original
Overview
Úvod:
Ischémia čreva po operáciách AAA je zriedkavou komplikáciou. Je ale najčastejšou príčinou smrti po operáciách AAA. Incidencia je 5–9 % a 30–60 % pri RAAA s mortalitou až 60 %.Metodika:
Retrospektívne sme vyhodnotili súbor pacientov operovaných pre AAA v období 1. 1. 2007 až 31. 7. 2010. Sledovali sme klinické, paraklinické príznaky a prejavy, ktoré viedli k diagnóze. Zaznamenali sme výsledky operačnej liečby a príčinu úmrtia pacientov.Výsledky:
V uvedenom období sme operovali 207 pacientov s AAA. 174 (84 %) bolo operovaných elektívne, 33 (16 %) akútne. V pooperačnom období zomreli 19 pacienti (9,2 %). Najčastejšou príčinou úmrtia bola ischemická kolitída – 8 pacienti (42 %). IK sme diagnostikovali u 17 pacientov (8,2 %) s mortalitou 41,2 %. Diagnóza bola stanovená kolonoskopicky u 58,8 %, ostatných pacientov sme operovali na základe známok NPB. V skupine pacientov s včasnou diagnózou a liečbou IK, t.j. do 4 pooperačného dňa, bola mortalita 20 %, ale stúpla na 71,4 %, ak bola diagnóza stanovená neskôr.Diskusia:
Vznik ischemickej kolitídy sa nedá v pooperačnom období nikdy vylúčiť, preto treba po nej aktívne pátrať, hlavne u pacientov s rizikovými faktormi. Klinické známky sú nešpecifické, najčastejšie je to rýchly nástup peristaltiky a krvavé, profúzne hnačky. Z biochemických markerov sú sľubné prokalcitonín a D-laktát. Metódou voľby je kolonoskópia, ktorú treba zrealizovať pri každom nejasnom pooperačnom priebehu. O nutnosti operačnej revízie rozhodne nielen kolonoskopický nález, ale významnou mierou aj klinický obraz a celkový stav pacienta. Chirurgická liečba spočíva v resekcii nekrotického čreva a výkon je vždy ukončený stómiou.Záver:
Diagnostika IK je obtiažna a rozhodnutie o reoperácii napriek klinickým a paraklinickým vyšetreniam ostáva na chirurgovi a jeho chirurgickej skúsenosti. Len včasná a adekvátna liečba má nádej na úspech, oddialenie diagnózy zväčša vedie k fatálnemu koncu.Kľúčové slová:
ischemická kolitída – AAA – rizikové fakory – kolonoskópiaÚVOD
Ischémia čreva po operáciách AAA je zriedkavou, ale nebezpečnou a život ohrozujúcou komplikáciou. Ochorenie popísal v roku 1966 Martson [1]. Ako komplikácia po operáciách na brušnej aorte sa popisuje od 70. rokov 20. storočia. Ischémia môže postihnúť ktorúkoľvek časť gastrointestinálneho traktu, ale tenké črevo je postihnuté len v 1%, preto pre klinickú prax má význam len ischémia hrubého čreva (ischemická kolitída – IK). Etiológia ischemickej kolitídy je multifaktoriálna a vzniká následkom koincidencie množstva fyziologických, anatomických a farmakologických faktorov. V literatúre sa vzhľadom na nedostatočnú homogénnosť študovaných súborov pacientov udáva pomerne široké rozpätie, v ktorom sa pohybuje incidencia IK. Závisí to od viacerých faktorov, ako napr. od metodiky stanovenia diagnózy (použitia rutinnej kolonoskópie), od zahrnutia RAAA do súborov, od pitvanosti apod.). Pri hodnotení len klinicky zjavnej IK je incidencia pri elektívnych operáciách AAA 3 % a pri rupturovaných AAA 10–30 %. Ak sa rutinne používa pooperačná kolonoskópia, incidencia stúpa na 5–9 %, resp. 30–60 % podľa rôznych autorov [2, 3, 4]. Welch s kol. histologizoval sliznicu u 58 pacientov odobratú kolonoskopicky jeden týždeň po operácii na infrarenálnej aorte a u 30 % našli histologické známky ischemickej kolitídy, pričom kolonoskopické známky IK boli len u 50 % z nich [5]. Mortalita rozvinutej IK s nekrózou čreva je až 60 % [6]. V Sandisonovej prospektívnej štúdii u 222 pacientov po resekcii AAA predstavovala IK najčastejšiu príčinu úmrtia, častejšiu ako multiorgánové zlyhanie a akútny infarkt myokardu. V prípade endovaskulárnej liečby (EVAR) je incidencia nižšia (1,5–3 %) [2], chýbajú však väčšie súbory.
METODIKA
Retrospektívne sme vyhodnotili súbor pacientov operovaných pre AAA v období od 1. januára 2007 do 31. júla 2010. Do súboru boli zaradení pacienti, ktorí podstúpili emergentnú alebo elektívnu operáciu pre AAA. Zamerali sme sa na klinické charakteristiky jednotlivých prípadov, t.j. či bol pacient asymptomatický alebo sa prezentoval so symptomatickou, rupturovanou AAA. Zaznamenali sme typ operačných výkonov pre AAA aj v dôsledku ischemickej kolitídy a vyhodnotili sme prítomnosť rizikových faktorov, ktoré mohli viesť k vzniku ischemickej kolitídy. Sledovali sme aj najdôležitejšie klinické a paraklinické príznaky a prejavy, umožňujúce diagnózu tejto komplikácie. Zaznamenali sme výsledky operačnej liečby celého súboru a pacientov s výskytom IK so zameraním na morbiditu a mortalitu a hlavnú príčinu úmrtia.
VÝSLEDKY
V období od 1. januára 2007 do 31. júla 2010 sme na Klinike cievnej chirurgie NÚSCH, a.s. operovali 207 pacientov s diagnózou AAA. Vekový priemer pacientov bol 73 rokov (56–91 rokov). Najčastejším rekonštrukčným arteriálnym výkonom po exklúzii vaku aneuryzmy bola aortobiiliacká rekonštrukcia, nasledovala aortobifemorálna rekonštrukcia (bypas), najmenej frekventným výkonom u našich pacientov bolo nahradenie aorty lineárnym interpozitom. 174 operácií (84 %) bolo vykonaných elektívne, 33 (16 %) pacientov bolo operovaných emergentne pre ruptúru AAA. V pooperačnom období zomreli 19 pacienti (9,2 %), pričom mortalita po RAAA bola 33,3 % na rozdiel od elektívnych operácií, pri ktorých bola mortalita 4,6 %. Príčinou úmrtia bol v 5 prípadoch hypovolemický šok, perioperačný IM (1x), multiorgánové zlyhanie (5x) a najčastejšou príčinou bola ischémia hrubého čreva (8x) (Graf. 1).
Graph 1. Príčiny úmrtia Graph 1. Causes of deaths 
V uvedenom období sme v celom súbore 207 pacientov diagnostikovali IK u 17 pacientov. Incidencia klinicky jasnej IK v našom súbore bola 17/207 (8,2 %), pričom pri elektívnych operáciách bola 12/174 (6,9 %) a pri RAAA stúpla na 5/33 (15,2 %). Definitívna diagnóza ischemickej kolitídy bola stanovená na základe kolonoskopického nálezu, operačného nálezu, resp. pitvou. V 16 prípadoch (94,1 %) boli ischemické zmeny lokalizované v oblasti ľavej polovice hrubého čreva (Obr. 1, 2), v jednom prípade u pacienta v ťažkom šoku s vysokou inotropnou podporou sme našli ischémiou postihnuté celé hrubé črevo. U všetkých pacientov boli prítomné známky ischémie v oblasti colon sigmoideum alebo colon rectosigmoideum. Dvaja pacienti zomreli po stanovení diagnózy bez operačnej liečby v súvislosti s ich ťažkým klinickým stavom a v 1 prípade sme u stabilizovaného, vysoko rizikového pacienta postupovali konzervatívne (nazogastrická sonda, totálna parenterálna výživa, kombinácia ATB, opakované kolonoskopické kontroly). U zvyšných 14 pacientov (82,4 %) sme indikovali operačnú revíziu brušnej dutiny. V prípade netransmurálneho postihnutia čreva sme v 3 prípadoch ustúpili od resekcie čreva a výkon sme ukončili drenážou dutiny brušnej. Všetci traja pacienti sa zhojili bez komplikácie. Pri náleze transmurálnej nekrózy čreva sme indikovali resekčný výkon v závislosti na lokalizácii zmien na hrubom čreve. Všetky resekcie sme ukončili kolostómiou. V jednom prípade pri rozsiahlom postihnutí celého hrubého čreva u pacienta v zlom celkovom stave, s vysokou inotropnou podporou sme indikovali len axiálnu transverzostómiu. V dvoch prípadoch bolo pre rozsiahlu nekrózu zadného peritonea nutné urobiť ľavostrannú hemikolektómiu, čím došlo k odhaleniu cievnej protézy (Obr. 3). Stav sme riešili výplachom a prekrytím protézy omentálnym lalokom (Obr. 4). Z 13 pacientov s transmurálnou ischémiou (11x potvrdená operáciou, 2x pitvou) zomreli 7 pacienti, čo predstavuje úmrtnosť 53,8 %. V prípade netransmurálneho postihnutia bola úmrtnosť na túto komplikáciu nulová a reoperácia s negatívnym nálezom prognózu pacientov neovplyvnila.
Image 1. Transmurálna nekróza lienálnej flexúry Fig. 1. Transmural necrosis of lienal flexure 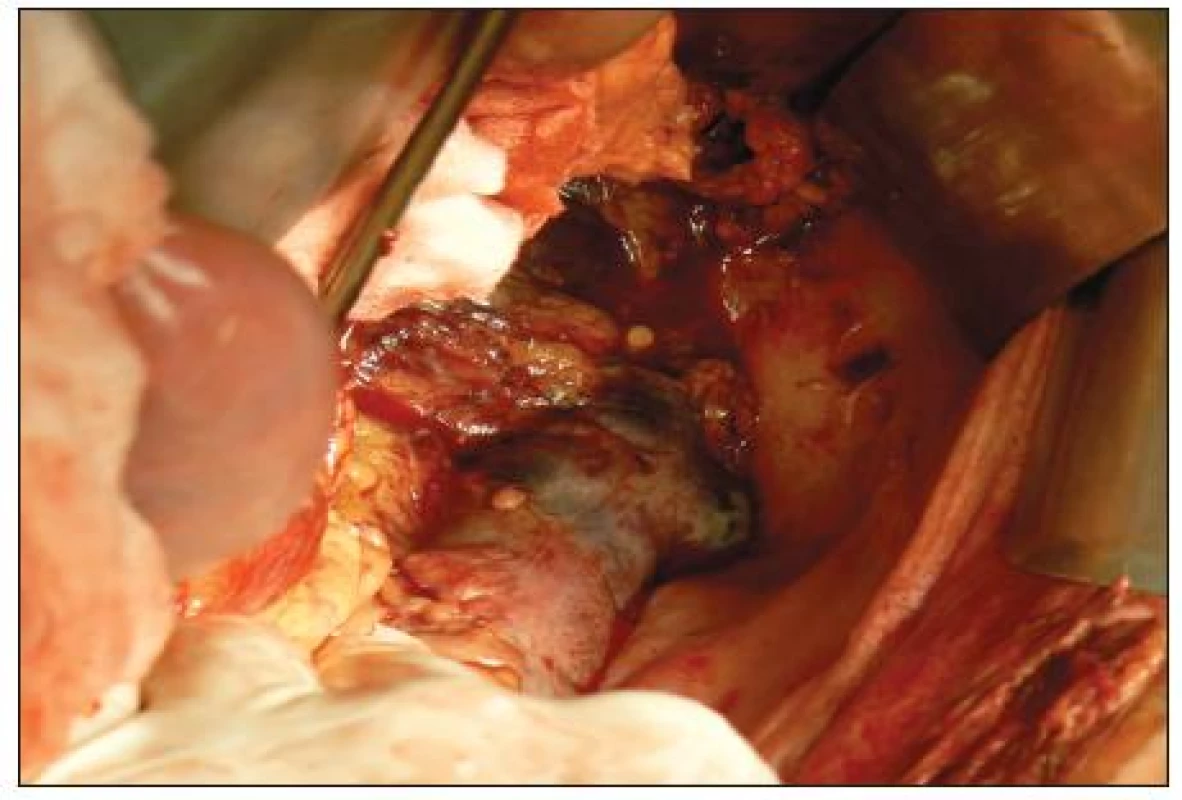
Image 2. Resekát čreva s ložiskami nekróz Fig. 2. Resected part of large bowel with visible transmural necrosis 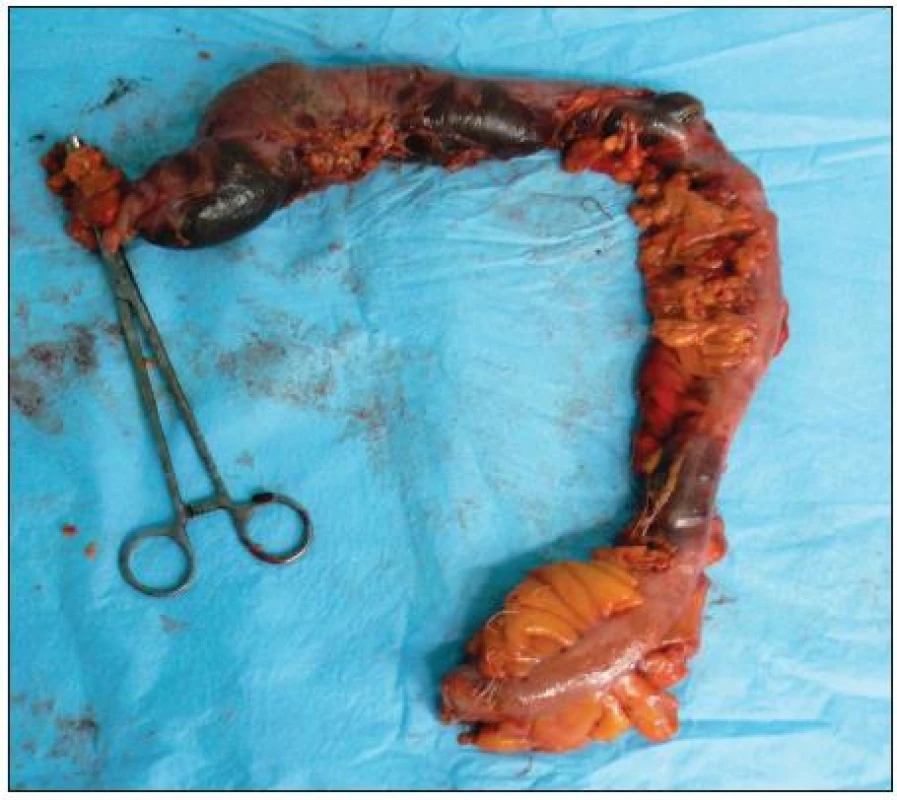
Image 3. Odhalená cievna protéza po ľavostrannej hemikolektómii Fig. 3. Visible vascular prosthesis after left hemicolectomy 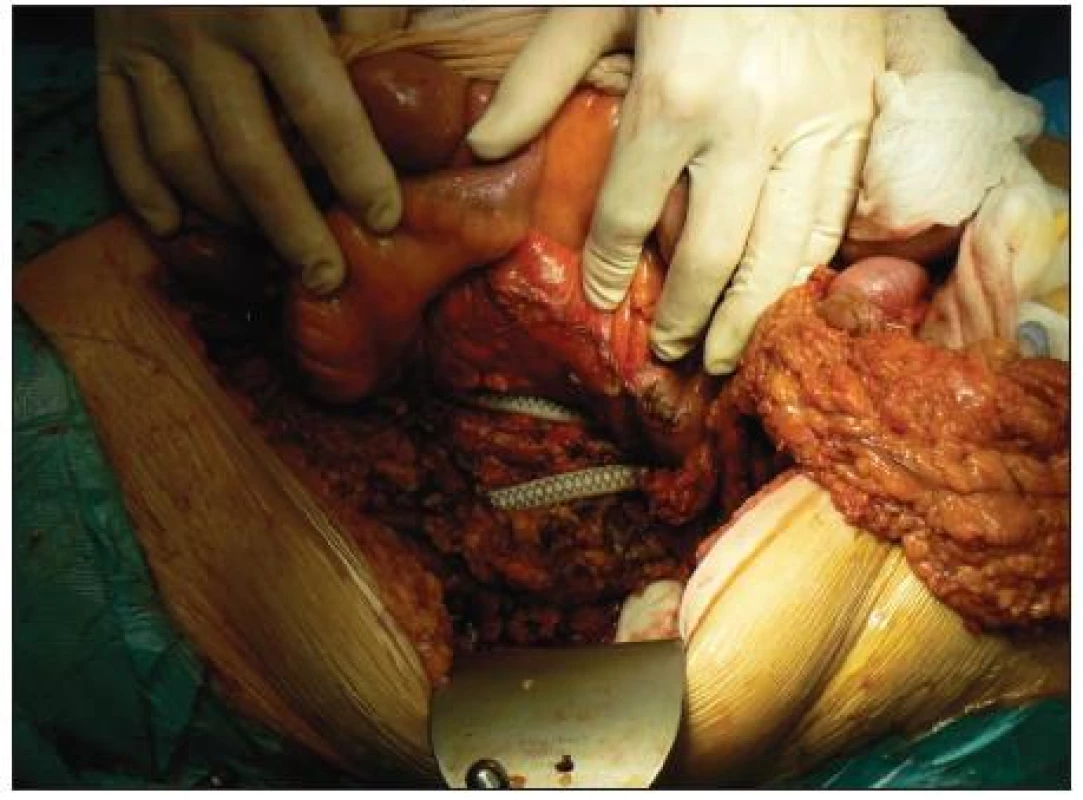
Image 4. Stav po prekrytí retroperitonea omentálnym lalokom Fig. 4. Status post omentoplasty of the retroperitoneum 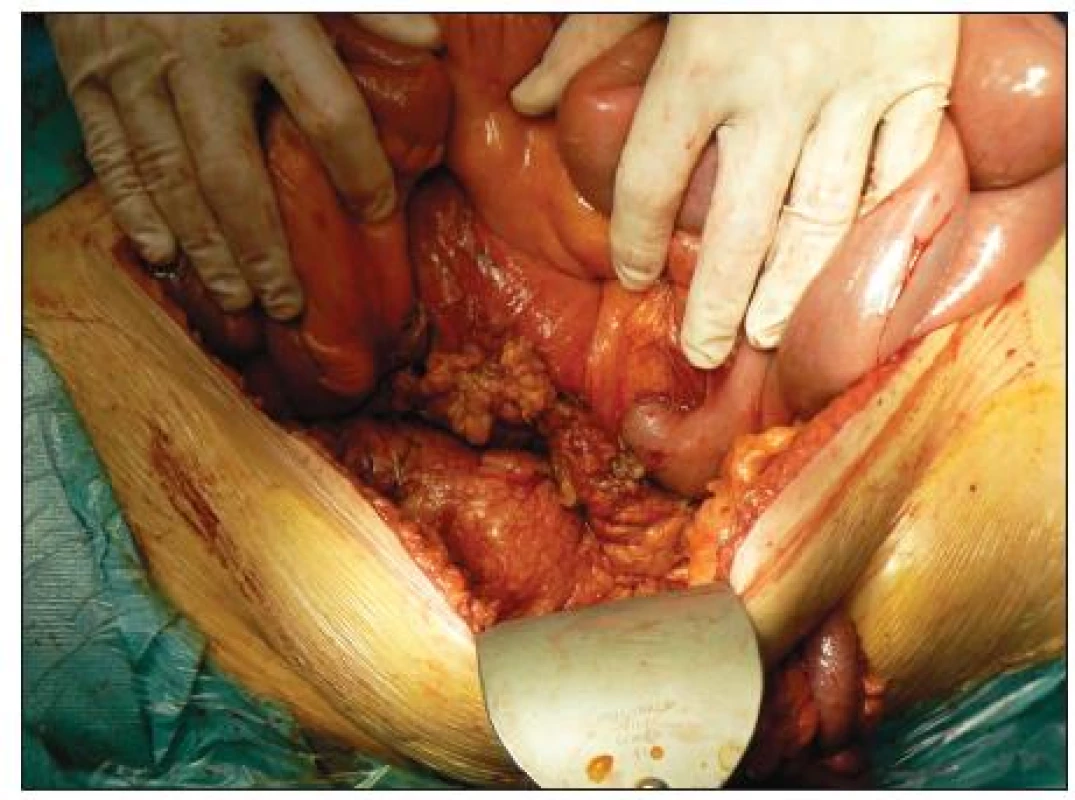
Diagnózu sme verifikovali kolonoskopickým vyšetrením u 10 pacientov (58,8 %). Vyšetrenie sme realizovali vo všetkých uvedených prípadoch pri posteli pacienta na základe klinického podozrenia na IK. Kolonoskópia sa nevykonávala v plnom rozsahu (pankolonoskópia), najčastejšie išlo o sigmoideoskópiu. Vo zvyšných 7 prípadoch sme indikovali a realizovali operačnú revíziu a prípadný výkon na hrubom čreve na základe jednoznačného klinického nálezu (známky NPB).
V 10 prípadoch sme diagnózu stanovili do 4. pooperačného dňa, v 7 prípadoch neskôr (Graf. 2). Úmrtnosť v 1. skupine bola 20%, zatiaľ čo v 2. skupine prudko stúpla na 71,4 %. Pacienti v 2. skupine mali pokročilé ochorenie – 2 zomreli po stanovení diagnózy, u 1 bola ischémia celého hrubého čreva a 2 pacienti mali nekrózu celej ľavej strany hrubého čreva presahujúcu na zadné peritoneum a do retroperitonea.
Graph 2. Interval od operácie AAA po diagnostiku IK Graph 2. Interval between AAA surgery and diagnosis of ischemic colitis 
DISKUSIA
Ischemická kolitída je nebezpečnou komplikáciou po operáciách na brušnej aorte. Môže vzniknúť po resekcii aneuryzmy brušnej aorty, ale aj po operáciách pre obliterujúce aterosklerotické ochorenie v aortoiliackom segmente, trombózu alebo disekciu brušnej aorty. Napriek pokroku v perioperačnej starostlivosti o pacienta po resekcii AAA, ktorý sme zaznamenali v poslednom desaťročí, sa mortalita pacientov s pooperačnou nekrózou čreva neznížila. Pacienta môže zachrániť len včasná diagnostika a následný radikálny operačný výkon. Diagnostika je však obtiažna, pretože u väčšiny pacientov sú prítomné len nešpecifické príznaky a dôležité klinické známky tejto komplikácie bývajú veľmi často zastreté modifikovaným klinickým obrazom v dôsledku ťažkého pooperačného priebehu. V dôsledku toho sa u väčšiny pacientov ischemická kolitída diagnostikuje až v štádiu nekrózy čreva a brušnej sepsy.
IK sa vyvíja v bezprostrednom pooperačnom období, v priebehu niekoľkých dní od operácie AAA. V našom súbore sme IK stanovili u 59 % v priebehu 4 pooperačných dní. Ak bola diagnóza stanovená neskôr , nálezy boli rozsiahlejšie a prudko stúpla úmrtnosť. Z toho sa dá usudzovať, že aj u týchto pacientov sa IK vyvinula v skorom pooperačnom priebehu, ale diagnóza bola stanovená neskoro.
Dôležitá je nielen samotná diagnostika, ale aj exaktné posúdenie stupňa a rozsahu postihnutia steny čreva, lebo pri postihnutí lokalizovanom na sliznicu je možné postupovať konzervatívne, zatiaľ čo pri transmurálnom poškodení je indikované operačné riešenie.
Klasickými, v literatúre často uvádzanými klinickými príznakmi a prejavmi IK, sú včasná obnova pasáže (v priebehu niekoľkých hodín po operácii), krvavá hnačkovitá stolica a atonické sfinktery. Tieto sú však prítomné len u necelej tretiny pacientov, u ktorých tak možno stanoviť diagnózu. Maupin popísal 20 pacientov, ktorí mali vo včasnom pooperačnom období explozívne alebo krvavé hnačky do 4–8 hodín od operácie, pričom 13 (65 %) z nich mali ischemickú kolitídu [7]. Známky peritonitídy vznikajú neskoro a vtedy je už často vzhľadom na plne rozvinutý obraz IK s pridruženým multiorgánovým zlyhávaním zvyčajne neskoro na záchranu pacienta. Ďalšie príznaky, ktoré môžu byť prítomné pri ischemickej kolitíde, sú nešpecifické, a môžu byť prítomné aj pri iných pooperačných komplikáciách (Tab. 1). Klinický obraz je často prekrytý šokom, poruchou vedomia a niektorými terapeutickými postupmi v rámci intenzívnej starostlivosti v dôsledku ťažkého pooperačného priebehu. Klinické vyšetrenie môže byť skreslené pooperačnou celkovou a epidurálnou analgéziou.
Table 1. Príznaky ischemickej kolitídy Tab. 1. Ischemic colitis symptoms 
Na základe klinického obrazu a štandardných laboratórnych vyšetrení sa zriedkakedy dá stanoviť diagnóza IK, a tak rozhodnúť o nutnosti operačnej revízie. Veľa autorov sa snažilo nájsť metodiku, ktorá by pomohla pri jej diagnostike.
Nagata a kol. publikovali prospektívnu štúdiu 93 pacientov, u ktorých sledovali plazmatickú hladinu prokalcitonínu (PCT) u pacientov po elektívnej aortálnej chirurgii. Ak bola hladina PCT 2. pooperačný deň vyššia ako 2,0 ng/ml, u pacienta realizovali vzhľadom na pravdepodobnosť IK kolonoskópiu. Senzitivita PCT bola 100% a špecificita 83,9%. Falošne pozitívne bolo vyšetrenie u pacientov s renálnou insuficienciou, peroperačnou autotransfúziou, polypmi čreva a vo vysokom veku [8]. Podobne Maruna popísal významnú eleváciu PCT u pacientov s vyskulárnym ileom na rozdiel od pacientov s paralytickým ileom [9].
Ďalším potenciálnym markerom ischémie hrubého čreva by mohol byť D-laktát [10, 11]. Je to stereoizomér L-laktátu a je normálnym produktom bakteriálnej fermentácie. Jeho normálne hodnoty v sére sú minimálne. Jedným z prvých patofyziologických následkov ischémie čreva je zvýšenie permeability črevnej steny, čo vedie k translokácii baktérií do krvi a následne k zvýšeniu D-laktátu v sére. Poeze a kol. dokázali, že hladina D-laktátu vo včasnom pooperačnom období má senzitivitu 82 % a špecificitu 77 % v diagnostike IK u pacientov po operácii rupturovanej AAA [11]. L-laktát ako marker IK nie je vhodný pre jeho nízku špecificitu. V literatúre sa udávajú aj ďaľšie biochemické parametre, ktoré sa sledovali v súvislosti s IK (D-dimér, kreatinín-fosfokináza, laktát-dehydrogenáza, tumor nekrotizujúci faktor alfa, interleukín 6, endotoxín) [12, 13], ale ich prínos pre klinickú prax sa nepotvrdil.
Najrozšírenejšou a najpresnejšou metodikou v diagnostike IK je kolonoskópia, ktorá okrem diagnózy často umožňuje aj určiť stupeň a rozsah poškodenia a tým priamo ovplyvniť ďalšiu liečbu. Vzhľadom na relatívne nízku incidenciu klinicky významnej IK sa kolonoskópia neodporúča paušálne u každého pacienta po operácii AAA. I keď sa dá zrealizovať pri posteli pacienta na JIS, ide o invazívne vyšetrenie s možnými príslušnými komplikáciami. V prípade klinického podozrenia na IK (včasný nástup peristaltiky alebo naopak prolongovaný ileus, krvavé hnačky, hemodynamická instabilita, známky sepsy, acidóza), pri nejasnom pooperačnom priebehu a klinickom náleze aj s prihliadnutím na operačný nález sa dá predpokladať rozvoj IK a v týchto prípadoch je kolonoskópia metódou voľby [6]. Vo svojom súbore 80 pacientov operovaných pre RAAA indikoval kolonoskópiu u 19 pacientov. Nemal periprocedurálnu komplikáciu. Pri nejasnom náleze, resp. pri konzervatívnej liečbe, je nevyhnutné opakované vyšetrenie. Pritom nemusí ísť o pankolonoskópiu, lebo až u 95 % pacientov sú zmeny prítomné v rozsahu aborálnych 40 cm. Nález pri kolonoskópii môže byť od slizničných zmien (erózie, ulkusy, krvácanie) až po nekrózu celej steny čreva. Zatiaľčo slizničné zmeny sú liečené konzervatívne, pri transmurálnej nekróze je indikovaná reexplorácia dutiny brušnej a resekčný výkon. Problémom sú endoskopické nálezy medzi týmito hraničnými nálezmi, kedy je nutné pri zvažovaní liečebného postupu prihliadať aj na klinický obraz a biochemické parametre. Treba zdôrazniť aj skutočnosť, že kolonoskópia nedokáže vždy odlíšiť transmurálnu nekrózu od slizničnej nekrózy.
Ďalšou, ale v klinickej praxi málo rozšírenou metódou, je pH-metria sliznice čreva (sigmoid pH-tonometry). Je založená na detekovaní zvýšenej lokálnej produkcie CO2 v ischemickej sliznici. Metóda má vysokú senzitivitu a špecificitu, dokáže rozlíšiť transmurálnu nekrózu čreva a tým indikovať relaparotómiu [15]. Podľa autorov nie je indikovaná u všetkých pacientov po elektívnej operácii, ale je indikovaná u RAAA a u pacientov s AAA a súčasným ťažkým bilaterálnym aterosklerotickým, alebo aneuryzmatickým postihnutím a. iliaca interna .
Diagnostika by mala viesť nielen k zisteniu IK, ale aj k rozhodnutiu o spôsobe liečby. Konzervatívna liečba je indikovaná pri netransmurálnej ischémii. Spočíva v parenterálnej výžive, ATB liečbe, sledovaní klinického stavu a opakovaných kolonoskopických vyšetreniach. V prípade zhoršenie klinického obrazu, biochemických parametrov alebo kolonoskopického nálezu je indikovaná operačná revízia. Pri operačnej revízii závisí postup od nálezu. Ak nie je prítomná transmurálna nekróza steny čreva, alebo perforácia čreva, výkon ukončíme drenážou brušnej dutiny. V našom súbore sme takto postupovali 3x, pričom táto reoperácia nemala negatívny vplyv na ďalší pooperačný priebeh. Pri náleze nekrózy celej steny, event. aj perforácie čreva je indikovaný resekčný výkon v závislosti od rozsahu nekrózy. Slizničné zmeny často presahujú ďalej ako je línia nekrózy viditeľná na seróze čreva, preto je nutné črevo resekovať v dostatočnej vzdialenosti od týchto zmien. Resekcia je vždy ukončená stómiou, nikdy nie primárnou anastomózou. Kedže nie je nutné dodržiavať princípy onkochirurgie, je zväčša možné resekovať črevo bez odhalenia cievnej protézy v retroperitoneu. V prípade rozsiahlej nekrózy, ktorá presahuje aj na zadné peritoneum, je vhodné po odstránení nekróz prekryť cievnu protézu omentálnym lalokom.
Prevencia
Prevencia IK by mala viesť k eliminácii ovplyvniteľných rizikových faktorov (Tab. 2). Primárna prevencia IK spočíva v jednoduchosti, rýchlom a efektívnom operačnom výkone s čo najmenšou stratou krvi (odhliadnuc od straty pre ruptúru AAA), ktorý zabezpečí stabilnú hemodynamiku počas celého operačného výkonu a v bezprostrednom pooperačnom priebehu. Pokiaľ je to možné a operačný nález to umožní, malo by byť snahou chirurga zachovať predoperačný stav výživy splanchnickej oblasti a malej panvy. Preto sú na mieste aortoiliacké rekonštrukcie, najlepšie na spoločnú iliackú artériu. V prípade aneuryzmatického postihnutia aj iliackých ciev je potrebné zachovať perfúziu aspoň cez jednu vnútornú iliackú artériu.
Table 2. Rizikové faktory Tab. 2. Risk factors 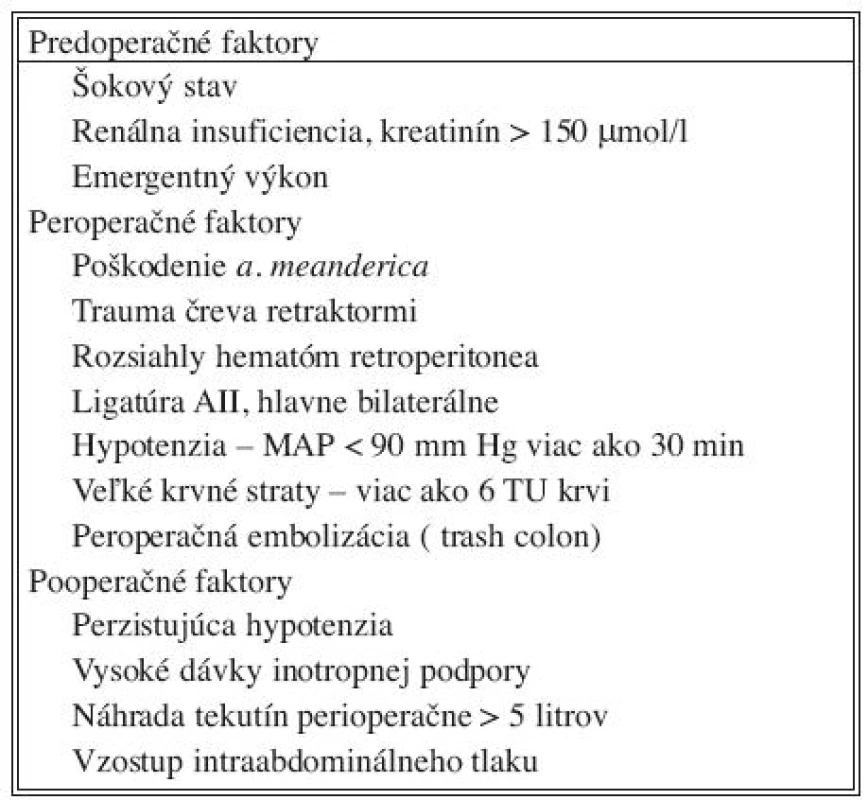
Zo všeobecných opatrení počas operácie treba uviesť minimalizáciu krvných strát, skrátenie cross-clampingu aorty a skrátenie operačného času. Ak je to možné, treba sa pokúsiť o revaskularizáciu aspoň jednej a. iliaca interna. Reimplantácia a. mesenterica inferior (AMI) sa v súčasnosti nepovažuje sa preventívne opatrenie vzniku ischémie čreva. Žiadna zo štúdií nepotvrdila vzťah medzi ligatúrou AMI a zvýšeným rizikom vzniku IK. Pri EVAR sa AMI konštantne prekrýva, ale incidencia IK je skôr nižšia. Reimplantácia AMI sa odporúča v prípade koincidencie AAA a aortoiliackého postihnutia, kedy sa AMI stáva významnou kolaterálou. Tiež v prípade aneuryziem resp. obliterácie oboch vnútorných iliackých artérií, kedy sa nedarí revaskularizácia ani jednej z nich, je reimplantácia AMI plne na mieste. Prediktorom nevyhnutnosti reimplantácie AMI je podľa niektorých autorov minimálny spätný tok z pahýľa AMI alebo neistá vitalita colon sigmoideum v priebehu operácie. V prípade ligatúry AMI treba cievu podviazať tesne za jej odstupom alebo opichnúť zvnútra vaku AAA, aby nedošlo k poškodeniu kolaterálnych tepien z povodia a. mesenterica superior, ktoré odstupujú vo vzdialenosti 3–4 cm od odstupu AMI z aorty [14].
Ischémia čreva nevzniká len počas vlastného operačného výkonu, ale k jej vývoju prispievajú aj faktory vo včasnom pooperačnom období. Preto prevencia musí pokračovať aj v pooperačnom období. Liečba hypovolémie, hypotenzie je samozrejmosťou. Použitie inotropných látok treba zvážiť pre riziko zvýraznenia splanchnickej vazokonstrikcie. Prílišná objemová nálož môže viesť k zvýšeniu intraabdominálneho tlaku (IAT), čím sa tiež znižuje perfúzia čreva. V prípade vzostupu IAT nad 25 cm H2O a pri klinických známkach IK alebo abdominal compartment syndrómu (ACS) je indikovaná dekompresia dutiny brušnej (relaparotómia a odložený uzáver brušnej steny) [15]. Po úprave tejto patofyziologickej situácie, čo sa prejaví okrem iného aj polyúriou, je po 3–5 dňoch možný definitívny uzáver brušnej dutiny.
ZÁVER
Napriek pokroku v operačnej liečbe a perioperačnej starostlivosti je ischemická kolitída po operáciách na brušnej aorte stále nebezpečnou komplikáciou s vysokou úmrtnosťou. Pri elektívnych operáciách je incidencia nízka, ale stúpa u pacientov po operáciách RAAA. Šok, veľké krvné straty a obmedzenie krvného toku do vnútorných iliackých artérií sú najdôležitejšími rizikovými faktormi. Neexistuje žiadny marker, ktorý by bezpečne odhalil túto komplikáciu. Treba na ňu ale myslieť a aktívne pátrať po symptómoch hlavne u pacientov po emergentných operáciách pre RAAA a za prítomnosti rizikových faktorov aj u elektívne operovaných pacientov. Vzhľadom na nešpecifické klinické príznaky sa v diagnostike uplatňuje hlavne kolonoskópia, ktorá vedie k diagnóze až u 95 % pacientov. Preto ju treba včas indikovať pri akomkoľvek nejasnom pooperačnom priebehu. Ale ani kolonoskópia neumožňuje vždy rozoznať nekrózu celej steny a tým selektovať pacientov indikovaných k operačnej liečbe. Toto rozhodnutie ostáva na chirurgovi, ktorý je často postavený pred neľahkú úlohu rozhodnúť o reoperácii u ťažko chorého, rizikového pacienta. Na druhej strane len včasná a adekvátna liečba má nádej na úspech, oddialenie diagnózy zväčša vedie k fatálnemu koncu.
MUDr. R. Necpal
Klinika cievnej chirurgie NÚSCH
Pod Krásnou hôrkou 1
833 48 Bratislava
Slovenská republika
Sources
1. Martson, A., Pheils, M. T., Thomas, M. L. Ischemic colitis. Gut, 1966; 7 : 1–15.
2. Becquemin, J. P., Majewski, M., Fermani, N. Colon ischemia following abdominal aortic aneurysm repair in the era of endovascular abdominal aortic repair. J. Vasc. Surgery, 2008; 47 : 258–263.
3. Megalopoulos, A., Vasiliadis, K., Tsalis, K., Kapetanos, D. Reliability of selective surveillance colonoscopy in the early diagnosis of colonic ischemia after succesful ruptured abdominal aortic aneurysm repair. Vasc. Endovasc. Surg., 2008; 41 : 509–515.
4. Perry, R. S., Martin, M. J., Eckert, M. S. Colonic ischemia complicating open vs. endovascular abdominal aortic aneurysm repair. J. Vas. Surg., 2008; 48 : 271–271.
5. Welch, M., Baguneid, M. S., McMahon, R. F. Histological study of colonic ischaemia after aortic surgery. Britisch J. Surg., 1998; 85 : 1095–1098.
6. Brandt, C. P., Piotrowski, J. J., Alexander, J. J. Flexible sigmoidoscopy: A reliable determinant of colonic ischemia following ruptured abdominal aortic aneurysm. Surg Endosc., 1997; 11 : 113–115.
7. Maupin, G. E., Rihar, S. D., Villalba, M. Ischemic colitis following abdominal aortic reconstruction for ruptured aneurysm. Am. Surg., 1989; 55 : 378–380.
8. Nagata, J., Kobayashi, M., Nishikimi, N., Komori, K. Serum procalcitonin (PCT) as a negative screening test for colonic ischemia after open abdominal aortic surgery. Eur. J. Vasc. Endovasc. Surg., 2008; 35 : 694–697.
9. Maruna, P., Fraško, R., Gürlich, R. Plasma prokalcitonin in patients with ileus. Relations to often inflammatory parameters. Physiol. Res., 2005; 57 : 481–486.
10. Assadian, A., Assadian, O., Senekowitsch, C. Plasma D-lactate as a potential early marker for colon ischaemia aften open aortic reconstruction. Eur. J. Vasc. Endovasc. Surg., 2006; 31 : 470–474.
11. Poeze, M., Froon, A.M., Greve, J. W., Ramsay, G. D-lactate as an early marker of intestinal ischaemia after ruptured abdominal aortic aneurysm repair. Br. J. Surg., 1998; 85 : 1221–1224.
12. Elmarasay, N. M., Soong, Ch. V., Walker, S. R., Macierewisz, J. A. Sigmoid ischemia and the inflammatory response following endovascular abdominal aortic repair. J. Endovasc. Ther., 2000; 7 : 21–30.
13. Block, T., Nilsson, T. B., Björck, M., Acosta, S. Diagnostic accuracy of plasma biomarkers for intestinal ischaemia. Scvans. J. Clin. Lab. Invest., 2008; 68 : 242–248.
14. Ernst, C. B. Colon ischemia following aortic reconstruction. In: Rutherford, R. B. et al.: Vascular Surgery. Fifth edition. W. B. Saunders Company, 2000 : 1542–1549.
15. Björck, M., Lindberg, F., Broman, G. pH monitoring of the sigmoid colon after aortoiliac surgery. A five-year prospective study. Eur. J. Vasc. Endovasc. Surg., 2000; 20 : 273–280.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 1-
All articles in this issue
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Změny velikosti pravého a falešného lumen ve viscerálním segmentu po endovaskulární léčbě disekcí aorty typu B
- Ischemická kolitída po operáciách pre AAA
- Plazmatické hladiny prozánětlivých cytokinů u aneuryzmatu abdominální aorty
- Roboticky asistované cévní rekonstrukce aorto-ilické oblasti
- Vliv infrainguinálních bypassů na dlouhodobou průchodnost pánevních intervencí – význam hybridních výkonů
- Žilní interponát při řešení krvácení z distální anastomózy pedálního bypassu
- Peroperační intraarteriální trombolýza v terapii akutní končetinové ischemie
- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Simultánní karotická endarterektomie a koronární revaskularizace: indikace a výsledky
- Jednoduchá metoda odstranění infikované cévní protézy
- Dva mylné mýty flebologické chirurgie 20. století
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Aneuryzma lienální tepny jako příčina bolesti břicha s hypotenzí
- Současné trendy v chirurgické léčbě výdutě torakoabdominální aorty
- Cytostatická hypertermická perfuze izolované končetiny (HILP) ve VFN
- Radikální operace infekce cévní protézy v aortofemorální pozici s pomocí čerstvého tepenného allograftu: naše střednědobé zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

