-
Medical journals
- Career
Chirurgická léčba jaterních metastáz kolorektálního karcinomu
Authors: V. Třeška; T. Skalický; A. Sutnar; V. Liška
Authors‘ workplace: Chirurgická klinika FN v Plzni, přednosta: prof. MUDr. Vladislav Třeška, DrSc.
Published in: Rozhl. Chir., 2009, roč. 88, č. 2, s. 69-74.
Category: Monothematic special - Original
Overview
Úvod:
Česká republika zaujímá ve výskytu kolorektálního karcinomu bohužel přední místo na světě. Operační výkony pro jaterní metastázy kolorektálního karcinomu (JMKRK) patří v naší republice k dobře zavedeným chirurgickým technikám s kvalitními dlouhodobými výsledky.Cíl:
Smyslem práce bylo zhodnotit výsledky vlastního pracoviště s odkazem na moderní trendy v chirurgii jater.Soubor nemocných a metoda:
Na Chirurgické klinice FN a LFUK v Plzni jsme operovali od 1. 1. 2000 do 1. 12. 2008 celkem 346 nemocných s JMKRK, u kterých jsme provedli celkem 442 výkonů na játrech.Výsledky:
30denní pooperační mortalita byla 0,3 % a morbidita 8,1 %. Pět let po operaci jater pro JMKRK přežívá 34,0 % nemocných. Tři roky po radiofrekvenční ablaci (RFA) JMKRK přežívá 35,5% nemocných.Závěr:
Chirurgická léčba JMKRK je dnes metodou léčebné volby. Druhou alternativou zůstává využití radiofrekvenční ablace (RFA) u neresekabilních JMKRK. V současnosti je však v době stanovení diagnózy JMKRK radikálně operovatelných jen okolo 20 % nemocných. Proto novým trendem v chirurgii jater jsou na naší klinice etapové, kombinované výkony a reresekce, jejichž cílem je zvýšení resekability JMKRK při zachování nízké pooperační morbidity a mortality nemocných.Klíčová slova:
jaterní metastázy kolorektálního karcinomu (JMKRK) – chirurgická léčbaÚVOD
Kolorektální karcinom (KRK) patří dnes celosvětově mezi nejčastější maligní onemocnění s více než 500 000 úmrtí a s výskytem téměř 700 000 nových případů ročně. Česká republika bohužel zaujímá ve výskytu KRK druhé místo na světě. V roce 2003 onemocnělo KRK 4 568 mužů a 3 306 žen. Incidence pak činila u mužů 51,5/100 000 a u žen 38,3/100 000 [1, 2]. Jestliže světová literatura udává výskyt synchronních a metachronních jaterních metastáz KRK mezi 40–60 % [3], pak v našich krajinách je to číslo opět vyšší a pohybuje se v rozmezí 60–80 %.
Na základě výše uvedených údajů můžeme proto očekávat, že incidence metastáz kolorektálního karcinomu do jater (JMKRK) bude v populaci stoupat. I přes sofistikované diagnostické možnosti zůstává však v době stanovení diagnózy JMKRK radikálně operovatelných jen kolem 20 % nemocných [4]. Přitom radikální léčba má v současnosti nejlepší výsledky z hlediska dlouhodobého přežívání nemocných, když 5 let po operaci přežívá 25–40 % nemocných [5, 6, 7]. Bez možnosti chirurgické léčby JMKRK není pak průměrné přežití nemocných delší než 1 rok.
MATERIÁL A METODA
Na chirurgické klinice Fakultní nemocnice a Lékařské fakulty v Plzni jsme od 1. 1. 2000 do 1. 12. 2008 operovali pro JMKRK 304 nemocných, u kterých jsme provedli celkem 466 výkonů na játrech. Průměrný věk nemocných byl 60,7 roku (29–84 let), poměr mužů a žen byl 4 : 1 (Tab. 1).
Table 1. Soubor nemocných s JMKRK (1. 1. 2000 – 1. 12. 2008) Tab. 1. Colorectal carcinoma liver metastases patient group (01-01-2000 – 01-12-2008) 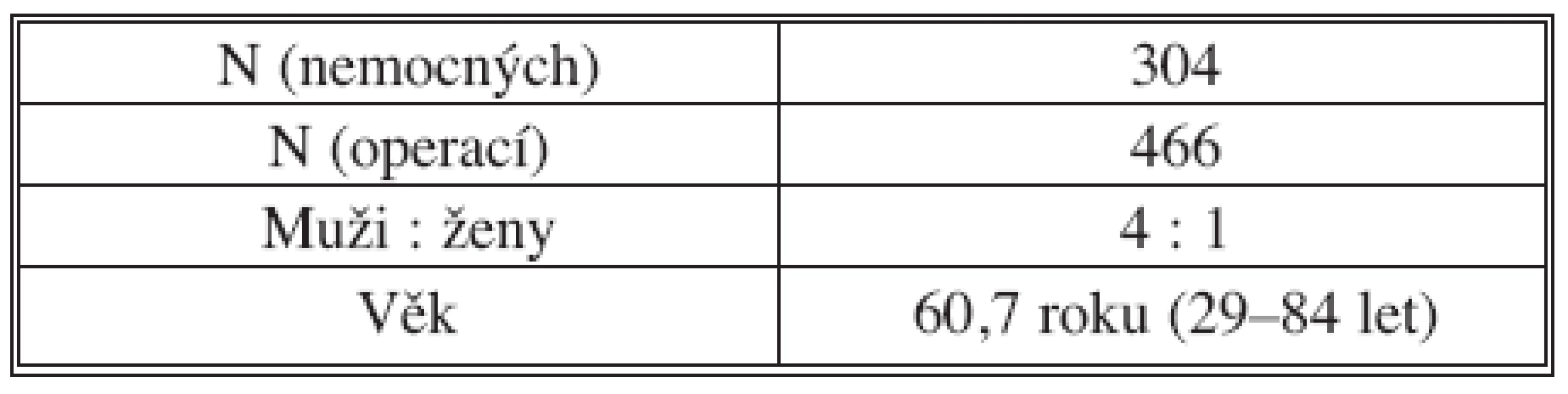
Předoperačně jsme nemocné vyšetřili pomocí duplexní ultrasonografie (USG), spirální výpočetní tomografie jater (HRCT) s podáním kontrastní látky intravenózně. V diagnosticky nejasných případech jsme pak využili magnetickou rezonanci (MRI) opět s podáním intravenózní kontrastní látky. V současnosti pak rutinně využíváme pro diagnostiku jaterních a mimojaterních metastáz pozitronovou emisní tomografii (PET CT). U rozsáhlých jaterní resekcí, nebo u cirhotiků s nutností zachovat maximum nádorem nepostižené jaterní tkáně jsme předoperačně provedli CT volumometrii. U nemocných s postižením jaterních funkcí nebo před rozsáhlými výkony na játrech využíváme ke stanovení jaterní rezervy testu retence indocyaninové zeleně. Během vlastního operačního výkonu na játrech jsme provedli ještě peroperační „staging“ JMKRK pomocí laparoskopické ultrazvukové sondy nebo peroperační USG otevřenou cestou.
Celkem jsme provedli 466 výkonů na játrech. Cílem resekcí jater bylo zachovat maximální radikalitu výkonu s minimálně 1 cm lemem zdravé jaterní tkáně kolem tumoru (tzv. R0 resekce) a minimalizací výkonu na játrech (zachování maxima zdravé jaterní tkáně). U nemocných (N = 139), kde jsme nemohli z technických příčin provést jaterní resekci, jsme využili metodu radiofrekvenční ablace (RFA). U 5 nemocných s JMKRK a plicními metastázami (v počtu 1–3) jsme provedli resekci jater a následně v odstupu 3 týdnů plicní resekci nebo RFA. RFA u JMKRK jsme prováděli pod peroperační USG kontrolou otevřenou nebo laparoskopickou cestou (do souboru nejsou zahrnuty transkutánní výkony RFA pod CT nebo USG kontrolou).
V roce 2004 jsme začali využívat tzv. etapové (N = 29) nebo kombinované výkony (např. RFA s resekcí jater v jedné době – N = 42) na játrech s cílem zvýšení resekability JMKRK. U etapových postupů jsme využívali různé multimodální přístupy. Nejčastěji jsme embolizovali větev portální žíly – PVE – na straně nádoru s cílem zvětšit objem jaterní tkáně druhého laloku a s odstupem 3–4 týdnů jsme pak provedli resekci jater. Dále jsme u bilobárního postižení jater nádorem provedli v první době PVE jednoho laloku a RFA ložisek ve druhém laloku a s odstupem 4 týdnů pak resekci jater na straně PVE. U řady nemocných jsme rovněž využili kombinaci PVE s vícedobými resekcemi jater nebo metodu tzv. „downstagingu“ pomocí systémové nebo lokoregionální chemoterapie u primárně inoperabilního JMKRK, kde jsme po zmenšení nádorové masy provedli jaterní resekci.
VÝSLEDKY
Do 30 dní po operaci zemřel 1 nemocný (0,3 %) z důvodů krvácivých komplikací při rozšířené pravostranné hepatektomii. Morbidita nemocných byla 7,8 % (N = 24). Příčinou pooperačních komplikací byla nejčastěji žlučová píštěl – 9x, absces podjaterní krajiny – 3x, bronchopneumonie – 3x. Ostatní komplikace, jako dehiscence laparotomie, cévní mozková příhoda, pneumotorax, krvácení z resekční plochy, byly sporadické.
Dobu přežití nemocných a interval bez recidivy nádoru jsme statisticky hodnotili pomocí Kaplanovy-Meierové křivky. Medián přežití nemocných po jaterním výkonu byl 30 měsíců (v rozmezí 1–57 měsíců). Pět let po operaci jater pro JMKRK přežívá 34,0 % nemocných. Medián bez recidivy nádoru v organismu nemocného po jaterním výkonu byl 16 měsíců (v rozmezí 1–55 měsíců). Lepšího, i když statisticky nevýznamného, přežívání z hlediska úmrtí nemocného pro nádorový rozsev jsme dosáhli u nemocných po jaterních resekcích v porovnání s RFA, kde 3 roky přežívá 35,5 % nemocných. U kombinovaných výkonů bylo tříleté přežití nemocných 24,0 % (Graf 1). Bezpříznakový interval (DFI) byl 26,7 % čtyři roky po resekci, 23,4 % dva roky po RFA a 62,3 % jeden rok po kombinovaném výkonu pro JMKRK (Graf 2). Po etapovém výkonu na játrech s využitím multimodálních léčebných postupů přežívá dva roky 22,1 % nemocných (Graf 3) a jednoroční DFI je 12,7 % (Graf 4).
Graph 1. Přežití nemocných po resekcích, RFA a kombinovaných výkonech pro JMKRK Graph 1. Patient survival rates following resections, RFA and combined procedures for colorectal carcinoma liver metastases 
Graph 2. DFI po resekcích, RFA a kombinovaných výkonech pro JMKRK Graph 2. DFI following resections, RFA and combined procedures for colorectal carcinoma liver metastases 
Graph 3. Přežívání nemocných po etapovém výkonu Graph 3. Patient survival rates following stage/phase procedures 
Graph 4. DFI nemocných po etapovém výkonu Graph 4. DFI in patients following stage/phase procedures 
DISKUSE
Chirurgie jater pro JMKRK zaznamenala v posledních několika letech obrovský rozmach zejména díky moderním diagnostickým [8] a léčebným prostředkům [9, 10]. Jestliže ještě v první polovině 20. století byla 30denní operační mortalita jaterních resekcí kolem 15 %, pak v současnosti nepřesahuje 5 % [11].
Jaterní resekce dnes jednoznačně patří k metodám volby v léčbě JMKRK především proto, že dosahují nejlepších dlouhodobých výsledků v porovnání s ostatní dostupnou léčbou, jakou jsou miniinvazivní postupy (radio-frekvenční, laserová, mikrovlnná ablace nebo kryoterapie) či lokoregionální nebo systémová chemoterapie. Průměrné pětileté přežití po radikálních resekcích jater pro JMKRK se pohybuje mezi 25–40 %, desetileté přežití pak kolem 20 %. Problémem zůstává, že jen přibližně 20 % nemocných s JMKRK je v době stanovení diagnózy radikálně resekabilních.
Indikace k jaterní resekci pro metastázy KRK se obecně rozšiřují a jednoznačným cílem je radikalita výkonu. Jednoznačně dáváme přednost R0 resekcím, i když u některých nemocných se nevyhneme R1 resekci z hlediska technického provedení operace. Domníváme se, že i tyto neradikální resekce mají v době moderní chemoterapeutické a biologické léčby své opodstatnění z hlediska dlouhodobého přežívání nemocných [12, 13, 14, 15]. Extrahepatální šíření metastáz kolorektálního karcinomu nepovažujeme za kontraindikaci k jaterní resekci tam, kde jsou mimojaterní metastázy odstranitelné v jedné, nebo více operačních dobách. K jaterní resekci indikujeme nemocné s technicky resekabilními plicními metastázami nebo technicky odstranitelnými metastázami v břišní dutině. Stejná indikační pravidla platí i pro nemocné s resekabilními JMKRK a odstranitelnými pozitivními uzlinami v hepatoduodenálním ligamentu.
Nejnovějším trendem v chirurgii jater je dostupnými prostředky zvýšit resekabilitu jaterních nádorů, významnou měrou prodloužit život nemocných a přitom nezvýšit mortalitu a morbiditu jaterních operací [16, 17]. Jedním z faktorů, které brání radikální operaci jaterních nádorů, je nedostatek zdravé jaterní tkáně po resekci nádoru, která postačuje ke krytí metabolických potřeb organismu bezprostředně po jaterní resekci; u funkčně zdravých jater přitom můžeme odstranit 75–80 % jaterní tkáně bez nebezpečí selhání jaterních funkcí v pooperačním období. Dalším faktorem je mnohočetné postižení jaterního parenchymu nádorem, který je v době diagnostiky technicky neodstranitelný. V neposlední míře jde o situaci, kdy nádorová masa dosahuje takového objemu a lokalizace v játrech, že je v jedné době neodstranitelná.
Možným řešením výše uvedených stavů je použití tzv. kombinovaných, etapových výkonů, které jsou založeny na kombinaci resekčních výkonů s miniinvazivními postupy, radiodiagnostickými metodami nebo se systémovou či lokoregionální chemoterapií [18]. Pro zvýšení objemu jaterní tkáně před odstraněním nádoru využíváme s výhodou PVE na straně nádoru transparietálním přístupem pomocí kovových spirálek, lipiodolu, tkáňového lepidla nebo fibrinové pěny. PVE způsobuje ischemizaci vyživované oblasti jater portální krví a kompenzatorní zvýšení toku krve do druhostranného řečiště s hypertorfií jaterního parenchymu. K hypertrofii jaterní tkáně dochází zpravidla do 3–4 týdnů a můžeme ji ověřit pomocí CT volumometrie. V další době pak můžeme resekovat JMKRK na straně po PVE [19].
Další možností redukce nádorové hmoty v játrech při postižení obou laloků jater nádorovým procesem je využití RFA pro likvidaci ložisek nádoru v jednom laloku se současnou PVE druhého laloku a s odstupem několika týdnů pak provést resekci jater na straně PVE. Dalším postupem je neoadjuvantní systémová nebo lokoregionální chemoterapie [20], či biologická léčba před vlastní resekci nádoru jater, jejímž cílem je redukce objemu nádorové masy (tzv. „down-staging“) a z technického hlediska umožnění resekability původně inoperabilního nádoru. Problémem tohoto postupuje, že neoadjuvantní chemoterapie a biologická léčba jsou v řadě případů toxické pro jaterní parenchym se snížením jeho regeneračních funkcí, což zvyšuje pooperační morbiditu nemocných. Neoadjuvantní chemoterapii lze kombinovat také s PVE nebo ablačními metodami jako přípravnou fází pro vlastní resekci jater u nemocných s mnohočetným postižením jaterní tkáně nádorovými ložisky. Na úlohu neoadjuvantní chemoterapie jsou v chirurgické literatuře různé názory. Nepochybná je v rámci výše uvedeného downstagingu. Pokud jsou však JMKRK technicky odstranitelné, přikláníme se na našem pracovišti k primární resekci jater a následné adjuvantní chemoterapii nebo biologické léčbě. Máme zkušenosti, že kvalita resekované jaterní tkáně po neoadjuvantní chemoterapii je podstatně horší ve smyslu křehkosti a krvácivosti.
Léčebnou alternativou u bilobárního postižení jater JMKRK je rovněž postupná resekce jaterního parenchymu postiženého nádorovým procesem. Obyčejně jsou nutné dva, ale i více resekčních výkonů, mezi kterými ponecháváme zpravidla čtyřtýdenní intervaly nutné k regeneraci zdravé jaterní tkáně. U některých nemocných jsme tyto výkony kombinovali s PVE. Na obdobném principu jsou založeny kombinace miniinvazivních a resekčních metod ve více dobách.
Moderní operační techniky můžeme dobře použít i při opakovaných resekcích [21] po primárním jaterním výkonu při recidivě nádoru v játrech, ke které dochází až u 60 % nemocných. Plných 85 % recidiv se přitom objevuje v prvních 30 měsících po operaci. Obvykle lze využít otevřené reresekce jater zpravidla neanatomické, nebo – a to zpravidla častěji – radiofrekvenční ablace transkutánní cestou pod ultrasonografickou nebo CT kontrolou.
Nové trendy v chirurgii jater, mezi něž patří etapové, kombinované postupy a opakované výkony, mají i přes svou indikační a technickou náročnost své místo v chirurgii jater především proto, že významnou měrou zvyšují operabilitu primárních a sekundárních nádorů jater při srovnatelné pooperační mortalitě a morbiditě nemocných s primárními jednodobými postupy. Jednoznačně prodlužují kvalitní život nemocných, u kterých byl metastatický proces v játrech původně neodstranitelný.
Indikací k použití miniinvazivních technik, z nichž nejlepší výsledky má RFA, jsou JMKRK, které nelze technicky odstranit chirurgickou cestou. Naším obecným kritériem pro využití RFA je pět metastáz, pro něž platí, že: největší nemá průměr větší než 5 cm; metastázy nejsou uloženy v blízkosti větvení hlavních žlučovodů a žil a nejde o mimojaterní šíření nádoru. Tato kritéria jsou však pouze pomocná a nepoužíváme je absolutně. K rozhodování přispívá celkový stav nemocného, jeho šance na dlouhodobé přežití. Jestliže např. máme před sebou mladého nemocného, u kterého z různých důvodů nemůžeme provést radikální resekční výkon, neváháme použít RFA i u více ložisek, z nichž některé přesahuje průměr 5 cm [22]. RFA s výhodou využíváme v kombinovaných multimodálních postupech, a zejména při recidivách JMKRK, kdy, pokud je to technicky možné, volíme transparietální přístup pod USG nebo CT kontrolou. Velkou výhodou RFA je její miniinvazivita a možnost jejího opakovaného použití pro destrukci ložisek JMKRK v játrech [23, 24]. Problémem zůstává zejména u špatně přístupných ložisek ponechání zbytku vitální nádorové hmoty v ložisku ošetřeném RFA – tzv. nonablace – a především u transparietálního přístupu poranění ostatních nitrobřišních orgánů (např. tlustého střeva, žaludku, bránice apod.). Po RFA se obecně udává vyšší procento místních recidiv nádoru v játrech [25], které podle různých autorů se pohybuje v rozmezí 5–30 %, a nižší dlouhodobé přežívání nemocných, což potvrdil i náš soubor nemocných. Lepší výsledky ve smyslu recidívy JMKRK po RFA má RFA aplikovaná otevřenou cestou než cestou transparietální [26].
ZÁVĚR
V posledních létech došlo v oblasti jaterní chirurgie k velkému pozitivnímu posunu, jehož výsledkem je velmi nízká pooperační mortalita a kvalitní dlouhodobé výsledky v přežívání nemocných s JMKRK. Předpokladem těchto výsledků je však využití moderních onkologických a radiodiagnostických postupů, bez kterých by chirurgická léčba nemohla dosáhnout tak kvalitních výsledků. Onkologické centrum, které pracuje v naší univerzitní nemocnici je toho důkazem.
*Práce byla podpořena grantem IGA MZ NS 9727-4.
Prof. MUDr. V. Třeška, DrSc.
U Českého dvora 11
326 00 Plzeň
e-mail: treska@fnplzen.cz
Sources
1. Novotvary 2003 ČR: ÚZIS ČR 2006, 58–84.
2. Havlíček, K., Šácha, M., Šiller, J., Sákra, L., Rajman, M., Beránek, K. K-ras mutace u kolorektálního karcinomu jako prognostický faktor vývoje onemocnění. Slov. Chir., 3; 2005, s. 8–12.
3. McLoughlin, J. M., Jensen, E. H., Malafa, M. Resection of colorectal liver metastases: Current perspectives. Cancer Control, 13; 2006, 32–41.
4. Ruers, T., Bleichrodt, R. P. Treatment of liver metastases, an update on the possibilities and results. Eur. J. Cancer, 38; 2002, 1023–1033.
5. Adam, R., Ducreux, M., Rougier, P., Chaibi, P., Mariette, C. Management of colorectal cancer and its metastases rot he liver. J. Chir., 145 Suppl. 1, 1–4.
6. Hirai, I., Kimura, W., Fuse, A., Isobe, H., Hadiga,O., Moriya T., Suto, K. Surgical management for metastatic liver tumors. Hepatogastroenterology, 53; 2006, 757–763.
7. Grundmann, R. T., Hermanek, P., Merkem, S., Germer, C. T., Grundmann, R. T., Hauss, J., et al. Diagnosis and treatment of colorectal liver metastases. Zentralbl. Chir., 133; 2008, 267–284.
8. Kockerling, F., Schwartz, S. I. Liver Surgery. 1. vyd., Heidelberg, J. A. Barth, 2001, 51–65.
9. Choti, M. A., Sitzmann, J. V., Tiburi, M. F., et al. Trends in long-term survival following liver resection for hepatic colorectal metastases. Ann. Surg., 235; 2002, 759–766.
10. Skalický, T., Třeška, V., Šnajdauf, J. Chirurgie jater. l. vyd., Praha, Maxdorf-Jessenius, 2004, 86–110.
11. Třeška, V. Liver resection technice – current advances. Rozhl. Chir., 86; 2007, 333–335.
12. Adam, R., Delvart, V., Pascal, G., Valeanu, A., et al. Rescue surgery for unresectable colorectal liver metastases downstaged chemotherapy: a model to predict long-term survival. Ann. Surg., 240; 2004, 644–657.
13. Liu, L. X., Zhang, W. H., Jiang, H. C. Current treatment for liver metastases from colorectal cancer. World J. Gastroenetrolog., 2; 2003, 193–200.
14. De Haas, R. J., Wicherts, D. A., Flores, E., Azoulay, D., Castaing, D., Adam, R. R1 resection by necessity for colorectal liver metastases: is it still a contraindication to Sumery? Ann. Surg., 248; 2008, 626–637.
15. Adam, R., de Haas, R. J., Wicherts, D. A., Alaia, T. A., Delvart, V., Azoulay, D., Bismuth, H., Castaing, D. Is hepatic resection justified after chemotherapy in patiens with colorectal liver metastases and lymf node involvement? J. Clin. Oncol., 26; 2008 : 3672–3680.
16. Jaeck, D., Pessaux, P. Bilobar colorectal liver metastases: treatment options. Surg. Oncol. Clin. N. Am., 17; 2008, 553–568.
17. Curley, S. A., Izzo, F., Abdalla, E., Vauthey, J. N. Surgical treatment of colorectal metastases. Cancer Metastasis Rev., 23, 2004, 165–182.
18. Khatri, V. P., Chee, K. G., Petrelli, N. J. Modern multimodality approach to hepatic colorectal metastases: solutions and controversies. Surg. Oncol., 16; 2007, 71–83.
19. Giraudo, G., Greget, M, Oussoultroglou, E., Rosso, E., Bachellier, P, Jaeck, D. Preoperative contralateral portal vein embolization efore major hepatic resection is a safe and efficient procedure: a large single institution experience. Surgery, 143; 2008, 476–482.
20. Bismuth, H., Adam, R., Vibert, E. Chemotherapy of liver metastasis from colorectal cancer. Bull. Acad. Natl. Med., 191; 2007, 1647–1660.
21. Třeška, V., Skalický, T., Liška, V., Ferda, J. Repeated procedures for colorectal liver metastases. Hepatogastroenterology, 54; 2007, 1741–1744.
22. Skalický, T., Třeška, V. Radiofrekvenční ablace jaterních nádorů. 1. vyd., Praha, Maxdorf-Jessenius, 2006, 21–36.
23. Wong, S. L.,Edwards, M. J., Chao, C. Radiofrequency ablation for unresectable hepatic tumors. Am. J. Surg., 182; 2001, 552–557.
24. Valtri, A., Sacchetto, P., Tosetti, I., Pagano, E., Fava, C., Gandini, G. Radiofrequency ablation of colorectal liver metastases: small size favorably predicts technice effectiveness and survival. Cardiovasc. Intervent. Radiol., 31; 2008, 948–956.
25. Lee, W. S., Yun, S. H., Chun, H. K., Lee, W. Y., Kim, S. J., Chai, S. H., Heo, J. S., Joh, J. W. Clinical outcomes of hepatic ablation in patiens with solitary colorectal liver metastasis. J. Clin. Gastroenterol., 42; 2008, 945–999.
26. Howard, J. H., Treng, C. W., Smith, J. K., Eckhoff, D. E., Bynan, J. S., Wang, T., Arnoletti, J. P., Heslin, M. J. Radiofrequency ablation for unresectable tumor sof the liver. Am. Surg., 74; 2008, 594–600.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 2-
All articles in this issue
- Výsledky chirurgické léčby karcinomu žaludku v období 2004–2008
- Traumatická perforace duodena – kazuistika
- Neurinom zvratného nervu
- Dvojitý průstřel hrudní stěny u afghánského vojenského policisty
- Ischemicko-reperfuzní poškození ledvin transplantovaných z nebijícího dárce (NHBD) – mají antioxidanty nebo protizánětlivé léky význam v jeho prevenci?
- Chirurgická léčba jaterních metastáz kolorektálního karcinomu
- Riziko úmrtí u polytraumatizovaných pacientů s poraněním pánve
- Nové trendy v diagnostice a léčbě karcinomu prsu na přelomu tisíciletí
- Radiodiagnostika zlomenin lopatky
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Radiodiagnostika zlomenin lopatky
- Traumatická perforace duodena – kazuistika
- Dvojitý průstřel hrudní stěny u afghánského vojenského policisty
- Ischemicko-reperfuzní poškození ledvin transplantovaných z nebijícího dárce (NHBD) – mají antioxidanty nebo protizánětlivé léky význam v jeho prevenci?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

