-
Medical journals
- Career
Radikální resekce u nemocných s karcinomem hlavy pankreatu. Retrospektivní analýza přežívání u souboru 307 nemocných
Authors: M. Ryska; R. Strnad; F. Bělina; M. Zavoral 1; C. Šálek 1; P. Hrabal 2; I. Buřič 3; E. Lásziková 4; H. Kvičerová; B. Jurenka 4; I. Holcátová 5
Authors‘ workplace: Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc. ; I. interní klinika 1. LF UK a ÚVN Praha, přednosta: doc. MUDr. M. Zavoral, Ph. D. 1; Oddělení patologie ÚVN Praha, primář: MUDr. P. Hrabal, CSc. 2; Rentgenologické oddělení ÚVN Praha, primář: MUDr. F. Charvát, CSc. 3; Oddělení anesteziologie a resuscitace ÚVN Praha, primář: MUDr. B. Jurenka 4; Ústav hygieny a epidemiologie 1. LF UK a VFN, přednosta: prof. MUDr. V. Bencko, DrSc. 5
Published in: Rozhl. Chir., 2007, roč. 86, č. 8, s. 432-439.
Category: Monothematic special - Original
Overview
Úvod:
Ve výskytu karcinomu pankreatu stojí Česká republika na předním místě na světě. Karcinom pankreatu je u nás na čtvrtém pořadí příčin úmrtí na maligní onemocnění. Resekční výkon je jedinou současnou léčebnou metodou, která je potencionálně kurabilní a signifikantně prodlužuje život nemocného.Cíl:
Zhodnotit morbiditu, mortalitu a přežívání u nemocných po radikálním a paliativním výkonu u nemocných s karcinomem hlavy pankreatu.Metoda a soubor nemocných:
K výkonu jsme indikovali nemocné, u kterých byl na základě předoperačního stagingu předpokládán: 1 – radikální resekční výkon, tj. pacienti ve stadiu I, II, 2 – paliativní resekční výkon – nemocní ve stadiu III či IVa bez předoperačně zjištěné angioinvaze. Do této skupiny byli zařazeni nemocní s peroperačním nálezem angioinvazivity do portomezenterického žilního povodí vyžadující resekci části žíly. 3 – paliativní spojkový výkon tam, kde byl předpoklad delšího přežití.
Radikálním resekčním výkonem byla proximální pankreatoduodenektomie (PDE) s ponecháním pyloru podle Traverso-Longmire s lymfadenektomií v rozsahu N1-2. s rekonstrukcí na exkludovanou kličku jejunální. Stejně jsme postupovali i v případě paliativní resekce. Získané údaje jsme statisticky vyhodnotili pomocí Logrankova testu.
Od 5/1998 do 12/2006 jsme ošetřili celkem 307 nemocných s karcinomem pankreatu a Vaterské papily. 242 pacientů mělo karcinom lokalizovaný na oblast hlavy pankreatu, u 65 se jednalo o tělo a kaudu slinivky. Resekční výkon jsme u karcinomu hlavy provedli u 78 nemocných: 46 mužů, 32 žen, průměrného věku 63,5 roků s mediánem 64 let. Výkon spojkový jsme provedli u 109 a exploraci u 55 nemocných.Výsledky:
Operační výkon, vyjma skupinu 55 nemocných s provedenou explorací, byl proveden u 187 pacientů. Z celkového počtu 78 PDE jsme resekci provedli ve stadiu I a II u 22, ve stadiu III u 41 nemocného. Ve skupině 63 radikálně resekovaných exitovali 2 nemocní: první pacient při multiorgánovém selhání, druhý pacient pro nekrotizující pooperační pankreatitidu. Ve skupině 15 paliativních resekcí jsme ztratili 3 nemocné. 10 nemocných zemřelo v časném pooperačním období po paliativní spojce. Celkově jsme ztratili v časném pooperačním období 15 nemocných, tj. 8 %. Po resekčním výkonu zemřelo 5 nemocných, tj. 6,4 %, po radikální resekci 3 %. U paliativně resekovaných jsme ztratili 3 nemocné. V časném pooperačním období jsme komplikaci pozorovali u 44 nemocných: u 6 nemocných se jednalo o insuficienci pankreatojejunoanastomózy, 5x hepatikojejunoanastomózy, 5x o akutní pooperační pankreatitidu, 10x o nitrobřišní absces, 19x o infekci v ráně s následkem sekundárního hojení a 33x o komplikace kardiopulmonální. U 19 nemocných (43 % ze všech komplikací) jsme provedli chirurgickou revizi.
60, resp. 29,5 a 39,5 % pacientů v I, resp. II a III stadiu onemocnění přežívá 3 roky, ve IVa stadiu 15,6 % a ve IVb stadiu pouze 10,5 %. Signifikantní je rozdíl mezi přežíváním pacientů v I, II a III stadiu oproti pacientům ve stadiu IV (p < 0,005). Není signifikantní rozdíl v přežívání u nemocných po radikální či paliativní resekci po uplynutí 3 let, nicméně od 3 měsíce do konce 2. roku signifikantně přežívá větší procento pacientů po radikální resekci (p < 0,05). Signifikantně déle přežívají pacienti po radikální resekci ve srovnání s paliativní resekcí a BDA v průběhu prvních 36 měsíců (p < 0,05). Srovnání přežívání pacientů po radikální a paliativní resekci je ovlivněno malým počtem pacientů s provedenou paliativní resekcí (n = 15), kdy po uplynutí 9. měsíce se procento přežívání do konce 3. roku již neliší. Signifikantní rozdíl je v přežívání nemocných po resekčním výkonu oproti exploraci (p < 0,05). V naší sestavě nelze hodnotit rozdíl v přežívání pacientů po paliativní resekci a provedenou BDA pro nehomogenitu nemocných.Závěr:
Radikální PDE pro karcinom hlavy pankreatu vede k signifikantně delšímu přežívání nemocných ve srovnání s paliativní spojkou. Pacient operovaný ve stadiu I,II a III signifikantně déle přežívá než pacient operovaný ve stadiu IV.Klíčová slova:
karcinom pankreatu – radikální resekce – paliativní léčba – komplikace – přežíváníVe výskytu karcinomu pankreatu stojí Česká republika na předním místě na světě, v Evropě za prvním Lotyšskem. Karcinom pankreatu je u nás na čtvrtém pořadí příčin úmrtí na maligní onemocnění [1]. Představuje zhoubné devastující onemocnění, které vede během jednoho roku k smrti u 80 % nemocných. Dlouhodobé přežívání je stále výjimkou. Resekční výkon je jedinou současnou léčebnou metodou, která je potencionálně kurativní a signifikantně prodlužuje život nemocného [2].
Z našich autorů uvedl sestavu radikálně operovaných nemocných poprvé Baláš se spol. [3] před 30 lety. Překvapivá byla na tehdejší dobu nízká perioperační mortalita 4,7 %. Po dlouhé odmlce následovaly rozbory dvou sestav až v roce 2005 – v práci Lefflera a spol. [4] a autorů tohoto sdělení [5, 6].
Cílem sdělení je analyzovat výsledky radikální resekce u karcinomu hlavy pankreatu a diskutovat současný názor na léčebný postup u těchto nemocných.
METODA A PACIENTI
Předoperační vyšetření
U nemocných indikovaných k operačnímu řešení pro karcinom pankreatu jsme předoperačně vyžadovali provedení ERCP, kontrastního CT vyšetření a v posledních 4 letech endoultrasonografického (EUS) vyšetření s tenkojehlovou aspirační biopsií (FNAB). Nevyžadovali jsme provedení selektivní angiografie, MR pankreatu a PET.
U každého nemocného byl předoperačně, peroperačně a definitivně stanoven staging onemocnění podle japonské klasifikace JPN – SC [7]. Nutriční status jsme před-operačně nestanovovali. Ikterus nebyl kontraindikací výkonu [8] a předoperační zavedení stentu žlučových cest jsme nevyžadovali. Před operací a v pooperačním období jsme kontrolovali hladiny tumorózních markerů Ca 19.9. a CEA.
U většiny nemocných jsme prováděli intraoperační ultrasonografii – IOUS [10].
Indikace a kontraindikace
K výkonu jsme indikovali nemocné, u kterých byl na základě předoperačního stagingu předpokládán:
- Radikální resekční výkon, tj. pacienti ve stadiu I, II a zčásti III.
- Paliativní resekční výkon – nemocní ve stadiu III či IVa bez předoperačně zjištěné angioinvaze. Do této skupiny byly dodatečně zařazeni nemocní s peroperačním nálezem angioinvazivity do portomezenterického žilního povodí vyžadující resekci části žíly.
- Paliativní spojkový výkon tam, kde byl předpoklad delšího přežití.
Takto vzniklé skupiny nemocných jsme hodnotili stran morbidity, mortality, přežívání a délky hospitalizace.
K resekčnímu výkonu jsme neindikovali pacienty se zjištěnou angioinvazivitou, při pozitivitě N2 zjištěné při EUS s FNAB a při vzdálených metastázách. Tito nemocní byli ošetření v případě ikteru stentem žlučových cest, při výrazném algickém syndromu chemoneurolýzou celiakální pleteně pod CT kontrolou [9] nebo při EUS, event. paliativní chemoterapií na základě rozhodnutí onkologa, na které jsme neměli vliv.
Operace, peroperační péče, dispenzarizace a statistika
Radikálním resekčním výkonem byla proximální pankreatoduodenektomie (PDE) s ponecháním pyloru podle Traverso-Longmire [11] s lymfadenektomií v rozsahu N1-2 [12]. Peroperačně jsme odesílali k rychlému vyšetření resekční plochu pankreatu. V případě pozitivity N3 jsme resekční výkon neprováděli. Pozitivita N2 neznamenala upuštění od resekce, ale zařazení pacienta do kategorie resekcí paliativních.
U všech nemocných jsme provedli rekonstrukci na exkludovanou kličku jejunální bez drenáže d. pancreaticus a d. hepaticus comm. Stejně jsme postupovali i v případě paliativní resekce.
Operační výkony byly provedeny v kombinované anestezii. Pacientům byl předoperačně v lokální anestezii zaveden epidurální katétr ke kontinuální pooperační analgezii [13]. Peroperačně byla monitorována hemodynamická stabilita pacienta, sledovali jsme EKG, IABP, MAP, CVP a diurézu, u pacientů ASA III.-IV. i CO, SVRI, DO2 i ventilační parametry sPO2, etCO2, PEAK. Délka operačních výkonů a potencionální krevní ztráty vyžadovaly rozšíření monitorovacího schématu o acidobazickou rovnováhu. Restriktivní tekutinový peroperační management se jevil výhodnější vzhledem k délce hospitalizace a riziku výskytu pooperačních komplikací [40]. Rozšířené monitorovací schéma zajišťovalo zvýšenou bezpečnost pro pacienta při již známém anesteziologickém riziku.
V rámci prevence sekundárního hojení rány jsme podávali jednorázově 1 hodinu před operací Sulperazon 2 gr. a Avrazor 0,5 gr. Somatostatin jsme podávali v dávce 0,1 Ūg 3? denně subkutánně v prevenci pooperační pankreatitidy (APP) pouze u prvních 20 nemocných [14]. Vzhledem k vysoké ceně preparátu jsme od farmakologické prevence APP později ustoupili. Detailní popis operačního postupu jsme již dříve popsali [5].
Při paliativním výkonu jsme prováděli HJA na exkludovanou kličku jejunální podle Rouxe. GEA jsme prováděli jen u nemocných se stenózou duodena. Preventivně jsme ji neprováděli [15].
Po propuštění jsme všechny nemocné dispenzarizovali s kontrolami po 3 měsících. Z vyšetření jsme prováděli US, tumorózní markery a biochemické vyšetření krve.
Při zjištěné progresi onemocnění jsme operační revizi neindikovali s výjimkou stenózy horní části GIT. Datum úmrtí jsme zjišťovali aktivně.
Získané údaje jsme statisticky vyhodnotili pomocí Logrankova testu.
SOUBOR NEMOCNÝCH
Od 5/1998 do 3/2004 jsme na Klinice transplantační chirurgie IKEM a od 4/2004 do 12/2006 na Chirurgické klinice 2. LF UK a ÚVN Praha ošetřili celkem 307 nemocných s karcinomem pankreatu a Vaterské papily.
Z celkového počtu 307 nemocných mělo 242 pacientů karcinom lokalizovaný na oblast hlavy pankreatu, u 65 se jednalo o tělo a kaudu slinivky. Resekční výkon jsme u karcinomu hlavy provedli u 78 nemocných: 46 mužů, 32 žen, průměrného věku 63,5 roků s mediánem 64 let. Výkon spojkový jsme provedli u 109 a exploraci u 55 nemocných (Tab. 1).
Table 1. Operační výkony u nemocných s karcinomem hlavy pankreatu Tab. 1. Procedures in patients with pancreatic head carcinomas 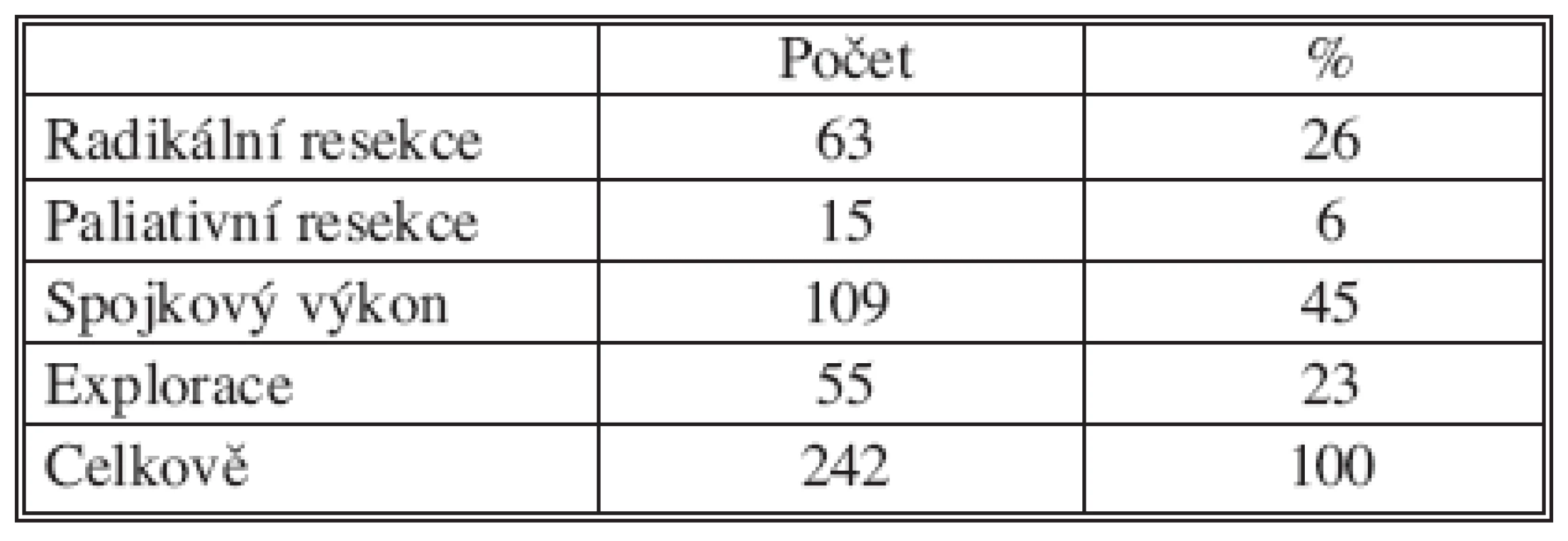
Stadia onemocnění pacientů, u kterých jsme provedli resekční nebo spojkový výkon, jsou zřejmá z tabulky 2.
Table 2. Rozdělení nemocných podle stádia onemocnění (klasifikace JPN – SC) (n = 77) Tab. 2. Classification of patients according to the disease stage (JPN – SC classification) (n = 77) 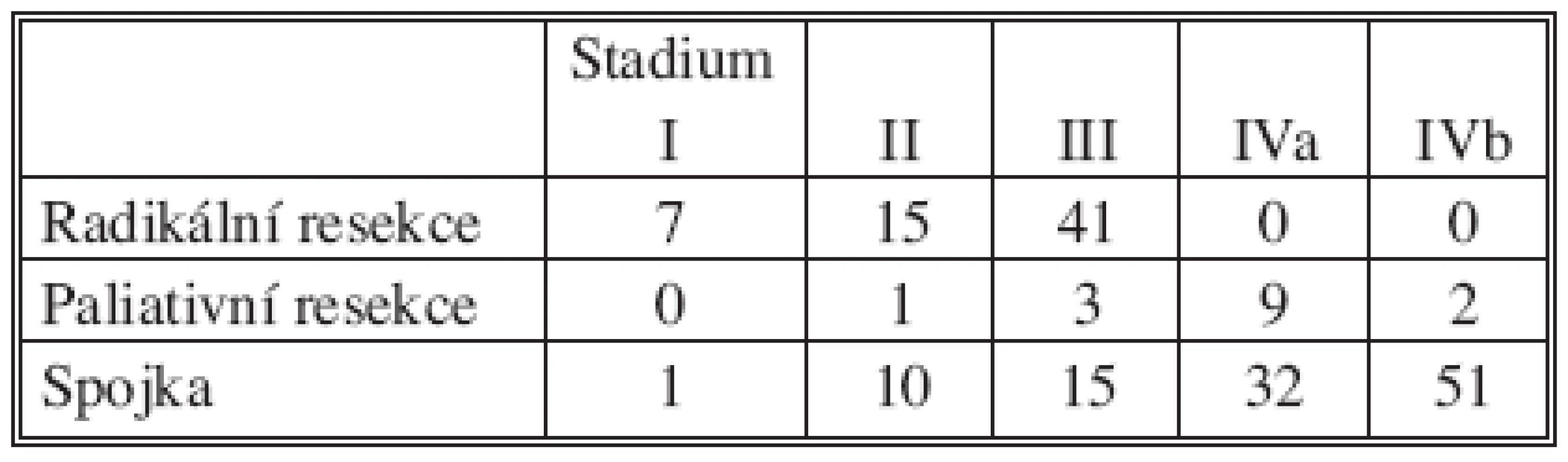
Histologicky se jednalo o duktální adenokarcinom u 57 nemocných. Cystický karcinom patolog nalezl u 2. V 18 případech se jednalo o jiný maligní nádor.
Ze 78 resekovaných nemocných s lokalizací v hlavě slinivky bylo hodnoceno jako G1 – 19, G2 – 36, G3 – 16 nemocných. Grading nebyl u 7 nemocných zhodnocen.
VÝSLEDKY
Většinu nemocných naší sestavy jsme operovali v pozdějších stadiích onemocnění. Z celkového počtu 78 nemocných jsme radikální PDE mohli provést ve stadiu I a II u 22, ve stadiu III u 41 nemocného. Paliativní resekci hlavy pankreatu jsme provedli u 15 nemocných.
Délka hospitalizace je uvedena na tabulce 3, včetně mediánu s rozmezím.
Table 3. Délka hospitalizace po jednotlivých skupinách nemocných (n = 187) Tab. 3. Duration of hospitalization in individual patient groups (n = 187) 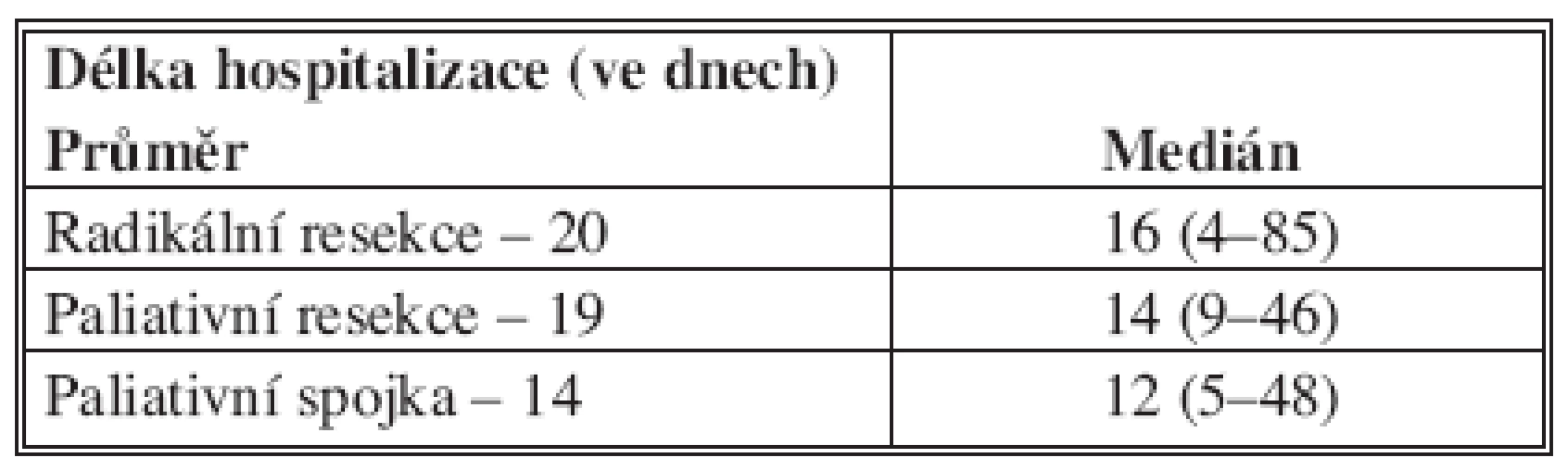
V časném pooperačním období, tj. do 30 dnů po operaci, jsme zaznamenali komplikaci u 44 nemocných (57 %). Z tohoto počtu se u 6 pacientů jednalo o insuficienci pankreatojejunoanastomózy, 5x hepatikojejunoanastomózy, 5x o akutní pooperační pankreatitidu, 10x o nitrobřišní absces, 19x o infekci v ráně s následkem sekundárního hojení a u 33 nemocných jsme zaznamenali komplikace kardiopulmonální. U 19 z nich si komplikace vyžadovala chirurgickou revizi.
Operační výkon, vyjma skupinu 55 nemocných s provedenou explorací, byl proveden u 187 pacientů. Ve skupině 63 radikálně resekovaných jsme 2 pacienty ztratili za příznaků septického stavu na multiorgánové selhání. Ve skupině 15 paliativních resekcí zemřeli 3 nemocní. 10 nemocných zemřelo v časném pooperačním období po paliativní spojce. Celkově jsme ztratili v časném pooperačním období 15 nemocných, tj. 8 %. Po resekčním výkonu zemřelo 5 nemocných, tj. 6,4 %, přičemž po radikální resekci pouze 2, to znamená letalitu 3 % (Tab. 4).
Table 4. Časná mortalita po jednotlivých typech výkonu (vyjma explorace) Tab. 4. Early mortality according to individual procedure types (excl. exploration) 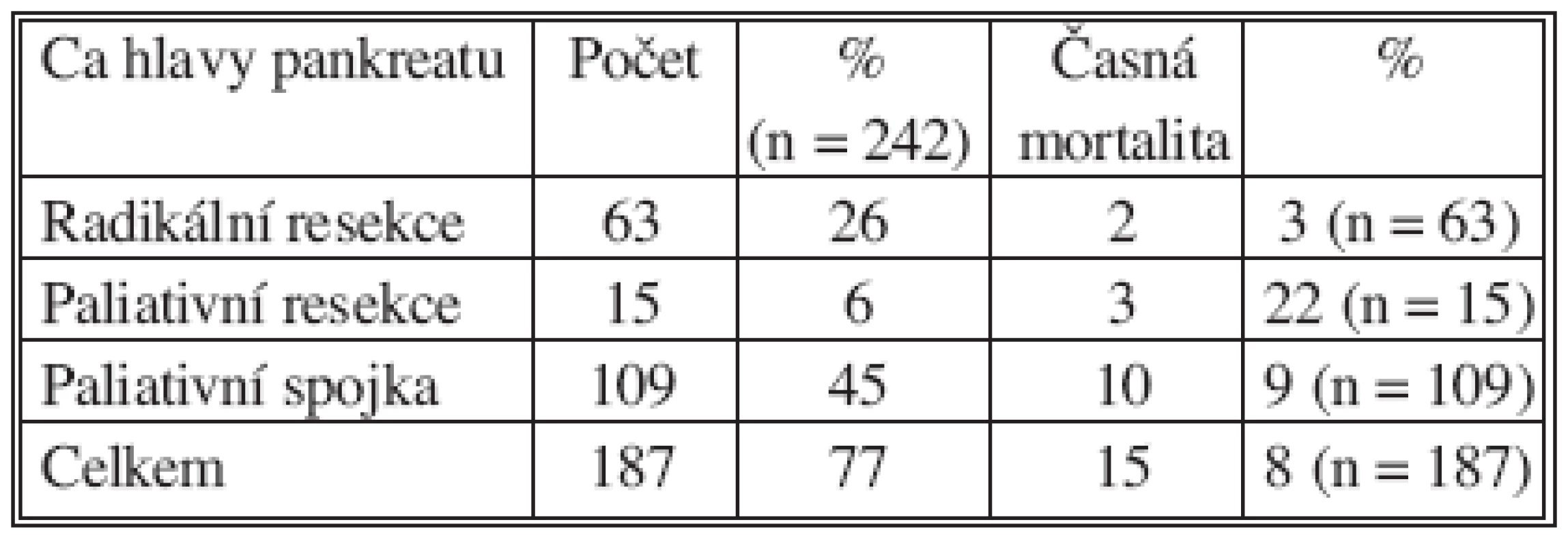
Délku přežívání jsme hodnotili v jednotlivých stadiích onemocnění v procentech po tříměsíčních intervalech. Zatímco 60, resp. 29,5 a 39,5 % pacientů v I, resp. II a III stadiu onemocnění přežívá 3 roky, ve IVa stadiu 15.6 % a ve IVb stadiu pouze 10,5 %. Signifikantní je rozdíl mezi přežíváním pacientů v I, II a III stadiu oproti pacientům ve stadiu IV (p < 0,005). Srovnání přežívání pacientů po radikální a paliativní resekci a biliodigestivní anastomóze (HJA) je patrné z tabulky 5.
Table 5. Přežívání pacientů po radikální a paliativní resekci, biliodigestivní anastomóze a exploraci (n = 187) Tab. 5. Patient survival after radical and palliative resections, biliodigestive anastomoses and explorations (n = 187) 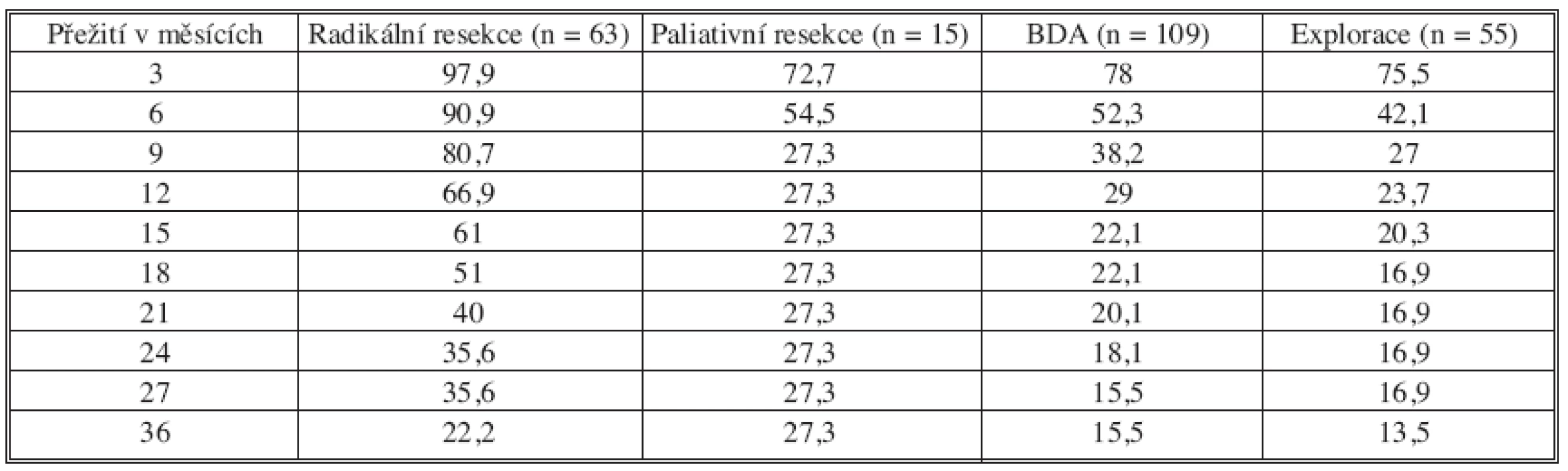
Není signifikantní rozdíl v přežívání u nemocných po radikální či paliativní resekci po uplynutí 3 let, nicméně od 3 měsíce do konce 2. roku signifikantně přežívá větší procento pacientů po radikální resekci (p < 0,05). Signifikantně déle přežívají pacienti po radikální resekci ve srovnání s paliativní resekcí a BDA v průběhu prvních 36 měsíců (p < 0,05). Srovnání přežívání pacientů po radikální a paliativní resekci je ovlivněno malým počtem pacientů s provedenou paliativní resekcí (n = 13), kdy po uplynutí 9 měsíce se procento přežívání do konce 3. roku již neliší. Signifikantní rozdíl je v přežívání nemocných po resekčním výkonu oproti exploraci (p < 0,05). V naší sestavě nelze hodnotit rozdíl v přežívání pacientů po paliativní resekci a provedenou BDA pro zjevnou nehomogenitu nemocných.
DISKUSE
Karcinom pankreatu je nejčastějším maligním onemocněním podjaterní oblasti, hlava slinivky je nejčastějším místem lokalizace. Výrazná biologická agresivita karcinomu pankreatu zapříčiňuje, že v době stanovení diagnózy má již třetina nemocných jaterní metastázy, třetina má postižené regionální uzliny, u poloviny nemocných lze nalézt angioinvazi nádoru a každý desátý nemocný má diseminaci nádoru po peritoneu [2].
V současné době je radikální resekce jedinou potencionálně kurabilní terapeutickou modalitou, která signifikantně prodlužuje přežití nemocného [16].
Odhad resekability
Odhad procenta nemocných, kteří jsou indikováni k resekci, se v literatuře výrazně liší. Friess se spolupracovníky [17] udává 10 %. Pitt v případě, že kontrastní CT předoperačně neprokáže metastatické postižení jater, uvádí 75 % [18]. Beger uvádí 10–15 % nemocných s diagnostikovaných duktálním karcinomem pankreatu. Kontraindikací je přítomnost vzdálených metastáz (především jaterních), diseminace po peritoneu, cirkulární nádorová infiltrace mezenterických cév, radixu mesenteria a mesocolon transverza [2]. Předoperačně neprokázanou suspektní drobnou metastázu jater pomůže odhalit s přesností až 95 % IOUS [10]. Na našem pracovišti bylo možné provést resekční výkon u 77 nemocných s karcinomem hlavy pankreatu z celkového počtu 242, tj. v 31,8 %, radikální resekci, tj. resekci u nemocných ve stadiu I a II, u 65 (26,9 %). Toto poměrně vysoké procento je důsledkem dobré spolupráce mezi chirurgickým a gastroenterologickým pracovištěm autorů sdělení, kdy stanovení předoperačního stagingu je základem indikační rozvahy.
Předoperační vyšetření
Z předoperačních zobrazovacích vyšetření velikosti, lokalizace a šíření nádoru pankreatu má základní význam pro chirurga kontrastní CT vyšetření slinivky břišní a jater. Endoskopické ultrasonografické vyšetření s biopsií tenkou jehlou umožní s vysokou pravděpodobností stanovit správný předoperační staging nádoru [19].
PET prokazuje obdobnou senzitivitu jako MR, nicméně nižší specificitu. Příslibem může být spojení obou těchto vyšetření [20].
Vzhledem k tomu, že drobné metastázy nemusí být nalezeny při předoperačních zobrazovacích vyšetření, je na některých pracovištích zdůrazňován přínos laparoskopie a laparoskopické abdominální ultrasonografie v upřesnění předoperačního stagingu. Změní předoperačně plánovaný postup v 11 % [21] a u radikálně neoperabilního nemocného lze laparoskopicky provést jak anastomózu biliodigestivní, tak i v případě stenózy duodena anastomózu gastrojejunální.
Sami s tímto postupem nemáme hodnotitelé zkušenosti.
Předoperační angiografické zobrazení cév podjaterní oblasti předoperační staging nádoru neovlivní a proto se standardně neprovádí [22].
Zavedení stentu do žlučových cest při endoskopické retrográdní cholangiografii u ikterického nemocného je motivováno spíše obavou endoskopisty z následné cholangoitidy než snahou předat nemocného chirurgovi po odeznění ikteru. Nebyl prokázán rozdíl v mortalitě ikterických a anikterických nemocných operovaných pro karcinom hlavy pankreatu [8]. Vyčkávat na odeznění ikteru znamená snižovat šanci na provedení radikálního výkonu.
Také předoperační perkutánní biopsie není indikována vzhledem k vysoké pravděpodobnosti nereprezentativního tkáňového odběru a nebezpečí implantace nádorových buněk v průběhu vpichu [23].
Z palety klinicky používaných tumorózních markerů je u karcinomu pankreatu nejvhodnější stanovení CA 19.9. Může pomoci v pooperačním sledování nemocného. Pro relativně malou specificitu nemůže však sloužit ani v depistáži, ani v diagnostice [24].
Příprava k operaci
Speciální předoperační příprava u nemocného s karcinomem pankreatu neexistuje. Je zdůrazňován význam nutrice a normalizace krevního obrazu. Maligní onemocnění bývá spojeno s aktivací imunitního systému a vyplavením prozánětlivých cytokinů. Následné metabolické procesy vedou k nutriční depleci a kachektizaci nemocného. Některé nemocné je třeba indikovat k adjuvantní nutriční podpoře. Je však prokázáno, že jak předoperační hodnoty albuminu v plazmě, tak i hemoglobinu, hematokrytu, trombocytů a leukocytů nepatří k významným prognostickým faktorům, které mají vliv na délku přežití nemocného po operaci [7].
S ohledem na tyto skutečnosti jsme nutriční status nemocného předoperačně neobjektivizovali a snažili se provést resekční výkon o nejdříve.
Radikální resekční výkon
Na základě závěrů Castelfranco meeting v roce 1998 [25] a recentních doporučených postupů [26] jsme u nemocných ve stadiu I a II. prováděli radikální PDE s lymfadenektomií N1-2 uzlin tak, jak jsme již popsali dříve [5]. Námi upřednostňovaná modifikace Traverso-Longmire [27] s ponecháním pyloru má prokazatelně stejnou onkologickou radikalitu jako původní operace podle Whipple [28] – správně Kausch-Whipple [2]. Totální pankreatektomii jsme považovali za výkon vynucený, stejně tak resekci části v. portae či v. mesenterica sup. Obojí nevede k signifikantnímu prodloužení přežívání [29, 30]. Rozšířenou lymfadenektomii jsme neprováděli, neprokázala ve dvou randomizovaných studií delší dobu přežití [31, 32]. Rekonstrukční výkon při proximální resekci spočíval v našití PJA end – to – side, HJA end – to – side a duodenojejunoanastomózy (DJA) end – to – side se zavedením výživné nazojejunální sondy do první kličky jejunální.
Paliativní resekční výkon
Nemocné, u kterých bylo možné provést resekční výkon, ale během výkonu nebo dodatečně pooperačně, bylo stanoveno stadium IV, jsme resekci považovali za paliativní. Do této skupiny jsme ze stejných důvodů zařadili i 4 nemocné, u kterých jsme vynuceně provedli resekci části v. portae či v. mesenterica sup. nebo totální pankreatektomii.
Spojkový výkon
Pokud byl nález při operaci, na rozdíl od předoperačního stagingu, neresekabilní, a pacient měl předpoklad delší doby přežívání, provedli jsme v případě stenózy žlučových cest HJA. Tento typ biliodigestivní spojky prokazuje lepší výsledky než dříve prováděná CHDA [33]. V případě stenózy duodena jsme připojili retrokolickou (GEA).
Explorace
Explorativní laparotomii jsme považovali za důsledek diskrepance předoperačního vyšetření s peroperačním nálezem, nikoliv za plánovaný výkon. Při pochybnostech předoperačního stagingu jsme výkon zahajovali laparoskopicky.
Komplikace
Ačkoliv se časná mortalita resekce pankreatu v posledních 25 létech výrazně snížila a nepřevyšuje 3–5 %, morbidita zůstává vysoká a dosahuje v některých sestavách až 60 %. Vysoké procento morbidity je způsobeno značným rozsahem operačního výkonu a velkým množstvím potencionálních komplikací: od sekundárního hojení rány až po velmi závažné dehiscence anastomóz či pooperační krvácení. Pooperační pankreatitida představuje jednu z nejzávažnějších komplikací s vysokou mortalitou dosahující až 80 %. Prevencí této komplikace je šetrná operační technika a vyloučení peroperační teplé ischemie pankreatu. Byl prokázán přínos preventivního podávání somatostatinu [14]. Krvácení do GIT nebo do volné břišní dutiny se vyskytuje v 5–16 % po pankreatoduodenektomii nebo palitivní biliodigestivní spojce. Příčinou krvácení bývá peptická ulcerace, krvácení z oblasti gastroenteroanastomózy, arodovaný arteriální pahýl s rupturou do tenkého střeva či natrávená stěna cévy pankreatickou šťávou při dehiscenci pankreatické anatomózy. Únik pankreatické šťávy (leak) se vyskytuje v 6–24 % [34]. Rizikovým faktorem vzniku dehiscence pankreatické anastomózy je především přítomnost měkké pankreatické tkáně (na rozdíl od fibroticky změněného parenchymu slinivky při chronické pankreatitidě).
Protrahované poruchy vyprazdňování žaludku můžeme sledovat u 25–70 % nemocných po standardní pankreatoduodenektomii [35]. Není rozdíl, zda se jedná o klasický či pylorus šetřící výkon. I když tato častá komplikace není spojena s vyšší mortalitou, je příčinou prodloužené hospitalizace a tím i nákladů na léčbu. Časná enterální výživa se ukazuje jako vhodná prevence této komplikace.
VÝSLEDKY
Pětileté přežití je uváděno mezi 2–20 %. V naší sestavě po radikální PDE přežívalo 3 roky 22 % operovaných nehledě ke stadiu onemocnění. Průměrné přežití u neoperovaného nemocného či po paliativním operačním výkonu je uváděno v rozmezí 4–6 měsíců, po resekčním výkonu 11–18 měsíců s mediánem rekurence 8–9 měsíců [17]. Vyjádřením úspěšnosti chirurgického postupu u malých sestav nemocných není pouze procento tříletého přežívání. Je jím především medián přežívání, který lépe vyjadřuje šance pacienta na přežití. Ten jednoznačně hovoří ve prospěch radikálně resekovaných.
Faktory ovlivňující přežívání po resekčním výkonu
Z hlediska dlouhodobého přežití existuje vedle stadia onemocnění řada signifikantně významných prognostických faktorů. Nemá signifikantně negativní vliv na dlouhodobé přežívání ani ikterus (bilirubin > 100 mmol/l), ani ztráta na váze převyšující 10 kg. Nesporný negativní vliv má lokalizace nádoru (karcinom hlavy pankreatu versus ampulom), jeho velikost (T > 2 cm), přítomnost N2 – 3 uzlin a angioinvazivita. Horší prognóza u nemocných s karcinomem v oblasti processus uncinatus je způsobena pozdními klinickými příznaky (mechanický ikterus). Velkou roli hraje peroperační převod krve. Negativní faktory jsou doplněny o grading nádoru (nízce diferencovaný karcinom) a pozitivitu resekční plochy [8]. Perineurální šíření nádoru patří jednoznačně k velmi nepříznivým faktorům u duktálního karcinomu pankreatu.
Pro praxi to znamená, že předoperační zavedení stentu [36], předoperační ztráta na váze a provedení rozšířeného operačního výkonu nemá signifikantní význam pro dlouhodobé přežívání nemocného.
Nepochybný vliv má biologická povaha nádoru: DNA ploidita, buněčná diferenciace a přítomnost mutovaných onkogenů a supresorových genů. Je prokázán vztah mezi počtem resekčních výkonů provedených na chirurgickém pracovišti a perioperační mortalitou [2].
Adjuvantní terapie
Přínos pooperační chemoterapie, intraoperační nebo pooperační radioterapie, hormonální terapie nebo imunoterapie je v současné době limitován [37–39] a je opakovaně sledován v klinických studiích. Dokončené randomizované studie prokazují její signifikantní přínos u nemocných po radikální resekci Jejich analýza však přesahuje rámec sdělení. Chemoterapie u našich nemocných byla prováděna na základě rozhodnutí spádového onkologa aniž bychom ji měli možnost ovlivnit.
Dispenzarizace
Dispenzarizace je nedílnou součástí léčby pacienta s karcinomem pankreatu.
Na našem pracovišti probíhala podle protokolu v tříměsíčních intervalech. V případě úmrtí pacienta jsme data získávali dodatečně na příslušné matrice obyvatelstva.
ZÁVĚR
V současné době je radikální resekce jedinou potencionálně kurabilní terapeutickou modalitou, která signifikantně prodlužuje přežití nemocného s karcinomem hlavy pankreatu. Měl by být proveden ve všech případech, kdy je tumor a uzliny skupiny N1-2 lokálně odstranitelné, není přítomna angioinvaze a vzdálené metastázy a kde to celkový stav nemocného dovolí. Předoperační staging postavený na provedení kontrastního CT, ERCP a EUS s FNAB je nutný v indikační rozvaze.
Zhodnotili jsme vlastní sestavu 242 nemocných s karcinomem hlavy pankreatu. U 77 (31,8 %) z nich jsme provedli resekční výkon. Ve skupině nemocných v I, resp. II, resp. III stadiu onemocnění 3 roky přežilo 60 %, resp. 29 %, resp. 39 %. Ve skupině 65 nemocných po radikální resekci přežívalo 1. rok 67 %, 2. rok 36 % a 3. rok 22 % pacientů s časnou pooperační úmrtností 3 %.
Dokončené randomizované studie prokazují signifikantní přínos adjuvantní chemoterapie u nemocných po radikální resekci. Paliativní chemoterapii nelze hodnotit z hlediska prodloužení přežívání, spíše z hlediska klinického benefitu.
Poměrně velké nároky, které klade pacient s operabilním karcinomem pankreatu na operační tým, a náklady s výkonem spojené, jsou zárukou, že postupně dochází i u nás ke koncentrování těchto nemocných na specializovaná pracoviště. Výsledky našich pracovišť se tak stávají srovnatelné s výsledky chirurgických pracovišť v civilizovaném světě.
Zkratky
UICC – Union International Contre la Cancer
JPS – SC – Japan Pancreas Society – staging classification
IBP – krevní tlak měřený invazivně
CVP – centrální žilní tlak
MAP – střední arteriální tlak
CO – srdeční výdej
SVR – systémová vaskulární rezistence
DO2 – dodávka kyslíku ke tkáním
etCO2 – tenze kysličníku uhličitého ve vydechované směsi na konci výdechu
SpO2 – saturace hemoglobinu kyslíkem v kapilární krvi měřená pulzní oxymetrií
ASA – American Society of Anesthesilogists – zhodnocení anesteziologického rizika podle medicínských nálezů
IABP – intraarteriální krevní tlak
PEAK – vrchol
Práce byla podpořena granty IGA MZ ČR NR 8027-3 a NR 9422 – 3.
Prof. MUDr. M. Ryska, CSc.
Chirurgické oddělení Ústřední vojenské nemocnice
U Vojenské nemocnice 1200
160 00 Praha 6
e-mail: miroslav.ryska@uvn.cz
Sources
1. ÚZIS ČR 2006
2. Beger, H. G., Rau, B., Gansauge, F., et al. Treatment of pancreatic cancer: challenge of the facts. World J. Surg., 2003, 27 : 1075–1084.
3. Balaš, V., Pešková, M., Šváb, J. Naše zkušenosti s radikálním léčením nemocných rakovinou slinivky břišní a papily Vaterské. Rozhl. Chir., 57, 1978 : 710–715.
4. Leffler, J., Polouček, P., Krejčí, T. Karcinom hlavy pankreatu a periampulární karcinomy. Výsledky resekční léčby za 10 let. Rozhl. Chir., 2005, 84 : 610–616.
5. Ryska, M., Bělina, F., Strnad, R. Chirurgická terapie. In: Zavoral, M., et al.: Karcinom pankreatu. Galén, 2005 : 167–219.
6. Ryska, M., Bělina, F., Strnad, R., et al. Resekční výkon – metoda volby terapie karcinomu pankreatu. Bull HPB, 12, 2004 : 90–92.
7. Meyenfeldt, M. F. Nutritional support during treatment of biliopancreatic malignancy. Ann. Oncol., 10, 1999, Suppl. 4: S273–S277.
8. Allema, J. H., Reinders, M. E., van Gulik, T. M., et al. Prognostic factors for survival after pancreaticoduodenectomy for patients with carcinoma of the pancreatic head region. Cancer, 75, 1995 : 2069–2076.
9. Lillemoe, K. D., Cameron, J. L., Kaufman, H. S., et al. Chemical splanchnicectomy in patients with unresectable pancreatic cancer: a prospective randomized trial. Ann. Surg., 217, 1993 : 447–457.
10. Bluemke, D. A., Cameron, J. L., Hruban, R. H., et al. Potentially resectable pancreatic adenocarcinoma: spiral CT assessment with surgical and pathological correlation. Radiology, 1995, 197 : 381–385.
11. Traverso, L. W., Longmire, P. Preservation of the pylorus in pancreaticoduodenectomy. SGO 146, 1978 : 959–962.
12. Gouma, D. J., Nieveen van Dijkum, E. J. M. The standard work-up and surgical treatment of pancreatic head tumours. Eur. J. Surg. Oncol., 25, 1999 : 113–123.
13. Bonnet, F., Marret, E. Influence of anasthetic and analgesic techniques on outcome after surgery. BJA, 2004, 95 : 52–58.
14. Büchler, M. W., Friess, H., Klempa, I., et al. Role of octreotide in the prevention of postoperative complications following pancreatic resection. Am. J. Surg., 163, 1992 : 125–130.
15. Watanapa, P., Williamson, R. C. N. Surgical palliation for pancreatic cancer: developments dutiny the past two decades. BJS, 1992, 79 : 8–20.
16. Beger, H., Büchler, M. W., Malfrtheiter, P. Standards in pancreatic surgery. Berlin, Springer Verlag, 1993 : 614–630.
17. Friess, H., Kleeff, J., Kulli, C., et al. The impact of different types of surgery in pancreatic cancer. Eur. J. Surg. Oncol., 25, 1999 : 124–131.
18. Pitt, H. A. Pancreatic cancer: evaluation, management from a surgical perspective. Postgr Course AASGE, Chicago, 2000.
19. Arcidiacono, P. G., Carrara, S. EUS: impact in diagnosis, staging and management of pancreatic tumors. An overview. JOP, 2004, 5 : 247–252.
20. Ruf, J., Hänninen, E. L., Böhmig, M., et al. Impact of FDG-PET/MRI image vision on the detection of pancreatic cancor. Pancreatology, 2006, 6 : 512–519.
21. Callery, M. P., Strasberg, S. M., Doherty, G. M., et al. Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy. J. Am. Coll. Surg., 185, 1997 : 33–39.
22. Dooley, W. C., Cameron, J. L., Pitt, H. A., et al. Is preoperative angiography useful in patients with periampullary tumors ? Ann. Surg., 211, 1990 : 649–655.
23. Parsons, L. Jr., Palmer, Ch. How accurate is fine-needle biopsy in malignant neoplasia of the pancreas? Arch. Surg., 1989, 124 : 681–683.
24. Pedrazzoli, S., Pasquali, C., Sperte, C. General aspects of surgical treatment of pancreatic cancer. Dig. Surg., 1999, 16 : 265–275.
25. Pedrazzoli, S., Pasquali, C., Sperti, C. Definition in pancreatic cancer surgery – Castelfranco consensus meeting. In: Dervenis, C. G., Bassi, C.: Pancreatic tumors. Thieme, 2000 : 138–146.
26. Jones, L., Russell, Ch., Mosca, F., et al. Standard Kausch-Whipple pancreatoduodenectomy. Dig. Surg., 16, 1999 : 297–304.
27. Patel, A. G., Toyama, M. K., Kusske, A. M., et al. Pylorus - preserving Whipple resection for pancreatic cancer. Is it better? Arch. Surg., 130, 1995 : 838–843.
28. Whipple, A. O., Parsons, W. B., Mullins, C. R. Treatment of cancer of the ampulla of Vater. Ann. Surg., 102, 1935 : 763–779.
29. Ihse, I., Andrén-Sandberg, A. Surgical treatment: total pancreatectomy. In: Beger, H., Warshaw, A. L., Büchler, M. W., et al. Pancreas. Blackwell Science, London, 1998 : 1047–1054.
30. Sasson, A. R., Hoffman, J. P., Ross, E. A., et al. En block resection for locally advanced cancer of the pancreas: is it worthwhile? J. Gastrointest. Surg., 2002, 6 : 147–158.
31. Pedrazzolli, P., DiCarlo, V., Dionigi, R., et al. Standard vs extended lymphadenectomy associated with PDE in the surgical treatment od adenocarcinoma of the head of the pancreas: a multicenter, prospective, randomized study. Lymphadenectomy study group. Ann. Surg., 1998, 228 : 508–517.
32. Yeo, C. J., Cameron, J. L., Lilemoe, K. D., et al. PDE with or without distal gastrectomy and extended retroperitoneal lymphadenectomy for periampullary adenocarcinoma, part 2: randomized control trial evaluating survival, morbidity, and mortality. Ann. Surg., 2002, 236 : 355–368.
33. van Wagensveld, B. A., Coene, P. P. L. O., van Gulik, T. M., et al. Outcome of paliative biliary and Bystric vypase surgery for pancreatic in 126 patients. BJS, 1997, 84 : 1402–1406.
34. van Berge Henegouwen, M. I., DeWitt, L. T., van Gulik, T. M., et al. Incidence, risk factors and treatment of pancreatic leakage after pancreatoduodenectomy: drainage versus resection of the pancreatic remnant. J. Am. Coll. Surg., 185, 1997 : 18–24.
35. van Berge Henegouwen, M. I., Gouma, D. J., Obertop, H. Postoperative complications after surgery for pancreatic cancer. In: Dervenis, C. G., Bassi, C.: Pancreatic tumors. Tyjeme, 2000 : 216–225.
36. Petr, W. T., Pistes, M. D., Wayne, A., et al. Effect of praeoperative biliary decompression on pancreaticoduodenectomy – associated morbidity in 300 consecutive patients. Ann. Surg., 234, 2001 : 47–55.
37. Neoptolemos, J. P., Dunn, J. A., Stocken, D. D., et al. Adjutant chemoradiotherapy and chemotherapy in resectable pancreatic cancer: a randomised controlled trial. The Lancet, 2001, 358 : 1576–1585.
38. Alexakis, N., Halloran, C., Raraty, M., et al. Current standards of surgery for pancreatic cancer. BJS, 2004, 91 : 1410–1427.
39. Bang, S., Jeon, T. J., Kim, M. H., et al. Phase II study of Cisplatin combined with weekly Gemcitabine in the treatment of patiens with metastatic pancreatic carcinoma. Pancreatology, 2006, 6 : 635–641.
40. Nisanevic, V., Felsenstein, I., Almogy, G., et al. Effect of intraoperative fluid management on outcome after intraabdominal surgery. Anesthesiology 2005, 103 : 25–32.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 8-
All articles in this issue
- Diagnostické a léčebné postupy u torakoabdominálních poranění – současný stav
- Podtlaková terapie (vacuum-assisted closure) v léčbě ranných infekčních komplikací po kardiochirurgických výkonech
- Naše první zkušenost s rigidní fixací sterna
- Aproximační střevní anastomóza při multifokální nekrotizující enterokolitidě u novorozence
- Komplikace laparoskopické operace tříselné kýly diagnostikované kolonoskopicky
- Demografická a epidemiologická studie pacientů s poraněním pánve
- 10 let zkušeností s Barronovou ligaturou na chirurgické klinice Ostrava
- Radikální resekce u nemocných s karcinomem hlavy pankreatu. Retrospektivní analýza přežívání u souboru 307 nemocných
- Videotorakoskopie, standardní a méně časté indikace
- Laparoskopická cholecystektómia v ambulantnej chirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Komplikace laparoskopické operace tříselné kýly diagnostikované kolonoskopicky
- 10 let zkušeností s Barronovou ligaturou na chirurgické klinice Ostrava
- Videotorakoskopie, standardní a méně časté indikace
- Podtlaková terapie (vacuum-assisted closure) v léčbě ranných infekčních komplikací po kardiochirurgických výkonech
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

