-
Medical journals
- Career
Bronchoplastické operace pro nemalobuněčný plicní karcinom
Authors: R. Pospíšil; P. Polouček; P. Horák
Authors‘ workplace: Chirurgická klinika UK 2. LF a FN Motol, Praha, přednosta: prof. MUDr. J. Hoch, CSc
Published in: Rozhl. Chir., 2007, roč. 86, č. 4, s. 201-205.
Category: Monothematic special - Original
Overview
Bronchoplastické operace představují rozšíření spektra standardních plicních resekcí při léčbě nemalobuněčného plicního karcinomu při zachování onkologické radikality.
Cílem práce je na základě vlastních zkušeností ze souboru 39 pacientů operovaných touto metodou zhodnotit výsledky pooperační morbidity a mortality, upozornit na rizika, která vedou ke vzniku komplikací při tomto typu resekce a na faktory, jak tato rizika omezit.
Velmi dobré bezprostřední i dlouhodobé výsledky staví bronchoplastické operace na úroveň standardním plicním resekcím. Při vhodně lokalizovaných centrálních nádorech jsou indikovány u všech pacientů bez ohledu na hodnoty respiračních funkcí.Klíčová slova:
plicní karcinom – bronchoplastické operace – komplikaceÚVOD
První bronchoplastickou operaci provedl v roce 1947 Price-Thomas pro bronchiální adenom. Od té doby byl tento typ plicních operací postupně zařazen do škály plicních resekcí a dnes se již stal standardem v léčbě centrálního typu bronchogenního karcinomu. Parenchym šetřící operace byly původně určeny pro pacienty s předoperačně redukovanými plicními funkcemi, pro které by pneumonektomie představovala výkon neslučitelný s dalším životem. Od doby, kdy se na velkých sestavách prokázalo, že výsledky dlouholetého přežití po bronchoplastických operacích jsou přinejmenším srovnatelné s přežitím po jiných typech plicních resekcí, navíc s lepšími funkčními výsledky, byly bronchoplastické operace – „sleeve resekce“ – přijaty jako metoda léčby pro pacienty s centrálním bronchogenním karcinomem, při anatomicky vhodné lokalizaci bez ohledu na respirační funkční parametry [1]. Nepostižený a plně funkční parenchym je u těchto operací šetřen a především ponechané plicní laloky přispívají k lepší kvalitě života po operaci. Další nespornou výhodou těchto operací ve srovnání s pneumonektomií je nižší pooperační morbidita a mortalita.
Cílem našeho sdělení je předat zkušenosti s bronchoplastickými operacemi a analyzovat pooperační morbiditu a mortalitu.
METODIKA
Předoperačně podstoupili všichni pacienti shodný diagnostický a stagingový proces: standardní předozadní a bočný rentgenogram plic, bronchoskopické vyšetření s odběrem biopsie z nádoru a jeho histologické vyšetření, CT hrudníku a horní břišní etáže a sonografii břicha. U symptomatických pacientů byla cíleně doplněna scintigrafie skeletu a CT mozku k vyloučení vzdálených metastáz. Přítomnost vzdálených metastáz byla považována za kontraindikaci operace. Krční mediastinoskopie s histopatologickým vyšetřením mediastinálních uzlin byla indikována a provedena u pacientů s podezřením na N2 či N3 status podle CT vyšetření. Postižení N2 neboN3 uzlin bylo kontraindikací výkonu v první době.
Všem pacientům byl v rámci předoperačního vyšetření proveden funkční body test s predikcí pooperačních plicní funkcí s ohledem na rozsah předpokládaného výkonu a echokardiografie srdce. Pro nedostatečnou funkci kardiorespiračního systému byli kontraindikováni pacienti s ejekční frakcí nižší než 30 % a pacienti, kteří podle hodnot plicních funkcí nesplňovali kritéria nutná pro plicní lobektomii.
Operační výkon jsme prováděli podle standardních operačních technik až do přerušení bronchu (Obr. 1). Proximální i distální hranici transekce bronchu jsme vedli ve vzdálenosti alespoň 2 mm od makroskopické hranice nádoru. V této fázi jsme ještě odstranili 1–2 mm silný kroužek z distálního i proximálního pahýlu bronchu a odeslali k peroperačnímu histologickému vyšetření. K založení anastomózy jsme přistoupili až po ověření, že okraje bronchu jsou mikroskopicky bez nádoru. Anastomózu jsme šili jednotlivými vicrylovými stehy 2-0 (Ethicon) v celé vrstvě bronchu a po celém obvodu (Obr. 2 ). Zadní stěnu anastomózy jsme uzlili endoluminálně a přední stěnu zevně od bronchiálního lumen. Anastomózu jsme kryli lalokem z parietální pleury jen u prvních 8 pacientů, dále jsme tuto techniku pro její sporný efekt neprováděli. Standardně jsme doplnili hilovou a systematickou mediastinální lymfadenektomii. Operace jsme končili kontrolou těsnosti bronchiální anastomózy pod vodní hladinou a umístěním dvou hrudních drénů k anastomóze podél předního a zadního obvodu plicního hilu.
Image 1. Peroperační snímek – založení prvního stehu bronchiální anastomózy za okraje hlavního a lobárního bronchu Pic. 1. Peroperative view – First bronchial anastomosis stitch applied to the main and lobe bronchi ends 
Image 2. Peroperační snímek – dokončení přední strany bronchiální anastomózy Pic. 2. Peroperative view – Completion of the anterior part of the bronchial anastomosis 
Všichni operanti, jejichž stav to dovolil, byli extubováni na sále. Kritéria pro mechanickou ventilaci a extubaci byla shodná pro všechny pacienty. Důvodem pro pokračování v umělé plicní ventilaci byla hrozící nedostatečná pooperační ventilace nebo hypotermie. Pacienti, kteří vyžadovali ventilační podporu, byli umístěni na resuscitačním lůžku, ostatní na JIP chirurgické kliniky. Od prvního pooperačního dne byla zahajována agresivní fyzioterapie, podpora mukolytiky a mobilizace pacientů k podpoře dobré expektorace. Antibiotickou profylaxi v perioperačním období jsme podávali po dobu 24 hodin.
Výsledky bronchoplastických operací jsme hodnotili retrospektivně v období od ledna 1998 do prosince 2006. Do sestavy jsme nezahrnuli nemocné s resekcí kariny operované ve stejném časovém úseku.
VLASTNÍ SESTAVA
V období od ledna 1998 do prosince 2006 jsme provedli celkem 39 bronchoplastických operací („sleeve resekcí“) pro nemalobuněčný plicní karcinom (NSCLC). Průměrný věk nemocných byl 64,5 roku (43–78 let). Mužů bylo 28, žen 11. Histologická klasifikace byla stanovena podle WHO. U 24 nemocných (61,6 %) se jednalo o epidermoidní karcinom, 13 nemocných (33,3 %) podstoupilo „sleeve resekci“ pro adenokarcinom a ve 2 případech (5,1 %) pro velkobuněčný karcinom. Chirurgicko-patologický staging byl stanoven podle New International Staging System for Lung Cancer [2]. TNM klasifikace u provedených resekcí je uvedena v tabulce 1.
Table 1. TNM klasifikace a jednotlivé histologické typy Tab. 1. TNM classification and individual histological types 
Indikací k bronchoplastické operaci byl centrálně uložený nádor u 32 pacientů.
V 7 případech bylo indikací postižení hilových uzlin nebo peribronchiální tkáně zjištěné při peroperačním histologickém vyšetření z okraje bronchu po klasické lobektomii. Přehled provedených branchoplastických resekcí v závislosti na histologickém typu nádoru je uveden přehledně v tabulce 2.
Table 2. Typ bronchoplastické operace u jednotlivých histologických typů Tab. 2. Types of bronchoplastic procedures in individual histological types 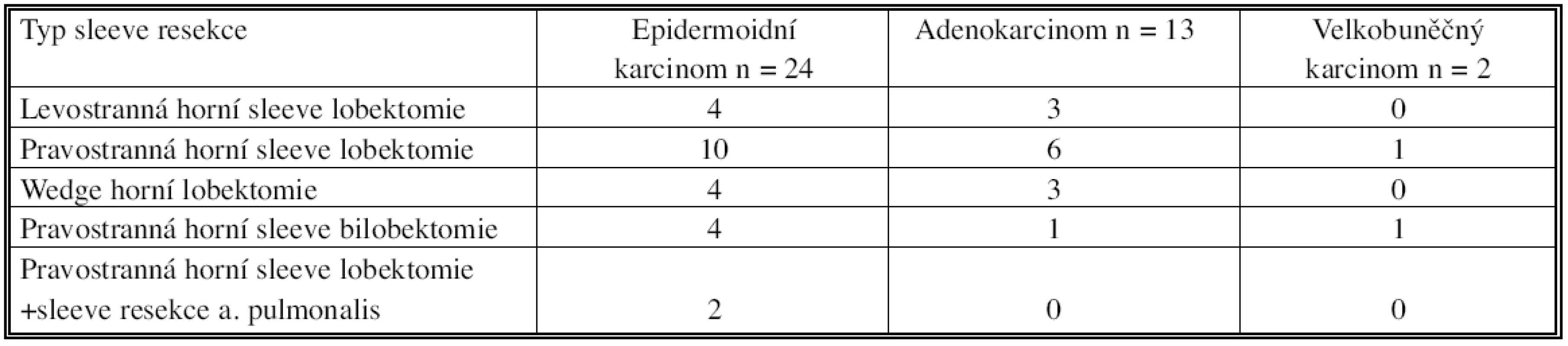
U dvou pacientů jsme byli nuceni pro intimní vztah tumoru k arterii pulmonalis provést sdruženou angioplastickou resekci s následnou termino-terminální cévní anastomózou.
U 12 pacientů, u kterých bylo mediastinoskopií s histologickým ověřením prokázáno postižení N2 uzlin a tedy stadium IIIA, byla indikována neoadjuvantní terapie. Všichni nemocní z této skupiny podstoupili chemoterapii, u 3 nemocných byla doplněna konkomitantní radioterapií. Operace byly provedeny do čtyř týdnů po skončení neoadjuvantní léčby.
Retrospektivně jsme hodnotili pooperační morbiditu a mortalitu, vliv pokračující umělé plicní ventilace a dále vliv neoadjuvantní terapie na četnost pooperačních komplikací.
VÝSLEDKY
Z celkového počtu 39 pacientů, kteří podstoupili v uvedeném období bronchoplastickou operaci pro plicní karcinom, bylo 24 extubováno na operačním sále. 15 pacientů bylo přeloženo z operačního sálu na lůžko ARK, kde pokračovala kontinuální umělá plicní ventilace v průměru 32 hodin po skončení operačního výkonu. Celkový počet pooperačních komplikací byl 16 (41,0 %). Komplikace mělo 11 (28,2 %) nemocných bez umělé plicní ventilace a 5 (12,8 %) s umělou plicní ventilací. Nejčastější komplikací, celkem 9 (23,0 %), byla plicní atelektáza s následnou pneumonií, která se rozvinula mezi 3.–5. pooperačním dnem. Jedna pacientka s rozsáhlou pneumonií ve zbylém laloku musela být přechodně ventilována pro rozvoj respiračního selhání. U 6 pacientů s touto komplikací jsme provedli bronchoskopii s cíleným odsátím a s následnou laváží dýchacích cest a doplnili antibiotickou terapií podle citlivosti. U 3 pacientů nebyla bronchoskopická sanace dýchacích cest nutná, vzhledem k tomu, že došlo ke spontánní mobilizaci hlenu s dobrou expektorací. Všichni pacienti s touto pooperační nesnází se zhojili bez dalších následků. Druhou nejčastější komplikací byla kardiální arytmie, nejčastěji tachyfibrilace síní, s rozvojem v průběhu prvních 24 hodin po výkonu a s dobrou odpovědí na medikamentózní léčbu. Jednalo se o přechodný stav bez dalších zdravotních komplikací. Počet a typ pooperačních komplikací v jednotlivých skupinách pacientů bez a s umělou plicní ventilací je uveden v tabulce 3.
Table 3. Komplikace u pacientů bez a s umělou plicní ventilací Tab. 3. Complications in patients without and with artificial pulmonary ventilation 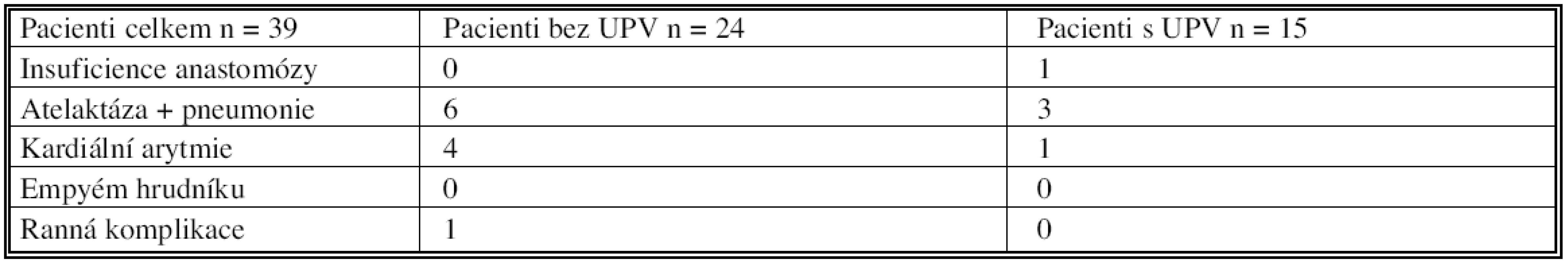
V celé skupině pacientů po bronchoplastické operaci jsme zaznamenali jedno úmrtí (2,5 %) a to v souvislosti s insuficiencí anastomózy. Jednalo se pacienta po pravostranné bronchovaskulární sleeve lobektomii. Po operaci byl 48 hodin ventilován, následná extubace a další pooperační průběh byl klidný. Jedenáctý pooperační den náhle exitoval za příznaků masivní hemoptýzy. Sekční nález potvrdil klinické podezření – insuficienci anastomózy a bronchovaskulární píštěl.
12 pacientů bylo operováno po neoadjuvantní terapii při stadiu IIIA. V této skupině jsme zaznamenali 3 (7,6 %) komplikace (1x atelektáza s pneumonií, 1x srdeční arytmie a 1x ranná komplikace). Ani u jednoho z nich nebyla zaznamenána insuficience anastomózy.
DISKUSE
Pro pacienty s centrálně umístěným karcinomem, kteří z hlediska plicních funkcí nejsou schopni tolerovat pneumonektomii, představují bronchoplastické operace léčebnou alternativu a často jedinou naději na onkologicky radikální výkon. Pro tyto nemocné jsou plastiky bronchiálního stromu, v nezbytných případech doplněné angioplastikou arterie pulmonalis, absolutní indikací. Zásadním problémem centrálně lokalizovaných bronchogenních karcinomů i u pacientů bez restrikce plicních funkcí je, že v naprosté většině vyžadují provedení pneumonektomie, při níž musí být často obětována velká část intaktního plicního parenchymu nárokům onkologické radikality. Od doby, co řada prací [1, 3] uvádí menší počet pooperačních komplikací a srovnatelné nebo dokonce lepší výsledky pětiletého přežití ve srovnání s „konvenční“ resekcí, stále více chirurgů dává přednost parenchym šetřícím výkonům. Bronchoplastická chirurgie může ve vybraných případech pomoci vyhnout se zbytečně extenzivním výkonům. V současnosti představují bronchoplastické operace 6–8 % výkonů u nemocných s chirurgicky řešitelným karcinomem [1]. Ve velkých sestavách ze zahraničních pracovišť se údaje o pooperační morbiditě a mortalitě při srovnání „sleeve resekcí“ a konvenčních lobektomií neliší. Pooperační morbidita lobektomie je shodně udávána mezi 1–2 % [4], u bronchoplastických operací 1–5 % [5]. O něco vyšší pooperační morbidita a mortalita po rekonstrukčních operacích je způsobena ve většině případů selháním bronchiální anastomózy [6]. Insuficience bronchiální anastomózy je typickou komplikací těchto výkonů. Snížení incidence této komplikace je podmíněno užitím operačních technik a perioperačního managementu užívaného při plicních transplantacích [7, 8]. Insuficience anastomózy je spojena s vysokou mortalitou, podobně jako u našeho pacienta bývá u ní přítomna bronchovaskulární píštěl. V naší sestavě tato komplikace činila 2,5 %, literární údaje udávají její frekvenci mezi 4–10 % [9], nejnovější sestavy kolem 3 % [10]. Faktory, které podstatně zvyšují riziko anastomotické komplikace, jsou mikroskopická rezidua karcinomu v resekční linii a zejména pak pozitivita N2 uzlin, tzn. jejich postižení nádorem. Riziko potenciálně inkompletní resekce při bronchoplastické operaci je dáno anatomickou situací, kde bezpečnostní lem mezi nádorem a hranicí resekce je prostorově limitován. Zejména u pacientů se sníženou funkční plicní rezervou, u kterých je omezen rozsah resekce, narůstá riziko nedostatečného bezpečnostního lemu. Přesto i u nich lze dosáhnout onkologicky radikální resekce při dodržení makroskopicky i mikroskopicky negativní resekční linie potvrzené peroperačním histologickým vyšetřením [11].
Nejčastější komplikací, která provází bronchoplastické operace, je perzistující atelektáza s udávanou frekvencí mezi 5,5–11,0 % [1]. Předpokládanou příčinou je porušená inervace distální části bronchu, pooperační otok bronchiální sliznice a oslabená mukociliární funkce v terminálních bronchiálních segmentech [12]. V našem souboru se vyskytla u 9 nemocných (23,0 %) s vyšší incidencí na počátku sledovaného období, kdy jsme začali provádět bronchoplastické operace a neměli jsme dokonale rozpracovanou pooperační péči o tyto nemocné. Shodně s dalšími soudíme, že tyto komplikace jsou častější u pacientů nespolupracujících, se sníženou plicní rezervou či jinak kompromitovaných [13]. Umělá plicní ventilace neměla vliv na četnost pooperačních komplikací.
Kardiální komplikace, především arytmie, jsou typické pro nitrohrudní operace. U bronchoplastických operací, jak potvrzují i naše zkušenosti, jsou podstatně méně časté než po pneumonektomiích [13].
Neoadjuvantní radioterapie a chemoterapie se uvádí mezi faktory, které mají vliv na vznik komplikace v anastomóze. Vliv předoperační radioterapie u pacientů s NSCLC, kteří jsou indikováni k bronchoplastické operaci, není jednoznačný. Ozáření vede k redukci peribronchiálního cévního zásobení a omezením dobré vaskularizace brání hladkému procesu hojení [14]. Proto někteří autoři nedoporučují předoperační radioterapii u pacientů, u kterých lze očekávat bronchoplastickou operaci [15]. U našich 3 pacientů, kteří v rámci neoadjuvantní léčby podstoupili radioterapii, jsme neshledali poruchu hojení anastomózy či pozdní anastomotickou stenózu. Zatím žádná prospektivní studie nezhodnotila vliv předoperační chemoterapie na hojení bronchiální anastomózy při bronchoplastické operaci. V práci japonských autorů byl zmíněn signifikantně vyšší počet obecných pooperačních komplikací u pacientů, kteří podstoupili neoadjuvantní chemoterapii, než bez ní. Jednalo se ale i o pacienty s pokročilým nádorovým onemocněním, u kterých byla provedena inkompletní resekce. Počet poruch hojení bronchiální anastomózy byl shodný u nemocných s před-operační chemoterapií i bez ní [15]. Ani v našem, byť nevelkém souboru pacientů, jsme nezaznamenali bronchiální insuficienci po předoperační onkologické léčbě.
Důležitým momentem bronchoplastických operací je pětileté přežití a četnost výskytu lokální recidivy ve srovnání s „konvenčními“ resekcemi. Podle literárních údajů je délka přežití, i pravděpodobnost vzniku lokální recidivy závislá hlavně na stadiu onemocnění, míře postižení lymfatických uzlin, radikalitě resekce a gradingu nádoru. Lze konstatovat, že u pacientů s nižším stadiem onemocnění a bez postižení lymfatických uzlin je pětileté přežití srovnatelné nebo lepší než u klasické lobektomie nebo pneumonektomie [16]. Při postižení N1 uzlin je délka přežití srovnatelná, u postižení N2 uzlin horší [17]. Proto je indikace k bronchoplastickým operacím u N2 postižení diskutabilní, stejně jako ke konvenčním typům operací, protože bez ohledu na typ výkonu život většiny pacientů ovlivňují vzdálené metastázy.
ZÁVĚR
Bronchoplastické operace představují operační techniku, která je při anatomicky vhodně lokalizovaných centrálních tumorech indikována u všech pacientů bez ohledu na hodnoty respiračních funkcí, za předpokladu dodržení všeobecně uznávaných indikačních kritérií k plicním resekcím. Podmínkou provedení je onkologická radikalita, která je podmíněna negativní peroperační histologií obou okrajů budoucí bronchiální anastomózy. Šetrná operační technika a dobře vedená pooperační péče umožňuje dosáhnout srovnatelné morbidity a mortality v porovnání se standardní lobektomií, a to při srovnatelných výsledcích dlouhodobého přežití. V našem souboru ani neoadjuvantní léčba nezvýšila procento komplikací hojení bronchiální anastomózy. U pacientů s N2 postižením lze tento typ resekce přijmout, neboť nemá vliv na délku přežití z hlediska tvorby vzdálených metastáz ve srovnání s klasickou lobektomií nebo pneumonektomií. Dalším důvodem, proč provádět v indikovaných případech bronchoplastické operace, jsou lepší hodnoty plicních parametrů po operaci ve srovnání s pneumonektomií a tím lepší kvalita dalšího života.
as. MUDr. R. Pospíšil
Chirurgická klinika UK 2. LF a FNM
V Úvalu 84
150 06 Praha 5
Sources
1. Tedder, M., Anstadt, M., et al. Current morbidity, mortality, and survival after bronchoplastic procedures for malignancy. Ann. Thorac. Surg., 1992, 54, s. 387–391.
2. Mountain, C. F. Revisions in the international system for staging lung cancer. Chest, 1997, 111, s. 1710–1717.
3. Vann Schill, P. E., de la Riviére, A. B., Knaepen, P. J., van Swieten, H. A., et al. TNM staging and long-term follow-up after sleeve resektion for bronchogenic tumors. Ann. Thorac. Surg., 1991, 52, s. 1996–1101.
4. Faber, L. P. Sleeve resections for lung cancer. Semin. Thorac. Cardiovasc. Surg., 1993, 5, s. 238–348.
5. Weisel, R. P., Cooper, J. D., Delavre, N., C., et al. Sleeve lobectomy for carcinoma of the lung. J. Thorac. Cardiovasc. Surg., 1974, 78, s. 839–844.
6. Maggi, G., Casadio, C., Pischedda, F., Cianci, R., Ruffini, E. Bronchoplastic and angioplastic techniques in the treatment of bronchogenic carcinoma. Ann. Thorac. Surg., 1993, 55, s. 1501–1507.
7. Schafers, H. J., Haydock, D. A., Cooper, J. D. The prevalence and management of bronchial anastomotic complications in lung transplantation. J. Thorac. Cardiovasc. Surg., 1991, 101, s. 1044–1052.
8. Schafers, H. J., Haverich, A., Wagner, T. O. F., Wahlers, T., Alken, A., Borst, H. G. Decreased incidence of bronchial complications following lung transplantation. Eur. J. Cardiothorac. Surg., 1992, 6, s. 174–179.
9. Kadri, M. A., Dussek, J. E. Survival and prognosis following resection of primary non - small cell bronchogenic carcinoma. Eur. J. Cardiothorac. Surg., 1991,5, s. 132–136.
10. Schinkel, C., Mueller, J., Reinmiedl, J., Fuerst, H. Morbidity and survival after bronchoplastic surgery for non-small-cell lung cancer. J. Cardiovasc. Surg., 2000, 41, s. 637–640.
11. Vogt-Moykopf, I., Fritz, T., Buelzebruck, H., Merkle, N., Daskos, G., Meyer, G. Bronchoplastic and angioplastic operations in bronchial carcinoma. Legenbecks Arch. Chir., 1987, 371, s. 85–101.
12. Deslauriers, J., Mehran, R. J., Guimont, C., Brisson, J. Staging and management of lung cancer: sleeve resection. World J. Surg., 1993, 17, s. 712–718.
13. Pospíšil, R. Význam „parenchym šetřících operací“ v léčbě bronchogenního karcinomu. Rozhl. Chir., 2001, roč. 80, č. 2, s. 57–61.
14. Tsubota, N., Simpson, W. J., Nostrands, A. W., Pearson, F. G. The effects of preoperative irradiation on primary tracheal anastomosis. Ann. Thorac. Surg., 1975, 20, s. 152–160.
15. Yatsuyanagi, E., Hirata, S., Yamazuki, K., et al. Anastomotic complications after Bronchoplastic procedurs for non-small-cell lung cancer. Ann. Thorac. Surg., 2000, 70, s. 396–400.
16. Faber, L. P., Jensik, R. J., Kittle, C. F. Results of sleeve lobectomy for bronchogenic Carcinoma in 101 patients. Ann. Thorac. Surg., 1984, 37, s. 279–285.
17. Mehran, R. J., Peslavriers, J., et al. Survival related to nodal status after sleeve resections for lung cancer. J. Thorac. Cardiovasc. Surg., 1994, 1, s 576–583.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2007 Issue 4-
All articles in this issue
- Chirurgické léčení krvácení z gastroduodenálního vředu
- Umělý svěrač u nemocných po kongenitálních malformacích anorekta
- Dlouhodobé výsledky po radikálních resekcích pro duktální adenokarcinom pankreatu – desetileté zkušenosti
- Naše zkušenosti s peroperační choledochoskopií
- Akútna intestinálna ischémia
- Ošetření střelných poranění a prevence vzniku komplikací v průběhu hojení
- Ošetření zlomenin proximálního humeru pomocí úhlově stabilního antegrádního zajištěného nitrodřeňového hřebu – prospektivní studie
- Bronchoplastické operace pro nemalobuněčný plicní karcinom
- Analýza regresivních změn v lymfatických metastázách plicního karcinomu po indukční chemoterapii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ošetření střelných poranění a prevence vzniku komplikací v průběhu hojení
- Chirurgické léčení krvácení z gastroduodenálního vředu
- Akútna intestinálna ischémia
- Dlouhodobé výsledky po radikálních resekcích pro duktální adenokarcinom pankreatu – desetileté zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

