-
Medical journals
- Career
Vrodená (nešpecifická) imunita stredného ucha a jej úloha pri stredoušnej otitíde
Authors: Hlávková Z. 1; M. Suchánková 2; L. Varga 3
Authors‘ workplace: Otorinolaryngologické oddelenie, FN Trnava 1; Imunologický ústav LF UK v Bratislave 2; Klinika otorinolaryngológie a chirurgie hlavy a krku LF UK a UN Bratislava 3
Published in: Otorinolaryngol Foniatr, 71, 2022, No. 1, pp. 24-32.
Category: Review Article
doi: https://doi.org/10.48095/ccorl202224Overview
Zápal stredného ucha predstavuje jedno z najbežnejších ochorení na svete a vo všeobecnosti patrí k najčastejším príčinám poruchy sluchu. V niektorých prípadoch môžu epizódy akútnej otitídy progredovať do chronického zápalu stredného ucha aj napriek adekvátnej liečbe. Kvôli komplexnej patogenéze a narastajúcej rezistencii patogénov na antibiotickú liečbu je nevyhnutné hľadanie iných terapeutických postupov, ktorými by bolo možné toto ochorenie modulovať a liečiť. Preto je zásadné porozumieť úlohe vrodenej imunity v strednom uchu pri obrane proti mikroorganizmom. V tejto prehľadovej práci sa zaoberáme úlohou prirodzenej imunity pri otitíde a poukazujeme na úlohy vrodenej celulárnej imunity pri ochrane stredného ucha vo svetle najnovších poznatkov. Vrodený imunitný systém v strednom uchu je zodpovedný za rýchlu identifikáciu a následné odstránenie patogénov. Bunky imunitného systému exprimujú obrovské množstvo receptorov s rozmanitými funkciami s cieľom eliminovať mnohé infekcie skôr, ako sa rozvinie antigénom slabo aktivovaná adaptívna imunita.
Klíčová slova:
imunogenetika – zápal stredného ucha – imunita stredného ucha
Úvod
Akútny zápal stredného ucha (otitis media acuta – OMA) patrí k celosvetovo najčastejším ochoreniam. Priemerný výskyt OMA sa odhaduje na 10,8 nových epizód/100 ľudí za rok. Celkový globálny ročný počet nových epizód OMA sa odhaduje na 709 miliónov, pričom 51 % sa vyskytuje u detí mladších ako 5 rokov [1]. V prvých 3 rokoch života sa takmer u všetkých detí vyskytne najmenej jedna epizóda tohto ochorenia a až u 50 % sa vyskytujú opakujúce sa epizódy. Patogenéza OMA je multifaktoriálna a zahŕňa predovšetkým vírusové a bakteriálne infekcie spôsobené najmä Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis a Streptococcus pyogenes [2], ale aj dysfunkciu Eustachovej trubice, zníženie ciliárnej funkcie v bubienkovej dutine a sluchovej trubici [3], alergie, extraezofageálny reflux, adenoidné vegetácie a kraniofaciálne malformácie [4], vrátane rázštepových porúch, kedy sa sekrét v stredouší objavuje aj na strane bez rázštepu [5]. Ďalšie etiologické faktory nie sú dodnes ešte úplne pochopené. V niektorých prípadoch môže OMA prejsť do chronického ochorenia a to najčastejšie ako komplikácia po perzistujúcej alebo recidivujúcej akútnej otitíde [6].
Chronickú stredoušnú otitídu novšie delíme na mukozálny a skvamózny typ, ktoré sa ďalej vyskytujú v aktívnej a neaktívnej forme [7]. K chronickým zápalom stredného ucha v klasickom ponímaní patrí najmä chronická sekretorická otitída, chronická mezotympanická otitída a chronická epitympanická otitída s cholesteatómom. Chronická sekretorická otitída (CHSO – chronická sekretorická otitída) je najčastejšou príčinou poruchy sluchu v detstve a je charakterizovaná hromadením tekutiny v strednom uchu za neporušenou blankou bubienka bez známok akútnej infekcie [8]. Rozdiel medzi fyziologickým nálezom a patologickým mikroskopickým nálezom pri CHSO a aktívnej chronickej supuratívnej otitíde zobrazuje obr. 1. Cholesteatóm ako dôsledok a súčasne aj príčina chronického zápalu, podľa charakteru jeho vzniku, je síce histologicky benígnym „tumorom“, má ale lokálne agresívnu povahu správania. Môže viesť až k rozsiahlej deštrukcii kostí stredoušnej dutiny a bázy lebky s intrakraniálnymi komplikáciami [9]. Zápalová reakcia pri takomto patologickom procese v stredouší so sebou prináša rozsiahlu dynamickú sieť bunkových a molekulárnych interakcií a imunitné bunky zohrávajú dôležitú úlohu pri jej kontrole.
Image 1. Rozdiel medzi makroskopickým a mikroskopickým patologickým nálezom pri rôznych typoch chronických otitíd (upravené podľa [5]).
Fig. 1. Gross and microscopic pathology in different subtypes of chronic otitis media [5].![Rozdiel medzi makroskopickým a mikroskopickým patologickým nálezom pri rôznych typoch chronických otitíd
(upravené podľa [5]).<br>
Fig. 1. Gross and microscopic pathology in different subtypes of chronic otitis media [5].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/b3b5994625ee2604496e5b5efde19d79.jpg)
Cieľom tohto naratívneho prehľadového článku je poukázať na úlohy vrodenej celulárnej imunity pri ochrane stredného ucha vo svetle najnovších vedeckých poznatkov. Jej pochopenie umožňuje lepšie porozumieť mechanizmom vzniku a udržiavania zápalu stredného ucha a súčasne predstavuje esenciálnu teoretickú výbavu otorinolaryngológov, pre ktorých je diagnóza stredoušného zápalu súčasťou každodennej práce.
Vrodená (nešpecifická) imunita stredného ucha
Vrodená imunita predstavuje včasnú a nešpecifickú obrannú líniu proti mikróbom. Reaguje na obmedzenejšie množstvo antigénov ako adaptívna imunita a cieľové antigény sú nevyhnutnými a nemennými štrukturálnymi komponentmi špecifickými pre mikróby. Takéto mikrobiálne zložky sú známe ako molekulárne vzorce spojené s patogénom (pathogen associated molecular pattern – PAMP). Rozpoznanie týchto vzorcov sa uskutočňuje prostredníctvom receptorov na rozpoznávanie vzorcov (pattern recognition receptors – PRR) exprimovaných na imunitných bunkách. PRR môžu tiež rozpoznať hostiteľské molekuly obsahujúce molekulárne vzorce spojené s poškodením (damage-associated molecular patterns – DAMP), ktoré sa uvoľňujú z nekrotických buniek poškodených patogénmi [10, 11].
Fylogeneticky je imunitný systém veľmi starý a objavil sa už v ranej fáze vývoja. Adaptívna imunita aj so svojimi špecifickými imunitnými bunkami a protilátkami sa evolučne vyvíjala už u rybovitých stavovcov [12], teda oveľa skôr, ako sa fylogeneticky vyvinulo stredné ucho. To sa objavilo v dobe, keď živočíchy prešli z vodného prostredia k životu na súši a tento neskorší fylogenetický vývoj urobil zo stredného ucha paradoxne akýsi imunodeficientný orgán spoliehajúci sa predovšetkým na účinný imunitný systém bez špecifickej adaptívnej imunity [13]. Keďže sa v zdravom strednom uchu nachádza len veľmi málo lymfocytov, počiatočnú odpoveď na infekciu v ňom sprostredkuje pravdepodobne len vrodená imunita, ktorá mu umožňuje eliminovať mnohé infekcie skôr, ako sa rozvinie antigénom slabo senzibilizovaná adaptívna imunita [14].
Fyzikálna a chemická bariéra, antimikrobiálne zložky
Prvú líniu obrany v strednom uchu proti patogénom zabezpečuje epitelová výstelka stredného ucha, ktorá obsahuje niekoľko defenzívnych mechanizmov.
Hlienová vrstva pokrývajúca epitel sliznice stredného ucha pôsobí ako prvá fyzikálna a biochemická bariéra. Sekrécia mucínov pohárikovými a hlienovými bunkami formuje teda hlienovú vrstvu (obr. 2), kde sa zachytávajú patogény, ktoré sa odstránia pomocou mukociliárneho transportu smerom k Eustachovej trubici [13, 15]. Mucíny sú jedinou zložkou, ktorá zodpovedá za viskozitu výpotku v strednom uchu a nadmerná produkcia viskóznych mucínov môže brániť normálnemu mukociliárnemu klírensu. Ich pretrvávajúca akumulácia v dutine stredného ucha pravdepodobne zahŕňa aj rozsiahlu proliferáciu a metapláziu slizníc [16].
Image 2. Slizničná imunita stredného ucha (upravené podľa [12]).
Fig. 2. Middle ear mucosal immunity [12].![Slizničná imunita stredného ucha (upravené podľa [12]).<br>
Fig. 2. Middle ear mucosal immunity [12].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ab5a0fdf214f3b5e7fba37c27a96b48b.jpg)
Ďalšiu vrstvu fyzikálnej ochrany poskytuje prepletená bunková sieť epitelových buniek. Dôležitou funkciou tohto jednovrstvového epitelu je taktiež transport elektrolytov a osmoticky viazanej tekutiny.
Mikroorganizmy, ktoré prechádzajú mucínovou bariérou, prichádzajú do styku s celým radom rozpustných mediátorov prítomných v hliene. Ide o povrchovo aktívne látky, z ktorých mnohé majú bakteriostatický alebo baktericídny účinok [13]. Tieto látky odstraňujú invazívne mikróby pomocou niekoľkých mechanizmov, vrátane narušenia bunkových stien. Epitelové bunky v strednom uchu primárne uvoľňujú b-defenzíny s antimikrobiálnou funkciou proti širokému spektru vírusov, baktérií, húb a prvokov. Defenzíny sú katiónové antimikrobiálne peptidy s veľkosťou od 3,5 do 4,5 kDa, ktoré sú stabilizované tromi intramolekulárnymi disulfidovými väzbami [17]. Majú antimikrobiálne účinky s priamou deštrukciou na bakteriálnu stenu, ktorú vedia niektoré baktérie modifikovať tak, aby boli na defenzíny menej citlivé. Ďalšou ich vlastnosťou sú imunomodulačné účinky [18]. Je známe, že niektoré defenzíny stimulujú prozápalové cytokíny/chemokíny a pôsobia ako chemoatraktanty pre neutrofily, žírne bunky a dendritické bunky. Bolo dokázané, že ľudský b-defenzín 2 je zvýšene produkovaný pri reakcii stredného ucha na baktérie a cytokíny, ako napríklad s netypizovateľným Haemophilus influenzae [16]. Ďalšími antimikrobiálnymi mediátormi sú lyzozým, laktoferín, transferín a bakteriocíny (obr. 2). Lyzozým spôsobuje lýzu steny grampozitívnych baktérií (Streptococcus, Staphylococcus) a je prítomný aj v neutrofiloch, makrofágoch a monocytoch. Laktoferín a transferín vykazujú priamu antibakteriálnu aktivitu tým, že obmedzujú rast baktérií naviazaním železa, ktoré je základným nutričným faktorom pre baktérie [15, 19]. Bakteriocíny sú peptidy syntetizované baktériami s antimikrobiálnou aktivitou predovšetkým proti príbuzným druhom. Takéto bakteriocíny produkuje aj niekoľko kmeňov a-hemolytických streptokokov a predstavuje pre ne selekčnú výhodu [20].
Bunková bariéra
Dôležitou súčasťou vrodenej imunity sú bunky, ktoré sú zdrojom početných humorálnych mechanizmov. K nemyeloidným bunkám patria napríklad epitelové bunky a fibroblasty, k myeloidným monocyty, makrofágy, dendritické bunky, neutrofily, bazofily, žírne bunky a krvné doštičky (obr. 2). Okrem vyššie spomínaných patria k vrodenej imunite tiež zložky komplementu, cytokíny, chemokíny a rastové faktory [11]. Zápalový infiltrát počas bakteriálnej stredoušnej otitídy pozostáva predovšetkým z neutrofilov a makrofágov. Neutrofily dominujú v strednom uchu prvých 24 hodín a makrofágy prevažujú od 48 do 72 hodín od vzniku infekcie. Väčšina buniek však pri normálnom hojení opustí stredoušie do 5 dní od počiatku infekcie [14].
Makrofágy delíme na rezidentné, teda také, ktoré sa nachádzajú vo všetkých tkanivách, prispievajú k imunologickému dohľadu, homeostáze a oprave tkanív. Druhou skupinou sú zápalové makrofágy, odvodené z obehových monocytov a schopné rýchleho prieniku do tkanív ohrozených infekciou, poranením. Makrofágy exprimujú širokú škálu povrchových receptorov, a tým rozpoznávajú a primerane reagujú na veľké množstvo endogénnych/exogénnych ligandov. Počas zápalovej reakcie produkujú tumor nekrotizujúci faktor (TNF), interleukín 1 a 6 (IL-1, IL-6), ale aj ďalšie cytokíny [11]. Makrofágy zohrávajú významnú úlohu v imunite stredného ucha. U ľudí sú hlavnou celulárnou zložkou výpotkov v stredoušnej dutine a sú schopné fagocytózy a vnútrobunkového usmrcovania baktérií. Na základe neúčinného odstraňovania baktérií môže akútna otitída prejsť do chronického stredoušného zápalu [16].
Neutrofilné granulocyty sú priťahované do miesta infekcie, kde fagocytujú mikróby a usmrcujú ich intracelulárne. Po preniknutí patogénov cez epitelové bariéry sú prvou bunkovou líniou [11]. Tu iniciujú fagocytózu rozpoznaním PAMP pomocou ich receptorov ako sú Toll-like receptory (TLR), ale tiež pomocou rozpoznania opsonínov ako sú protilátky a zložky komplementu pomocou Fc receptorov pre protilátky a komplementových receptorov. Neutrofily uplatňujú svoje antimikrobiálne účinky prostredníctvom reaktívnych druhov kyslíka a cytotoxických zložiek. Neutrofily sú taktiež schopné ničiť patogény pomocou neutrofilných extracelulárnych pascí (NET), ktoré boli prvýkrát opísané v roku 2004. Neutrofily vytvárajú siete z chromatínových vlákien, ktoré obsahujú antimikrobiálne peptidy a enzýmy, ako sú neutrofilná elastáza, katepsín G a myeloperoxidáza [21]. Po bunkovej smrti prichádza k následnému uvoľneniu DNA s baktericídnymi peptidmi, ktoré sú schopné zachytiť patogény práve pomocou NET. Prebytok týchto NET prispieva k patológii mnohých ochorení. Rýchly klírens NET zo slizničných povrchov dýchacích ciest je dôležitý a nedostatočná funkcia Eustachovej trubice (ako je to u dojčiat a batoliat) vedie k nedostatočnému klírensu NET. Okrem toho aj akumulácia mucínov spôsobuje hromadenie NET v strednom uchu, a tým zhoršuje zápalové ochorenie [22, 23].
Dendritické bunky (DC) v dýchacích cestách sa považujú za sentinelové bunky imunitného systému sliznice. Sú schopné migrovať, prezentovať antigény T lymfocytom a indukovať v nich imunitné odpovede. Zvýšený počet týchto buniek v tympanickej membráne bol dokázaný u pacientov s chronickou hnisavou otitídou, ako aj v matrixe cholesteatómu v porovnaní so zdravou populáciou [24].
Fibroblasty sú bunky spojivového tkaniva schopné produkovať rôzne imunitné modulátory, ako rastové faktory, cytokíny a chemokíny. Pri stredoušnej otitíde fibroblasty do veľkej miery zodpovedajú za architektonické zmeny v stredouší, ktoré zahŕňajú hyperpláziu epitelu sliznice, ako aj subepiteliálneho tkaniva. Sliznica stredného ucha proliferuje do pseudostratifikovaného epitelu, je tu významná neovaskularizácia, ktorá zväčšuje hrúbku sliznice a napomáha následnej infiltrácii leukocytov. Toto je potenciálny faktor pri vzniku výpotku stredného ucha [16].
Žírne bunky (mastocyty) sa bežne vyskytujú v zdravej stredoušnej dutine a prednostne sa distribuujú do dobre vaskularizovanej sliznice. Ich prítomnosť a degranulácia prispieva k rýchlym nešpecifickým zápalovým reakciám epitelu na bakteriálne antigény a vedie k fagocytóze a uvoľňovaniu biologicky aktívnych molekúl, ako je histamín, TNF a IL-6. To môže ovplyvniť migráciu, dozrievanie alebo diferenciáciu DC, T buniek a B buniek. Prispievajú tiež k tvorbe granulačného tkaniva, k recidívam otitíd alebo k chronickému zápalu stredného ucha [25].
NK bunky exprimujú niekoľko aktivačných a inhibičných receptorov, ktoré rozpoznávajú zmenenú expresiu proteínov na cieľových bunkách. Sú skupinou vrodených imunitných buniek, ktoré vykazujú spontánnu cytolytickú aktivitu proti bunkám pod stresom, ako sú napríklad nádorové bunky a bunky infikované vírusom. Po aktivácii NK bunky vylučujú niekoľko cytokínov, ako je interferón - g (INFg), TNF, faktor stimulujúci kolónie granulocytových makrofágov a rôzne iné chemokíny, ktoré môžu modulovať funkciu iných vrodených a adaptívnych imunitných buniek. Vykazujú široké spektrum tkanivovej distribúcie a fenotypovej variability [26].
Receptory rozpoznávania vzorov (PRR)
PRR sa označujú aj ako receptory pre rozpoznávanie primitívnych vzorov, pretože sa evolučne vyvinuli pred špecifickou imunitou. Medzi receptory PRR, ktoré sú spojené s PAMP patria membránové Toll-like receptory (TLR) a C-lektínové receptory (CLR), do skupiny cytoplazmatických PRR zase Nod-like receptory (NLR) a receptory podobné RIG-I (RLR). Aktivácia týchto receptorov, ktoré môžu byť spúšťané extracelulárnymi alebo cytoplazmatickými molekulami patogénov, vedie k iniciácii zápalu a ďalších mechanizmov, dôležitých nielen pre odstránenie patogénov a obnovenie homeostázy tkanív, ale aj k aktivácii špecifickej imunity. Aktivujú širokú škálu génov, ktoré kódujú cytokíny a chemokíny, aktivujú leukocyty vrátane neutrofilov, monocytov, makrofágov a NK buniek. Infikované epitelové bunky sa stávajú cieľom NK buniek, zatiaľ čo neutrofily a makrofágy pomáhajú pri fagocytárnom klírense baktérií a odumretých buniek [27, 28].
Toll-like receptory (TLR) hrajú rozhodujúcu úlohu v skorej vrodenej imunitnej odpovedi na patogény prostredníctvom rozpoznávania mikroorganizmov – podieľajú sa na aktivácii buniek, fagocytóze a expresii prozápalových génov [29]. Signálne dráhy TLR môžu byť regulované protizápalovým cytokínom ako je transformujúci rastový faktor beta (TGFβ). Ten je kľúčovým regulátorom tkanivovej prestavby a hrá dôležitú úlohu pri tvorbe granulačného tkaniva, ktorého tvorba sa urýchľuje v chronickom štádiu stredoušného zápalu. Výsledkom je proliferácia fibroblastov v submukóze a zhrubnutie sliznice v stredoušnej dutine [30]. Na epitelových bunkách stredného ucha bolo detegovaných najmenej desať rôznych TLR. TLR2 a TLR4 sa nachádzajú v bunkovej membráne, čo im umožňuje detegovať baktérie v extracelulárnom priestore (napr. TLR2 je nevyhnutný na rozpoznávanie PAMP z grampozitívnych baktérií, TLR4 je aktivovaný lipopolysacharidom gramnegatívnych baktérií). Po ligácii so svojim ligandom sa TLR4 translokuje z cytoplazmatickej membrány do endozómu. TLR, ktoré rozpoznávajú nukleové kyseliny (TLR3, TLR7 a TLR9), sa nachádzajú v endozóme a tu detegujú vírusy. Po rozpoznaní ligandu sa tieto TLR translokujú do rôznych kompartmentov, napr. TLR9 do endoplazmatického retikula (obr. 3) [27, 31]. Medzi jednotlivými podtypmi týchto receptorov, rozhodujúcu úlohu pri stredoušných zápaloch majú TLR2 a TLR4. Rôzne bunky exprimujúce TLR (dendritické, endotelové bunky, makrofágy) môžu vylučovať tiež rôzne zápalové cytokíny a/alebo chemokíny v reakcii na nepretržitú stimuláciu. Zníženie expresie TLR počas zápalu stredného ucha môže viesť k neefektívnej obrane hostiteľa, recidivujúcim infekciám alebo pretrvávajúcemu zápalu, ktorý vyústi do chronického ochorenia stredného ucha [31].
Image 3. Signalizačná dráha TLR, NLR, CLR a RLR receptorov.
TLR, NLR, CLR a RLR signalizácia spôsobuje aktiváciu NF-κB (nukleárny faktor κB), čo vedie k produkcii prozápalových cytokínov a stimulácii imunitných odpovedí. Základná (neúplná) schéma signalizácie jednotlivých receptorov.
Fig. 3. Signaling pathway via TLR, NLR, CLR and RLR receptors.
TLR, NLR, CLR and RLR signaling cause activation of NF-κB (nuclear factor κB), leading to the production of pro-inflammatory cytokines and stimulation of immune responses. Basic (incomplete) signaling scheme of individual receptors.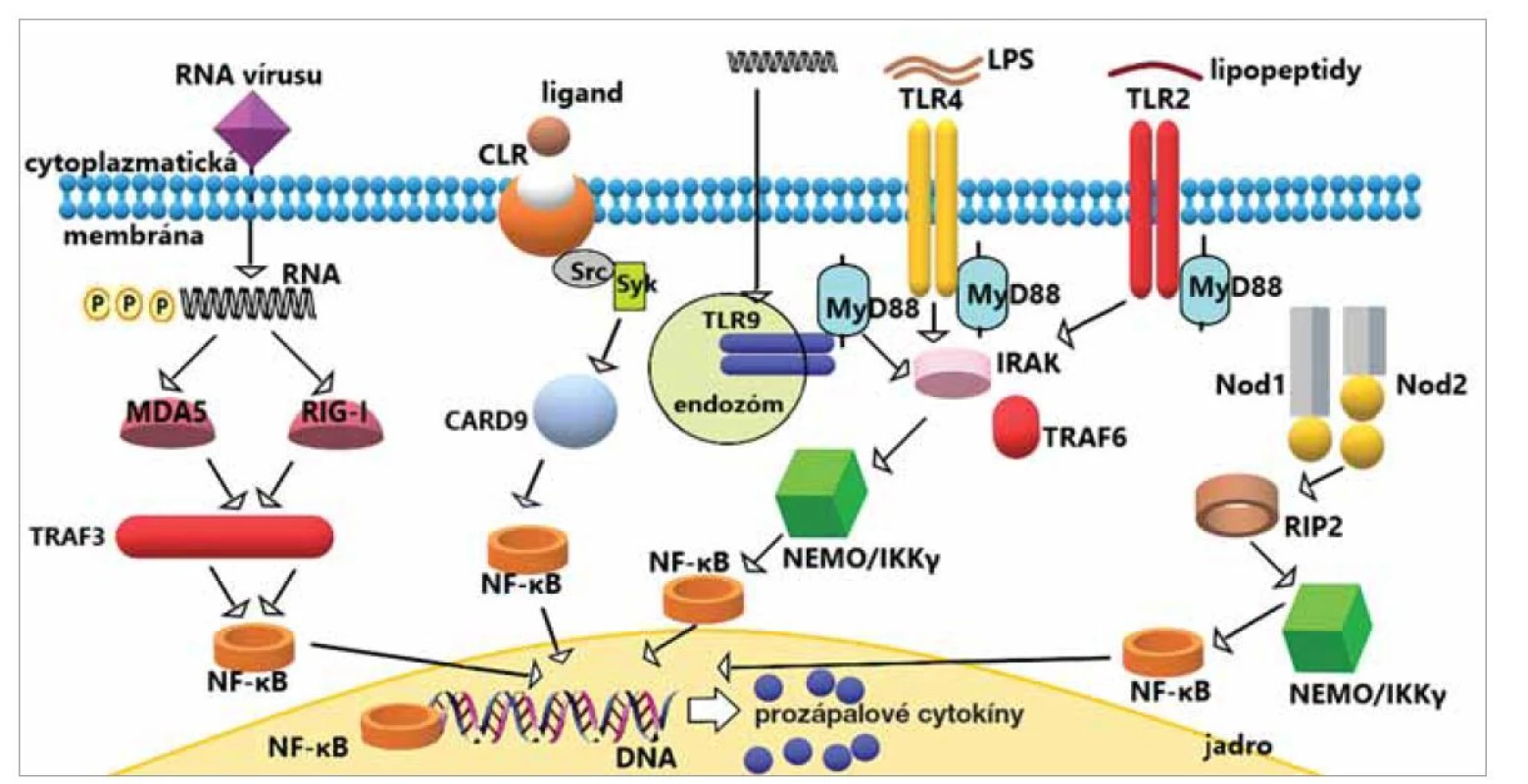
Nod-like receptory (NLR) sú cytoplazmatické PRR, ktoré sprostredkovávajú detekciu intracytoplazmatických bakteriálnych produktov. Najznámejšie z tejto skupiny sú Nod1 a Nod2 (nukleotidová oligomerizačná doména 1, 2) (obr. 3). Nod2 je považovaný za všeobecný senzor baktérií, zatiaľ čo detekcia Nod1 je špecifickejšia pre gramnegatívne baktérie. Oba sú exprimované ľudským epitelom dýchacích ciest [15].
RIG-I-like receptory (RLR) detekujú prítomnosť vírusových nukleových kyselín a pôsobia prostredníctvom proteínov asociovaných s mitochondriami a endoplazmatickým retikulom (obr. 3). RLR skrížene komunikujú so signalizáciou TLR. U pacientov náchylných k stredoušnej otitíde sa zistilo, že úroveň expresie RIG-I (kyselinou retinovou indukovaný gén I), podobne ako TLR9, je nižšia ako u zdravých pacientov [28]. RIG-I sa považuje za nevyhnutný pre vrodenú imunitnú reakciu proti mnohým vírusom rozpoznávaním ich koncov RNA s 5‘-trifosfátom v ich genóme (obr. 3) alebo v replikačných medziproduktoch. Nedávno sa zistilo, že RIG-I je schopný detegovať aj bakteriálnu mRNA, ktorá sa translokuje do cytosolu [32].
Lektínové receptory typu C (CLR). Lektíny sú proteíny viažuce sa na sacharidové štruktúry, a to mechanizmom závislým od vápnika. Ióny vápnika sa priamo podieľajú na väzbe ligandu, ako aj na udržiavaní štrukturálnej integrity. Lektíny typu C existujú buď ako transmembránové proteíny (napr. selektíny), alebo v rozpustnej forme (napr. kolektíny) [33]. Distribúcia rôznych typov lektínov v uchu môže úzko korelovať s normálnym fyziologickým nálezom v stredouší, ako aj s patofyziológiou stredoušnej otitídy [34]. Vybrané CLR viažu manózu (MBL), fukózu alebo glukány, a hrajú kľúčovú úlohu pri vrodenej imunite proti kvasinkám, vláknitým hubám, mykobaktériám a niektorým ďalším mikroorganizmom zvýšením aktivácie komplementu. Manóza sa vyskytuje vo vírusoch, hubách a mykobaktériách, zatiaľ čo fukóza je špecificky exprimovaná určitými baktériami a parazitmi. C-lektínové receptory umožňujú DC bunkám patogény viazať a endocytovať, čo vedie k degradácii patogénov a produkcii antigénov [35]. CLR tvoria početnú rodinu receptorov s rôznymi funkciami od adhézie buniek, regulácie NK buniek, fagocytózy, endocytózy, aktivácie krvných doštičiek, aktivácie komplementu, remodelácie tkanív a vrodenej imunity. Narastajúce dôkazy tiež naznačujú, že CLR navzájom komunikujú s TLR, čím udržujú rovnováhu medzi imunitnou toleranciou a aktiváciou imunitného systému [10, 33].
Vrodená imunita je teda rozhodujúca v skorých štádiách infekcie. Avšak jemné doladenie tejto reakcie je absolútne nevyhnutné, aby sa zabránilo nadmernému zápalu a poškodeniu tkanív. Vrodené imunitné receptory, ako napríklad spúšťacie receptory exprimované na myeloidných bunkách (TREM), modulujú vrodenú reakciu buď zosilnením alebo tlmením signálov indukovaných TLR, a tým hrajú významnú úlohu pri dolaďovaní zápalovej reakcie [36]. TREM-1 sú členmi imunoglobulínovej superrodiny a ich expresia prebieha najmä na myeloidných bunkách, ako sú monocyty / makrofágy a neutrofily. Je výrazne zvýšená napríklad pri bakteriálnej infekcii, kde môže byť stimulovaná lipopolysacharidom, pri plesňovej infekcii, ale taktiež aj pri akútnych neinfekčných ochoreniach či chronických aseptických zápaloch [37]. TREM-2 majú vo všeobecnosti protizápalové alebo prozápalové funkcie, záleží na pôvode buniek, ktoré exprimujú TREM-2. Ak sú exprimované na povrchu makrofágov a mikroglií, zmierňujú zápalovú odpoveď, ak sú exprimované na povrchu dendritických buniek, zápalovú reakciu skôr zosilňujú [38].
Imunogenetika stredného ucha
V posledných rokoch prišlo k významnému pokroku pri identifikácii genetických faktorov ovplyvňujúcich stredoušné zápaly a lepšiemu chápaniu geneticky podmienenej variability v nešpecifickej vrodenej imunite, ktorá môže predisponovať k tomuto ochoreniu. Neexistuje jeden základný génový variant, ktorý vyvoláva ochorenie takej multifaktoriálnej genézy, ako je stredoušná otitída. Existuje však široké spektrum génových polymorfizmov, ktoré môžu byť spojené s náchylnosťou alebo rezistenciou k stredoušnej otitíde [39]. Na základe pokusov na geneticky modifikovaných myšiach boli identifikované rôzne gény vrodeného imunitného systému, ktoré sú dôležité v prevencii vzniku chronického stredoušného zápalu. Niektoré z týchto génov kódujú TLR, ako napríklad TLR2 a TLR4, iné kódujú molekuly pre signálne dráhy, napr. MyD88 alebo TNF. Deficit v každom z týchto génových produktov je spojený so zhoršeným procesom hojenia akútneho stredoušného zápalu. U pacientov so sklonom k zápalu stredoušia boli nájdené znížené hladiny mRNA kódujúce TLR2, TLR4, TLR5, TLR6 a TLR9 [29]. Pri sledovaní SNP (jednonukleotidový polymorfizmus) v génoch TLR2, TLR4, TLR9 a CD14 sa ukázalo, že určité SNP v génoch pre TLR sú častejšie u detí náchylných k zápalu stredného ucha voči deťom bez anamnézy stredoušnej otitídy [40]. V inej práci pri skúmaní 348 detí, ktoré prekonali 2 a viac otitíd bolo dokázané, že nosičstvo alely TLR4 299 A (alela A génu pre TLR299) bolo spojené s náchylnosťou na akútnu otitídu, naopak nosičstvo TLR4 299 G (alela G génu pre TLR299) bolo spojené s nižším počtom epizód akútnych otitíd, avšak štatistická významnosť bola zistená iba u detí mladších ako 4 roky [41]. Jedna z novších prospektívnych kohortových štúdií analyzovala u fínskych detí polymorfizmus v génoch MBL2 (gén pre prekurzor lektínu viažuceho manózu 2), TLR2, TLR4 TLR7 a TLR8, teda na génoch, ktoré u malých detí podporujú citlivosť alebo ochranu pred respiračnými infekciami a zápalmi stredného ucha. Polymorfizmus MBL bol spojený s dlhšou symptomatológiou respiračnej infekcie, pričom počet epizód respiroinfektu za rok ovplyvnený nebol. Polymorfizmus v géne TLR8 bol spojený so zvýšeným rizikom opakujúcich sa rinovírusových infekcií, naopak v géne TLR7 ich riziko znižoval. Polymorfizmus génu TLR4 nebol spojený s akútnym zápalom stredného ucha, zatiaľ čo polymorfizmus TLR2 riziko akútneho zápalu stredoušia zvyšoval 6-násobne a súčasne viac ako 3-násobne zvyšoval riziko jeho recidívy [42].
Využitie poznatkov v praxi
Poznanie imunitných mechanizmov v strednom uchu je dôležité najmä z hľadiska potenciálneho terapeutického zacielenia, či už v liečbe akútnej alebo chronickej stredoušnej otitídy. Platí to najmä v dnešnej dobe, kedy nadužívanie antibiotík vedie k vzniku rezistentných baktérií a následnej potrebe ich vyšších terapeutických dávok a preskripcii pokročilejších generácií antibiotík. Vzhľadom k tomu je nevyhnutné hľadať ďalšie účinné preventívne a terapeutické postupy, medzi ktoré zaraďujeme napríklad aktívnu cielenú imunizáciu a nešpecifickú imunostimuláciu či imunomoduláciu. Zavedenie očkovania proti pneumokokom výrazne znížilo incidenciu akútnych stredoušných otitíd [43] a očkovanie proti Haemophilus influenzae b zaručuje kompletnú ochranu pred závažnými invazívnymi ochoreniami, ako je meningitída a znižuje tiež počet komplikácií pri bežných ORL infekciách [44]. Imunomodulácia, napr. bakteriálnymi lyzátmi a bakteriálnymi ribozómami, zvyšuje systémovú syntézu imunoglobulínov triedy IgA a IgG a tiež aktiváciu imunokompetentných buniek vrátane CD4+ lymfocytov, NK buniek či B lymfocytov [45]. Liečba bakteriálnymi lyzátmi OM-85 (orálny imunomodulátor) znížila celkový počet epizód stredoušného zápalu o 68 % po 6 mesiacoch [46] a o 79 % po 12 mesiacoch [47] oproti placebu. Tento bakteriálny lyzát z 21 bakteriálnych kmeňov pôsobí nielen na vrodenú imunitu, kde zvyšuje koncentráciu antimikrobiálnych peptidov, neutrofilov, NK buniek a uvoľňovanie antivírusových cytokínov, ale aj adaptívnu imunitu, a to zvyšovaním interakcie medzi T-bunkami a dendritickými bunkami, zvyšovaním koncentrácie cytotoxických T buniek a produkciou IFNg. Takto poskytuje ochranu pred vírusovými a bakteriálnymi infekciami, čím znižuje poškodenie tkanív. Naviac obmedzuje súčasné užívanie antibiotík, čím by sa OM-85 a podobné preparáty mohli považovať za sľubný terapeutický nástroj aj v odbore ORL [48].
Rovnako je zaujímavé, že schopnosť protilátok spustiť produkciu NET v strednom uchu môže byť kľúčová k uľahčeniu rozvoja bakteriálneho ochorenia pneumokokovou infekciou. V tomto prípade by terapeutické využitie DNázy rozkladajúcej NET mohla byť užitočným doplnkom liečby práve u detí s recidivujúcimi otitídami. Experimentálne bolo dokázané, že takáto transmyringická aplikácia DNázy do bubienkovej dutiny výrazne redukovala rast pneumokokov na myšacích modeloch, ktoré boli súčasne infikované vírusom chrípky A [49].
Taktiež sa skúmalo využitie pegylovaného interferónu-a (PEG-INF) u pacientov s eozinofílnym typom stredoušného zápalu (EOM), ktorý je primárne využívaný v liečbe vírusovej hepatitídy alebo hypereozinofilného syndrómu. Pacientom s EOM, ktorí boli refraktérni k štandardnej liečbe lokálnymi alebo celkovými kortikoidmi či liečbe anti-IgE protilátkami (omalizumab) bol aplikovaný práve PEG-IFN. Štyria z ôsmych pacientov dosiahli úplnú klinickú odpoveď s kompletným vymiznutím výtoku z uší a s normalizáciou sliznice stredného ucha. U polovice pacientov s ústupom ťažkostí sa pri prerušení liečby PEG-IFN obnovili klinické obtiaže a po obnovení terapie príznaky opäť ustúpili. Treba však zohľadniť aj výskyt významných vedľajších účinkov liečby interferónom [50]. Pilotná štúdia z r. 2019 zase naznačuje možné konzervatívne vyhojenie cholesteatómu u pacientky odmietajúcej chirurgický zákrok pri pravidelnej dlhodobej infúznej aplikácii infliximabu (monoklonálna protilátka proti TNF). Keďže existujú dôkazy, že TNF hrá dôležitú úlohu pri tvorbe cholesteatómu, protilátky namierené proti tomuto cytokínu môžu v budúcnosti predstavovať prínos v znižovaní miery recidív či chirurgických intervencií [51].
Záver
Mnohé imunitné mechanizmy sa podieľajú na vzniku, recidíve a perzistencii stredoušného zápalu. Sú popretkávané zložitou sieťou celulárnych a molekulárnych interakcií zabezpečujúcich dynamickú rovnováhu fyziologických pomerov na sliznici stredného ucha a ochranu proti patogénom. Ich jemné ladenie ovplyvňuje celý rad exogénnych a endogénnych faktorov, ktoré môžu byť rozhodujúce pre efektivitu zápalovej reakcie. Preto je nevyhnutné porozumieť úlohe vrodenej imunity v obrane proti mikroorganizmom v dutine stredného ucha a viaceré receptory nešpecifickej imunity je potrebné aj naďalej podrobne skúmať a vyhodnocovať ich potenciál ako nových terapeutických cieľov.
Prehlásenie o strete záujmu
Autorka práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohoto článku nie je v strete záujmu a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Poďakovanie
Grafická úprava obrázkov bola vykonaná s podporou nadácie Sluch ako dar.
ORCID autorov
M. Suchánková ORCID 0000-0002-5516-9845,
L. Varga ORCID 0000-0001-9141-3596.
Prijato k recenzii: 18. 3. 2021
Prijato do tlače: 20. 5. 2021
MUDr. Zuzana Hlávková
Otorinolaryngologické oddelenie
Fakultná nemocnica Trnava
A. Žarnova 11
917 75 Trnava
Sources
1. Schilder AG, Chonmaitree T, Cripps AW et al. Otitis media. Nat Rev Dis Primers 2016; 2 : 16063. Doi: 10.1038/nrdp.2016.63.
2. Principi N, Marchisio P, Rosazza C et al. Acute otitis media with spontaneous tympanic membrane perforation. Eur J Clin Microbiol Infect Dis 2017; 36 (1): 11–18. Doi: 10.1007/ s10096-016-2783-9.
3. Oh JH, Kim WJ. Interaction between allergy and middle ear infection. Curr Allergy Asthma Rep 2016; 16 (9): 66. Doi: 10.1007/s11882-016-0646-1.
4. Robb PJ, Williamson I. Otitis media with effusion. In: Scott-Brown‘s Otorhinolaryngology and Head and Neck Surgery: Volume 2: Paediatrics, The Ear, and Skull Base Surgery. Edited by Watkinson JC, Clarke RW. USA: CRC Press; 2018 : 115–135.
5. Jurovčík M, Borský J, Dytrych P et al. První příznaky sekretorické otitidy u novorozenců operovaných pro rozštěpovou vadu – záchyt v desetiletém souboru. Otorinolaryngol Foniatr 2020; 69 (2): 55–61.
6. Bhutta MF, Thornton RB, Kirkham LS et al. Understanding the aetiology and resolution of chronic otitis media from animal and human studies. Dis Model Mech 2017; 10 (11): 1289–1300. Doi: 10.1242/dmm.029983.
7. Browning CG. Condition of middle ear-classification. In: Scott-Brown‘s Otolaryngology. edn. Edited by Kerr AG. London: Arnold 2008 : 3396–3401.
8. Vanneste P, Page C. Otitis media with effusion in children: Pathophysiology, diagnosis, and treatment. A review. J Otol 2019; 14 (2): 33–39. Doi: 10.1016/j.joto.2019.01.005.
9. Chrobok V, Pellant A, Profant M. Cholesteatom spánkové kosti. Havlíčkův Brod: Tobiáš 2008.
10. McDonald DR, Levy O. Innate immunity. In: Clinical Immunology: Principles and Practice. edn. Edited by Rich RR, Fleisher TA, Shearer WT, Schroeder H, Frew AJ, Weyand CM. The Netherlands: Elsevier 2018.
11. Carrillo JLM, García FPC, Coronado OG et al. Physiology and pathology of innate immune response against pathogens. IntechOpen 2017. Doi: 10.5772/intechopen.70556.
12. Pancer Z, Cooper MD. The evolution of adaptive immunity. Annu Rev Immunol 2006; 24 : 497–518. Doi: 10.1146/annurev.immunol.24.021 605.090542.
13. Mansour S, Magnan J, Haidar H et al. Comprehensive and Clinical Anatomy of the Middle Ear. Cham: Springer 2019.
14. Leichtle A, Lai Y, Wollenberg B et al. Innate signaling in otitis media: pathogenesis and recovery. Curr Allergy Asthma Rep 2011; 11 (1): 78–84. Doi: 10.1007/s11882-010-0158-3.
15. Bartlett JA, Fischer AJ, McCray PBJ. Innate immune functions of the airway epithelium. Contrib Microbiol 2008; 15 : 147–163. Doi: 10.1159/000136349.
16. Mittal R, Kodiyan J, Gerring R et al. Role of innate immunity in the pathogenesis of otitis media. Int J Infect Dis 2014; 29 : 259–267. Doi: 10.1016/j.ijid.2014.10.015.
17. Park K, Moon SK, Choung YH et al. Expression of beta-defensins in human middle ear cholesteatoma. Acta Otolaryngol 2003; 123 (2): 236–240. Doi: 10.1080/0036554021000028102.
18. Kuchynková Z, Pácová H. Defensiny – důležitá složka přirozené imunity v obraně proti infekci. Otorinolaryngol Foniatr 2008; 57 (1): 36–39.
19. Mayer G. Immunology – chapter one innate (non-specific) immunity. [online]. Dostupné z: http: //www.microbiologybook.org/ghaffar/innate-back.htm.
20. Underwood M, Bakaletz L. Innate immunity and the role of defensins in otitis media. Curr Allergy Asthma Rep 2011; 11 (6): 499–507. Doi: 10.1007/s11882-011-0223-6.
21. Kaplan MJ, Radic M. Neutrophil extracellular traps: double-edged swords of innate immunity. J Immunol 2012; 189 (6): 2689-2695. Doi: 10.4049/jimmunol.1201719.
22. Thornton RB, Wiertsema SP, Kirkham LA et al. Neutrophil extracellular traps and bacterial biofilms in middle ear effusion of children with recurrent acute otitis media – a potential treatment target. PLoS One 2013; 8 (2): e53837. Doi: 10.1371/journal.pone.0053837
23. Val S, Poley M, Brown K et al. Proteomic characterization of middle ear fluid confirms neutrophil extracellular traps as a predominant innate immune response in chronic otitis media. PLoS One 2016; 11 (4): e0152865. Doi: 10.1371/journal.pone.0152865.
24. Jacob TM, Indrasingh I, Yadav BK et al. Langerhans cells in the human tympanic membrane in health and disease: a morphometric analysis. Otol Neurotol 2013; 34 (2): 325–330. Doi: 10.1097/MAO.0b013e31826db ce5.
25. Massa HM, Lim DJ, Kurono Y et al. Middle ear and eustachian tube mucosal immunology. Mucosal Immunology 2015 : 1923–1942. Doi: 10.1016/B978-0-12-415847-4.00101-4.
26. Paul S, Lal G. The Molecular mechanism of natural killer cells function and its importance in cancer immunotherapy. Front Immunol 2017; 8 : 1124. Doi: 10.3389/fimmu.2017.01124.
27. Kumagai Y, Akira S. Identification and functions of pattern-recognition receptors. J Allergy Clin Immunol 2010; 125 (5): 985–992. Doi: 10.1016/j.jaci.2010.01.058.
28. Kurabi A, Pak K, Ryan AF et al. Innate immunity: Orchestrating inflammation and resolution of otitis media. Curr Allergy Asthma Rep 2016; 16 (1): 6. Doi: 10.1007/s11882-015-0585-2.
29. Wigand M, Hoffmann TK, Ryan AF et al. The role of innate immunity in otitis media. HNO 2018; 66 (6): 464–471. Doi: 10.1007/s00106 - 018-0501-x.
30. Lee YW, Chung Y, Juhn SK et al. Activation of the transforming growth factor beta pathway in bacterial otitis media. Ann Otol Rhinol Laryngol 2011; 120 (3): 204–213. Doi: 10.1177/000348941112000310.
31. Kawauchi H. Mucosal regulatory system for the balanced immunity in the middle ear and nasopharynx. In: Mucosal Vaccines. Edited by Kiyono H, Pascual DW: Academic Press 2020 : 313–323.
32. Martinez I, Oliveros JC, Cuesta I et al. Apoptosis, Toll-like, RIG-I-like and NOD-like Receptors Are Pathways Jointly Induced by Diverse Respiratory Bacterial and Viral Pathogens. Front Microbiol 2017; 8 : 276. Doi: 10.3389/fmicb.2017.00276.
33. Cambi A, Koopman M, Figdor CG. How C-type lectins detect pathogens. Cell Microbiol 2005; 7 (4): 481–488. Doi: 10.1111/j.1462-5822.2005.00506.x.
34. Jung SY, Kim SS, Kim YI et al. Expression, Distribution, and Role of C-Type Lectin Receptors in the Human and Animal Middle Ear and Eustachian Tube: A Review. Molecules 2018; 23 (4). Doi: 10.3390/molecules23040734.
35. Kim SH, Han SH, Byun JY et al. Expression of C-type lectin receptor mRNA in chronic otitis media with cholesteatoma. Acta Otolaryngol 2017; 137 (6): 581–587. Doi: 10.1080/00016489. 2016.1269196.
36. Ford JW, McVicar DW. TREM and TREM - -like receptors in inflammation and disease. Curr Opin Immunol 2009; 21 (1): 38–46. Doi: 10.1016/j.coi.2009.01.009.
37. Cao C, Gu J, Zhang J. Soluble triggering receptor expressed on myeloid cell-1 (sTREM-1): a potential biomarker for the diagnosis of infectious diseases. Front Med 2017; 11 (2): 169–177. Doi: 10.1007/s11684-017-0505-z.
38. Nguyen AH, Berim IG, Agrawal DK. Chronic inflammation and cancer: emerging roles of triggering receptors expressed on myeloid cells. Expert Rev Clin Immunol 2015; 11 (7): 849–857. Doi: 10.1586/1744666X.2015.1043893.
39. Mittal R, Robalino G, Gerring R et al. Immunity genes and susceptibility to otitis media: a comprehensive review. J Genet Genomics 2014; 41 (11): 567–581. Doi: 10.1016/j.jgg.2014. 10.003.
40. Carroll SR, Zald PB, Soler ZM et al. Innate immunity gene single nucleotide polymorphisms and otitis media. Int J Pediatr Otorhinolaryngol 2012; 76 (7): 976–979. Doi: 10.1016/j.ijporl.2012.03.011.
41. Emonts M, Veenhoven RH, Wiertsema SP et al. Genetic polymorphisms in immunoresponse genes TNFA, IL6, IL10, and TLR4 are associated with recurrent acute otitis media. Pediatrics 2007; 120 (4): 814–823. Doi: 10.1542/peds.2007-0524.
42. Toivonen L, Vuononvirta J, Mertsola J et al. Polymorphisms of mannose-binding lectin and toll-like receptors 2, 3, 4, 7 and 8 and the risk of respiratory infections and acute otitis media in children. Pediatr Infect Dis J 2017; 36 (5): e114–e122. Doi: 10.1097/INF.0000000000001479.
43. Kaur R, Morris M, Pichichero ME. Epidemiology of acute otitis media in the postpneumococcal conjugate vaccine era. Pediatrics 2017; 140 (3). Doi: 10.1542/peds.2017-0181.
44. Forstová G, Šlapák I. Podíl Haemophilus influenzae b na akutních zánětech středouší a meningitidách otogenního původu u dětí po zavedení očkování antihemofilovou vakcínou. Otorinolaryngol Foniatr 2015; 64 (1): 8–12.
45. Feleszko W, Marengo R, Vieira AS et al. Immunity-targeted approaches to the management of chronic and recurrent upper respiratory tract disorders in children. Clin Otolaryngol 2019; 44 (4): 502–510. Doi: 10.1111/coa.13335.
46. Jara-Perez JV, Berber A. Primary prevention of acute respiratory tract infections in children using a bacterial immunostimulant: a double-masked, placebo-controlled clinical trial. Clin Ther 2000; 22 (6): 748–759. Doi: 10.1016/S0149-2918 (00) 90008-0.
47. Gutierrez-Tarango MD, Berber A. Safety and efficacy of two courses of OM-85 BV in the prevention of respiratory tract infections in children during 12 months. Chest 2001; 119 (6): 1742–1748. Doi: 10.1378/chest.119.6. 1742.
48. Marengo R, Ortega Martell JA, Esposito S. Paediatric Recurrent Ear, Nose and Throat Infections and Complications: Can We Do More? Infect Dis Ther 2020; 9 (2): 275–290. Doi: 10.1007/s40121-020-00289-3.
49. Short KR, von Kockritz-Blickwede M, Langereis JD et al. Antibodies mediate formation of neutrophil extracellular traps in the middle ear and facilitate secondary pneumococcal otitis media. Infect Immun 2014; 82 (1): 364–370. Doi: 10.1128/IAI.01104-13.
50. Neff BA, Voss SG, Carlson ML et al. Treatment of eosinophilic otitis media with pegylated interferon-alpha 2a and 2b. Laryngoscope 2017; 127 (5): 1208–1216. Doi: 10.1002/lary.26303.
51. Chao J, Dewyer N, McKenna MJ. Spontaneous Resolution of Cholesteatoma in a Patient on Long-Term Infliximab. Ann Otol Rhinol Laryngol 2019; 128 (4): 365–368. Doi: 10.1177/0003489418823790.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics
2022 Issue 1-
All articles in this issue
- Editorial
- Efekt chirurgické terapie syndromu obstrukční spánkové apnoe na výši tlaků na Positive Airway Pressure (PAP) – první výsledky
- Mikroprostředí spinocelulárního karcinomu hlavy a krku jako analogie hojící se rány
- Vrodená (nešpecifická) imunita stredného ucha a jej úloha pri stredoušnej otitíde
- Koincidence bilaterálního Warthinova tumoru příušních žláz a epitelio-myoepiteliálního karcinomu parafaryngu
- Inflamatorní myofibroblastický tumor v otorinolaryngologii
- Izolovaná lézia n. hypoglossus ako dôsledok aneuryzmy arteria carotis interna – kazuistika
- Jubileum prof. MUDr. Milana Profanta, CSc.
- Životní jubileum doc. MUDr. Jaroslava Slípky, CSc.
- Odešel doc. MUDr. František Šram, CSc.
- Doc. MUDr. Zdeněk Kasl, CSc., odešel
- Otochirurgický workshop v Kajetanoch
- Správa z Open Medical Institute (OMI) – Salzburg Weill Cornell seminára otológie a chirurgie spánkovej kosti
- Vyjádření k válce na Ukrajině
- Historie ORL – 100 let
- ENT bodies stand up for Ukraine STATEMENTS IN FULL
- Adaptace a validace české verze dotazníku pro hodnocení příznaků nosní obstrukce (NOSE-cz)
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Izolovaná lézia n. hypoglossus ako dôsledok aneuryzmy arteria carotis interna – kazuistika
- Adaptace a validace české verze dotazníku pro hodnocení příznaků nosní obstrukce (NOSE-cz)
- Mikroprostředí spinocelulárního karcinomu hlavy a krku jako analogie hojící se rány
- Inflamatorní myofibroblastický tumor v otorinolaryngologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

