-
Medical journals
- Career
Narůstající incidence HPV pozitivních orofaryngeálních karcinomů
: H. Binková 1; Z. Horáková 1; R. Kostřica 1; K. Veselý 2
: Klinika otorinolaryngologie a chirurgie hlavy a krku LF MU a FN u svaté Anny v Brně 1; I. patologicko-anatomický ústav LF MU a FN u svaté Anny v Brně 2
: Otorinolaryngol Foniatr, 64, 2015, No. 4, pp. 205-212.
: Review Article
Výskyt nádorů hlavy a krku má všeobecně stagnující až mírně klesající charakter, což je připisováno zejména klesající prevalenci kouření. Tento trend ale neplatí pro orofaryngeální karcinomy (OFK), jejichž incidence naopak rapidně vzrůstá, v České republice je nyní 3x vyšší než před 30 lety. Tento nárůst má přímou souvislost s rozrůstající se skupinou OFK (45-95 %), které vznikají na podkladě infekce lidským papilomavirem (HPV). HPV pozitivní OFK představují etiologicky, epidemiologicky i klinicky odlišnou identitu nemocných, pro kterou je charakteristické postižení věkově mladších jedinců, lepší odpověď na léčbu a výrazně lepší prognóza. Léčebné standardy prozatím HPV status nezohledňují, nicméně probíhá intenzivní výzkum zaměřený na možnou deintenzifikaci léčby HPV pozitivních OFK s cílem omezit mutilující následky radikální chirurgické i konzervativní onkologické léčby. Rovněž se zkoumá možnost preventivní vakcinace dospívajících mladých mužů a žen. Na rozdíl od cervikálního karcinomu, kde preventivní programy přinášejí ve světě již výsledky ve formě klesající incidence, virové etiologii nádorů mandlí a kořene jazyka, se věnuje v tomto směru jen malá pozornost. V osvětě by měl být kladen důraz na nejrizikovější faktory infekce, a s tím spojený zodpovědnější přístup při výběru sexuálních partnerů zejména pro orogenitální sex a také na preventivní očkování.
Klíčová slova:
orofaryngeální karcinom, HPV infekce, orální sex, prognóza, prevenceÚVOD
Spinocelulární karcinomy hlavy a krku představují ve světě šestou nejrozšířenější skupinu nádorových onemocnění, orální a OFK se podílejí na 3–5 % malignit v Evropě. Většina nádorů hlavy a krku je asociována se známými rizikovými faktory jako jsou kouření, abúzus alkoholu, žvýkání betelu (37). Karcinomy hlavy a krku jsou heterogenní skupinou, léčba a prognóza závisí především na lokalizaci primárního nádoru a stadiu onemocnění. Díky nespecifické symptomatologii prvních příznaků je, bohužel, většina nádorů diagnostikována až ve formě lokálně pokročilého onemocnění, nezřídka s přítomností krčních lymfatických metastáz, což se odráží i v nepříznivých prognostických ukazatelích. Výskyt nádorů hlavy a krku má všeobecně stagnující až mírně klesající charakter, což je připisováno zejména klesající prevalenci kouření (47). Tento trend ale neplatí pro OFK, jejichž incidence naopak rapidně vzrůstá, a to zejména v mladších věkových skupinách. V České republice počet nově diagnostikovaných nádorů orofaryngu během posledních 30 let narostl trojnásobně, v roce 2010 byla incidence tohoto onemocnění u nás 5 případů/100 000 obyvatel za rok (7). Dnes je již jasné, že za tímto nárůstem stojí rozrůstající se skupina OFK, které mají souvislost s virovou infekcí HPV (11). Podskupina HPV pozitivních OFK představuje etiologicky, epidemiologicky i klinicky odlišnou identitu nemocných, pro kterou je charakteristická lepší odpověď na léčbu a výrazně lepší prognóza (9).
Lidský papilomavirus a jeho úloha v kancerogenezi
HPV byl poprvé identifikován v roce 1949, dnes je známo více než 130 různých typů tohoto malého DNA viru. Replikuje se výlučně v kůži a sliznicích (genitálie, anus, ústní dutina, dýchací cesty) a je druhově nepřenosný. Virus je vysoce nakažlivý, na kůži a sliznicích může infekce způsobit různé afekce podle typu viru. Většina virů je naštěstí tzv. low-risk HPV, jež jsou příčinou různých benigních lézí charakteru bradavic (typ 2, 3, 7, 10), kondylomat a laryngeálních papilomů (typ 6, 11). Z 15 high-risk HPV (HR) se v etiopatogenezi OFK uplatňují především typy HPV 16 a 33, nejrozšířenější je jednoznačně HPV 16, který je detekován u 90-95 % HPV pozitivních OFK (27). Po expozici většina nakažených dokáže infekci eliminovat během 1-2 roků, u části jedinců však může virus v buňkách přetrvávat a perzistentní infekce je rizikovým faktorem pro vznik a progresi onemocnění. Integrace virového genomu HR typů do genomu hostitele vede ke zvýšené expresi E6 a E7 proteinů, které inaktivují nádorově supresorové geny p53 a pRb, aktivují enzym telomerázu a vyvolávají řadu dalších změn, které stimulují přechod buňky do S-fáze buněčného cyklu a vedou k replikaci. Buňka permanentně infikovaná HPV tak prochází sérií buněčných dělení a není schopna reagovat apoptózou na mutační změny. HR HPV produkují velmi málo virových proteinů, nevyvolávají virémii a nelyzují infikované buňky. Proto jsou pro imunitní systém téměř neviditelné. Mimo to disponují řadou mechanismů, které aktivně inhibují imunitní systém hostitele. Není zatím zcela jisté, zda mechanismus kancerogeneze ověřený u cervikálních karcinomů je identický i pro HPV asociované nádory hlavy a krku (14, 40).
Virus se replikuje výlučně v bazálních vrstvách epitelu kůže a sliznic, k virémii s rozsevem na vzdálená místa nedochází. V anogenitální oblasti low grade intraepiteliální léze dlaždicového epitelu v naprosté většině případů spontánně regredují nebo dlouhodobě stagnují. Jen u 10 % z nich dochází k progresi v high grade lézi a jen 0,15 % progredují v invazivní karcinom, a to po více než 10 letech od primární infekce. Nejzávažnější je perzistence viru HPV 16, jenž uniká imunitnímu dozoru. U nádorů hlavy a krku je výskyt HR HPV nejvyšší u nádorů orofaryngu, a to zejména tonzil. Invaginované záhyby tonzilárních krypt jsou zřejmě ideálním prostředím pro replikaci viru, vliv na replikaci viru mohou mít i cytokiny produkované lymfatickou tkání, v hlubokých rozvlákněných kryptách může být snazší přístup viru k bazálním buňkám (24).
EPIDEMIOLOGIE
Incidence OFK ve světě je podobně jako i u jiných lokalizací nádorů v ORL oblasti rozdílná. Například v Číně je obecně výskyt tonzilárních karcinomů poměrně nízký, v Pekingu u mužů 0,1 případ/100 000 obyvatel /rok, naproti tomu v Hong Kongu a na Taiwanu, místech s výrazným západním vlivem, je incidence 6–12x vyšší. Mezinárodní rozdíly jsou výrazné i v Evropě, nejvyšší počty jsou zaznamenávány ve Francii, kde je incidence u mužů uváděna 6,4 a u žen 0,8 případů/100 000 obyvatel /rok (42). Ve většině zemí je postižení mužů vyšší než žen, poměr je zhruba 2 : 1 až 5 : 1. Incidence OFK ve většině západních zemí v posledních 20 letech dramaticky vzrostla, zejména u mužů. Současně narůstala podobným způsobem i prevalence HPV v těchto tumorech (15). HPV je dnes identifikován u 45-95 % OFK (48) a prevalence HPV 16 v OFK je v celém světě vcelku obdobná (17).
Rizikové faktory HPV asociovaných OFK
Na rozdíl od HPV asociovaných cervikálních karcinomů, kde byl přenos sexuálním stykem jasně potvrzen, rizikové faktory pro orální HPV infekci a mechanismy přenosu nejsou dnes ještě detailně jasné. Orální HPV infekce u novorozenců vertikálně infikovaných matkou v těhotenství nebo při porodu je vzácná, podobně i u dětí před zahájením sexuálního života (průměrně 1,9% prevalence). Prevalence stoupá rychle zejména v prvních letech po zahájení sexuálního života, u zdravých dospělých je pak zhruba 4,5 % rovnocenně u mužů a žen (26). Co je příčinou perzistence infekce u některých jedinců je v současnosti stále předmětem výzkumů. Nejrizikovějším pro získání infekce se zdá rizikové sexuální chování - orogenitální sexuální praktiky a promiskuitní styl života. Podle americké studie případů a kontrol (6) riziko HPV asociovaného OFK významně narůstá při vyšším počtu sexuálních partnerů, zejména pak při orálním sexu nebo sexuálním kontaktu s náhodným partnerem. Riziko je vyšší u mladých lidí začínajících s pohlavním životem ve věku pod 18 let a při výjimečně používaném kondomu (tab. 1). Spojitost výskytu HPV pozitivních OFK s rizikovým sexuálním chováním potvrdila i rozsáhlá mezinárodní epidemiologická studie, na které participovali zástupci všech kontinentů (16). Česká studie z roku 2005 vazbu na počet životních sexuálních partnerů ani orogenitální sexuální praktiky neprokázala, vyšší incidenci mezi nekuřáky a abstinenty potvrdila (48). Zda je možný přenos i náhodným dotykem či polibkem, není zatím zcela zřejmé, v jedné menší studii hluboké francouzské polibky byly spojeny s vyšší orální HPV prevalencí (5). Přenos krví je nepravděpodobný, vzhledem k tomu, že virémie v průběhu infekce HPV je vzácná. Nejběžnější způsob přenosu je kontakt kůže a sliznice s penisem, šourkem, pochvou, vulvou nebo řitním otvorem infikované osoby. Použití kondomu nezaručuje bezpečnou ochranu, virus může být na kůži nekryté kondomem. Vyšší výskyt HPV pozitivních OFK u mladších jedinců lze pravděpodobně přičíst na vrub změnám v sexuálních praktikách u mladších generací. Zda lze výrazně vyšší incidenci HPV pozitivních OFK u mužů také vysvětlit odlišnostmi v sexuálním chování mužů a žen, nebo je tato vyšší zátěž způsobena biologickými rozdíly v působení viru na obě pohlaví, je prozatím otázkou (35).
1. Rizikové faktory HPV pozitivních OFK ( zpracováno podle D'Souza, NEJM, 2007). 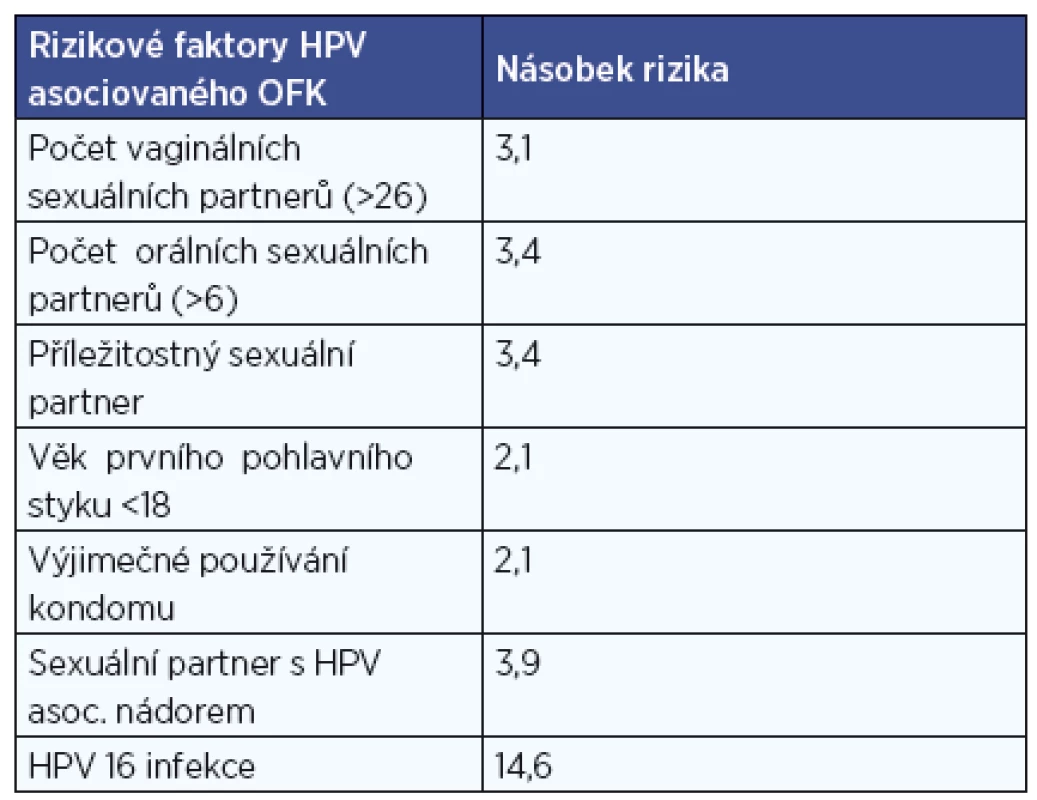
Dalšími rizikovými faktory životního stylu, kterým je věnována pozornost, jsou špatná ústní hygiena a abúzus marihuany, jedna z nových studií prokázala, že riziko HPV pozitivního karcinomu hlavy a krku narůstá s narůstajícím abúzem marihuany, zatímco korelace s ústní hygienou se neprokázala (10). Rozvoj nádoru by ale nemusel být důsledkem samotného kouření marihuany, jiná studie předpokládá, že by mohlo jít spíše o důsledek vzájemného sdílení cigaret mezi kuřáky, a s tím souvisejícím přenosem orální HPV infekce (51). Otázka, zda kouření a alkohol zvyšují riziko HPV pozitivního nádoru není zcela jednoznačná, některé studie vyšší riziko nepotvrdily (6, 10), jiné souvislost našly (45). Nízké zastoupení kuřáků mezi HPV asociovanými OFK oproti HPV negativním představuje nejvýznamnější demografický rozdíl potvrzený v case–case studiích (6, 11). Zvýšené riziko pro vznik OFK souvisí zřejmě také s imunosupresí. Nedávná studie ukázala, že u HIV pozitivních jedinců jsou onemocnění ústní dutiny, souvisejících s HPV, častější, a to i navzdory široce aplikované antiretrovirové terapii (41).
Detekce
Ačkoliv status HPV prozatím nemá vliv na léčbu OFK, HPV testování se pomalu stává standardem většiny pracovišť. Metody detekce HPV infekce lze rozdělit podle principu na přímé, které prokazují infekční agens v postižených buňkách tkáňových vzorků, a nepřímé, prokazující HPV infekci z charakteristických změn, které virus vyvolává v infikovaném organismu. Nejpoužívanější přímou metodou detekce HPV DNA v klinických vzorcích jsou amplifikační PCR testy. Metody PCR jsou extrémně citlivé, což může ale vést k falešně pozitivním výsledkům podmíněným tranzitorní infekcí nebo kontaminaci při zpracování bloku (27). PCR na bázi detekce HPV E6 mRNA v zmrazených vzorcích je dnes považován za zlatý standard pro diagnostiku onkologicky relevantní HPV infekce. Detekce exprese virových onkogenů pomocí reverzní transkripce a následné PCR by měla poskytovat důkaz transformační aktivity HR HPV a v lézi prokázat pouze infekci, která je v etiologickém vztahu k nádoru. Bohužel, toto vyšetření není běžně dostupné v patologických laboratořích, navíc neumožňuje spolehlivou detekci z archivního histologického materiálu pro účely retrospektivních studií (35). Metoda vyžaduje kvalitní mRNA, kterou je obvykle možné extrahovat pouze z čerstvého zamraženého materiálu a/nebo v prostředí s RNA inhibitory. In situ hybridizace s použitím specifických HPV sond umožňuje přímou vizualizaci HPV ve vzorcích tkání (obr. 1). V obarveném řezu lze rozpoznat, zda je DNA HPV integrovaná do genomu, nebo se vyskytuje pouze v episomální formě (4). Nevýhodou je ale nižší senzitivita metody. Z nepřímých metod je nejběžnější imunohistochemické stanovení zvýšené exprese proteinu p16, které dominuje jako hlavní detekční metoda především na pracovištích patologie (obr. 2). Za normálních podmínek je v buňce exprimován v množství nezjistitelném pomocí imunohistochemie, při narušení funkce proteinů p53 a pRb, např. virovými onkoproteiny E6 a E7, dochází k imunohistochemicky prokazatelné zvýšené expresi tohoto proteinu (29). Protein je senzitivním, ale nikoliv zcela specifickým ukazatelem aktivní replikace HR HPV. Výsledky je proto třeba brát s obezřetností a doporučuje se ověřit je další metodou. Serologickým vyšetřením lze nepřímo stanovit protilátky proti proteinům E6 a E7, které jsou známkou invazivního karcinomu asociovaného s HPV, vyšetření je vysoce specifické, ale citlivost detekce vlastního invazivního karcinomu je poměrně nízká.
1. Pozitivní (hnědé zbarvení v buněčných jádrech) chromogenní in situ hybridizace (CISH) s probami proti HPV DNA různých typů, původní zvětšení 400x (PAÚ FN u svaté Anny, Brno). 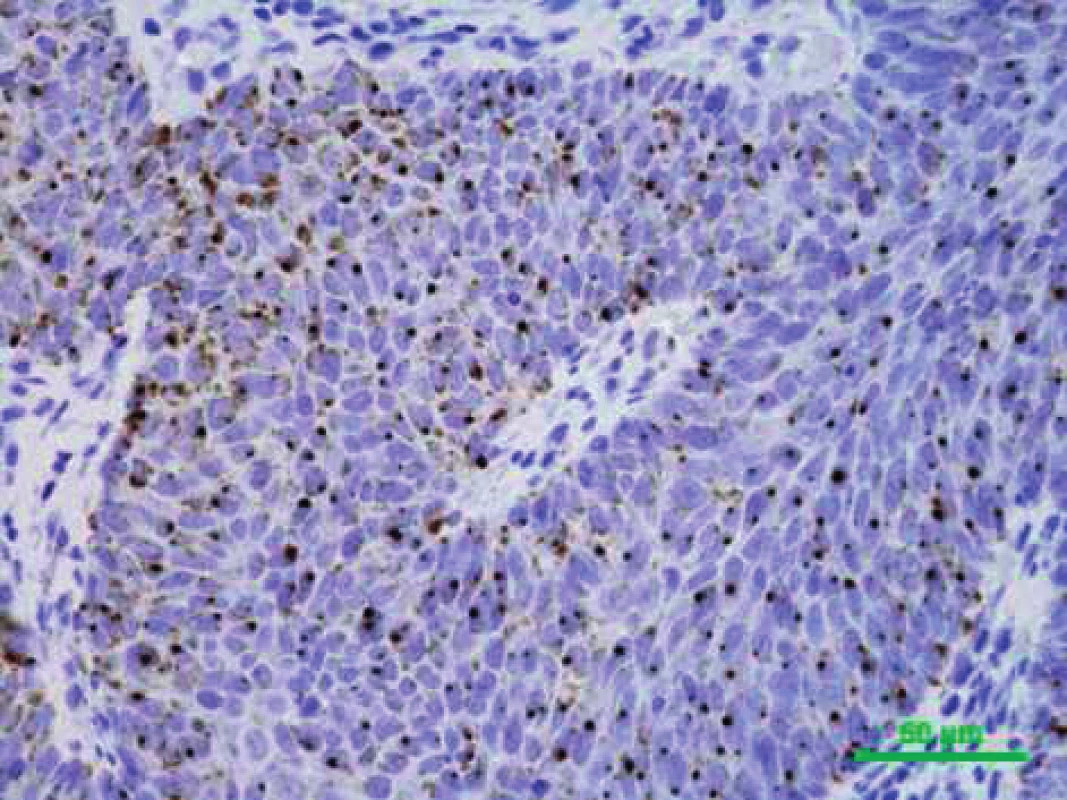
2. Imunohistochemicky p16 pozitivní (hnědé zbarvení) dlaždicový karcinom, původní zvětšení 200x (PAÚ FN u svaté Anny, Brno). 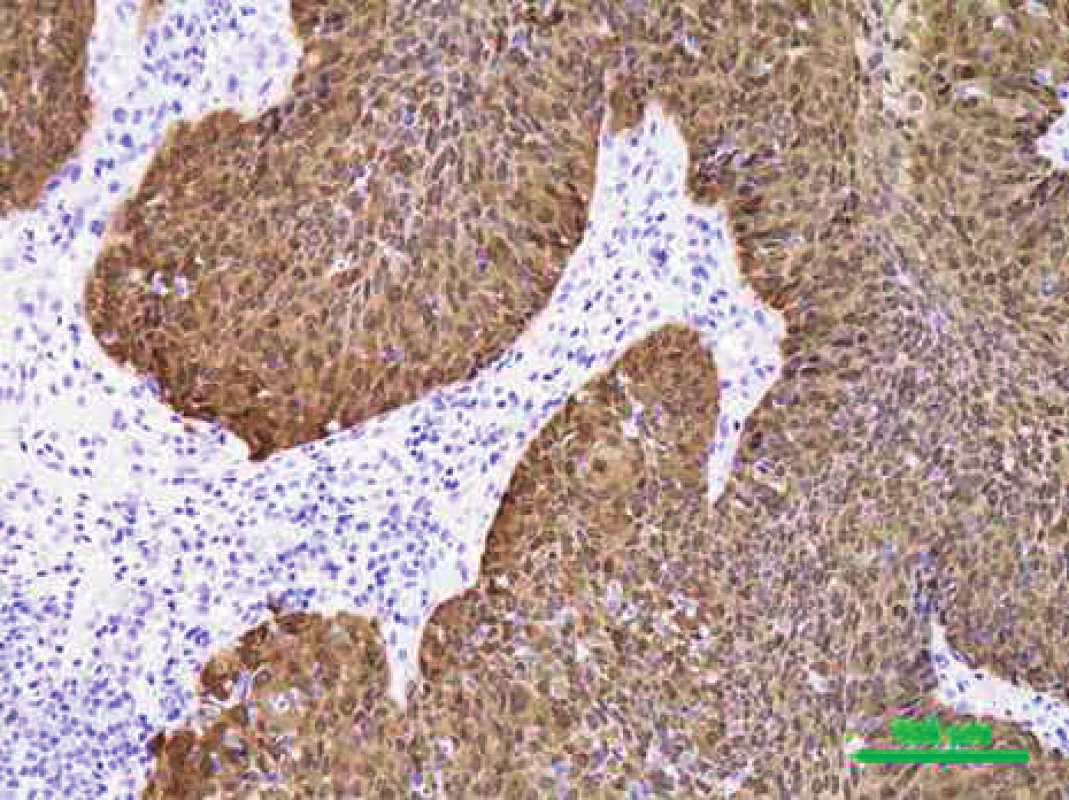
Jednotný konsenzus algoritmu vyšetření pro stanovení statusu HPV prozatím není. Na základě dostupných znalostí přítomnost HPV DNA v tkáňových biopsiích není vždy dostačujícím potvrzením kauzálního vlivu HPV infekce na vznik OFK, zejména pak u pacientů s anamnestickou expozicí alkoholu a tabáku. Vzorky nádorů s nízkým zatížením HPV DNA jsou často negativní v E6 / E7 projevu. Řešením je používání testů s vhodnou citlivostí pro detekci DNA (tedy ne příliš vysokou) a/nebo kombinace různých testů (21, 23). Detekovaná HPV DNA potvrzená pozitivitou p16 je vhodná pro testování vzorků z formaldehydu nebo parafinu, zatímco detekce mRNA zůstává zlatým standardem pro čerstvé vzorky. Imunohistochemická detekce proteinu p16 a/nebo serologická detekce protilátek proti virovým onkoproteinům E6 a E7 jsou v kombinaci s PCR detekcí HPV DNA ve tkáni nádoru také dostatečně senzitivní a specifické metody ke stanovení kauzálního vztahu HPV infekce k nádorovému onemocnění (43).
HPV A NÁDORY HLAVY A KRKU
Jednoznačně nejrozšířenější malignitou asociovanou s HPV infekcí je karcinom děložního hrdla. Na možnou souvislost HPV infekce s rozvojem orálního karcinomu poprvé upozornil Syrjänen už v roce 1983, zvýšená pozornost se ale tomuto tématu začala věnovat až v posledních 10-15 letech, v roce 2007 byl HPV uznán WHO jako jeden z příčinných faktorů rozvoje orálních karcinomů (18). Rozdílná etiologie vzniku karcinomu je příčinou, že podskupina HPV pozitivních nemocných je odlišná epidemologicky i klinickopatologicky od HPV negativních. Na rozdíl od nich nejsou etiologicky tyto nádory spojovány s abúzem alkoholu a kouřením, ale s rizikovým sexuálním chováním. Častěji se vyskytují o osob mladšího věku (50), nejvyšší zastoupení mají v oblasti hlavy a krku mezi karcinomy patrových tonzil a kořene jazyka (obr. 3, obr. 4) (44). Nemocní jsou většinou v lepším celkovém zdravotním stavu (10, 19). Imunohistochemické stanovení markerů obvykle u HPV pozitivních prokáže intaktní p53, zvýšenou expresi proteinu p16, minimální procento mutací. Naproti tomu pro druhou skupinu jsou četné mutace v genomu typické, především u p53, cyklin D1, EGFR (epidermální růstový faktor). Mikroskopicky jsou HPV pozitivní OFK často nízce diferencované, nekeretinizující, typický je basaloidní typ (50). Pro obě skupiny nádorů je, bohužel, typické, že jsou většinou diagnostikovány až ve stadiu pokročilého onemocnění. U HPV pozitivních karcinomů je to většinou kvůli časté přítomnosti velkých krčních lymfatických metastáz (obr. 5) při poměrně malém primárním nádoru (T1-T2) (30). Často se jedná o cysticky změněné metastázy (12), což může být pro klinika určitým vodítkem při hledání okultního primárního nádoru, aby zaměřil svoji pozornost právě na oblast orofaryngu, popřípadě nechal cytologický nebo histologický vzorek uzliny vyšetřit na HPV. Přehled rozdílných charakteristik HPV pozitivních a negativních nádorů je obsahem tabulky 2.
3. Karcinom předního patrového oblouku a horního pólu levé tonzily c T1 (KOCHHK FN u svaté Anny, Brno). 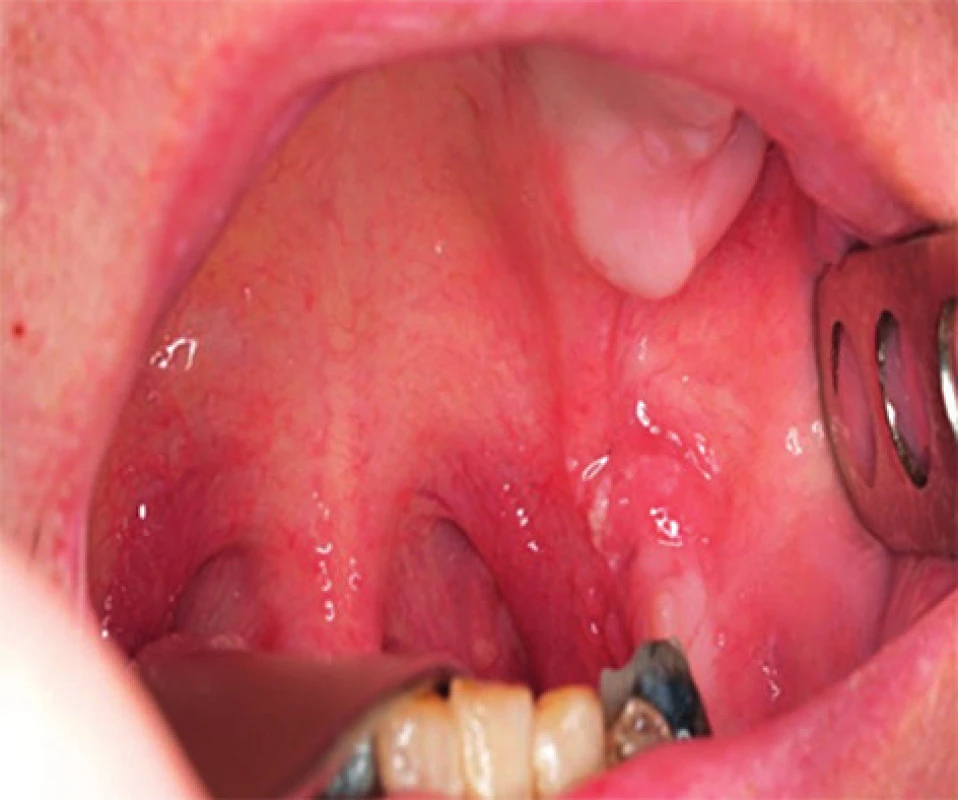
4. Karcinom levé tonzily prorůstající do parafaryngeálního prostoru cT3 (KOCHHK FN u svaté Anny, Brno). 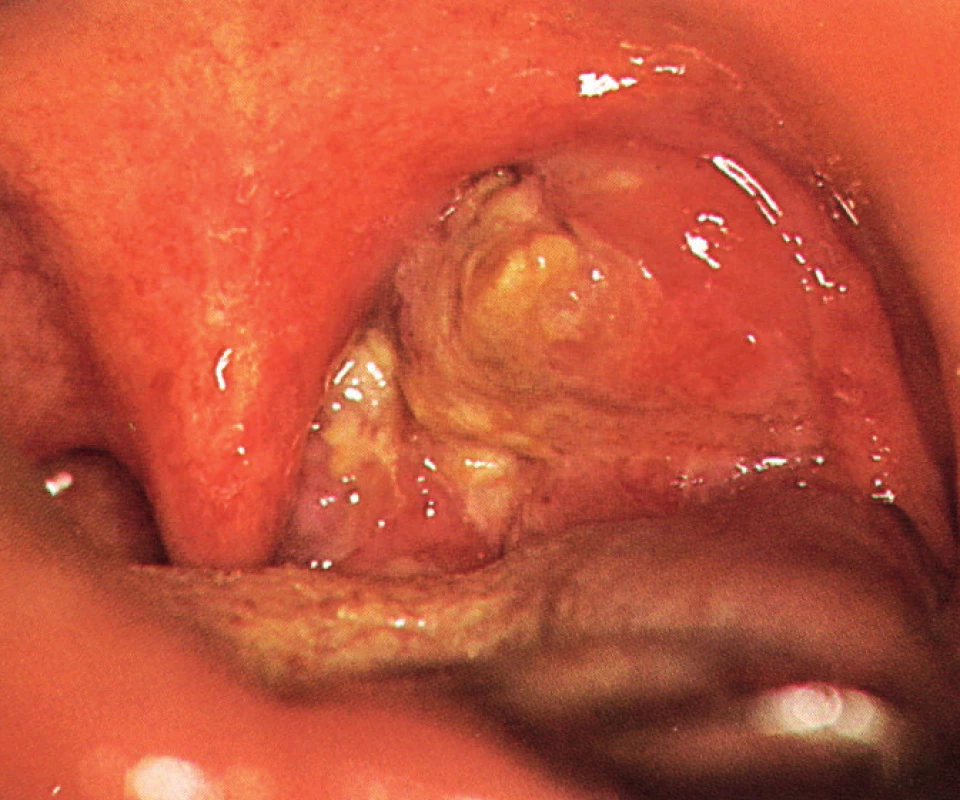
2. Hlavní rozdíly mezi HPV pozitivními a negativními OFK. 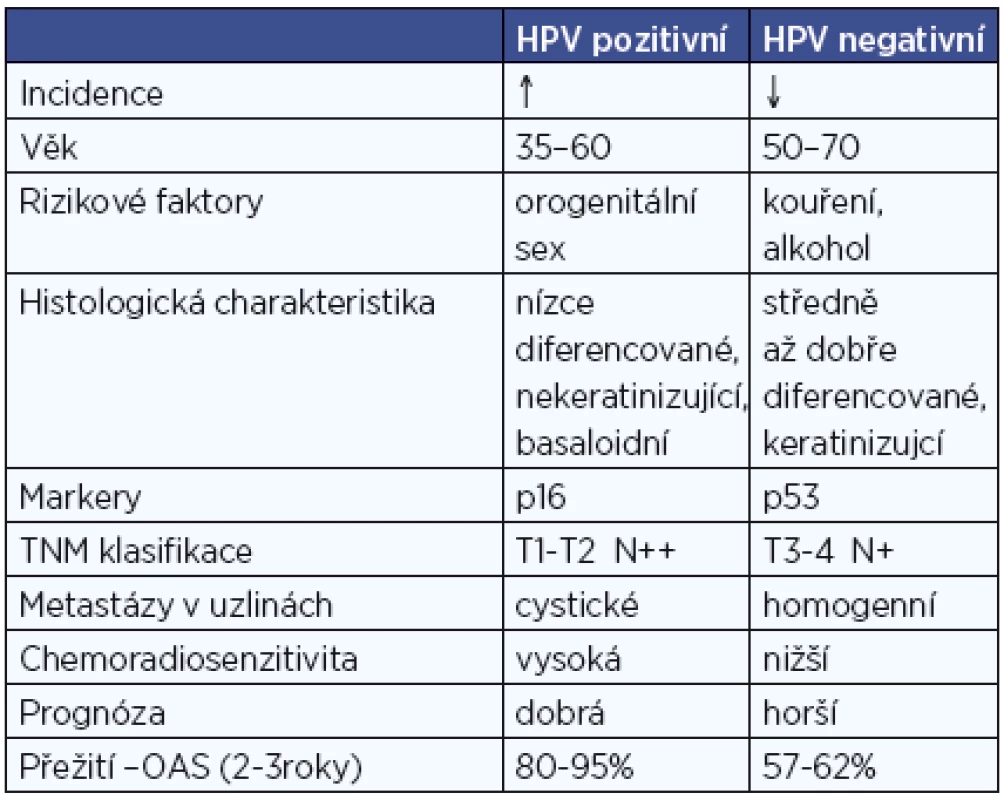
5. Krční lymfatická metastáza OFK (KOCHHK FN u svaté Anny, Brno). 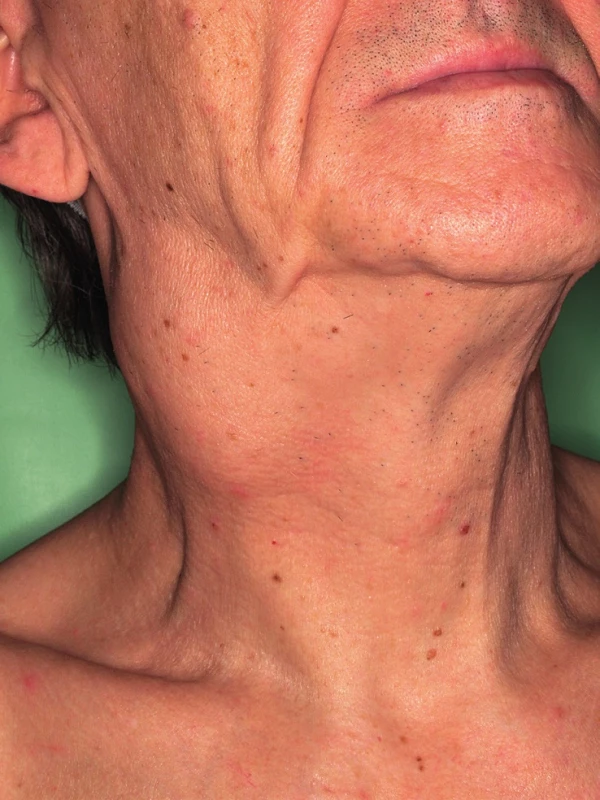
Prognóza a terapie HPV pozitivních OFK
HPV pozitivní OFK mají vzhledem k jiné patogenezi odlišné klinické chování od HPV negativních karcinomů. Mnoho studií z posledních let ukázalo, že jejich prognóza je výrazně lepší nezávisle na věku, pohlaví, stadiu, postižení uzlin, diferenciaci (9). Metastatické postižení krčních uzlin je jedním z nejvýznamnějších negativních prognostických faktorů u většiny nádorů hlavy a krku, nicméně v predikci výsledků HPV pozitivních nemocných je mnohem méně důležité (22). Vícero studií prokázalo, že jejich 2-3leté přežití je zhruba 80-95% ve srovnání s 57-62% ve skupině HPV negativních OFK (1, 2, 9). Zdá se, že prognostická výhoda HPV pozitivity není vázána na typ léčby, lepší prognostické ukazatele této skupiny ukázala řada studií jak u chirurgické léčby (30, 31), tak u léčby zářením nebo konkomitantní chemoradioterapií (9). Někteří lepší prognózu přičítají statisticky významně nižší expozici alkoholu a kouření a lepšímu celkovému stavu s minimem komorbidit ve skupině HPV asociovaných tumorů. Většinou se ale tento fenomén spojuje s vyšší radio a chemosenzitivitou těchto tumorů. Díky alespoň malému množstvím funkční p53 zajišťující apoptózu a minimalizující chromozomální aberace si tak zachovávající citlivost vůči radio a chemoterapii (36). Další možností jsou imunologické faktory související s HPV infekcí (46).
I když je stále nejasné, zda je kouření rizikovým faktorem pro indukci HPV pozitivních OFK (6, 10, 45), je zřejmé, že kouření má negativní dopad na relaps a přežití těchto nemocných (1, 13).
Léčba nádorů hlavy a krku se dnes řídí standardy v závislosti na stadiu onemocnění. Léčba pacientů s pokročilým onemocněním zahrnuje většinou kombinovanou léčbu onkologickou a chirurgickou, přičemž obě mohou být provázeny akutními i chronickými komplikacemi a vést k celoživotní mutilaci a následkům. Zintenzivněním onkologické léčby v posledních desetiletích se sice obecně zlepšily výsledky léčby pacientů s nádory hlavy a krku, současně ale výrazně narostla morbidita provázející takto intenzivní léčbu (3, 33). Prozatím byly limitujícími faktory pro maximálně intenzivní léčbu zejména významné komorbidity a celkový stav nemocného.
Dnes se zdá, že minimálně u OFK by status HPV mohl být činitelem ovlivňujícím intenzitu léčby. Předmětem výzkumu v posledních letech je otázka, zda by u této skupiny nádorů nebyla vhodná deintenzifikace léčby, která by snížila negativní dopady léčby při zajištění stejně příznivého přežití (34, 38, 49).
Možností jak deeskalovat léčbu HPV pozitivních nemocných se nabízí několik, při konkomitanci s radioterapií nahrazení chemoterapie biologickou léčbou nebo její úplné vynechání, aplikace nižší dávky radioterapie, preference nechirurgické léčby (zejména u zákroků, které znamenají značnou mutilaci nemocného jako resekce kořene jazyka nebo bukofaryngektomie). Je zřejmé, že deintenzifikace léčby nebude vhodná pro všechny HPV pozitivní pacienty, protože i mezi těmito pacienty je menší podskupina, jejíž klinické výsledky jsou horší, hůře reagují na léčbu a mají vyšší riziko rekurence (1). Studiově testovaný návrh nového stagingového systému pro HPV asociované OFK zohledňuje kromě TNM také kouření (39). Zkoumá se, zda známé markery (p16, p53, cyklin D1, EGFR a p21) mohou být významné pro predikci prognózy a napomoci tak selekci vhodných pacientů pro optimální léčbu. Vzhledem k vyššímu riziku vzdálených metastáz u uzlinového nálezu vyššího než N2b, nebude redukovaná léčba patrně vhodná pro nemocné s tímto uzlinovým postižením (38).
PREVENCE
U děložního hrdla jsou řadu let prekancerózní změny přístupné detekci a návazné léčbě. U OFK se sice cytologie ukázala jako užitečná pro detekci invazivního karcinomu (8), nicméně neexistují žádné screeningové programy pro detekci prekanceróz v oblasti hlavy a krku. OFK se obvykle vyvíjejí bez klinicky zjistitelné přednádorové léze. Detekce HPV v ústní dutině a orofaryngu pravděpodobně také nebude pro časnou diagnostiku nádoru nebo jeho rekurenci příliš přínosná (25). Perspektivnější se v tomto směru recentně ukazuje být spíše vyšetření protilátek specifických pro HPV onkoprotein E6, které byly detekovány více než 10 let před vznikem nádoru (28).
Fakt, že potenciál sekundární prevence je prozatím u OFK minimální, zvýrazňuje význam primární prevence cestou profylaktické vakcinace, pokud se ukáže jako účinná a náklady s ní spojené efektivní. Vývoji vakcín se v posledních letech věnuje maximální pozornost. Zatímco terapeutické vakcíny jsou stále předmětem experimentů a prozatím nepřinesly významnější efekt nemocným, profylaktické vakcíny v prevenci cervikálního karcinomu již do běžné praxe zavedené byly a přinášejí první výsledky.
K dispozici jsou 2 vakcíny – kvadrivalentní Silgard, chránící nejen proti HR HPV 16 a 18, ale i proti původcům kondylomat (HPV 6,11). Očkování bylo zahájeno v roce 2006 a je doporučováno ženám od 9 do 26 let, nejvyšší ochranu poskytuje dívkám, které byly očkovány před zahájením sexuálního života. Od roku 2009 byla indikace rozšířena i o očkování chlapců jako prevence nejčastějšího virového sexuálně přenosného onemocnění – kondylomat a také rakoviny anální oblasti (80), doporučuje se očkování maximálně do věku 21 let. Ochranu proti genitálním bradavicím neposkytuje bivalentní vakcína Cervivax (HPV 16,18). Profylaktická vakcína obsahuje HPV 16 virový kapsidový protein, ne DNA viru, je bezpečná a dobře tolerovaná. Má předejít perzistující HPV 16 infekci, která je riziková. Klinické studie prokázaly vysokou účinnost vakcín (vyšší než 98%) v prevenci anogenitální rakoviny pokud se jedinci dosud s virem nesetkali, pokud již infekce proběhla, pak je účinnost nižší (50–78%) (32). Vzhledem k tomu, že HPV 16 je odpovědná až za 94 % HPV pozitivních OFK, dá se předpokládat, že by vakcinace byla vysoce účinná i v prevenci OFK, nicméně tento předpoklad nebyl ještě studiemi potvrzen.
BUDOUCNOST
Masivní nárůst výskytu OFK indukovaných HPV infekcí v posledních dvou dekádách je alarmující. Pokud bude tento trend pokračovat, mohly by OFK během 10-15 let tvořit až polovinu všech nádorů hlavy a krku (20). Jak již bylo zmíněno v předchozích kapitolách, ve zkoumání HPV asociovaných nádorů hlavy a krku stále zůstává mnoho nezodpovězených otázek. Těch, jež již byly vyjasněny, bychom měli využít pro účinnou preventivní osvětu a také v poradenství. Lze očekávat, že se stále více nejen pacientů a jejich rodin bude na lékaře obracet s dotazy týkajícími se rizikových faktorů, prognózy a také zdravotních a psychologických dopadů HPV infekce na minulé, přítomné i budoucí sexuální vztahy.
ZÁVĚRY
Prozatím nejrozšířenější malignitou indukovanou HPV infekcí je karcinom děložního čípku. Jeho výzkumu se v posledních 30 letech věnovala maximální pozornost a těžiště se již přesunulo od epidemiologických analýz přes terapii až k preventivním screeningovým a vakcinačním programům, které začínají přinášet pozitivní výsledky v podobě klesající incidence onemocnění. Na rozdíl od genitálních karcinomů se výzkum HPV asociovaných OFK prozatím ještě nepromítl do terapeutických a preventivních doporučení. Výzkum se momentálně zaměřuje zejména na možnosti deintenzifikace léčby HPV pozitivních OFK a efektivitu preventivní vakcinace.
Alarmujícím faktem je, že riziko virové etiologie u nádorů mandlí a kořene jazyka, bohužel, zatím nevstoupilo příliš do povědomí široké veřejnosti, mnohdy ani té lékařské, ačkoliv se předpokládá, že v průběhu 10 let výskyt tohoto onemocnění převýší počet cervikálních karcinomů a cílovou skupinou budou zejména muži.
Tato práce byla podpořena grantem IGA MZ ČR NT12483-4/2011.
Adresa ke korespondenci:
MUDr. Hana Binková, Ph.D.
Klinika ORL a chirurgie hlavy a krku
FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: hana.binkova@fnusa.cz
Sources
1. Ang, K. K., Harris, J., Wheeler, R. et al.: Human papillomavirus and survival of patients with oropharyngeal cancer. New England Journal of Medicine, 363, 2010, 1, s. 24-35.
2. Binkova, H., Horakova, Z., Kostrica, R. et al.: HPV in prognosis and therapy of oropharyngeal cancer. Florence, Eurogin 2013: HPV at a crossroads - 30 years of research and practice, s. 313.
3. Binková, H., Horáková, Z., Tóthová, E. et al.: Záchovný protokol u nádorů orofaryngu. Otorinolaryng. a Foniat. /Prague/, 59. 2010, 3, s. 114-121.
4. Bishop, J. A., Ma, X. J., Wang, H. et al.: Detection of transcriptionally active high-risk HPV in patients with head and neck squamous cell carcinoma as visualized by a novel E6/E7 mRNA in situ hybridization method. Am. J. Surg. Pathol., 36, 2012, 12, s. 874-882.
5. D’Souza, G., Agrawal, Y., Halpern, J. et al.: Oral sexual behaviors associated with prevalent oral human papillomavirus infection. Journal of Infectious Diseases. 2009, 199, 9, s. 1263-1269.
6. D’Souza, G., Kreimer, A., Viscidi, R. et al.: Case–kontrol study of human papillomavirus and oropharyngeal cancer. N. Engl. J. Med., 365, 2007, s. 1944-1956.
7. Dušek, L., Mužík, J., Kubásek, M. et al.: Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita,. [Online] [cit. 2014-5-04] 2005. http://www.svod.cz/analyse.php?modul=incmor#.
8. Fakhry, C., Rosenthal, B. T., Clark, D. P. et al: Associations between oral HPV16 infection and cytopathology: evaluation of an oropharyngeal "Pap-test equivalent" in high-risk populations. Cancer Prev. Res., 2011, 4, s. 1378-1384.
9. Fakhry, C., Westra, W. H., Li, S. et al.: Improved survival of patients with human papillomavirus-positive head and neck squamous cell carcinoma in a prospective clinical trial. Journal of the National Cancer Institute, 100, 2008, 4, s. 261-269.
10. Gillison, M. L., D’Souza, G., Westra, W. et al.: Distinct risk factor profiles for human papillomavirus type 16-positive and human papillomavirus type 16-negative head and neck cancers. Journal of the National Cancer Institute, 100, 2008, 6, s. 407-420.
11. Gillison, M. L., Koch, W. M., Capone, R. B. et al.: Evidence for a causal association between human papillomavirus and a subset of head and neck cancers. J. Natl. Cancer Inst., 92, 2000, 9, s. 709-720.
12. Goldenberg, D., Begum, S., Westra, W. H. et al.: Cystic lymph node metastasis in patients with head and neck cancer: an HPV-associated phenomenon. Head and Neck, 30, 2008, 7, s. 898-903.
13. Hafkamp, H. C., Manni, J. J., Haesevoets, A. et al.: Marked differences in survival rate between smokers and nonsmokers with HPV 16-associated tonsillar carcinomas. International Journal of Cance, 122, 2008, 12, s. 2656-2664.
14. Häfner, N., Driesch, C., Gajda, M. et al.: Integration of the HPV16 genome does not invariably result in high levels of viral oncogene transcripts. Oncogene, 27, 2008, 6 (11), s. 1610-1617.
15. Hammarstedt, L., Lindquist, D., Dahlstrand, H. et al.: Human papillomavirus as a risk factor for the increase in incidence of tonsillar cancer. International Journal of Cancer, 119, 2006, 11, s. 2620-2623.
16. Heck, J. E., Berthiller, J., Vaccarella, S. et al.: Sexual behaviours and the risk of head and neck cancers: a pooled analysis in the International Head and Neck Cancer Epidemiology (INHANCE) consortium. International Journal of Epidemiology, 39, 2010, 1, s. 166-181.
17. Herrero, R., Castellsagué, X., Pawlita, M. et al.: Human papillomavirus and oral cancer: the international agency for research on cancer multicenter study. Journal of the National Cancer Institute, 95, 2003, 23, s. 1772-1783.
18. Chaturvedi, A., Gillison, M. L.: Human papillomavirus and head and neck cancer. In: Epidemiology, Pathogenesis, and Prevention of Head and Neck Cancer (1st ed.). New York, Springer, 2010, ISBN 978-1-4419-1471-2.
19. Chaturvedi, A. K., Engels, E. A., Anderson, W. F. et al.: Incidence trends for human papillomavirus-related and -unrelated oral squamous cell carcinomas in the United States. Journal of Clinical Oncology, 26, 2008, 4, s. 612-619.
20. Chaturvedi, A. K., Engels, E. A., Pfeiffer, R. M. et al.: Human papillomavirus and rising oropharyngeal cancer incidence in the United States. J. Clin. Oncol.. 29, 2011, 32, s. 4294-4301.
21. Kašpírková, J., Ondič, O., Černá, K. et al.: Možnosti průkazu biologicky relevantní papilomavirové infekce u maligních nádorů hlavy a krku v diagnostické patologii. Cesk. Patol., 49, 2013, 1, s. 29-34.
22. Klozar, J., Koslabova, E., Kratochvil, V. et al.: Nodal status is not a prognostic factor in patients with HPV-positive oral/oropharyngeal tumors. J. Surg. Oncol., 107, 2013, 6, s. 625-633.
23. Klozar, J., Tachezy, R.: What are the implications of human papillomavirus status in oropharyngeal tumors for clinical practice? Curr. Opin. Otolaryngol. Head Neck Surg., 22, 2014, 2, s. 90-94.
24. Klussmann, J. P., Weissenborn, S. J., Wieland, U. et al.: Prevalence, distribution, and viral load of human papillomavirus 16 DNA in tonsillar carcinomas. Cancer, 92, 2001, 11, s. 2875-2884.
25. Koslabova, E., Hamsikova, E., Salakova, M. et al.: Markers of HPV infection and survival in patients with head and neck tumors. Int. J. Cancer. 133, 2013, s.1832-1839.
26. Kreimer, A. R., Bhatia, R. K., Messeguer, A. I. et al.: Oral human papillomavirus in healthy individuals: A Systematic Review of the Literature. Sexually Transmitted Diseases, 37, 2010, 6, s. 386-391.
27. Kreimer, A. R., Clifford, G. M., Boyle, P. et al.: Human papillomavirus types in head and neck squamous cell carcinomas worldwide: a systemic review. Cancer Epidemiology Biomarkers and Prevention, 14, 2005, 2, s. 467-475.
28. Kreimer, R., Johansson, M., Waterboer, T. et al.: Evaluation of human papillomavirus antibodies and risk of subsequent head and neck cancer. J. Clin. Oncol., 31, 2013, s. 2708-2715.
29. Laco, J.: Lidské papilomaviry a jejich úloha v etiopatogenezi dlaždicobuněčného karcinomu dutiny ústní a orofaryngu. Praha, Galén, 2012, s. 70-73.
30. Lassen, P., Eriksen, J. G., Hamilton-Dutoit, S. et al.: Effect of HPV-associated p16 expression on response to radiotherapy and survival in squamous cell carcinoma of the head and neck. Journal of Clinical Oncology, 27, 2009, 12, s. 1992-1998.
31. Licitra, L., Perrone, F., Bossi, P. et al.: High-risk human papillomavirus affects prognosis in patients with surgically treated oropharyngeal squamous cell carcinoma. Journal of Clinical Oncology, 24, 2006, 36, s. 5630-5636.
32. Lu, B., Kumar, A., Castellsague, X. et al.: Efficacy and safety of prophylactic vaccines against cervical HPV infection and diseases among women: a systematic review & meta-analysis. BMC Infect Dis., 2011, s. 11-13.
33. Machtay, M., Moughan, J., Trotti, A. et al.: Factors associated with severe late toxicity after concurrent chemoradiation for locally advanced head and neck cancer: an RTOG analysis. Journal of Clinical Oncology. 26, 2008, 21, s. 3582-3589.
34. Marur, S. et al.: ASCO annualm meeting, JCO, 2013. E1308: A phase II trial of induction chemotherapy (IC) followed by cetuximab with low dose versus standard dose IMRT in patients with human papilloma virus (HPV) -associated resectable squamous cell carcinoma of the orophayrnx (OPSCC). Suppl, s. 6005.
35. Marur, S., D'Souza, G., Westra, W. H. et al.: HPV-associated head and neck cancer: a virus-related cancer epidemic. Lancet Oncol., 11, 2010, 8, s. 781-789.
36. Mellin, H., Friesland, S., Lewensohn, R. et al.: Human papillomavirus (HPV) DNA in tonsillar cancer: clinical correlates, risk of relapse, and survival. Int. J. Cancer, 89, 2000, 3, s. 300-304.
37. Neuwirthová, J., Smilek, P., Gál, B. et al.: Patogeneze kancerogenity etanolu u karcinomů hlavy a krku. Onkologie, Olomouc, Solen, 2014, ISSN 1802-4475.
38. O’Sullivan, B., Huang, S. H., Siu, L. L. et al: Deintensification candidate subgroups in human papillomavirus-related oropharyngeal cancer according to minimal risk of distant metastasis. J. Clin. Oncol., 31, 2013, s. 543-550.
39. Oldenburg, O. S., Moore, J. E., Van Abel, K. et al.: Human papillomavirus associated oropharyngeal squamous cell carcinoma: proposal fot a new staging systemNG SYSTEM. http://ahns.jnabstracts.com/Detail.aspx?ID=56440. [Online].
40. Olthof, N. C., Speel, E. J., Kolligs, J. et al.: Comprehensive analysis of HPV16 integration in OSCC reveals no significant impact of physical status on viral oncogene and virally disrupted human gene expression. PLOS One., 9, 2014, 2, s. 24.
41. Palefsky, J.: Human papillomavirus-related disease in people with HIV. Current Opinion in HIV and AIDS, 4, 2009, 1, s. 52-56.
42. Parkin, D. M., Whelan, S. L., Ferlay, J. et al.: Cancer Incidence in five continents, 8, 2002.
43. Rotnáglová, E., Tachezy, R., Saláková, M. et al.: HPV involvement in tonsillar cancer: prognostic significance and clinically relevant markers. Int. J. Cancer, 129, 2011, 1, s. 101-110.
44. Smith, E. M., Ritchie, J. M., Summersgill, K. F. et al: Age, sexual behavior and human papillomavirus infection in oral cavity and oropharyngeal cancers. International Journal of Cancer, 108, 2004, 5, s. 766-772.
45. Smith, E. M., Rubenstein, L. M., Haugen, T. H. et al.: Tobacco and alcohol use increases the risk of both HPV-associated and HPV-independent head and neck cancers. Cancer Causes and Control, 21, 2010, 9, s. 1369-1378.
46. Spanos, W. C., Nowicki, P., Lee, D. W. et al.: Immune response during therapy with cisplatin or radiation for human papillomavirus-related head and neck cancer. Archives of Otolaryngology-Head and Neck Surgery, 135, 2009, 11, s. 1137-1146.
47. Sturgis, E. M., Cinciripini, P. M.: Trends in head and neck cancer incidence in relation to smoking prevalence: an emerging epidemic of human papillomavirus-associated cancers . Cancer, 110, 2007, 7, s. 1429-1435.
48. Tachezy, R., Klozar, J., Saláková, M. et al.: HPV and other risk factors of oral cavity/oropharyngeal cancer in the Czech Republic. Oral Dis., 11, 2005, s. 181-185.
49. Trotti, A., Gillison, M.: Phase III trial of radiotherapy plus cetuximab versus chemoradiotherapy in HPV. Associated Oropharynx Cancer. http://www.rtog.org/ClinicalTrials/ProtocolTable/StudyDetails.aspx?study=1016.
50. Wilczynski, S. P., Lin, B. T. Y., Xie, Y. et al.: Detection of human papillomavirus DNA and oncoprotein overexpression are associated with distinct morphological patterns of tonsillar squamous cell carcinoma. American Journal of Pathology, 152, 1998, 1, s. 145-156.
51. Zwenger, S. R.: Bogarting that joint might decrease oral hpv among cannabis users. Curr. Oncol., 16, 2009, 6, s. 5-7.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2015 Issue 4-
All articles in this issue
- Incidental Parathyroidectomy in Surgical Treatment of Thyroid Gland Diseases
- Increasing Incidence of HPV Related Oropharyngeal Cancers
- Psychogenic Disorder on Hearing in Children
- Inflammatory Pseudotumor of Temporal Bone
- Papillary Carcinoma in a Medial Cervical Cyst
- Value of Narrow Band Imaging (NBI) in Management of Leukoplakia
- Surgical Treatment of Rhinophyma
- Infrared Lasers versus Classical Technique in Tonsillectomy
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inflammatory Pseudotumor of Temporal Bone
- Increasing Incidence of HPV Related Oropharyngeal Cancers
- Psychogenic Disorder on Hearing in Children
- Papillary Carcinoma in a Medial Cervical Cyst
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

