-
Medical journals
- Career
Přítomnost Helicobacter pylori v orofaryngu a její vztah k žaludeční infekci
Authors: E. Nártová 1; P. Lukeš 1; E. Pavlík 2; I. Šterzl 2; J. Astl 1; J. Betka 1
Authors‘ workplace: Klinika ORL a chirurgie hlavy a krku 1. LF UK a FN Motol, Praha Katedra otorinolaryngologie IPVZ, Praha ; přednosta prof. MUDr. J. Betka, DrSc. Ústav imunologie a mikrobiologie 1. LF UK a VFN, Praha 1; přednosta prof. MUDr. I. Šterzl, CSc. 2
Published in: Otorinolaryngol Foniatr, 58, 2009, No. 2, pp. 97-101.
Category: Original Article
Overview
Helicobacter pylori (HP) je významný lidský patogen, který je spojován s chronickou gastritidou, žaludečním vředem a s nádory žaludku, především s adenokarcinomem a MALT lymfomem. V posledních letech byl HP nalezen v ústní dutině, především ve slinách a dentálním plaku. Do této doby byl za jediný rezervoár infekce HP v lidském organismu považován žaludek. Cílem práce bylo zjištění, zda může být HP v orofaryngu přítomen nezávisle na žaludeční infekci. Do studie bylo zařazeno 20 osob s prokázanou přítomností HP v orofaryngu. U těchto osob byla zjišťována žaludeční infekce ureázovým dechovým testem (UBT). Přítomnost HP v žaludku byla prokázána pouze u 8 jedinců. Zbylých 12 pacientů bylo UBT negativních. Z těchto výsledků vyplývá, že HP může být přítomen v orofaryngeální oblasti nezávisle na žaludeční infekci.
Klíčová slova:
Helicobacter pylori (HP), ureázový dechový test (UBT), orofaryng, PCR, žaludek.ÚVOD
Infekce HP je rozšířena po celém světě. Ve státech střední a východní Evropy je promořenost udávána od 60 do 95 % (4). V rozvojových zemích je vysoké procento infekce spojeno s nízkým so-cioekonomickým statutem a infekce se zpravidla rozvíjí od časného dětství. Naopak ve vyspělých zemích je prevalence nízká. Klinické projevy se objevují pouze u 10-15 % nakažených jedinců, což je dáno různou imunitní odpovědí hostitele a odlišným stupněm virulence kmenů (24).
Nejvýznamnějšími faktory virulence jsou vakuolizační cytotoxin (vac A) a cytotoxin asociovaný gen (CagA), dále adheziny, lipopolysacharid a ureáza (20). VacA je cytotoxin, který indukuje vakuolizaci epiteliálních buněk. Je kódován genem vac A, který nesou všechny kmeny HP. Pouze asi 50 % kmenů produkuje vac A protein (22). Kmeny produkující toxin jsou spojovány s vyšším výskytem peptických vředů a rakoviny žaludku. Mezi jednotlivými kmeny existují ve struktuře vacA genu rozdíly. Za velmi toxické jsou považovány kmeny s alelami s1 m1 a jsou spojovány s mnoha formami gastritidy, atrofie a intestinální metaplázie [10]. Přítomnost vacA také indukuje expresi VEGF (vascular endothelial growth factor) a vede ke spuštění nádorového procesu (20).
CagA gen, čili cytotoxin - asociovaný gen A - kóduje vysokomolekulární a vysoce imunoreaktivní protein, který je přítomný asi u 60 % kmenů HP (20). Tento gen je součástí ostrůvku patogenicity cag - PAI, který zahrnuje 31 genů , které hrají roli v aktivaci chemokinů a MAP - kinázy v cestě aktivace prozánětlivých faktorů (20). V hostitelské buňce je cag A fosforylován kinázami ze skupiny Src, což vede k produkci různých cytokinů a růstových faktorů (22). Kmeny s přítomností cagA jsou označovány jako CagA+. Pacienti infikovaní těmito kmeny mají vyšší zánětlivou odpověď a je u nich zaznamenán vyšší výskyt peptických vředů, atrofické gastritidy, rakoviny žaludku (15). Protein cagA a další virulentní faktory jsou do hostitelské buňky injektovány prostřednictvím sekrečního systému typu IV (10).
Přežití HP je možné díky schopnosti produkovat ureázu, což je enzym, který štěpí v žaludku ureu na amoniak a oxid uhličitý. Zajišťuje neutralizaci kyselého prostředí ve svém okolí. Ureáza hraje důležitou roli ve vyhodnocení ureázového dechového testu. Při stanovení pozitivity/negativity UBT se laboratorně vyhodnocuje koncentrace oxidu značeného uhličitého ve vydechovaném vzduchu.
Infekce HP aktivuje neutrofily, které tvoří volné radikály (ROS), zejména superoxid a hydrogen peroxidový ion. Proti těmto radikálům existují v buňkách žaludeční sliznice enzymy, které ROS ničí. Vysoká aktivita těchto enzymů byla zaznamenána u Cag A+ kmenů HP (20).
Po proniknutí HP do žaludku se uplatňuje imunita přirozená a imunita získaná. Přirozenou imunitu zastupují antigen prezentující buňky, a to zvláště buňky dendritické a monocyty. Tyto buňky mají na svém povrchu TLRs (Toll - like receptors). Po kontaktu s bakterií dochází k sekreci prozánětlivých cytokinů – TNF-α, IL - 1β a IL - 8 (22). IL - 8 má vliv na buněčnou proliferaci, migraci a tumorovou angiogenezi. Dominantní odpovědí je Th - 1 imunitní odpověď v žaludeční sliznici, charakterizovaná indukcí IFN - γ. Th - 1 odpověď je spojená se zvýšeným vyplavováním prozánětlivých cytokinů – IL - 12, IL - 18 a TNF - α a vede k produkci IgG (22).
METODY PRŮKAZU HP
Metody průkazu HP jsou invazivní a neinvazivní. Pro žaludek se jako standardní test používá ureázový dechový test – Urea Breath Test (UBT).
UBT je v současné době považován za zlatý standard metod k detekci Helicobacter pylori v žaludku (14). První vztah UBT (14C) k detekci žaludeční ureázové aktivity u kočky byl publikován v roce 1954 Kornbergem. V roce 1987 byl použit Grahamem neradioaktivní izotop uhlíku 13 C, což je prvek v prostředí přirozeně přítomný. Vzorky jsou analyzovány metodou hmotnostní spektrometrie, nebo metodou NDIRS (nondispersive infrared spectrometry). Tato metoda je založená na změnách oscilačního spektra molekul izotopů CO2 v infračerveném světle. Použití této metody spočívá měření absolutních koncentrací plynu a naměřené hodnoty více kolísají. Důležité je kritérium změny poměru vydechovaného CO2 v čase 30 oproti T - DOB větší než 5 š (14). Dechový test byl použit i v modifikovaném provedení jako endoskopický UBT, vykazující přesnost v detekci. UBT patří do popředí všech diagnostických metod HP. Podle Maastrichtského konsenzu 2 z roku 2000 se jedná o vyšetření vhodné k průkazu infekce a rovněž je pokládáno za vyšetření určené ke kontrole eradikace. Ke zhodnocení UBT byla publikována řada prací, jejichž autoři v naprosté většině považují uvedenou metodu za jednu z nejdůležitějších pro detekci HP. Největším problémem dechových testů zůstává kvantitativní interpretace. Objem vzduchu při dýchání se liší v závislosti na fyzické aktivitě, psychickém stresu a dalších faktorech. Výsledkem je jejich vysoká biologická variabilita.
VÝSKYT HP V ÚSTNÍ DUTINĚ A HLTANU
Výskyt HP v ústní dutině a hltanu je intenzivně studován. Byla prokázána jeho přítomnost v lidském dentálním plaku a ve slinách (8, 12). Důležitost tonzilární tkáně pro kolonizaci HP jako první zdůraznil Minocha (19). HP byl prokázán pomocí CLO testu v adenoidní tkáni (25). Vzorek adenoidní tkáně i patrových tonzil byl pozitivní také při použití RUT a histologie (1). Cirak a spol. (6) a Bulut a spol. (3) detekovali pomocí metody PCR Cag A+ kmeny. Bitar a spol. (2) sledovali výskyt HP v středoušním sekretu a v adenoidní vegetaci pomocí kultivace, RUT a PCR. Pozitivita HP byla zjištěna pouze ve vzorku adenoidní vegetace metodou RUT. HP byl zjištěn také ve středoušním sekretu a adenoidních vegetacích pomocí PCR s použitím primeru pro 23 S ribosomální RNA (26).Yilmaz a spol. (27)našli HP také v aspirátech středoušního sekretu pomocí kultivace a PCR. Byl také srovnáván výskyt HP na povrchu a uvnitř tonzil. Z celkem 106 vzorků bylo pozitivních 56 povrchových (53 %) a 24 vzorků ze stromatu tonzil (23 %) (13). Předpokládá se také souvislost infekce HP a orofaryngeálních nádorů. Tento vztah zkoumala řada autorů. Pouze jedna studie je však založená na genotypizaci kmenů HP pomocí metody real-time PCR (21).
Cílem práce je zjištění incidence probíhající žaludeční infekce HP pomocí ureázového dechového testu u pacientů, u kterých byla zjištěna přítomnost HP v tonzilární tkáni metodou real-time PCR.
METODY
Do studie bylo zařazeno celkem 40 pacientů s diagnózou karcinomu tonzil, syndromem spánkové apnoe a chronickou tonzilitidou. Tito pacienti podstoupili v letech 2006–2008 chirurgický výkon na klinice ORL a chirurgie hlavy a krku 1. LF UK a FN v Motole. Během operace jim byl odebrán vzorek orofaryngeální tkáně. Z uvedených vzorků byla u 20 pacientů zjištěna pomocí metody real–time PCR pozitivita Helicobacter pylori v orofaryngu (tab. 1). U těchto pacientů byl proveden UBT v době od ledna do srpna 2008. U žádného z pacientů nebyla před provedením UBT provedena eradikace HP. U osob UBT pozitivních byla následně provedena gastroskopie k ověření probíhající žaludeční infekce pomocí PCR ze vzorků žaludeční sliznice.
Table 1. Přehled orofaryngeálních onemocnění u PCR pozitivních pacientů. 
Ureázový dechový test – Urea – Breath - Test (UBT)
Test byl prováděn ráno nalačno. Pacienti provedli výdech do prvního sáčku, poté vypili 200 ml 100% pomerančové šťávy se 100 mg 13C močoviny. Po 30 minutách byl odebrán vzorek dechu do druhého sáčku. Sáčky byly odeslány do laboratoře a zpracovány do 1 týdne od odběru.
Real–time–PCR
Real–time PCR je vysoce senzitivní variantou PCR metody. Umožňuje provádět genotypizaci jednotlivých kmenů HP přímo z tkáňových vzorků. Vyšetření byla prováděna na přístroji Light-CyclerR 2.0 s využitím specifických primerů a sond pro cagA gen a pro signální a střední sekvenci vacA genu.
VÝSLEDKY
Z dvaceti pacientů s PCR prokázanou orofaryngeální přítomností infekce HP bylo celkem 8 (40 %) UBT pozitivních. U všech těchto osob byla následně ověřena přítomnost žaludeční infekce pomocí PCR. U zbylých 12 osob (60 %) byl ureázový dechový test negativní (tab. 2, graf 1).
Table 2. Přehled UBT pozitivit a negativit u PCR pozitivních pacientů. 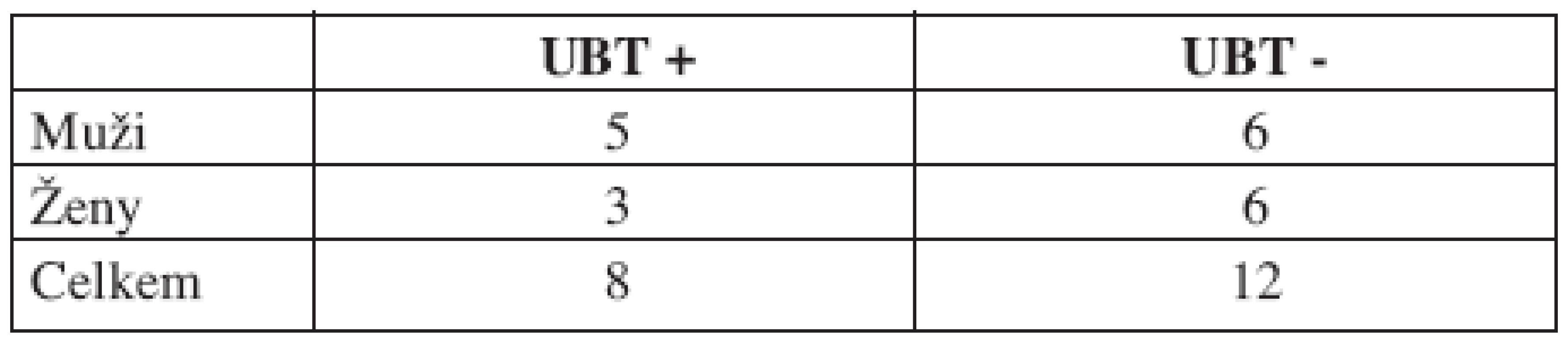
Graph 1. Počty UBT pozitivních a negativních pacientů. 
DISKUSE
Dosud publikované práce, jejichž cílem byla detekce HP v ústní dutině, byly většinou zaměřeny na pacienty se žaludečními obtížemi, případně s již prokázanou žaludeční infekcí HP. Pacienti zařazeni do této studie byli vybráni na základě pozitivního nálezu HP v orofaryngu a následně u nich byla zjišťována přítomnost HP v žaludku pomocí UBT. Ve shodě s prací Burgerse (5) bylo prokázáno, že se HP může nacházet v ústní dutině, aniž by byl přítomen zároveň v žaludku.
UBT je v současné době považován za zcela spolehlivou neinvazivní metodu detekce žaludeční HP infekce (7). Základní metodika UBT je uzpůsobena tak, že vylučuje detekci HP v jiné lokalizaci než v žaludku. Jedna studie byla zaměřena na aplikaci UBT v ústní dutině (16), kdy autoři nechali pacienty vyplachovat ústa roztokem značené urey.
U pacientů v této studii byla UBT pozitivita potvrzena endoskopií a detekcí HP v bioptickém materiálu. V minulosti byla diskutována otázka, zda přítomnost HP v orofaryngu není jen přechodná, např. způsobená gastroezofageálním refluxem. Výsledky této studie ukazují, že kolonizace orofaryngu je nezávislá na žaludeční infekci HP (tab. 3).
Table 3. Počet UBT negativit u jednotlivých orofaryngeálních onemocnění PCR pozitivních pacientů. 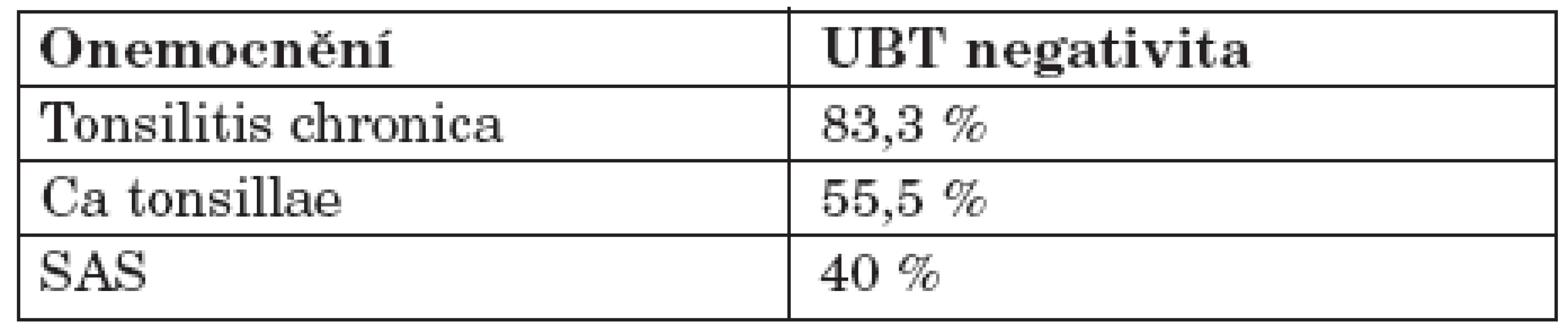
Metody detekce HP jsou invazivní a neinvazivní. Pro oblast orofaryngu jsou vhodné metody invazivní. Detekce HP v této oblasti je však značně limitována. Při použití histologie se setkáváme s problémem, který je představován výskytem jiných bakteriálních kmenů. Tato metoda je tedy málo specifická [9].
S falešně pozitivními výsledky se můžeme setkat při aplikaci CLO testu nebo RUT. Tyto metody jsou založeny na průkazu HP na základě barevné reakce, která vzniká po reakci substrátu s ureou. Hlavním důvodem možných falešně pozitivních výsledků je existence dalších ureázu-produktujících kmenů v této oblasti (9).
Kultivace je považována za zlatý standard pro detekci HP v žaludku. V ústní dutině je však její použití značně limitováno (9). Je náročná na přesnost provedení. Klinická významnost spočívá ve stanovení citlivosti vypěstovaného kmene na antibiotika, zejména v případech neúspěšné eradikace. Vzorky se vyhodnocují po týdenní inkubaci (18). Nevýhodou použití kultivace v orofaryngu je možná inhibice HP jinými orálními druhy baktérií (11).
Využití molekulárních metod (PCR) umožňuje amplifikaci HP – specifického regionu DNA (23). Využívá se standardní (end-point) PCR pro detekci zejména cagA a vacA genů (18). Tato metoda je vysoce specifická a senzitivní. Při jejím použití v orofaryngu však byly výsledky studií vysoce variabilní, mezi 0 % - 90 % (9).
Genotypizace pomocí PCR metody umožňuje rozlišovat různé kmeny HP a jejich geny kódující různé faktory virulence (21). V posledních letech je využívána také real–time PCR. Představuje zlom v diagnostice HP, protože umožňuje provádět genotypizaci jednotlivých kmenů HP přímo ze tkáňových vzorků. Při použití PCR detekce však nelze získat přesnou představu, zda se jedná o viabilní či mrtvé bakterie (9). PCR je v současné době považována za nejvíce senzitivní metodu k detekci HP v orofaryngu. Je rezistentní vůči externím faktorům a je zatížena nejmenším rizikem falešně pozitivních či falešně negativních výsledků (17).
ZÁVĚR
Na základě výsledků studie můžeme konstatovat, že infekce Helicobacter pylori může existovat samostatně v orofaryngu bez současné koexistence infekce žaludeční. Toto tvrzení dokazuje skutečnost, že většina pacientů, u nichž byla zjištěna PCR pozitivita v orofaryngu, byla UBT negativní.
MUDr. Eva Nártová
Klinika ORL a chirurgie hlavy a krku 1. LF UK a FNM
V Úvalu 84
150 06 Praha 5-Motol
Sources
1. Bitar, A., Soweid A. et al.: Is Helicobacter really present in the adenoids of children? Eur Arch. Otorhinolaryngol, 262, 2005, s. 987-992.
2. Bitar, M., Mahfouz, R., Soweid, A. et al.: Does Helicobacter pylori colonize the nasopharynx of children and contribute to their middle ear disease? Acta Otolaryngol, 126, 2006, s. 154-159.
3. Bulut, Y., Agacayak, A., Karlidag, T. et al. Association of Cag A+ Helicobacter pylori with adenotonsillar hypertrophy. Tohoku J. Exp. Med., 209, 2006, 3, s. 229-233.
4. Bureš, J., Kopáčová, M., Koupil, I. a kol.: Epidemiology of Helicobacter pylori infection in the Czech Republic. Helicobacter, 11, 2006, s. 56-65.
5. Bürgers, R., Schneider-Brachert, W., Reischl, U., Behr, A., Hiller, K. A., Lehn, N., Schmalz, G., Ruhl, S.: Helicobacter pylori in human oral cavity and stomach. Eur J. Oral Sci., 2008; 116, s. 297-304.
6. Cirak, M. Y., Ozdek, A., Yilmaz, D. et al.: Detection of Helicobacter pylori and its CagA gene in tonsil and adenoid tissues by PCR. Arch. Otolaryngol Head Neck Surg., 129, 2003, s. 1225-1229.
7. Cutler, A. F., Havstad, S. et al.: Accuracy of invasive and noninvasive tests to diagnose Helicobacter pylori infection. Gastroenterology, 109, 1995, 1, s. 136-141.
8. Czesnikiewicz-Guzik, M., Bielanski, W., Guzik, T. J., Loster, B., Konturek, S. J.: Helicobacter pylori in the oral cavity and its implications in gastric infection, periodontal health, immunology and dyspepsia. J. Physiol. Pharmacol., 56, 2005, Suppl. 6, s. 77-89.
9. Dowsett, S. A., Kowolik, M. J.: Oral Helicobacter pylori: Can we stomach it? Crit. Rev. Oral Biol. Med., 14, 2003, 3, s. 226-233.
10. Höcker, M., Hohenberger, P.: Helicobacter pylori virulence factors-one part of a big picture. Lancet, 362, 2003, 2 (9391), s. 1231-1233.
11. Ishihara, K., Miura, T., Kimizuka, R., Ebihara, Y., Mizuno, Y., Okuda, K.: Oral bacteria inhibit Helicobacter pylori growth. FEMS Microbiol. Lett., 152, 1997, s. 355-361.
12. Karczewska, E., Konturek, J. E., Konturek, P. C. et al.: Oral cavity as a potential source of gastric reinfection by Helicobacter pylori. Dig. Dis. Sci., 47, 2002, s. 978-986.
13. Khademi, B., Niknejad, N., Gandomi, B., Yeganeh, F.: Comparison of Helicobacter pylori colonization on the tonsillar surface versus tonsillar core tissue as determined by the CLO test. Ear Nose Throat, 86, 2007, 8, s. 498-501.
14. Kocna, P.: Dechové testy - moderní, neinvazivní diagnostika. Interní Med., 2006, 7 a 8, s. 336-341.
15. Kusters, J. G., van Vliet, A. H., Kuipers, E. J.: Pathogenesis of Helicobacter pylori infection. Clin. Microbiol. Rev., 19, 2006, 3, s. 449-490.
16. Loster, B. W., Majewski, S. W., Czesnikiewicz-Suzik, M., Bielanski, W., Pierzchalski, P., Konturek, S. J.: The relationship between the presence of Helicobacter pylori in the oral cavity and gastric in the stomach. J. Physiol. Pharmacol., 57, 2006, s. 91-100.
17. Lukeš, P., Astl, J., Pavlík, E., Potužníková, B., Šterzl, I., Betka, J.: Helicobacter pylori in tonsillar and adenoid tissue and its possible role in oropharyngeal carcinogenesis. Folia Microbiol., 54, 2008, s. .33-39.
18. Mégraud, F., Lehours, P.: Helicobacter pylori detection and antimicrobial susceptibility testing. Clin. Microbiol. Rev., 20, 2007, 2, s. 280-332.
19. Minocha, A., Raczkowski, C. A., Richards, R. J. Is a history of tonsillectomy associated with a decreased risk of Helicobacter pylori infection? J. Clin. Gastroenterol., 25, 1997, s. 580-582.
20. Olivares, D., Gisbert, J. P. et al. Factors involved in the pathogenesis of Helicobacter pylori infection. Rev. Esp. Enferm. Dig., 98, 2006, 5, s. 374-386.
21. Pavlík, E., Lukeš, P., Potužníková, B., Astl, J., Hrdá, P., Souček, A., Matucha, P., Doseděl, J., Šterzl, I.: Helicobacter pylori isolated from patients with tonsillar cancer or tonsillitis chronica could be of different genotype compared to isolates from gastrointestinal tract. Folia Microbiol., 52, 2007, s. 91-94.
22. Portal-Celhay, C., Perez-Perez, G.: Immune responses to Helicobacter pylori colonization: Mechanisms and clinical outcomes. Clin. Sci., 110, 2006, 3, s. 305-314.
23. Song, Q., Haller, B., Schmid, R. M., Adler, G., Bode, G.: Helicobacter pylori in dental plaque: a comparison of different PCR primer sets. Dig. Dis. Sci., 44, 1999, s. 479-484.
24. Stromberg, E., Edebo, A., Svennerholm, A. M., Lindholm, C. Decreased epithelial cytokine responses in the duodenal mucosa of Helicobacter pylori-infected duodenal ulcer patients. Clin. Dian. Lab. Immunol., 10, 2003, s. 116-124.
25. Unver, S., Kubilay, U., Sezen, O. S., Coskuner, T.: Investigation of Helicobacter pylori colonization in adenotonsillectomy specimens by means of CLO-test. Laryngoskope, 111, 2001, s. 2183-2186.
26. Yilmaz, M., Kara, C. O., Kaleli, I., Demir, M., Tumkaya, F., Buke, A. S., Topuz, B.: Are tonsils a reservoir for Helicobacter pylori infection in children? Int. J. Pediatr. Otorhinolaryngol, 68, 2004, s. 307-310.
27. Yilmaz, T., Ceylan, M., Akyon, Y., Ozcakyr, O., Gursel, B.: Helicobacter pylori: a possible association with otitis media with effusion. Otolaryngol Head Neck Surg., 134, 2006, s. 772-777.
Labels
Audiology Paediatric ENT ENT (Otorhinolaryngology)
Article was published inOtorhinolaryngology and Phoniatrics

2009 Issue 2-
All articles in this issue
- Cizí tělesa v ORL oblasti u dětí
- Parafaryngeální a retrofaryngeální absces u dětí
- Radiofrekvenčně indukovaná termoterapie tonzil u dětí
- Prognostický a prediktivní význam exprese EGFR, Her2/neu a genetických alterací v EGFR signální cestě u spinocelulárních karcinomů hlavy a krku
- Přítomnost Helicobacter pylori v orofaryngu a její vztah k žaludeční infekci
- Přítomnost Helicobacter pylori v lymfatické tkáni nosohltanu a jeho možná souvislost se vznikem adenoidních vegetací
- Primární (vřetenobuněčný) rhabdomyosarkom podčelistní slinné žlázy (Kazuistika a přehled literatury)
- Cholesteatóm v okcipito-temporálnej oblasti
- Periferní paréza lícního nervu při středoušní manifestaci Wegenerovy granulomatózy
- Otorhinolaryngology and Phoniatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Parafaryngeální a retrofaryngeální absces u dětí
- Cizí tělesa v ORL oblasti u dětí
- Radiofrekvenčně indukovaná termoterapie tonzil u dětí
- Přítomnost Helicobacter pylori v lymfatické tkáni nosohltanu a jeho možná souvislost se vznikem adenoidních vegetací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

