-
Medical journals
- Career
Antidiabetika nová i klasická v roce 2018*
Authors: M. Prokeš; J. Suchopár
Authors‘ workplace: DrugAgency, a. s.
Published in: Reviz. posud. Lék., 21, 2018, č. 3-4, s. 71-82
Category: Original Articles, Review Articles, Case Reports
Overview
V tomto článku autoři předkládají údaje o přínosech a rizicích antidiabetik nových i klasických. Deriváty sulfonylurey pomalu, ale jistě opouštějí pozici bezpečných a nejvíce předepisovaných antidiabetik. Nové lékové skupiny přicházejí s odlišnými mechanismy účinků a lékaři tedy lépe než kdy předtím mohou předepisovat léky na míru svým pacientům, ovšem jen tehdy, když se naučí znát nejen přínosy léků, ale i jejich rizika. Lékové interakce antidiabetik tak, jako v jiných lékových skupinách, mohou zvýšit nebo snížit účinek některých léčivých látek nebo pacienta poškodit jiným způsobem.
Klíčová slova:
antidiabetika – deriváty sulfonylurey – inhibitory DPP-4 – pioglitazon – inhibitory SGLT2 – lékové interakce
ÚVOD
V současné době ve všech vyspělých zemích světa probíhá epidemie onemocnění diabetes mellitus. V ČR bylo koncem roku 2016 evidováno 861 450 nemocných s diabetem, přičemž naprostá většina z nich trpí diabetes mellitus 2. typu (dále jen DM2), jak uvádí Pelikánová [1]. V nedávné době bylo do klinické praxe zavedeno několik skupin nových antidiabetik, z nichž některé mohou zásadním způsobem zlepšit kontrolu diabetu zejména u pacientů s DM2. Vzhledem k velkému objemu nových informací se v tomto článku nemůžeme zabývat problematikou inzulinů, kde též došlo k určitému pokroku.
Podle doporučených postupů by každý diabetik měl být léčen alespoň jedním antidiabetikem, a pokud není kompenzován, měl by užívat antidiabetika dvě nebo i více (podobně jako většina pacientů s hypertenzí zpravidla užívá kombinaci několika antihypertenziv). Česká diabetologická společnost ve svých doporučených postupech pro diabetes 2. typu uvádí, že při volbě farmak máme dát přednost antidiabetikům bezpečným, zejména těm, která přinášejí jen nízké riziko hypoglykémií, což jsou metformin, gliptiny, agonisté GLP-1 a glifloziny [2]. Je třeba zvážit i další vlastnosti antidiabetik, které by mohly mít vztah k dlouhodobé prognóze nemocného. Je to například vliv na tělesnou hmotnost pacienta či na hodnoty postprandiální glykémie, které významně ovlivňují dlouhodobou kompenzaci diabetu. U vybraných skupin nemocných by mělo být vždy zváženo antidiabetikum s prokázaným příznivým efektem na danou komorbiditu: u osob s vysokým kardiovaskulárním rizikem jsou takovými léky empagliflozin a/nebo liraglutid, u osob s rizikem srdečního selhání empagliflozin nebo kanagliflozin. Z toho je patrné, že náhled na jednotlivé lékové třídy antidiabetik se mění. Deriváty sulfonylurey již nejsou uváděny mezi bezpečnými léky, lze očekávat další pokles jejich spotřeby a do budoucna bude dávána přednost lékům, které teprve nedávno přišly na náš trh. V tomto přehledovém článku se pokusíme přehledným způsobem popsat charakteristiky jednotlivých antidiabetik a upozornit též na jejich rizika. Předtím však ukážeme vývoj spotřeb a nákladů na jednotlivá antidiabetika v České republice (dále jen ČR) tak, aby zaměstnanci zdravotních pojišťoven mohli predikovat nárůst nákladů na tato léčiva, ke kterému zřejmě bude v příštích letech docházet nejen u nás, ale i na celém světě. Náklady zřejmě zvýší nejen přesun preskripce ze „starých“ léčivých látek na léčivé látky nové, ale také současná preskripce více antidiabetik jednomu pacientovi.
Graf 1 ukazuje pozvolný nárůst spotřeb antidiabetik vyjádřených v DDD/1000 obyvatel a den v ČR, přičemž náklady (graf 2) rostou podstatně rychleji. Zdrojem dat je SÚKL. Při výpočtu nákladů jsou údaje poněkud nadhodnoceny (počítá se totiž s maximálními cenami i maximálními obchodními přirážkami léků). Příčinou rychlejšího růstu nákladů je příliv nových dražších antidiabetik na náš trh.
Graph 1. Spotřeba antidiabetik kromě inzulinů v České republice (DDD/TID) 
Graph 2. Náklady na antidiabetika kromě inzulinů v České republice (mil. Kč) 
Z grafu 1 je patrné, že spotřeba metforminu mírně stoupá a spotřeba derivátů sulfonylurey (dále SU) od roku 2011 postupně klesá. Tytéž křivky můžeme pozorovat na grafu 2, jen jsou o poznání užší, neboť jak metformin, tak i SU jsou levné léky. Hlavním důvodem poklesu spotřeb SU je změna doporučených postupů, podle kterých je třeba v první linii léčby DM2 podávat metformin, který má na rozdíl od SU prokazatelně příznivé dopady na osud pacienta. Také bezpečnost podávání SU začíná být zpochybňována. Třetím pásem zezdola jsou v grafech 1 a 2 kombinovaná antidiabetika, mezi která patří zejména kombinace metforminu s novými antidiabetiky, a to zejména s gliptiny a v poslední době též s glifloziny. Příznačné je, že kombinace metforminu s klasickými PAD, tedy se SU, má jen minimální spotřebu, a proto tuto tenkou křivku v grafu 1 ani 2 nelze jednoduše rozeznat. Nad křivkou spotřeb kombinací nových PAD vidíme tmavě fialovou křivku glitazonů (dnes je k dispozici již pouze pioglitazon), výše pak oranžovou křivku gliptinů, ještě výše tmavomodrou křivku analogů GLP-1 a zejména pak na grafu 2 hnědou křivku nejnovějších léků – gliflozinů. Nad glifloziny lze jen s obtížemi rozeznat úzkou červenou křivku repaglinidu, který moderními guidelines není příliš preferován.
METFORMIN
Metformin zpomaluje absorpci glukózy ve střevě, snižuje produkci glukózy v játrech inhibicí glukoneogeneze a glykogenolýzy, zvyšuje citlivost na inzulin ve svalech a zlepšuje vychytávání a využití glukózy v periferních tkáních. Též redukuje chuť k jídlu. Nezvyšuje sekreci inzulinu a jeho podávání není přímo spojeno s rizikem hypoglykémie. Prokazatelně snižuje kardiovaskulární morbiditu i mortalitu. Lze jej kombinovat se všemi antidiabetiky včetně analog GLP-1 nebo inzulinu. Metformin se vstřebává z GIT zhruba z 50–65 %, nevstřebaný se vylučuje stolicí a může působit GIT diskomfort. Potrava snižuje biologickou dostupnost metforminu až o 40 % a vede ke zvýšení jeho koncentrace ve střevě, což může způsobit nepříjemné zažívací potíže (podrobnosti viz níže). Metformin se v organismu nemetabolizuje a není tedy substrátem isoenzymů P450, je ale substrátem různých transportérů, zejména OCT a MATE (transportéry organických kationtů). Transportéry typu OCT zajišťují vstup metforminu do buňky a transportér MATE naopak zajišťuje eliminaci metforminu z buňky. Z organismu se metformin vylučuje v nezměněné formě močí, při snížení clearance kreatininu pod 60 ml/min je třeba snížit jeho dávku, při trvalém poklesu clearance kreatininu pod 30 ml/min je třeba podávání metforminu ukončit.
Bezpečnost metforminu a jeho lékové interakce
Nejčastějším nežádoucím účinkem metforminu je jeho intolerance, neboť zejména na počátku léčby působí četné gastrointestinální nežádoucí účinky: nevolnost, zvracení, průjem, bolesti břicha a ztráta chuti k jídlu. Pokud pacient nemá dostatek trpělivosti, na lék si nezvykne a definitivně metformin vysadí, přichází tím o jedno z nejúčinnějších a nejbezpečnějších (a také nejlevnějších) antibiabetik, což má negativní důsledky pro další průběh jeho života. Zajímavé je, že současné podávání gliptinů (inhibitorů DPP-4) snížilo četnost gastrointestinálních nežádoucích účinků metforminu [2], což zřejmě přispívá k oblibě takové fixní kombinace léků v jedné tabletě. Doporučuje se proto podávat zpočátku nízké dávky metforminu a teprve při jejich toleranci je možno dávky zvyšovat, s výhodou lze užít formy s prodlouženým uvolňováním. Některé interagující léky k intoleranci metforminu přispívají, proto by měli lékaři pečlivě zvažovat, jaké další léky s metforminem pacientovi předepíší. Při současném podávání léků inhibujících transportér OCT1, který se na vstřebávání metforminu z GIT velkou měrou podílí, zůstává větší množství metforminu ve střevech a působí GIT potíže. Silné inhibitory OCT1 jsou spironolakton, verapamil, doxazosin, propafenon, chlorpromazin, kodein a citalopram. Mezi slabé a středně silné inhibitory patří tramadol, amilorid, trimetoprim a estradiol. Inhibitory protonové pumpy (PPI), jako např. rabeprazol, pantoprazol, lansoprazol, jsou inhibitory všech tří typů, a to OCT1, OCT2, který usnadňuje transport metforminu v ledvinách a OCT3, který usnadňuje vstup metforminu do jaterní buňky. Klinický význam takové interakce byl prokázán ve studii autorů Dujic et al. [3] u 1915 pacientů s metforminem, kteří jej tolerovali, a u 251 pacientů, kteří metformin netolerovali, zjišťovali možné příčiny takové intolerance. Současné užívání inhibitorů OCT1 zvyšovalo riziko intolerance metforminu o 63 % (p = 0,001). Graf 3 ukazuje, do jaké míry jednotlivé inhibitory OCT1 zvyšují intoleranci metforminu (vyjádřeno jako podíl pacientů, u kterých musela být terapie metforminem ukončeno pro intoleranci). Lékaři by zejména při zahajování léčby metforminem měli dbát na to, aby současně podávanými léky intoleranci metforminu nezhoršovali, neboť by tak škodili svým pacientům a zároveň generovali i vyšší výdaje zdravotních pojišťoven, neboť by následně místo metforminu byl zřejmě podáván některý z nových a drahých léků.
Graph 3. Vliv vybraných inhibitorů OCT1 na riziko vzniku GIT intolerance metforminu 
Vzácným, ale obávaným nežádoucím účinkem metforminu je laktátová acidóza, která se může vyskytnout zejména v souvislosti s dehydratací a poklesem renálních funkcí. Intravaskulární podání jodovaných kontrastních látek může vést k nefropatii indukované kontrastní látkou s následnou akumulací metforminu a zvýšeným rizikem laktátové acidózy, proto je taková kombinace kontraindikovaná.
Další lékové interakce metforminu
Při současném podávání trimetoprim ve dvou studiích u 23, respektive 12 zdravých dobrovolníků, zvýšil plazmatické koncentrace metforminu průměrně o 37, respektive 44 %. Očekává se, že interakce metforminu s trimethoprimem má klinický význam u specifických pacientů, kterým je podáván kotrimoxazol v abnormálně vysokých dávkách po dlouhou dobu, žádná taková kazuistika však nebyla dosud popsána. Zvýšení plazmatických koncentrací metforminu mohou též způsobit jiné lékové interakce: Diuretika mohou způsobit dehydrataci, současně podávané ACE-inhibitory (nebo sartany) a NSA naruší ochranné mechanismy, což může způsobit akutní poškození ledvin prerenálního typu. Takové trojité interakci se říká triple whammy neboli „trojitá facka“ (viz níže). Zvlášť ohroženi jsou touto interakcí pacienti s preexistující poruchou ledvin a senioři náchylní k dehydrataci.
DERIVÁTY SULFONYLUREY
Deriváty sulfonylurey (SU) působí především prostřednictvím stimulací sekrece inzulinu [1]. Sekundárně, v důsledku poklesu glykémie, dochází k poklesu inzulinové rezistence v periferních tkáních. Většina SU je vylučována močí, při poklesu renálních funkcí lze očekávat zvýšení jejich plazmatických koncentrací (s výjimkou gliquidonu).
Bezpečnost SU
Bohužel se ukazuje, že přinejmenším některé SU zvyšují apoptózu β-buněk Langerhansových ostrůvků, viz např. Maedler et al. [4]. V dřívějších dobách po selhání monoterapie metforminem bylo jedinou alternativou současné podávání SU, jinak bylo nezbytné začít s podáváním inzulinu. Dnes však je třeba se ptát, zda z dlouhodobého hlediska s ohledem na prognózu nemocných není výhodnější místo SU podávat jiná antidiabetika, zvláště když začíná být zřejmá spojitost mezi podáváním SU a výskytem kardiovaskulárních komplikací. Schramm et al. [5] nad národním registrem pacientů v Dánsku zjistili, že pacienti užívající SU vykazují vyšší mortalitu než pacienti užívající metformin, jedinou výjimkou byl gliklazid (druhý nejčastěji předepisovaný SU po glimepiridu). Podávání SU je ze všech PAD nejvíce zatíženo rizikem výskytu hypoglykémie a zvyšování tělesné hmotnosti.
Lékové interakce SU
Na vzniku hypoglykémie se může podílet i skutečnost, že SU jsou metabolizovány na CYP2C9 a také na CYP2C8 (jedině glibenklamid se majoritně metabolizuje na CYP3A4 a méně pak na CYP2C9) a že řada léků rychlost takové metabolizace ovlivňuje. V tabulce 1 jsou uvedeny léky, které inhibují, respektive indukují rychlost metabolizace léků na CYP2C8, CYP2C9 a CYP3A4, a/nebo rychlost transportu na přenašečích P-gp (glykoprotein P) a OATP, což může ovlivnit plazmatické koncentrace SU i jejich účinky žádoucí i nežádoucí.
Table 1. Inhibitory a induktory vybraných izoenzymů P450 a transportérů (DrugAgency a.s., 2018) 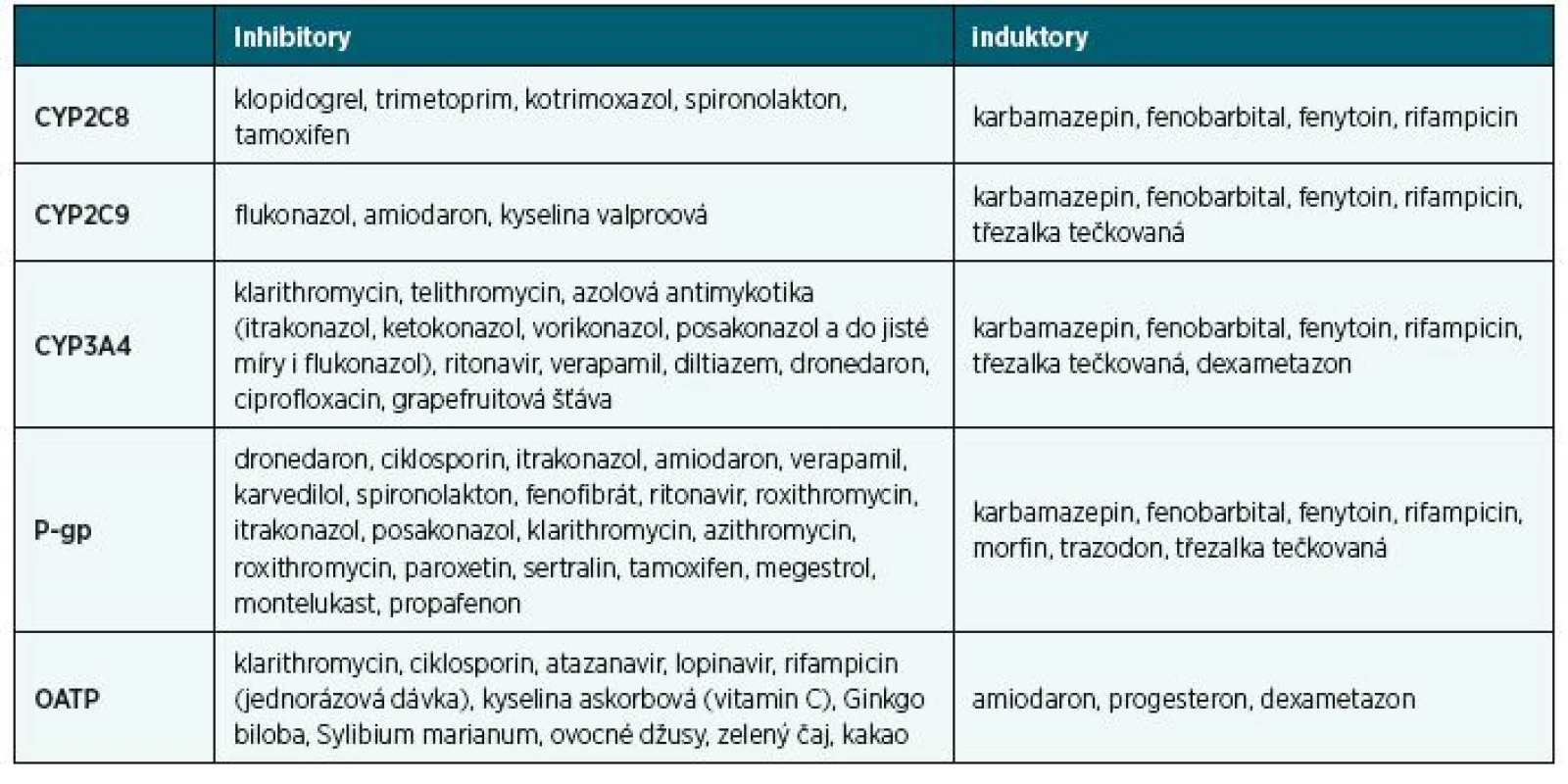
Nárůst plazmatických koncentrací SU způsobený lékovými interakcemi není bezvýznamný, což dokládá graf 4, zdrojem je publikace Diflucan Product Monograph, 2010. Vidíme zde například, že současné podání flukonazolu 100 mg denně (inhibitor CYP2C9) a jednorázové dávky glibenklamidu 5 mg vedlo k průměrnému zvýšení plazmatických koncentrací glibenklamidu průměrně o 44 %, přičemž rozptyl činil od 13 % až po 115 %. Zvýšení plazmatických koncentrací o 115 %, tedy na více než dvojnásobek, lze nepochybně považovat za klinicky významné, což ostatně dokládá i sdělení, že u pěti z dvaceti dobrovolníků, jimž byl glibenklamid s flukonazolem podán, došlo k hypoglykémii. Podobné změny lze též očekávat, když s glibenklamidem (nebo s jinými SU) podáme amiodaron (druhé nejčastěji užívané antiarytmikum), nebo kyselinu valproovou (antiepileptikum). Zmíněné zvýšení plazmatických koncentrací SU způsobené inhibicí CYP2C9 nastává ihned po vstřebání inhibitoru. Pokud inhibitor vysadíme, tento efekt mizí vzápětí po eliminaci inhibitoru z organismu. Naopak třezalka tečkovaná je induktorem CYP2C9, urychluje metabolismus SU a snižuje jejich účinek. Podobně metabolizaci SU ovlivňují další induktory, jako jsou např. karbamazepin, fenytoin nebo fenobarbital. Podmínkou však je, aby induktory CYP2C9 byly podávány nepřetržitě po dobu několika dní, aby se jejich účinek mohl projevit, a po ukončení podávání induktoru jejich indukční účinek působí nejméně 1–2 týdny poté.
Graph 4. Změny plazmatických koncentrací derivátů sulfonylurey vlivem inhibitorů, respektive induktorů CYP2C9 
Následující kazuistika ukazuje, že hypoglykémie způsobená SU a inhibitorem CYP2C9 může být hluboká a protrahovaná. Gunaratne et al. [6] popisují případ 56letého pacienta léčeného metforminem 2500 mg denně, gliklazidem s prodlouženým uvolňováním 90 mg denně, inzulinem 24 IU denně, kterému byl pro suspektní mykotickou pneumonii nasazen perorální flukonazol 480 mg. Již druhý den v 18 hodin musel být pacient hospitalizován pro příznaky těžké hypoglykémie, která při přijetí činila 1,7 mmol/l. Pacientovi byl opakovaně podáván slazený ovocný džus a sendvič, přesto se glykémie vracela k normě pomalu, až 1 hodinu po půlnoci dosáhla 5,9 mmol/l. Podávání flukonazolu bylo ukončeno a podávání gliklazidu bylo přerušeno. Ve 4 hod 30 min byl pacient probuzen ke kontrole, opět jevil evidentní známky hypoglykémie, která v tu dobu činila 1,4 mmol/l. Ihned byla podána dextróza v bolusové dávce a poté v kontinuální infuzi a současně byl podáván oktreotid. Stav pacienta se následně pomalu znormalizoval.
Riziko hypoglykémie, deriváty sulfonylurey a antibiotika
Ve studii Parekh et al. [7] nad databází Texas Medicare (USA) byly v letech 2006–2009 sledovány případy pacientů ve věku 66 let a více, kterým byl předepsán glibenklamid nebo glipizid a jimž byla během takové léčby předepsána ATB, respektive chemoterapeutika. Nárůsty rizik hypoglykémie u klarithromycinu, levofloxacinu, ciprofloxacinu, kotrimoxazolu i metronidazolu jsou uvedeny v tabulce 2.
Table 2. Zvýšení rizika hypoglykémie deriváty sulfonylurey 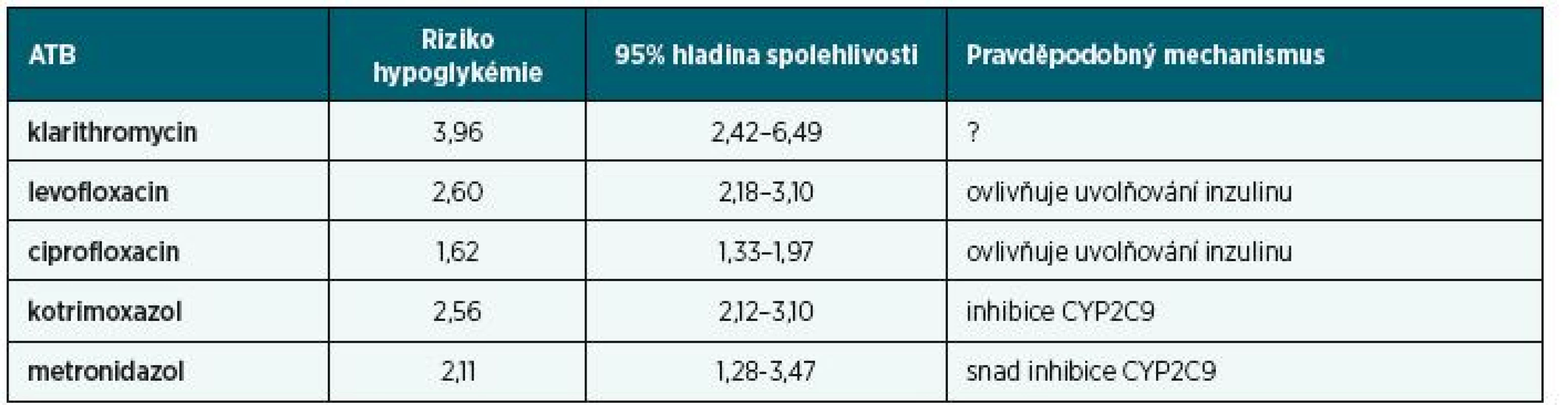
GLIPTINY – INHIBITORY DPP-4
Inkretiny jsou tělu vlastní hormony, které produkují endokrinní buňky GIT. Inkretiny stimulují sekreci inzulinu, snižují uvolňování glukagonu a vykazují i další antidiabetogenní účinky v CNS i v GIT. Potrava fyziologicky stimuluje vyplavování inkretinů do krve. Peptid podobný glukagonu (zkratka GLP-1) patří mezi důležité inkretiny. Po uvolnění GLP-1 do krevního řečiště jeho hladiny rychle klesají, neboť jej intenzivně metabolizuje enzym dipeptidylpeptidáza 4 (DPP-4). Gliptiny jsou léky, které inhibují destruktivní účinek DPP-4, čímž snižují metabolizaci GLP-1 a zvyšují jeho plazmatické koncentrace. Gliptiny snižují glykémii postprandiální i ranní glykémii nalačno a snižují hodnoty glykovaného hemoglobinu cca o 5 mmol/mol. Neovlivňují tělesnou hmotnost. Na rozdíl od SU samy o sobě nevedou k hypoglykémii, riziko hypoglykémie se zvyšuje jen při současném podávání SU nebo inzulinu. Gliptiny lze (při intoleranci metforminu) užívat v monoterapii, zpravidla však bývají součástí kombinací s metforminem i jinými PAD, a také s inzulinem.
Bezpečnost gliptinů
Předmětem diskusí je bezpečnost jejich dlouhodobého podávání z hlediska celkové mortality, rizika kardiovaskulárních příhod, srdeční nedostatečnosti a snad i rizika nádorových onemocnění. Kardiovaskulární bezpečnost byla prokázána pro sitagliptin (studie TECOS), saxagliptin (studie SAVOR-TIMI), alogliptin (studie EXAMINE), a v nejbližších dnech mají být publikovány výsledky pro linagliptin (studie CAROLINA). Byla zaznamenána hlášení poruch funkce jater u vildagliptinu, proto vildagliptin nesmí být podáván u pacientů se zhoršenou funkcí jater. U všech pacientů léčených vildagliptinem je třeba monitorovat jaterní testy, v prvním roce léčby výrobce přípravku Galvus (vildagliptin) stanovuje tříměsíční intervaly pro taková vyšetření.
Lékové interakce gliptinů
Gliptiny jsou malé, vzájemně značně odlišné molekuly, které různě interagují. Tabulka 3 ukazuje spotřeby gliptinů v roce 2017 (DDD/TID), míru metabolizace a způsoby metabolizace na izoenzymech cytochromu P450 a transportu prostřednictvím P-gp. Čím vyšší je podíl metabolizace, tím výraznější můžeme očekávat interakce na jednotlivých cytochromech a naopak (viz tab. 3). Údaje o spotřebách byly získány z dat publikovaných SÚKLem a zahrnují též spotřeby kombinací jednotlivých gliptinů. Zdrojem ostatních údajů je práce Scheen et al. [8]. Lékové interakce lze očekávat především u saxagliptinu (významný substrát CYP3A4) a linagliptinu (významný substrát P-gp).
Table 3. Spotřeby gliptinů v roce 2017 vyjádřené v DDD/1000 obyvatel/den, stupeň a způsob jejich metabolizace na izoenzymech P450 a transportu prostřednictvím P-gp 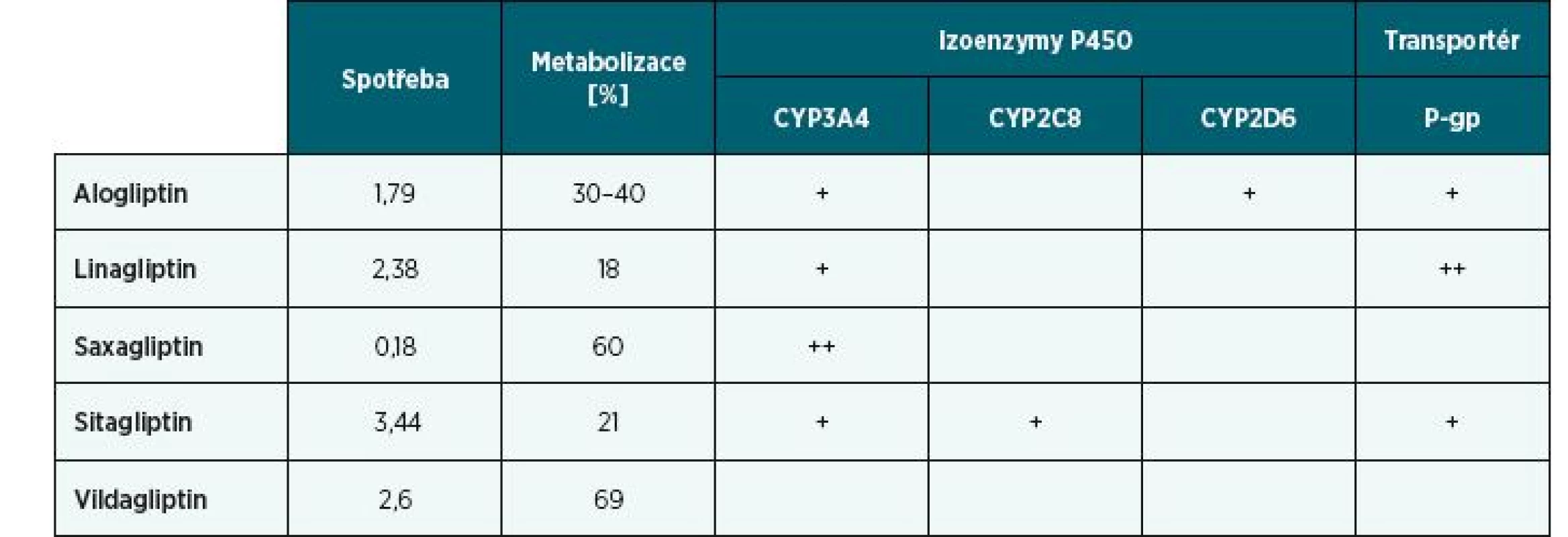
Z tabulky 3 je patrné, že plazmatické koncentrace saxagliptinu zvyšují inhibitory CYP3A4. Scheen et al. [8] zjistili zvýšení plazmatických koncentrací o 145 % po podání ketokonazolu, který je silným inhibitorem CYP3A4, a o 109 % po podání diltiazemu, který je středně silným inhibitorem CYP3A4. Linagliptin je metabolizován na CYP3A4 a je substrátem P-gp. Výrobce linagliptinu uvádí, že ritonavir, který je silným inhibitorem CYP3A4 a středně silným inhibitorem P-gp, zvyšuje plazmatické koncentrace linagliptinu na dvojnásobek. Pozoruhodné je, že výrobce linagliptinu v ČR [9] nepovažuje takové interakce za klinicky významné, kdežto výrobce v USA [10] důrazně doporučuje zvolit raději jinou terapii. Domníváme se, že je namístě zachovat obezřetnost nejen při současném podávání linagliptinu a ritonaviru, ale též při současném podávání linagliptinu a itrakonazolu, klarithromycinu, verapamilu a dronedaronu, které jsou současně jak inhibitory CYP3A4, tak i P-gp, respektive při současném podávání karbamazepinu, fenytoinu, fenobarbitalu a třezalky tečkované, neboť tyto jsou induktory P-gp a mnoha dalších izoenzymů P450 a mohly by účinek linagliptinu snížit (viz tab. 1). Jinak je to se sitagliptinem a s alogliptinem, kde lze očekávat klinicky významnou interakci jen za zvláštních podmínek, jako je výrazné snížení renálních funkcí, jak uvádí výrobce sitagliptinu [11]. Vildagliptin neinteraguje vůbec, neboť se metabolizuje cestou hydrolýzy.
Analoga GLP-1
GLP-1 je přirozený peptid, který je vytvářen buňkami střeva. Vzhledem k jeho krátkému poločasu několika minut byly vytvořeny analoga GLP-1, které mají mnohem delší poločas, neboť (na rozdíl od tělu vlastnímu GLP-1) jsou odolné vůči odbourávání prostřednictvím DPP-4. Analoga GLP-1 mají komplexní působení: v pankreatu zvyšují sekreci inzulinu, snižují chuť k jídlu, ve svalové a tukové tkáni zvyšují utilizaci glukózy, a také zvyšují novotvorbu glykogenu. Snižují hodnoty glykovaného hemoglobinu cca o 10 mmol/mol, nevedou k hypoglykémii, snižují hmotnost a mohou vést k poklesu systolického krevního tlaku cca o 3–4 mmHg [1]. Lze je kombinovat prakticky se všemi antidiabetiky (kromě inhibitorů DPP-4) včetně inzulinu.
Bezpečnost analog GLP-1
Nejčastějším nežádoucím účinkem analog GLP-1 je nauzea a další gastrointestinální obtíže, které se objeví při začátku terapie a které zpravidla pozvolna odezní. Otázkou je jejich dlouhodobý vliv na celkovou mortalitu a kardiovaskulární rizika. Zatím byla doložena kardiovaskulární bezpečnost u lixisenatidu a liraglutidu, jehož dlouhodobé podávání diabetikům s vysokým kardiovaskulárním rizikem v dávkách 1,8 mg denně vedlo ke snížení kardiovaskulární mortality o 22 % a celkové mortality o 15 %. U pacientů však nejsou tyto léky zatím příliš oblíbené, neboť se aplikují injekčně, a to 1krát nebo 2krát denně (exenatid IR, liraglutid, lixisenatid) a nové přípravky 1krát za týden (exenatid SR, albiglutid, dulaglutid). Na rozdíl od inzulinu není třeba monitorovat glykémii.
Lékové interakce analog GLP-1
Analoga GLP-1 (podobně jako tělu vlastní GLP-1) jsou peptidy, proto nemají prakticky žádné farmakokinetické interakce, jedinou výjimkou je zpomalení evakuace žaludku a tedy i nástupu účinku řady perorálně podávaných léků. U dlouhodobě podávaných léků není pro jejich účinek důležité, za jak dlouho po podání léky začnou účinkovat (protože jejich plazmatické koncentrace bývají udržovány každodenním podáváním), plochu pod křivkou plazmatických koncentrací analoga GLP-1 nijak významně nemění. Naopak u paracetamolu na rychlosti nástupu účinků záleží, analoga GLP-1 bohužel výrazně oddalují začátek jeho analgetického působení.
GLITAZONY – PIOGLITAZON
Glitazony (neboli thiazolidindiony) působí aktivací receptorů PPARγ, čímž je snižována rezistence na inzulin v buňkách jater, tukové tkáni a kosterního svalstva. Glitazony dále snižují novotvorbu glukózy v játrech a zvyšují periferní eliminaci glukózy v případě inzulinové rezistence. Glitazony snižují ranní glykémii nalačno zhruba o 2–3 mmol/l a přiměřeně tomu glykémii postprandiální. Pokles hodnot glykovaného hemoglobinu monoterapií glitazony je srovnatelný s léčbou metforminem a činí cca 5–15 mmol/mol.
Bezpečnost pioglitazonu
Může dojít k retenci tekutin, proto se nepodávají u srdečního selhání, edémových stavů a v těhotenství. Jiné glitazony než pioglitazon již nejsou v ČR k dispozici, neboť troglitazon byl stažen z trhu v roce 2000 z důvodů hepatotoxicity a rosiglitazon v roce 2010 z důvodů kardiotoxicity. Oproti tomu spotřeba pioglitazonu u nás v letech 2015/2017 vzrostla o 36 % na 1,27 DDD/TID. Pioglitazony by samy o sobě neměly způsobit hypoglykémii, vzácně se však taková příhoda vyskytnout může.
Lékové interakce pioglitazonu
Pioglitazon je z 99 % metabolizován, je citlivým substrátem CYP2C8 a metabolizuje se z menší části též na CYP3A4. Má tedy podobné interakce jako repaglinid a SU, změny plazmatických koncentrací repaglinidu jinými, současně podávanými léky jsou znázorněny v grafu 5. Ve studii Itkonen et al. 2016 [12] u 10 zdravých dobrovolníků byl podán klopidogrel v první dávce 300 mg a poté po dva dny 75 mg denně, nebo bylo podáno placebo. Pioglitazon v dávce 15 mg byl podán 1 hodinu po první dávce klopidogrelu, respektive placeba. Klopidogrel zvýšil AUC pioglitazonu průměrně o 110 % (80–160 % na 90% hladině spolehlivosti). Autoři studie upozorňují, že podávání klopidogrelu by mohlo zvýšit nežádoucí účinky pioglitazonu, jako je například retence tekutin. Ve studii Tornio et al. [13] byl u 16 zdravých dobrovolníků po dobu 6 dní podáván trimethoprim 160 mg 2krát denně, třetí den studie byl podán pioglitazon v jednorázové dávce 15 mg. Trimethoprim zvýšil AUC pioglitazonu o 42 % (p < 0,001). Ve studii Jaakkola et al. [14] rifampicin podávaný po dobu 6 dnů snížil AUC pioglitazonu o 54 % (22–66 % na 95% hladině spolehlivosti). Lze tedy předpokládat, že klinicky významně budou interagovat i karbamazepin, fenytoin, fenobarbital i třezalka tečkovaná, a to ve smyslu snížení účinku pioglitazonu (neboť to jsou induktory CYP2C8 i CYP3A4), viz tabulka 1. K lékovým interakcím patří i potenciace retence tekutin při současném podávání NSA.
Graph 5. Rozložení výběrového vzorku na základě počtu obyvatel obce, v níž senior žije 
GLINIDY – REPAGLINID
Glinidy zvyšují sekreci inzulinu inhibicí ATP--dependentních kanálů pro draslík β-buněk pankreatu podobně jako SU, ale váží se na jiné vazebné místo a jejich vazba je ve srovnání se SU slabší. Účinek repaglinidu začíná za 30 minut a je krátkodobý. Glykémie nalačno není prakticky vůbec ovlivněna. Glinidy se podávají k ovlivnění postprandiální glykémie před hlavními jídly, v individuálně vytitrované dávce 0,5–4,0 mg zpravidla 3krát denně. Titrace je nutná proto, že při předávkování by mohly vyvolat hypoglykémii, přičemž různí pacienti potřebují různé dávky repaglinidu, aby bylo dosaženo žádoucího účinku. Jejich využití v klinické praxi již delší dobu zůstává na okraji zájmu, jak uvádí Pelikánová [1]. V kohortové studii autorů Schramm et al. [5] bylo u pacientů s repaglinidem zjištěno riziko hospitalizace pro srdeční selhání vyšší o 53 % (24 % až 8 % na 90% hladině spolehlivosti). Mortalita pacientů nebyla repaglinidem ovlivněna.
V současné době je v ČR dostupný pouze repaglinid, který je substrát především CYP2C8 a také CYP3A4, OATP1B1 a OATP1B3. Plazmatické koncentrace repaglinidu i jeho účinky jsou zvýšeny, pokud jsou podávány inhibitory těchto izoenzymů a transportérů, a naopak sníženy při podávání induktorů (viz výše, též tab. 1).
Zdrojem údajů pro graf 6 jsou klinické studie Niemi et al. [15–17] a také SPC výrobce repaglinidu [18]. Klopidogrel (silný inhibitor CYP2C8) při podání jednorázové nasycovací dávky zvyšuje AUC repaglinidu více než 4krát, při dlouhodobém podávání je AUC repaglinidu zvýšena 2,9krát. Trimethoprim (včetně kotrimoxazolu) je středně silný inhibitor CYP2C8 a zvyšuje AUC repaglinidu průměrně o 60 %. Inhibitory CYP3A4, jako je itrakonazol a klarithromycin, zvyšují AUC repagulindu v průměru „pouze“ o 40 %, ale cyklosporin, který je inhibitor CYP3A4 a zároveň i OATP, zvyšuje AUC repaglinidu o 150 %. Induktory CYP2C8 a CYP3A4, jako je např. rifampicin, snižují AUC repaglinidu o 50–80 %; karbamazepin, třezalka a další (tab. 4) budou interagovat podobně.
Graph 6. Změny plazmatických koncentrací repaglinidu způsobené interagujícími léky 
Table 4. Vybrané nekardiovaskulární ukazatelé bezpečnosti podávání gliflozinů 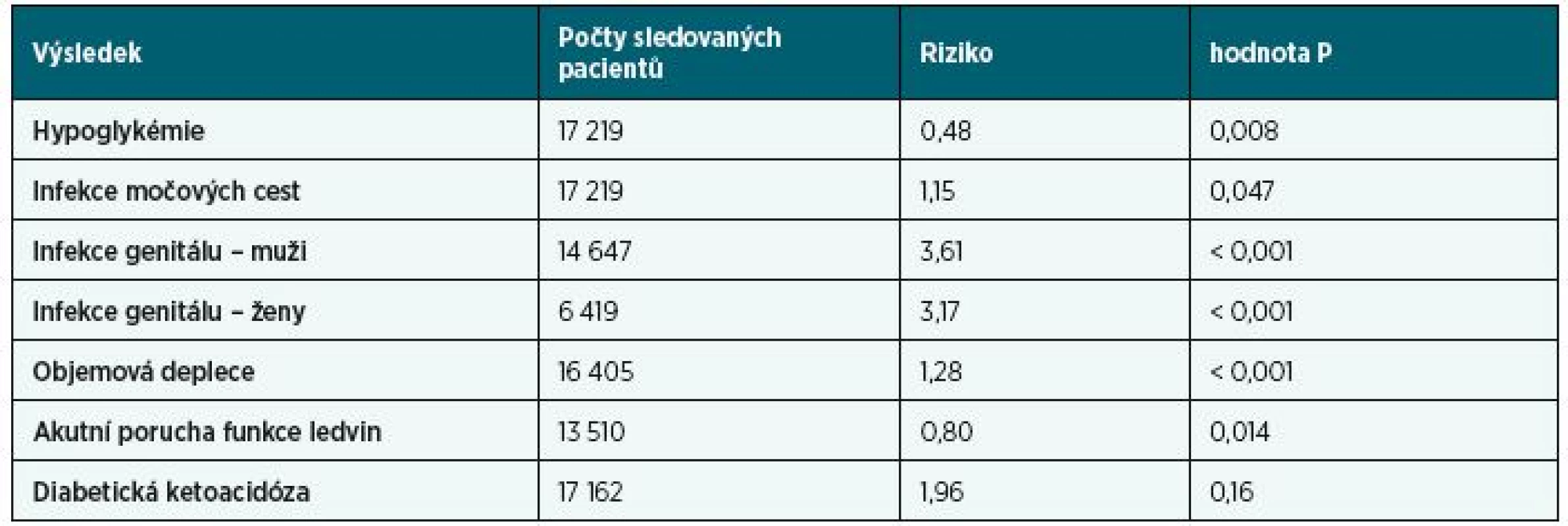
Doporučení pro lékové interakce repaglinidu: Rozhodně bychom měli respektovat SPC [18], které doporučuje vyvarovat se současnému podávání repaglinidu s klopidogrelem a pokud možno nepodávat s repaglinidem trimethoprim. U ostatních bychom měli zachovávat opatrnost a individuálně zvažovat přínosy a rizika kombinací repaglinidu pro jednotlivé pacienty. Pro takové zvažování pro a proti je vhodné připomenout, že repaglinid není uveden v základním algoritmu kombinační terapie diabetes mellitus [2].
GLIFLOZINY – INHIBITORY SGLT2
Přestože glifloziny jsou nejnovější skupinou antidiabetik, patří k lékům s prokázaným příznivým vlivem nejen na morbiditu, ale také na mortalitu pacientů. Protože lze očekávat postupné, nebo možná i razantnější rozšiřování preskripce pro široký okruh pacientů, kterým glifloziny mohou prokázat značný užitek, budeme se v tomto článku těmto lékům věnovat podrobněji. Inhibitory SGLT2 snižují glykémii nalačno i glykémii postprandiální a snižují hodnoty glykovaného hemoglobinu o 15–25 mmol/mol. Jejich mechanismus účinku spočívá v inhibici transportní pumpy SGLT2, která je exprimovaná v ledvinách. Tato pumpa za normálních okolností reabsorbuje glukózu z glomerulárního filtrátu zpět do organismu, takže člověk nepřichází o důležitý zdroj energie. Inhibicí SGLT2 způsobené glifloziny transportní pumpa přestává reabsorbovat glukózu a ta uniká močí, člověk tak ztrácí zhruba 70 gramů glukózy denně. To je výhodné zejména pro obézní pacienty, kteří mají v organismu uskladněné energie až moc a kteří se dosud marně snažili dodržovat redukční dietu. Není divu, že se spotřeby těchto léků v ČR za poslední dva roky zdvojnásobily a jejich nárůst bude nepochybně pokračovat, neboť přibývá důkazů o příznivém působení těchto léků i na „přidružená“ onemocnění. Například v metaanalýze pěti klinických studií zkoumajících glifloziny autorů Zhang et al. [19] u celkem 35 1476 pacientů s DM2 sekvenční analýza prokázala 20% snížení kombinovaného kardiovaskulárního výsledku (MACE) i mortality. Kromě toho podávání gliflozinů celkově snížilo progresi albuminurie, poklesla průměrně o 32 % (p < 0,001).
Bezpečnost gliflozinů
Bezpečnost dlouhodobé glykosurie dokládá skutečnost, že existuje geneticky podmíněné onemocnění, tzv. familiární renální glykosurie, které není spojeno s rozvojem chronické infekce močových cest ani s rozvojem chronické renální nedostatečnosti [1]. Glykosurie vyvolaná glifloziny je však spojena s polyurií a ta za určitých podmínek může způsobit poruchy elektrolytové rovnováhy. Tabulka 4 shrnuje výsledky šetření důležitých ukazatelů bezpečnosti gliflozinů, tak jak byly zjištěny ve výše zmíněné metaanalýze [19]. Vzácnými nežádoucími účinky gliflozinů je diabetická ketoacidóza, která není vyvolána hyperglykémií, a dále vyšší riziko amputace na DK u zvlášť rizikových pacientů se syndromem diabetické nohy.
Z tabulky 4 je zřejmé, že riziko hypoglykémie bylo při léčbě glifloziny sníženo na polovinu (!) a že výskyt akutní poruchy funkce ledvin byl nižší o 20 %. Výskyt infekce močových cest byl zvýšen pouze o 15 %, ale pacienty zřejmě bude více trápit infekce genitálu, neboť zmíněná metaanalýza prokázala více než trojnásobný nárůst oproti placebu nebo jiné antidiabetické terapii. Nejvíce se však obáváme výskytu objemové deplece tělesných tekutin, i když frekvence takových příhod byla zvýšena „jen“ o 28 % (p < 0,001). I samotní výrobci gliflozinů [20–22] upozorňují, že je zapotřebí opatrnosti u pacientů, u kterých může pokles krevního tlaku vyvolaný glifloziny představovat riziko, což jsou např. pacienti se známým kardiovaskulárním onemocněním (což je ovšem cílová skupina těchto léků – diabetici s kardiovaskulárním onemocněním), pacienti léčení antihypertenzivy s anamnézou hypotenze nebo starší pacienti. U takových pacientů je třeba provádět pečlivé sledování objemového statutu (např. fyzikálním vyšetřením, měřením krevního tlaku, laboratorními testy včetně hematokritu) a elektrolytů. U pacientů, u kterých je zjištěna objemová deplece, se doporučuje dočasné přerušení léčby glifloziny až do doby, než dojde ke korekci objemové deplece. Jak známo, pokud dojde k výraznému snížení objemu tělesných tekutin, hrozí vznik akutní poruchy funkce ledvin prerenálního typu, který může navodit selhání ledvin. Glifloziny tedy za normálních okolností ledviny diabetika chrání před progresí nefropatie (viz výše), paradoxně ale mohou za určitých okolností k renálnímu selhání přispět (viz níže). Dalším problémem je zhruba 2krát vyšší frekvence amputací v oblasti dolních končetin u diabetiků 2. typu užívajících glifloziny, kteří trpí kardiovaskulárním onemocněním, a u kterých byly zjištěny alespoň dva další rizikové faktory. Mezi řídkými nežádoucími účinky gliflozinů výrobci uvádějí vznik diabetické ketoacidózy. Samy o sobě glifloziny hypoglykémii nepůsobí (viz též tabulka 4), ale v kombinaci s inzulinem nebo deriváty sulfonylurey k hypoglykémii nezřídka dochází. Může dojít k nevelkému zvýšení cholesterolu, a to celkového, LDL i HDL. Podávání gliflozinů by nemělo být zahájeno při trvalém poklesu glomerulární filtrace pod 60 ml/min/1,73m2, pokud u pacienta užívající gliflozin k takovému trvalému poklesu dojde, je třeba dávku gliflozinu snížit a při trvalém poklesu pod 45 ml/min/1,73m2 je třeba léčbu glifloziny ukončit.
Lékové interakce gliflozinů
Glifloziny se metabolizují glukuronizací prostřednictvím různých izoenzymů UGT, a to zejména na UGT1A9. Nemetabolizují se na žádném z izoenzymů cytochromu P450 a nejsou ani substráty přenašečů P-gp. Empagliflozin je též substrátem transportéru OATP. Podávání rifampicinu (který kromě jiného indukuje i UGT) vedlo k víceméně zanedbatelnému poklesu plazmatických koncentrací gliflozinů (dapagliflozinu o 7 %, kanagliflozinu o 28 % a empagliflozinu o 19 %), farmakokinetických lékových interakcí se tedy zřejmě bát nemusíme.
Při předepisování léků pacientům užívajících glifloziny musíme především věnovat pozornost jejich interakci s diuretiky, a to zejména kličkovými, ale také s ostatními (hydrochlorothiazid a pravděpodobně i indapamid). Diuretické účinky gliflozinu a diuretik se totiž vzájemně potencují a u vnímavých osob (zejména u seniorů) mohou vést k těžké dehydrataci a k renálnímu selhání. Kromě toho bylo prokázáno, že glifloziny zvyšují účinek antihypertenziv, a to jak diuretik, ACE-inhibitorů, betablokátorů i blokátorů kalciových kanálů, jak zjistili Mancia et al. [37] a Weber et al. [38]. V metaanalýze studií u diabetiků léčených inhibitory SGLT2 Reed et al. [39] bylo zjištěno, že dapagliflozin, kanagliflozin i empagliflozin u pacientů s DM2 a hypertenzí snižují TK, přičemž intenzita antihypertenzního účinku byla u všech tří léků srovnatelná. Graf 7 znázorňuje potenciaci účinku dapagliflozinu a hydrochlorothiazidu na exkreci natria močí, který byl zjištěn v dosud nezveřejněné Study MB 102004 [23].
Graph 7. Potenciace natriuretického účinku hydrochlorothiazidu dapagliflozinem Study MB 102004 
Výrobci gliflozinů renální selhání (respektive akutní poškození funkce ledvin) uvádějí mezi méně častými nežádoucími účinky a uvádějí, že rizikovými faktory pro vznik renálního selhání je preexistující poškození renálních funkcí, vyšší věk, dehydratace, v USA výrobci [24–26] mezi rizikovými faktory též uvádí současné podávání diuretik, ACE-inhibitorů (respektive inhibitorů angiotenzinu II) a NSA, což se ve světové literatuře označuje jako „triple whammy“, neboli trojitá facka.
Účinek diuretik je inhibitory SGL2 potencován tím, že glukóza unikající močí s sebou strhává vodu a natrium. Ztráta tekutin způsobená zvýšenou diurézou však u zdravých lidí nevede ke snížení filtračního tlaku v glomerulu, a tedy ani ke snížení glomerulární filtrace, neboť organismus se dokáže s takovými jevy vypořádat. Využívá přitom zejména renin-angiotenzinový systém (RAAS) a prostaglandiny, jak je zřejmé z obrázku 1, který byl vytvořen podle práce Prieto-Garcia [27]. NSA jako inhibitory cyklooxygenáz výrazně sníží tvorbu prostaglandinů a zabrání tak dilataci aferentní arterie v glomerulu ledvin, kterým se ledviny brání proti snížení glomerulární filtrace. ACE-inhibitory (respektive inhibitory angiotenzinu II) zase zabrání reaktivnímu zúžení eferentní arterie, což je další ochranný mechanismus chránící pacienty před renálním selháním. Nejvyšší riziko představuje trojkombinace takových léčiv – současné podávání diuretik, ACE-inhibitorů (respektive inhibitorů angiotenzinu II) a NSA (obrázek 2). Vysokou frekvenci renálního selhání popsali Mandal et al. [28] při podání ACE-inhibitorů a diuretik, prognóza takové interakce však byla dobrá. V Austrálii v roce 2002 bylo hlášeno 129 případů akutního renálního selhání, z toho 28 pacientů užívalo ACE-inhibitor, diuretikum a NSA [29]. Medián věku takových pacientů byl 76 let, u 10 % pacientů příhoda skončila fatálně. Také Carmin et al. [30] ve Španělsku prokázali vyšší riziko takové kombinace a zjistili též nemalé riziko při kombinaci diuretik s NSA bez ACE inhibitorů zřejmě proto, že řada pacientů již před nasazením takové kombinace trpěla renálním nebo srdečním selháním.
Image 1. Reakce organismu na snížení glomerulární filtrace, např. při snížení objemu tělesných tekutin vyvolaném diuretickou léčbou 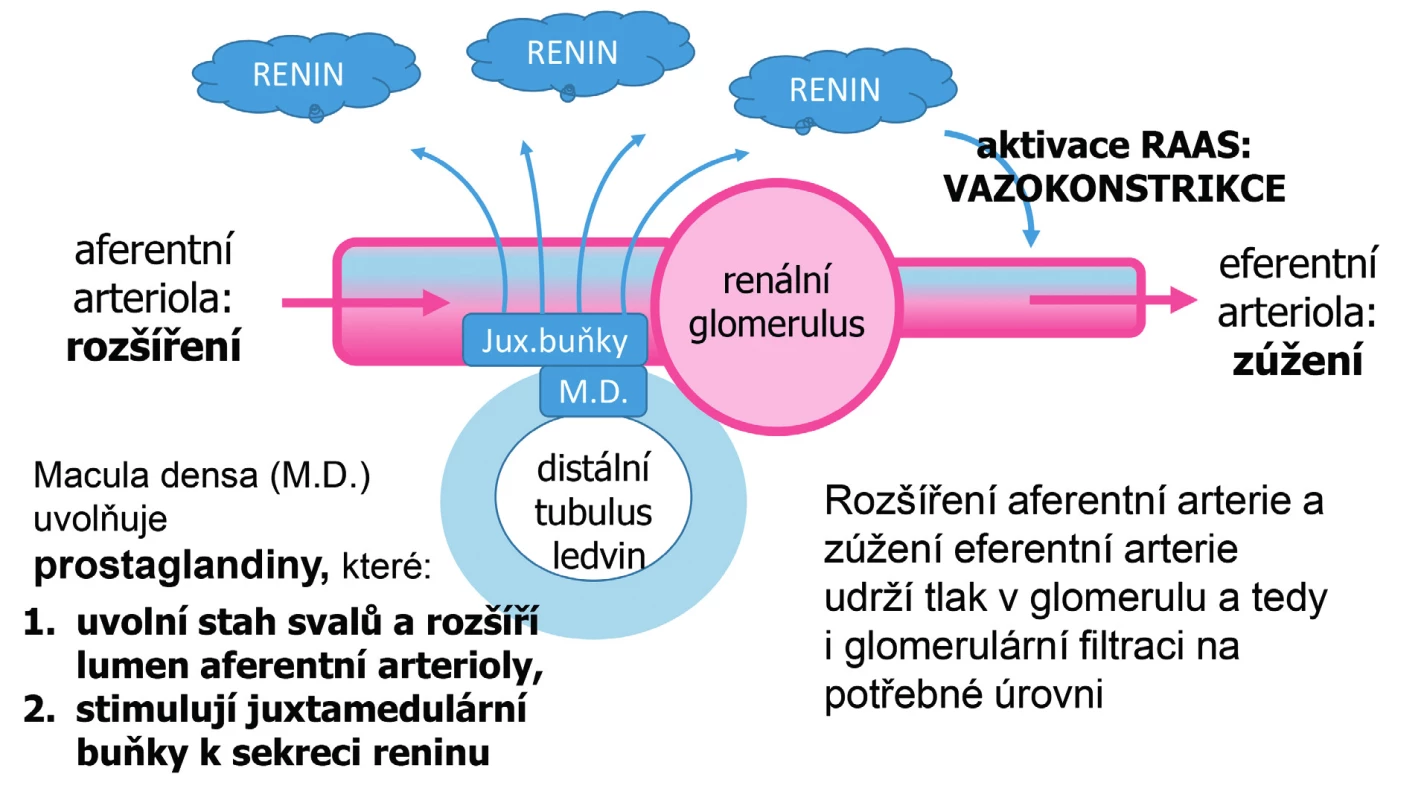
Image 2. Inhibitory SGLT2 a triple whammy 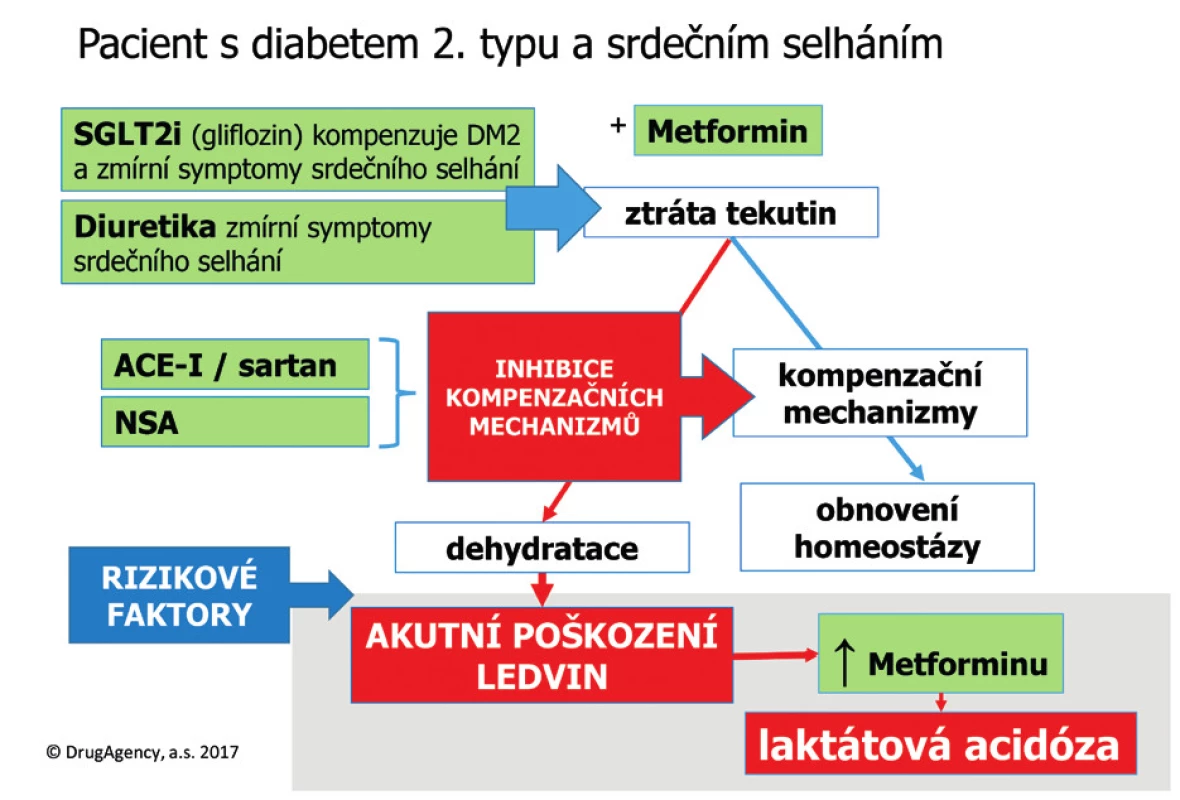
Lékaři by tedy měli být varováni, že současná terapie glifloziny může riziko takových kombinací ještě zvýšit, a to potenciací diurézy. Pacient může být ohrožen nejen samotným renálním selháním, ale také zvýšením plazmatických koncentrací léků, které se vylučují ledvinami, pokud je dotyčný pacient užívá. Pokud tedy pacient bude současně s glifloziny užívat metformin (což lze u většiny diabetiků očekávat), může v případě poruchy renálních funkcí dojít ke kumulaci metforminu a ke vzniku laktátové acidózy (obr. 2).
ZÁVĚR
Při zavádění nových léků na trh jsou lékaři o takových lécích informováni především od výrobců, a to přímo v rámci reklamních kampaní, a nepřímo prostřednictvím přednášek, odborných článků a jiných vzdělávacích aktivit, které bývají těmito výrobci sponzorovány. V České republice postrádáme nezávislý zdroj jednoduchých a srozumitelných informací o nových lécích, který by na základě recentních poznatků přednesl nejen přínosy, ale i rizika takových léků. Naše české doporučené postupy bývají zaměřeny především na léčbu nemoci a lékovou problematikou se zpravidla podrobně nezabývají. Důležitým zdrojem informací o lécích jsou SPC léků, ale jejich srozumitelnost a přehlednost bývá nedostatečná a informace v nich se často mění. Vynikajícím pramenem jsou Farmakoterapeutické informace SÚKL, které před lety bývaly rozesílány všem lékařům spolu s časopisem lékařské komory, což se nyní neděje. Jsou sice dostupné na webových stránkách SÚKL, ale nejsou propagovány a jejich témata bohužel pokrývají potřeby lékařů v terénu jen neúplně a ne zcela systematicky.
Nedostatek objektivních informací o léku může v lékařích probudit nekritický obdiv k novým možnostem terapie a podcenění rizikového profilu nových léků a jejich lékových interakcí, jak se již před lety stalo u kombinace ACE-inhibitorů/sartanů se spironolaktonem, kde pozitivní vliv na srdeční selhání může být zcela potlačen zvýšeným rizikem potenciálně fatální hyperkalémie [31, 32]. Náš článek se snaží podat vyvážené informace o přínosech a rizicích jak nových, tak i klasických léků užívaných k léčbě DM2, neboť lékaři takové informace potřebují nejen ke správně volené individuální terapii jednotlivých pacientů, ale i ke správné péči o léčené pacienty i v případě, že rizikový lék předepsal jiný lékař. Bezpečnost současně užívaných účinných léků je sice vysoká, ale nikdy nemůže být zcela absolutní.
Adresa pro korespondenci:
MUDr. Michal Prokeš
Klokotská 833/1a
148 00 Praha 4
e-mail: prokes@drugagency.cz
Sources
1. Pelikánová, T. Léčiva používaná k terapii diabetu. In: Suchopár, J. et al. Compendium – Léčiva používaná v podmínkách ČR, 5. vydání, s. 567–592.
2. Škrha, J., Pelikánová, T., Kvapil, M. Diabetes mellitus (za Českou diabetologickou společnost ČLS JEP). Doporučený postup péče o diabetes mellitus 2. typu. Dostupné na www: http://www.diab.cz/dokumenty/standard_lecba_dm_typ_II.pdf.
3. Dujic, T., Zhou, K., Donnelly, L. A. et al. Association of organic cation transporter 1 with intolerance to metformin in type 2 diabetes: a GoDARTS study. Diabetes, 2015, 64(5), s. 1786–1793.
4. Maedler, K., Carr, R. D., Bosco, D. et al. Sulfonylurea induced beta-cell apoptosis in cultured human islets. J Clin. Endocrinol. Metab., 2005, 90(1), s. 501–506.
5. Schramm, T. K., Gislason, G. H., Vaag, A. et al. Mortality and cardiovascular risk associated with different insulin secretagogues compared with metformin in type 2 diabetes, with or without previous myocardial infarction: a nationwide study. Eur Heart J., 2011, 32(15), s. 1900–1908.
6. Gunaratne, K., Austin, E., Wu, P. E. Unintentional sulfonylurea toxicity due to a drug-drug interaction: a case report. BMC Res Notes, 2018, 21, 11(1), s. 331. doi: 10.1186/s13104-018-3404-8.
7. Parekh, T. M., Raji, M., Lin, Y. L. et al. Hypoglycemia after antimicrobial drug prescription for older patients using sulfonylureas. JAMA Intern Med., 2014, 174(10), s. 1605–1612.
8. Scheen, A. J. Dipeptidylpeptidase-4 inhibitors (gliptins): focus on drug-drug interactions. Clin Pharmacokinet, 2010, 49(9), s. 573–588.
9. SPC přípravku Trajenta (linagliptin), Boehringer Ingelheim, 2016. Dostupné na www: http://www.sukl.cz/modules/medication/search.php.
10. FDA Label information Tradjenta, 2017, USA. Dostupné na www: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/201280s016lbl.pdf.
11. SPC přípravku Vipidia (sitatgliptin), Takeda Pharma, 2015. Dostupné na www: http://www.sukl.cz/modules/medication/search.php.
12. Itkonen, M. K., Tornio, A., Neuvonen, M. et al. Clopidogrel Markedly Increases Plasma Concentrations of CYP2C8 Substrate Pioglitazone. Drug Metab Dispos., 2016, 44(8), s. 1364–1371.
13. Tornio, A., Niemi, M., Neuvonen, P. J., Backman, J. T. Trimethoprim and the CYP2C8*3 allele have opposite effects on the pharmacokinetics of pioglitazone. Drug Metab Dispos., 2008, 36(1), s. 73–80.
14. Jaakkkolla, T., Backman, J. T., Neuvonen, M. et al. Effect of rifampicin on the pharmacokinetics of pioglitazone. Br J Clin Pharmacol., 2006, 61(1), s. 70–78.
15. Niemi, N., Neuvonen, P. J., Kivistö, K. T. The cytochrome P4503A4 inhibitor clarithromycin increases the plasma concentrations and effects of repaglinide. Clin Pharmacol Ther., 2001, 70(1), s. 58–65.
16. Niemi, N., Backman, J. T., Neuvonen, M., Neuvonen, P. J. Effects of gemfibrozil, itraconazole, and their combination on the pharmacokinetics and pharmacodynamics of repaglinide: potentially hazardous interaction between gemfibrozil and repaglinide. Diabetologia, 2003, 46(3), s. 347–351.
17. Niemi, M., Jajosaari, L. I., Neuvonen, M. et al. The CYP2C8 inhibitor trimethoprim increases the plasma concentrations of repaglinide in healthy subjects. Br J Clin Pharmacol., 2004, 57(4), s. 441–447.
18. SPC přípravku Novonorm (repaglinid), Novo Nordisk, 2016. Dostupné na www: http://www.sukl.cz/modules/medication/search.php.
19. Zhang, X. L., Zhu, Q. Q., Chen, Y. H. et al. Cardiovascular Safety, Long-Term Noncardiovascular Safety, and Efficacy of Sodium-Glucose Cotransporter 2 Inhibitors in Patients With Type 2 Diabetes Mellitus: A Systemic Review and Meta-Analysis With Trial Sequential Analysis. J Am Heart Assoc., 2018, 20;7(2). pii: e007165. doi: 10.1161/JAHA.117.007165.
20. SPC ČR: Invokana® (kanagliflozin), Janssen-Cilag, 10/2018. Dostupné na www: https://www.ema.europa.eu/documents/product-information/invokana-epar-product-information_cs.pdf.
21. SPC ČR: Forxiga® (dapagliflozin), AstraZeneca, 12/2017. Dostupné na www: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002322/WC500136026.pdf.
22. SPC ČR: Jardiance® (empagliflozin), Boehringer Ingelheim, 6/2018. Dostupné na www: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002677/WC500168592.pdf.
23. Australian Public Assessment Report for Dapagliflozine propanediol monohydrate, 2013. Dostupné na www: https://www.tga.gov.au/sites/default/files/auspar-dapagliflozin-propanediol-monohydrate-130114.pdf, vstup 27.7.2018.
24. FDA Full Prescribing Information (USA): Invokana® (kanagliflozin), Janssen Pharms, 7/2017. Dostupné na www: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/204042s026lbl.pdf.
25. FDA Full Prescribing Information (USA): Farxiga® (dapagliflozin), AstraZeneca, 10/2017. Dostupné na www: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/202293s012lbl.pdf.
26. FDA Full Prescribing Information (USA): Jardiance® (empagliflozin), Boehringer Ingelheim, 12/2017. Dostupné na www: https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/204629s016lbl.pdf.
27. Prieto-García, L., Pericacho, M., Sancho-Martínez, S. M. et al. Mechanismus of triple whammy acute kidney injury. Pharmacol Ther., 2016, 167, s. 132–145. doi: 10.1016/j.pharmthera.2016.07.011. Epub 2016 Aug 1.
28. Mandal, E. K., Market, R. J., Saklayen, M. G. et al. Diuretics potentiate angiotensin converting enzyme inhibitor-induced acute renal failure. Clin Nephrol., 1994, 42(3), s. 170–174.
29. No autors listed: ACE inhibitor, diuretic and NSAID: a dangerous combination. ADRAC bulletin, 2003, 22 (4), s. 14–15.
30. Carmin, R. M., Cols, M., Chevarria, J. L. et al. Acuta kidney injury secondary to combination of renin-angiotensin system inhibitors, diuretics and NSAIDS: „The Triple Whammy“. Nefrologia, 2015, 35(2), s. 197–206.
31. Juurlink, D. N., Mamdani, M. M., Lee, D. S. et al. Rates of hyperkalemia after publication of the randomized aldactone evaluation study. N Engl J Med., 2004, 351(6), s. 543–551.
32. Prokeš, M., Suchopár, J. Léky ovlivňující renin-angiotenzinový systém, diuretika a kalemie: jsme dostatečně opatrní? Med. Praxi, 2014, 11(3), s. 127–130.
Labels
Medical assessment Occupational medicine
Article was published inMedical Revision

2018 Issue 3-4
Most read in this issue- Zkušenosti z kontrol a revizí správnosti a oprávněnosti preskripce NOAC
- Antidiabetika nová i klasická v roce 2018*
- Posuzování zdravotního stavu osob s karcinomem prsu
- Metoda sebehodnocení v posudkové činnosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

