-
Medical journals
- Career
Je bolest břicha po traumatu pouze úrazové etiologie? Kazuistika raritní aspirační pneumonie s gangrénou plic a peritoneální odezvou u pětiletého dítěte
Authors: Ján Hrubovčák 1; Ubomír Tulinský 1; Peter Ihnát 1; Petr Jelínek 1; Ivana Slívová 1; Marcel Mitták 1; Jan Roman 1; Jan Stránský 2
Authors‘ workplace: Chirurgická klinika LF UO a FN Ostrava 1; Klinika úrazové chirurgie a ortopedie LF UO a FN Ostrava 2
Published in: Čas. Lék. čes. 2023; 162: 160-163
Category: Case report
Overview
I když je pneumonie relativně častá, ne vždy má klasické příznaky nebo nekomplikovaný průběh. Předkládaná kazuistika popisuje zřídkavý případ aspirační nekrotizující pneumonie, která i přes intenzivní terapii progredovala do gangrény plic a vyžádala si lobektomii. Netypická byla skutečnost, že správná diagnózu byla stanovena až při vyšetření traumatologem pro akutní bolesti břicha. Tento případ zdůrazňuje nutnost důkladného celkového vyšetření pacienta a upozorňuje na vzácnou, ale konzervativně neřešitelnou nekrotizující pneumonii komplikovanou gangrénou plic.
Klíčová slova:
pediatrie – bolest břicha – nekrotizující pneumonie – lobektomie – akutní břicho
ÚVOD
Bolesti břicha úrazové etiologie jsou poměrně častým důvodem návštěvy chirurgické či úrazové ambulance. Etiologie akutní bolesti v traumatologii je obvykle přímočará, jelikož je spojena s konkrétním úrazovým mechanismem. Tato skutečnost však nemusí platit absolutně. U traumatologických pacientů byl měl lékař uvažovat v souvislostech, často i nad rámec rutinních diagnóz (protože žádný medicínský obor není osvobozen od diferenciální diagnostiky). Předkládaná kazuistika demonstruje, že akutní bolesti břicha mohou být navzdory úrazové anamnéze vyvolány zcela jinou, extraabdominální patologií.
POPIS PŘÍPADU
5letá pacientka (15 kg, 104 cm) byla pro bolesti břicha dovezena rodiči na akutní traumatologickou ambulanci v čase ústavní pohotovostní služby. Rodiče bolesti břicha připisovali kontuznímu mechanismu, protože 6 dní předtím byla pacientka udeřena stejně starou dívkou pěstí do břicha. Potíže dítěte nabíraly na intenzitě v podobě stupňujících se bolestí břicha, nechutenství a zvracení. V anamnéze rodiče uváděli astma a sezonní alergie. Dívka užívala beklomethason-dipropionát (Ecobec) 100 µg 2× 1 vdech a salbutamol (Ventolin) při potížích, akutně navíc nyní dropropizin (Ditustat) 15 kapek 3× denně, bisulepin-hydrochlorid (Dithiaden) 1 mg na noc a paracetamol (Paralen) podle potřeby pro recentní respirační infekt. Očkována byla řádně – vakcinace proti klíšťové encefalitidě, hepatitidě A, rotavirům i pneumokokům (Prevenar 13).
Při úvodním vyšetření bylo dítě somnolentní, vyčerpané, zcela neschopné chůze nebo sedu; na dotazy odpovídalo adekvátně a uvádělo pouze bolesti břicha. Břicho bylo v niveau, klinicky difuzně peritoneální, peristaltika oslabena až neslyšná. Nebyla hmatná rezistence nebo kýla, bolest však adekvátní vyšetření břicha velmi limitovala. Do klasického obrazu peritoneálního dráždění úrazové etiologie nezapadala poměrně nízká intenzita úrazu (úder pěstí do břicha 5letou vrstevnicí).
Na ambulanci byly zaznamenány horečka 39,8 °C a známky oběhové nestability (TK 60/40 mmHg, tachykardie 180/min.). Srdeční ozvy sice byly bez šelestů, ale přesunuty doprava. Auskultačně bylo dýchaní vlevo výrazně oslabené, s malým okrskem trubicového dýchaní vepředu, tachypnoe dosahovala cca 30 vdechů/min. Pro nejednoznačnost symptomů, nevysvětlující anamnézu, avšak o to evidentnější závažnost celkového stavu, byl zajištěn periferní žilní vstup, provedeny skiagrafie hrudníku a ultrazvukové vyšetření břicha. Rentgen prokázal homogenní zastření celého plicního křídla vlevo a přesun mediastina doprava (obr. 1). Ultrasonografie břicha prokázala lem volné tekutiny v nadbráničním prostoru vlevo o šíři 16 mm, bez nitrobřišní patologie.
Image 1. Rtg snímek při přijetí 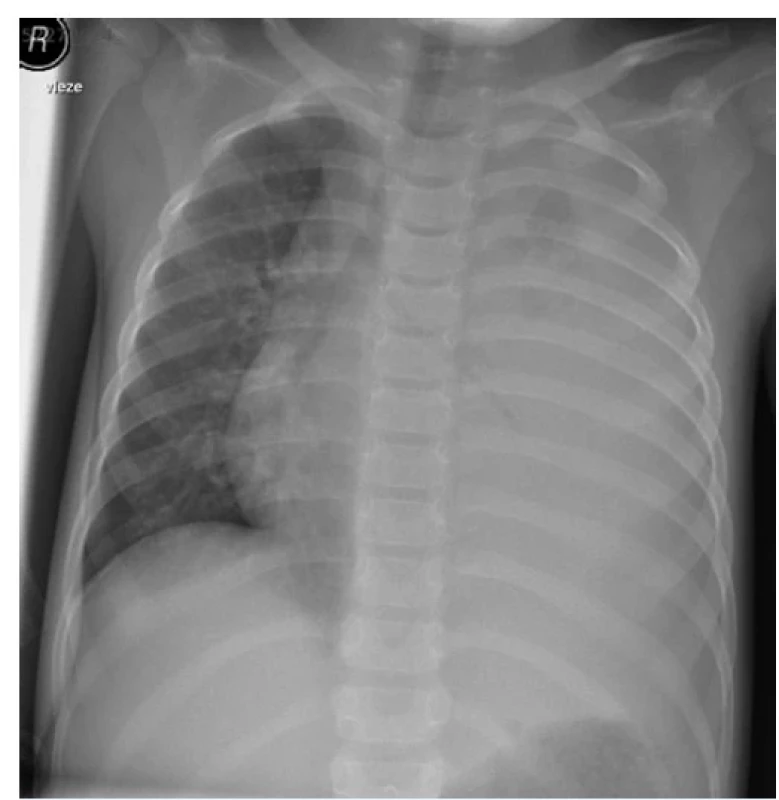
Zdravotní stav dítěte byl ihned konzultován s pediatry a po domluvě byla holčička hospitalizována na oddělení dětské resuscitační a intenzivní péče k léčbě levostranné alární pneumonie. Doplněná anamnéza ukázala, že již před 9 dny se u dítěte objevily kašel, nechutenství a febrilie (až 40 °C), během této doby byla dívka jednou vyšetřena praktickým dětským lékařem a dvakrát pediatrem na LSPP. Zdravotní stav byl hodnocen jako rinofaryngitida, viróza a akutní bronchitida s dehydratací. Odběry krve nebo rtg snímek hrudníku nebyly u dítěte s astmatem, protrahovanými febriliemi a domnělým respiračním infektem provedeny. Pro opakované negativní závěry stran respiračního infektu dávají rodiče zhoršující se zdravotní stav dítěte do souvislosti s předchozím úrazem a vyhledávají úrazovou pohotovost.
Na oddělení dětské resuscitační a intenzivní péče byly empiricky nasazeny cefotaxim a amikacin, zahájena oxygenoterapie, laboratoří hlášeny hladiny C-reaktivního proteinu (CRP) 407 mg/l a prokalcitoninu 10,7 μg/l. Výpočetní tomografie (CT) plic prokázala rozsáhlý fluidothorax vlevo a kondenzaci prakticky celého plicního křídla vlevo s deviací mediastina doprava. Navzdory intenzivní terapii došlo podle kontrolního rtg hrudníku k další progresi pleurálního výpotku vlevo. Proto byla 3 dny od příjmu za thorakoskopické kontroly provedena hrudní drenáž s odsátím cca 450 ml putridního výpotku. Metodou PCR byl ve výpotku prokázán Streptococcus pneumoniae.
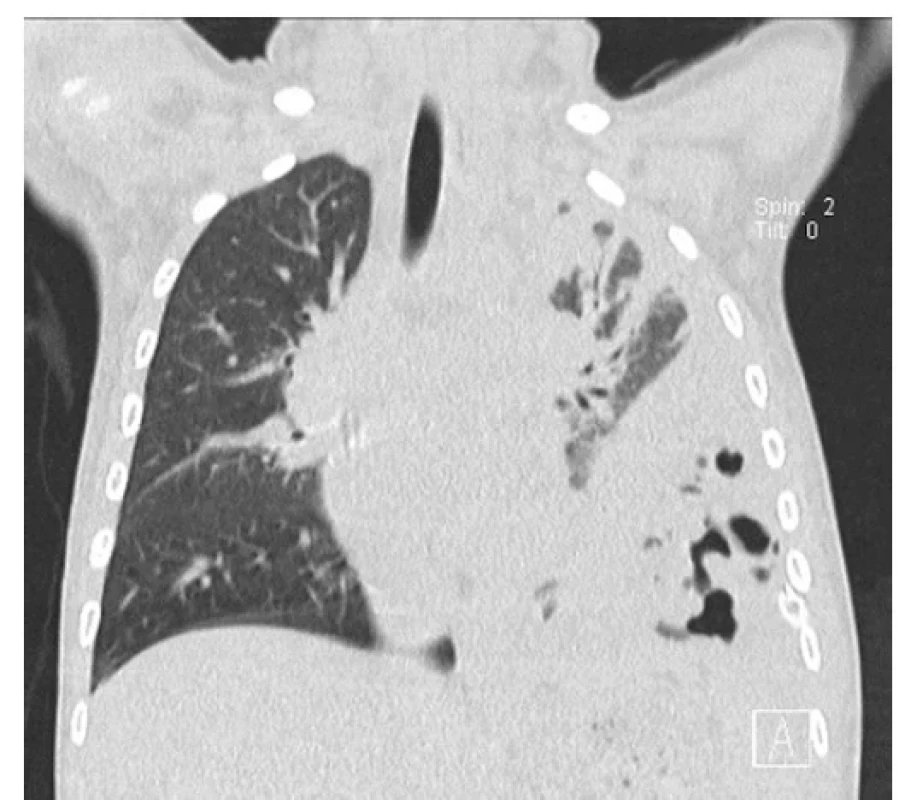
Po výkonu bylo dítě 2 dny na umělé plicní ventilaci; pro febrilie a nárůst hodnoty CRP byly nasazeny vysoké dávky krystalického penicilinu. Z hrudního drénu byl však nadále putridní odpad, kontrolní CT plic odhalila přetrvávající pyothorax a bubliny vzduchu vlevo s rozpadovými dutinami v levém dolním laloku (obr. 2). Obraz byl suspektní z gangrény plic, proto byla 11. den od příjmu indikována thorakotomická revize levé pohrudniční dutiny. Peroperačně se potvrdila abscedující pneumonie vlevo s gangrénou dolního plicního laloku. Proto byla provedena dolní lobektomie a dekortikace pleury vlevo (obr. 3). Histopatologické vyšetření plicního resekátu prokázalo známky cizích těles a obraz abscedující splývající aspirační bronchopneumonie. V pooperačním průběhu (po plicní lobektomii) došlo k postupnému zlepšení celkového stavu. Dítě bylo přeloženo na standardní dětské oddělení, hrudní drény s ustávající sekrecí extrahovány. Podávaní penicilinu bylo ukončeno po 21 dnech a následně pacientka propuštěna do další domácí péče.
Image 3. Resekovaný levý dolní plicní lalok 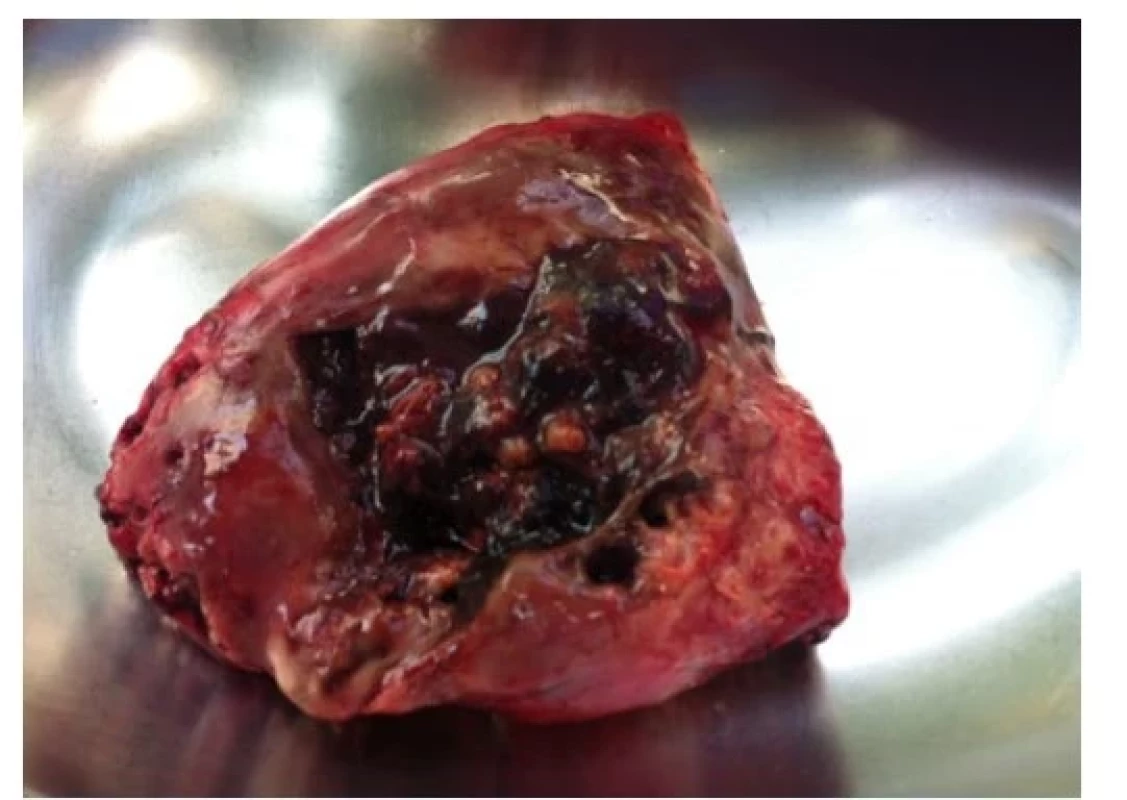
Při ambulantní kontrole byla holčička v pořádku, kontrolní rtg hrudníku ukázal plíci rozvinutou, výpotek nebyl přítomen. Na dalších kontrolách po ukončení rehabilitace byla bez potíží nebo omezení v běžném životě. Spirometricky (s odstupem 4 let od pneumonie) trvá pouze lehká redukce vitální kapacity, která odpovídá redukci plicního parenchymu po lobektomii.
DISKUSE
Nekrotizující pneumonie je těžkou a zřídkavou formou komplikované pneumonie. Charakterizuje ji progredující zánět plic s protrahovaným průběhem, nereagující na léčbu, s destrukcí plicního parenchymu ve formě nekrózy až gangrény (1). Nekrotizující pneumonie často vede ke vzniku plicního abscesu, pleurálního výpotku, empyému, bronchopleurální fistuly nebo pyopneumothoraxu. Tato diagnóza by měla být zvažována při nelepšícím se klinickém stavu navzdory odpovídající antibiotické terapii trvající 72 a více hodin. Myslet na ní je potřebné i v situacích, kdy drenáž parapneumonické efuze, empyému nebo pyopneumothoraxu nevede ke zlepšení stavu (2). U dětí ji poprvé popsali až Kerem et al. v roce 1994 (3).
Zásluhou konjugovaných pneumokokových vakcín celosvětově klesá mortalita a incidence pneumonie jako takové (4). Podíl komplikovaných průběhů pneumonie ale roste (5). Nekrotizující pneumonie komplikuje < 1 % komunitně získaných pneumonií (6, 7), data týkající se frekvence výskytu u aspirační pneumonie nejsou dostupná. Etiologicky je vyvolána nejčastěji pneumokoky a zlatými stafylokoky, ale podílet se mohou i klebsiely, pseudomonády, hemofily, bordetely a běžné streptokoky, případně i SARS-CoV-2 (2). Pneumokoky způsobující nekrotizující pneumonii u dětí očkovaných pneumokokovou vakcínou jsou způsobeny sérotypy, které nejsou zahrnuty v pneumokokových vakcínách (8, 9).
Diagnostice kromě kliniky a elevace zánětlivých parametrů nejvíce pomohou zobrazovací metody, nejpřesněji CT plic (10, 11). S ohledem na věk a nežádoucí radiační zátěž lze s výhodou použít i ultrasonografii plicního parenchymu (12). Základem léčby je dlouhodobá intravenózní antibiotická terapie. Kvůli vysokému zastoupení S. aureus, S. pyogenes a S. pneumoniae jsou namístě antistafylokoková antibiotika (5, 13). Při podezření nebo průkazu Mycoplasma pneumoniae se osvědčují makrolidy (14). Počáteční empirická terapie by měla pokrývat i gramnegativní bakterie, například pomocí cefalosporinů 3. či 4. generace (2). Je potřebná podpůrná a systematická terapie s monitorováním vitálních funkcí, nezřídka na jednotce intenzivní péče.
Chirurgicky je doporučováno intervenovat co nejméně kvůli riziku vzniku bronchopleurální fistulace (11, 15–17). Pokud se však stav komplikuje větším pleurálním výpotkem, empyémem, abscesy nebo kavitami (které svou lokalitou a rozsahem mohou kompromitovat dýchaní nebo cirkulaci), je chirurgické řešení nezbytné. Samotná hrudní drenáž empyému nebo výpotku nemusí stačit a může si vyžádat thorakoskopickou nebo thorakotomickou revizi (18–20). Při progredující nekróze a gangréně plic jsou indikovány resekční výkony na plicním parenchymu. Chirurg se do léčby nekrotizující pneumonie zapojuje taky v případě masivní hemoptýzy, vzniku rozsáhlých/tenzních pneumatokél nebo perzistující bronchopleurální fistuly (21).
Sawicki et al. na souboru 80 dětí s nekrotizující pneumonií popsali nutnost invazivní léčby u 69 z nich (5). Prostá thorakocentéza postačovala u 6, hrudní drenáž byla potřeba u 47, závažný průběh si u dalších 16 dětí vynutil kromě hrudní drenáže i následní chirurgický zákrok.
Lemaîtreová et al. publikovali práci, v níž 26 z 41 dětí s touto diagnózou vyžadovalo drenáž nebo thorakocentézu (7). Hacimustafaoglu et al. referují o provedení thorakotomické revize až u 24 z 36 dětí (22). Wong et al. popisují léčbu 21 dětských pacientů, přičemž podle nich samotná antibiotika postačovala pouze u 2 případů, ATB a hrudní drenáž vyžadovalo 9 dětí, 10 podstoupilo thorakoskopii s rozrušením srůstu nebo dekortikací a další 2 segmentární plicní resekci (17). Krenkeová et al. popisují nutnost hrudní drenáže u 28 z 36 dětských pacientů, přičemž u 25 byla aplikována urokináza (18). V práci, kterou publikovali Janapatla et al., potřebovalo chirurgické řešení ve smyslu lobektomie nebo thorakoskopie 10 z 12 dětí (23).
Z literatury je tedy patrná častá potřeba chirurgického řešení pleurálního výpotku nebo empyému. Není zřídkavé, že je nutné doplnění dekortikace nebo thorakoskopicky asistované revize pleurální dutiny. Pacientů, kteří vyžadují i resekční výkon na plíci, literatura zmiňuje podstatně méně; autoři v těchto případech popisují velké individuální rozdíly, shodují se však v tom, že děti s nekrotizující pneumonií mají i navzdory těžké nemoci s dlouhou hospitalizací velice nízkou mortalitu a jen minimální funkční následky (1, 2). Do budoucna těmto pacientům hrozí výskyt tenzní pneumatokély a pneumothoraxu (24, 25).
Námi popisovaný případ vykazuje při ex post analýze všechny známky typické pro nekrotizující pneumonii s plicní gangrénou. I u očkovaného dítěte ji způsobil pneumokok, patrně některý z asi stovky jiných sérotypů, než byly obsaženy ve 13valentní vakcíně. To význam očkování nesnižuje, nutí nás však myslet na to, že konjugovaná pneumokoková vakcína neposkytuje neprůstřelnou protekci, jelikož nepokrývá všechny kmeny S. pneumoniae. 5leté dítě s astmatem zapadá do profilu pacienta, u kterého lze tento typ pneumonie očekávat. I další průběh nemoci odpovídal v literatuře popisovanému scénáři nekrotizující pneumonie. Zdravotní stav dítěte se totiž nezlepšoval navzdory intenzivní terapii s intravenózní dvojkombinací baktericidních antibiotik a thorakoskopické hrudní drenáži. Průběh nemoci si vyžádal změnu antibiotik (cefotaxim za krystalický penicilin) a dekortikaci s dolní plicní lobektomií vlevo pro gangrénu plic. Následná úprava stavu (prakticky ad integrum) je v souladu se zkušenostmi jiných autorů. Jediné, čím se námi popisovaný případ vymyká z běžného průběhu nekrotizující pneumonie, je histologicky prokázána přítomnost cizích těles v resekovaném spodním laloku plic. O kombinaci aspirační pneumonie a nekrotizující pneumonie vyžadující lobektomii je v literatuře minimum zmínek (26), v pediatrii prakticky žádná.
Uvedená kazuistika představuje námět k úvaze ve dvou aspektech. Na jedné straně je potřebné upozornit na výskyt sice raritní, ale o to závažnější nekrotizující pneumonie u dětí, která může skončit chirurgickým řešením. S komplikací, která se vyskytuje u méně než 1 % pneumonií, se nepotká běžně ani většina pediatrů, nemluvě o úrazových a břišních chirurzích. O to důležitější je proto zdůraznit, že bolesti břicha nemusejí mít příčinu jenom v břišní patologii. Mezi základní příznaky pneumonie sice patří kašel, únava, febrilie, dyspnoe, bolesti na hrudníku a tvorba sputa (27), ale u některých pacientů může být prezentována extrathorakálními symptomy, jako jsou bolesti břicha, které se vyskytují cca u 12 % pneumonií (28). Statisticky je zánět plic prokazatelně nejčastější mimobřišní příčinou akutní bolesti břicha u dětí (29). Analogicky k tomu pneumonie jistě nemůže být jediná diagnóza, ze které malé pacienty rozbolí břicho.
Pacienti, kteří nemají klasické příznaky a běžné diagnózy, se naštěstí objevují málokdy. Bolesti břicha při pneumonii jsou sice zřídkavé, ale mohou být jediným příznakem zánětu plic. Zcela zásadní je připomenutí, že prostřednictvím akutních bolestí břicha se může projevovat patologie celé plejády nitrobřišních a někdy i mimobřišních orgánů.
ZÁVĚR
Předložená kazuistika nabízí popis raritního případu aspirační pneumonie u dítěte, která se komplikovala plicní gangrénou. Kromě intenzivní konzervativní terapie vyžadoval zdravotní stav dítěte také hrudní drenáž a posléze lobektomii levého dolního plicního laloku. Netypická byla skutečnost, že správná diagnóza byla stanovena až při vyšetření traumatologem pro akutní bolesti břicha. Anamnéza a průběh nemoci zdůrazňují nutnost celkového vyšetření pacienta a racionálního uvažování i mimo zajetou rutinu.
Čestné prohlášení
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
Adresa pro korespondenci:
MUDr. Ján Hrubovčák
Chirurgická klinika LF OU a FN Ostrava
17. listopadu 1790/5, 708 00 Ostrava
Tel.: 597 375 052
e-mail: jan.hrubovcak@fno.cz
Sources
- Tsai Y-F, Ku Y-H. Necrotizing pneumonia: a rare complication of pneumonia requiring special consideration. Curr Opin Pulm Med 2012; 18 : 246–252.
- Masters IB, Isles AF, Grimwood K. Necrotizing pneumonia: an emerging problem in children? Pneumonia (Nathan) 2017; 9 : 11.
- Kerem E, Bar Ziv Y, Rudenski B et al. Bacteremic necrotizing pneumococcal pneumonia in children. Am J Respir Crit Care Med 1994; 149 : 242–244.
- Griffin MR, Zhu Y, Moore MR et al. U.S. hospitalizations for pneumonia after a decade of pneumococcal vaccination. N Engl J Med 2013; 369 : 155–163.
- Sawicki GS, Lu FL, Valim C et al. Necrotising pneumonia is an increasingly detected complication of pneumonia in children. Eur Respir J 2008; 31 : 1285–1291
- Strachan R, Jaffe A. Assessment of the burden of paediatric empyema in Australia. J Paediatr Child Health 2009; 45 : 431–436.
- Lemaître C, Angoulvant F, Gabor F et al. Necrotizing pneumonia in children. Report of 41 cases between 2006 and 2011 in a French tertiary care center. Pediatr Infect Dis J 2013; 32 : 1146–1149.
- Byington CL, Hulten KG, Ampofo K et al. Molecular epidemiology of pediatric pneumococcal empyema from 2001 to 2007 in Utah. J Clin Microbiol 2010; 48 : 520–525.
- Tan TQ. Serious and invasive pediatric pneumococcal disease: epidemiology and vaccine impact in the USA. Expert Rev Anti Infect Ther 2010; 8 : 117–125.
- Hodina M, Hanquinet S, Cotting J et al. Imaging of cavitary necrosis in complicated childhood pneumonia. Eur Radiol 2002; 12 : 391–396.
- Hoffer FA, Bloom DA, Colin AA, Fishman SJ. Lung abscess versus necrotizing pneumonia: implications for interventional therapy. Pediatr Radiol 1999; 29 : 87–91.
- Lai SH, Wong KS, Liao SL. Value of lung ultrasonography in the diagnosis and outcome prediction of pediatric community-acquired pneumonia with necrotizing change. PLoS One 2015; 10: e0130082.
- Paradisi F, Corti G, Messeri D. Antistaphylococcal (MSSA, MRSA, MSSE, MRSE) antibiotics. Med Clin North Am 2001; 85 : 1–17.
- Wang Y, Xu D, Li S, Chen Z. Mycoplasma pneumoniae-associated necrotizing pneumonitis in children. Pediatr Int 2012; 54 : 293–297.
- Fretzayas A, Moustaki M, Alexopoulou E et al. Clinical notations on bacteraemic cavitating pneumococcal pneumonia in nonvaccinated immunocompetent children. J Trop Pediatr 2009; 55 : 257–261.
- Macedo M, Meyer KF, Oliveira TCM. Necrotizing pneumonia in children submitted to thoracoscopy due to pleural empyema: incidence, treatment and clinical evolution. J Bras Pneumol 2010; 36 : 301–305.
- Wong KS, Chiu CH, Yeow KM et al. Necrotising pneumonitis in children. Eur J Pediatr 2000; 159 : 684–688.
- Krenke K, Sanocki M, Urbankowska E et al. Necrotizing pneumonia and its complications in children. Adv Exp Med Biol 2015; 12 : 9–17.
- Jester I, Nijran A, Singh M, Parikh DH. Surgical management of bronchopleural fistula in pediatric empyema and necrotizing pneumonia: efficacy of the serratus anterior muscle digitation flap. J Pediatr Surg 2012; 47 : 1358–1362.
- Pabary R, Balbour-Lynn IM. Complicated pneumonia in children. Breathe 2013; 9 : 211–222.
- Loizzi M, De Palma A, Pagliarulo V et al. Pulmonary infections of surgical interest in childhood. Thorac Surg Clin 2012; 22 : 387–401.
- Hacimustafaoglu M, Celebi S, Sarimehmet H et al. Necrotizing pneumonia in children. Acta Paediatr 2004; 93 : 1172–1177.
- Janapatla R-P, Hsu M-H, Hsieh Y-C et al. Necrotizing pneumonia caused by nanC-carrying serotypes is associated with pneumococcal haemolytic uraemic syndrome in children. Clin Microbiol Infect 2013; 19 : 480–486.
- Al-Saleh S, Grasemann H, Cox P. Necrotizing pneumonia complicated by early and late pneumatoceles. Can Respir J 2008; 15 : 129–132.
- Demirel N, Quizon A, Belteton de Leon EL et al. On the nature of pleural involvement in necrotizing pneumonia: a report of two cases of life threatening late complications. Pediatr Pulmonol 2014; 49: E90–E95.
- Atkinson AL, Canterino J. Foreign body aspiration in pregnancy. Case Rep Obstet Gynecol 2012; 2012 : 890106.
- Tintinalli JE. Emergency Medicine: A Comprehensive Study Guide. McGraw-Hill, New York, 2010 : 480.
- Gauss H. Abdominal pain in pneumonia. Am J Dig Dis 1946; 13 : 73–77.
- Tsalkidis A, Gardikis S, Cassimos D et al. Acute abdomen in children due to extra-abdominal causes. Pediatr Int 2008; 50 : 315–318.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2023 Issue 4-
All articles in this issue
- ÚVODEM
- Prevence a programy prevence karcinomu plic
- Hypoparatyreóza
- Terapeutické monitorování léků v psychiatrii
- Etické aspekty transplantace tkání a orgánů
- Je bolest břicha po traumatu pouze úrazové etiologie? Kazuistika raritní aspirační pneumonie s gangrénou plic a peritoneální odezvou u pětiletého dítěte
- 100 let od popisu oční toxoplazmózy profesorem Josefem Janků
- MUDr. Vlastimil Dostálek – zakladatel oddělení ORL v Novém Jičíně – a jeho žáci
- Odešla vynikající lékařka prof. Marie Brodanová
- Zemřel Emil Kormuth, hostující profesor FBMI ČVUT
- Lavička Jaroslava Blahoše
- Projekt Terapie budoucnosti
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (ZÁŘÍ – ŘÍJEN 2023)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Etické aspekty transplantace tkání a orgánů
- Prevence a programy prevence karcinomu plic
- Terapeutické monitorování léků v psychiatrii
- Je bolest břicha po traumatu pouze úrazové etiologie? Kazuistika raritní aspirační pneumonie s gangrénou plic a peritoneální odezvou u pětiletého dítěte
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career