-
Medical journals
- Career
Hypoparatyreóza
Authors: Richard Sotorník
Authors‘ workplace: Interní klinika 3. LF UK a FNKV, Praha
Published in: Čas. Lék. čes. 2023; 162: 136-147
Category: Review Article
Overview
Hypoparatyreóza představuje vzácné endokrinní onemocnění, při kterém chybí či je nedostatečná produkce parathormonu. Následkem je snížená koncentrace sérového vápníku odpovědná za subjektivní neuromuskulární obtíže pacientů. Konvenční léčba zahrnuje podávání vápníku a aktivních metabolitů vitaminu D, ale nejedná se o plnohodnotnou náhradu chybějícího parathormonu. Ačkoliv léčba často vede k výraznému zmírnění obtíží, může docházet k nepozorovanému rozvoji chronických komplikací, zvláště renálních. Na jejich vzniku se podílí zejména nárůst hladin fosfátů, ale též konvenční léčba sama. Řešení této situace tkví v podávání rekombinantního parathormonu, nicméně jediný dostupný přípravek je v současnosti stahován z trhu. Stěžejní opatření v prevenci hypoparatyreóz představuje uvážlivé indikování totální tyreoidektomie, která je hlavní příčinou onemocnění.
Klíčová slova:
vápnik – hypokalcémie – parathormon – vitamín D – hypoparatyreóza – fosfát
ÚVOD
Hypoparatyreóza (hypoPT) je vzácné endokrinní onemocnění charakterizované nízkými hladinami vápníku, hyperfosfatémií a nízkou, respektive nedostatečně zvýšenou hladinou parathormonu (PTH). Jedná se o heterogenní skupinu onemocnění s převahou chirurgického poškození příštítných tělísek (PT). Hypoparatyreózy nesouvisející s operacemi v oblasti krku jsou důsledkem zejména autoimunitního postižení, genetického defektu nebo střádavých onemocnění.
EPIDEMIOLOGIE
Prevalenci hypoPT v populaci hodnotilo jen málo studií. Práce z USA, Itálie a Skotska odhadují její výskyt na 25–40 případů/100 000 obyvatel (1–4). Asi 70–80 % všech trvalých hypoPT je důsledkem chirurgického zákroku na krku (5, 6), s prevalencí 18–29/100 000 obyvatel (1, 2, 7, 8). Výskyt nechirurgických forem se udává v širokém rozmezí 2,3–16,0/100 000 obyvatel (2, 8–10).
Roční nárůst případů pooperačních hypoPT odhadla dánská studie na 0,8/100 000 obyvatel (7), v případě nechirurgických forem se tato čísla pohybovala od 0,1–0,2/100 000 v Jižní Koreji (11) až 1–4/100 000 v Norsku (10).
V souborech pacientů s hypoPT převládají ženy (69–75 %) (1, 3, 8, 10) a tato převaha je zřetelná zejména u pooperačních forem (2, 7). Průměrný věk pacientů s hypoPT se pohybuje od 44 do 64 let (4, 11).
ETIOLOGIE
Základní přehled příčin hypoparatyreóz je uveden v tab. 1.
Table 1. Základní přehled příčin hypoparatyreóz 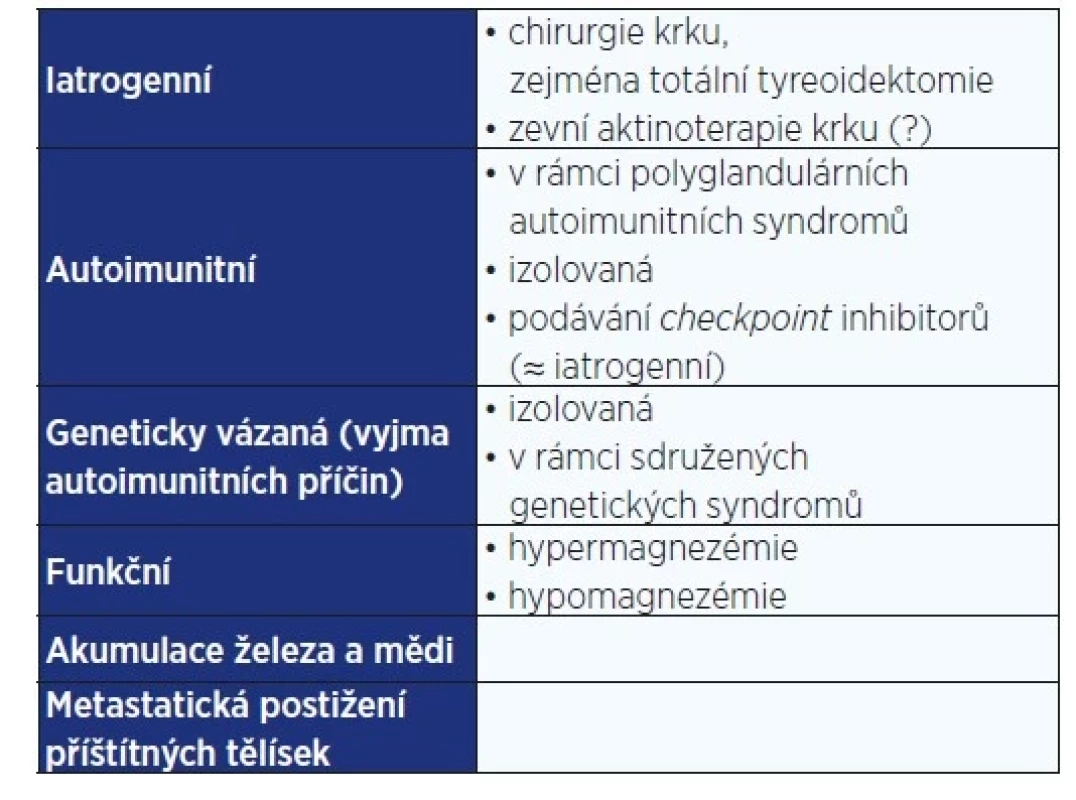
Iatrogenní hypoparatyreóza
Přechodná hypoPT představuje častou komplikaci operací krku, zatímco k trvalé vede přibližně 1,5–2,0 % všech zákroků (1, 3). Převládajícím typem výkonu je operace štítné žlázy (6). Zatímco přechodná hypoPT se vyskytuje přibližně u třetiny pacientů po oboustranném výkonu, trvalá formu se rozvine podle metaanalýzy z roku 2014 a řady následných studií u 1–5 % operovaných (12–15). Existují však i práce, které uvádějí výskyt značně vyšší. Příčinou odlišných výsledků je absence jednotné definice trvalé hypoPT včetně doby, po kterou je hypoPT považována ještě za přechodnou (6).
Nejednotná definice je příčinou určitých rozdílů i v pátrání po rizikových faktorech. Mezi nejčastěji zmiňované patří rozsáhlejší disekce uzlin (6, 16), objemná či retrosternální struma (17), karcinom štítné žlázy větší než 4 cm nebo rozsáhlá invaze do okolí, nutnost reoperace (12) nebo Gravesova-Basedowova (GB) nemoc (18). Významné faktory tvoří rovněž zkušenost operačního týmu (17–19) a počty výkonů na štítné žláze, který by měl dosahovat 25–50 operací na chirurga a rok (20, 21).
Ve vztahu k samotným PT se za rizikový faktor uvádí nechtěná paratyreoidektomie (PTE) odhalená až při histologickém vyšetřením. Některé studie prokázaly inverzní vztah mezi počtem zachovaných PT a rizikem trvalé hypoPT, zatímco v jiných stačilo k prevenci trvalé hypoPT jen jedno PT s neporušeným cévním zásobením (12, 13, 22, 23).
Z laboratorních nálezů je negativním prognostickým faktorem trvalé hypoPT pokles hladiny PTH první pooperační den pod 0,58 pmol/l (5,5 pg/ml), zatímco hodnota nad 1,06 pmol/l (10 pg/ml) by měla predikovat normální funkci PT za 6 měsíců od operace (18). V případě sérového vápníku se uvádějí hodnoty pod 1,9–2,0 mmol/l (12, 17), nicméně oproti PTH jde o méně specifický ukazatel.
Primární PTE pro hyperfunkci PT, ať už minimálně invazivní či s oboustrannou explorací, vede k trvalé hypoPT vzácně. Při nutnosti reoperace pro rekurentní či perzistující hyperparatyreózu se však riziko trvalé hypoPT pohybuje mezi 3 a 13,5 % (24, 25).
Léčba netyreoidálních malignit v oblasti krku může být příčinou vzniku hypoPT. V malých souborech pacientů byly zjištěny zcela protichůdné výsledky rizikovosti chirurgického zákroku a radioterapie (26, 27). Ve větší 2leté prospektivní studii se 137 pacienty, kde téměř všichni podstoupili radioterapii a jen 27 % totální laryngektomii, se hypoPT vyvinula u 7,3 % (28). Systematický přehled literatury z roku 2021 uvádí, že trvalá hypoPT se vyskytla u 0–12,8 % pacientů po laryngektomii s výrazně vyšším podílem u těch, kteří měli současně ezofagektomii nebo úplné odstranění štítné žlázy (29).
Radiační léčba v oblasti krku pro Hodgkinovu nemoc nebyla prokázána jako rizikový faktor rozvoje hypoPT (30). Podobně se nejeví jako rizikové podání radiojódu, ať už pro benigní nebo maligní tyreoidální léze (31, 32).
Autoimunitní hypoparatyreóza
Autoimunitní poškození PT je považováno za nejčastější příčinu nechirurgické hypoPT (2, 19). Může se vyskytovat izolovaně nebo v rámci autoimunitních polyglandulárních syndromů (APS). Juvenilní formou je APS-1, rovněž označovaný APECED (autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy). Jedná se monogenně vázané onemocnění způsobené mutací genu AIRE (autoimunitní regulátor). HypoPT se v rámci tohoto syndromu vyskytuje se 100% penetrací u žen a 60% penetrací u mužů (19). Manifestaci hypoPT obvykle předchází mukokutánní kandidóza a následuje rozvoj Addisonovy nemoci (33). Přítomnost dvou z těchto tří onemocnění je základem stanovení diagnózy APS-1. Dalšími možnostmi jsou průkaz mutace v genu AIRE nebo přítomností specifických protilátek (19, 33). Za nejspecifičtější jsou považovány protilátky proti interferonu α a ω (10, 19).
Autoimunitní hypoPT může být též součástí adultních forem APS, nicméně zde se její výskyt udává v méně než 5 % případů. Dalšími autoimunitami jsou tyreopatie, diabetes mellitus 1. typu, vzácně hypogonadismus a hypopituitarismus. Dědičnost je polygenní s prokázanou asociací na některé antigeny HLA I. a II. třídy (33). Autoimunitní hypoPT se může rovněž vyskytovat jako izolované autoimunitní onemocnění s nejasným genetickým pozadím a významem autoprotilátek (33). Kazuisticky je popisována autoimunitní hypoPT jako komplikace léčby checkpoint inhibitory (34).
Genetické příčiny hypoparatyreózy (s vyloučením autoimunitních syndromů)
Geneticky vázané hypoPT jsou důsledkem zárodečných nebo somatických mutací. Postižení PT se může vyskytovat izolovaně nebo jako součást širších vývojových poruch. Penetrace a expresivita syndromů je variabilní s výraznými rozdíly v klinické závažnosti (19). Souhrnný přehled genetických příčin hypoPT je uveden v tab. 2.
Table 2. Genetické příčiny hypoparatyreóz (vyjma autoimunitních) 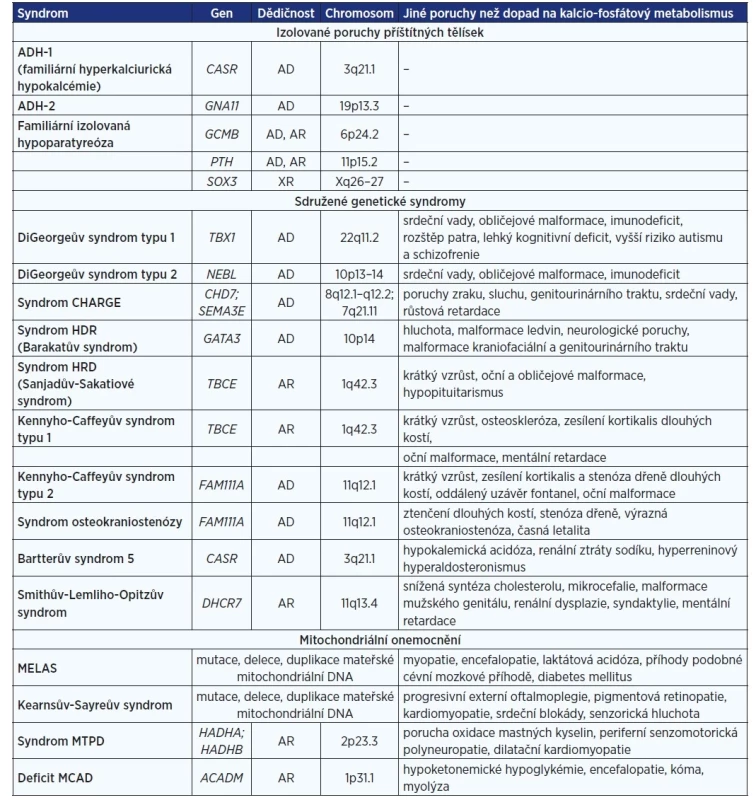
Pozn.: ACADM – gen pro dehydrogenázu acyl-CoA se středním řetězcem (MCAD); AD – autosomálně dominantní; ADH – autosomální dominantní hypokalcémie; AR – autosomálně recesivní; CASR – gen pro kalciový receptor; CHARGE – coloboma, heart anomaly, choanal atresia, retardation, genital, ear anomalies; CHD7 – chromodomain helicase DNA binding protein 7; DHCR7 – gen pro 7-dehydrocholesterol reduktázu; DNA – deoxyribonukleová kyselina; FAM111A – family with sequence similarity 111, member A; GNA11 – gen pro alfa podjednotku proteinu G11; GCMB – glial cells missing homolog B; HADHA, HADHB – geny pro mitochondiální trifunkční protein odpovědný za oxidaci mastných kyselin s dlouhým řetězcem; HDR – hypoparatyreóza, hluchota, renální dysplazie; HRD – hypoparatyreóza, retardace a dysmorfismus; MCAD – medium chain acyl-CoA dehydrogenase; MELAS – syndrom mitochondriální encefalopatie, laktátové acidózy a epizod podobných CMP; MTPD – deficit mitochondriálního trifunkčního proteinu; NEBL – gen pro nebulette; PTH – parathormon; SEMA3E – gen pro semaforin 3E; TBCE – gen pro tubulinově specifický chaperon E; XR – vázaná na chromosom X. Izolované geneticky vázané hypoPT
Jedná se o skupinu onemocnění, kde jedinou patologii představuje porucha vývoje nebo funkce PT. Dědičnost může být autosomálně dominantní (AD), recesivní (AR) nebo vázaná na chromosom X, nicméně většina případů je sporadických (19).
Pravděpodobně nejčastější příčinou izolované genetické hypoPT je autosomální dominantní hypokalcémie typu 1 (ADH-1), také nazývaná familiární hyperkalciurická hypokalcémie (10). Její příčinou je aktivační mutace receptoru citlivého na kalcium (CaSR) vedoucí ke konstitutivní aktivaci receptoru se supresí transkripce a sekrece PTH a zvýšené exkreční frakci vápníku v ledvinách. V heterozygotní formě vede obvykle k mírné hypokalcémii s nezávažnými, či dokonce chybějícími příznaky, nicméně nositelé této mutace jsou ohroženi nefrolitiázou a kalcifikacemi měkkých tkání při konvenční léčbě hypokalcémie (19).
Vzácnou variantou je ADH-2 způsobená aktivační mutací α podjednotky signalizačního proteinu G11 (Gα11), který zprostředkovává přenos signálu z CaSR. Klinický obraz odpovídá ADH-1 s obvykle mírným až asymptomatickým průběhem a méně vyjádřenou renální problematikou (19).
Mutace v genu pro GCMB (glial cells missing B) je příčinou vzniku familiární izolované hypoparatyreózy (FIH). GCMB je transkripční faktor specifický pro PT, odpovědný za vývoj, diferenciaci a funkci PT. Další jednotky FIH tvoří mutace v genu pro preproPTH a pro transkripční faktor SOX3, která je dědičná X-recesivně. Mutace vede k raritní, ale těžké hypoPT v důsledku ageneze PT (19).
HypoPT v rámci sdružených genetických syndromů
Mezi syndromovými hypoPT převládá DiGeorgeův syndrom (DGS) typu 1 a 2 (9, 10). Jeho příčinou jsou de novo vzniklé či AD přenesené mikrodelece v oblasti chromosomu 22q11.2 nebo 10p13-14 (19). Pro DGS-1 je charakteristická haploinsuficience TBX1, jehož transkript T-box 1, DNA vázající transkripční faktor, je zásadní ve vývoji thymu a PT. U DGS-2 chybí gen NEBL kódující protein nebulette (aktin vázající protein účastnící se mj. vývoje srdečních myocytů). Klinicky se kromě hypoPT projevují srdečními defekty, obličejovými malformacemi, rozštěpem patra, imunodeficitem i neuropsychickými alteracemi. Penetrace a závažnost hypoPT u DGS je variabilní.
Těžké vývojové defekty spolu s hypoPT jsou přítomny u syndromu CHARGE (coloboma, heart anomaly, choanal atresia, retardation, genital, ear anomalies) způsobeného mutacemi v genech pro CHD7 (chromodomain helicase DNA binding-7) nebo SEMA3E (semaphorin 3E) (19).
Inhibiční mutace genu pro transkripční faktor GATA3 je příčinou syndromu HDR (hypoparathyroidism, sensorineural deafness and renal disease syndrome), rovněž nazývaného Barakatův syndrom. HypoPT zde může být mírná až závažná v závislosti na míře aplazie PT. Kromě hypoPT, hluchoty a malformací ledvin se mezi ostatní projevy řadí neurologické poruchy, malformace kraniofaciální a genitourinárního traktu.
Homozygotní mutace v genu pro TBCE (tubulin-specific chaperone E) je příčinou syndromu HRD (hypoparathyroidism, retardation and dismorphism syndrome), též nazývaného Sanjadův-Sakatiové syndrom, a Kennyho-Caffeyova syndromu 1. typu (KCS-1). U obou jsou přítomné malý vzrůst a oční poruchy, obličejová dysmorfie a poruchy vývoje skeletu. Mutace v genu FAM111A (family with sequence similarity 111, member A) jsou příčinou KCS 2. typu (KCS-2) a časně letálního syndromu osteokraniostenózy (OCS).
Do syndromových hypoPT lze také zařadit Bartterův syndrom 5 způsobený specifickou mutací CASR, kde hypokalcémii, hyperkalciurii a nefrokalcinózu doprovázejí hypokalemická acidóza, renální ztráty sodíku s následnou hypotenzí a hyperreninový hyperaldosteronismus (8).
Nedávno byla hypoPT v důsledku hypoplazie PT zjištěna též u Smithova-Lemliho-Opitzova syndromu (35).
HypoPT může být spolu s dalšími endokrinopatiemi (hypogonadismem, deficitem růstového hormonu, diabetem) součástí komplexních mitochondriálních onemocnění s obvykle těžkým průběhem (17, 19).
Poruchy metabolismu hořčíku – funkční hypoparatyreózy
Hořčík je významným regulátorem sekrece PTH. Jeho zvýšené hladiny inhibují sekreci PTH vazbou na CaSR podobně jako vápník, ačkoliv přibližně 2–3× slaběji. Mezi situace, které vedou k hypermagnezémii a mohou inhibovat sekreci PTH, patří mj. nadměrný přívod hořčíku per os nebo parenterálně (tokolýza), podávání lithia a konečná stadia chronické renální insuficience (17).
Na druhou stranu je hořčík nezbytný k regulaci postreceptorové signalizace v PT. Fyziologické hladiny hořčíku stabilizují proteiny G v inaktivním stavu vazbou na podjednotku α. Při výrazném poklesu hladin hořčíku (pod 0,5 mmol/l) dochází k desinhibici podjednotek α, a tím k potlačení sekrece PTH (36).
Těžká hypomagnezémie se může vyskytovat u malnutričních a malabsorpčních stavů, zvýšených ztrát hořčíku a dále u familiárních hypomagnezémií (17). Mutovaný epitelový kationtový kanál TRMP6 (transient receptor potential cation channel subfamily member 6) je příčinou snížené absorpce hořčíku v zažívacím traktu a zvýšených ztrát v ledvinách. Inhibiční dopad na transportní funkci TRMP6 se předpokládá i při dlouhodobé terapii inhibitory protonové pumpy (PPI – proton pump inhibitors). Mutované klaudiny 16 a 19 vedou též k renálním ztrátám vápníku a hořčíku spolu s polyurií/polydipsií, nefrokalcinózou a rizikem poškození renálních funkcí (37). Renální ztráty hořčíku se mohou vyvinout též v důsledku diuretické léčby, podávání některých antibiotik, antimykotik, inhibitorů kalcineurinu či protinádorových léků (cisplatina) (17, 37).
Vzhledem k tomu, že magnézium je kofaktorem adenylátcyklázy, může hypomagnezémie vést i k rezistenci vůči účinku PTH na úrovni skeletu (37).
Ostatní příčiny hypoparatyreóz
Akumulace mědi či železa v rámci Wilsonovy choroby, hemochromatózy či opakovaných krevných převodů u talasémie může vést k narušení funkce PT a je obvykle spojena s dalšími endokrinopatiemi (diabetes, hypotyreóza, hypogonadismus). U pacientů s talasémií je hypoPT popisována v 10–24 % případů v závislosti na úspěšnosti chelatační terapie (17).
Vzácnou, kazuisticky popisovanou příčinou hypoPT je metastatické postižení PT, nejčastěji při karcinomu prsu (38).
KLINICKÝ OBRAZ
Za obtížemi pacientů a klinickými dopady hypoPT stojí v různé míře kombinace nedostatečných koncentrací vápníku, hyperfosfatémie, deficitu PTH a konvenční léčby, zejména pokud je nesprávně nastavená.
Neuromuskulární, neurologické a psychiatrické dopady
Hypokalcémie vede na nervosvalové úrovni ke zvýšené dráždivosti a vzniku tetanie, v centrálním nervovém systému ke křečím a alteraci mentálního stavu. Dánské studie prokázaly, že ve srovnání se zdravou populací se významně častěji vyskytují křečové stavy zahrnující tetanie, křeče a epilepsii jak u pacientů s pooperační, tak nechirurgickou hypoPT (7, 9).
Patofyziologickým podkladem neuromuskulárních obtíží je inverzní vztah mezi hladinami extracelulárního vápníku a neuronální dráždivostí. Extracelulární vápník stabilizuje klidový membránový potenciál, ovlivňuje aktivitu iontových kanálů a uvolňování excitačních molekul i senzitivitu inhibičních receptorů kyseliny gamma-aminomáselné (GABA). K některým z těchto účinku jsou nutné influx kalcia do buněk nebo vazba na CaSR (39).
Ve své nejmírnější formě se hypokalcémie projevuje paresteziemi prstů končetin a periorálně. Tetanie je přítomna latentně a lze ji prokázat elektromyograficky či provokačními testy. V těžších případech přistupují karpopedální spasmy, křeče celých končetin i křeče atypicky lokalizované (lumbální či interkostální svalstvo apod.).
Vzácným projevem zvýšené svalové dráždivosti je konstrikce hladkého svalstva v oblasti dýchacích cest vedoucí k laryngospasmu či bronchospasmu. Stav se projevuje stridorem, dysfonií, případně dysfagií a je obvykle spojen s velmi nízkými hladinami kalcia (40).
Zvýšená neuronální excitabilita na úrovni mozku může být příčinou fokální či generalizované epilepsie (41, 42). Ve skotské studii bylo při prospektivním 9letém sledování pacientů s chirurgickou i nechirurgickou hypoPT prokázáno 1,6–1,7násobné riziko (43). Korejská práce u nechirurgických forem prokázala riziko zvýšené téměř 6× (11). Stanovení hladin vápníku a hořčíku by tedy mělo být součástí vyšetření při primomanifestaci křečových stavů.
Kalcifikace v oblasti bazálních ganglií (BG) a na dalších místech mozku jsou popisovány u 50–74 % pacientů s hypoPT (8, 44). Příčina se hledá ve vyšším kalciofosfátovém součinu, též kalciofosfátovém produktu (Ca × P), dopadu hyperfosfatémie na expresi kostních transkripčních faktorů v BG i přímém vlivu deficitu PTH (42, 45). Jejich dopad na neurologické a psychické funkce však zůstává nevyjasněn a spíše převládá názor, že přítomnost a rozsah intrakraniálních kalcifikací nekoreluje s cerebelárními, extrapyramidovými či kognitivními poruchami ani výskytem Parkinsonovy nemoci (8, 46).
Zvýšený výskyt psychiatrických poruch u pacientů s pooperační i idiopatickou hypoPT dokumentovala řada studií. Jednalo se o hospitalizace pro neuropsychiatrická onemocnění, deprese či bipolární poruchy (9, 47). Riziko jejich rozvoje oproti kontrolní skupině bylo zvýšeno téměř 2násobně při 10letém prospektivním sledování (11).
Katarakta
Známou komplikací hypoPT je šedý zákal, zejména zadní subkapsulární varianta. Některé studie naznačují, že zvýšené riziko se týká pouze nechirurgických forem, kde se předpokládá dlouholetý průběh onemocnění (9, 43, 47). Nicméně v jedné studii s pooperační hypoPT se katarakta vyvinula již po 7 letech u více než 50 % operovaných (48).
Renální komplikace
Nízké hladiny PTH vedou ke snížené tubulární reabsorpci vápníku. Dochází k relativní hyperkalciurii vzhledem k hladinám sérového vápníku, ale u neléčených pacientů je celková denní exkrece v důsledku hypokalcémie snížena (17). Paralelně se zmenšuje exkreční frakce pro fosfáty, která je hlavní příčinou hyperfosfatémie. Nízké hladiny vápníku jsou do jisté míry protekcí proti nefrolitiáze, nefrokalcinóze a poklesu renálních funkcí, nicméně snahy o korekci hypokalcémie mohou vést ke zvýšenému riziku těchto komplikací. Zvláště citliví jsou v tomto směru pacienti s vrozenými formami hypoPT s alterací v signalizační kaskádě CaSR (19).
Epidemiologické práce jednoznačně prokazují, že ledviny jsou „cílovým orgánem“ komplikací chronické hypoPT (18). Americká studie sledovala 7,5 roku 120 pacientů s převážně získanou hypoPT s průměrnou dobou trvání této nemoci 17 let (44). V předem definovaném rozmezí sérového vápníku 1,95–2,50 mmol/l strávili tito pacienti 86 % času. Přesto byla u 41 % zjištěna renální insuficience (odhadovaná míra glomerulární filtrace [eGFR] < 1,0 ml/s), u 38 % hyperkalciurie a u 31 % kalcifikace ledvin. Z dánských registrů vyplynulo, že mírná renální insuficience (eGFR 1,0–1,5 ml/s) je přítomna u 45 % pacientů s převážně pooperační hypoPT a středně závažná (eGFR < 1,0 ml/s) u 21 % (49). Riziko renální insuficience bylo zvýšeno 3násobně u pooperačních hypoPT a 6násobně u nechirurgických forem. Riziko nefrokalcinózy bylo paradoxně zvýšeno jen u pooperačních hypoPT, a to 4násobně (7, 9). Prospektivní práce z Jižní Koreje potvrdila 3,4× vyšší riziko renální insuficience a 2násobné riziko nefrolitiázy u pacientů s nechirurgickou hypoPT (11).
Jako nezávislé rizikové faktory poškození ledvin byly v různých studiích prokázány věk, délka onemocnění a doba strávená v relativní hyperkalcémii (> 2,5 mmol/l), stoupající hodnota Ca × P a epizody hyperkalcémie (44, 49). Paradoxně nebyla zjištěna korelace mezi sérovými hladinami vápníku nebo kalciurií a nefrolitiázou či nefrokalcinózou ani mezi kalciurií a funkcí ledvin (50, 51). Pacienti užívající alfa kalcidiol v dávce > 1 μg denně měli nižší riziko než ti, kteří dostávali méně (49).
Kardiovaskulární komplikace
Newman et al. provedli systematický přehled publikací, většinou kazuistických sdělení zabývajících se vztahem hypokalcémie a srdečních poruch z let 1948–2011 (52). Z výsledků vyplynul lineární vztah mezi koncentrací vápníku, délkou korigovaného intervalu QT (QTc) a velikostí ejekční frakce levé komory srdeční (EFLK). Prodloužený QTc i zhoršená funkce levé komory byly reverzibilní po normalizaci hladiny vápníku. Závislost srdeční kontraktility na kalcémií byla prokázána experimentálně i v malých klinických studiích (53). Kazuisticky jsou popisovány srdeční arytmie typu torsades de pointes navazující na prodloužený QTc, plně reverzibilní po korekci vnitřního prostředí (54).
Přes reverzibilitu uvedených abnormalit se ukazuje, že hypoPT zvyšuje riziko kardiovaskulárních (KV) příhod. Bez rozlišení etiologie hypoPT bylo analýzou záznamů zdravotní pojišťovny prokázáno 1,2–1,7násobné riziko pro fibrilaci síní a jiné tachyarytmie, infarkt myokardu, ischemickou chorobu srdeční, srdeční selhání, cévní mozkovou příhodu (CMP) a periferní cévní onemocnění (55). Naproti tomu ve studiích zohledňujících etiologii bylo zvýšené riziko ischemické choroby srdeční, arytmií, srdečního selhání a CMP potvrzeno pouze u jedinců s nechirurgickou formou (7, 9, 11, 43). Mezi rizikovými faktory se nacházely doba trvání nemoci, klesající hladina ionizovaného vápníku a prodělání více než 4 epizod hyperkalcémie (49). Rozdíl mezi pooperační a nechirurgickou hypoPT může být tedy mj. dán trváním onemocnění (4), nicméně postižení KV systému u některých genetických syndromů může do určité míry zkreslovat dopad vlastní hypoPT.
Mortalita
U nechirurgické hypoPT bylo ve skotské práci zjištěno 2násobné riziko úmrtí, přičemž zde byla prokázána souvislost se stoupající koncentrací vápníku (43). Výsledky dánské studie se pohybovaly na hranici významnosti a v jihokorejské významný rozdíl zjištěn nebyl (9, 11).
U pacientů s pooperační hypoPT sledovaných průměrně 4,5 roku byla 2násobná mortalita zjištěna ve švédské studii, zatímco dánská a skotská práce tyto výsledky nepotvrdily (7, 15, 43).
Při analýze faktorů spojených s vyšší mortalitou u pacientů s převážně pooperační hypoPT se ukázala jako riziková vyšší koncentrace fosfátů (> 1,21 mmol/l), Ca × P (> 2,8), delší doba trvání nemoci (> 12,7 roku) a dávka alfa-kalcidiolu < 1,0 μg denně (49).
Malignity
Výskytem malignit se zabývaly pouze dánské studie. U jedinců s nechirurgickou hypoPT bylo bez bližší specifikace zjištěno celkově nižší riziko malignit (9). U pacientů s pooperační hypoPT bylo sníženo riziko malignit zažívacího traktu (47).
Dopad na skelet
PTH je významným faktorem v remodelaci skeletu. V jeho nepřítomnosti dochází k výraznému zpomalení kostního obratu a akumulaci trabekulární i kortikální kosti. Snížený kostní obrat lze demonstrovat nižšími hladinami markerů kostního obratu a dynamickými histomorfometrickými studiemi z kostních biopsií (17). Ty prokazují zvětšený objem trabekulární kosti, šíři trabekul, jejich počet a konektivitu (5). Nárůst objemu trabekulární i kortikální kosti se odráží ve změnách kostní minerální denzity (BMD) měřené duální rentgenovou absorpciometrií (DXA). BMD stoupá obvykle minimálně o 1 směrodatnou odchylku zejména v oblasti bederní páteře a pozitivně koreluje s délkou trvání hypoPT (56).
Na otázku, zda je hypoPT spojena se zvýšeným rizikem zlomenin, přinesly epidemiologické studie rozporuplné odpovědi. Z dánských registrů vyplynulo 2násobné riziko zlomenin horních končetin u jedinců s nechirurgickou hypoPT, a naopak významně snížené u pooperačních forem (47). Skotská studie statisticky významné ovlivnění rizika zlomenin neprokázala ani u jednoho typu hypoPT (43). Jihokorejská práce zachytila přibližně 2násobné riziko zlomenin vertebrálních (11). Příčinou protichůdných závěrů může být jednak vzácný výskyt této komplikace u onemocnění s nízkou prevalencí v populaci, jednak eventuální protichůdný dopad sníženého kostního obratu na skelet. Protektivní efekt akumulace kostní hmoty může být do značné míry anulován její horší kvalitou (17).
Infekce
Vápníkový kation je nezbytný v regulaci funkce buněk imunitního systému a někteří autoři připouštějí, že hypokalcémie by mohla mít negativní dopad na imunitní systém (8). Role PTH v regulaci imunitního systému vyjasněna není. Oproti tomu je kalcitriol známým modulátorem imunitních funkcí (57), alterace metabolismu vitaminu D by tak mohla predisponovat k infekčním komplikacím. Uvedený předpoklad podporuje dánská studie, kde podávání alfa-kalcidiolu v dávce > 1 μg denně bylo spojeno s redukcí rizika infekcí oproti účinku nižší dávky (49).
U nechirurgických hypoPT bylo prokázáno přibližně 2násobně zvýšené riziko infekcí (9, 43). U pooperačních forem bylo riziko zvýšené mírně a jen v některých studiích (43, 47).
Kvalita života
Většina studií, nicméně ne všechny (58), prokazuje u pacientů významné snížení pocitu životní pohody a kvality života. Na druhou stranu se zdá, že dopad hypoPT na kvalitu života je konzistentně a významně podhodnocován (59).
Dochází k zhoršení emočního prožívání, často až s rysy anxiózních poruch, akumulují se somatické obtíže zahrnující kromě parestezií a křečí i myalgie a pocity vyčerpanosti, narušeny jsou i sociální interakce (10, 48, 59, 60). Významná část pacientů udává dopad onemocnění na mentální funkce, koncentraci, spánek, zvládání nároků běžného života i pracovní výkonnost a zařazení (59–61). Významně častější je u této skupiny čerpání sociálních dávek a zatížení blízkého okolí. Významný inverzní vztah byl prokázán mezi kvalitou života a závažností hypoparatyreózních obtíží nebo množstvím tablet vápníku (60).
DIAGNOSTIKA
Podezření na hypoPT vzniká při projevech zvýšené neuromuskulární dráždivosti, rozvoji křečových stavů, náhodném záchytu hypokalcémie nebo v rámci vyšetřování pro syndromy zahrnující hypoPT.
Klinicky ověřujeme zvýšenou neuromuskulární dráždivost poklepem na lícní nerv v blízkosti ucha, který vede k stejnostrannému stahu lícních svalů (Chvostkův příznak). Udává se, že test je pozitivní u 10–25 % zdravé populace, a naopak může chybět až u 30 % hypokalcemických jedinců. Naopak Trousseauův příznak bývá přítomen u více než 90 % hypokalcemických pacientů a přibližně jen u 1 % normokalcemických. Test se provádí nafouknutím manžety tonometru lehce nad systolický tlak na dobu 3 minut a očekává se karpální spasmus (5).
Diagnóza hypoPT je potvrzena nálezem hypokalcémie v kombinaci se sníženou či neadekvátně normální hladinou PTH. Zahraniční doporučení používají k definici hypokalcémie hodnotu ionizovaného vápníku nebo vápník korigovaný na hladinu albuminu (Alb) podle rovnice CaCorr = CaSer + [0,02 × (41,3 – AlbSer)], kde CaSer (v mmol/l) a AlbSer (v g/l) jsou hodnoty naměřené v séru (22, 37, 62). Nicméně pokud u pacientů nejsou diagnostické pochyby ani podezření na malnutrici, postačí měření hodnoty celkového vápníku. Nezbytnou podmínkou definitivní diagnózy je úprava hladin hořčíku.
DIFERENCIÁLNÍ DIAGNOSTIKA
Údaj o operaci krku, zejména štítné žlázy, je s vysokou pravděpodobností dostatečný ke stanovení diagnózy pooperační hypoPT. Za trvalou formu je považována porucha trvající déle než 6 měsíců (37).
Pokud operace krku neproběhla, je třeba pátrat po nechirurgické etiologii (obr. 1). Anamnéza (osobní i rodinná) a klinické vyšetření by se měly zaměřit na přítomnost střádavých onemocnění a na projevy autoimunitních endokrinopatií, případně asociovaných poruch imunity. Při podezření na autoimunitní etiologii lze vyšetřit mutaci v genu AIRE a hladiny autoprotilátek. Pozitivní výsledek potvrzuje juvenilní formu (APS-1), negativní svědčí pro adultní (APS-3 nebo APS-4) (33).
Nález vrozených vývojových vad, kostních dysplazií, poruch dentice, hluchoty, hypokalemické alkalózy apod. svědčí pro hypoPT v rámci sdružených genetických syndromů (8). Podle souboru příznaků je pak klinickým genetikem indikováno vyšetření příslušných genů (tab. 2).
V případě absence vývojových vad je třeba pomýšlet na izolovanou hypoPT a dovyšetřit mutace v genech vedoucích k ADH 1 nebo 2 či FIH. Vzhledem k velké frekvenci v populaci a variabilní penetraci se doporučuje vyloučit přítomnost DGS i u dospělých se zdánlivě izolovanou formou (19).
Pokud je zachycena jinak nevysvětlitelná hypomagnezémie (malabsorpce, léky apod.), je třeba vyloučit vrozené poruchy metabolismu hořčíku (37).
Image 1. Diagnostický algoritmus nechirurgické hypoparatyreózy 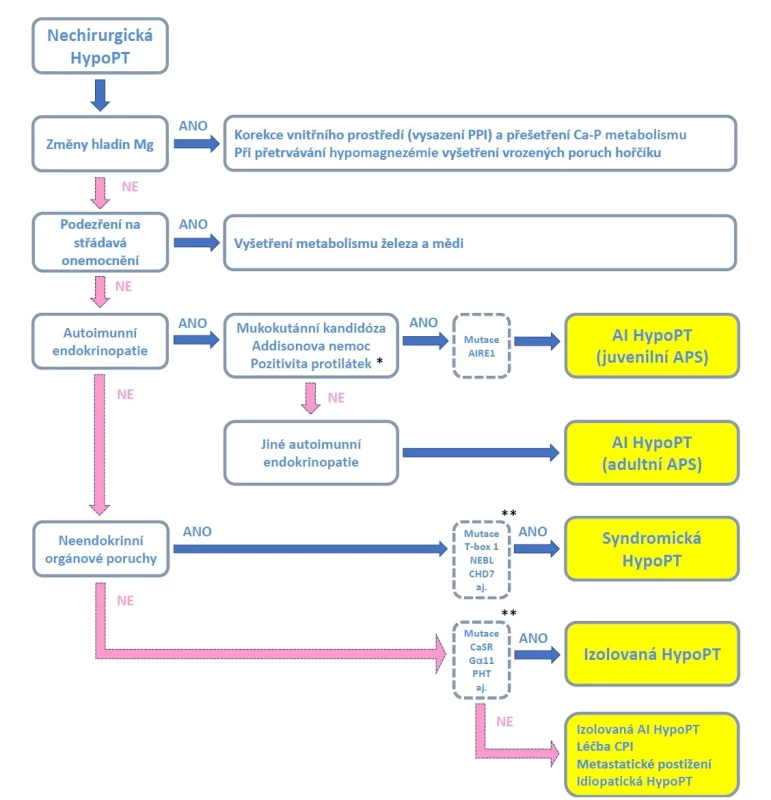
Pozn.: AI – autoimunitní; APS – autoimunitní polyglandulární syndrom; Ca-P = kalciumfosfátový; CPI – checkpoint inhibitory; hypoPT – hypoparatyreóza; Mg – hořčík; PPI – inhibitory protonové pumpy.
* Výčet protilátek typických pro juvenilní APS je uveden v textu.
** Úplný seznam mutací je uveden v tab. 2.LÉČBA
Akutní léčba
Akutní léčba spočívá v parenterální aplikaci 10% kalciumglukonátu. Nejčastěji se s touto potřebou setkáváme v pooperačním období, případně pokud u pacientů užívajících chronickou léčbu, při níž dojde k zhoršení obtíží či život ohrožujícím stavům. Iniciálně se doporučuje podat 1–3 ampule po 10 ml jako bolus nebo v krátké, 10–20minutové infuzi v 50–100 ml 5% glukózy. Následovat by měla dlouhodobá infuze o rychlosti 0,5–1,5 (eventuálně až 3,0) mg elementárního vápníku na kilogram hmotnosti a hodinu (5, 18, 37). Při ředění 10 ampulí kalciumglukonátu do 1000 ml 5% glukózy to odpovídá rychlosti podávání přibližně 50–100 ml/hod. U pacientů, kteří dosud neužívají chronickou medikaci, se současně zavádějí perorálně kalciumkarbonát 1,5–3,5 g/den rozdělený do 3 a více dávek a aktivní metabolity vitaminu D: kalcitriol 0,25–2,0 μg/den ve 2 dávkách, alfa-kalcidiol 0,5–3,0 μg/den v 1–2 dávkách (16, 18).
Při parenterální aplikaci vápníku je třeba monitorovat elektrokardiogram, zejména u pacientů s anamnézou poruch rytmu nebo digitalizovaných. Nezbytnou součástí terapie je rovněž korekce hypomagnezémie.
Parenterální aplikace je nutná do nástupu efektu perorální léčby (obvykle 72 hodin). Nedostatečná reakce na léčbu nebo dlouhodobá potřeba parenterálního podávání vápníku se může vyskytovat u syndromu hladové kosti, malabsorpčních stavů, achlorhydrie nebo podávání PPI (6).
Chronická léčba konvenční
Mezinárodní doporučení pro léčbu hypoPT se opírají pouze o expertní a konsenzuální závěry; velké randomizované studie chybějí. Primárním cílem je zmírnit neuromuskulární obtíže a sérovou hladinu vápníku udržovat v dolním pásmu normy, resp. lehce pod ní (5, 62, 63). Průměrné hladiny sérového vápníku u léčených pacientů se v literatuře uvádějí 2,11–2,31 mmol/l pro celkový, příp. korigovaný vápník a 1,13–1,17 mmol/l pro ionizovaný (44, 48, 49, 64, 65). V prevenci některých komplikací hypoPT, zejména renálních a kardiovaskulárních, se zdá být zásadní předcházení epizodám hyperkalcémie či dlouhodobým koncentracím v horním pásmu normy (44, 49).
Sekundárním cílem je udržování hladiny fosfátů v normálním rozmezí a Ca × P < 4,4 mmol2/l2 (22). Průměrné hladiny fosfátů se u léčených hypoparatyreózních pacientů pohybují mezi 1,16 a 1,36 mmol/l (44, 48, 49, 64, 65). Ačkoliv se jedná o hodnoty v normálním rozmezí, jsou signifikantně vyšší oproti kontrolám (48). Vzhledem k rizikovosti vyšší hladiny fosfátů, byť v normálním rozmezí, by měla léčba cílit k dolnímu pásmu normy a minimalizovat podíl těch, kteří normálních hodnot nedosahují (v literatuře se uvádí 7–29 %) (49, 64, 65).
Mezní hodnota Ca × P 4,4 mmol2/l2 je převzata z doporučení pro pacienty s chronickou renální insuficiencí a studie ověřující odůvodněnost této hranice u pacientů s hypoPT chybí (66, 67). Ve velkých průřezových studiích se průměrná hodnota pohybovala kolem 2,8–2,9 a pacientů, kteří překračovali hranici 4,4 mmol2/l2, bylo minimum (44, 49, 64, 65). Srovnání pacientů s Ca × P nad a pod hranicí 2,8 ukázalo významně vyšší riziko renálních a infekčních komplikací a mortality v první skupině a závislost těchto komplikací na stoupajících hodnotách Ca × P (49). Kalcifikace BG a renální komplikace se vyskytovaly i navzdory normální hodnotě (65). Snahou by tedy i zde mělo být udržování hodnoty Ca × P bezpečně pod 4,4, spíše k 3,0 mmol2/l2.
Ačkoliv dosud nebyla prokázána souvislosti mezi kalciurií, kalcifikacemi ledvin a poklesem renálních funkcí (18), doporučuje se předcházet hyperkalciurii (> 7,5 mmol/den u mužů a > 6,25 mmol/den u žen) (5, 62).
Základem konvenční léčby je podávání kalciumkarbonátu, u nás nejběžnější, resp. jediné komerční formy perorálního vápníku. Obsah elementárního vápníku je v této sloučenině 40 % a k adekvátní absorpci ze zažívacího traktu je nezbytné kyselé žaludeční prostředí (16). Z tohoto důvodu je doporučeno užívat vápník s jídly, zejména bílkovinnými (5). U pacientů s achlorhydrií či jinou patologií žaludku (např. stav po žaludečním bypassu) je třeba zvážit kalciumcitrát, který kyselé pH nevyžaduje. Množství léčiva je v tomto případě výrazně vyšší, neboť molekula obsahuje pouze 21 % elementárního vápníku.
Obvyklé dávky elementárního vápníku se pohybují od 1 do 2 g za den (7, 44). Vyšší potřeba se udává u pacientů s nedetekovatelným PTH a u pacientů s pooperační hypoPT (7, 9, 58). Rozptyl dávek vápníku uváděných v literatuře je však značný, od < 500 mg k dávkám > 9 g denně (44).
Vzhledem k maximální absorpční kapacitě zažívacího traktu by mělo být množství > 500 mg rozděleno do 2–3 i více dávek (62, 63). Tento přístup též sníží riziko epizod hyperkalcémií.
Druhým pilířem konvenční léčby je podávání aktivních metabolitů vitaminu D v dávkách uvedených výše v části věnované akutní léčbě. V literatuře se uvádějí dávky od 0,125 do 4,0 μg/den pro kalcitriol (44, 64) a jsou opět vyšší u pacientů s nedetekovatelným PTH (58). V obdobných mezích se uvádějí dávky i pro alfa-kalcidiol (0,5–2,0 μg/den) (7, 42).
Podíl vápníku a aktivních metabolitů vitaminu D na léčbě se odvíjí od biochemické a klinické odpovědi a často odráží lokální léčebné zvyklosti (8). Někteří považují za základ podávání solí vápníku pro jeho předpokládaný fosfát vázající efekt (6, 18). Jiné práce zdůrazňují aktivní metabolity vitaminu D a dokládají jejich přínos v prevenci renálních a infekční komplikací a ovlivnění mortality (49).
V případě, že se nedaří udržovat dostatečnou hladinu vápníku bez současné hyperkalciurie, je na prvním místě nezbytné omezení solení. V druhé době je doporučováno přidání thiazidových diuretik, nicméně přínos této léčby je mnohými zpochybňován (18, 44, 68). Možnou příčinou je potřeba vyšších dávek k dosažení potřebného efektu (22, 62), což však může být spojeno s vyšším rizikem elektrolytových poruch (5, 37).
Při výskytu hypomagnezémie je třeba nejprve přehodnotit ostatní medikaci a případně omezit užívání diuretik a PPI (22). K normalizaci hladin hořčíku se doporučuje jeho suplementace v dávkách 250–1000 mg denně odděleně od kalciových solí (62, 63). Druhou možností je zvážit podávání amiloridu, který má magnézium a kalium šetřicí efekt (22, 62).
Zajištěna by měla být normální koncentrace 25-hydroxyvitaminu D (> 50 nmol/l) (18, 63). Podávání vazačů fosfátů k ovlivnění hyperfosfatémie není v současnosti doporučováno, ačkoliv se jejich užití připouští u extrémních hladin fosfátů (63).
Chronická léčba pomocí rekombinantního PTH
Používání rekombinantního lidského PTH (rhPTH) bylo schváleno americkým Úřadem pro kontrolu potravin a léčiv (FDA) i Evropskou lékovou agenturou (EMA) v roce 2015 na základě registrační studie z roku 2013 (62, 69). Základním výstupem bylo snížení dávek vápníku a aktivních metabolitů vitaminu D o > 50 % u 53 % aktivně léčených pacientů a u 43 % možnost úplného vysazení aktivních metabolitů vitaminu D při souběžné redukci dávek vápníku pod 500 mg/den. Zároveň došlo k statisticky významnému vzestupu hladin vápníku a poklesu hladin fosfátů a hodnoty Ca × P. Hodnoty kalciurie se snížily o 1,84 mmol/den, avšak bez významného rozdílu oproti placebové skupině (pravděpodobně v důsledku vzestupu sérové hladiny vápníku). Ze stejného souboru vyšla studie hodnotící změnu kvality života (70). Ačkoliv nebyl zjištěn rozdíl oproti placebové větvi, v aktivně léčené skupině došlo k významnému nárůstu v několika doménách fyzického a duševního zdraví a tento rozdíl byl tím významnější, čím horší bylo vstupní skóre pacientů. 5letá retrospektivní kontrolovaná studie prokázala zlepšení renálních funkcí (eGFR) oproti placebové větvi, kde docházelo k progresi zhoršování (71). 8leté podávání rhPTH bylo též spojeno s úpravou kostní histomorfometrie na úroveň kontrol s normální funkcí (72).
Další studie byly již jen otevřené nebo se jednalo o extenze původně kontrolovaných prací. Obecně tyto studie potvrzovaly trend k redukci dávek konvenční léčby až vysazení, pokles hladin fosfátů a Ca × P při stabilních hladinách vápníku, snižování kalciurie a zlepšování kvality života (73–75). Důležitým závěrem všech těchto prací byla nepřítomnost rozvoje kostních malignit.
V Česku bylo v roce 2021 po vzoru zahraničních doporučení vydáno stanovisko, za jakých podmínek lze předepsat léčbu pomocí rhPTH a jaké jsou její kontraindikace (tab. 3) (63). Léčba jediným dostupným přípravkem Natpar byla soustředěna do vybraných center. Na podzim 2022 však společnost produkující tento lék vydala prohlášení o ukončení výroby do konce roku 2024.
Table 3. Indikační kritéria a kontraindikace zavedení rekombinantního parathormonu 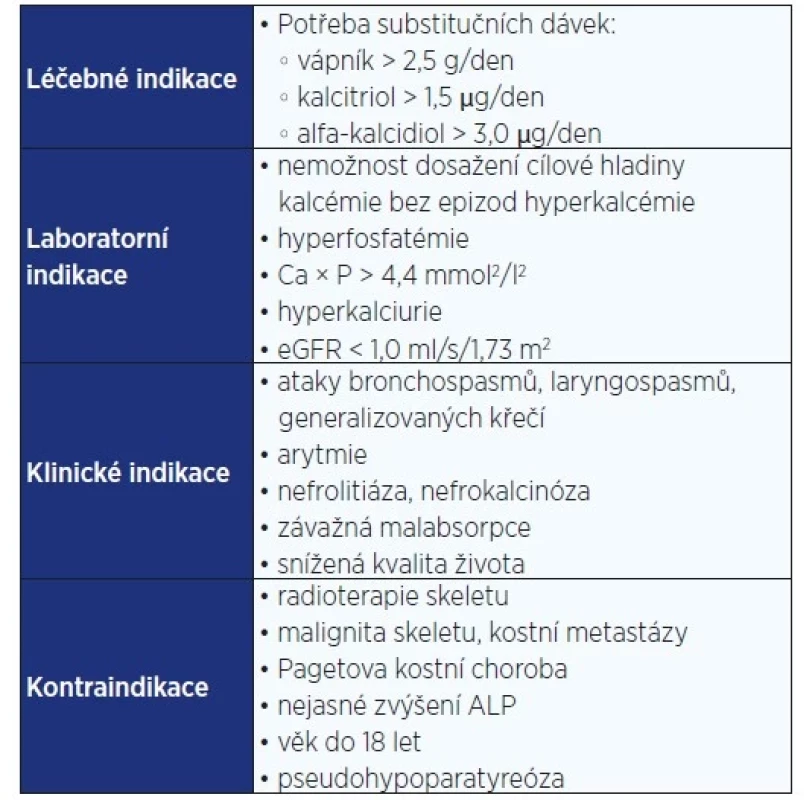
Pozn.: ALP – alkalická fosfatáza; Ca × P – kalciofosfátový produkt; eGFR – odhadovaná míra glomerulární filtrace. Sledování pacientů s chronickou hypoPT
U stabilizovaných pacientů stačí kontroly sérových koncentrací vápníku, fosfátů, hořčíku a Ca × P v intervalu 3–6 měsíců (18, 62). Kontrola hodnoty PTH by přicházela do úvahy u pooperačních forem tam, kde klinický a laboratorní obraz naznačují případnou pozdní obnovu funkce PT (76).
Vyšetřování kalciurie a renálních funkcí je doporučováno v intervalu 6–12 měsíců, podobně také hladin vitaminu D (18). Větší pozornost je třeba věnovat kalciurii u ADH 1 a 2 (19). V případě anamnézy či rozvoje nefrolitiázy je doporučován podrobnější rozbor močové biochemie (odpady urátů, oxalátů, citrátů apod.). Sonografické vyšetření ledvin a močových cest by se mělo provést vstupně a dále v ročních až 5letých intervalech.
Vyšetření kalcifikace BG (preferenčně pomocí nekontrastní výpočetní tomografie) je doporučováno u pacientů s odpovídajícími symptomy, ale klinický přínos není jasný. Nejasný je i význam vyšetření a sledování BMD a kostního obratu. Doporučuje se u jedinců s jiným onemocněním ovlivňujícím kostní metabolismus nebo při podávání rhPTH. V případě klinického podezření je vhodné rentgenologicky vyloučit kompresivní zlomeniny obratlů. Oční vyšetření by mělo být provedeno na začátku léčby a dále podle klinického stavu.
Při zavedení rhPTH je do nastavení stabilní dávky nutná častá monitorace kalcémie před podáním a k přesnějšímu vyladění i 8–12 hodin po něm. Před podáváním rhPTH a na jeho začátku se také častěji monitoruje hladina vitaminu D pro jeho vyšší metabolizaci na aktivní formy (67).
Léčba v těhotenství
Gravidita a laktace jsou spojeny se zvýšenými požadavky plodu na vápník a významnými změnami hladin hormonů zapojených do kalcium-fosfátového metabolismu (37). Uvádí se, že potřebné dávky vápníku a aktivních metabolitů vitaminu D obvykle v graviditě klesají v důsledku zvýšené endogenní produkce kalcitriolu a proteinu příbuzného PTH (PTHrP), ačkoliv u části žen mohou naopak stoupat (18). Těžší hypokalcémie mohou vést k vyšší dráždivosti dělohy a zvýšenému riziku potratu či předčasného porodu, u plodu k sekundární hyperparatyreóze s demineralizací skeletu (63). Hyperkalcémie může naopak indukovat fetální hypoPT s rizikem poporodní hypokalcémie (62). Z těchto důvodů je nezbytná monitorace koncentrací vápníku, fosfátů, hořčíku a kalciurie v intervalu 3–4 týdnů, při změnách terapie a před porodem i častěji. Hodnoty kalcémie (v graviditě sledované formou korigovaného nebo ionizovaného vápníku) se mají pohybovat v dolní polovině normálního rozmezí, ostatní parametry včetně hladin vitaminu D mají být v normě. Podávání thiazidových diuretik a rhPTH je třeba přerušit (63).
Přestože se v období laktace produkce kalcitriolu vrací k normálu, přetrvává zvýšená sekrece PTHrP. Z tohoto důvodu obvykle přetrvává nižší potřeba vápníku a aktivních metabolitů vitaminu D.
Dítě hypoparatyreózní matky má být klinicky pečlivě sledováno a první týden v intervalu 2 dnů mají být vyšetřovány hladiny ionizovaného vápníku. Indikována je běžná suplementace vitaminu D (18).
PREVENCE
Smysluplně lze předcházet zejména hypoPT po totální tyreoidektomii. Prvním bodem zasluhujícím přehodnocení by mělo být odesílání pacientů k ultrasonografickému vyšetření štítné žlázy. Přibližně 60 % dospělé populace má ve štítné žlázy přítomen 1 a více uzlů, ale pouze méně než 5 % z nich je maligních (77). Z těch, které maligní jsou, se často jedná o drobné, dobře diferencované papilární karcinomy (PTC) s indolentním průběhem (78). Cílený screening karcinomů štítné žlázy je pak spojen s nárůstem incidence, operativy a komplikací včetně hypoPT, aniž by vedl ke snížení úmrtnosti (79). Z tohoto důvodu by mělo být ultrasonografické vyšetření prováděno pouze u nemocných s palpačním nálezem uzlu či lymfadenopatie a u těch, kteří jsou ve vyšším riziku (aktinoterapie krku, rodinná zátěž atd.) (80). Při nálezu uzlu je nezbytné využít kombinace ultrasonografických charakteristik, tenkojehlové biopsie, případně i genetického vyšetření k rozhodnutí o nezbytnosti chirurgického výkonu a jeho rozsahu (77). Velmi rezervovaný by měl být přístup k profylaktickým krčním disekcím u dobře diferencovaného PTC (81). Řadu benigních (nenádorových) tyreopatií, jako jsou GB nemoc nebo benigní toxický adenom, lze spolehlivě řešit podáním radiojódu.
Při indikaci operace štítné žlázy jsou nezbytné zkušenost chirurga a snaha o vizualizaci a protekci PT (16). Rutinní profylaktická autotransplantace doporučována není a má se k ní přistoupit jen v případě ektomovaných či zcela devaskularizovaných PT (17). Uvádí se, že dostatečná předoperační saturace vitaminem D může mít mechanismem prevence časné pooperační hypokalcémie pozitivní vliv na regeneraci poškozených, ischemizovaných PT (13).
ZÁVĚR
Hypoparatyreóza představuje vzácné endokrinní onemocnění, jehož hlavní příčinou je iatrogenní poškození PT při chirurgickém zásahu na krku, zejména totální tyreoidektomii. Zásadním bodem prevence tohoto onemocnění je tedy zabránit zbytečným operacím štítné žlázy.
Pokud k rozvoji chronické hypoPT dojde nebo pokud se jedná o nechirurgickou příčinu, je onemocnění spojeno se zatížením pacientů neuromuskulárními obtížemi a nutností celoživotního užívání vápníkových solí a aktivních metabolitů vitaminu D. Ačkoliv tato konvenční léčba často významně uleví od subjektivních obtíží, nejedná se o plnohodnotnou náhradu chybějícího PTH. Přetrvávající abnormality kalcium-fosfátového metabolismu, někdy potencované terapií, jsou pak příčinou pozdních komplikací, zejména renálního poškození. Kromě postižení ledvin jsou popisovány kardiovaskulární komplikace, katarakta, neurologické a psychiatrické poruchy a celkové zhoršení kvality života.
Rekombinantní PTH byl pro řadu pacientů příslibem výrazné redukce konvenční terapie, potenciální nefroprotekce a zlepšení kvality života. V současnosti očekáváme nástupce končícího přípravku Natpar a s ním spojená nová a robustnější klinická data.
Čestné prohlášení
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam použitých zkratek
AD autosomálně dominantní
ADH autosomálně dominantní hypokalcémie
AIRE autoimunitní regulátor
Alb albumin
ALP alkalická fosfatáza
APECED autoimunitní polyendokrinopatie, kandidiáza a ektodermální dystrofie
APS autoimunitní polyglandulární syndrom
AR autosomálně recesivní
BG bazální ganglia
BMD kostní minerální denzita
Ca × P kalciofosfátový produkt (kalciofosfátový součin)
CaSR kalciový receptor (calcium-sensing receptor)
CMP cévní mozková příhoda
DGS DiGeorgeův syndrom
DXA duální rentgenová absorpciometrie
eGFR odhadovaná míra glomerulární filtrace
EMA Evropská léková agentura
FAM111A family with sequence similarity 111, member A
FDA Úřad pro kontrolu potravin a léčiv (USA)
FIH familiární izolovaná hypoparatyreóza
Gα11 podjednotka alfa proteinu G11
GABA kyselina gamma-aminomáselná
GB Gravesova-Basedowova nemoc
GCMB glial cells missing B
HDRS syndrom hypoparatyreoidismu, hluchoty a renální dysplazie
HRDS syndrom hypoparatyreoidismu, retardace a dysmorfismu
hypoPT hypoparatyreóza
CHARGE coloboma, heart anomaly, choanal atresia, retardation, genital, ear anomalies
CHD7 chromodomain helicase DNA-binding protein 7
KCS Kennyho-Caffeyův syndrom
NEBL gen kódující nebulette
OCS syndrom osteokraniostenózy
PPI inhibitor protonové pumpy
PT příštítná tělíska
PTC papilární karcinom štítné žlázy
PTE paratyreoidektomie
PTH parathormon
PTHrP protein příbuzný PTH
QTc korigovaný interval QT
rhPTH rekombinantní lidský PTH
SEMA3E semaforin 3E
TBCE tubulinově specifický chaperon E
TRMP6 transient receptor potential cation channel subfamily member 6
Adresa pro korespondenci:
MUDr. Richard Sotorník, Ph.D.
Interní klinika 3. LF UK a FNKV
Šrobárova 1150/50, 100 34 Praha 10
Tel.: 267 162 758
e-mail: richard.sotornik@lf3.cuni.cz
Sources
1. Powers J, Joy K, Ruscio A, Lagast H. Prevalence and incidence of hypoparathyroidism in the United States using a large claims database. J Bone Miner Res 2013; 28 : 2570–2576.
2. Vadiveloo T, Donnan PT, Leese GP. A population-based study of the epidemiology of chronic hypoparathyroidism. J Bone Miner Res 2018; 33 : 478–485.
3. Cianferotti L, Parri S, Gronchi G et al. Prevalence of chronic hypoparathyroidism in a mediterranean region as estimated by the analysis of anonymous healthcare database. Calcif Tissue Int 2018; 103 : 144–150.
4. Cusano NE, Bilezikian JP. Update on hypoparathyroidism. Curr Opin Rheumatol 2019; 31 : 381–387.
5. Bilezikian JP. Hypoparathyroidism. J Clin Endocrinol Metab 2020; 105 : 1722–1736.
6. Kazaure HS, Sosa JA. Surgical hypoparathyroidism. Endocrinol Metab Clin North Am 2018; 47 : 783–796.
7. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. Cardiovascular and renal complications to postsurgical hypoparathyroidism: A Danish nationwide controlled historic follow-up study. J Bone Miner Res 2013; 28 : 2277–2285.
8. Clarke BL, Brown EM, Collins MT et al. Epidemiology and diagnosis of hypoparathyroidism. J Clin Endocrinol Metab 2016; 101 : 2284–2299.
9. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. The epidemiology of nonsurgical hypoparathyroidism in Denmark: A nationwide case finding study. J Bone Miner Res 2015; 30 : 1738–1744.
10. Astor MC, Løvås K, Debowska A et al. Epidemiology and health-related quality of life in hypoparathyroidism in Norway. J Clin Endocrinol Metab 2016; 101 : 3045–3053.
11. Kim SH, Rhee Y, Kim YM et al. Prevalence and complications of nonsurgical hypoparathyroidism in Korea: A nationwide cohort study. PLoS One 2020; 15: e0232842.
12. Edafe O, Antakia R, Laskar N et al. Systematic review and meta-analysis of predictors of post-thyroidectomy hypocalcaemia. Br J Surg 2014; 101 : 307–320.
13. Lorente-Poch L, Sancho JJ, Ruiz S, Sitges-Serra A. Importance of in situ preservation of parathyroid glands during total thyroidectomy. Br J Surg 2015; 102 : 359–367.
14. Kim SM, Kim HK, Kim KJ et al. Recovery from permanent hypoparathyroidism after total thyroidectomy. Thyroid 2015; 25 : 830–833.
15. Almquist M, Ivarsson K, Nordenström E, Bergenfelz A. Mortality in patients with permanent hypoparathyroidism after total thyroidectomy. Br J Surg 2018; 105 : 1313–1318.
16. Orloff LA, Wiseman SM, Bernet VJ et al. American Thyroid Association statement on postoperative hypoparathyroidism: diagnosis, prevention, and management in adults. Thyroid 2018; 28 : 830–841.
17. Shoback DM, Bilezikian JP, Costa AG et al. Presentation of hypoparathyroidism: Etiologies and clinical features. J Clin Endocrinol Metab 2016; 101 : 2300–2312.
18. Bollerslev J, Rejnmark L, Zahn A et al. European expert consensus on practical management of specific aspects of parathyroid disorders in adults and in pregnancy: Recommendations of the ESE educational program of parathyroid disorders. Eur J Endocrinol 2022; 186: R33–R63.
19. Cianferotti L, Marcucci G, Brandi ML. Causes and pathophysiology of hypoparathyroidism. Best Pract Res Clin Endocrinol Metab 2018; 32 : 909–925.
20. Adam MA, Thomas S, Youngwirth L et al. Is there a minimum number of thyroidectomies a surgeon should perform to optimize patient outcomes? Ann Surg 2017; 265 : 402–407.
21. Aspinall S, Oweis D, Chadwick D. Effect of surgeons' annual operative volume on the risk of permanent hypoparathyroidism, recurrent laryngeal nerve palsy and haematoma following thyroidectomy: Analysis of United Kingdom registry of endocrine and thyroid surgery (UKRETS). Langenbecks Arch Surg 2019; 404 : 421–430.
22. Bollerslev J, Rejnmark L, Marcocci C et al. European Society of Endocrinology clinical guideline: Treatment of chronic hypoparathyroidism in adults. Eur J Endocrinol 2015; 173: G1-G20.
23. Song CM, Jung JH, Ji YB et al. Relationship between hypoparathyroidism and the number of parathyroid glands preserved during thyroidectomy. World J Surg Oncol 2014; 12 : 200.
24. Richards ML, Thompson GB, Farley DR, Grant CS. Reoperative parathyroidectomy in 228 patients during the era of minimal-access surgery and intraoperative parathyroid hormone monitoring. Am J Surg 2008; 196 : 937–942.
25. Nawrot I, Chudziński W, Ciąćka T et al. Reoperations for persistent or recurrent primary hyperparathyroidism: Results of a retrospective cohort study at a tertiary referral center. Med Sci Monit 2014; 20 : 1604–1612.
26. Geminiani M, Aimoni C, Scanelli G, Pastore A. Parathyroid function study in patients submitted to laryngeal surgery for squamous cell carcinoma. Acta Otorhinolaryngol Ital 2007; 27 : 123–125.
27. Negm H, Mosleh M, Fathy H, Awad A. Thyroid and parathyroid dysfunction after total laryngectomy in patients with laryngeal carcinoma. Eur Arch Otorhinolaryngol 2016; 273 : 3237–3241.
28. Lo Galbo AM, Kuik DJ, Lips P et al. A prospective longitudinal study on endocrine dysfunction following treatment of laryngeal or hypopharyngeal carcinoma. Oral Oncol 2013; 49 : 950–955.
29. Edafe O, Sandler LM, Beasley N, Balasubramanian SP. Systematic review of incidence, risk factors, prevention and treatment of post-laryngectomy hypoparathyroidism. Eur Arch Otorhinolaryngol 2021; 278 : 1337–1344.
30. Miltényi Z, Keresztes K, Lakos G et al. Is the treatment of Hodgkin's disease detrimental to the parathyroid gland? Acta Haematol 2004; 112 : 148–151.
31. Mortensen LS, Smidt K, Jørgensen A et al. Long-term parathyroid - and c-cell function after radioiodine for benign thyroid diseases. Basic Clin Pharmacol Toxicol 2005; 97 : 22–28.
32. Guven A, Salman S, Boztepe H et al. Parathyroid changes after high dose radioactive iodine in patients with thyroid cancer. Ann Nucl Med 2009; 23 : 437–441.
33. Betterle C, Garelli S, Presotto F. Diagnosis and classification of autoimmune parathyroid disease. Autoimmun Rev 2014; 13 : 417–422.
34. Dadu R, Rodgers TE, Trinh VA et al. Calcium-sensing receptor autoantibody-mediated hypoparathyroidism associated with immune checkpoint inhibitor therapy: Diagnosis and long-term follow-up. J Immunother Cancer 2020; 8: e000687.
35. Donoghue SE, Pitt JJ, Boneh A, White SM. Smith-Lemli-Opitz syndrome: Clinical and biochemical correlates. J Pediatr Endocrinol Metab 2018; 31 : 451–459.
36. Vetter T, Lohse MJ. Magnesium and the parathyroid. Curr Opin Nephrol Hypertens 2002; 11 : 403–410.
37. Khan AA, Koch CA, Van Uum S et al. Standards of care for hypoparathyroidism in adults: a Canadian and international consensus. Eur J Endocrinol 2019; 180: p1–p22.
38. Bauer JL, Toluie S, Thompson LDR. Metastases to the parathyroid glands: a comprehensive literature review of 127 reported cases. Head Neck Pathol 2018; 12 : 534–541.
39. Han P, Trinidad BJ, Shi J. Hypocalcemia-induced seizure: demystifying the calcium paradox. ASN Neuro 2015; 7 : 1759091415578050.
40. van Veelen MJ, Visser MF, Baggen MG, Dees A. Hypocalcaemic laryngospasm in the emergency department. BMJ Case Rep 2011; 2011: bcr1120103555.
41. Weiner M, Epstein FH. Signs and symptoms of electrolyte disorders. Yale J Biol Med 1970; 43 : 76–109.
42. Goswami R, Sharma R, Sreenivas V et al. Prevalence and progression of basal ganglia calcification and its pathogenic mechanism in patients with idiopathic hypoparathyroidism. Clin Endocrinol (Oxf) 2012; 77 : 200–206.
43. Vadiveloo T, Donnan PT, Leese CJ et al. Increased mortality and morbidity in patients with chronic hypoparathyroidism: a population-based study. Clin Endocrinol (Oxf) 2019; 90 : 285–292.
44. Mitchell DM, Regan S, Cooley MR et al. Long-term follow-up of patients with hypoparathyroidism. J Clin Endocrinol Metab 2012; 97 : 4507–4514.
45. Zavatta G, Clarke BL. Basal ganglia calcification in hypoparathyroidism and pseudohypoparathyroidism: Local and systemic metabolic mechanisms. J Endocrinol Invest 2021; 44 : 245–253.
46. Zavatta G, Tebben PJ, McCollough CH et al. Basal ganglia calcification is associated with local and systemic metabolic mechanisms in adult hypoparathyroidism. J Clin Endocrinol Metab 2021; 106 : 1900–1917.
47. Underbjerg L, Sikjaer T, Mosekilde L, Rejnmark L. Postsurgical hypoparathyroidism – risk of fractures, psychiatric diseases, cancer, cataract, and infections. J Bone Miner Res 2014; 29 : 2504–2510.
48. Arlt W, Fremerey C, Callies F et al. Well-being, mood and calcium homeostasis in patients with hypoparathyroidism receiving standard treatment with calcium and vitamin D. Eur J Endocrinol 2002; 146 : 215–222.
49. Underbjerg L, Sikjaer T, Rejnmark L. Long-term complications in patients with hypoparathyroidism evaluated by biochemical findings: A case-control study. J Bone Miner Res 2018; 33 : 822–831.
50. Gosmanova EO, Houillier P, Rejnmark L et al. Renal complications in patients with chronic hypoparathyroidism on conventional therapy: a systematic literature review. Renal disease in chronic hypoparathyroidism. Rev Endocr Metab Disord 2021; 22 : 297–316.
51. Ridder LO, Harsløf T, Sikjaer T et al. Determinants of hypercalciuria and renal calcifications in chronic hypoparathyroidism: a cross-sectional study. Clin Endocrinol (Oxf) 2021; 95 : 286–294.
52. Newman DB, Fidahussein SS, Kashiwagi DT et al. Reversible cardiac dysfunction associated with hypocalcemia: A systematic review and meta-analysis of individual patient data. Heart Fail Rev 2014; 19 : 199–205.
53. Lang RM, Fellner SK, Neumann A et al. Left ventricular contractility varies directly with blood ionized calcium. Ann Intern Med 1988; 108 : 524–529.
54. Gupta P, Agstam S, Yadav A, Ghosh S. Malignant prolongation of the QTc interval due to severe vitamin D deficiency: An unusual presentation. BMJ Case Rep 2020; 13: e237157.
55. Gosmanova EO, Chen K, Ketteler M et al. Risk of cardiovascular conditions in patients with chronic hypoparathyroidism: A retrospective cohort study. Adv Ther 2021; 38 : 4246–4257.
56. Rubin MR, Dempster DW, Zhou H et al. Dynamic and structural properties of the skeleton in hypoparathyroidism. J Bone Miner Res 2008; 23 : 2018–2024.
57. Baeke F, Takiishi T, Korf H et al. Vitamin D: Modulator of the immune system. Curr Opin Pharmacol 2010; 10 : 482–496.
58. Lorente-Poch L, Sancho JJ, Carballo L, Sitges-Serra A. Clinical profile and long-term follow-up of 32 patients with postoperative permanent hypoparathyroidism. Gland Surg 2017; 6 (Suppl. 1): s3–s10.
59. Cho NL, Moalem J, Chen L et al. Surgeons and patients disagree on the potential consequences from hypoparathyroidism. Endocr Pract 2014; 20 : 427–446.
60. Siggelkow H, Clarke BL, Germak J et al. Burden of illness in not adequately controlled chronic hypoparathyroidism: Findings from a 13-country patient and caregiver survey. Clin Endocrinol (Oxf) 2020; 92 : 159–168.
61. Hadker N, Egan J, Sanders J et al. Understanding the burden of illness associated with hypoparathyroidism reported among patients in the PARADOX study. Endocr Pract 2014; 20 : 671–679.
62. Makras P, Yavropoulou MP, Kassi E et al. Management of parathyroid disorders: recommendations of the working group of the Bone Section of the Hellenic Endocrine Society. Hormones (Athens) 2020; 19 : 581–591.
63. Kršek M, Šumník Z, Zajíčková K a kol. Doporučený postup České endokrinologické společnosti pro diagnostiku a léčbu primární hyperparathyreózy a hypoparathyreózy. Vnitřní lékařství 2021; 67 (Suppl. A).
64. Meola A, Vignali E, Matrone A et al. Efficacy and safety of long-term management of patients with chronic post-surgical hypoparathyroidism. J Endocrinol Invest 2018; 41 : 1221–1226.
65. Khan AA, AbuAlrob H, Punthakee Z et al. Canadian national hypoparathyroidism registry: An overview of hypoparathyroidism in Canada. Endocrine 2021; 72 : 553–561.
66. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42(4 Suppl 3): s1–s201.
67. Clarke BL, Vokes TJ, Bilezikian JP et al. Effects of parathyroid hormone rhPTH(1-84) on phosphate homeostasis and vitamin D metabolism in hypoparathyroidism: REPLACE phase 3 study. Endocrine 2017; 55 : 273–282.
68. Saha S, Goswami R. Auditing the efficacy and safety of alfacalcidol and calcium therapy in idiopathic hypoparathyroidism. J Clin Endocrinol Metab 2019; 104 : 1325–1335.
69. Mannstadt M, Clarke BL, Vokes T et al. Efficacy and safety of recombinant human parathyroid hormone (1–84) in hypoparathyroidism (REPLACE): a double-blind, placebo-controlled, randomised, phase 3 study. Lancet Diabetes Endocrinol 2013; 1 : 275–283.
70. Vokes TJ, Mannstadt M, Levine MA et al. Recombinant human parathyroid hormone effect on health-related quality of life in adults with chronic hypoparathyroidism. J Clin Endocrinol Metab 2018; 103 : 722–731.
71. Chen KS, Gosmanova EO, Curhan GC et al. Five-year estimated glomerular filtration rate in patients with hypoparathyroidism treated with and without rhPTH(1-84). J Clin Endocrinol Metab 2020; 105: e3557–e3565.
72. Rubin MR, Zhou H, Cusano NE et al. The effects of long-term administration of rhPTH(1-84) in hypoparathyroidism by bone histomorphometry. J Bone Miner Res 2018; 33 : 1931–1939.
73. Cusano NE, Rubin MR, McMahon DJ et al. The effect of PTH(1-84) on quality of life in hypoparathyroidism. J Clin Endocrinol Metab 2013; 98 : 2356–2361.
74. Mannstadt M, Clarke BL, Bilezikian JP et al. Safety and efficacy of 5 years of treatment with recombinant human parathyroid hormone in adults with hypoparathyroidism. J Clin Endocrinol Metab 2019; 104 : 5136–5147.
75. Cusano NE, Rubin MR, McMahon DJ et al. The effect of PTH (1-84) on quality of life in hypoparathyroidism. J Clin Endocrinol Metab 2013; 98 : 2356–2361.
75. Tabacco G, Tay YD, Cusano NE et al. Quality of life in hypoparathyroidism improves with rhPTH(1-84) throughout 8 years of therapy. J Clin Endocrinol Metab 2019; 104 : 2748–2756.
76. Cusano NE, Anderson L, Rubin MR et al. Recovery of parathyroid hormone secretion and function in postoperative hypoparathyroidism: a case series. J Clin Endocrinol Metab 2013; 98 : 4285–4290.
77. Grani G, Sponziello M, Pecce V et al. Contemporary thyroid nodule evaluation and management. J Clin Endocrinol Metab 2020; 105 : 2869–2883.
78. Welch HG, Doherty GM. Saving thyroids – overtreatment of small papillary cancers. N Engl J Med 2018; 379 : 310–312.
79. Ahn SV, Lee JH, Bove-Fenderson EA et al. Incidence of hypoparathyroidism after thyroid cancer surgery in South Korea, 2007–2016. JAMA 2019; 322 : 2441–2443.
80. Gharib H, Papini E, Garber JR et al. American Association of Clinical Endocrinologists, American College of Endocrinology, and Associazione Medici Endocrinologi Medical Guidelines for Clinical Practice for the diagnosis and management of thyroid nodules – 2016 update. Endocr Pract 2016; 22 : 622–639.
81. Muller S, Senne M, Kirschniak A et al. Impact of surgical resection extension on outcome for primary well-differentiated thyroid cancer-a retrospective analysis. World J Surg Oncol 2017; 15 : 190.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2023 Issue 4-
All articles in this issue
- ÚVODEM
- Prevence a programy prevence karcinomu plic
- Hypoparatyreóza
- Terapeutické monitorování léků v psychiatrii
- Etické aspekty transplantace tkání a orgánů
- Je bolest břicha po traumatu pouze úrazové etiologie? Kazuistika raritní aspirační pneumonie s gangrénou plic a peritoneální odezvou u pětiletého dítěte
- 100 let od popisu oční toxoplazmózy profesorem Josefem Janků
- MUDr. Vlastimil Dostálek – zakladatel oddělení ORL v Novém Jičíně – a jeho žáci
- Odešla vynikající lékařka prof. Marie Brodanová
- Zemřel Emil Kormuth, hostující profesor FBMI ČVUT
- Lavička Jaroslava Blahoše
- Projekt Terapie budoucnosti
- PŘEDNÁŠKOVÉ VEČERY SPOLKU ČESKÝCH LÉKAŘŮ V PRAZE (ZÁŘÍ – ŘÍJEN 2023)
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Etické aspekty transplantace tkání a orgánů
- Prevence a programy prevence karcinomu plic
- Terapeutické monitorování léků v psychiatrii
- Je bolest břicha po traumatu pouze úrazové etiologie? Kazuistika raritní aspirační pneumonie s gangrénou plic a peritoneální odezvou u pětiletého dítěte
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

