-
Medical journals
- Career
Ztukovatění jater spojené s metabolickou dysfunkcí (MAFLD) jako přesnější název pro NAFLD – společné aspekty patogeneze
Authors: Barbora Nováková
Authors‘ workplace: 4. interní klinika – klinika gastroenterologie a hepatologie 1. LF UK a VFN v Praze
Published in: Čas. Lék. čes. 2022; 161: 65-71
Category: Review Article
Overview
Nealkoholové ztukovatění jater (NAFLD) bývá v posledních letech považováno za jaterní manifestaci metabolického syndromu. S ohledem na podklad patogeneze jaterní steatózy a nealkoholové steatohepatitidy (NASH) byla skupinou odborníků navržena změna názvu NAFLD na „ztukovatění jater spojené s metabolickou dysfunkcí“ (MAFLD – metabolic dysfunction-associated fatty liver disease). Nový název by podle těchto autorů měl lépe odrážet nejen patogenezi onemocnění, ale také lépe stratifikovat rizika pacientů ve vztahu k léčbě a odstranit jejich stigmatizaci z přítomnosti „alkoholu“ v názvu onemocnění. Tato práce také upozorňuje na některé důležité společné aspekty patogeneze jaterní steatózy a metabolického syndromu, jako jsou např. dyslipidémie, porušená glukózová tolerance, střevní dysbióza, oxidační stres, a některé genetické, epigenetické a hormonální vlivy.
Klíčová slova:
dyslipidemie – mikrobiom – diabetes mellitus 2. typu – metabolický syndrom – nealkoholové ztukovatění jater – nealkoholová steatohepatitida – proteom – adipokiny – žlučové kyseliny – nepřekládaná RNA
ÚVOD
Nealkoholové ztukovatění jater (NAFLD) je definováno jako akumulace více než 5 % tuku v jaterní biopsii u pacientů, kteří ve zvýšené míře nekonzumují alkohol (tj. dle doporučení Světové zdravotnické organizace ženy v množství méně než 20 g/den čistého alkoholu, muži v množství méně než 30 g/den), a u kterých byla zároveň vyloučena sekundární příčina steatózy jater (např. virová hepatitida, jaterní onemocnění vyvolané léky, autoimunitní onemocnění jater, onemocnění žlučových cest a dědičné metabolické nemoci).
NAFLD je v současnosti nejčastější chronické jaterní onemocnění, které postihuje zejména pacienty s metabolickým syndromem (MS) a lze ho považovat za jeho jaterní manifestaci (tab. 1) (1–3). Odhaduje se, že zhruba 30 % pacientů s prostou jaterní steatózou vyvine časem těžší formu, nealkoholovou steatohepatitidu (NASH), která je charakterizovaná histologicky zánětem a balónovitou degenerací hepatocytů, a při které významně narůstá riziko vzniku jaterní fibrózy, cirhózy a hepatocelulárního karcinomu (HCC) (1). Právě NAFLD (NASH) je z příčin jaterní cirhózy nejvíce na vzestupu a čím dál více se tito pacienti objevují na čekacích listinách k jaterní transplantaci i pro HCC (4).
Table 1. Současná definice metabolického syndromu (MS) dle (2), jeho další komponenty (vpravo) a důsledky jejich komplexního působení (dole) (3) 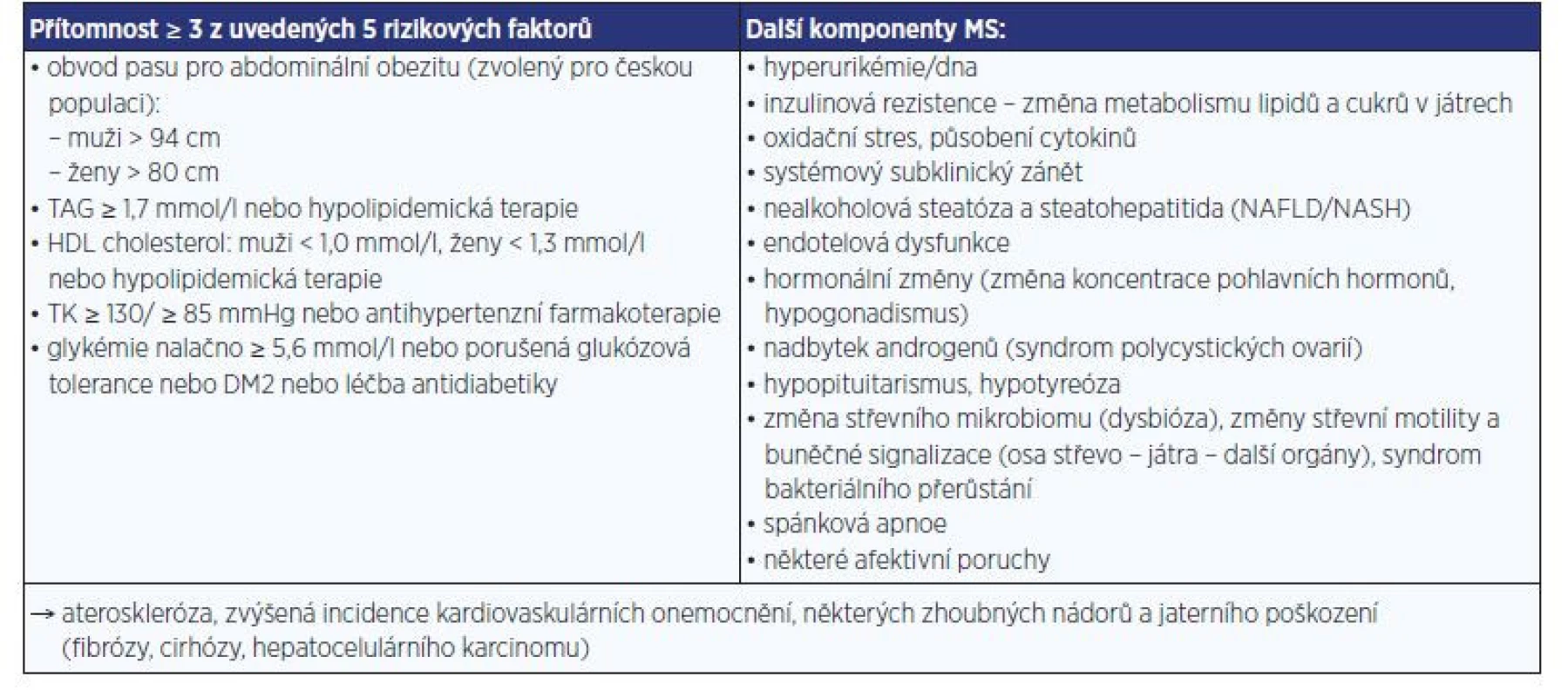
SPOLEČNÉ ASPEKTY PATOGENEZE NAFLD A MS
Patofyziologický podklad jaterní steatózy i MS je komplexní – u většiny pacientů se v něm uplatňují zejména strava a životní styl. Sedavý způsob života, strava bohatá na tuky a chudá na vlákninu, pozitivní energetická bilance – to vše jsou hlavní příčiny vzniku MS a zároveň NAFLD. Více či méně jsou v jejich patogenezi důležité další faktory, jako například věk, genetická predispozice nebo působení střevního mikrobiomu (1).
Polovina diabetiků 2. typu má jaterní steatózu
Prevalence MS závisí na použitých kritériích, pohlaví a věku. Prevalence NAFLD ve Spojených státech se nyní pohybuje kolem 25 % a podobně je tomu i na jiných světadílech (27 % Asie, 24 % Evropa) (1). V selektované populaci diabetiků 2. typu (DM2) se jaterní steatóza vyskytuje dvakrát častěji (celosvětová prevalence 55 %) (1), a naopak polovina pacientů s jaterní steatózou a až 85 % s NASH má metabolický syndrom (5). Výše uvedenému odpovídá i elevace sérové gama-glutamyltransferázy (GGT) jak u pacientů s NAFLD, tak i DM2, nebo kardiovaskulárními onemocněními, nezávisle na příjmu alkoholu (6). Obezita a MS jsou dokonce silnějším prediktorem elevace jaterních testů než příjem alkoholu (7). Pacient s NAFLD vzhledem k složité etiologii onemocnění tak často potřebuje péči lékařů více oborů, kromě gastroenterologa např. diabetologa nebo kardiologa (8).
Dyslipidémie – lipotoxicita
Jedním ze společných znaků MS a NAFLD je viscerální a ektopická akumulace tukové tkáně (játra, pankreas, omentum, kosterní svaly, myokard), která se pojí s inzulinovou rezistencí. Dochází při ní k narušení metabolismu lipidů a sacharidů, imunitního systému, nerovnováze působení různých cytokinů a zvýšení oxidačního stresu, který je hlavním katalyzátorem vzniku subklinického zánětu (obr. 1) (5).
Image 1. Komplexní patogeneze NAFLD při metabolickém syndromu (5) 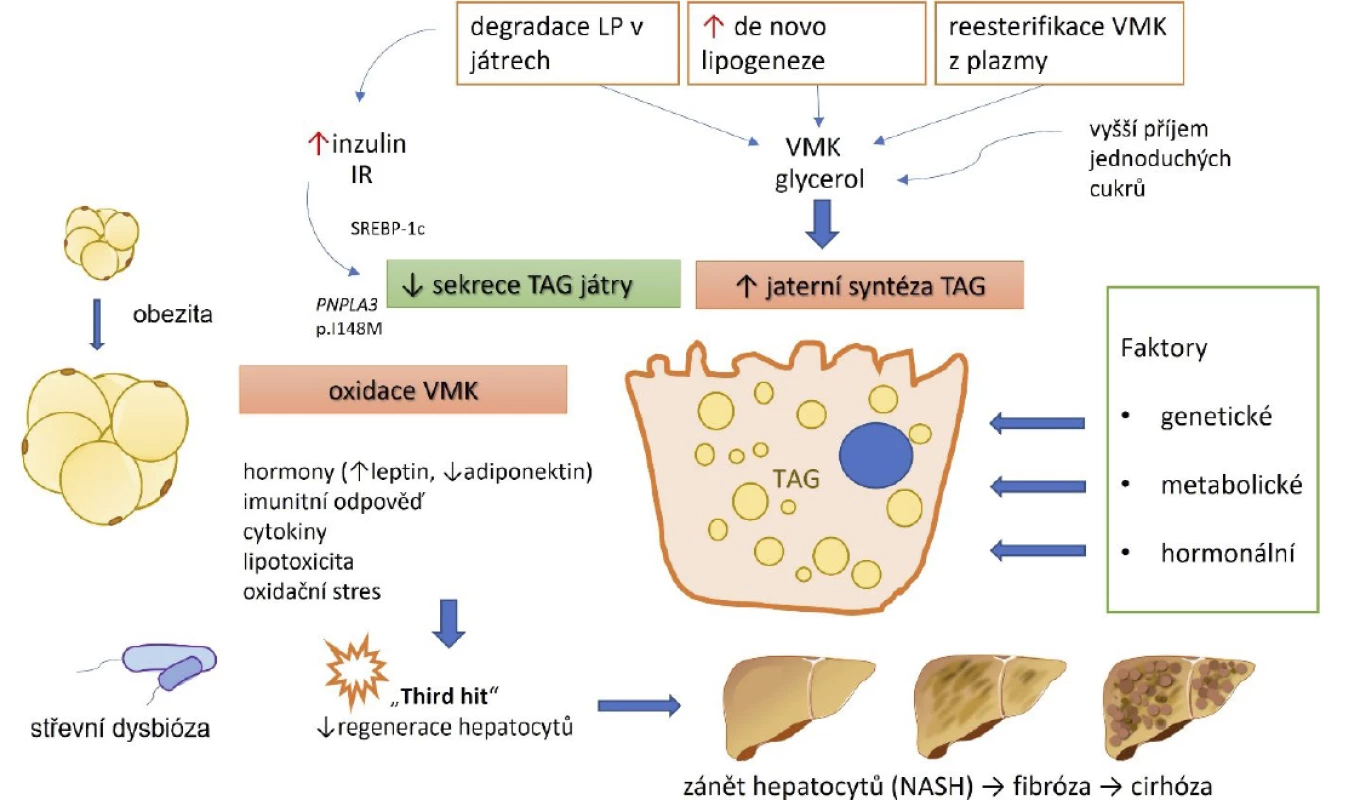
Pozn.: NASH – nealkoholová steatohepatitida; LP – lipoproteiny; VMK – volné mastné kyseliny; TAG – triacylglyceroly; IR – inzulinová resistence; SREP-c – transkripční faktor SREBP-1c (sterol regulatory element binding protein, který kontroluje exprese lipogenních genů). Klíčová je v tomto případě nerovnováha mezi příjmem, syntézou, skladováním a sekrecí volných mastných kyselin. Hlavními zdroji nasycených mastných kyselin (NMK) jsou tuková tkáň, strava a de novo lipogeneze z glukózy. Za fyziologických podmínek jsou NMK transportovány do mitochondrií, kde je jejich energie zužitkována beta-oxidací, nebo jsou reesterifikovány a dále exkretovány jako VLDL (very low density lipoproteins), nebo uskladněny jako tukové kapénky (lipid droplets), jejichž nadbytek v jaterní tkáni charakterizuje jaterní steatózu.
S MS a obezitou je asociován vyšší příjem nasycených mastných kyselin a s výraznou převahou omega-6 nad omega-3 mastnými kyselinami (5, 9). Naopak s pozitivními dopady na organismus jsou spojeny omega-3 polynenasycené mastné kyseliny. Jejich suplementace vede u pacientů s NAFLD ke zlepšení biochemických parametrů, redukci množství tuku v játrech a má pozitivní efekt na složení plazmatického lipidového profilu (10).
Inzulinová rezistence
Inzulinová rezistence je základní charakteristikou MS i významným faktorem v patogenezi a progresi NAFLD. Zdravá játra jsou vysoce senzitivní na inzulin. Inzulinová rezistence stimuluje influx mastných kyselin a ukládání triacylglycerolů v játrech, vede také k lipoperoxidaci (oxidativnímu poškození vyšších mastných kyselin), při které se uvolňují volné radikály, které následně mj. stimulují jaterní Itovy buňky (hepatic stellate cells) k produkci vaziva (11).
Adipokiny
Adipokiny (adipose tissue cytokines) jsou hormony a cytokiny produkované adipocyty, ale také jinými buňkami, které se v tukové tkáni vyskytují nebo ji infiltrují (makrofágy, monocyty, fibroblasty atd.). Nejznámější adipokiny jsou leptin, adiponektin a resistin, tumor nekrotizující faktor alfa nebo interleukin-6. U pacientů s MS a NAFLD se tuk ukládá nejen v játrech, ale též viscerálně a ektopicky. To vede k změnám profilu produkovaných adipokinů ve smyslu zvýšené produkce prozánětlivých cytokinů, pod jejichž vlivem jaterní steatóza progreduje do NASH a fibrózy (12).
Střevní mikrobiom a NAFLD
Střevní mikrobiom ovlivňuje řadu fyziologických procesů hostitele, včetně např. imunity, glukózové homeostázy, známý je vztah na ose střevo-játra-CNS. Interakce mezi mikrobiomem a hostitelem jsou podmíněny bakteriálními metabolity. NAFLD je asociován s rozvolněním mezibuněčných spojení, tzv. tight junctions, enterocytů nezřídka vedoucí k syndromu bakteriálního přerůstání v tenkém střevě (SIBO – small intestinal bacterial overgrowth).
Při něm dochází k poruše střevní bariéry a translokaci bakterií a jejich produktů. Mezi ně patří např. lipopolysacharid, mastné kyseliny s krátkým řetězcem, trimethylamin (TMA), endogenní ethanol a acetaldehyd. Mikrobiální produkty se dostávají cestou portálního řečiště k játrům i do systémové cirkulace, což má za následek stimulaci imunitních buněk k produkci cytokinů a zánětlivou odpověď. SIBO a zvýšená permeabilita střevní stěny koreluje s tíží steatózy (13). K bakteriálnímu přerůstání predisponuje také diabetická porucha střevní motility. Výsledkem je alterace mikrobiomu (dysbióza) popisovaná u pacientů s MS. Je pravděpodobné, že změny mikrobiomu vedou ruku v ruce s působením jejích metabolitů ke strukturální poruše střevního epitelu, což usnadňuje bakteriální translokaci (5, 13).
Obezita je také asociována se zvýšenou kapacitou zisku energie z hostitelské stravy. Enzymatická výbava bakterií např. umožnuje zisk energie z jinak nestravitelných polysacharidů. U obézních i u pacientů s NAFLD bylo popsáno, že určité druhy bakterií, např. Bacteroidetes fermentují vlákninu v potravě a při tom produkují mastné kyseliny s krátkým řetězcem (acetát, propionát, butyrát), které jsou substrátem pro syntézu cholesterolu a jaterní de novo lipogenezi, podílí se významně na energetickém příjmu a aktivují zánětlivou odpověď (14).
Strava s vysokým obsahem tuků rezultuje v mikrobiom, který velmi snadno konvertuje stravou přijatý cholin v metylaminy, které snižují jaterní sekreci VLDL a tím umocňují zvýšenou akumulaci triacylglycerolů v játrech. TMA, vzniklý bakteriální přeměnou cholinu, je posléze v játrech oxidován na trimetylamin-N-oxid, který je aterogenní a je asociován s výskytem kardiovaskulárních příhod (14).
Výše uvedené procesy představují přímou vazbu mezi střevním mikrobiomem a akumulací lipidů v játrech.
Žlučové kyseliny
U pacientů s NAFLD i MS byly popsány specifické změny cirkulujících žlučových kyselin (ŽK) (15). ŽK jsou v rámci enterohepatálního cyklu vstřebávány v terminálním ileu, kde mají přímý bakteriostatický efekt. Zajišťují komunikaci mezi játry a střevem a podobně jako hormony se váží na řadu receptorů, jejichž prostřednictvím ovlivňují chod metabolismu. Receptory pro ŽK nesou buňky jater a střeva (farnesoid-X receptor /FXR/ a plazmatický membránově vázaný receptor spojený s G proteinem /TGR5/), ale také pankreatu, tukové tkáně i štítné žlázy. ŽK působí také na imunitní a kardiovaskulární systém a CNS. Prostřednictvím střevního FXR receptoru ŽK zpětnovazebně regulují svoji syntézu, a tím i spotřebu cholesterolu. Aktivace TGR5 zvyšuje energetický výdej a stimuluje sekreci glukagonu podobného peptidu 1 (GLP-1) a tak zlepšuje inzulinovou senzitivitu. Na základě ovlivnění intestinálního FXR a TGR5 receptoru jsou vyvíjeny některé nové léky ke zmírnění jaterní steatózy (16).
Proteomika
Játra jsou centrálním orgánem metabolismu včetně syntézy bílkovin. Změny proteosyntézy pacientů s NAFLD zasahují do regulace imunitního systému, zánětu, koagulace, ovlivňují funkci transportních krevních proteinů a složení mezibuněčné matrix (17). Do oběhu se také dostávají produkty apoptózy a oxidačního stresu, například fragmenty cytokeratinu (18).
Oxidační stres a dysregulace imunity
MS se pojí s oxidačním stresem, zánětem tukové tkáně a subklinickým systémovým zánětem. Dlouhodobé působení volných radikálů aktivuje Kupfferovy buňky, jiné makrofágy a hvězdicovité Itovy buňky a dochází k vazivovatění (5).
Genetické a epigenetické faktory
Ukazuje se, že polymorfismy v určitých kandidátních genech, jako jsou PNPLA3, TM6SF2, CETP a PEMT, pravděpodobně zčásti mohou za výskyt NAFLD u štíhlých jedinců (19). Nejznámější varianta p.I148M v genu PNPLA3 kódujícím lipázu (patatin-like phospholipase domain-containing protein 3 gene) je s NAFLD významně asociovaná. Přítomnost nepříznivé homozygotní varianty ovlivňuje akumulaci lipidových kapének v hepatocytech a přispívá k jaterní fibrogenezi. Exprese proteinu PNPLA3 je také upregulována mediátory zánětu a inzulinem, což naznačuje její možný vliv v patogenezi DM2 (20).
Cirkulující mikroRNA (miRNA) jsou molekuly RNA, které samy nekódují bílkovinu, ale regulují expresi proteinů. Předpokládá se, že hrají roli v mezibuněčné komunikaci i patogenezi různých onemocnění. Např. miRNA-122 je asociována s NAFLD i s inzulinovou rezistencí, obezitou, DM2 a MS (21).
Epigenetická modifikace se týká např. receptorů PPAR-γ (jaderné receptory gama aktivované proliferátory peroxisomů). Modulace promotéru PPAR-γ akcentuje oxidační stres a zánět hepatocytů. Receptory PPAR-γ ovlivňují adipogenezi a regulují funkce tukové tkáně včetně ukládání mastných kyselin (22). Fyzická aktivita pomáhá PPAR-γ aktivovat, a tím zvyšuje energetický výdej a pomáhá hubnutí (23).
PROČ PŘEJMENOVAT NAFLD NA MAFLD
Je ztukovatění jater spojené s metabolickou dysfunkcí?
Vzhledem k popsané silné vazbě jaterní steatózy na MS přišla skupina autorů s tezí přejmenovat NAFLD na ztukovatění jater spojené s metabolickou dysfunkcí (MAFLD – metabolic dysfunction-associated fatty liver disease) (8).
Název MAFLD více reflektuje silnou vazbu jaterní steatózy na MS. Současně autoři upozorňují, že název „nealkoholové jaterní ztukovatění“ začíná záporem. Říká pacientovi, co nemá a nedostatečně reflektuje metabolické příčiny onemocnění. Název NAFLD je zejména nepřesný, protože patofyziologie vzniku jaterní steatózy je velmi komplexní a heterogenní. Nepodílejí se na ní jen tuky. Patogeneze zahrnuje mnoho různých faktorů, např. subklinický zánět tukové tkáně, působení adipokinů, inzulinovou rezistenci nebo vliv střevního mikrobiomu a metabolitů produkovaných střevními bakteriemi. Za pozornost stojí i dobře dokumentované stoupající riziko rozvoje HCC s narůstající délkou trvání diabetu a počtem metabolických komorbidit (DM2, obezita, hypertenze, dyslipidémie) (5, 24). Pacienty i lékaře je potřeba na metabolický původ jaterní steatózy lépe upozornit. Nově navržený název MAFLD toto nabízí, a je tedy přesnější (tab. 2) (8, 25).
Table 2. Nejčastější argumenty pro a proti přejmenování NAFLD na MAFLD (8, 25) 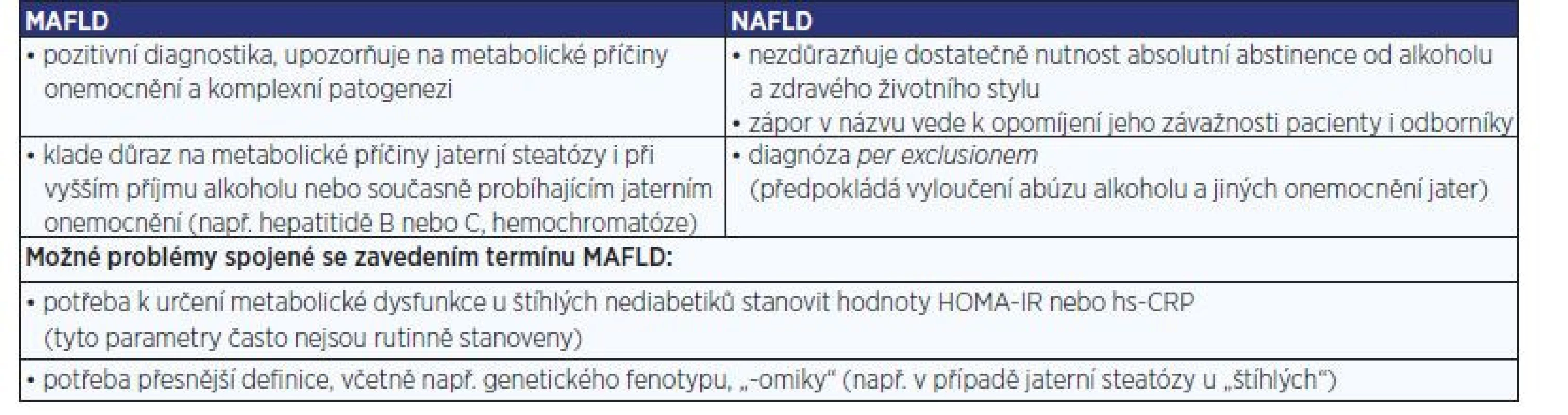
Problém označení představuje také to, že je v něm použit termín „alkohol“, který může pacienty stigmatizovat. Je chybou, pokud jaterní steatózu u pacienta s MS připíšeme pouze souběžnému pití alkoholu (zvlášť pokud jeho příjem není nijak extenzivní). Stejně tak je chybou přítomnost jaterní steatózy při metabolickém onemocnění bagatelizovat (i před samotným pacientem), protože existuje jasná souvislost mezi MS a jaterní cirhózou nebo hepatocelulárním karcinomem (1, 24). Naopak je na místě pravidelná úvaha o možném postižení jater a u každého takového pacienta jeho pravidelný screening.
Kritéria MAFLD
Navržená diagnostická kritéria MAFLD (25) se opírají o průkaz jaterní steatózy (histologicky, zobrazovacími metodami nebo pomocí krevních biomarkerů) a současně splnění jedné ze 3 následujících podmínek:
- nadváha/obezita
- diabetes 2. typu
- metabolická dysregulace (daná existencí alespoň dvou rizikových parametrů, obr. 2).
Image 2. Navržená kritéria pro diagnostiku MAFLD, kritéria pro dospělou bělošskou populaci dle (25) 
Pozn.: BMI – body mass index; DM2 – diabetes mellitus 2. typu; HbA1c –glykovaný hemoglobin; HDL – lipoproteiny s vysokou hustotou; HOMA-IR – skóre Homeostasis Model Assessment – Insulin Resistence; hs-CRP – high sensitivity CRP; MAFLD – tukové onemocnění jater spojené s metabolickou dysfunkcí; OGT – postprandiální glukózový toleranční trest; TAG – triacylglyceroly; TH – specifická léková terapie; TK – krevní tlak. Pacienti s kryptogenní cirhózou by podle nově navržených kritérií měli spadat pod diagnózu „cirhóza asociovaná s MAFLD“, pokud mají (nebo v minulosti měli) jaterní steatózu a zároveň MS nebo některou z jeho komponent (25).
Diagnóza MAFLD toleruje vyšší příjem alkoholu i virovou hepatitidu
Dosavadní diagnóza NAFLD per exclusionem předpokládá vyloučení vyššího příjmu alkoholu a jiného jaterního onemocnění (1). Nicméně dlouhodobé populační studie prokázaly, že MS je nezávisle na příjmu alkoholu spojen s rozvojem pokročilého jaterního onemocnění. Právě pacienty s vyšším příjmem alkoholu nebo jiným jaterním onemocněním je třeba upozornit na škodlivý vliv metabolických komorbidit a nutnost jejich léčby. Diagnostika MAFLD proto klade důraz na pozitivní průkaz MS nebo metabolické dysfunkce, aniž bychom museli vyloučit pacienty s anamnézou abúzu alkoholu nebo konkomitantního jaterního onemocnění (25). Stejně tak by se neměli pacienti domnívat, že když má jejich nemoc v názvu přívlastek „nealkoholová“, mohou alkohol dále v menší míře konzumovat. Toxické působení alkoholu zhoršuje průběh NAFLD, akcentuje akumulaci tuků v játrech, a vede k časnější fibrotizaci a vyšší mortalitě na jaterní, kardiovaskulární a onkologická onemocnění (5).
Štíhlí, ale s metabolickou dysfunkcí
Šest až dvacet procent pacientů s diagnózou MAFLD nejsou obézní, nemají nadváhu ani jim nebyl diagnostikován DM2 (1). Přesto pokud splňují některá kritéria MS a je pravděpodobné, že se u nich MS časem plně rozvine tito „štíhlí“ pacienti s jaterní steatózou mohou mít metabolickou dysfunkci (5). Pokud u „štíhlého“, nediabetika s jaterní steatózou nenajdeme žádný znak MS, ideálně bychom měli stanovit skóre HOMA-IR (homeostasis model assessment-insulin resistence) nebo hs-CRP (high sensitivity CRP, tj. hodnota C-reaktivního proteinu získaná metodou s vysokou citlivostí), které nebývají rutinně využívány (obr. 2) (25).
Vyšší jaterní, kardiovaskulární a onkologická úmrtnost MAFLD
Morbidita a mortalita v souvislosti s chronickým onemocněním jater celkově v posledních letech stoupá (1). Pacienti s NAFLD mají proti těm, kteří jaterní steatózu nemají, o 65 % vyšší pravděpodobnost výskytu kardiovaskulárních příhod, srdečních arytmií a dle některých studií i vyšší kardiovaskulární mortalitu i mortalitu na extrahepatální onkologická onemocnění (26, 27).
MAFLD u dětí a mladistvých
NAFLD je jednou z nejčastějších komorbidit také u obézních dětí a adolescentů. Jeho výskyt v pediatrické populaci podle dosavadních studií dosahuje až 12 % a u obézních jedinců cca 30 % (28). Při použití kritérií MAFLD je pak prevalence ještě 1,5krát vyšší (29). Na vině jsou podobně jako u dospělých vnější faktory (zejména vyšší příjem jídel obohacených fruktózou a sacharózou), a na rozdíl od dospělých se před dosažením dospělosti pravděpodobně více uplatňují i genetické vlivy (28).
ZÁVĚR
NAFLD je dnes celosvětově velmi rozšířeným chronickým onemocněním v dospělé i dětské populaci (1). Je silně asociováno s metabolickým syndromem, jak je upozorňováno skrze nově navržený název ztukovatění jater spojené s metabolickou dysfunkcí – MAFLD (8). Obě jsou v převážném počtu případů civilizační nemoci vznikající v důsledku nadbytečného příjmu energie (5). Patofyziologie MAFLD je komplexní, ke vzniku jaterní steatózy přispívají různou mírou vícečetné vzájemně propojené mechanismy (dyslipidémie, inzulinová resistence, střevní dysbióza, oxidační stres a některé genetické, epigenetické a hormonální vlivy) (5).
Za pozornost stojí dokumentovaná vyšší mortalita pacientů s MAFLD, a to nejen jaterní, ale i kardiovaskulární a onkologická (24, 26, 27). Nová diagnostická kritéria MAFLD jsou založena na průkazu BMI > 25, diabetu 2. typu nebo metabolické dysfunkce. Diagnostikovat MAFLD tedy vyžaduje nejen diagnostikovat přítomnost jaterní steatózy, ale i zvažovat a vyšetřovat jednotlivé prvky metabolického syndromu. Nevýhodou této definice se může zdát nutnost v některých případech stanovit méně obvyklé parametry jako např. skóre HOMA-IR nebo hs-CRP (25). Specifickou skupinou jsou pak štíhlí pacienti s jaterní steatózou bez diabetu mellitu 2. typu, u nichž mohou být na vině ve větší míře genetické faktory (19). Oproti dosavadní definici pak MAFLD nevylučuje pacienty s konkomitantním jaterním onemocněním (např. virovými hepatitidami nebo alkoholovým postižením), naopak vzhledem k horší prognóze těchto pacientů s duální diagnózou vybízí, abychom jim věnovali více péče a léčili u nich metabolické onemocnění jater stejně intenzivně jako druhou komponentu diagnózy. Jaterní steatózu je tedy třeba vnímat v širším pohledu a stejně tak přistupovat k její léčbě. Je třeba se zaměřit i na léčbu složek metabolického syndromu (25). S ohledem na tuto problematiku lze tedy jasně doporučit screening NAFLD u pacientů s metabolickým syndromem, DM2, obezitou, arteriální hypertenzí a dyslipidémií.
Čestné prohlášení
Autorka práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Podpořeno grantem MZ ČR-RVO-VFN00064165.
Seznam použitých zkratek
BMI body mass index
CETP cholesteryl ester transfer protein
CNS centrální nervový system
CRP C-reaktivní protein
DM2 diabetes mellitus 2. typu
FXR farnesoid-X receptor
GGT gama-glutamyltransferáza
GLP-1 glukagonu podobný peptid 1
HbA1c glykovaný hemoglobin
HCC hepatocelulární karcinom
HDL lipoproteiny s vysokou hustotou
HOMA-IR skóre Homeostasis Model Assessment – Insulin Resistence
hs-CRP CRP stanovený metodou s vysokou citlivostí
IR inzulinová resistence
LP lipoproteiny
MAFLD ztukovatění jater spojené s metabolickou dysfunkcí
miRNA mikro RNA
MS metabolický syndrom
NAFLD nealkoholové ztukovatění jater
NASH nealkoholová steatohepatitida
NMK nasycené mastné kyseliny
OGT postprandiální glukózový toleranční trest
PEMT fosfatidyletanolamin N-metyltransferáza
PNPLA3 patatin-like phospholipase domain-containing protein 3 gene
PPAR-γ jaderné receptory gama aktivované proliferátory peroxisomů
RNA ribonukleová kyselina
SIBO syndrom bakteriálního přerůstání v tenkém střevě
SREP-c transkripční faktor SREBP-1c
SREBP-1c sterol regulatory element binding protein, který kontroluje expresi lipogenních genů
TAG plazmatické triacylglyceroly
TGR5 plazmatický membránově vázaný receptor spojený s G proteinem
TH specifická léková terapie
TK krevní tlak
TM6SF2 transmembrane 6 superfamily member 2
TMA trimetylamin
VLDL lipoproteiny s velmi nízkou hustotou
VMK volné mastné kyseliny
ŽK žlučové kyseliny
Adresa pro korespondenci:
MUDr. Barbora Nováková
4. interní klinika 1. LF UK a VFN
U Nemocnice 499/2, 128 08 Praha 2
Tel.: 224 962 489
e-mail: barbora.novakova2@vfn.cz
Sources
- Younossi Z, Anstee QM, Marietti M et al. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol 2017; 15(1): 11–20.
- Alberti KG, Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120(16): 1640–1645.
- Kučera K, Malinovská J, Jenšovský M a kol. Metabolický syndrom v ordinaci praktického lékaře. Praktický lékař 2020; 100(4): 182–185.
- Michelotti GA, Machado MV, Diehl AM. NAFLD, NASH and liver cancer. Nat Rev Gastroenterol Hepatol 2013; 10(11): 656–665.
- Polyzos SA, Kountouras J, Mantzoros CS. Obesity and nonalcoholic fatty liver disease: From pathophysiology to therapeutics. Metabolism 2019; 92 : 82–97.
- Kunutsor SK, Abbasi A, Adler AI. Gamma-glutamyl transferase and risk of type II diabetes: an updated systematic review and dose-response meta-analysis. Ann Epidemiol 2014; 24(11): 809–816.
- Adams L. Body mass index is a stronger predictor of alanine aminotransaminase levels than alcohol consumption. J Gastroenterol Hepatol 2008; 23(7 Pt. 1): 1089–1093
- Méndez-Sánchez N, Bugianesi E, Gish RG et al. Global multi-stakeholder endorsement of the MAFLD definition. Lancet Gastroenterol Hepatol 2022; 7(5): 388–390.
- Fuchs M, Sanyal AJ. Lipotoxicity in NASH. J Hepatol 2012; 56(1): 291–293.
- Šmíd V, Dvořák K, Šedivý P et al. Effect of omega‐3 polyunsaturated fatty acids on lipid metabolism in patients with metabolic syndrome and NAFLD. Hepatol Commun 2022; 6(6): 1336–1349.
- Angelico F, Del Ben M, Conti R et al. Insulin resistance, the metabolic syndrome, and nonalcoholic fatty liver disease. J Clin Endocrinol Metab 2005; 90(3): 1578–1582.
- Marra F, Bertolani C. Adipokines in liver diseases. Hepatology 2009; 50(3): 957–969.
- Miele L, Valenza V, La Torre G et al. Increased intestinal permeability and tight junction alterations in nonalcoholic fatty liver disease. Hepatology 2009; 49(6): 1877–1887.
- Aron-Wisnewsky J, Vigliotti C, Witjes J et al. Gut microbiota and human NAFLD: disentangling microbial signatures from metabolic disorders. Nat Rev Gastroenterol Hepatol 2020; 17(5): 279–297.
- Puri P, Daita K, Joyce A et al. The presence and severity of nonalcoholic steatohepatitis is associated with specific changes in circulating bile acids. Hepatology 2017; 67(2): 534–548.
- Vítek L, Haluzík M. The role of bile acids in metabolic regulation. J Endocrinol 2016; 228(3): R85–R96.
- Bell LN, Theodorakis JL, Vuppalanchi R et al. Serum proteomics and biomarker discovery across the spectrum of nonalcoholic fatty liver disease. Hepatology 2009; 51(1): 111–120.
- Williams CD, Stengel J, Asike MI et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study. Gastroenterology 2011; 140(1): 124–131.
- Ren TY, Fan JG. What are the clinical settings and outcomes of lean NAFLD? Nat Rev Gastroenterol Hepatol 2021; 18(5): 289–290.
- Pingitore P, Romeo S. The role of PNPLA3 in health and disease. Biochim Biophys Acta Mol Cell Biol Lipids 2019; 1864(6): 900–906.
- Willeit P, Skroblin P, Moschen AR et al. Circulating microRNA-122 is associated with the risk of new-onset metabolic syndrome and type 2 diabetes. Diabetes 2016; 66(2): 347–357.
- Zhao Q, Qin CY, Zhao ZH et al. Epigenetic modifications in hepatic stellate cells contribute to liver fibrosis. Tohoku J Exp Med 2013; 229(1): 35–43.
- Boström P, Wu J, Jedrychowski MP et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature 2012; 481(7382): 463–468.
- Simon TG, King LY, Chong DQ et al. Diabetes, metabolic comorbidities, and risk of hepatocellular carcinoma: Results from two prospective cohort studies. Hepatology 2018; 67(5): 1797–1806.
- Eslam M, Newsome PN, Sarin SK et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J Hepatol 2020; 73(1): 202–209.
- Targher G, Byrne CD, Lonardo A et al. Non-alcoholic fatty liver disease and risk of incident cardiovascular disease: A meta-analysis. J Hepatol 2016; 65(3): 589–600.
- Simon TG, Roelstraete B, Khalili H et al. Mortality in biopsy-confirmed nonalcoholic fatty liver disease: results from a nationwide cohort. Gut 2020; 70(7): 1375–1382.
- Nobili V, Alisi A, Valenti L et al. NAFLD in children: new genes, new diagnostic modalities and new drugs. Nat Rev Gastroenterol Hepatol 2019; 16(9): 517–530.
- Liu J, Mu C, Li K et al. Estimating global prevalence of metabolic dysfunction-associated fatty liver disease in overweight or obese children and adolescents: systematic review and meta-analysis. Int. J. Public Health 2021; 66.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

2022 Issue 2-
All articles in this issue
- ÚVODEM
- EDITORIAL
- Jaterní testy
- Možnosti diagnostiky jaterní steatózy
- Elastografie jater
- Ztukovatění jater spojené s metabolickou dysfunkcí (MAFLD) jako přesnější název pro NAFLD – společné aspekty patogeneze
- Diagnostika nealkoholové tukové nemoci jater a její aktivní screening v rizikových skupinách
- Současné možnosti léčby nealkoholového ztukovatění jater (NAFLD)
- Statiny a játra
- Alkoholová choroba jater v terénní praxi
- Současná léčba hepatitidy C
- Klinická obezitologie – nejen Základy
- Nutriční návyky studentů lékařských fakult
- Za profesorem Peterem Krištúfkem, čestným prezidentem SLS
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

