-
Medical journals
- Career
Význam krevních biomarkerů u spontánního intracerebrálního krvácení – prospektivně zhodnocený soubor nemocných
Authors: Jolana Mračková 1; Tereza Růžičková 2; Petr Ševčík 1; Marie Karlíková 3; Jan Mraček 4; Jiří Polívka 1
Authors‘ workplace: Neurologická klinika LF UK a FN Plzeň 1; Neurologická klinika 2. LF UK a FN Motol, Praha 2; Oddělení imunochemické diagnostiky FN Plzeň 3; Neurochirurgická klinika LF UK a FN Plzeň 4
Published in: Čas. Lék. čes. 2020; 159: 185-191
Category: Original Articles
Overview
Nové možnosti v diagnostice, určení etiologie, stanovení prognózy i v managementu léčby nemocných se spontánním intracerebrálním krvácením může přinést studium krevních biomarkerů. Cílem naší studie bylo zhodnotit vztah panelu vybraných krevních biomarkerů a klinických a radiodiagnostických parametrů u nemocných se spontánním intracerebrálním krvácením, především pak nalézt prognostický marker, který by napomohl v rozhodování o optimální kategorizaci léčby.
Z našich zjištění vyplývá, že vyšší hladiny proteinu S-100B jsou asociované s větším objemem hematomu, predikují jeho progresi a nepříznivý výsledný klinický stav. Pozitivně korelují s objemem hematomu i hladiny interleukinu 6, interleukinu 10 a glykémie. Nižší hladiny matrixové metaloproteinázy 9 (MMP-9) jsou nezávislým prognostickým faktorem pro progresi hematomu u nemocných se spontánním intracerebrálním krvácením.
Klíčová slova:
krevní biomarkery – spontánní intracerebrální krvácení – stanovení prognózy – objem hematomu
ÚVOD
Spontánní intracerebrální krvácení je závažné a často devastující onemocnění s nejistou prognózou i při intenzivní léčbě a s poměrně vysokou mortalitou – 30denní mortalita dosahuje 40 %, roční až 50 %. Pouze 20 % přeživších se během 6 měsíců od příhody vrací do stavu funkční nezávislosti. Tyto údaje se v posledních dvou desetiletích nemění, klinické výstupy nemocných s intracerebrální hemoragií (ICH) tak zůstávají horší ve srovnání s nemocnými s ischemickou cévní mozkovou příhodou (1). Nové možnosti v diagnostice, určení etiologie, stratifikaci rizika, stanovení prognózy, v managementu léčby (především racionální kategorizaci péče) a v monitorování její účinnosti může přinést studium krevních biomarkerů (BBM – blood biomarkers) (2).
Různé typy biomarkerů již zkoumaly celé generace lékařů, vědců i epidemiologů. Jejich přínos pro diagnózu a management infekcí, některých kardiovaskulárních onemocnění, imunologických a onkologických onemocnění je již znám a dostatečně prokázán. Zájem o biomarkery neuronového poškození stoupá od druhé poloviny 20. století až do současnosti.
První práce se zabývaly biomarkery u traumat a mozkových ischemií. Možnosti studia biomarkerů samozřejmě vzrůstají s rozvojem molekulární biologie a laboratorních technologií.
Ve snaze zlepšit management péče o nemocné s intracerebrálním krvácením bylo dosud zkoumáno mnoho biomarkerů z různých skupin – mezi nimi markery zánětu (interleukiny, C-reaktivní protein [CRP]), neuroendokrinní markery (kopeptin), růstové faktory (vaskulární endotelové růstový faktor [VEGF]), markery zavzaté do koagulačních procesů (D-dimery) a řada dalších (např. 3, 4). Záměrem je nalézt krevní biomarkery, jež by napomohly správné diagnostice, určení etiologie krvácení, prognostické biomarkery i takzvané náhradní či zástupné biomarkery (v anglosaské literatuře označované jako surrogates), které mají doplnit klinické parametry v určení reálného výsledného klinického stavu (5).
Diagnostické biomarkery by měly být schopné odlišit ICH nejen od ischemického iktu, ale i od epileptického záchvatu, synkopy nebo migrény (stroke mimics). Toto rozlišení by bylo nápomocné především v přednemocniční fázi, kde by následně sloužilo ke správnému směřování nemocného na příslušné pracoviště a v případě ICH k adekvátnímu managementu krevního tlaku. Mezi nejčastěji zkoumané biomarkery z této skupiny patří gliový fibrilární acidický protein (GFAP) a protein S-100B, dále např. apolipoprotein C-III.
Etiologické biomarkery mají, jak název napovídá, sloužit k určení etiologie ICH, tedy zda se jedná o krvácení hypertonické, amyloidové (cerebrální amyloidová angiopatie), krvácení při koagulopatii (především u pacientů léčených antikoagulancii), nebo z jiných příčin (2). Jednoznačně nejčastěji je zde obracena pozornost k beta-amyloidu.
Prognostické biomarkery mají potenciál předvídat komplikace (včetně progrese hematomu nebo perifokálního edému), mortalitu či špatný výsledný klinický stav, a tím i napomoci rozhodování o optimální kategorizaci péče o nemocné s ICH, tedy předpokladu, kteří nemocní by těžili z intenzivní léčby, potažmo i operační. Patří sem rovněž markery korelující s objemem hematomu. Mezi nejčastěji zkoumanými jsou matrixové metaloproteinázy (především MMP-9) a protein S-100B, dále mozkový natriuretický peptid (BNP), vaskulární adhezivní protein 1 (VAP-1), hladina glukózy, markery zánětu (zejména interleukiny), 25-hydroxyvitamin D, počet leukocytů nebo hladina CRP (6–13).
Asi nejméně dat je zatím publikováno o náhradních markerech (surrogates), jež by měly v predikci výsledného funkčního stavu nemocného za úkol nahradit klinické vyšetření.
Cílem naší studie bylo zhodnotit vztah vybraných krevních biomarkerů a zkoumaných klinických parametrů u nemocných se spontánním intracerebrálním krvácením, především potom pokusit se nalézt prognostický marker, který by mimo jiné napomohl v rozhodování o optimální kategorizaci léčby.
METODIKA STUDIE
Byla provedena prospektivní observační studie u nemocných se spontánním intracerebrálním krvácením léčených v Komplexním cerebrovaskulárním centru Fakultní nemocnice Plzeň v období od ledna 2016 do července 2017. Vstupními kritérii pro zařazení do studie byly spontánní intracerebrální krvácení, přijetí nemocného do zdravotnického zařízení do 6 hodin od vzniku příznaků, věk 18–90 let. Mezi vylučující kritéria patřily iktus (ischemický či hemoragický) v posledních 3 měsících, kraniocerebrální trauma v posledních 3 měsících, infekce CNS v posledních 3 měsících, podstoupení velkého chirurgického výkonu v posledních 3 měsících, známá hemoragická diatéza, aktivní onkologické onemocnění a systémové autoimunitní onemocnění.
Hodnocen byl panel biomarkerů (tab. 1) sestavený na základě dosud publikovaných poznatků (GFAP, S-100B, MMP-9, interleukin 6 [IL-6], IL-10, 25-hydroxyvitamin D, 1,25-dihydroxyvitamin D, celkový cholesterol, počet leukocytů, glykémie, hodnota CRP). Odběr vzorků proběhl do 2 hodin od přijetí do nemocnice.
Table 1. Přehled hodnocených krevních biomarkerů a metod stanovení 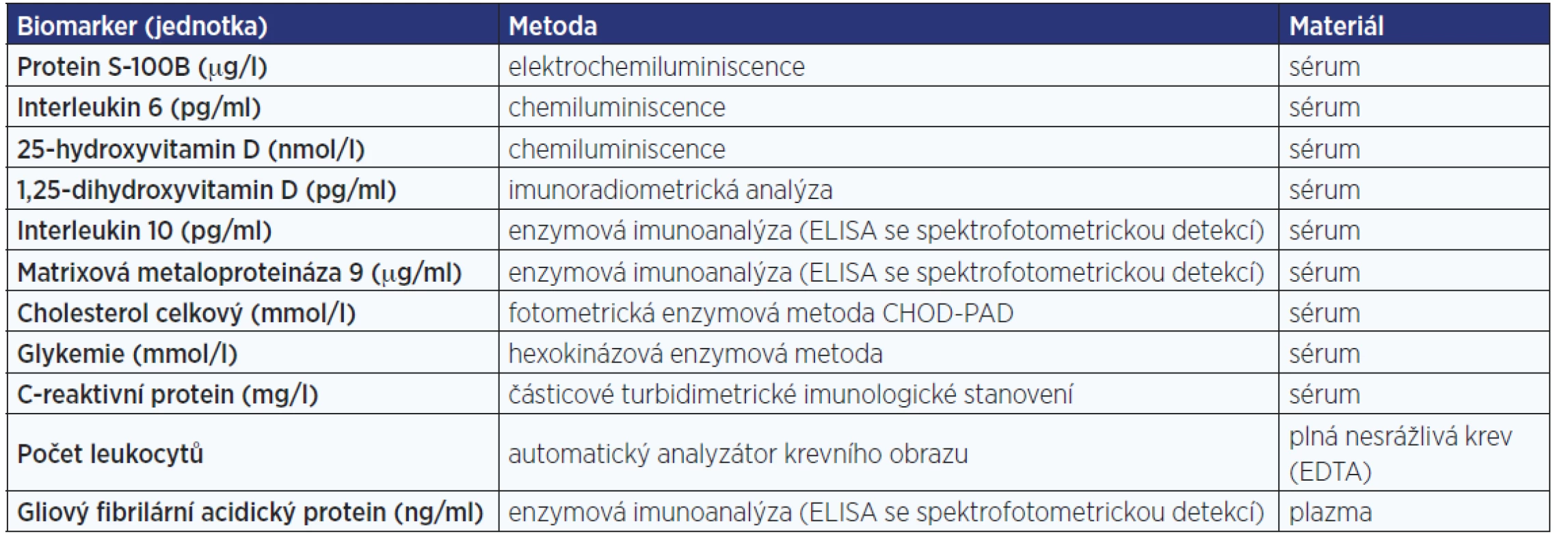
Byly sledovány následující klinické a radiodiagnostické parametry:
-
tíže vstupního deficitu hodnocená podle National Institute of Health Stroke Scale (NIHSS);
-
progrese tíže neurologického deficitu po 24 hodinách od přijetí (NIHSS);
-
objem hematomu stanovený pomocí výpočetní tomografie (vstupní vyšetření zahrnovalo krom nekontrastního i CT angiografii k případnému ozřejmění zdroje krvácení), pro výpočet objemu hematomu (v ml) byl použit standardní vzorec V = a × b × c/2, kde hodnoty a–c jsou největší rozměry hematomu měřené v centimetrech ve 3 na sebe kolmých rovinách (14);
-
progrese hematomu za 24 hodin od přijetí (nekontrastní CT vyšetření);
-
výsledný klinický stav při propuštění a po 3 měsících hodnocený podle modifikované Rankinovy škály (mRS) – follow-up byl zajištěn ambulantní kontrolou v cévní poradně nebo v případě těžkého deficitu telefonickou informací od příbuzných či ošetřovatelů nemocného.
Imunoanalytické metody
Vzorky periferní žilní krve byly nabírány odběrovým systémem VACUETTE (Greiner Bio-One, Rakousko) do 2 zkumavek, z nichž jedna obsahovala aktivátor hemokoagulace pro srážlivou krev (sérum) a druhá antikoagulační činidlo EDTA pro nesrážlivou krev (plazma). Sérum bylo po vysrážení odděleno 10minutovou centrifugací při 1,700 × g, krevní plazma byla separována 10minutovou centrifugací při 1,300 × g. Alikvoty séra a plazmy byly zamraženy na –80 °C až do analýzy. Měření hladin všech markerů stanovených s využitím imunoanalytických metod proběhlo v souladu s protokolem výrobce reakčního kitu.
Biochemické (bioanalytické) metody
Vzorky periferní žilní krve byly nabírány odběrovým systémem VACUETTE (Greiner Bio-One, Rakousko). Celkový cholesterol byl zjištěn fotometrickou enzymovou metodou CHOD-PAD. Glykemii jsme stanovili hexokinázovou enzymovou metodou. K měření hladin CRP jsme použili částicové turbidimetrické imunologické stanovení, pro určení počtu leukocytů automatický analyzátor krevního obrazu.
Statistické metody
Data byla statisticky zpracována. Deskriptivní statistiku jsme použili pro charakteristiku všech pacientů a následujících podskupin: pacienti s dobrým a nepříznivým klinickým stavem 3 měsíce od prodělaného ICH (definováno jako mRS 0–2 a 3–6), pacienti s progresí a bez progrese hematomu na kontrolním CT po 24 hodinách od přijetí, mortalita po 3 měsících od dimise.
K zhodnocení vztahu mezi hodnotami laboratorních parametrů a objemem hematomu, stejně jako skóre NIHSS, jsme vzhledem k rozložení dat zvolili Spearmanovu korelaci. Logistická regrese byla uplatněna pro adjustaci statistické významnosti asociace mezi demografickými charakteristikami, hodnotou skóre NIHSS, objemem hematomu, laboratorními parametry a výsledným klinickým stavem včetně mortality, stejně jako progresí velikosti hematomu na kontrolním CT.
Proměnné, jež dosáhly hladiny významnosti p < 0,1 v jednorozměrné analýze, jsme následně použili pro testování ve vícerozměrném logistickém modelu. Hladina statistické významnosti v konečném modelu byla určena jako p < 0,05.
Statistické analýzy byly provedeny v programu IBM SPSS Statistics 25.0 (IMB, USA).
VÝSLEDKY
Studijní soubor tvořilo celkem 70 pacientů (23 žen, 47 mužů, průměrný věk 68,8 roku), základní charakteristiku souboru a jednotlivých podskupin pacientů shrnuje tab. 2.
Table 2. Základní charakteristika souboru 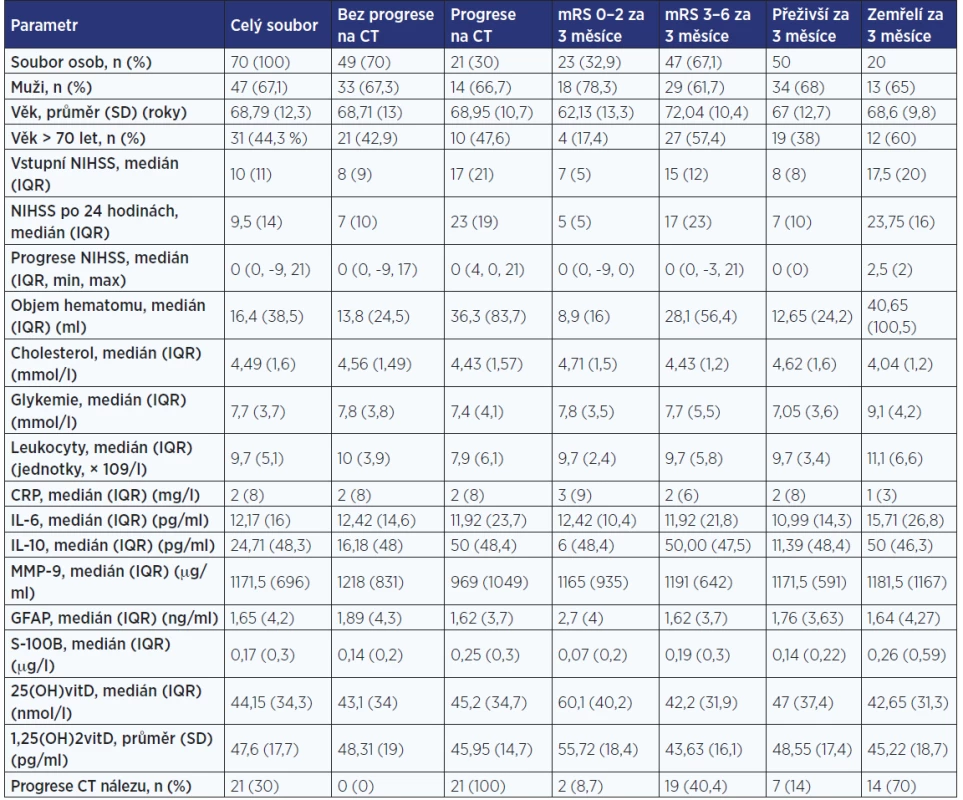
Pozn.: NIHSS – National Institute of Health Stroke Scale; CRP – C-reaktivní protein; IL-6 – interleukin 6; IL-10 – interleukin 10; MMP-9 – matrixová metaloproteináza 9; GFAP – gliový fibrilární acidický protein; S-100B – protein S-100B; 25(OH)vitD – 25-hydroxyvitamin D; 1,25(OH)2vitD – 1,25-dihydroxyvitamin D; mRS – modifikovaná Rankinova škála; CT –výpočetní tomografie; IQR – mezikvartilové rozpětí; SD – směrodatná odchylka. Ve vztahu k objemu hematomu byla nalezena statisticky významná pozitivní korelace hodnot S-100B, IL-10, IL-6 a glykemie (S-100B: Spearmanův korelační koeficient ρ = 0,54, p < 0,001; IL-10: ρ = 0,43, p < 0,001; IL-6: ρ = 0,26, p = 0,027; glykemie: ρ = 0,24, p = 0,045).
Tab. 3 ukazuje vliv jednotlivých studovaných ukazatelů na progresi hematomu hodnocený jednorozměrnou logistickou regresní analýzou. Vícerozměrná analýza poté ukázala, že statisticky významně jsou s progresí hematomu asociované následující ukazatele: vstupní skóre NIHSS (OR 1,13, 95% interval spolehlivosti [CI] 1,04–1,23; p = 0,006), MMP-9 (OR 0,10; 95% CI 0,02–0,54; p = 0,007) a koncentraci S-100B > 0,15 μg/l (OR 6,77; 95% CI 1,55–29,61; p = 0,011). Vyšší hodnoty NIHSS a S-100B a nižší hodnoty MMP-9 přitom predikují progresi hematomu.
Table 3. Jednorozměrná logistická regresní analýza vlivu sledovaných ukazatelů na progresi hematomu 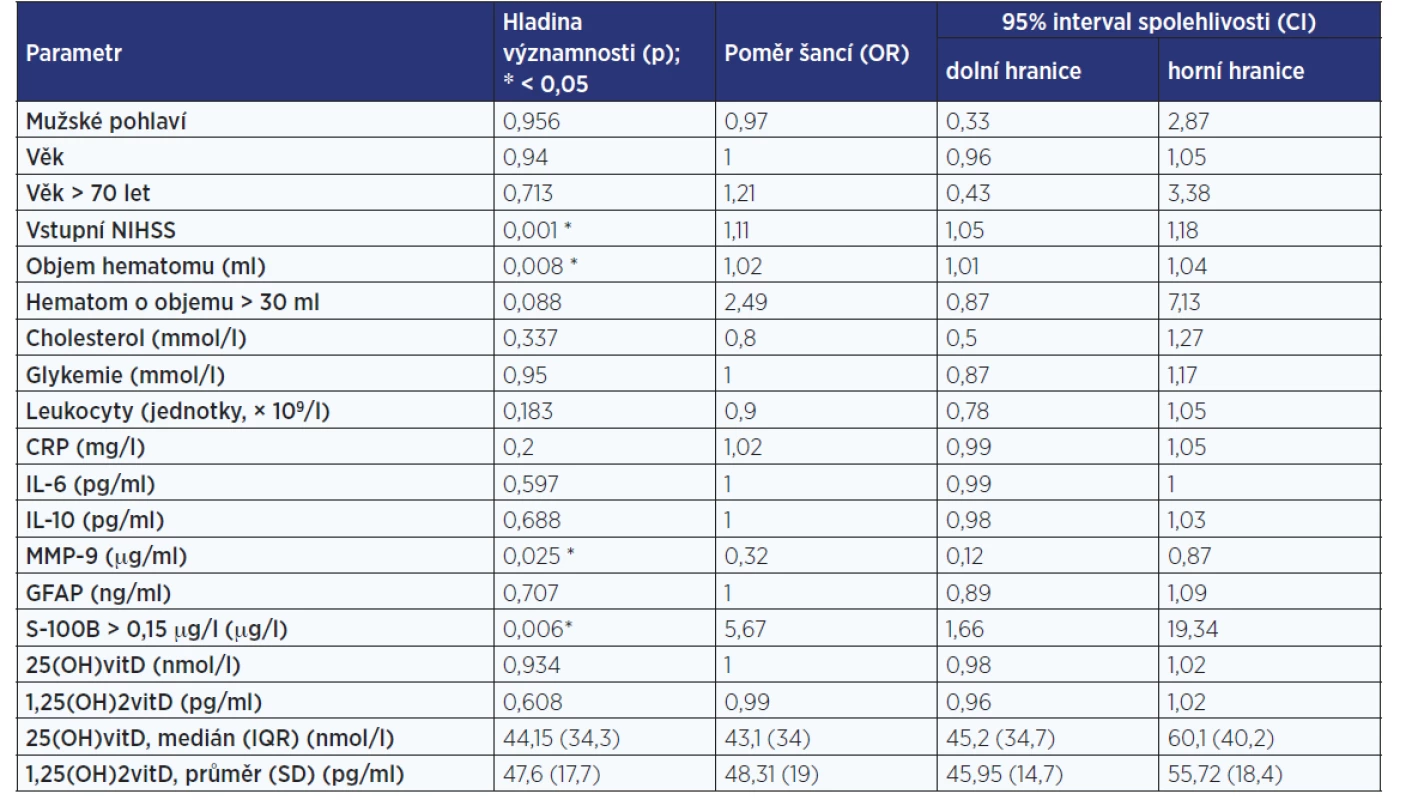
Pozn.: NIHSS – National Institute of Health Stroke Scale; CRP – C-reaktivní protein; IL-6 – interleukin 6; IL-10 – interleukin 10; MMP-9 – matrixová metaloproteináza 9; GFAP – gliový fibrilární acidický protein; S-100B – protein S-100B; 25(OH)vitD – 25-hydroxyvitamin D; 1,25(OH)2vitD – 1,25-dihydroxyvitamin D. Rozložení nemocných podle hodnot mRS po uplynutí 3 měsíců od dimise ukazuje obr. 1.
Image 1. Rozložení mRS 3 měsíce po intracerebrálním krvácení Pozn.: mRS – modifikovaná Rankinova škála. 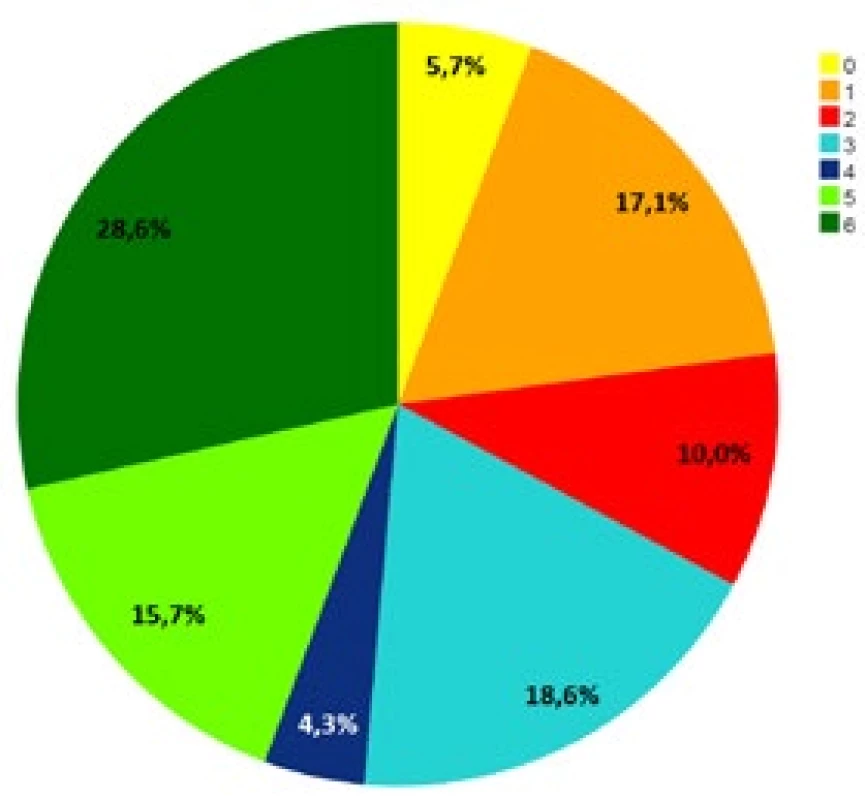
Tab. 4 shrnuje vliv jednotlivých sledovaných ukazatelů na dobrý výsledný klinický stav po 3 měsících (mRS 0–2) hodnocený jednorozměrnou logistickou regresní analýzou. Při vícerozměrné analýze byly významně asociované s příznivým výsledným klinickým stavem pacientů následující faktory: věk (OR 0,92; 95% CI 0,87–0,98; p = 0,006), S-100B > 0,15 μg/l (OR 0,26, 95% CI 0,07–0,90; p = 0,034), progrese na CT po 24 hodinách (OR 0,16; 95% CI 0,03–0,97; p = 0,046). Starší nemocní, nemocní s vyššími hodnotami S-100B a s progresí hematomu zjištěnou CT měli menší šanci dosáhnout příznivého výsledného klinického stavu.
Tab. 5 demonstruje vliv jednotlivých sledovaných ukazatelů na 3měsíční mortalitu hodnocený jednorozměrnou logistickou regresní analýzou. Následně při vícerozměrné analýze nebyl žádný ze zkoumaných laboratorních parametrů významně asociován s 3měsíční mortalitou.
Table 4. Jednorozměrná logistická regresní analýza vlivu sledovaných ukazatelů na příznivý výsledný klinický stav 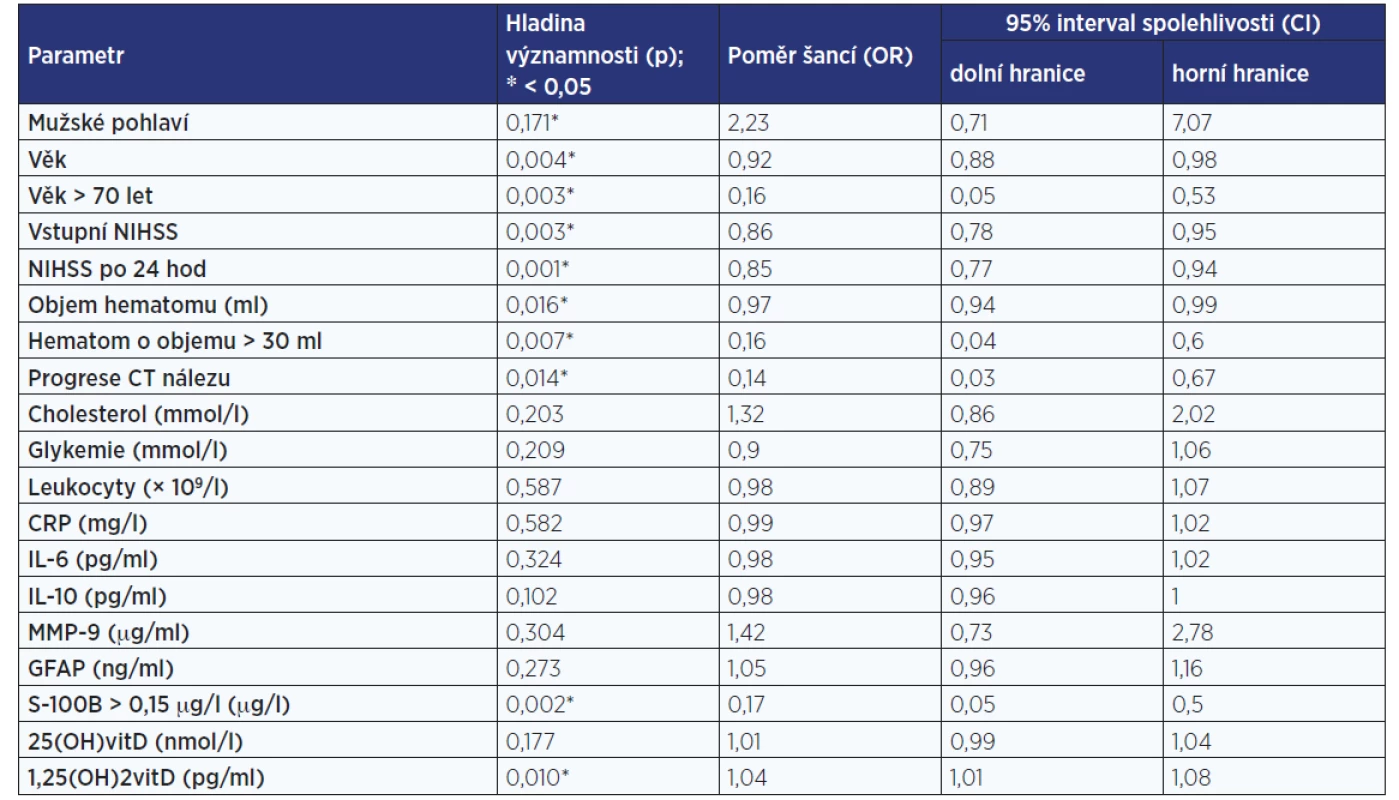
Pozn.: NIHSS – National Institute of Health Stroke Scale; CRP – C-reaktivní protein; IL-6 – interleukin 6; IL-10 – interleukin 10; MMP-9 – matrixová metaloproteináza 9; GFAP – gliový fibrilární acidický protein; S-100B – protein S-100B; 25(OH)vitD – 25-hydroxyvitamin D; 1,25(OH)2vitD – 1,25-dihydroxyvitamin D. Table 5. Tab. 5 Jednorozměrná logistická regresní analýza vlivu sledovaných ukazatelů na tříměsíční mortalitu 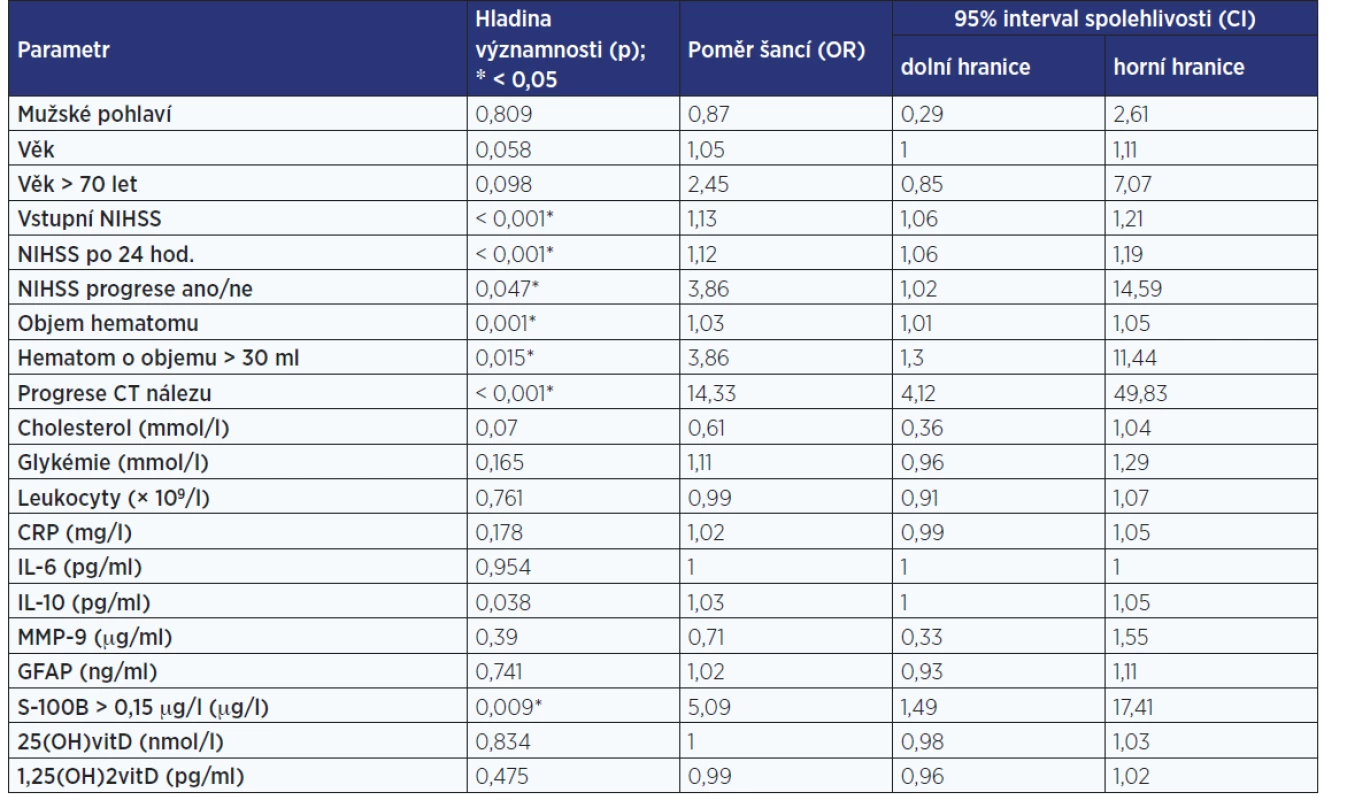
Pozn.: NIHSS – National Institute of Health Stroke Scale; CRP – C-reaktivní protein; IL-6 – interleukin 6; IL-10 – interleukin 10; MMP-9 – matrixová metaloproteináza 9; GFAP – gliový fibrilární acidický protein; S-100B – protein S-100B; 25(OH)vitD – 25-hydroxyvitamin D; 1,25(OH)2vitD – 1,25-dihydroxyvitamin D. DISKUSE
Intracerebrální krvácení je onemocnění, u něhož máme dosud k dispozici pouze omezené možnosti jak zlepšit klinický výstup nemocných, čímž se podstatně odlišuje od mozkových ischemií, u nichž se s rozvojem rekanalizační terapie zásadně zvyšují šance na dosažení dobrého výsledného klinického stavu. Krevní biomarkery mají sloužit k doplnění stávajících diagnostických a léčebných metod, nikoliv k jejich nahrazení. Ideální biomarker použitelný pro klinickou praxi by měl vynikat vysokou senzitivitou i specificitou a jeho stanovení by mělo být pokud možno rychlé, snadné a finančně nenáročné.
V naší studii jsme prokázali pozitivní korelaci S-100B s progresí a objemem hematomu. Při posuzování vztahu mezi hodnotou S-100B a výsledným klinickým stavem jsme zjistili, že nemocní s vyššími koncentracemi S-100B mají menší šanci dosáhnout dobrého výsledného klinického stavu. Tyto výsledky jsou v souladu například s prací Delgadové et al. hodnotící plazmatické hladiny S-100B u 78 nemocných s intracerebrálním krvácením (15). Dále jsme prokázali pozitivní korelaci IL-10, IL-6 a glykémie s objemem hematomu – i tyto naše poznatky jsou v souladu s daty, jež publikovali jiní autoři (2, 7, 9).
Překvapivý výsledek přinesla naše studie v oblasti průkazu korelace MMP-9 s progresí hematomu. S růstem hematomu korelovaly nižší hodnoty MMP-9, což je v rozporu s dosud publikovanými studiemi, kde progresi hematomu predikují vyšší hodnoty MMP-9, jak uvádějí například Silva et al. (7). Jedním z možných vysvětlení je skutečnost, že hladiny MMP-9 v prvních dnech po krvácení kolísají, podle některých autorů by měly dosahovat maxima až sedmý den (16). Podle jiných autorů navíc mohou hladiny matrixových metaloproteináz záviset na určitých faktorech, jako jsou například věk, počet leukocytů či hladina albuminu (17). V neposlední řadě je prokázáno, že hladiny MMP dosahují odlišných hodnot v séru oproti plazmě – obvykle jsou nižší v plazmě (18).
Naše data nepotvrdila vliv počtu leukocytů, hladiny vitaminu D, CRP a ostatních zkoumaných biomarkerů na výsledný klinický stav včetně mortality ani na ostatní hodnocené parametry.
Výhodou krevních biomarkerů je možnost objektivního měření a reliabilita, nevýhodou riziko laboratorní chyby, často vysoké finanční náklady a také to, že pro interpretaci výsledku je kritické přesné načasování odběru vzorku. Právě časová kritéria patří mezi limitace naší studie, neboť z dosud publikovaných prací není zcela jasné, v jakém časovém horizontu by měl optimálně probíhat odběr vzorků. Navíc pro větší výtěžnost je zajisté lepší odběr po určité (opět ne zcela jasně dané) době zopakovat, což s sebou ovšem nese vyšší finanční nároky. Hladiny některých biomarkerů se mohou také signifikantně lišit v závislosti na tom, zda jsou stanovovány v séru, či v plazmě. V neposlední řadě je bezesporu hodnotnější hodnocení většího souboru nemocných, což v tomto případě předpokládá koncipování spíše multicentrické studie, ačkoli v dostupné literatuře se lze setkat i s pracemi zahrnujícími menší soubory účastníků, než byl náš.
Výsledky naší studie ukazují možný budoucí potenciál několika krevních biomarkerů, především S-100B, IL-6, IL-10 a glykémie, které by mohly částečně doplňovat, nikoli však nahrazovat klinické a radiodiagnostické parametry v procesu péče o nemocné s intracerebrálním krvácením. Předpokladem je ovšem jejich další zkoumání při opakovaných odběrech a na větším počtu nemocných.
ZÁVĚR
Predikovat výsledný klinický stav a mortalitu nemocných s intracerebrálním krvácením v časném stadiu, lze-li vycházet pouze z klinických dat, je obtížné. Minulý i současný výzkum krevních biomarkerů přináší, navzdory prvotní vlně optimismu, rozporuplné výsledky, nekonkluzivní, a dokonce konfliktní studie. Laboratorní biomarkery, které jsme zvolili, jsou podle našich výsledků v procesu stanovování prognózy převáženy klinickými parametry, jediným hraničně významným BBM je zde S-100B. Korelace MMP-9 s progresí hematomu je podle našich zjištění statisticky významná, avšak v opačném směru než v jiných studiích. Nicméně pozitivní korelace S-100B s progresí a objemem hematomu, stejně jako IL-10, IL-6 a glykémie s objemem hematomu, které jsme pozorovali, jsou v souladu s dosud publikovanými daty.
V současnosti není v klinické praxi stále běžně dostupný krevní biomarker pro využití v diagnostice, managementu nebo stanovení prognózy pacientů s intracerebrálním krvácením. Mnoho biomarkerů, které se účastní různých patofyziologických mechanismů, je intenzivně zkoumáno, přesto však role některých z nich dosud není zcela objasněna a k optimalizaci výsledků je třeba dalších, a to rozsáhlejších, kvalitně designovaných, ideálně multicentrických studií.
Poděkování
Podpořeno projektem institucionálního výzkumu MZČR–FNPI 00669806 a SVV Lékařské fakulty Univerzity Karlovy v Plzni 260 390.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Autoři práce prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000.
Seznam zkratek
- BBM krevní biomarkery
- BNP mozkový natriuretický peptid
- CNS centrální nervový systém
- CRP C-reaktivní protein
- CT výpočetní tomografie
- GFAP gliový fibrilární acidický protein
- ICH intracerebrální hemoragie
- IL-6 interleukin 6
- IL-10 interleukin 10
- MMP-9 matrixová metaloproteináza 9
- mRS modifikovaná Rankinova škála
- NIHSS National Institute of Health Stroke Scale
- S-100B protein S-100B
- VAP-1 vaskulární adhezivní protein 1
- VEGF vaskulární endotelový růstový faktor
Adresa pro korespondenci:
MUDr. Jolana Mračková
Neurologická klinika LF UK a FN Plzeň
Alej Svobody 80, 304 60 Plzeň
Tel.: 377 103 473
e-mail: mrackovaj@fnplzen.cz
Sources
-
Flaherty ML, Haverbusch M, Sekar P et al. Long-term mortality after intracerebral hemorrhage. Neurology 2006; 66 : 1182–1186.
-
Senn R, Elkind MS, Montaner J et al. Potential role of blood biomarkers in the management of nontraumatic intracerebral hemorrhage. Cerebrovasc Dis 2014; 38(6): 395–409.
-
Di Napoli M, Godoy DA, Campi V et al. C-reactive protein in intracerebral hemorrhage: time course, tissue localization, and prognosis. Neurology 2012; 79 : 690–699.
-
Misra S, Kumar A, Ram S et al. Role of copeptin as a biomarker for predicting outcome after intracerebral hemorrhage: a prospective cohort study. Abstract. J Neurol Sci 2017; 381 : 622.
-
Drucker E, Krapfenbauer K. Pitfalls and limitations in translation from biomarker discovery to clinical utility in predictive and personalised medicine. EPMA J 2013; 4(1): 7.
-
Abilleira S, Montaner J, Molina CA et al. Matrix metalloproteinase-9 concentration after spontaneous intracerebral hemorrhage. J Neurosurg 2003; 99 : 65–70.
-
Silva Y, Leira R, Tejada J et al. Molecular signatures of vascular injury are associated with early growth of intracerebral hemorrhage. Stroke 2005; 36 : 86–91.
-
Glushakova OY, Glushakov AV, Miller ER et al. Biomarkers for acute diagnosis and management of stroke in neurointensive care units. Brain Circ 2016; 2 : 28–47.
-
Hu YY, Dong XQ, Yu WH et al. Change in plasma S100B level after acute spontaneous basal ganglia hemorrhage. Shock 2010; 33 : 134–140.
-
Kubiak C, Mohamed W, Bhattacharya P. Admission blood glucose predicts high hematoma volume in intracerebral hemorrhage. Neurology 2013; 80: P05.229.
-
Bakradze E, McCullough LD, Staff I, Nouh A. Vitamin D deficiency correlates with stroke severity on presentation in intracerebral hemorrhage [abstract]. Stroke 2016; 47: ATP375.
-
Agnihotri S, Czap A, Staff I et al. Peripheral leukocyte counts and outcomes after intracerebral hemorrhage. J Neuroinflammation 2011; 8 : 160.
-
Di Napoli M, Godoy DA, Campi V et al. C-reactive protein level measurement improves mortality prediction when added to the spontaneous intracerebral hemorrhage score. Stroke 2011; 42 : 1230–1236.
-
Newman CG. Clarification of abc/2 rule for ICH volume. Stroke 2007; 38 : 862.
-
Delgado P, Alvarez Sabin J, Santamarina E et al. Plasma S100B level after acute spontaneous intracerebral hemorrhage. Stroke 2006; 37 : 2837–2839.
-
Castellazzi M, Tamborino C, De Santis G et al. Timing of serum active MMP-9 and MMP-2 levels in acute and subacute phases after spontaneous intracerebral hemorrhage. Acta Neurochir Suppl. 2010; 106 : 137–140.
-
Kreisel SH, Stroick M, Griebe M et al. True effects or bias? MMP-2 and MMP-9 serum concentrations after acute stroke. Cerebrovasc Dis 2016; 42 : 352–360.
-
Jonsson A, Hjalmarsson C, Falk P et al. Levels of matrix metalloproteinases differ in plasma and serum – aspects regarding analysis of biological markers in cancer. Br J Cancer 2016; 115(6): 703–706.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Výroba a použití rekonvalescentní plazmy pro léčbu COVID-19 s přihlédnutím ke zkušenostem v ÚVN Praha
- Případ těžkého průběhu onemocnění COVID-19 u vysoce rizikového 70letého muže
- Význam krevních biomarkerů u spontánního intracerebrálního krvácení – prospektivně zhodnocený soubor nemocných
- Psychosomatické a psychosociální aspekty percepce zdravotních rizik z životního i pracovního prostředí
- Hazardní hry a jejich rizikovost z hlediska rozvoje problémového hráčství
- Nové trendy ve výuce anatomie a naše zkušenosti s výukou v českém jazyce během karantény kvůli onemocnění COVID-19
- Zdravotní péče u pražských benediktinek v 17. a 18. století
- Smrt ve Svatováclavské trestnici a pankrácké trestnici v letech 1827–1926
- Úvodem
- Zapomenutý gastroenterolog?
- Opustila nás prof. Eva Seemanová
- Zemřel nestor české ortopedie prof. Oldřich Čech
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výroba a použití rekonvalescentní plazmy pro léčbu COVID-19 s přihlédnutím ke zkušenostem v ÚVN Praha
- Případ těžkého průběhu onemocnění COVID-19 u vysoce rizikového 70letého muže
- Hazardní hry a jejich rizikovost z hlediska rozvoje problémového hráčství
- Zapomenutý gastroenterolog?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

