-
Medical journals
- Career
Osteoporóza u mužů
Authors: Jan Štěpán
Authors‘ workplace: Revmatologický ústav, Praha
Published in: Čas. Lék. čes. 2016; 155: 340-348
Category: Review Articles
Overview
S prodlužující se délkou života se osteoporóza stává zdravotním, sociálním a ekonomickým problémem také u mužů. Zlomeniny obratlů a v oblasti kyčle jsou spojeny s morbiditou a mortalitou u mužů. Pro klinickou diagnostiku a rozhodování o léčbě jsou nezbytná klinická vyšetření, osteodenzitometrie, laboratorní testy a hodnocení individuální pravděpodobnosti zlomenin. U mužů byla klinickými studiemi prokázána účinnost farmakoterapie osteoporózy. V prevenci zlomenin mužů lze užít farmakoterapii osteoporózy, ale mimořádně významná jsou opatření vedoucí ke zlepšení svalové síly a koordinace a opatření ke snížení rizika pádů.
Klíčová slova:
epidemiologie, osteodenzitometrie, osteoporóza, prevence, riziko zlomenin, terapieÚvod
S prodlužující se délkou života se osteoporóza stává zdravotním, sociálním a ekonomickým problémem také u mužů. Osteoporóza je definována jako onemocnění skeletu, které je charakterizováno sníženou pevností a zvýšeným rizikem zlomenin, přičemž pevnost kostí je výrazem zejména denzity a kvality kostní hmoty (1). Za osteoporotické (nízkotraumatické) se označují zlomeniny, k nimž dochází po nepřiměřeně malém úrazovém ději, např. po pádu ze stoje. Jeden z pěti padesátiletých mužů prodělá během dalšího života nízkotraumatickou zlomeninu. U mužů je vyšší pravděpodobnost zlomeniny než karcinomu prostaty (2). Muže postihuje každá třetí zlomenina proximálního femuru (viz tab. 1) (3).
Table 1. Pravděpodobnost prodělání zlomeniny po 50. roce <em>(podle: 3)</em> 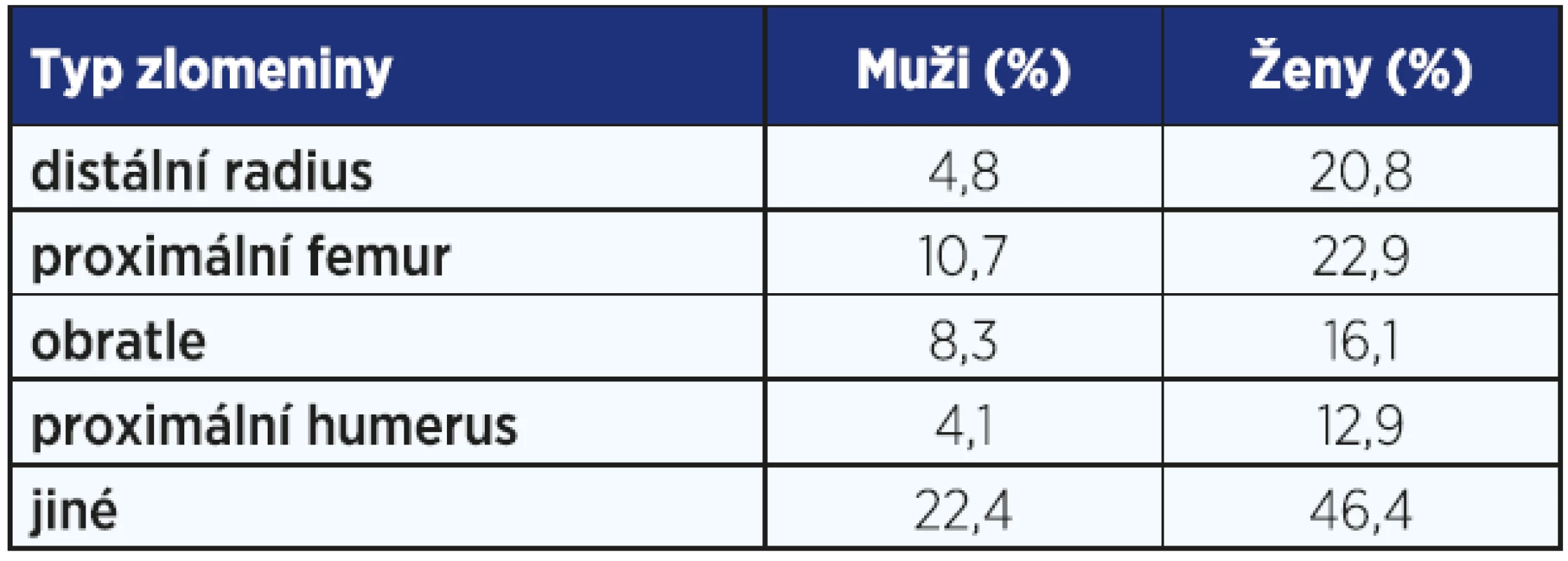
Prevalence osteoporózy u českých mužů není dobře známa. Odhaduje se, že ve věku ≥ 50 let má denzitu kostního minerálu (BMD) v osteodenzitometrické kategorii osteoporózy (T-skóre ≥ −2,5) kolem 6,6 % českých mužů (103 tisíc z 1,71 milionu), a některou ze zlomenin utrpí za rok 1,6 % mužů (28 tisíc z 1,71 milionu, z toho ve věku ≥ 75 let kolem 10 tisíc mužů) (4). Podle českých statistických údajů utrpělo v roce 2009 zlomeninu proximálního femuru 9471 žen a 3833 mužů ≥ 50 let a 7444 žen a 3579 mužů ≥ 75 let (5). Incidence všech typů zlomenin narůstá s věkem (viz obr. 1).
Image 1. Incidence zlomenin u českých mužů a žen v závislosti na věku a pohlaví <em>(podle: 4, 5)</em> 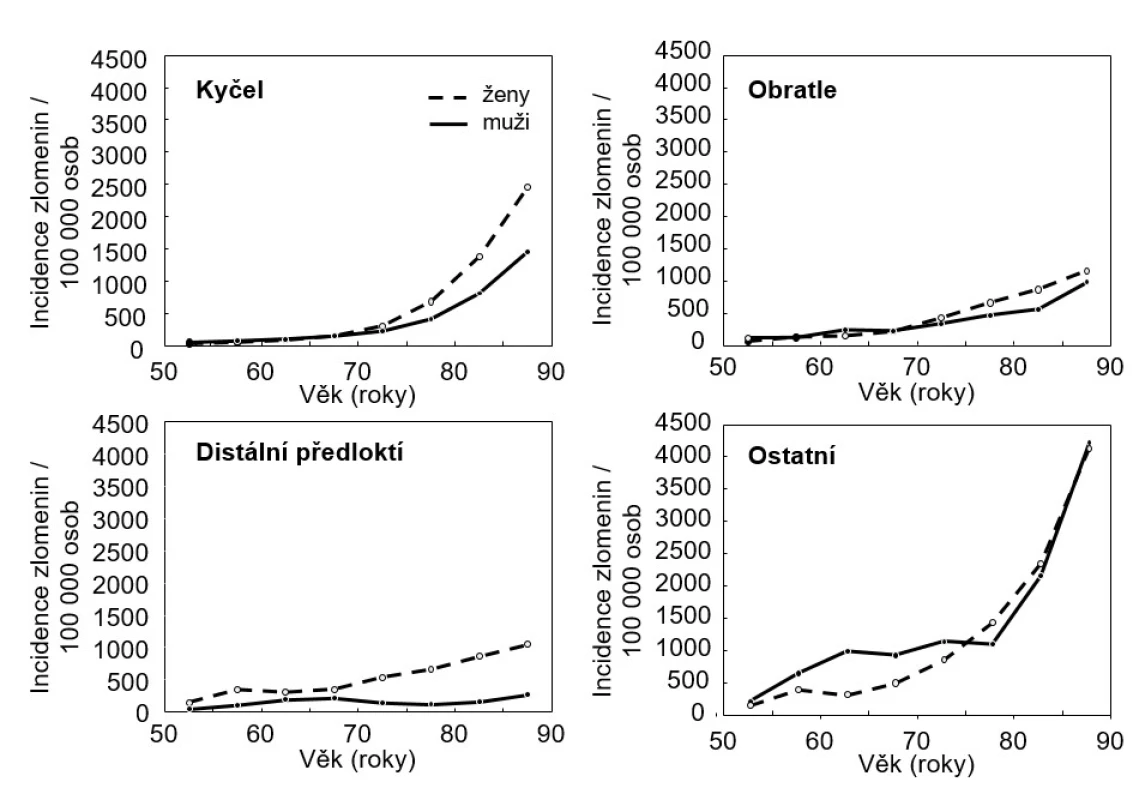
Po zlomenině v oblasti kyčle má pouze 20 % mužů uchovánu původní nezávislost na dopomoci. Polovina všech mužů po zlomenině v oblasti kyčle odchází do domovů dlouhodobé péče. Osteoporotické zlomeniny proximálního femuru i obratlů jsou asociovány se zvýšeným rizikem úmrtí v dalších 5−10 letech (6). Ve všech věkových kategoriích je mortalita u mužů vyšší než u žen (7). V prvním roce po zlomenině kyčle umírá 37 % mužů a 20 % žen (8, 9).
Syndrom osteoporózy je klinickou manifestací řady onemocnění a stárnutí. Riziko osteoporózy a zlomenin ve vyšším věku závisí mj. na dosažení možného maxima vrcholové kostní hmoty (peak bone mass). Muži dosahují peak bone mass kolem 18. roku věku (10). Samotná volumetrická BMD (g/cm3) je u obou pohlaví obdobná a s věkem se podstatně nemění, ale při měření duální rentgenovou absorpciometrií (DXA) je hodnota plošné BMD (g/cm2) u mladých mužů o 8−10 % vyšší než u žen. Vytváření vrcholové kostní hmoty je úzce vázáno na genetické faktory, výživu, fyzickou aktivitu a hormonální změny během puberty. Kostní trámce se během puberty zesilují více u chlapců než u dívek (11). U mladých mužů je průřez kostí o 40 % větší než u žen, tloušťka kortexu je obdobná (12). To vše je spojeno s významným rozdílem v mechanické odolnosti kosti, který zčásti vysvětluje nižší riziko zlomenin u mužů ve vyšším věku (13). I když je pohlavní dimorfismus skeletu komplexní, jsou to zejména androgeny a větší svalová hmota a aktivita, které stimulují periostální novotvorbu a rozšiřování průměru kosti.
Klasifikace a rizikové faktory osteoporózy a zlomenin u mužů
Jakkoli jsou příčiny úbytku a zhoršování kvality kostní hmoty u mužů individuálně značně rozdílné, lze je rozdělit na primární (idiopatická a involuční osteoporóza) a sekundární (viz tab. 2). U pacientů s idiopatickou osteoporózou chybí průkaz sekundárních příčin úbytku kostní hmoty, není zde konstituční hubenost ani pozdní nástup puberty. Charakteristické jsou symptomatické fraktury obratlů ve věku 30−70 let a stresové fraktury kostí končetin. Osteoporóza v rodinné anamnéze svědčí pro významnou úlohu genetických faktorů, ať už je to polymorfismus genu pro kolagen typu I, aromatázu, IGF-1, LRP5, receptor pro vitamin D nebo estradiol (14−16). Histomorfometricky se prokazuje snížení kostní novotvorby, jehož příčinou je dysfunkce osteoblastů (17, 18).
Table 2. Etiologie sekundární osteoporózy u mužů <em>(podle: 22, 36, 95–97)</em> 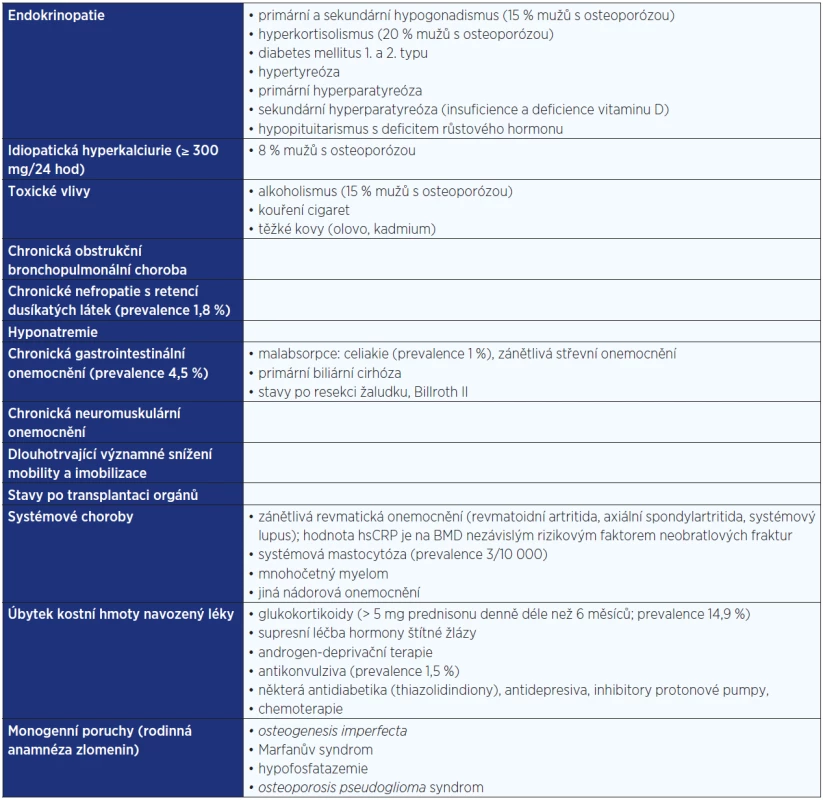
Involuční osteoporóza je nejvýznamnější příčinou osteoporózy a nízkotraumatických zlomenin u mužů. Stárnutí je i u mužů spojeno s významnými změnami množství, kvality a architektury kosti. Protože se u zdravých mužů kolem 50. roku života neuplatňuje dočasně zrychlený úbytek zejména trabekulární kostní hmoty, ke kterému dochází u žen po menopauze, není ani u starších mužů porušena mikroarchitektura kosti a konektivita kostních trámců tak výrazně jako u žen (19). Přesto se i u mužů již ve středním věku ztenčují kostní trámce, ale počet trámců významně neklesá (20, 21). Úbytek kortikální kostní hmoty se u obou pohlaví prokazuje již kolem 65. roku. U obou pohlaví je po 65. roce věku srovnatelná jak rychlost úbytku kostní hmoty s věkem, tak i rychlost nárůstu incidence zlomenin obratlů a proximálního femuru (viz obr. 1). Ke zlomeninám dochází nejčastěji po 70. roce věku, typicky v oblasti proximálního femuru (22). Pokud u starších mužů není průkazná sekundární příčina úbytku kostní hmoty, jsou významným kritériem involuční osteoporózy hraničně nižší markery kostní novotvorby a nezvýšené biochemické markery osteoresorpce. Nízká remodelace kosti je spojena s hromaděním mikropoškození, která navozují apoptózu osteocytů a mohou snižovat mechanickou sílu kosti (23). Důsledkem nízké remodelace je také glykace kostního kolagenu, hromadění pentosidinu a zhoršování elasticity kosti. Protože však i u starších mužů pokračuje periostální apozice kostní hmoty, uchovává se nárůstem průměru kosti mechanická síla kosti u mužů lépe než u žen (24).
S věkem u mužů klesají sérové koncentrace sexagenů, zvyšují se sérové koncentrace SHBG, klesá produkce růstového hormonu, IGF-1, funkce osteoblastů a kostní novotvorba (25, 26). Pokles sérové koncentrace sexagenů u mužů v závislosti na věku (27) zčásti vysvětluje nárůst endokortikální osteoresorpce a porotizace kortikální kosti s věkem. Díky metabolickým konverzím testosteronu zůstává i u starých mužů sérová koncentrace biologicky dostupného estradiolu významně vyšší než u žen po menopauze (28). Estradiol tlumí remodelaci endokortikální kosti a porotizaci kortexu. Incidence zlomenin se u mužů zvyšuje až při sérových koncentracích celkového estradiolu < 60 pmol/l (29).
Mimořádně důležitým faktorem nárůstu rizika zlomenin je u mužů současný úbytek kostní hmoty a svalové hmoty a síly s věkem (30, 31). Mezi svalovou a kostní hmotou je u mužů i u žen velmi úzká asociace (32). Na interakci metabolismu kosti a svalu se uplatňují genetické faktory, vlivy prostředí v časném vývoji, fyzická aktivita (mechanostat) a endokrinní vlivy, ale také faktory tvořené kostí a ovlivňující metabolismus svalu a naopak faktory tvořené svalem a ovlivňující metabolismus kostní hmoty (33). Pomocí vysokorozlišující periferní QCT byla prokázána významná pozitivní korelace mezi svalovou hmotou těla a objemem a tloušťkou kostních trámců a mezi svalovou hmotou těla a tloušťkou kortikální kostní hmoty (34). Pokles svalové síly kvadricepsu je u mužů nezávislým prediktorem rizika zlomenin (35).
Při sekundární osteoporóze se uplatňují validované rizikové faktory, které jsou asociovány s pravděpodobností prodělat zlomeninu. U starších mužů i žen je to zejména zvýšená resorpce kosti navozená sekundární hyperparatyreózou při insuficienci nebo deficienci vitaminu D. Některý z rizikových faktorů, jež se podílejí na onemocnění skeletu, je prokázán až u poloviny všech mužů s osteoporózou a nízkotraumatickými zlomeninami (viz tab. 2). Nejvýznamnějšími jsou abúzus alkoholu, hyperkortisolismus a hypogonadismus (36).
Diagnostika a diferenciální diagnostika úbytku kostní hmoty a zlomenin
V klinické praxi nelze výpověď osteodenzitometrického vyšetření (osteodenzitometrickou kategorii BMD) zaměnit za klinickou diagnózu osteoporózy ani ji užít k určení intervenčního prahu, nebo dokonce způsobu terapie (37). Hodnota BMD −2,5 T-skóre je ve vztahu k riziku zlomenin dostatečně specifická, ale není dostatečně senzitivní. Tento poznatek reflektuje výše uvedená definice osteoporózy (1). Protože v České republice je pro úhradu léčby zvažována především osteodenzitometrická diagnóza onemocnění, je klinická diagnóza osteoporózy stanovena pozdě, a dokonce i po zlomenině je léčeno mnohem méně mužů než žen (viz obr. 2).
Image 2. Zajištění léčby osteoporózy v České republice <em>(podle: 4)</em> 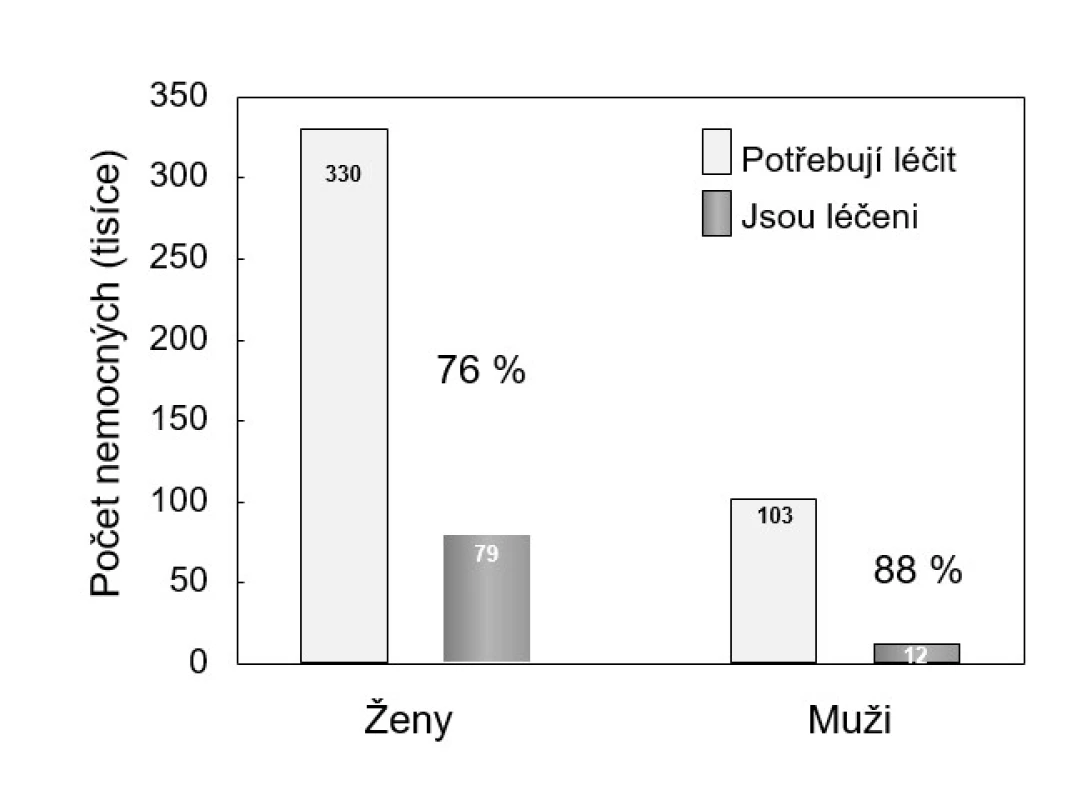
Klinická diagnóza osteoporózy má vycházet z anamnézy a klinického vyšetření doplněného hodnocením výsledku DXA, radiologického vyšetření (zejména morfometrie obratlů) a laboratorního vyšetření (38). Úbytek kostní hmoty, zlomeniny při nepřiměřeně nízkém traumatu a bolest kostí při nepřiměřeném zatížení se totiž v různém stupni zjišťují i při jiných klinicky významných situacích (osteomalacie, Pagetova kostní choroba, fibrózní dysplazie, osteomyelitida obratlů). Léčebné postupy při těchto onemocněních jsou zásadně odlišné od postupů při osteoporóze, a diferenciální diagnostika stavů s uvedenými klinickými projevy je proto velmi významná.
Osteodenzitometrická kategorie stupně poklesu BMD (g/cm2) se stanoví pomocí DXA v bederní páteři nebo v proximálním femuru, případně v oblasti distálního radia. Z tohoto hlediska osteodenzitometrickou kategorii osteoporózy definovala Světová zdravotnická organizace (a později International Osteoporosis Foundation, National Osteoporosis Foundation a International Society for Clinical Densitometry) poklesem denzity kostního minerálu (BMD) o −2,5 směrodatné odchylky (T-skóre) a více. Doporučeným referenčním standardem, podle kterého se vypočítává T-skóre u žen i u mužů, je databáze pro zdravé ženy, bělošky, ve věkovém rozmezí 20−29 let (NHANES III) (37, 39−42). Prevalence osteopenie (BMD v rozmezí −1 až −2,5 SD) a osteoporózy se však významně liší, použije-li se referenční databáze pro ženy nebo pro muže. V americké populaci mělo v prvním případě osteoporózu 1−4 %, zatímco při použití databáze pro muže 3−6 % mužů (43). U mužů, kteří mají při denzitometrickém vyšetření jen osteopenii (nikoli osteoporózu), vzniká 61 % neobratlových zlomenin a 58 % zlomenin proximálního femuru (44−46). Problematičnost výpovědi DXA u mužů potvrzuje i skutečnost, že ve věku ≥ 50 let má BMD ≤ −2,5 T-skóre 3× více českých žen než mužů, zlomeninu však každoročně ročně utrpí ~2 % žen i mužů.
Osteodenzitometrické vyšetření je doporučováno u všech mužů ve věku 70 let a starších a zejména u mužů po nízkotraumatické zlomenině (včetně morfometrické deformity obratle), při onemocněních nebo léčbě navozujících úbytek kostní hmoty, u mužů s genetickou dispozicí zlomenin a před zahájením léčby glukokortikoidy a antiandrogeny. U posléze uvedené skupiny pacientů je doporučeno kontrolní měření BMD po 6 měsících léčby. V ostatních klinických situacích je opakování osteodenzitometrického vyšetření doporučeno po 1−2 letech. Výpověď rychlosti poklesu BMD proximálního femuru o riziku zlomeniny však lze vzhledem k variabilitě opakovaných měření BMD posuzovat až s odstupem desítky let (47) a v některých studiích nebyla potvrzena (48). Interpretaci změn BMD páteře ve vyšším věku komplikují mj. degenerativní hyperostotické změny, deformity obratlů, těžká skolióza, cévní kalcifikace, osteoartróza, osteomalacie. Výpovědní hodnota měření BMD v krčku femuru není zaměnitelná s výpovědí měření míst skeletu s převážně trámčitou strukturou.
Poklesem BMD lze vysvětlit jen 4násobek nárůstu rizika zlomeniny proximálního femuru mezi 50 a 80 roky věku, ale riziko zlomenin se v tomto období zvyšuje 30×. Na tomto fenoménu se nezávisle na změnách BMD významně podílí zhoršení kvality kostní hmoty s věkem nebo navozené sekundárními příčinami (49, 50). Kvalitu kostní hmoty v klinické praxi neumíme měřit; chceme-li numericky vyjádřit individuální pravděpodobnost fraktury kyčle (případně hlavní osteoporotické zlomeniny) během následujících 10 let podle klinických rizikových faktorů, je doporučen nástroj FRAX (51−53). Postup vychází z incidence zlomenin a mortality v závislosti na věku v dané geografické oblasti, kterou koriguje podle individuálních údajů o prodělané zlomenině, zlomenině kyčle u rodičů, užívání glukokortikoidů, diabetu, BMI, sekundární osteoporóze, revmatoidní artritidě, kouření cigaret a nadměrné konzumaci alkoholu, případně o BMD u daného pacienta (www.shef.ac.uk/FRAX). Nejde však o nástroj pro diagnostiku osteoporózy, názory na jeho klinickou výpověď u mužů se liší (54, 55) a v České republice není způsob použití FRAX v klinické praxi doporučen (38).
Úprava modifikovatelných faktorů rizika zlomenin a nefarmakologická opatření ke snížení rizika zlomenin
Prevence osteoporózy u mužů se řídí obecnými principy zajištění optimálního vývoje skeletu během dospívání a udržení maxima kostní hmoty v dospělosti a vyšším věku. Prevence osteoporózy u mužů ve zvýšeném riziku zlomenin spočívá v zajištění přiměřené fyzické aktivity, přiměřeného přívodu vápníku a bílkovin v potravě, přiměřeného zásobení vitaminem D a v úpravě nebo vyloučení sekundárních příčin úbytku kostní hmoty. Pokud je u dospělých mužů s osteopenií potvrzena dostatečná produkce sexagenů a nejsou přítomné další příčiny sekundární osteoporózy, nedošlo k fraktuře a není zrychlená kostní remodelace, postačuje přiměřený přívod živin, vápníku potravou a vitaminu D potravou a insolací. Jestliže dostatečné zásobení vápníkem a vitaminem D není dosažitelné z přirozených zdrojů, je vhodné individuálně zvážit nutnost suplementace vápníkem a vitaminem D.
Tělesná hmotnost se má udržovat přiměřeně výšce postavy, protože neúměrně nízká hmotnost je rizikovým faktorem osteoporózy. Pro zajištění doporučeného příjmu vápníku je doporučena vyvážená strava. Pokud v jídelníčku chybí mléko a mléčné výrobky (denně půl litru nízkotučného mléka, 65 gramů tvrdého tvarohu nebo eidamského sýra nebo čtvrt litru bílého jogurtu), je u mužů ve zvýšeném riziku zlomenin vhodné doplnit 0,5 g vápníku (večer při jídle). Doporučený denní přívod 800 IU vitaminu D je vhodné zajistit celoročně při osteoporóze i při osteopenii. Vitamin D se uplatňuje také úpravou myopatie navozené hypovitaminózou D a následně snížením rizika pádů a tím i zlomenin (zejména u starých osob v ústavní péči).
Základním opatřením pro zpomalení úbytku kostní hmoty při involuční osteoporóze je udržení či zvýšení svalové hmoty a síly. Metaanalýza 44 studií provedených v letech 1989−2013 (56) potvrdila význam svalové hmoty a fyzické aktivity pro prevenci úbytku kostní hmoty v populaci. Doporučují se cvičení, která zatěžují skelet, a pravidelné zatěžování skeletu rychlou chůzí, a to 2−4 hodiny denně. Fyzicky aktivní muži mají významně nižší riziko zlomenin v oblasti kyčle než muži s nízkou fyzickou aktivitou (57). Otázka frekvence a stupně fyzické zátěže nutné pro vytvoření už dříve ztracené kostní hmoty není dořešena. Klinické studie však neprokázaly osteoanabolický účinek těchto opatření (58−60). Naproti tomu komplexní a vysoce intenzivní intervalový trénink, zatím u žen s nízkou BMD, může navodit nárůst kostní hmoty (61, 62). Může se přitom pozitivně uplatňovat řada faktorů tvořených ve svalu při cvičení (33, 63).
Léčba sekundární osteoporózy
Léčba osteoporózy má být kauzální. Protože polovina až dvě třetiny onemocnění osteoporózou u mužů mají prokazatelné sekundární příčiny úbytku kostní hmoty, je předpokladem zahájení jakékoli léčby klinické a laboratorní vyšetření a zjištění příčiny osteoporózy. Pokud je u mužů s nízkou kostní hmotou prokázána některá z příčin sekundární osteoporózy (viz tab. 2), je nutné včas léčit základní příčinu úbytku kostní hmoty.
Farmakoterapie osteoporózy u mužů
Cílem léčby osteoporózy je udržet nebo zlepšit množství a kvalitu kostní hmoty, a zabránit tak zlomeninám a zachovat nebo zlepšit kvalitu života. V ČR jsou léčebná opatření zajištěna jen u desetiny mužů a u čtvrtiny žen, kteří (podle osteodenzitometrického vyšetření) trpí osteoporózou (viz obr. 2). U mužů se roční náklady na léčení zlomenin v oblasti kyčle odhadují na 920 mil. Kč, na léčení všech fraktur pak na 2,2 mld. Kč. Na prevenci zlomenin u mužů se vydává 175 mil. Kč, tedy 13 % částky, kterou u mužů stojí jejich léčba (4).
V klinické praxi je nutné před zahájením terapie u jednotlivých pacientů vyloučit jiná metabolická a nádorová kostní onemocnění a během léčby individuálně ověřovat očekávanou účinnost léku. Osteoporóza je chronickým onemocněním a jedním z problémů je nedostatečná adherence k léčbě (schopnost a ochota pacienta dodržovat doporučený léčebný režim, compliance a perzistence) (64). Léčbu perorálními aminobisfosfonáty ukončují během 3 let více než 2/3 mužů, léčbu teriparatidem ukončuje do 18 měsíců čtvrtina mužů (65). U starých a křehkých pacientů může být i při plné adherenci účinnost léčby nízká (66). Při všech způsobech farmakoterapie osteoporózy je nezbytné zajistit doporučený příjem vápníku a vitaminu D.
V České republice jsou pro léčbu osteoporózy u mužů registrovány aminobisfosfonáty (risedronát a kyselina zoledronová), stroncium ranelát, denosumab a teriparatid. Denosumab je u mužů registrován také k léčbě sekundární osteoporózy navozené androgen-deprivační terapií karcinomu prostaty, pokud je zvýšené riziko zlomenin. Zmíněné léky (kromě alendronátu a denosumabu) jsou uvedeny v úhradové vyhlášce, podle které je hrazen také parenterální ibandronát (jen u mužů s denzitometricky potvrzenou osteoporózou a prodělanou zlomeninou).
Antiresorpční léčba osteoporózy u mužů
Cílem zpomalení remodelace kosti pomocí antiresorpčních léků je zpomalit ubývání kostní hmoty a zhoršování její mikroarchitektury. Pokud se stará kostní hmota neresorbuje, pokračuje její sekundární mineralizace (stoupá BMD). Vytváření nové kostní hmoty však tyto léky nenavozují. Aminobisfosfonáty inhibicí farnesyldifosfát syntázy tlumí účinnost osteoklastů a navozují jejich apoptózu. Jednotlivé aminobisfosfonáty se liší nejenom stupněm vazby na kostní minerál, ale také stupněm biologického účinku a způsobem podávání. Denosumab ovlivněním signální dráhy ligandu pro RANK brání diferenciaci osteoklastů a tlumí jejich funkci a přežívání.
Alendronát (10 mg denně) v prospektivní studii u 241 mužů o průměrném věku 63 let (u třetiny pacientů byla nízká koncentrace testosteronu v krvi) a s BMD v páteři nebo v kyčli ≤ −2,0 SD zvyšoval po 2 letech BMD bederní páteře o 7,1 % a krčku femuru o 2,5 % a snížil riziko zlomenin obratlů (p = 0,02) (67).
Risedronát (35 mg jednou za týden) v prospektivní studii u 284 mužů o průměrném věku 62 let, randomizovaných v poměru 2 : 1 do skupiny léčené a kontrolní, a s BMD v páteři ≤ −2,5 SD a v krčku femuru ≤ −1 SD (nebo s BMD v páteři ≤ −1 SD a v krčku femuru ≤ −2 SD) zvyšoval po 2 letech BMD bederní páteře o 4,5 % a byl zde trend ke snížení rizika zlomenin (68). Otevřená klinická studie potvrdila snížení rizika zlomenin obratlů (o 60 %) a neobratlových zlomenin (o 47 %) po 2 letech léčby mužů risedronátem (69). Další kontrolované studie prokázaly při 18měsíční léčbě risedronátem zvýšení BMD a snížení rizika zlomenin v oblasti kyčle u mužů po iktu a starších 65 let (70) a zvýšení BMD a snížení rizika zlomenin obratlů u mužů s Alzheimerovou chorobou (71).
Ibandronát (150 mg 1× za měsíc p. o.) v prospektivní studii u 132 mužů o průměrném věku 64 let a s průměrnou BMD v páteři a v krčku femuru ≤ −2,1 SD zvýšil po 12 měsících BMD bederní páteře o 2,4 % a v krčku femuru o 1,4 % proti skupině s placebem. (72).
Kyselina zoledronová (5 mg v infuzi jednou ročně) v prospektivní studii u 154 mužů o průměrném věku 64 let, zařazených na základě BMD v krčku femuru a prevalentních zlomenin, zvýšila po 2 letech BMD v bederní páteři o 6 % podobně jako alendronát (70 mg 1× za týden) u 148 mužů (73). Studie účinku kyseliny zoledronové na riziko zlomenin u mužů a žen (průměrný věk 75 let) po zlomenině v oblasti kyčle prokázala po roce léčby snížení rizika neobratlových zlomenin (74). Účinky léčby na BMD byly obdobné u žen i u mužů (75). Hojení zlomenin nebylo léčbou nepříznivě ovlivněno. Ve studii kontrolované placebem u 1199 mužů ve věku 50−85 let se při léčbě kyselinou zoledronovou snížilo po 2 letech relativní riziko zlomenin obratlů o 67 % (absolutně o 3,3 %) (76). Kyselina zoledronová významně snižuje markery kostní remodelace a zvyšuje BMD také u mužů s idiopatickou osteoporózou, hypogonadismem a glukokortikoidy indukovanou osteoporózou (73, 77). Podmínkou podání kyseliny zoledronové je dostatečná hydratace pacienta. Reakce akutní fáze (horečka, artralgie, myalgie) po infuzi uvádí 45 % pacientů; příznaky lze zmírnit opakovaným podáváním paracetamolu a většinou odeznívají do několika dnů.
Denosumab je plně lidská monoklonální protilátka proti ligandu RANK, která brání jeho vazbě na RANK (receptor aktivující jaderný faktor kappa B). Léčba denosumabem (60 mg s. c. po 6 měsících) v prospektivní studii kontrolované placebem u 219 mužů (průměrný věk 65 let) po 2 letech významně zvýšila BMD v bederní páteři o 8 %, v krčku femuru o 3,4 % a v distálním radiu o 0,7 % (p < 0,01) (78). Studie neměla statistickou sílu pro hodnocení rizika zlomenin, ale změny BMD i sérových markerů remodelace kosti byly u mužů obdobné, jako tomu bylo ve studiích, které prokázaly snížení rizika zlomenin u mužů s androgen-deprivační terapií pro karcinom prostaty (79) a u žen s osteoporózou léčených denosumabem v registrační studii (80). Účinek denosumabu na snížení rizika zlomenin hodnotila dvojitě zaslepená a kontrolovaná studie u 1468 mužů se sekundární vysokoobratovou osteoporózou navozenou androgen-deprivační terapií pro karcinom prostaty u mužů bez metastatického postižení. V porovnání s placebovou skupinou se při podávání denosumabu (s. c. 60 mg po 6 měsících) významně zvýšila BMD v bederní páteři, krčku femuru, celkovém proximálním femuru a radiu a po 3 letech byla incidence nových zlomenin obratlů u léčených mužů o 62 % nižší než v placebové skupině (1,5 vs. 3,9 %; p < 0,006) (79).
Stroncium ranelát (2 g/den p. o.) v otevřené studii u mužů navodil po roce větší zvýšení BMD než alendronát (81). Ve studii kontrolované placebem u mužů o průměrném věku 73 let se po 2 letech zvýšila BMD bederní páteře i proximálního femuru (82). Stroncium uložené v kostech však absorbuje rentgenové záření více než vápník a výpověď osteodenzitometrie nekontrolovaně nadhodnocuje. Osteoanabolický, respektive duální účinek stroncium ranelátu nebyl prokázán ani při hodnocení biochemických markerů kostní remodelace, ani v histomorfometrických studiích nepárových i párových biopsií u žen s postmenopauzální osteoporózou léčených doporučenými dávkami SrR.
Antiresorpční terapie není vhodná při kontraindikaci podávání vápníku a vitaminu D, při koncentraci vápníku v séru < 2,1 mmol/l a > 2,65 mmol/l, při deficienci vitaminu D (sérová koncentrace 25-hydroxyvitaminu D < 25 nmol/l) a při clearance kreatininu < 0,6 ml/s. Stroncium ranelát se nedoporučuje pacientům s rizikem trombembolie, ischemickou chorobou srdeční a nekorigovanou hypertenzí, závažnou komplikací léčby může být syndrom DRESS (83). Perorální aminobisfosfonáty nejsou vhodné pro pacienty neschopné zůstat ve vzpřímené poloze po dobu 30 minut, při krvácení do gastrointestinálního traktu v posledním roce, při rekurentní či aktivní gastroduodenální vředové chorobě, gastroezofageálním refluxu nebo pokud je prokázána striktura, achalázie či porucha motility jícnu.
Osteonekróza čelisti jako komplikace antiresorpční léčby se uvádí při léčbě nádorových onemocnění (incidence 1−15 %), ale při antiresorpční léčbě osteoporózy je její riziko jen hraničně vyšší (0,001−0,01 %) proti její incidenci v běžné populaci (< 0,001 %) (84). Zatímco etiologie osteonekrózy čelisti je multifaktoriální, je prokazatelná asociace antiresorpční terapie a atypických zlomenin (nejčastěji v subtrochanterické oblasti femuru a v průběhu diafýzy), která zajišťuje hojení mikropoškození kosti.
Aminobisfosfonáty i denosumab tlumí obnovování kvality kosti (remodelaci) rozdílným mechanismem účinků. Aminobisfosfonáty navozují apoptózu osteoklastů, osteoblastů i pro periostálních buněk. Tento mechanismus se může uplatnit rovněž při iritaci horního úseku zažívacího traktu (85−88). Jednotlivé aminobisfosfonáty ovšem tlumí remodelaci různě silně (risedronát méně než alendronát) a po ukončení léčby přetrvává jejich efekt různě dlouho (u risedronátu kratší dobu než u alendronátu). Aminobisfosfonáty nejsou (na rozdíl od pyrofosfátu) enzymaticky hydrolyzovány a ukládají se v kosti na dobu desítek let. Léčba aminobisfosfonáty by proto měla trvat po dobu 3−5 let, po kterou klinické studie doložily bezpečnost léčby pro kost (89). Denosumab na rozdíl od aminobisfosfonátů nemá přímý účinek na osteoblasty. Útlum remodelace je pouze projevem spřažení funkce osteoklastů a osteoblastů a odeznívá po 6 měsících od podání léku. Přesto může být podávání denosumabu u pacientů s bazálně utlumenou funkcí osteoblastů asociováno s rizikem atypické zlomeniny, zejména při současné terapii glukokortikoidy nebo u pacientů dříve léčených aminobisfosfonáty.
Osteoanabolická léčba
Pro léčbu osteoporózy u mužů a glukokortikoidy indukované osteoporózy u mužů je v České republice registrován rekombinantní fragment PTH 1-34 − teriparatid. Lék má plně zachovanou biologickou účinnost nativního PTH na kostní metabolismus a kalciofosfátový metabolismus. Kvalita novotvořené kostní hmoty je zcela normální. Teriparatid zvýšením osteoresorpce a převahou novotvorby zajišťuje nahrazení starší poškozené kosti novou kostní hmotou, jejíž množství je větší než množství odstraněné kosti. Kromě toho teriparatid navozuje vytváření nové kostní hmoty na klidových površích (90). Uplatňují se při tom osteoblasty rekrutované z buněk kambiové vrstvy periostu, zejména v místech svalových úponů.
Lék se aplikuje s. c. 1× denně pomocí injekčního pera. Zajištění dostatečného denního přívodu vápníku (1−1,5 g denně) a vitaminu D (800 IU denně) a zajištění přiměření fyzické aktivity jsou nutným předpokladem pro plnou účinnost terapie. Doporučená doba podávání léku je 24 měsíců. V České republice je léčba u mužů hrazena, jen pokud selhala předchozí nejméně 2 roky trvající antiresorpční terapie a pokud pacient má zlomeniny nejméně 2 obratlů a současně BMD v bederní páteři horší než −2,9 T-skóre. Výjimkou je léčba glukokortikoidy indukované osteoporózy, kdy lze lék podávat mužům dříve neléčeným a bez prevalentní fraktury.
V prospektivní studii u 437 mužů s idiopatickou osteoporózou navodil teriparatid (20 μg/den s. c. 1× za den) po 11 měsících sledování zvýšení BMD bederní páteře o 5,9 % a v krčku femuru o 1,5 % (p < 0,001) (91). Stupeň zvýšení BMD při léčbě teriparatidem byl u mužů obdobný jako při léčbě teriparatidem u žen. Sledování pacientů z prospektivní studie po dalších 30 měsíců prokázalo pokles BMD po ukončení léčby teriparatidem (92).
Účinnost teriparatidu při léčení glukokortikoidy indukované osteoporózy u mužů prokázala otevřená randomizovaná studie, kde dostávalo 45 mužů teriparatid a 47 mužů risedronát (93). Průměrný věk činil 56 let, medián denní dávky prednizonu 8,8 mg, medián léčby glukokortikoidy 6,4 roku; 39 % mužů mělo prevalentní zlomeninu a 33 % mužů bylo dříve léčeno aminobisfosfonáty. Volumetrická BMD (g/cm3) byla měřena v bederní páteři pomocí QCT. V Th12 byla pomocí vysokorozlišující QCT měřena mikrostruktura kosti a pomocí finite element analýzy biomechanická pevnost kosti. Po 18 měsících se BMD trámčité kosti obratlů zvýšila o 16,3 % u mužů léčených teriparatidem a o 3,8 % při léčbě risedronátem (p = 0,004). Pevnost obratlů v kompresi, ventrálním stlačení a v torzi se zvýšila při léčbě teriparatidem o 26−34 %, statisticky významněji než při léčbě risedronátem (4,2−6,7 %). Novou zlomeninu utrpěla desetina pacientů léčených risedronátem a žádný muž léčený teriparatidem.
Léčba teriparatidem je hrazena jen po dobu 2 let a po jejím ukončení BMD rychle klesá. Pokud pacienti dostávali po ukončení anabolické léčby antiresorpční léky, BMD se udržela a riziko středních a těžkých deformit obratlů se snížilo o 83 % (p < 0,01). Současné podávání teriparatidu a risedronátu u mužů zvyšuje BMD více než jednotlivé léky, není však výhodné z hlediska snížení rizika zlomenin (94).
Závěr a diskuse
Závěrem je nutné uvést, že porovnání účinnosti jednotlivých farmakoterapeutických opatření při léčbě osteoporózy u mužů má řadu omezení. Vzhledem k nízkému počtu pacientů v klinických studiích je průkaz účinnosti léků na snížení rizika zlomenin u mužů omezen na užití teriparatidu a denosumabu (zde u pacientů se sekundární osteoporózou). Proto je třeba pro klinickou praxi užít výsledků metaanalýzy, která hodnotila zvýšení BMD v bederní páteři a snížení rizika zlomenin u mužů při různých režimech léčby (viz obr. 3). BMD páteře se zvyšovala nejvíce při léčbě kyselinou zoledronovou. Riziko zlomenin u mužů nejlépe snižuje osteoanabolická léčba teriparatidem a nebo kyselina zoledronová. Tyto závěry opět potvrzují význam zlepšení kvality kostní hmoty pro snížení rizika zlomenin.
Image 3. Účinnost antiresorpční a osteoanabolické léčby osteoporózy u mužů (upraveno podle: 98) 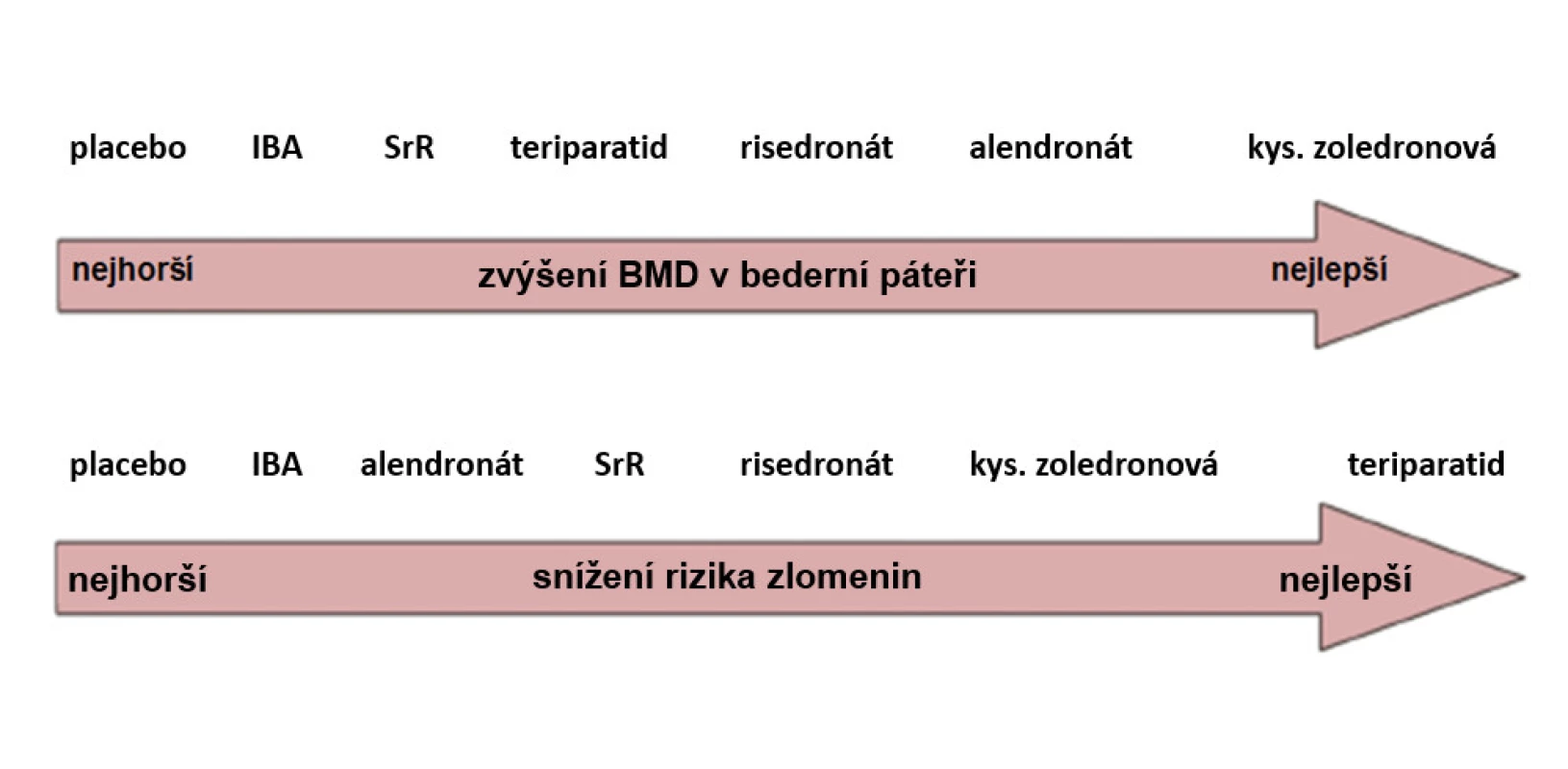
Pozn.: IBA = ibandronát; SrR = stroncium ranelát. Práce byla podpořena projektem Ministerstva zdravotnictví ČR v rámci koncepčního rozvoje výzkumné organizace 00023728 (Revmatologický ústav).
Autor prohlašuje, že není v souvislosti s tématem a publikací tohoto článku v konfliktu zájmů. Text práce nevznikl za žádné komerční nebo finanční podpory ani spolupráce, která by mohla být považována za potenciální konflikt zájmu. Autor obdržel honoráře za přednášky a za účast v International Advisory Board Amgen a Eli Lilly.
Seznam použitých zkratek
BMD denzita kostního minerálu
BMI body mass index
DRESS drug rash with eosinophilia and systemic symptoms
DXA duální rentgenová absorpciometrie
IGF-1 insulin-like growth factor 1
LRP5 low-density lipoprotein receptor-related protein 5
PTH parathormon
QCT kvantitativní výpočetní tomografie
RANK receptor aktivující jaderný faktor kappa B
SD směrodatná odchylka
SHBG sex hormone-binding globulin
SrR stroncium ranelát
Adresa pro korespondenci:
prof. MUDr. Jan Štěpán, DrSc.
Revmatologický ústav
Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
Tel.: 775 269 414
e-mail: stepan@revma.cz
Sources
1. NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA 2001; 285(6): 785–795.
2. Melton LJ 3rd. Epidemiology of fractures. In: Riggs BL, Melton LJ 3rd (eds.): Osteoporosis: etiology, diagnosis and management. Raven Press, New York, 1995 : 133–154.
3. Johnell O, Kanis J. Epidemiology of osteoporotic fractures. Osteoporos Int 2005; 16 Suppl. 2: S3–S7.
4. Svedbom A, Hernlund E, Ivergård M et al. Osteoporosis in the European Union: a compendium of country-specific reports. Arch Osteoporos 2013; 8(137): 35–42.
5. Štěpán JJ, Vaculík J, Pavelka K et al. Hip fracture incidence from 1981 to 2009 in the Czech Republic as a basis of the country-specific FRAX model. Calcif Tissue Int 2012; 90(5): 365–372.
6. von Friesendorff M, McGuigan FE, Besjakov J, Akesson K. Hip fracture in men-survival and subsequent fractures: a cohort study with 22-year follow-up. J Am Geriatr Soc 2011; 59(5): 806–813.
7. Bliuc D, Nguyen ND, Milch VE et al. Mortality risk associated with low-trauma osteoporotic fracture and subsequent fracture in men and women. JAMA 2009; 301(5): 513–521.
8. Poor G, Atkinson EJ, Lewallen DG et al. Age-related hip fractures in men: clinical spectrum and short-term outcomes. Osteoporos Int 1995; 5(6): 419–426.
9. Magaziner J, Simonsick EM, Kashner TM et al. Survival experience of aged hip fracture patients. Am J Public Health 1989; 79(3): 274–278.
10. Seeman E. Sexual dimorphism in skeletal size, density, and strength. J Clin Endocrinol Metab 2001; 86(10): 4576–4584.
11. Kirmani S, Christen D, van Lenthe GH et al. Bone structure at the distal radius during adolescent growth. J Bone Miner Res 2009; 24(6): 1033–1042.
12. Riggs BL, Melton LJ 3rd, Robb RA et al. Population-based study of age and sex differences in bone volumetric density, size, geometry, and structure at different skeletal sites. J Bone Miner Res 2004; 19(12): 1945–1954.
13. Khosla S. Update in male osteoporosis. J Clin Endocrinol Metab 2010; 95(1): 3–10.
14. Cohen-Solal ME, Baudoin C, Omouri M et al. Bone mass in middle-aged osteoporotic men and their relatives: familial effect. J Bone Miner Res 1998; 13(12): 1909–1914.
15. Van Pottelbergh I, Goemaere S, Zmierczak H et al. Deficient acquisition of bone during maturation underlies idiopathic osteoporosis in men: evidence from a three-generation family study. J Bone Miner Res 2003; 18(2): 303–311.
16. Ferrari SL, Deutsch S, Baudoin C et al. LRP5 gene polymorphisms and idiopathic osteoporosis in men. Bone 2005; 37(6): 770–775.
17. Pernow Y, Hauge EM, Linder K et al. Bone histomorphometry in male idiopathic osteoporosis. Calcif Tissue Int 2009; 84(6): 430–438.
18. Ostertag A, Collet C, Chappard C et al. A case-control study of fractures in men with idiopathic osteoporosis: Fractures are associated with older age and low cortical bone density. Bone 2013; 52(1): 48–55.
19. Seeman E. Pathogenesis of osteoporosis. J Appl Physiol 2003; 95(5): 2142–2151.
20. Aaron JE, Makins NB, Sagreiya K. The microanatomy of trabecular bone loss in normal aging men and women. Clin Orthop 1987; 215 : 260–271.
21. Riggs BL, Melton LJ, Robb RA et al. A population-based assessment of rates of bone loss at multiple skeletal sites: evidence for substantial trabecular bone loss in young adult women and men. J Bone Miner Res 2008; 23(2): 205–214.
22. Kelepouris N, Harper KD, Gannon F et al. Severe osteoporosis in men. Ann Intern Med 1995; 123(6): 452–460.
23. Schaffler MB, Choi K, Milgrom C. Aging and matrix microdamage accumulation in human compact bone. Bone 1995; 17(6): 521–525.
24. Seeman E. Pathogenesis of bone fragility in women and men. Lancet 2002; 359(9320): 1841–1850.
25. Kanis JA, Bianchi G, Bilezikian JP et al. Towards a diagnostic and therapeutic consensus in male osteoporosis. Osteoporos Int 2011; 22(11): 2789–2798.
26. Watts NB, Adler RA, Bilezikian JP et al. Osteoporosis in men: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012; 97(6): 1802–1822.
27. Ferrini RL, Barrett Connor E. Sex hormones and age: a cross-sectional study of testosterone and estradiol and their bioavailable fractions in community-dwelling men. Am J Epidemiol 1998; 147(8): 750–754.
28. Khosla S, Melton LJ 3rd, Atkinson EJ, O'Fallon WM. Relationship of serum sex steroid levels to longitudinal changes in bone density in young versus elderly men. J Clin Endocrinol Metab 2001; 86(8): 3555–3561.
29. Mellstrom D, Vandenput L, Mallmin H et al. Older men with low serum estradiol and high serum SHBG have an increased risk of fractures. J Bone Miner Res 2008; 23(10): 1552–1560.
30. Frost M, Nielsen TL, Brixen K, Andersen M. Peak muscle mass in young men and sarcopenia in the ageing male. Osteoporos Int 2015; 26(2): 749–756.
31. Rezaei A, Dragomir-Daescu D. Femoral strength changes faster with age than BMD in both women and Men: A biomechanical study. J Bone Miner Res 2015; 30(12): 2200–2206.
32. Ferretti JL, Capozza RF, Cointry GR et al. Gender-related differences in the relationship between densitometric values of whole-body bone mineral content and lean body mass in humans between 2 and 87 years of age. Bone 1998; 22(6): 683–690.
33. Edwards MH, Dennison EM, Aihie Sayer A et al. Osteoporosis and sarcopenia in older age. Bone 2015; 80 : 126–130.
34. Madeira E, Mafort TT, Madeira M et al. Lean mass as a predictor of bone density and microarchitecture in adult obese individuals with metabolic syndrome. Bone 2013; 59C: 89–92.
35. Pham HM, Nguyen ND, Center JR et al. Contribution of quadriceps weakness to fragility fracture: A prospective study. J Bone Miner Res 2016; 31(1): 208–214.
36. Gennari L, Bilezikian JP. Osteoporosis in men. Endocrinol Metab Clin North Am 2007; 36(2): 399–419.
37. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organisation; Geneva, 1994.
38. Rosa J, Šenk F, Palička V. Diagnostika a léčba postmenopauzální osteoporózy. Stanovisko Společnosti pro metabolická onemocnění skeletu ČLS JEP 2015. Osteologický bulletin 2016; 20(4): 150–168.
39. Kanis JA, Gluer CC. An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporos Int 2000; 11(3): 192–202.
40. Kanis JA, McCloskey EV, Johansson H et al. A reference standard for the description of osteoporosis. Bone 2008; 42(3): 467–475.
41. Looker AC, Wahner HW, Dunn WL et al. Updated data on proximal femur bone mineral levels of US adults. Osteoporos Int 1998; 8(5): 468–489.
42. Official Positions of the International Society for Clinical Densitometry. Dostupné na: https: //iscd.app.box.com/v/op-iscd-2015-adult
43. Looker AC, Orwoll ES, Johnston CC jr. et al. Prevalence of low femoral bone density in older U.S. adults from NHANES III. J Bone Miner Res 1997; 12(11): 1761–1768.
44. Schuit SC, van der Klift M, Weel AE et al. Fracture incidence and association with bone mineral density in elderly men and women: the Rotterdam Study. Bone 2004; 34(1): 195–202.
45. Pasco JA, Lane SE, Brennan SL et al. Fracture risk among older men: osteopenia and osteoporosis defined using cut-points derived from female versus male reference data. Osteoporos Int 2014; 25(3): 857–862.
46. Bliuc D, Alarkawi D, Nguyen TV et al. Risk of subsequent fractures and mortality in elderly women and men with fragility fractures with and without osteoporotic bone density: the Dubbo Osteoporosis Epidemiology Study. J Bone Miner Res 2015; 30(4): 637–646.
47. Nguyen TV, Center JR, Eisman JA. Femoral neck bone loss predicts fracture risk independent of baseline BMD. J Bone Miner Res 2005; 20(7): 1195–1201.
48. Leslie WD, Majumdar SR, Morin SN, Lix LM. Why does rate of bone density loss not predict fracture risk? J Clin Endocrinol Metab 2015; 100(2): 679–683.
49. Hui SL, Slemenda CW, Johnston CC jr. Age and bone mass as predictors of fracture in a prospective study. J Clin Invest 1988; 81(6): 1804–1809.
50. Kanis JA, Borgstrom F, De Laet C et al. Assessment of fracture risk. Osteoporos Int 2005; 16(6): 581–589.
51. Kanis JA, McCloskey EV, Johansson H et al. Development and use of FRAX in osteoporosis. Osteoporos Int 2010; 21 Suppl. 2: S407–S413.
52. Assessment of osteoporosis at the primary health care level. Report of a WHO Study Group. Kanis JA (ed). University of Sheffield Medical School, Sheffield, UK, 2007.
53. Leslie WD, Lix LM. Comparison between various fracture risk assessment tools. Osteoporos Int 2014; 25(1): 1–21.
54. Fraser LA, Langsetmo L, Berger C et al. Fracture prediction and calibration of a Canadian FRAX(R) tool: a population-based report from CaMos. Osteoporos Int 2011; 22(3): 829–37.
55. Ettinger B, Ensrud KE, Blackwell T et al. Performance of FRAX in a cohort of community-dwelling, ambulatory older men: the Osteoporotic Fractures in Men (MrOS) study. Osteoporos Int 2013; 24(4): 1185–1193.
56. Ho-Pham LT, Nguyen UD, Nguyen TV. Association between lean mass, fat mass, and bone mineral density: a meta-analysis. J Clin Endocrinol Metab 2014; 99(1): 30–38.
57. Forsen L, Bjorndal A, Bjartveit K et al. Interaction between current smoking, leanness, and physical inactivity in the prediction of hip fracture. J Bone Miner Res 1994; 9(11): 1671–1678.
58. Duckham RL, Masud T, Taylor R et al. Randomised controlled trial of the effectiveness of community group and home-based falls prevention exercise programmes on bone health in older people: the ProAct65+ bone study. Age Ageing 2015; 44(4): 573–579.
59. Bello M, Sousa MC, Neto G et al. The effect of a long-term, community-based exercise program on bone mineral density in postmenopausal women with pre-diabetes and type 2 diabetes. J Hum Kinet 2014; 43 : 43–48.
60. McNamara A, Gunter K. The influence of participation in Better Bones and Balance on skeletal health: evaluation of a community-based exercise program to reduce fall and fracture risk. Osteoporos Int 2012; 23(6): 1813–1822.
61. Gianoudis J, Bailey CA, Ebeling PR et al. Effects of a targeted multimodal exercise program incorporating high-speed power training on falls and fracture risk factors in older adults: a community-based randomized controlled trial. J Bone Miner Res 2014; 29(1): 182–191.
62. Watson SL, Weeks BK, Weis LJ et al. Heavy resistance training is safe and improves bone, function, and stature in postmenopausal women with low to very low bone mass: novel early findings from the LIFTMOR trial. Osteoporos Int 2015; 26(12): 2889–2894.
63. Colaianni G, Cuscito C, Mongelli T et al. The myokine Irisin increases cortical bone mass. PNAS 2015; 112 : 12157–12162.
64. Jin J, Sklar GE, Min Sen Oh V, Chuen Li S. Factors affecting therapeutic compliance: A review from the patient's perspective. Ther Clin Risk Manag 2008; 4(1): 269–286.
65. Mikyas Y, Agodoa I, Yurgin N. A systematic review of osteoporosis medication adherence and osteoporosis-related fracture costs in men. Appl Health Econ Health Policy 2014; 12(3): 267–277.
66. Greenspan SL, Perera S, Ferchak MA et al. Efficacy and safety of single-dose zoledronic acid for osteoporosis in frail elderly women: a randomized clinical trial. JAMA Intern Med 2015; 175(6): 913–921.
67. Orwoll E, Ettinger M, Weiss S et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000; 343(9): 604–610.
68. Boonen S, Orwoll ES, Wenderoth D et al. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebo-controlled, double-blind, multicenter study. J Bone Miner Res 2009; 24(4): 719–725.
69. Ringe JD, Farahmand P, Faber H, Dorst A. Sustained efficacy of risedronate in men with primary and secondary osteoporosis: results of a 2-year study. Rheumatol Int 2009; 29(3): 311–315.
70. Sato Y, Iwamoto J, Kanoko T, Satoh K. Risedronate therapy for prevention of hip fracture after stroke in elderly women. Neurology 2005; 64(5): 811–816.
71. Sato Y, Kanoko T, Satoh K, Iwamoto J. The prevention of hip fracture with risedronate and ergocalciferol plus calcium supplementation in elderly women with Alzheimer disease: a randomized controlled trial. Arch Intern Med 2005; 165(15): 1737–1742.
72. Orwoll ES, Binkley NC, Lewiecki EM et al. Efficacy and safety of monthly ibandronate in men with low bone density. Bone 2010; 46(4): 970–976.
73. Orwoll ES, Miller PD, Adachi JD et al. Efficacy and safety of a once-yearly i.v. Infusion of zoledronic acid 5 mg versus a once-weekly 70-mg oral alendronate in the treatment of male osteoporosis: a randomized, multicenter, double-blind, active-controlled study. J Bone Miner Res 2010; 25(10): 2239–2250.
74. Lyles KW, Colon-Emeric CS, Magaziner JS et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007; 357(18): 1799–1809.
75. Boonen S, Orwoll E, Magaziner J et al. Once-yearly zoledronic acid in older men compared with women with recent hip fracture. J Am Geriatr Soc 2011; 59(11): 2084–90.
76. Boonen S, Reginster JY, Kaufman JM et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med 2012; 367 : 1714–1723.
77. Sambrook PN, Roux C, Devogelaer JP et al. Bisphosphonates and glucocorticoid osteoporosis in men: results of a randomized controlled trial comparing zoledronic acid with risedronate. Bone 2012; 50(1): 289–295.
78. Langdahl BL, Teglbjaerg CS, Ho PR et al. A 24-month study evaluating the efficacy and safety of denosumab for the treatment of men with low bone mineral density: results from the ADAMO trial. J Clin Endocrinol Metab 2015; 100(4): 1335–1342.
79. Smith MR, Egerdie B, Hernandez Toriz N et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med 2009; 361(8): 745–755.
80. Cummings SR, San Martin J, McClung MR et al. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med 2009; 361(8): 756–765.
81. Ringe JD, Dorst A, Farahmand P. Efficacy of strontium ranelate on bone mineral density in men with osteoporosis. Arzneimittelforschung 2010; 60(5): 267–272.
82. Kaufman JM, Audran M, Bianchi G et al. Efficacy and safety of strontium ranelate in the treatment of osteoporosis in men. J Clin Endocrinol Metab 2013; 98(2): 592–601.
83. Jonville-Bera AP, Autret-Leca E. Adverse drug reactions of strontium ranelate (Protelos) in France. Presse Med 2011; 40(10): e453–e462.
84. Khan AA, Morrison A, Hanley DA et al. Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res 2015; 30(1): 3–23.
85. Suri S, Monkkonen J, Taskinen M et al. Nitrogen-containing bisphosphonates induce apoptosis of Caco-2 cells in vitro by inhibiting the mevalonate pathway: a model of bisphosphonate-induced gastrointestinal toxicity. Bone 2001; 29(4): 336–343.
86. Iwata K, Li J, Follet H, Phipps RJ, Burr DB. Bisphosphonates suppress periosteal osteoblast activity independently of resorption in rat femur and tibia. Bone 2006; 39(5): 1053–1058.
87. Ma YL, Zeng QQ, Chiang AY et al. Effects of teriparatide on cortical histomorphometric variables in postmenopausal women with or without prior alendronate treatment. Bone 2014; 59 : 139–147.
88. Idris AI, Rojas J, Greig IR et al. Aminobisphosphonates cause osteoblast apoptosis and inhibit bone nodule formation in vitro. Calcif Tissue Int 2008; 82(3): 191–201.
89. Adler RA, El-Hajj Fuleihan G, Bauer DC et al. Managing osteoporosis in patients on long-term bisphosphonate treatment: Report of a Task Force of the American Society for Bone and Mineral Research. J Bone Miner Res 2016; 31(1): 16–35.
90. Lindsay R, Krege JH, Marin F, Jin L, Štěpán JJ. Teriparatide for osteoporosis: importance of the full course. Osteoporos Int 2016; 27(8): 2395–2410.
91. Orwoll ES, Scheele WH, Paul S et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res 2003; 18(1): 9–17.
92. Kaufman JM, Orwoll E, Goemaere S et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int 2005; 16(5): 510–516.
93. Gluer CC, Marin F, Ringe JD et al. Comparative effects of teriparatide and risedronate in glucocorticoid-induced osteoporosis in men: 18-month results of the EuroGIOPs trial. J Bone Miner Res 2013; 28(6): 1355–1368.
94. Walker MD, Cusano NE, Sliney J et al. Combination therapy with risedronate and teriparatide in male osteoporosis. Endocrine 2013; 44 : 237–246.
95. Khosla S, Amin S, Orwoll E. Osteoporosis in men. Endocr Rev 2008; 29(4): 441–464.
96. Gielen E, Vanderschueren D, Callewaert F, Boonen S. Osteoporosis in men. Best Pract Res Clin Endocrinol Metab 2011; 25(2): 321–335.
97. Ebeling PR. Osteoporosis in men. N Engl J Med 2008; 358(14): 1474–1482.
98. Chen LX, Zhou ZR, Li YL et al. Comparison of bone mineral density in lumbar spine and fracture rate among eight drugs in treatments of osteoporosis in men: a network meta-analysis. PLoS One 2015; 10(5): e0128032.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Osteoporóza u mužů
- Transplantace Langerhansových ostrůvků v léčbě syndromu porušeného vnímání hypoglykemie. Vyhodnocení pilotního programu a porovnání s transplantací pankreatu
- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nekódující RNA – od nepotřebných po nepostradatelné
- Správný postup při indikaci a provádění pitev v České republice
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Sekulární trend v tělesné výšce a hmotnosti dospělé populace v České republice
- Správný postup při indikaci a provádění pitev v České republice
- Klinické hodnocení poruch acidobázické rovnováhy: Hendersonův-Hasselbalchův, nebo Stewartův-Fenclův přístup?
- Nástrahy diagnostického procesu aneb „zamyšlení nad myšlením lékařů“
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

