-
Medical journals
- Career
Kardiovaskulární riziko u revmatických onemocnění
Authors: Sabína Oreská; Michal Tomčík
Authors‘ workplace: Revmatologická klinika 1. LF UK ; Revmatologický ústav
Published in: Čas. Lék. čes. 2016; 155: 324-332
Category: Review Article
Overview
Kardiovaskulární choroby na podkladě aterosklerózy stojí celosvětově v čele žebříčku příčin mortality. Samotný aterosklerotický proces, dříve považovaný za degenerativní onemocnění, se dnes řadí svým patogenetickým mechanismem spíše k autoimunitně zprostředkovaným procesům s účastí řady složek vrozené i získané imunity. V posledních letech bylo zjištěno vyšší kardiovaskulární riziko u autoimunitních chorob.
V patogenezi aterosklerózy u pacientů s chronickým zánětlivým onemocněním se mimo tradičních faktorů uplatňují i tzv. netradiční faktory související se základním revmatickým onemocněním. Tyto nemoci, obecně považované za nefatální, jsou většinou spojeny s předčasným úmrtím právě v důsledku kardiovaskulárních příčin, pravděpodobně vlivem akcelerace aterosklerózy. Nejširší evidence o zvýšeném kardiovaskulárním riziku je u revmatoidní artritidy a systémového lupus erythematodes. U ostatních revmatických onemocnění existuje nepoměrně méně publikovaných studií.
Vzhledem k těmto zjištěním vydala v roce 2010 Evropská liga proti revmatismu (EULAR) doporučení umožňující časné rozpoznání rizikových pacientů a zahájení preventivní péče. Tato doporučení byla v roce 2013 revidována s ohledem na nové poznatky z praxe a provedených studií a v říjnu 2016 byla publikována nová upravená doporučení. Základem zůstávají pravidelný screening kardiovaskulárních rizik a důsledná kontrola aktivity revmatického nemocnění. Důležitá je spolupráce dispenzarizujících odborníků včetně lékaře primární péče. Stále však zůstává mnoho otevřených otázek, které do budoucna vyžadují provedení řady studií.Klíčová slova:
kardiovaskulární riziko, ateroskleróza, revmatická onemocněníAteroskleróza a kardiovaskulární riziko
Kardiovaskulární choroby jsou celosvětově nejčastější příčinou úmrtí s podílem zhruba na jedné třetině úmrtí ve světě (1, 2). V Evropě i v rozvíjejících se zemích jsou choroby oběhové soustavy na podkladě aterosklerózy vedoucí příčinou mortality a morbidity se zhoršením kvality života (3).
Ačkoli byla ateroskleróza dříve považována za degenerativní onemocnění spojené se stárnutím, výzkumy posledních tří desetiletí prokázaly, že se spíše jedná o (auto)imunitně podmíněný stav, pro nějž jsou charakteristické změny lipidového metabolismu, proliferace hladkých svalových buněk, tvorba aterosklerotických plátů a zúžení průsvitu arterií (4).
Tradiční rizikové faktory (věk, pohlaví, hypertenze, dyslipidemie, diabetes mellitus) popsané již ve Framinghamské studii (5), vysvětlují pouze 75 % nových případů kardiovaskulárních manifestací. Zbývající čtvrtina připadá na jen částečně známé nové rizikové faktory, související zejména se zánětlivými pochody v organismu (6). Jako asi nejvýznamnější se zatím jeví C-reaktivní protein (CRP) asociovaný s vyšším kardiovaskulárním rizikem (7), který by mohl přispívat k aterogenezi aktivací komplementu a indukcí uvolňování prozánětlivých cytokinů, např. interleukinu 6 (IL-6) (8, 9).
V patogenezi aterosklerózy se uplatňují molekulární a buněčné pochody a další složky usnadňující iniciaci tvorby plátů, progresi a i klinickou manifestaci aterosklerózy (3). Klíčová je porucha endotelové funkce, zvýšení propustnosti a aktivace endotelových buněk (1). Oxidované částice LDL (low density lipoprotein) − oxLDL spouštějí zánětlivou reakci prostřednictvím buněk cévní stěny a makrofágů. Dochází k produkci růstových faktorů stimulující proliferaci hladkých svalových buněk, k expresi adhezivních molekul, selektinů a chemokinů (4, 10, 11) a k sekreci cytokinů vyvolávajících apoptózu endotelových buněk, což s přispěním metaloproteináz vede k narušení stability aterosklerotických plátů a jejich ruptuře (6, 12).
Role imunitního systému v aterogenezi je v celém průběhu velmi komplexní a zahrnuje všechny jeho složky (1, 12, 13). Mezi nejvýznamnější mediátory zánětu patří cytokiny TNF-α (tumor nekrotizující faktor α) a interleukin IL-1β (1).
Z autoprotilátek se v aterogenezi pravděpodobně nejvíce uplatňují protilátky proti oxidovaným LDL částicím (anti-oxLDL) a beta-2-glykoproteinu (anti-β2GPI) (14−16), uplatňují se i antifosfolipidové protilátky (APA), které působí protromboticky, umocňují vazbu komplexu oxLDL/β2GPI na makrofágy a tím jejich transformaci na pěnové buňky (17, 18) a podporují atrakci monocytů do cévní stěny (19, 20). Protilátky proti hsp60 (heat shock protein 60) exprimovanému na endotelových buňkách vystavených hemodynamickému, metabolickému či mechanickému stresu, byly nalezeny u pacientů s kardiovaskulárními chorobami a u zvířecích modelů s hypercholesterolemií [1]. Endogenní hsp60 se stává imunogenním také v důsledku reakce na mimikry infekčních agens (Chlamydia pneumoniae, Helicobacter pylori) (21). U jedinců se stenokardií a chorobou tří tepen byly, oproti kontrolám s negativním angiografickým nálezem, častěji detekovány antinukleární protilátky (ANA) (22), které jsou asociovány s vyšším rizikem akutního infarktu myokardu (23).
Autoprotilátky tedy mohou být markery imunitně podmíněného kardiovaskulárního onemocnění jak u jedinců s autoimunitou, tak i bez autoimunitních poruch. Preklinická pozitivita autoprotilátek může být spojena nejen s vyšším rizikem vzniku systémového onemocnění pojiva, ale i s vyšším rizikem kardiovaskulárního onemocnění, proto nelze preklinický autoimunitní proces považovat za benigní stav (24).
Existuje mnoho systémů komplexně hodnotících riziko kardiovaskulárních nemocí u pacientů dle přítomných rizikových faktorů (25). Neovlivnitelné tradiční rizikové faktory (věk, pohlaví, rodinná anamnéza, etnikum) jsou klíčové pro stratifikaci populace, zatímco modifikovatelné faktory (hypertenze, dyslipidemie, diabetes mellitus) jsou cílem intervence (25). Celkem významnou roli hraje životní styl a sociální deprivace často spojená s nedostatečnou preventivní péčí (25).
Framinghamské skóre, které patří mezi první široce užívané modely, hodnotí vliv tradičních rizikových faktorů na riziko kardiovaskulárních příhod (26). Výchozí Framinghamská studie z roku 1991 sice byla provedená na malé populaci (27), data z ní však posloužila pro vytvoření novějších skórovacích systémů pro hodnocení kardiovaskulárního rizika.
V Evropě je velmi rozšířený model SCORE (Systemic Coronary Risk Evaluation) (28) vytvořený na základě 12 velkých západoevropských kohortových studií. Stratifikuje populaci dle rizika fatálních kardiovaskulárních příhod během 10 let na základě přítomnosti tradičních rizikových faktorů.
Pro možnost včasného záchytu aterosklerózy u dosud asymptomatických jedinců byly vyvinuty komplexní vyšetřovací metody. Americká kardiologická společnost (The American College of Cardiology Foundation/American Heart Foundation [ACCF/AHA]) uvedla seznam doporučených laboratorních a klinických vyšetření a postupů pro hodnocení kardiovaskulárního rizika (29) založených na studiích v běžné populaci. Chronický zánětlivý stav může výsledky vyšetření zkreslovat (3, 12). Ačkoli dostupných metod k detekci subklinické aterosklerózy je mnoho (viz tab. 1), ne všechny jsou validizované a široce dostupné a některé se používají jen experimentálně anebo ve studiích.
Table 1. Zobrazovací techniky pro vyšetření cévní funkce a/nebo poškození (upraveno podle: 6) 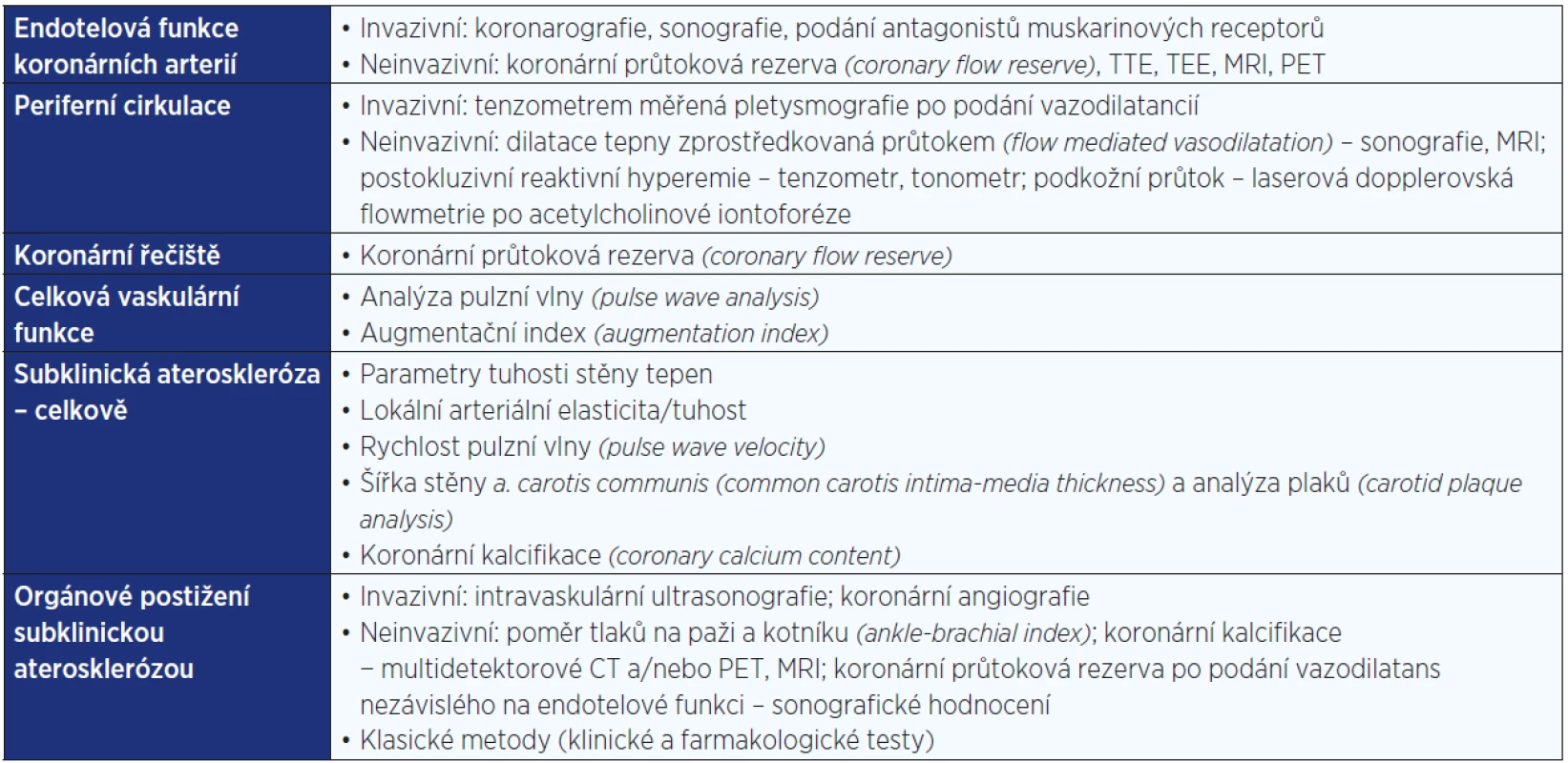
Pozn.: TTE = transthorakální echokardiografie; TEE = transezofageální echokardiografie; MRI = magnetická rezonance; PET = pozitronová emisní tomografie. Kardiovaskulární riziko u revmatických onemocnění
Autoimunitní choroby zahrnují široké spektrum chronických onemocnění se společným základním imunopatologickým mechanismem. Pokroky v terapii prodloužily pacientům s revmatickými chorobami život, zároveň ale umožnily manifestaci komorbidit a pozdních následků nemocí, v čele s projevy aterosklerotického postižení (30, 31). Zvýšené riziko kardiovaskulárních onemocnění u revmatických chorob je dobře známé a široce popsané zejména u revmatoidní artritidy, systémového lupus erythematodes a nedávno také u ankylozující spondylitidy a psoriatické artritidy. Ačkoli tyto nemoci nejsou obecně považovány za fatální, většina z nich je spojena s předčasným úmrtím na vrub kardiovaskulárního postižení způsobeného akcelerovaným aterosklerotickým procesem (3). Specifické imunopatologické pochody u jednotlivých autoimunitních nemocí souvisí také se specifickou proaterogenní signální dráhou a různou manifestací kardiovaskulárních onemocnění (32, 33).
Role tradičních rizikových faktorů je vícečetná. Mohou spouštět aktivitu revmatického onemocnění a zároveň mohou být samy důsledkem revmatického onemocnění a synergicky působit s již přítomnými rizikovými faktory (3).
Netradiční rizikové faktory lze rozdělit na faktory geneticky podmíněné, související s autoimunitním onemocněním a smíšené (34). Uplatňují se také epigenetické mechanismy, další komorbidity a v neposlední řadě deprese často přítomná u revmaticky nemocných a těsně asociovaná s kardiovaskulárními riziky (35). Svou roli hraje věk pacienta při nástupu či manifestaci onemocnění, aktivita a délka trvání onemocnění (12, 36).
Terapie modulující imunitní pochody také nepřímo ovlivňuje kardiovaskulární mortalitu a morbiditu (35, 36). Nesteroidní antirevmatika (NSA) a selektivní inhibitory cyklooxygenázy 2 (koxiby) zvyšují kardiovaskulární riziko svým protrombotickým účinkem. Na druhé straně zlepšují fyzickou aktivitu u revmatoidní artritidy, která protrombotický efekt snižuje (37, 38).
Glukokortikoidy ovlivňují kardiovaskulární riziko dvěma cestami: 1. prohlubují dyslipidemii, glukózovou toleranci a inzulinovou rezistenci, zvyšují krevní tlak a zvyšují predispozici k obezitě (39); 2. na druhou stranu tlumí zánět, což paradoxně zmíněné faktory zlepšuje (38, 40). Dlouhodobé užívání glukokortikoidů ve vysokých dávkách (> 7,5 mg/den) je spojeno s vyšší kardiovaskulární mortalitou. Efekt nízkých dávek je z tohoto hlediska nejednoznačný (41).
V revmatologii často užívané chorobu modifikující léky – csDMARDs (conventional synthetic disease modyfying antirheumatic drugs) sestávají z heterogenní skupiny imunosupresivně působících molekul, jejichž vedlejší účinky jsou různé. U csDMARDs byl prokázán potenciál redukovat progresi aterosklerózy v několika studiích. Časné zahájení terapie csDMARDs by mohlo figurovat zároveň jako vhodné kardiopreventivní opatření [33].
Efekt biologických preparátů, zejména anti-TNF-α, na kardiovaskulární systém je komplexní, přes příznivý protizánětlivý a protiaterosklerotický účinek až po potenciaci srdečního selhání (3, 12). IL-6 podmiňuje mobilizaci mastných kyselin do periferních tkání, proto blokáda IL-6 tocilizumabem (protilátka proti receptoru pro anti-IL-6) teoreticky příznivě ovlivňuje lipidogram (41), ačkoli tento efekt není jednoznačně potvrzen. Kromě hladiny HDL zřejmě zvyšuje také hladiny celkového, LDL cholesterolu a triglyceridů (42). Spektrum zvýšených lipidů je diskutováno v desítkách publikací, ale definitivní zhodnocení vlivu tocilizumabu na kardiovaskulární riziko přinese až nyní dokončovaná RCT proti etanerceptu (https://clinicaltrials.gov/ct2/show/NCT01331837).
Anti-TNF-α preparáty snižují kardiovaskulární riziko, i když dle některých studií méně než MTX (43, 44), naopak v jiných studiích prokázaly výraznější příznivý efekt (45). Protektivní působení anti-TNF-α spočívá spíše v ovlivnění hladiny HDL (high density lipoprotein) než v kvantitativních změnách LDL (46). Blokádou TNF-α se obnovuje antiaterogenní potenciál HDL molekuly. Dlouhodobá terapie anti-TNF-α byla navíc spojena s 51% redukcí rizika rozvoje diabetes mellitus (47). V roce 2007 byla publikována data z britského registru, která konkrétně ukazují snížení frekvence výskytu infarktu myokardu u nemocných léčených anti-TNF-α (48). Ačkoli neexistují přesvědčivé důkazy o asociaci anti-TNF-α s městnavým srdečním selháním, není tato terapie doporučena u revmatoidní artritidy s přítomným srdečním selháváním (49).
Revmatoidní artritida
Revmatoidní artritida (RA) je chronické zánětlivé onemocnění postihující primárně synoviální výstelku kloubního aparátu s možnou extraartikulární manifestací. Vyskytuje se s prevalencí průměrně 0,5−1 % obyvatel s převahou postižení žen (50, 51). RA je provázena 1,5−2× vyšším rizikem kardiovaskulárních chorob oproti běžné populaci bez systémových nemocí (24, 31). Absolutní riziko úmrtí na kardiovaskulární příčiny je nejvyšší u starších mužů s RA, zatímco relativní riziko je vyšší u mladých pacientek. Morbidita u RA je celkově srovnatelná s diabetem mellitus (52). Spektrum kardiovaskulárních manifestací u RA je široké s celkovou prevalencí 30−50 % (32).
Hlavní příčinou úmrtí na kardiovaskulární nemoci u RA je ischemická choroba srdeční (ICHS) (31). Důvodem je klinicky tichý průběh, pozdní diagnóza. Vyšší mortalita na ICHS je spojena s pozitivitou revmatoidního faktoru (RF) a protilátek proti citrulinovaným peptidům (aCCP) (24, 41). Reakce citrulinovaných peptidů nalezených ve stěně aorty postižené aterosklerózou u jedinců bez revmatických onemocnění s anti-CCP protilátkami podporuje hypotézu, že anti-CCP by mohly urychlovat progresi aterosklerózy u pacientů s RA (53).
S délkou trvání RA roste i kardiovaskulární riziko, částečně na vrub vyšší prevalence hypertenze a kouření (54), které negativně ovlivňuje průběh RA a podporuje produkci revmatoidního faktoru. Přímý podíl kouření na zvýšení kardiovaskulární mortality se ale neprokázal (55).
Chronický zánět provází uvolňování mediátorů štěpících kolagen, které destabilizují aterosklerotický plát. Stejné mediátory jsou zodpovědné za eroze kostí a chrupavky u RA a do určité míry i za extraartikulární postižení (56).
Nepříznivé změny lipidového profilu u RA, charakteristicky změny hladin LDL, vznikají spíše vlivem sekundárního efektu zánětu než na podkladě primárně metabolických změn [56] a jsou přítomné až 10 let před nástupem RA (57).
Chorobu modifikující léky (csDMARDs) a iniciální dávka glukokortikoidů mají příznivý vliv na lipidový profil u časné RA (58−60). Tento účinek během několika prvních měsíců terapie vykazují také blokátory TNF-α (61−63), dále efekt závisí na aktivitě nemoci, změnách terapie a komedikace (zejména glukokortikoidů) a životním stylu (např. dieta, fyzická aktivita) (64−66). Dle recentní metaanalýzy dostupných studií bylo nejvíce zvýšeno riziko kardiovaskulárních příhod pří užívání glukokortikoidů (RR 1,47), NSA − koxibů (RR 1,36), naopak riziko kleslo podobně při terapii MTX (methotrexát) či anti-TNF-α preparáty (RR 0,72, resp. 0,70) [45].
Systémový lupus erythematodes
Systémový lupus erythematodes (SLE) je autoimunitní systémové onemocnění charakteristické tvorbou orgánově nespecifických autoprotilátek. Typicky se vyskytuje u žen ve středním věku, s celkovou prevalencí v populaci 0,3−0,5 % (67−69). U pacientů se SLE se kardiovaskulární choroby vyskytují přinejmenším dvakrát častější než v běžné populaci (70), s pestrou manifestací. Jsou hlavní příčinou pozdního úmrtí pacientů se SLE, zatímco časná mortalita souvisí s aktivitou samotné revmatické nemoci (31).
Z tradičních rizikových faktorů se v akceleraci aterosklerózy uplatňuje zejména hypertenze, diabetes mellitus, změny plazmatických lipidů a kouření. Typické rysy dyslipoproteinemie, tzv. lupus pattern, souvisejí s aktivitou choroby a zahrnují nízké hladiny HDL, elevaci triacylglycerolů (TAG), mírně zvýšené či normální hladiny LDL a vyšší hladinu lipoproteinu a (Lp(a)). Apolipoprotein A1 spjatý s HDL snižuje hladiny TNF-α, proto i nízká hladina HDL přispívá k progresi aterosklerózy u SLE (71). Zvýšené hladiny TAG v důsledku tvorby protilátek proti lipoproteinové lipáze provázejí vysokou aktivitu nemoci (71).
Z faktorů souvisejících se základním onemocněním hraje roli věk manifestace onemocnění a jeho trvání, orgánové poškození (zejména nefropatie), autoprotilátky (absence anti-Sm protilátek je asociovaná s vyšším kardiovaskulárním rizikem) a v neposlední řadě terapie (72). Glukokortikoidy mají v nízkých dávkách protektivní efekt díky udržení nízké aktivity onemocnění (31).
Poruchy myokardiální perfuze (detekované PET/CT) hlavně v oblasti mikrocirkulace mohou mít příčinu v tvorbě mikrotrombů indukovaných antifosfolipidovými protilátkami (73). Pozitivita anti-dsDNA protilátek je spojena spíše s vyšší nekardiovaskulární mortalitou (74).
Psoriatická artritida
Psoriatická artritida (PsA) je systémové onemocnění ze skupiny spondyloartritid postihující 0,05−0,25 % populace a až 41 % pacientů s kožní psoriázou (75). Riziko infarktu myokardu u PsA je až 1,6× častější než v běžné populaci (35), u závažné formy nemoci s těžkým kožním postižením dokonce trojnásobné (36). Prevalence metabolického syndromu je 2−3× vyšší než v běžné populaci a vyšší než u jiných revmatických onemocnění (76).
Lipidogram se mění dle zánětlivé aktivity nemoci, v akutní fázi klesají hladiny LDL i HDL, během remise naopak stoupají (35). Několik studií se zabývalo apolipoproteiny apo-A1 a apo-B, kdy u PsA byla zachycena nižší sérová hladina a vyšší synoviální hladina apolipoproteinu. Předpokládá se, že odtržení apo-A1 v zánětem postižené tkáni při zvýšené endotelové permeabilitě zodpovídá za pokles koncentrace HDL v séru, který tak zvyšuje kardiovaskulární riziko u PsA, podobně jako je tomu u RA (77).
U PsA bylo popsáno výraznější zvýšení hodnoty tloušťky intimy-médie společných karotid (CIMT − common carotid intima-media thickness), která korelovala s některými parametry nemoci a s přítomností tradičních rizikových faktorů. Naopak hladina CRP, stupeň závažnosti revmatického onemocnění ani medikace MTX či anti-TNF-α neměly vliv na postižení karotid (35, 78). Nedávná studie u pacientů se spondylartritidami včetně PsA prokázala pravděpodobný příznivý efekt terapie anti-TNF na kardiovaskulární riziko (79).
Systémová sklerodermie
Systémová sklerodermie (SSc) postihuje pojivovou tkáň a cévy kůže i vnitřních orgánů s prevalencí 1−20 případů na 100 000 obyvatel (80). Cévní postižení u systémové sklerodermie bylo do nedávna považováno hlavně za mikrovaskulární. Nové poznatky svědčí také pro postižení středních cév, ačkoli data nejsou konzistentní (81).
Kardiovaskulární mortalita u SSc se pohybuje mezi 20 a 30 %, a ačkoli je podobného charakteru jako u běžné populace, objevuje se o dekádu dříve (82). Symptomy se nacházejí u 10 % pacientů se SSc. Koronární kalcifikace se vyskytují u 33−40 % asymptomatických nemocných. Pro SSc je charakteristický spasmus koronárních arterií podílející se na manifestaci akutního infarktu myokardu (AIM) spolu s myokardiální fibrózou a patologickou myokardiální perfuzí (81, 83, 84). Studie subklinické aterosklerózy u SSc provedené na malých kohortách prokázaly zhoršení koronární rezervy a postižení periferních tepen – zhoršení endotelové funkce a postižení karotid navzájem na sobě nezávislé, u nichž nebyla zjevná asociace s tradičními rizikovými faktory (85, 86).
Podíl tradičních a netradičních rizikových faktorů není jistý (87, 88). Změny lipidogramu – typicky nízké hladiny HDL, normální LDL a zvýšení Lp(a) – spolu s CRP přispívají k propagaci zánětu i progresi aterosklerózy (89).
Přítomnost APA většinou provází těžší vaskulopatii a kapilární postižení, data o ostatních protilátkách asociovaných s aterosklerózou jsou nekonzistentní (90). Určitou roli může hrát také polymorfismus genu pro angiotenzin konvertující enzym (ACE). Homozygotní delece (DD) spojená s vyššími hladinami ACE spolu s endotelovou dysfunkcí predisponují k cerebrovaskulárnímu postižení. Přítomnost alely D, častější u SSc, bývá asociována se závažnějším cévním poškozením (91).
Idiopatické zánětlivé myopatie
Idiopatické zánětlivé myopatie (IZM) jsou skupina onemocnění primárně postihující kosterní svalstvo. Nejčastěji se z této skupiny vyskytuje dermatomyozitida (DM) a polymyozitida (PM) (92, 93). Zánětlivé postižení kosterních svalů se týká přibližně 0,02 % obyvatel (94). Údaje o kardiovaskulárním postižení u těchto nemocí jsou nedostačující a výsledky epidemiologických studií si protiřečí. Metaanalýza studií, zabývajících se prevalencí kardiovaskulárních chorob u IZM odhalila 2,24× vyšší kardiovaskulární riziko oproti běžné populaci (95). Jedna případová studie toto zvýšené riziko nepotvrdila (96).
U pacientů s IZM je zjišťována vyšší prevalence tradičních rizikových faktorů (97, 98), které u těchto nemocných specificky souvisí se sníženou pohybovou aktivitou. Svou roli hraje i kortikoterapie, která na jedné straně svými vedlejšími účinky podporuje aterogenezi, na druhé straně má protektivní vliv díky tlumení zánětlivého procesu. Převažující účinek glukokortikoidů není jasný (95).
Současné strategie hodnocení a prevence kardiovaskulárního rizika
Hodnocení kardiovaskulárního rizika by mělo být běžnou součástí péče o pacienty s revmatickým onemocněním (41). Evropská liga proti revmatismu (EULAR) vydala v roce 2010 doporučení pro hodnocení a zajištění kardiovaskulárního rizika u pacientů s RA, PsA a ankylozující spondylitidou (AS), přičemž nejvyšší sílu mají doporučení pro RA vzhledem k největší evidenci zvýšeného kardiovaskulárního rizika. Doporučení shrnují v 10 bodech přístup k pacientům zejména s RA, s určitou modifikací a převzetím i pro PsA a AS. Důraz je kladen na časnou diagnostiku aterosklerózy (24, 38).
Tato doporučení byla následně revidována a modifikována skupinou odborníků z oboru revmatologie, endokrinologie, kardiologie a epidemiologie. Nové pokyny byly shrnuty celkem ve 25 bodech roztříděných do 3 základních okruhů: 1. nástroje k hodnocení kardiovaskulárního rizika, 2. určení vhodných pacientů k vyšetření rizika, 3. frekvence vyšetřování a terapeutická strategie kontroly kardiovaskulárních rizik (49).
Na základě dalších poznatků byla posléze doporučení EULAR upravena, upřesněna a nově publikována v říjnu 2016 (viz tab. 2) (99).
Table 2. Doporučené postupy u pacientů se zvýšeným kardiovaskulárním rizikem podle EULAR (upraveno podle: 99) 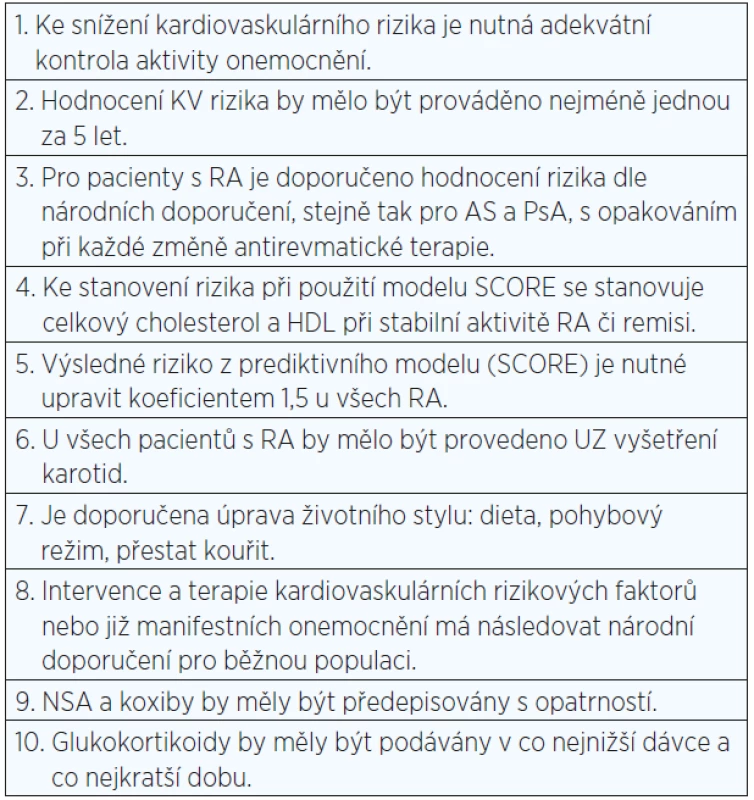
Pozn.: KV = kardiovaskulární; RA = revmatoidní artritida; AS = ankylozující spondylitida; PsA = psoriatická artritida; HDL = lipoprotein o vysoké hustotě. Kardiovaskulární riziko by mělo být objektivizováno podobně jako v běžné populaci s použitím modelu SCORE, eventuálně pomocí národního modelu pro hodnocení kardiovaskulárního rizika. U pacientů s nízkou aktivitou nemoci stačí hodnocení jednou za 5 let, případně při každé změně terapie. Dosud žádná studie nepodpořila nutnost každoročního hodnocení rizika u RA (49, 99).
Klasický skórovací systém určený pro běžnou populaci v oboru revmatologie nestačí, protože nezahrnuje netradiční rizikové faktory (6). V roce 2013 byla vydána doporučení společné pracovní skupiny Americké kardiologické společnosti (ACC/AHA − American College of Cardiology and American Heart Association), která sice významně zvýšila počet pacientů s RA vhodných k zahájení terapie dyslipidemie, ale nezlepšila predikci 10letého rizika kardiovaskulárních příhod (100, 101).
Riziko kardiovaskulárního úmrtí při době trvání RA méně než dva roky je zvýšené 1,2×, zatímco u etablované RA až 1,9× (102). Pacienti s extraartikulární manifestací RA a pozitivitou RF a aCCP mají zhruba 3,3× vyšší riziko kardiovaskulárního postižení (103, 104). Samotná pozitivita RF a/nebo aCCP zvyšuje riziko kardiálních příhod a selhání 3× oproti séronegativním a aCCP negativním pacientům (105). Vzhledem k těmto zjištěním je doporučeno výsledné skóre násobit koeficientem 1,5, v původních doporučeních z roku 2010 pouze v případě, že pacient splňuje nejméně 2 ze 3 kritérií: trvání choroby více než 10 let, pozitivita RF a/nebo aCCP a přítomnost extraartikulární manifestace. Dle některých studií se koeficient 1,5 ukázal jako nedostatečný (106), proto bylo navrženo přidání neinvazivních vyšetření jako CIMT či ABI k detekci subklinické aterosklerózy u asymptomatických pacientů ve středním riziku dle SCORE (1−4 %) (107−109). Výběr metody záleží na zkušenostech vyšetřujícího a technickém vybavení (49). Vzhledem ke zjištěné přítomnosti subklinické ATS i u pacientů s časnou RA je nově doporučeno koeficient 1,5 aplikovat u všech pacientů s touto diagnózou nehledě na dříve určená kritéria (99).
Včasná diagnóza kardiovaskulárního postižení umožňuje rychlý a adekvátně razantní zásah v rámci primární prevence. V běžné praxi většinou stačí alespoň důsledné a pravidelné monitorování krevního tlaku a stanovení plazmatických lipidů v rámci ambulantní kontroly. Léčba rizikových faktorů u RA (hypercholesterolemie, hypertenze, obezity, závislosti na tabáku) se řídí stejnými postupy jako v běžné populaci (38, 41, 49).
Prevence či zmírnění kardiovaskulárních komorbidit spočívá ve třech hlavních přístupech: nefarmakologickém, farmakologickém a těsné kontrole aktivity revmatické choroby. Zanechání kouření i pravidelné cvičení dle možností pacienta mají prokázaný příznivý efekt na kardiovaskulární systém (38, 41, 49).
Z farmakologických intervencí jde především o snížení krevního tlaku a kontrolu lipidogramu. Cílové hladiny LDL u RA by měly být nižší než hranice stanovená pro běžnou populaci, současně by se měla zvážit preventivní antiagregační terapie. Statiny a inhibitory ACE, eventuálně blokátory angiotenzinu II jsou preferovány pro své potenciální protizánětlivé účinky (33, 38, 41). Kontrolovaná studie s atorvastatinem u RA prokázala nejen významné snížení celkového cholesterolu (cCH) a LDL, ale i zmírnění aktivity choroby (110). Kardioprotektivní terapie by měla být zahájena v případě překročení hraniční hodnoty rizika stanovené skórovacími systémy. Intervence by měla být prováděna dle postupů národních doporučení.
Ke snížení kardiovaskulárního rizika je nutná adekvátní kontrola aktivity nemoci (časná a efektivní), nejlépe s použitím inhibitorů TNF-α a MTX, u kterých byla nezávisle prokázaná asociace se snížením kardiovaskulárního rizika (48, 111−115). Efektivní terapie zlepšuje fyzický stav a kondici, což umožňuje zvýšit fyzickou aktivitu a snížit riziko hypertenze, obezity či diabetu (důležitých determinant kardiovaskulárního rizika) (38).
Zároveň je třeba brát v úvahu možné nežádoucí účinky medikace na kardiovaskulární systém. Pro specifické situace, jakými jsou srdeční selhání či akutní koronární syndrom, byla doporučení EULAR upravena tak, že by se anti-TNF-α preparáty neměly podávat pacientům s těžkým srdečním selháním, dysfunkcí levé komory či akutní fázi koronárního syndromu (49). Pozornost je nutné věnovat nesteroidním antiflogistikům. NSA mohou zhoršit hypertenzi a renální funkce a jejich dlouhodobé užívání zvyšuje kardiovaskulární mortalitu (116).
Nízké dávky glukokortikoidů (< 10 mg denně) zřejmě nezvyšují kardiovaskulární riziko, i když jedna studie prokázala vyšší incidenci infarktu myokardu a cévní mozkové příhody CMP při dávce 6−10 mg na den u RF pozitivních pacientů (117). Proto EULAR doporučuje podávat glukokortikoidy co nejkratší dobu (jako přemosťující terapii) v co nejnižší dávce (38, 99).
Závěr
Kardiovaskulární komorbidity na podkladě akcelerované aterosklerózy u pacientů s chronickými systémovými nemocemi jsou významným faktorem ovlivňujícím prognózu. Existuje široká evidence o zvýšení tohoto rizika u nejčastějších revmatických chorob (RA, SLE) a rostoucí počet studií dokládajících podobný stav u vzácnějších nemocí.
Vzhledem k potřebě kontroly kardiovaskulárního rizika u specifické skupiny, jakou jsou pacienti se systémovými zánětlivými chorobami, byly Evropskou ligou proti revmatismu publikovány oficiální doporučené postupy, následně revidované s ohledem na nové poznatky o účinnosti a adekvátnosti těchto doporučení a zkušenosti z praxe. Zahrnuta je rovněž specifická imunosupresivní terapie a její vliv na kardiovaskulární rizika, například zlepšení funkčnosti u pacientů s revmatickým onemocněním po aplikaci biologické léčby umožňuje zlepšení kardiovaskulární výkonnosti a může být mimo jiné jedním z faktorů důležitých při hodnocení biologické léčby.
Strategie prevence u pacientů splňujících kritéria pro zahájení cílené terapie k redukci rizikových faktorů vyžaduje pravidelné monitorování a kontrolu této skupiny pacientů. I přes to, že zodpovědnost za sledování kardiovaskulárního rizika u revmatických pacientů byla předána dle nových doporučení z roku 2016 do rukou revmatologa, měla by ideálně probíhat spolupráce praktického lékaře, revmatologa i kardiologa.
Poděkování:
Tato práce vznikla za podpory grantu AZV 16-33574A a za podpory MZ ČR – Institucionální podpora, Koncepční rozvoj výzkumné organizace č. MZO 023728.
Seznam použitých zkratek
ACCF American College of Cardiology Foundation
aCCP protilátky proti citrulinovaným peptidům
ACE angiotenzin konvertující enzym
AHA American Heart Association
ANA antinukleární protilátky
anti-β2GPI protilátky proti beta-2-glykoproteinu
APA antifosfolipidové protilátky
apo-A1 apolipoprotein A1
apo-B apolipoprotein B
AS ankylozující spondylitida
cCH celkový cholesterol
CIMT tloušťka intimy-médie společných karotid
CMP cévní mozková příhoda
CRP C-reaktivní protein
csDMARDs konvenční syntetické chorobu modifikující antirevmatické léky
EULAR European League Against Rheumatism
HDL lipoprotein o vysoké hustotě
hsp60 heat shock protein 60
ICHS ischemická choroba srdeční
IL interleukin
IZM idiopatické zánětlivé myopatie
LDL lipoprotein o nízké hustotě
Lp(a) lipoprotein a
MRI magnetická rezonance
MTX methotrexát
NSA nesteroidní antirevmatika
oxLDL oxidovaný lipoprotein o nízké hustotě
PET pozitronová emisní tomografie.
PsA psoriatická artritida
RA revmatoidní artritida
RF revmatoidní faktor
RCT randomizovaná kontrolovaná studie
SCORE Systemic Coronary Risk Evaluation
SLE systémový lupus erythematodes
SSc systémová sklerodermie
TAG triglyceridy
TEE transezofageální echokardiografie
TNF-α tumor nekrotizující faktor alfa
TTE transthorakální echokardiografie
Adresa pro korespondenci:
MUDr. Sabína Oreská
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Tel.: 721 343 383
e-mail: oreska.sab@gmail.com
Sources
1. Libby P, Lichtman AH, Hansson GK. Immune effector mechanisms implicated in atherosclerosis: from mice to humans. Immunity 2013 Jun 27; 38(6): 1092–1104.
2. Murray CJ, Vos T, Lozano R et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012 Dec 15; 380(9859): 2197–2223.
3. Catapano AL, Reiner Z, De Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011 Jul; 217(1): 3–46.
4. Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 2005 Apr 21; 352(16): 1685–1695.
5. Anderson KM, Odell PM, Wilson PW, Kannel WB. Cardiovascular disease risk profiles. Am Heart J 1991 Jan; 121(1 Pt 2): 293–298.
6. Kerekes G, Soltesz P, Nurmohamed MT et al. Validated methods for assessment of subclinical atherosclerosis in rheumatology. Nature reviews Rheumatology 2012 Apr; 8(4): 224–234.
7. Emerging Risk Factors Collaboration; Kaptoge S, Di Angelantonio E, Lowe G et al. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis. Lancet 2010 Jan 9; 375(9709): 132–140.
8. Paul A, Yeh ET, Chan L. A proatherogenic role for C-reactive protein in vivo. Curr Opin Lipidol 2005 Oct; 16(5): 512–517.
9. Zwaka TP, Hombach V, Torzewski J. C-reactive protein-mediated low density lipoprotein uptake by macrophages: implications for atherosclerosis. Circulation 2001 Mar 6; 103(9): 1194–1197.
10. Kim SH, Lee CK, Lee EY et al. Serum oxidized low-density lipoproteins in rheumatoid arthritis. Rheumatol Int 2004 Jul; 24(4): 230–233.
11. Lopez-Mejias R, Genre F, Gonzalez-Juanatey C, Gonzalez-Gay MA. Autoantibodies and biomarkers of endothelial cell activation in atherosclerosis. Vasa 2014 Mar; 43(2): 83–85.
12. Libby P, Ridker PM, Hansson GK; Leducq Transatlantic Network on Atherotrombosis. Inflammation in atherosclerosis: from pathophysiology to practice. J Am Coll Cardiol 2009 Dec 1; 54(23): 2129–2138.
13. Libby P. Inflammation in atherosclerosis. Arterioscler Thromb Vasc Biol 2012 Sep; 32(9): 2045–2051.
14. Hansson GK, Robertson AK, Soderberg-Naucler C. Inflammation and atherosclerosis. Annu Rev Pathol 2006; 1 : 297–329.
15. Sherer Y, Tenenbaum A, Praprotnik S, Shemesh J et al. Coronary artery disease but not coronary calcification is associated with elevated levels of cardiolipin, beta-2-glycoprotein-I, and oxidized LDL antibodies. Cardiology 2001; 95(1): 20–24.
16. Inoue T, Uchida T, Kamishirado H et al. Antibody against oxidized low density lipoprotein may predict progression or regression of atherosclerotic coronary artery disease. J Am Coll Cardiol 2001 Jun 1; 37(7): 1871–1876.
17. Kobayashi K, Lopez LR, Matsuura E. Atherogenic antiphospholipid antibodies in antiphospholipid syndrome. Ann N Y Acad Sci 2007 Jun; 1108 : 489–496.
18. Hasunuma Y, Matsuura E, Makita Z et al. Involvement of beta 2-glycoprotein I and anticardiolipin antibodies in oxidatively modified low-density lipoprotein uptake by macrophages. Clin Exp Immunol 1997 Mar; 107(3): 569–573.
19. Jara LJ, Medina G, Vera-Lastra O, Amigo MC. Accelerated atherosclerosis, immune response and autoimmune rheumatic diseases. Autoimmun Rev 2006 Mar; 5(3): 195–201.
20. Gurlek A, Ozdol C, Pamir G et al. Association between anticardiolipin antibodies and recurrent cardiac events in patients with acute coronary syndrome. Int Heart J 2005 Jul; 46(4): 631–638.
21. Matsuura E, Kobayashi K, Inoue K et al. Oxidized LDL/beta2-glycoprotein I complexes: new aspects in atherosclerosis. Lupus 2005; 14(9): 736–741.
22. Grainger DJ, Bethell HW. High titres of serum antinuclear antibodies, mostly directed against nucleolar antigens, are associated with the presence of coronary atherosclerosis. Ann Rheum Dis 2002 Feb; 61(2): 110–114.
23. Liang KP, Kremers HM, Crowson CS et al. Autoantibodies and the risk of cardiovascular events. J Rheumatol 2009 Nov; 36(11): 2462–2469.
24. Majka DS, Chang RW. Is preclinical autoimmunity benign? The case of cardiovascular disease. Rheum Dis Clin North Am 2014 Nov; 40(4): 659–668.
25. Payne RA. Cardiovascular risk. Br J Clin Pharmacol 2012 Sep; 74(3): 396–410.
26. D'Agostino RB sr., Vasan RS, Pencina MJ et al. General cardiovascular risk profile for use in primary care: the Framingham Heart Study. Circulation 2008 Feb 12; 117(6): 743–753.
27. Donnan PT, Donnelly L, New JP, Morris AD. Derivation and validation of a prediction score for major coronary heart disease events in a U.K. type 2 diabetic population. Diabetes Care 2006 Jun; 29(6): 1231–1236.
28. Conroy RM, Pyorala K, Fitzgerald AP et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J 2003 Jun; 24(11): 987–1003.
29. Greenland P, Alpert JS, Beller GA et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation 2010 Dec 21; 122(25): 2748–2764.
30. Wasko MC. Comorbid conditions in patients with rheumatic diseases: an update. Curr Opin Rheumatol 2004 Mar; 16(2): 109–113.
31. Zinger H, Sherer Y, Shoenfeld Y. Atherosclerosis in autoimmune rheumatic diseases-mechanisms and clinical findings. Clin Rev Allergy Immunol 2009 Aug; 37(1): 20–28.
32. Amaya-Amaya J, Montoya-Sanchez L, Rojas-Villarraga A. Cardiovascular involvement in autoimmune diseases. Biomed Res Int 2014; 2014 : 367359.
33. Prasad M, Hermann J, Gabriel SE et al. Cardiorheumatology: cardiac involvement in systemic rheumatic disease. Nat Rev Cardiol 2015 Mar; 12(3): 168–176.
34. Sarmiento-Monroy JC, Amaya-Amaya J, Espinosa-Serna JS et al. Cardiovascular disease in rheumatoid arthritis: a systematic literature review in Latin America. Arthritis 2012; 2012 : 371909.
35. Ramonda R, Lo Nigro A, Modesti V et al. Atherosclerosis in psoriatic arthritis. Autoimmun Rev 2011 Oct; 10(12): 773–778.
36. Husni ME. Comorbidities in Psoriatic Arthritis. Rheum Dis Clin North Am 2015 Nov; 41(4): 677–698.
37. Goodson NJ, Brookhart AM, Symmons DP et al. Non-steroidal anti-inflammatory drug use does not appear to be associated with increased cardiovascular mortality in patients with inflammatory polyarthritis: results from a primary care based inception cohort of patients. Ann Rheum Dis 2009 Mar; 68(3): 367–372.
38. Peters MJ, Symmons DP, McCarey D et al. EULAR evidence-based recommendations for cardiovascular risk management in patients with rheumatoid arthritis and other forms of inflammatory arthritis. Ann Rheum Dis 2010 Feb; 69(2): 325–331.
39. Panoulas VF, Douglas KM, Stavropoulos-Kalinoglou A et al. Long-term exposure to medium-dose glucocorticoid therapy associates with hypertension in patients with rheumatoid arthritis. Rheumatology (Oxford) 2008 Jan; 47(1): 72–75.
40. Hallgren R, Berne C. Glucose intolerance in patients with chronic inflammatory diseases is normalized by glucocorticoids. Acta Med Scand 1983; 213(5): 351–355.
41. Nurmohamed MT, Heslinga M, Kitas GD. Cardiovascular comorbidity in rheumatic diseases. Nat Rev Rheumatol 2015 Dec; 11(12): 693–704.
42. Kawashiri SY, Kawakami A, Yamasaki S et al. Effects of the anti-interleukin-6 receptor antibody, tocilizumab, on serum lipid levels in patients with rheumatoid arthritis. Rheumatol Int 2011 Apr; 31(4): 451–456.
43. Micha R, Imamura F, Wyler von Ballmoos M et al. Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol 2011 Nov 1; 108(9): 1362–1370.
44. Westlake SL, Colebatch AN, Baird J et al. Tumour necrosis factor antagonists and the risk of cardiovascular disease in patients with rheumatoid arthritis: a systematic literature review. Rheumatology 2011 Mar; 50(3): 518–531.
45. Roubille C, Richer V, Starnino T et al. The effects of tumour necrosis factor inhibitors, methotrexate, non-steroidal anti-inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2015 Mar; 74(3): 480–489.
46. Daien CI, Duny Y, Barnetche T et al. Effect of TNF inhibitors on lipid profile in rheumatoid arthritis: a systematic review with meta-analysis. Ann Rheum Dis 2012 Jun; 71(6): 862–868.
47. Antohe JL, Bili A, Sartorius JA et al. Diabetes mellitus risk in rheumatoid arthritis: reduced incidence with anti-tumor necrosis factor alpha therapy. Arthritis Care Res (Hoboken) 2012 Feb; 64(2): 215–221.
48. Dixon WG, Watson KD, Lunt M, Hyrich KL, British Society for Rheumatology Biologics Register Control Centre Consortium; Silman AJ, Symmons DP; British Society for Rheumatology Biologics Register. Reduction in the incidence of myocardial infarction in patients with rheumatoid arthritis who respond to anti-tumor necrosis factor alpha therapy: results from the British Society for Rheumatology Biologics Register. Arthritis Rheum 2007 Sep; 56(9): 2905–2912.
49. Martin-Martinez MA, Gonzalez-Juanatey C, Castaneda S et al. Recommendations for the management of cardiovascular risk in patients with rheumatoid arthritis: scientific evidence and expert opinion. Semin Arthritis Rheum 2014 Aug; 44(1): 1–8.
50. Kaneko Y, Takeuchi T. A paradigm shift in rheumatoid arthritis over the past decade. Intern Med 2014; 53(17): 1895–1903.
51. Firestein GS. Evolving concepts of rheumatoid arthritis. Nature 2003 May 15; 423(6937): 356–361.
52. van Halm VP, Peters MJ, Voskuyl AE et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross-sectional study, the CARRE Investigation. Ann Rheum Dis 2009 Sep; 68(9): 1395–1400.
53. Sokolove J, Brennan MJ, Sharpe O et al. Brief report: citrullination within the atherosclerotic plaque: a potential target for the anti-citrullinated protein antibody response in rheumatoid arthritis. Arthritis Rheum 2013 Jul; 65(7): 1719–1724.
54. Chung CP, Oeser A, Avalos I et al. Utility of the Framingham risk score to predict the presence of coronary atherosclerosis in patients with rheumatoid arthritis. Arthritis Res Ther 2006; 8(6): R186.
55. Shoenfeld Y, Gerli R, Doria A et al. Accelerated atherosclerosis in autoimmune rheumatic diseases. Circulation 2005 Nov 22; 112(21): 3337–3347.
56. Gerli R, Bartoloni Bocci E, Sherer Y et al. Association of anti-cyclic citrullinated peptide antibodies with subclinical atherosclerosis in patients with rheumatoid arthritis. Ann Rheum Dis 2008 May; 67(5): 724–725.
57. van Halm VP, Nielen MM, Nurmohamed MT et al. Lipids and inflammation: serial measurements of the lipid profile of blood donors who later developed rheumatoid arthritis. Ann Rheum Dis 2007 Feb; 66(2): 184–188.
58. Munro R, Morrison E, McDonald AG et al. Effect of disease modifying agents on the lipid profiles of patients with rheumatoid arthritis. Ann Rheum Dis 1997 Jun; 56(6): 374–377.
59. Park YB, Choi HK, Kim MY et al. Effects of antirheumatic therapy on serum lipid levels in patients with rheumatoid arthritis: a prospective study. Am J Med 2002 Aug 15; 113(3): 188–193.
60. Boers M, Nurmohamed MT, Doelman CJ et al. Influence of glucocorticoids and disease activity on total and high density lipoprotein cholesterol in patients with rheumatoid arthritis. Ann Rheum Dis 2003 Sep; 62(9): 842–845.
61. Vis M, Nurmohamed MT, Wolbink G et al. Short term effects of infliximab on the lipid profile in patients with rheumatoid arthritis. J Rheumatol 2005 Feb; 32(2): 252–255.
62. Spanakis E, Sidiropoulos P, Papadakis J et al. Modest but sustained increase of serum high density lipoprotein cholesterol levels in patients with inflammatory arthritides treated with infliximab. J Rheumatol 2006 Dec; 33(12): 2440–2446.
63. Popa C, Netea MG, Radstake T et al. Influence of anti-tumour necrosis factor therapy on cardiovascular risk factors in patients with active rheumatoid arthritis. Ann Rheum Dis 2005 Feb; 64(2): 303–305.
64. Georgiadis AN, Papavasiliou EC, Lourida ES et al. Atherogenic lipid profile is a feature characteristic of patients with early rheumatoid arthritis: effect of early treatment – a prospective, controlled study. Arthritis Res Ther 2006; 8(3): R82.
65. Popa C, van den Hoogen FH, Radstake TR et al. Modulation of lipoprotein plasma concentrations during long term anti-TNF therapy in patients with active rheumatoid arthritis. Ann Rheum Dis 2007 Nov; 66(11): 1503–1507.
66. Peters MJ, Vis M, van Halm VP et al. Changes in lipid profile during infliximab and corticosteroid treatment in rheumatoid arthritis. Ann Rheum Dis 2007 Jul; 66(7): 958–961.
67. Boumpas DT, Austin HA 3rd, Fessler BJ et al. Systemic lupus erythematosus: emerging concepts. Part 1: Renal, neuropsychiatric, cardiovascular, pulmonary, and hematologic disease. Ann Intern Med 1995 Jun 15; 122(12): 940–950.
68. Boumpas DT, Fessler BJ, Austin HA, 3rd et al. Systemic lupus erythematosus: emerging concepts. Part 2: Dermatologic and joint disease, the antiphospholipid antibody syndrome, pregnancy and hormonal therapy, morbidity and mortality, and pathogenesis. Ann Intern Med 1995 Jul 1; 123(1): 42–53.
69. Bertsias G, Ioannidis JP, Boletis J et al. EULAR recommendations for the management of systemic lupus erythematosus. Report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics. Ann Rheum Dis 2008 Feb; 67(2): 195–205.
70. Schoenfeld SR, Kasturi S, Costenbader KH. The epidemiology of atherosclerotic cardiovascular disease among patients with SLE: a systematic review. Semin Arthritis Rheum 2013 Aug; 43(1): 77–95.
71. de Carvalho JF, Bonfa E, Borba EF. Systemic lupus erythematosus and "lupus dyslipoproteinemia". Autoimmun Rev 2008 Jan; 7(3): 246–250.
72. Roman MJ, Shanker BA, Davis A et al. Prevalence and correlates of accelerated atherosclerosis in systemic lupus erythematosus. N Engl J Med 2003 Dec 18; 349(25): 2399–2406.
73. Plazak W, Gryga K, Milewski M et al. Association of heart structure and function abnormalities with laboratory findings in patients with systemic lupus erythematosus. Lupus 2011 Aug; 20(9): 936–944.
74. Gustafsson JT, Simard JF, Gunnarsson I et al. Risk factors for cardiovascular mortality in patients with systemic lupus erythematosus, a prospective cohort study. Arthritis Res Ther 2012; 14(2): R46.
75. Ogdie A, Weiss P. The epidemiology of psoriatic arthritis. Rheum Dis Clin North Am 2015 Nov; 41(4): 545–568.
76. Mok CC, Ko GT, Ho LY et al. Prevalence of atherosclerotic risk factors and the metabolic syndrome in patients with chronic inflammatory arthritis. Arthritis Care Res (Hoboken) 2011 Feb; 63(2): 195–202.
77. Oliviero F, Sfriso P, Baldo G et al. Apolipoprotein A-I and cholesterol in synovial fluid of patients with rheumatoid arthritis, psoriatic arthritis and osteoarthritis. Clin Exp Rheumatol 2009 Jan-Feb; 27(1): 79–83.
78. Kimhi O, Caspi D, Bornstein NM et al. Prevalence and risk factors of atherosclerosis in patients with psoriatic arthritis. Semin Arthritis Rheum 2007 Feb; 36(4): 203–209.
79. Angel K, Provan SA, Gulseth HL et al. Tumor necrosis factor-alpha antagonists improve aortic stiffness in patients with inflammatory arthropathies: a controlled study. Hypertension 2010 Feb; 55(2): 333–338.
80. Allcock RJ, Forrest I, Corris PA et al. A study of the prevalence of systemic sclerosis in northeast England. Rheumatology 2004 May; 43(5): 596–602.
81. Guiducci S, Giacomelli R, Cerinic MM. Vascular complications of scleroderma. Autoimmun Rev 2007 Sep; 6(8): 520–523.
82. Belch JJ, McSwiggan S, Lau C. Macrovascular disease in systemic sclerosis: the tip of an iceberg? Rheumatology 2008 Oct; 47(Suppl. 5): v16–17.
83. Hettema ME, Bootsma H, Kallenberg CG. Macrovascular disease and atherosclerosis in SSc. Rheumatology 2008 May; 47(5): 578–583.
84. Belloli L, Carlo-Stella N, Ciocia G et al. Myocardial involvement in systemic sclerosis. Rheumatology 2008 Jul; 47(7): 1070–1072.
85. Sulli A, Ghio M, Bezante GP et al. Blunted coronary flow reserve in systemic sclerosis. Rheumatology 2004 Apr; 43(4): 505–509.
86. Bartoli F, Blagojevic J, Bacci M et al. Flow-mediated vasodilation and carotid intima-media thickness in systemic sclerosis. Ann N Y Acad Sci 2007 Jun; 1108 : 283–290.
87. Stafford L, Englert H, Gover J, Bertouch J. Distribution of macrovascular disease in scleroderma. Ann Rheum Dis 1998 Aug; 57(8): 476–479.
88. Szucs G, Timar O, Szekanecz Z et al. Endothelial dysfunction precedes atherosclerosis in systemic sclerosis – relevance for prevention of vascular complications. Rheumatology 2007 May; 46(5): 759–762.
89. Borba EF, Borges CT, Bonfa E. Lipoprotein profile in limited systemic sclerosis. Rheumatology international 2005 Jun; 25(5): 379–383.
90. Herrick AL, Illingworth KJ, Hollis S et al. Antibodies against oxidized low-density lipoproteins in systemic sclerosis. Rheumatology 2001 Apr; 40(4): 401–405.
91. Fatini C, Guiducci S, Abbate R, Matucci-Cerinic M. Vascular injury in systemic sclerosis: angiotensin-converting enzyme insertion/deletion polymorphism. Curr Rheumatol Rep 2004 Apr; 6(2): 149–155.
92. Bohan A, Peter JB. Polymyositis and dermatomyositis (first of two parts). N Engl J Med 1975 Feb 13; 292(7): 344–347.
93. Bohan A, Peter JB. Polymyositis and dermatomyositis (second of two parts). N Engl J Med 1975 Feb 20; 292(8): 403–407.
94. Findlay AR, Goyal NA, Mozaffar T. An overview of polymyositis and dermatomyositis. Muscle Nerve 2015 May; 51(5): 638–656.
95. Ungprasert P, Suksaranjit P, Spanuchart I et al. Risk of coronary artery disease in patients with idiopathic inflammatory myopathies: a systematic review and meta-analysis of observational studies. Semin Arthritis Rheum 2014 Aug; 44(1): 63–67.
96. Linos E, Fiorentino D, Lingala B et al. Atherosclerotic cardiovascular disease and dermatomyositis: an analysis of the Nationwide Inpatient Sample survey. Arthritis Res Ther 2013; 15(1): R7.
97. de Moraes MT, de Souza FH, de Barros TB, Shinjo SK. Analysis of metabolic syndrome in adult dermatomyositis with a focus on cardiovascular disease. Arthritis Care Res (Hoboken) 2013 May; 65(5): 793–799.
98. Limaye VS, Lester S, Blumbergs P, Roberts-Thomson PJ. Idiopathic inflammatory myositis is associated with a high incidence of hypertension and diabetes mellitus. Int J Rheum Dis 2010 May; 13(2): 132–137.
99. Agca R, Heslinga SC, Rollefstad S et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2016 Oct 3, pii: annrheumdis-2016-209775 [Epub ahead of print].
100. Kawai VK, Chung CP, Solus JF et al. The ability of the 2013 American College of Cardiology/American Heart Association cardiovascular risk score to identify rheumatoid arthritis patients with high coronary artery calcification scores. Arthritis Rheumatol 2015 Feb; 67(2): 381–385.
101. Tournadre A, Tatar Z, Pereira B et al. Application of the European Society of Cardiology, Adult Treatment Panel III and American College of Cardiology/American Heart Association guidelines for cardiovascular risk management in a French cohort of rheumatoid arthritis. Int J Cardiol 2015 Mar 15; 183 : 149–154.
102. Ward MM. Recent improvements in survival in patients with rheumatoid arthritis: better outcomes or different study designs? Arthritis Rheum 2001 Jun; 44(6): 1467–1469.
103. Innala L, Moller B, Ljung L et al. Cardiovascular events in early RA are a result of inflammatory burden and traditional risk factors: a five year prospective study. Arthritis Res Ther 2011; 13(4): R131.
104. Myasoedova E, Crowson CS, Nicola PJ et al. The influence of rheumatoid arthritis disease characteristics on heart failure. J Rheumatol 2011 Aug; 38(8): 1601–1606.
105. Lopez-Longo FJ, Oliver-Minarro D, de la Torre I et al. Association between anti-cyclic citrullinated peptide antibodies and ischemic heart disease in patients with rheumatoid arthritis. Arthritis Rheum 2009 Apr 15; 61(4): 419–424.
106. Gomez-Vaquero C, Robustillo M, Narvaez J et al. Assessment of cardiovascular risk in rheumatoid arthritis: impact of the new EULAR recommendations on the score cardiovascular risk index. Clin Rheumatol 2012 Jan; 31(1): 35–39.
107. Greenland P, Alpert JS, Beller GA et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2010 Dec 14; 56(25): e50–103.
108. Vlachopoulos C, Aznaouridis K, Terentes-Printzios D et al. Prediction of cardiovascular events and all-cause mortality with brachial-ankle elasticity index: a systematic review and meta-analysis. Hypertension 2012 Aug; 60(2): 556–562.
109. Stein JH, Korcarz CE, Hurst RT et al. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Endorsed by the Society for Vascular Medicine. J Am Soc Echocardiogr 2008 Feb; 21(2): 93–111; quiz 189–190.
110. McCarey DW, McInnes IB, Madhok R et al. Trial of Atorvastatin in Rheumatoid Arthritis (TARA): double-blind, randomised placebo-controlled trial. Lancet 2004 Jun 19; 363(9426): 2015–2021.
111. Choi HK, Hernan MA, Seeger JD et al. Methotrexate and mortality in patients with rheumatoid arthritis: a prospective study. Lancet 2002 Apr 6; 359(9313): 1173–1177.
112. Jacobsson LT, Turesson C, Gulfe A et al. Treatment with tumor necrosis factor blockers is associated with a lower incidence of first cardiovascular events in patients with rheumatoid arthritis. J Rheumatol 2005 Jul; 32(7): 1213–1218.
113. van Halm VP, Nurmohamed MT, Twisk JW et al. Disease-modifying antirheumatic drugs are associated with a reduced risk for cardiovascular disease in patients with rheumatoid arthritis: a case control study. Arthritis Res Ther 2006; 8(5): R151.
114. Naranjo A, Sokka T, Descalzo MA et al. Cardiovascular disease in patients with rheumatoid arthritis: results from the QUEST-RA study. Arthritis Res Ther 2008; 10(2): R30.
115. Symmons DP, Jones MA, Scott DL, Prior P. Longterm mortality outcome in patients with rheumatoid arthritis: early presenters continue to do well. J Rheumatol 1998 Jun; 25(6): 1072–1077.
116. Bavry AA, Khaliq A, Gong Y et al. Harmful effects of NSAIDs among patients with hypertension and coronary artery disease. Am J Med 2011 Jul; 124(7): 614–620.
117. Ruyssen-Witrand A, Fautrel B, Saraux A et al. Cardiovascular risk induced by low-dose corticosteroids in rheumatoid arthritis: a systematic literature review. Joint Bone Spine 2011 Jan; 78(1): 23–30.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- 15 let zkušeností s biologickou léčbou zánětlivých revmatických onemocnění v národním registru ATTRA
- Časná diagnostika spondyloartritid
- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
- Kardiovaskulární riziko u revmatických onemocnění
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika monoartritid
- Osteoartróza ručních kloubů
- Raynaudův fenomén
- Imunitně zprostředkovaná nekrotizující myopatie asociovaná s léčbou statiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

