-
Medical journals
- Career
Osteoartróza ručních kloubů
: prof. MUDr. Ph.D. Ladislav Šenolt
: Revmatologický ústav: Na Slupi 4, 128 50 Praha 2
: Čas. Lék. čes. 2016; 155: 305-309
: Review Article
Osteoartróza (OA) ručních kloubů je velmi časté chronické onemocnění způsobující bolest a omezení hybnosti zasažených kloubů. Prevalence choroby vzrůstá s věkem, častější postihuje ženy. Klinické příznaky se obvykle neshodují s rentgenovým nálezem − symptomatická OA ručních kloubů postihuje přibližně 2−6 % dospělých jedinců, ale rentgenově ji lze prokázat až u dvou třetin žen a poloviny mužů starších 55 let. Průběh nemoci se mezi jednotlivými pacienty liší. OA ručních kloubů je heterogenní onemocnění, nejčastější je nodální forma postihující interfalangeální klouby, při postižení kořenového kloubu palce hovoříme o rizartróze. Specifický podtyp představuje erozivní OA, která je charakterizována opakovanými zánětlivými iritacemi kloubů, je spojena s větší bolestí, funkčním omezením a erozivními změnami na rentgenu.
Osteoartróza (OA) ručních kloubů je velmi časté chronické onemocnění způsobující bolest a omezení hybnosti zasažených kloubů. Prevalence choroby vzrůstá s věkem, častější postihuje ženy. Klinické příznaky se obvykle neshodují s rentgenovým nálezem − symptomatická OA ručních kloubů postihuje přibližně 2−6 % dospělých jedinců, ale rentgenově ji lze prokázat až u dvou třetin žen a poloviny mužů starších 55 let.
Průběh nemoci se mezi jednotlivými pacienty liší. OA ručních kloubů je heterogenní onemocnění, nejčastější je nodální forma postihující interfalangeální klouby, při postižení kořenového kloubu palce hovoříme o rizartróze. Specifický podtyp představuje erozivní OA, která je charakterizována opakovanými zánětlivými iritacemi kloubů, je spojena s větší bolestí, funkčním omezením a erozivními změnami na rentgenu.
Léčebné možnosti OA ručních kloubů jsou omezené. Jedinou možností jak ovlivnit symptomy jsou analgetika a nesteroidní antirevmatika. Nové poznatky v patogenezi onemocnění by měly přispět k vývoji účinné léčby OA ručních kloubů.Klíčová slova:
osteoartróza ručních kloubů, rizartróza, erozivní poškozeníÚvod
Osteoartróza (OA) je velmi častou příčinou bolesti a funkčního omezení. Představuje pomalý, ale trvale progresivní proces, který vede k úbytku hyalinní chrupavky, změnám v subchondrální kosti, tvorbě osteofytů, zánětlivé iritaci synoviální tkáně a svalové slabosti (1). Příčina onemocnění dosud není zcela objasněna, přijímána je multifaktoriální etiologie, na které se podílí stárnutí populace, mechanické faktory a reparativní odpověď organismu s aktivací imunitních buněk (2, 3).
OA ručních kloubů představuje jedno z opomíjených onemocnění, které se vyskytuje poměrně často, přibývá s věkem a častěji postihuje ženy (4, 5). V tomto přehledovém článku budou diskutovány diagnostika OA ručních kloubů, její prevalence a rizikové faktory, klinické příznaky a průběh onemocnění, jednotlivé podtypy nemoci a léčebné možnosti.
Diagnostika OA ručních kloubů
OA ručních kloubů představuje heterogenní onemocnění (5), které zpravidla postihuje více ručních kloubů a kromě bolesti vede k jejich zvětšení a rozvoji deformit (viz obr. 1). Často se projevuje jako nodální OA − postihuje distální interfalangeální (DIP) a proximální interfalangeální (PIP) klouby známé jako Heberdenovy a Bouchardovy uzly. Tyto změny bývají zpravidla klinicky rozpoznatelné a pomocí rentgenových snímků jednoduše zobrazitelné.
1. Osteoartróza (OA) kloubů ruky. Variabilní průběh nemoci mezi jednotlivými pacienty, tvorba uzlů v distálních a proximálních interfalangeálních kloubech a rozvoj těžkých kloubních deformit včetně kvadratizace kořenového kloubu palce u erozivní formy onemocnění (z archivu autora). 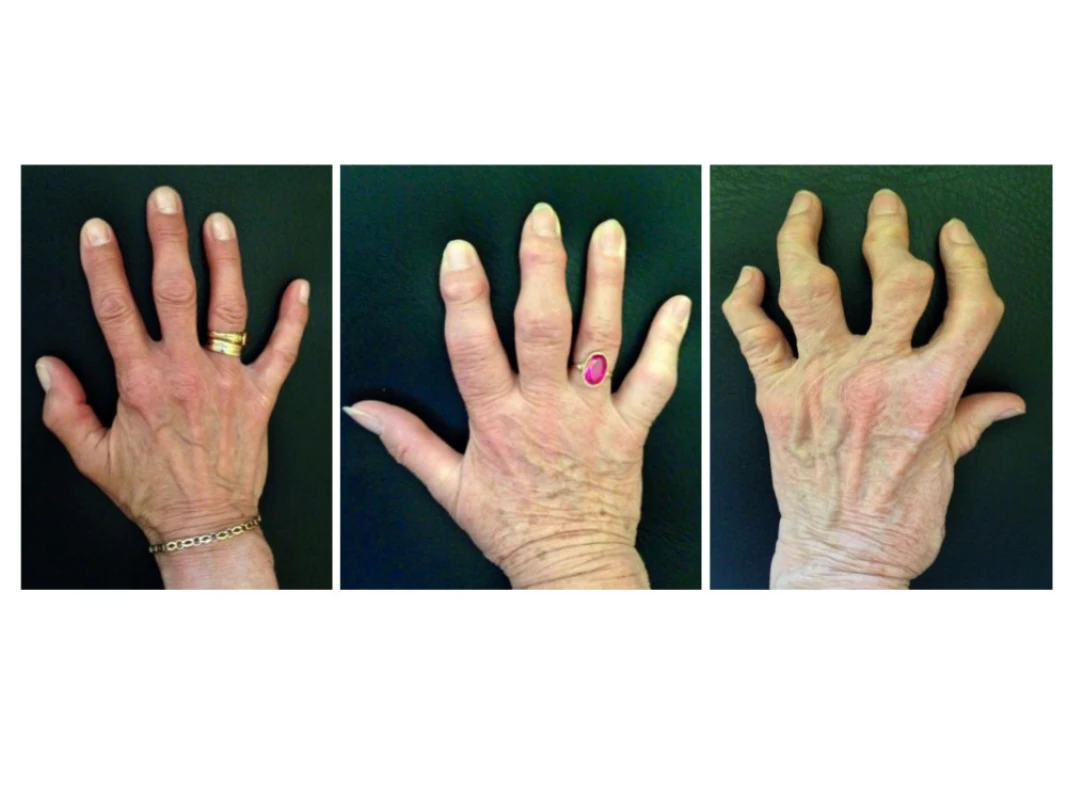
Typické artrotické změny se nemusejí vždy projevit bolestí, ztuhlostí nebo sníženou hybností, navíc mezi rentgenovým nálezem a symptomy onemocnění neexistuje přímý vztah. Klouby zároveň nebývají postiženy rovnoměrně, nejčastěji bývají zasaženy DIP klouby a nejméně často metakarpofalangeální (MCP) klouby (4). Onemocnění je zpravidla symetrické polyartikulární, často je postiženo více PIP, DIP a případně MCP kloubů; nejméně časté je postižení paprsčité, kdy jsou zasaženy jen klouby na jednom prstu.
Nejčastěji se pro diagnostiku OA ručních kloubů využívají doporučení Evropské ligy proti revmatismu (EULAR) a klasifikační kritéria Americké revmatologické asociace (ACR) (6, 7). První doporučení lépe napomáhají při diagnostice onemocnění v běžné klinické praxi a umožňují klasifikaci několika podtypů OA (viz tab. 1). Kritéria ACR nacházejí své využití spíše pro účely klinických studií (viz obr. 2).
1. Doporučení Evropské ligy proti revmatismu (EULAR) pro klinickou diagnostiku osteoartrózy (OA) ručních kloubů <em>(upraveno dle: Zhang et al., 2009)</em> 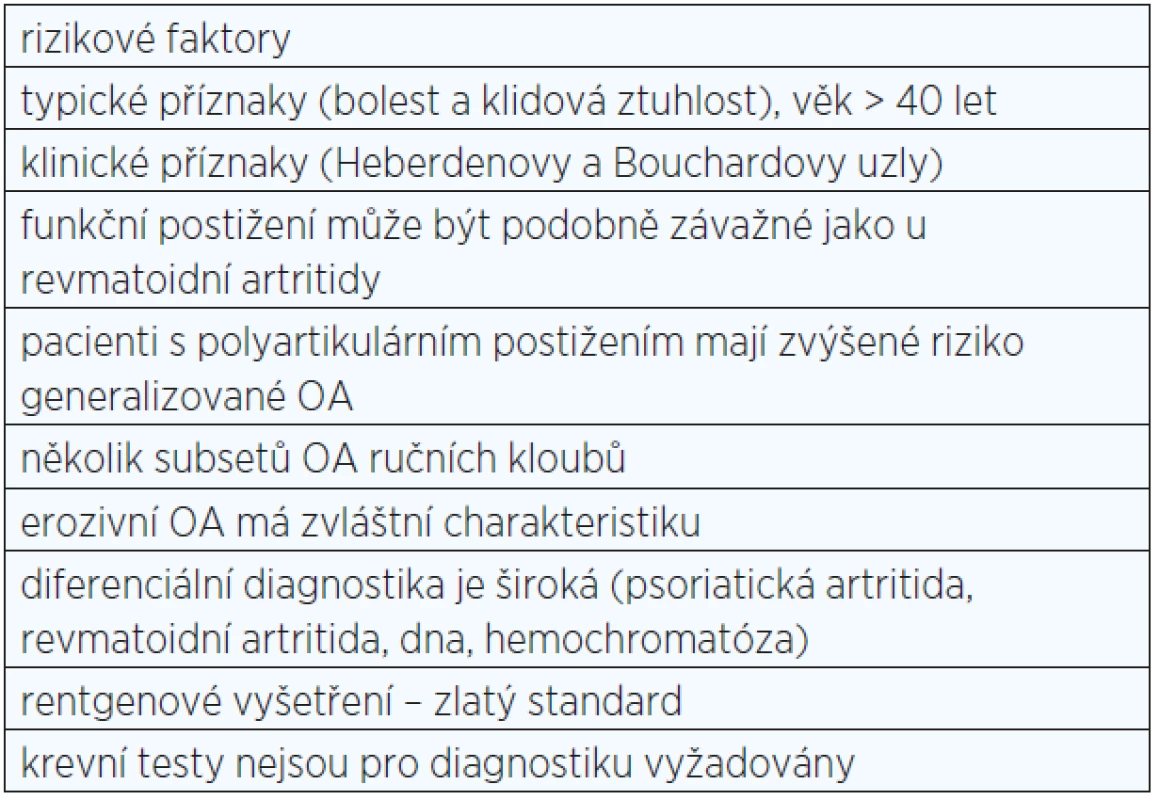
2. Klasifikační kritéria osteoartrózy (OA) rukou podle Americké revmatologické asociace <em>(upraveno dle: Altman et al., 1990)</em> 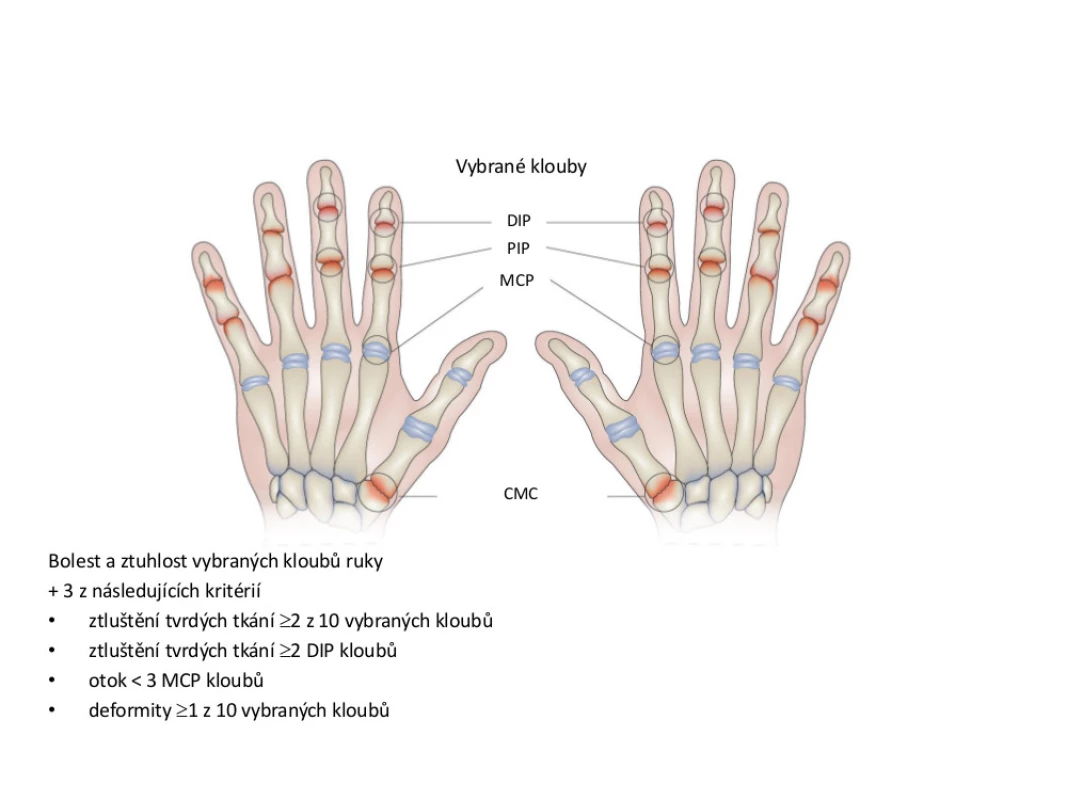
Je třeba zdůraznit, že diagnostika onemocnění je klinická, žádné z kritérií nevyžaduje nutnost provedení rentgenového vyšetření nebo krevních testů pro definitivní určení diagnózy OA ručních kloubů.
Prevalence
Prevalence OA obecně záleží na použité definici onemocnění, věku, pohlaví a zároveň na hodnocené populaci. Rentgenová definice OA implikuje nejvyšší prevalenci onemocnění, nejčastěji jsou postiženy DIP klouby, poté kolena a kyčle (8). Rentgenově prokázaná OA ručních kloubů postihuje až dvě třetiny žen a polovinu mužů starších 55 let. V jedné starší nizozemské studii bylo artrotické postižení DIP kloubů zjištěno u 75 % žen mezi 60. a 70. rokem věku, přičemž ve stejné práci bylo prokázáno artrotické postižení na kloubech rukou nebo nohou dokonce až u 20 % jedinců mladších 40 let (9).
Naopak prevalence symptomatické OA ručních kloubů je podstatně nižší než rentgenově definované formy nemoci. Symptomatická OA ručních kloubů se podle kritérií ACR vyskytuje u 2−6 % dospělých jedinců a u více než 20 % jedinců starších 70 let (8).
Rizikové faktory
Existuje několik rizikových faktorů pro rozvoj OA ručních kloubů (viz tab. 2). Nejdůležitějším rizikovým faktorem je věk. Symptomatická OA ručních kloubů se u jedinců mladších 40 let vyskytuje zřídka, její výskyt strmě stoupá u jedinců starších 50 let, a to převážně u žen (10).
2. Rizikové faktory osteoartrózy (OA) ručních kloubů 
Rodinná anamnéza je ze všech podtypů OA nejsilnějším rizikovým faktorem pro rozvoj Heberdenových uzlů. Genetická zátěž pro OA ručních kloubů představuje téměř 60 % (11). Nicméně studium polymorfismu genů OA ručních kloubů neposkytuje konzistentní výsledky. Dosud byly provedeny dvě rozsáhlé celogenomové asociační studie. V první byl na několika populacích jedinců s OA ručních kloubů prokázán jednonukleotidový polymorfismus genu pro FOX1 RNA vazebný protein (RBFOX1, známý také jako ataxin 2 vazebný protein) (12) a ve druhé pak polymorfismus genu pro oligomerní komponentu Golgiho komplexu 5 (COG5) (13). Zvýšené riziko rozvoje OA ručních kloubů bylo popsáno i pro polymorfismus genů některých proteinů hyalinní chrupavky, např. genu pro matrilin 3 (nekolagenní extracelulární oligomerní matrixový protein), pro kolagen typu II (COL2A1) nebo agrekan, případně pro interleukin 1 (IL-1) nebo transformující růstový faktor beta (TGF-β) a další (12, 13).
Významné riziko rozvoje OA ručních kloubů představuje opakované a nadměrné přetěžování kloubů využívající silné úchopy a sevření prstů. Podle profesního zaměření se často jedná o přadleny, šičky, těžce manuálně pracující lidi, ale také například stomatology (14). V těchto případech hraje podstatnou roli interakce zevních faktorů s genetickou predispozicí. Dalším rizikem může být například poranění ruky nebo laxita (rozvolnění) vazů.
Obezita představuje známý rizikový faktor rozvoje gonartrózy, nicméně více než dvojnásobně zvyšuje také riziko rozvoje OA ručních kloubů (15). Protože se při OA ručních kloubů neuplatňují (tak jako u nosných kloubů) biomechanické vlivy, předpokládá se působení metabolických faktorů, zejména působků tukové tkáně, tzv. adipokinů (16).
Klinické příznaky a průběh onemocnění
Charakteristickými příznaky OA ručních kloubů jsou bolest, obvykle při zatížení, a krátká ranní ztuhlost v postižených prstech. Bolest je variabilní, mění se v čase a je zpravidla intermitentní. Nejčastěji bývají bolestivé DIP klouby a kořenové klouby palců (rizartróza). OA ručních kloubů je stále považována za nezávažné, mírné onemocnění. V některých případech jsou bolest, omezení úchopu a hybnosti, včetně zhoršení kvality života tak značné, že často bývají přirovnávány k těm u revmatoidní artritidy (17). Onemocnění navíc může představovat významný estetický problém (viz obr. 1). Mezi jednotlivými pacienty se obtíže velmi často liší, a jak bylo zmíněno výše, symptomy nebývají přímo závislé na rentgenovém nálezu. Bolest je však často asociována s přítomností synoviálního zánětu a edému kostní dřeně na magnetické rezonanci, nicméně se nezdá, že by snížení těchto parametrů vedlo k potlačení bolesti (18, 19).
Progrese OA ručních kloubů je zpravidla pomalá. Symptomatickou progresi v intervalu 3−8 let uvádí polovina jedinců, přičemž čtvrtina popisuje naopak zmírnění symptomů, které lze pravděpodobně přičíst adaptaci na chronický stav (5). Po 10 letech mají téměř všichni pacienti nové osteofyty a tři čtvrtiny mají další zúžení kloubní štěrbiny (20). V některých případech může být rentgenová progrese patrna již po 2 letech (21). Mezi rizikové faktory rentgenové progrese patří síla stisku u mužů, časná menopauza u žen, scintigrafická aktivita, vstupní bolest, počet uzlů a erozivní postižení. Strukturální progrese OA ručních kloubů významně závisí na intenzitě synoviálního zánětu a edému kostní dřeně na MRI rukou (22).
Podtypy OA ručních kloubů
Existuje několik podtypů OA ručních kloubů. Rozeznává se typická nodální forma onemocnění, v některých případech také nenodální. Relativně častá je rizartróza, méně častou je erozivní varianta OA. V některých případech je OA ručních kloubů součástí generalizované OA, která postihuje více kloubních oblastí.
OA karpometakarpálního kloubu palce
Karpometakarpální kloub palce (CMC1) bývá postižen OA poměrně často a zpravidla doprovází artrotické postižení ostatních kloubů ruky. Projevuje se bolestí, palpační citlivostí a omezenou hybnosti v kořenovém kloubu palce. Postižený kloub bývá zvětšený, často je přítomná kvadratizace kloubu. Při rentgenovém vyšetření lze prokázat typické artrotické projevy (viz obr. 3), tedy osteofyty, zúžení kloubní štěrbiny, sklerotizace a cysty. Při OA kloubů ruky se na bolesti a funkčním omezení nejvíce podílí právě artrotické postižení CMC1 kloubu (23).
3. Rentgenový snímek osteoartrózy karpometakarpálního kloubu palce (rizartróza). Šipka ukazuje na osteofyt, přítomné obvykle bývají zúžení kloubní štěrbiny, sklerotizace a cysty. 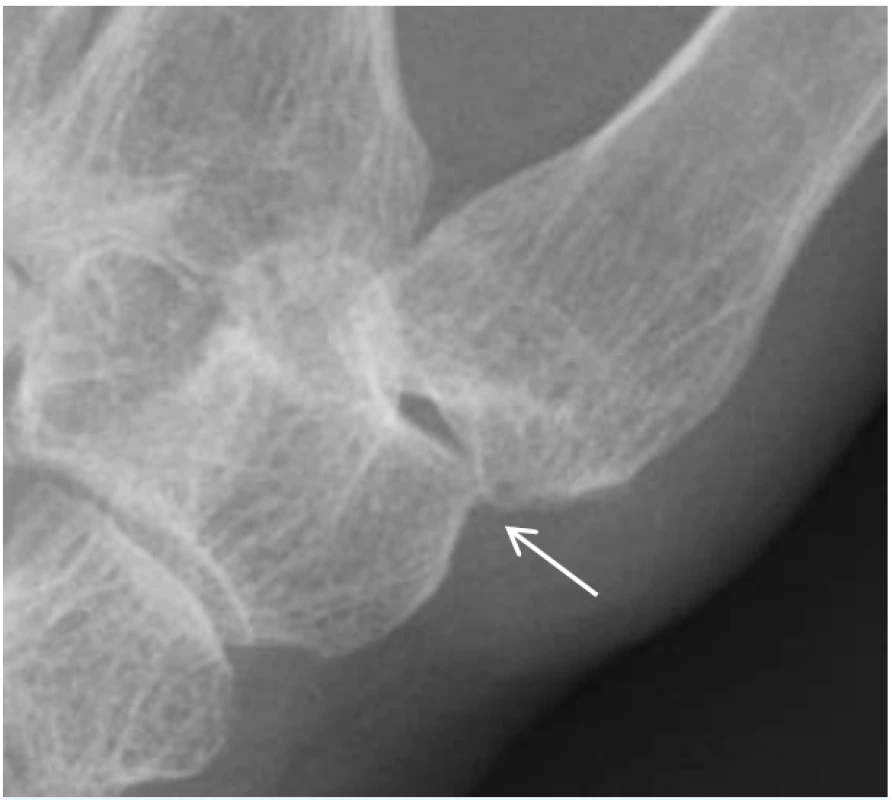
Výskyt OA v CMC1 kloubu je poměrně častý, při rentgenovém vyšetření lze prokázat u více než třetiny jedinců starších 55 let (4). Klinicky významná a symptomatická OA v CMC1 kloubu postihuje 1,4 % dospělé populace, přičemž ženy bývají postiženy 3−4× častěji než muži (24). Onemocnění je častější ve vyšším věku a podobně jako u nodální OA ručních kloubů mají významný vliv mechanické faktory (25), zvažuje se role hypermobility a obezity. Zvýšené riziko OA v CMC1 kloubu je u jedinců s mutací v genu pro matrilin 3 (13).
Erozivní OA ručních kloubů
Erozivní OA ručních kloubů je proti neerozivní formě nemoci častěji provázena zánětlivými epizodami u interfalangeálních kloubů a je charakterizována tvorbou erozivních změn. Nejčastěji jsou postiženy DIP klouby, méně často PIP klouby, může být přítomná synovitida a při zánětlivé iritaci může být kloub lehce načervenalý. Pro rentgenové vyšetření jsou charakteristické centrální eroze (tzv. křídla racka) a kolaps subchondrální kosti, přítomné jsou zpravidla zúžení kloubní štěrbiny a subchondrální sklerotizace (viz obr. 4).
4. Rentgenové snímky osteoartrózy (OA) ručních kloubů. Počínající Heberdenovy uzly a zúžení kloubní štěrbiny v proximálním interfalangeálním kloubu (a). Erozivní OA postihující distální interfalangeální klouby s charakteristickým projevem centrální eroze (křídla racka) a kolapsem subchondrální kosti (b, c) <em>(z archivu autora).</em> 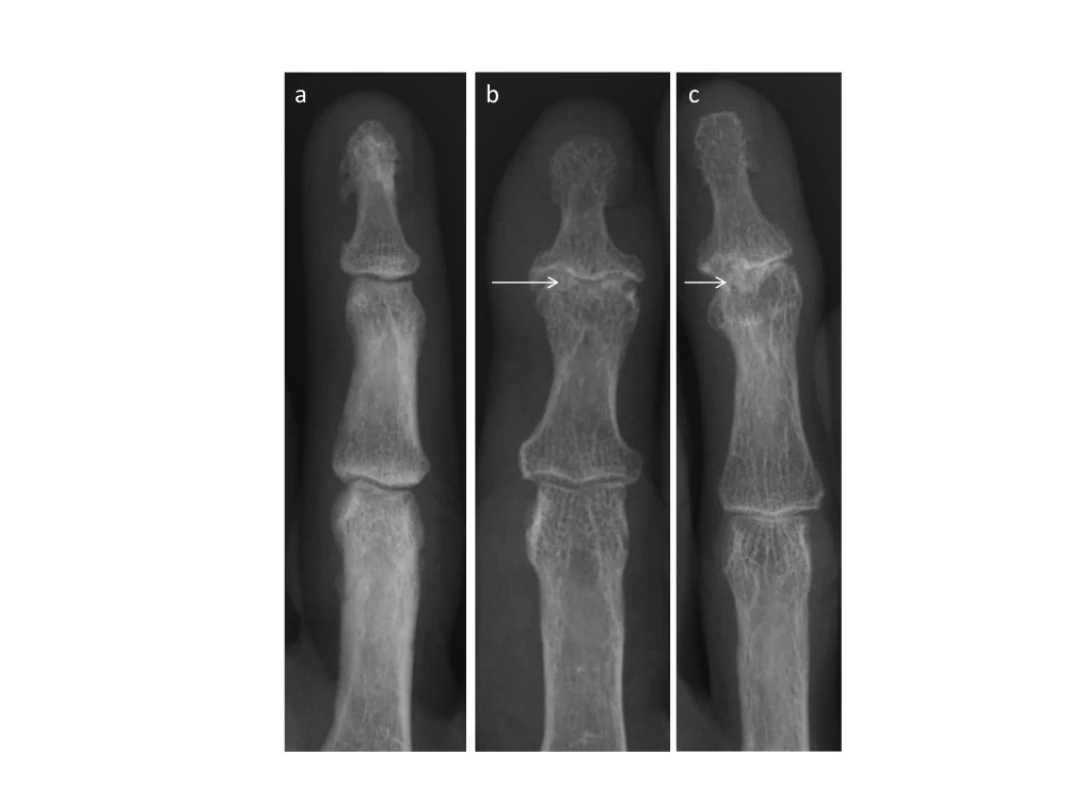
Pacienti s erozivní OA udávají větší bolest, mají horší funkční schopnost, omezenou hybnost a větší nespokojenost s estetickými projevy nemoci (16). Zpravidla bývá zasaženo více interfalangeálních kloubů. Na bolesti se účastní větší počet nodozit, které jsou častější u pacientů s erozivní OA (26). Bolest je navíc způsobena edémem kostní dřeně a synovitidou (27). Častěji dochází k progresi nemoci − bylo prokázáno, že čtvrtina jedinců s neerozivní OA progreduje v průběhu 6 let do erozivní formy nemoci (28). Při ultrazvukovém vyšetření bylo zjištěno, že neerozivní klouby jsou u pacientů s erozivní OA více postiženy synoviálním zánětem v porovnání s klouby u neerozivní OA (29). Ultrazvukové zánětlivé změny jsou během času většinou stabilní, ale liší se zpravidla na úrovni jednotlivých kloubů.
Největší vliv na progresi mají převážně lokální faktory – bolest a zúžení kloubní štěrbiny, nikoliv např. hladina CRP (29). Erozivní klouby jsou více zasaženy zánětem než neerozivní, přičemž existuje pozitivní vztah mezi tloušťkou synovie, aktivní synovitidou a palpačně bolestivými klouby (28). Nedávno bylo prokázáno, že progrese erozivního poškození kloubů je významně podpořena právě probíhajícím synoviálním zánětem (30).
Termín erozivní OA byl poprvé užit před 50 lety a pro přítomnost zánětlivých epizod bylo toto onemocnění označováno některými autory také jako zánětlivá OA (31). Na podkladě rozsáhlé epidemiologické studie byla pro erozivní OA nedávno prokázána prevalence 2,8 % u jedinců starších 55 let (32). Při přítomnosti symptomatické formy nemoci se erozivní postižení popisuje u 10,2 % nemocných a v rámci specializovaných pracovišť se prevalence erozivní formy nemoci zvyšuje na 25 % u jedinců s OA ručních kloubů (33, 34). Z vlastních zkušeností lze odhadnout, že na vysoce specializovaných (terciárních) pracovištích je mezi symptomatickými pacienty s OA ručních kloubů záchyt jedinců s erozivní formou nemoci až kolem 50 %.
Rizikové faktory pro erozivní OA jsou podobné jako u nodální formy onemocnění, výskyt stoupá s věkem, častěji jsou postiženy ženy, určité riziko přináší také nadváha a je popsán rodinný výskyt onemocnění (33). Genetické riziko pak představuje zejména polymorfismus v genu pro interleukin 1 (IL-1) nebo přítomnost alely HLA-BRB1*07 (34). U pacientů s erozivní OA se v posledních letech poukazuje na zvýšený výskyt metabolického syndromu, zejména dyslipidemie (33). V patogenezi erozivní OA tak lze zvažovat roli aktivovaných imunitních buněk a systémových metabolických faktorů. Neexistuje proto jednotný názor, jestli erozivní OA představuje závažnější variantu nodální OA, nebo odlišnou jednotku (35).
Léčba
Doposud stále chybí efektivní terapie OA ručních kloubů, která by dokázala ovlivnit kloubní struktury tak, aby došlo k zastavení rentgenové progrese a ke zlepšení funkčního postižení, včetně významné úlevě od bolesti (36).
Důležitá je kombinace nefarmakologického a farmakologického přístupu. Základem nefarmakologické léčby je cílená edukace, domácí cvičení a aplikace tepla (např. parafin), v některých případech může být účinné noční dlahování DIP kloubů.
Analgetika a nesteroidní antirevmatika (NSA) mají symptomatický účinek. Aplikace intraartikulárního glukokortikoidu do interfalangeálních kloubů je za některých situací vhodná, většinou snižuje otok a tlumí bolest kloubu (37). U OA ručních kloubů není mnoho klinických studií podporujících účinnost pomalu působících symptomatických léků na OA (SYSADOA − symptomatic slow acting drugs for osteoarthritis), dříve známých jako chondroprotektiva. V léčbě bolesti a funkce u pacientů se symptomatickou OA ručních kloubů byl prokázán účinek jen pro chondroitinsulfát (38). Methotrexát nebo antimalarika, která se užívají k léčbě revmatoidní artritidy, nemají při léčbě OA ručních kloubů zpravidla dostatečný efekt. Zkoušely se dokonce i biologické léky blokující TNF, které také nemají symptomatický účinek, ale v subpopulaci pacientů s erozivní OA a přítomností synovitidy mohou zpomalit strukturální progresi (39, 40).
V některých případech je možností léčba chirurgická, například déza DIP kloubů.
Závěr
Osteoartróza je velmi časté muskuloskeletální onemocnění, jehož výskyt se bude se stárnutím populace nadále zvyšovat. Projevuje se bolestí, funkčním omezením a zpravidla pozvolnou progresí. Průběh onemocnění je mezi jednotlivými pacienty variabilní a některé podtypy OA ručních kloubů, například erozivní OA nebo rizartróza, mají závažnější průběh a jsou obtížně léčitelné. Bližší porozumění heterogennímu charakteru onemocnění a nové poznatky v patogenezi mohou v budoucnu přispět k účinné léčbě OA ručních kloubů.
Poděkování:
Podpořeno projektem Ministerstva zdravotnictví ČR pro koncepční rozvoj výzkumné organizace 023728.
Adresa pro korespondenci:
prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
Tel.: 234 075 232
e-mail: senolt@revma.cz
Sources
1. Bijlsma JW, Berenbaum F, Lafeber FP. Osteoarthritis: an update with relevance for clinical practice. Lancet 2011; 377(9783): 2115−2126.
2. Felson DT. Osteoarthritis as a disease of mechanics. Osteoarthritis Cartilage 2013; 21(1): 10−15.
3. Orlowsky EW, Kraus VB. The role of innate immunity in osteoarthritis: when our first line of defense goes on the offensive. J Rheumatol 2015; 42(3): 363−371.
4. Dahaghin S, Bierma-Zeinstra SM, Ginai AZ et al. Prevalence and pattern of radiographic hand osteoarthritis and association with pain and disability (the Rotterdam study). Ann Rheum Dis 2005; 64 : 682–687.
5. Kloppenburg M, Kwok WY. Hand osteoarthritis − a heterogeneous disorder. Nat Rev Rheumatol 2011; 8(1): 22−31.
6. Zhang W, Doherty M, Leeb BF et al.; ESCISIT. EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann Rheum Dis 2009; 68(1): 8−17.
7. Altman R, Alarcón G, Appelrouth D et al. The American College of Rheumatology criteria for the classification and reporting of osteoarthritis of the hand. Arthritis Rheum 1990; 33(11): 1601−1610.
8. Litwic A, Edwards MH, Dennison EM, Cooper C. Epidemiology and burden of osteoarthritis. Br Med Bull 2013; 105 : 185−199.
9. van Saase JL, van Romunde LK, Cats A et al. Epidemiology of osteoarthritis: Zoetermeer survey. Comparison of radiological osteoarthritis in a Dutch population with that in 10 other populations. Ann Rheum Dis 1989; 48 : 271–280.
10. Oliveria SA, Felson DT, Reed JI, Cirillo PA, Walker AM. Incidence of symptomatic hand, hip, and knee osteoarthritis among patients in a health maintenance organization. Arthritis Rheum 1995; 38(8): 1134−1141.
11. Spector TD, Cicuttini F, Baker J et al. Genetic influences on osteoarthritis in women: a twin study. BMJ 1996; 312(7036): 940−943.
12. Zhai G, van Meurs JB, Livshits G et al. Genetic influences on hand osteoarthritis in Finnish women − a replication study of candidate genes. PLoS One 2014; 9(5): e97417.
13. Michou L. Genetics of digital osteoarthritis. Joint Bone Spine 2011; 78(4): 347−351.
14. Ding H, Solovieva S, Leino-Arjas P. Determinants of incident and persistent finger joint pain during a five-year follow-up among female dentists and teachers. Arthritis Care Res (Hoboken) 2011; 63(5): 702−710.
15. Reyes C, Leyland KM, Peat G et al. Association between overweight and obesity and risk of clinically diagnosed knee, hip, and hand osteoarthritis: A population-based cohort study. Arthritis Rheumatol 2016; 68(8): 1869−1875.
16. Yusuf E, Ioan-Facsinay A, Bijsterbosch J et al. Association between leptin, adiponectin and resistin and long-term progression of hand osteoarthritis. Ann Rheum Dis 2011; 70(7): 1282−1284.
17. Michon M, Maheu E, Berenbaum F. Assessing health-related quality of life in hand osteoarthritis: a literature review. Ann Rheum Dis 2011; 70(6): 921−928.
18. Haugen IK, Bøyesen P, Slatkowsky-Christensen B et al. Associations between MRI-defined synovitis, bone marrow lesions and structural features and measures of pain and physical function in hand osteoarthritis. Ann Rheum Dis 2012; 71(6): 899−904.
19. Haugen IK, Slatkowsky Christensen B, Bøyesen P et al. Increasing synovitis and bone marrow lesions are associated with incident joint tenderness in hand osteoarthritis. Ann Rheum Dis 2016; 75(4): 702−708.
20. Harris PA, Hart DJ, Dacre JE et al. The progression of radiological hand osteoarthritis over ten years: a clinical follow-up study. Osteoarthritis Cartilage 1994; 2(4): 247−252.
21. Botha-Scheepers S, Riyazi N, Watt I et al. Progression of hand osteoarthritis over 2 years: a clinical and radiological follow-up study. Ann Rheum Dis 2009; 68(8): 1260−1264.
22. Damman W, Liu R, Bloem JL et al. Bone marrow lesions and synovitis on MRI associate with radiographic progression after 2 years in hand osteoarthritis. Ann Rheum Dis 2016 Jun 20, pii: annrheumdis-2015-209036. doi: 10.1136/annrheumdis-2015-209036 [Epub ahead of print].
23. Bijsterbosch J, Visser W, Kroon HM et al. Thumb base involvement in symptomatic hand osteoarthritis is associated with more pain and functional disability. Ann Rheum Dis 2010; 69(3): 585−587.
24. Moriatis Wolf J, Turkiewicz A, Atroshi I, Englund M. Prevalence of doctor-diagnosed thumb carpometacarpal joint osteoarthritis: an analysis of Swedish health care. Arthritis Care Res (Hoboken) 2014; 66(6): 961−965.
25. Fontana L, Neel S, Claise JM et al. Osteoarthritis of the thumb carpometacarpal joint in women and occupational risk factors: a case-control study. J Hand Surg Am 2007; 32(4): 459−465.
26. Kwok WY, Vliet Vlieland TP, Rosendaal FR et al. Limitations in daily activities are the major determinant of reduced health-related quality of life in patients with hand osteoarthritis. Ann Rheum Dis 2011; 70(2): 334−336.
27. Bijsterbosch J, Watt I, Meulenbelt I et al. Clinical burden of erosive hand osteoarthritis and its relationship to nodes. Ann Rheum Dis 2010; 69(10): 1784−1788.
28. Bijsterbosch J, Watt I, Meulenbelt I et al. Clinical and radiographic disease course of hand osteoarthritis and determinants of outcome after 6 years. Ann Rheum Dis 2011; 70(1): 68−73.
29. Kortekaas MC, Kwok WY, Reijnierse M et al. In erosive hand osteoarthritis more inflammatory signs on ultrasound are found than in the rest of hand osteoarthritis. Ann Rheum Dis 2013; 72(6): 930−934.
30. Kortekaas MC, Kwok WY, Reijnierse M et al. Brief report: association of inflammation with development of erosions in patients with hand osteoarthritis: a prospective ultrasonography study. Arthritis Rheumatol 2016; 68(2): 392−397.
31. Ehrlich GE. Erosive osteoarthritis: presentation, clinical pearls, and therapy. Curr Rheumatol Rep 2001; 3(6): 484−488.
32. Kwok WY, Kloppenburg M, Rosendaal FR et al. Erosive hand osteoarthritis: its prevalence and clinical impact in the general population and symptomatic hand osteoarthritis. Ann Rheum Dis 2011; 70(7): 1238−1242.
33. Marshall M, Peat G, Nicholls E et al. Subsets of symptomatic hand osteoarthritis in community-dwelling older adults in the United Kingdom: prevalence, inter-relationships, risk factor profiles and clinical characteristics at baseline and 3 years. Osteoarthritis Cartilage 2013; 21(11): 1674−1684.
34. Ramonda R, Lorenzin M, Modesti V et al. Serological markers of erosive hand osteoarthritis. Eur J Intern Med 2013; 24(1): 11−15.
35. Marshall M, Nicholls E, Kwok WY et al. Erosive osteoarthritis: a more severe form of radiographic hand osteoarthritis rather than a distinct entity? Ann Rheum Dis 2015; 74(1): 136−141.
36. Mobasheri A. The future of osteoarthritis therapeutics: emerging biological therapy. Curr Rheumatol Rep 2013; 15(12): 385.
37. Spolidoro Paschoal Nde O, Natour J, Machado FS et al. Effectiveness of triamcinolone hexacetonide intraarticular injection in interphalangeal joints: a 12-week randomized controlled trial in patients with hand osteoarthritis. J Rheumatol 2015; 42(10): 1869−1877.
38. Gabay C, Medinger-Sadowski C, Gascon D et al. Symptomatic effects of chondroitin 4 and chondroitin 6 sulfate on hand osteoarthritis: a randomized, double-blind, placebo-controlled clinical trial at a single center. Arthritis Rheum 2011; 63(11): 3383−3391.
39. Verbruggen G, Wittoek R, Vander Cruyssen B, Elewaut D. Tumour necrosis factor blockade for the treatment of erosive osteoarthritis of the interphalangeal finger joints: a double blind, randomised trial on structure modification. Ann Rheum Dis 2012; 71(6): 891−898.
40. Chevalier X, Ravaud P, Maheu E et al; French section of osteoarthritis. Adalimumab in patients with hand osteoarthritis refractory to analgesics and NSAIDs: a randomised, multicentre, double-blind, placebo-controlled trial. Ann Rheum Dis 2015; 74(9): 1697−1705.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Orthopaedics General practitioner for adults Pain management Dental Hygienist Surgery
Article was published inJournal of Czech Physicians

-
All articles in this issue
- 15 years’ experience with biological therapy of inflammatory rheumatic diseases in Czech national register ATTRA
- Early diagnosis of spondyloarthritis
- Differential diagnosis of monoarthritis
- Hand osteoarthritis
- Raynaud's phenomenon
- Immune mediated necrotizing myopathy associated with statin treatment
- Cardiovascular risk in rheumatic diseases
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnosis of monoarthritis
- Hand osteoarthritis
- Raynaud's phenomenon
- Immune mediated necrotizing myopathy associated with statin treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

