-
Medical journals
- Career
IgA nefropatie – jistoty, pochybnosti a výhledy kauzální léčby
: Karel Matoušovic 1; Jiří Městecký 2; Karel Vondrák 3; Jiří Dušek 3; Eliška Chvátalová 4; Jaromír Háček 5; Milada Horynová 6; Alena Kašperová 6; Pavel Rossmann 7; Ivan Šterzl 8; Milan Raška 6
: Interní klinika 2. LF UK a FNM, Praha 1; Department of Microbiology and Medicine, University of Alabama at Birmingham AL, USA a Ústav imunologie a mikrobiologie 1. LF UK, Praha 2; Pediatrická klinika 2. LF UK a FNM, Praha 3; 2. LF UK, Praha 4; Ústav patologie a molekulární medicíny 2. LF UK a FNM, Praha 5; Ústav imunologie LF UP, Olomouc 6; Mikrobiologický ústav Akademie věd České republiky, Praha 7; Endokrinologický ústav, Praha 8
: Čas. Lék. čes. 2015; 154: 168-173
: Review Article
IgA nefropatie je v současné době nejvíce studovanou glomerulonefritidou. Je definována průkazem převažujících nebo s jinými imunoglobuliny „kodominujících“ depozit imunoglobulinu A1 v mezangiu glomerulů. Depozita IgA1 nejpravděpodobněji pocházejí z cirkulujících imunitních komplexů, může ale jít i o agregaci IgA1 pozměněné struktury či o vazbu na receptory pro IgA1 na mezangiálních buňkách. Příčinou tvorby imunitních komplexů odpovědných za IgA nefropatii je nedostavěný O-glykosidický řetězec imunoglobulinu A1, na jehož konci v důsledku anomálií glykosyltransferáz chybí galaktóza. Na tento cukerný antigen se váží přirozeně se vyskytující protilátky třídy IgG nebo IgA1. V klinickém obrazu rozeznáváme časné stadium obvykle se vyznačující erytrocyturií a proměnlivé stadium pozdní, dané buď klinickou remisí, nebo perzistencí erytrocyturie či u jedné třetiny pacientů narůstající proteinurií, zvýšeným krevním tlakem a klesající funkcí ledvin. Prognózu IgA nefropatie nedovedeme v časném stadiu odhadnout ani z klinické prezentace ani z morfologického nálezu ani z množství odchylně glykosylovaného IgA1 v cirkulaci. Spolehlivým ukazatelem závažné prognózy je teprve pozdní stadium se stoupající proteinurií a hypertenzí a v biopsii s atrofií tubulů a intersticiální sklerózou. Hlavním trendem v léčbě IgA nefropatie je důraz na podávání inhibitorů ACE/sartanů, které sami podáváme již při mikroalbuminurii. Jestliže při této léčbě proteinurie nepoklesne pod 1 g/24 h, je lékem volby prednison. Nové poznatky o patogeneze choroby nabízejí možnosti zásahu na úrovni tvorby nefritogenních imunitních komplexů blokádou dnes již známé antigenní determinanty na imunoglobulinu A1 a/nebo na základě kompetitivní inhibice přirozeně se vyskytujících příslušných protilátek.
Klíčová slova:
IgA nefropatie – imunoglobulin A – O-glykosylace – imunitní komplexy – léčbaÚVOD
IgA nefropatie (IgAN) je v současné době nejvíce studovanou glomerulonefritidou. Po 2. světové válce poutala největší pozornost akutní glomerulonefritída (1), v sedmdesátých letech 20. století byla stanovena prognóza jednotlivých morfologických typů glomerulonefritidy (2, 3), v devadesátých letech se pozornost obrátila na patogenezi membranózní glomerulonefritidy (4, 5), s objevem ANCA protilátek (6, 7) se pojí klasifikace rychle progredujících glomerulonefritid a v posledních 20 letech je předmětem největšího zájmu právě IgAN (8–10). Ukázalo se totiž, že IgAN většinou nemá stacionární průběh, jak se původně myslelo, ale u 30 až 50 % pacientů se za 20 let rozvine chronické selhání ledvin. Výzkum patogeneze a možností terapeutického ovlivnění IgAN je proto významnou výzvou současné nefrologii.
DEFINICE IgAN
Onemocnění popsal v roce 1968 francouzský imunolog a patolog Jean Berger a Nicole Hinglais (proto Bergerova choroba) (11) na základě imunofluorescenčního nálezu dominujících depozit imunoglobulinu A (IgA) a imunoglobulinu G (IgG) v mezangiu glomerulů, většinou doprovázených C3 složkou komplementu a vzácně imunoglobulinem M. Tito pacienti měli nápadnou erytrocyturii, někdy i přechodně makroskopickou (při běžné respirační infekci – „synfaryngitická hematurie“) a normální glomerulární filtraci. Onemocnění se proto jevilo jako benigní (11). Imunofluorescenční průkaz interkapilárních depozit IgA-IgG je až do současnosti jediným diagnostickým kritériem, na němž lze diagnózu IgAN založit. V případě jasné dominance IgA v imunofluorescenčním nálezu je diagnóza IgAN nepochybná. Ale v některých biopsiích je intenzita fluorescence IgG či C3 obdobná jako IgA či vyšší. V těchto případech vyřkneme diagnózu IgAN jen s rozpaky nebo dokonce nález uzavřeme jinak (imunokomplexová glomerulonefritida, C3 nefropatie, IgM nefropatie apod.). Proto byla definice IgAN později doplněna o slovo „kodominující“, čímž byly mnohé z těchto glomerulonefritid zařazeny pod pojem IgAN. Kromě toho intenzita fluorescence nemusí přesně odrážet množství deponované bílkoviny, záleží na tloušťce řezu, kvalitě a ředění protilátky, druhu a intenzitě zdroje excitačního spektra, počtu odkrytých vazebných míst a při častém zpracování z parafinových řezů je též vliv rekonstituce. Proto diagnózu IgAN považujeme za (téměř) jistou v případě jasného imunofluorescenčního nálezu depozit IgA doprovázeného typickou klinickou symptomatikou, tj. dominující erytrocyturií. Přítomnost mezangiálních depozit potvrdí elektronová mikroskopie. Mezangiální depozita IgA jsou ale též náhodným nálezem u řady pitvaných osob, které za svého života neměly žádné klinické příznaky IgAN (12) a rovněž přetrvávají u osob, které jsou v klinické remisi IgAN. Je tedy zřejmé, že sama depozice IgA, IgG a C3 nutně nevyvolá klinické projevy IgAN. Na druhé straně ani IgAN nemusí být chorobou jednotné patogeneze. Může jít nejen o depozici cirkulujících imunitních komplexů (CIK) obsahujících IgA, IgG a případně C3, ale i o deposita IgA pozměněné struktury se zvýšenou tendencí k mezangiální agregaci či o vazbu cirkulujícího IgA na specifický receptor či receptor pro jiné proteiny (např. receptor pro transferin) (13), který váže i IgA a je exprimován mezangiálními buňkami.
PATOGENEZE
IgA je glykoprotein, který se pouze u člověka a některých primátů vyskytuje ve dvou podtřídách: IgA1 a IgA2. Oba proteiny jsou strukturálně podobné, ale IgA1 má oproti IgA2 delší spojovací oblast mezi první a druhou konstantní doménou těžkého řetězce, takzvanou pantovou oblast („hinge region“) a to o 13 aminokyselin, z nichž devět jsou hydroxyaminokyseliny serin a treonin, na jejichž hydroxylovou skupinu mohou být navázány O-glykany (obr. 1).
1. Schéma polymerního IgA s detailem pantové oblasti tvořené 19 vmezeřenými aminokyselinami, z nichž devět je serin (S) či treonin (T) a z nich až šest (označených pozičním číslem) může být O-glykosylováno. Pod sekvencí pantové oblasti je prezentován proces postupného prodlužování O-glykosidického řetězce navázaného na serin či treonin a jeho možné varianty. Za normálních okolností začíná syntéza řetězce v Golgiho aparátu připojením GalNAc (N-acetylgalaktozamin; žluté čtverce) na serin či treonin: Reakce je katalyzována enzymem N-acetylgalaktosyltransferázou (GalNAc-Ts). Syntéza O-glykanů IgA1 pokračuje připojením galaktózy (Gal; žluté kroužky) na GalNAc, katalyzovaném ß1,3 galaktosyltransferázou (C1GalT1) za účasti chaperonu Cosmc. Dalším krokem je připojení sialové kyseliny (SA, fialové čtverce na koso) na galaktózu, katalyzované α2,3 sialyltransferázou (ST3Gal). Výstavba řetězce může pokračovat připojením další sialové kyseliny katalyzovaným α2,6 sialyltransferázou (ST6GalNAc-II). V případě IgAN může být tvorba O-glykanů již ve fázi připojeného GalNAc zastavena předčasnou sialyzací GalNAc za katalýzy enzymem α2,6 sialyltransferázou (uprostřed, vyznačeno červeně). Tento stav vede k tvorbě patogenních imunitních komplexů. Dolní část obrázku je souhrnem struktur O-glykanů, které se vyskytují na pantové oblasti IgA1 za normálních okolností a za IgAN. Imunitní komplexy vyvolávající IgA nefropatii vznikají jen v případě nedokončené O-glykosylace (vpravo dole). 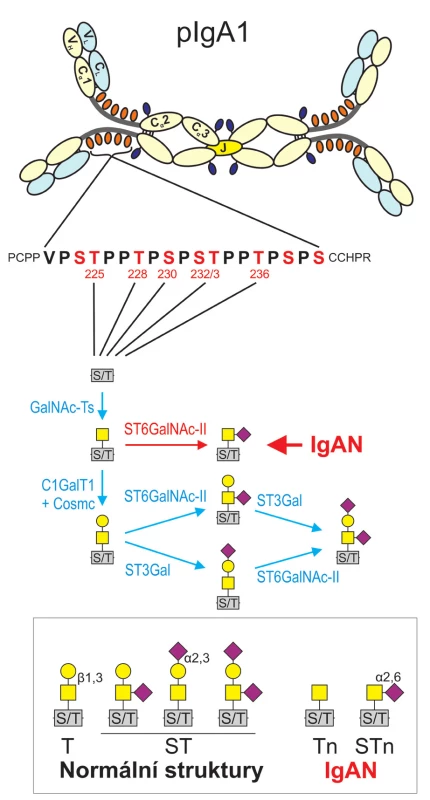
IgAN je imunokomplexová choroba. Pacienti s IgAN mají zvýšenou hladinu CIK obsahujících IgA1, která kolísá v závislosti na aktivitě choroby (14). Tyto CIK se skládají z dimerního IgA1, který se uplatňuje jako antigen a IgG (nebo dalšího IgA1), který se uplatňuje jako autoprotilátka specificky rozlišující IgA1 (15, 16). Antigenní determinanta na IgA1, rozpoznávaná IgG autoprotilátkou není peptid, ale O-oligosacharidy nebo O-oligosacharidy včetně aminokyselinové částí pantové oblasti IgA1 s abnormálním zastoupením jednotlivých monosacharidů, jež je charakteristické pro IgAN (17–21). Tvorba O-cukerného řetězce v pantové („hinge“) oblasti IgA1 probíhá v Golgiho aparátu lymfoblastů a plazmatických buněk postupně. Za normálních okolností se nejprve na OH – skupinu serinu či treoninu naváže monosacharid N-acetylgalaktozamin (GalNAc), poté se ke GalNAc připojí galaktóza (Gal) a nakonec může být připojena jak na Gal tak na GalNAc sialová kyselina (SA). Připojené oligosacharidy mohou mít i u zdravých jedinců různé varianty (obr. 1), jejich základní páteř však vždy sestává z disacharidu GalNAc--Gal. Naopak, u pacientů s IgAN je charakteristické zvýšené zastoupení O-oligosacharidů bez Gal, tedy terminálního GalNAc nebo GalNAc-SA v malé proporci IgA1, většina molekul IgA1 má však i u pacientů s IgAN normální strukturu. Příčina spočívá v tom, že u pacientů s IgAN je změněná aktivita klíčových enzymů zapojených do tvorby zmíněných O-oligosacharidů (22–24) a zřejmě i jejich lokalizace v Golgiho komplexu. Protože každý člověk má přirozeně se vyskytující protilátky (IgM) se specificitou proti GalNAc a odvozeným glykopeptidům, může u predisponovaných jedinců dojít k jejich další afinitní maturaci a izotypovému přesmyku v IgG nebo IgA1 a následné tvorbě CIK, které se mohou ukládat v mezangiu glomerulu a způsobit rozvoj IgAN. Experimentálně bylo prokázáno, že nefropatogenní jsou CIK o velikosti nad 800 kDa (25). Tyto komplexy ve tkáňové kultuře mezangiálních buněk stimulují jejich proliferaci a aktivují tvorbu prozánětlivých cytokinů (18). CIK o menší molekulové hmotnosti mají opačnou biologickou aktivitu a proliferaci tlumí. Zásah do velikosti CIK by tedy mohl být novým terapeutickým přístupem.
DĚDIČNOST
IgAN není vysloveně familiárním onemocněním, přestože rodinný výskyt byl opakovaně popsán (26, 27). Existuje však řada dokladů o významu genetických faktorů v její patogeneze (detaily viz citace 28). Asi třetina pokrevních příbuzných má vyšší hladinu IgA1 s abnormitami O-oligosacharidů, které spočívající ve sníženém množství Gal oproti kontrolní populaci, ale nikoliv klinické projevy onemocnění. V recentní celogenomové asociační studii jednonukleotidových polymorfismů (GWAS SNP) bylo identifikováno na populaci IgAN pacientů a kontrol čítající přes 20 000 jedinců nejrůznějších ras 15 lokusů s významnou asociací SNP a IgAN. Dominantní roli hrají 6p21 lokusy kódující molekuly hlavního histokompatibilního systému (HLA-DQB1, HLA-DP); lokusy 1q32 spojené s delecí genů kódujících analog H faktoru komplementové kaskády; dva SNP v 16p11 lokusu kódujícím αX a αM podjednotky integrinů CD11/CD18, které se mino jiné uplatňují jako receptory pro komplement a regulátory produkce IgA1. Dále byly identifikovány SNP v genech kódujících CARD9 protein (kaspázu-aktivující domény obsahující protein; 9q34), významný pro aktivaci antigen prezentujících buněk v odpovědi na některé bakteriální patogenní motivy (PAMP). Popsaná SNP je asociována s ulcerózní kolitidou a Crohnovou chorobou. Dále byla popsána asociace se SNP v lokusu VAV3 (guanin nukleotid výměnný faktor pro Rho GTPázu, 1p13) významném pro chemokinovou signalizaci, prezentaci antigenu a produkci IgA1; dvě SNP v 8p23 lokusech kódujících α-defensiny významné pro přirozenou obranu včetně sliznic gastrointestinálního traktu; SNP v lokusu kódujícím PSMB8 podjednotku imunoproteasomu vedoucí k poruše syntézy PSMB8 a dalších proteinů zapojených do prezentace antigenů na HLA molekulách; SNP v lokusu TNFSF13 kódujícím APRIL molekulu zapojenou mimo jiné do izotypového přesmyku imunoglobulinu směrem k IgA1; a SNP v lokusu kódujícím HORMAD2 protein, který patří do IL-6-JAK-STAT signalizační dráhy významné obecně pro rozvoj zánětlivé odpovědi, produkci a glykosylaci IgA1 a sníženou pravděpodobnost rozvoje Crohnovy choroby (28). Popsané SNP jsou charakteristicky spojeny s fungováním slizničního imunitního systému a některé z nich jsou rizikové pro rozvoj nespecifických střevních zánětů. Zajímavá asociace vyšla srovnáním nejrůznějších signalizačních drah obsahujících výše uvedené enzymy s drahami zapojenými do fungování slizničního imunitního systému a slizniční protiinfekční imunity. Rozdílný geografický výskyt IgAN a rozdílná incidence onemocnění mezi různými etniky byly v uvedené studii asociovány s klimatickými, dietetickými a infekčními faktory, z nichž nejvýznamnější asociace byla prokázána s geografickou diverzitou parazitických červů (28). Známé skutečnosti zatím neumožňují jednoznačné závěry.
KLINIKA IgAN
Onemocnění je často diagnostikováno náhodným průkazem erytrocyturie při preventivních prohlídkách nebo (u 1/3 pacientů) při náhle vzniklé nebolestivé makroskopické hematurii, která se objevila současně (hodiny) s běžnou respirační infekcí („synfaryngitická hematurie“). Obvykle hovoříme o „zdánlivém začátku“ IgAN, neboť je velmi pravděpodobné, že depozita IgA v ledvinách byla přítomna již dříve. Co je stimulem k časné depozici CIK se neví, ale je známo, že akutní respirační infekce IgAN aktivuje (25, 29). Klasickým prvním příznakem IgAN je erytrocyturie, ať mikro-, či makroskopická s nízkou nebo žádnou proteinurií (0–1 g/24 h/1,73 m2). Krevní tlak je normální nebo mírně zvýšený. V pozdějším období je rozmanitost klinické prezentace velká a vyšší proteinurie, časněji a častěji u dětí, není výjimkou. Extrarenální projevy IgAN jsou jen subklinické (depozita IgA1 např. v cévách kůže), pokud je přítomna kožní purpura, gastrointestinální symptomatika a bolesti kloubů, klasifikujeme onemocnění jako Henochovu-Schönleinovu purpuru. Ta má stejnou patogenezi a stejný imunofluorescenční nález v biopsii ledviny, ale s predilekcí patogenetických a klinických projevů na kůži, v gastrointestinálním traktu a v kloubech. Renální projevy IgAN přítomny být nemusí, depozice IgA do glomerulů je však velmi pravděpodobná i při jejich nepřítomnosti. Laboratorní testy specifické pro IgAN nemáme. Polovina pacientů má zvýšenou plazmatickou hladinu IgA, což samo o sobě k rozvoji IgAN nevede. Pacienti s IgA myelomem a extrémně vysokou sérovou hladinou IgA nemají IgAN. Ta se vyvine jen v případě myelomu, který produkuje IgA se sníženým obsahem galaktózy. Zatím však nemáme vhodný laboratorní test na kvantitativní stanovení hladiny IgA deficientního v galaktóze. Slibné v tomto ohledu jsou lektiny, které se vážou na GalNAc (např. Helix aspersa), ale rozptyl hodnot u zdravých a IgAN je příliš široký, takže diagnóza IgAN na tomto podkladě možná není. Mnoho let je nejspolehlivějším ukazatelem aktivity IgAN výše proteinurie. Zvýší-li se, obvykle stoupne i krevní tlak a následně i kreatinin. Onemocnění potom končí v chronickém selhání ledvin, obvykle za mnoho let. Za přijatelnou hodnotu proteinurie se u dospělého jedince považuje 0,5 g/24 h. U pacientů, u kterých se IgAN klinicky vyhojila, přetrvává často mikroalbuminurie. Její prognostický význam dosud nebyl zhodnocen, lze však soudit, že u pacienta s IgAN je mikroalbuminurie známkou neúplně vyhojeného procesu či v jeho důsledku sníženého počtu fungujících a přetížených nefronů. Zatímco diagnóza IgAN je založena na imunofluorescenční mikroskopii, na prognózu se kromě výše proteinurie a arteriální hypertenze soudí z nálezu ve světelně mikroskopii. Nejvíce používaná je klasifikace dle Haase (30), která však zohledňuje pouze změny glomerulů. Tubulointersticiálních regresivních změn či změn na cévách si všímá je okrajově. Novější, tzv. Oxfordská klasifikace (31) dle očekávání prokázala významný vztah mezi stupněm atrofie tubulů a intersticiální sklerózy a závažností IgAN, což je dávno známá skutečnost u jiných typů glomerulonefritidy (32, 33). Vztah mezi stupněm aterosklerózy a prognózou IgAN však nedosáhl statistické významnosti ani zde. Z dlouhodobého prognostického hlediska lze dle různých studií uzavřít, že u třetiny nemocných se IgAN (obvykle už v časném stadiu) vyhojí, u druhé třetiny močový nález perzistuje při zachované funkci a poslední třetina dospívá po 10–20 letech od zdánlivého začátku do chronického selhání ledvin. Průběh pod obrazem rychle progredující glomerulonefritidy je vzácný (34), stejně jako akutní postinfekční glomerulonefritida s dominujícími mezangiálními a subendoteliálními depozity IgA (35) či současná IgAN při nefrotickém syndromu s minimálními změnami.
SOUČASNÉ MOŽNOSTI LÉČBY
V současnosti nejvíce respektovaný doporučený postup léčby glomerulonefritid, KDIGO (kidney disease improving global outcome) (36), který je obecně velmi konzervativní, klade důraz na inhibitory ACE/sartany jako základní kameny léčby IgAN. Na přelomu tisíciletí ještě neexistovaly přesvědčivé doklady o užitečnosti inhibitorů ACE či sartanů u této choroby (37) a tyto léky byly zmiňovány především v souvislostech antihypertenzivní léčby (38). Nově se doporučují s jistotou při proteinurii vyšší než 1 g/24 h a velmi pravděpodobně již i u pacienta s proteinurií vyšší než 0,5 g/24 h. Jejich dávku je třeba zvyšovat dle tolerance pacientem tak dlouho, dokud proteinurie neklesne pod 1 g/24 h. Sami se domníváme, že inhibitory ACE/sartany mají být podávány již u pacientů s mikroalbuminurií. Další skupinou používaných léků jsou glukokortikoidy. Zatímco dříve se za indikaci k zahájení léčby prednisonem považovala poměrně vysoká proteinurie (3 g/24 h) (37), dnes mají být glukokortikoidy podávány již při proteinurii nízké (nad 1 g/24 h), a to alespoň po 6 měsíců, pokud se proteinurie nesnížila po inhibitorech ACE/sartanech. Je velmi pravděpodobné, že efekt glukokortikoidní léčby zahájené až v době zvýšené proteinurie (1 g/24 h), tedy v období funkční progrese, bude menší, než kdyby léčba byla zahájena dříve. Zatím však nemáme testy, kterými bychom odhalili aktivitu IgAN předtím, než se začne zvyšovat proteinurie a krevní tlak. Příznivý účinek kombinace prednisonu s cytostatiky (cyklofosfamid, azathioprin) nebyl nikdy přesvědčivě doložen a proto není (s výjimkou IgAN probíhající pod obrazem rychle progredující glomerulonefritidy) doporučována ani nyní. Rovněž efekt mykofenolátu mofetilu zatím nebyl prokázán. Dříve ani nyní není jasně prokázán účinek antiagregancií, a proto se ani v rozboru KDIGO nedoporučují. Zatímco dříve bylo doporučováno provedení tonsilektomie při recidivujících tonsilitidách (37), dle posledního rozboru není tonsilektomie u IgAN indikována z jiné než otorinolaringologické indikace. Dříve i nyní byly a jsou rozpaky nad použitím rybího oleje (39). Zřejmě v důsledku důrazu na studii provedenou v Mayo Clinic (40) je podle KDIGO doporučeno jeho použití u pacientů s proteinurií nad 1 g/24 h, u nichž proteinurie po inhibitorech ACE či sartanech nepoklesla pod 1 g/24 h. V praxi je ovšem tento postup realizovatelný jen obtížně vzhledem k finančním nárokům při nutnosti vysoké dávky (12–24 g/24 h). Probíhá-li IgAN pod obrazem rychle progredující glomerulonefritidy, je indikována kombinace steroidů s cyklofosfamidem. Hlavním trendem v léčbě IgAN je tedy důraz na podávání inhibitorů ACE (sartanů) téměř u každého pacienta s proteinurií a důraz na léčbu prednisonem již při poměrně nízké proteinurii.
VÝHLEDY KAUZÁLNÍ LÉČBY
Kauzální léčba známa není. Museli bychom znormalizovat glykosylaci IgA1, což by znamenalo definovat poruchu glykosyltransferáz (24), tedy enzymů odpovědných za správnou konfiguraci O-glykosidického řetězce pantové oblasti IgA1. Tento přístup není dosud v dohlednu. Nové poznatky o patogenezi choroby však nabízejí možnosti zásahu v časné fázi patogenetického řetězce, tj. na úrovni tvorby CIK. U IgAN, stejně jako u akutní sérové nemoci, je tkáňové poškození působeno velkými CIK (800 kDa a více), které se tvoří v oblasti rovnováhy mezi koncentrací antigenu a protilátky. Tyto CIK jsou obtížně likvidovány ve fagocytárním systému a deponují se v ledvinách. Zjištění, že odchylná skladba cukerných řetězců pantové oblasti je antigenním terčem pro vazbu IgG nebo IgA1 autoprotilátky, odkrývá imunologické přístupy, jimiž by bylo možné zabránit tvorbě těchto velkých nefropatogenních CIK. Změnou molárních koncentrací antigenu (odchylně glykosylovaný IgA1) a/nebo autoprotilátky (IgG či IgA1) by se mohlo podařit posunout interakci mezi antigenem a protilátkou směrem ke stavu, který by připomínal buď její časné, nebo pozdní stadium, tedy období, v nichž je nadbytek antigenu nebo nadbytek protilátky, a tudíž se tvoří malé CIK, které jsou pro ledviny neškodné. Teoretických možností je několik a jsou založeny jednak na zablokování vazebného místa pro autoprotilátku (pomocí peptidu nesoucího nedostavěné O-glykosidické řetězce), jednak na snížení sérové koncentrace volné IgA1 protilátky s abnormálními O-glykany. K inhibici tvorby vysokomolekulárních a nefritogenních CIK se jeví jako vhodné různé fragmenty autoprotilátek, popsaných u IgAN, které by vzhledem k přítomnosti pouze jednoho vazebného místa pro antigen nemohly spojovat molekuly IgA1. Monovalentními fragmenty protilátkových molekul mohou být buď Fab, obsahující celý lehký řetězec a polovinu těžkého řetězce s variabilními doménami, nebo Fv obsahující pouze variabilní domény lehkých a těžkých řetězců spojených přes spojovací peptid. Zcela novým přístupem by bylo využití jedinečné struktury protilátek velblouda či lamy, které postrádají lehké řetězce (41, 42), ale přesto si izolovaná variabilní doména těžkých řetězců zachovává vysokou vazebnou aktivitu a specificitu proti antigenům, spolu s neobvyklou termostabilitou a rozpustností. Tyto fragmenty nazývané VHH nebo též „nanobody“ proti několika antigenům jsou komerčně dostupné a byly použity k diagnostickým a léčebným účelům u člověka. Druhou možností je příprava syntetizovaných krátkých glykopeptidů strukturálně shodných s pantovou oblastí IgA1 popsanou u IgAN. Druhý přístup je biotechnologicky náročnější, neboť vyžaduje nejdříve přípravu polypeptidu pantové oblasti IgA1 a následnou in vitro glykosylaci s využitím rekombinantních enzymů zapojených do glykosylace IgA1 v buňkách pacienta s IgAN. Druhý postup byl již experimentálně vyzkoušen (43). Oběma přístupy by se změnil poměr mezi koncentrací autoprotilátky a antigenu a vznikly by CIK o nízké molekulové hmotnosti, které mají vysokou plazmatickou clearance a nepoškozovaly by ledviny.
Seznam použitých zkratek
Gal galaktóza
GalNAc N-acetylgalaktozamin
IgA imunoglobulin A
IgAN IgA nefropatie
IgG imunoglobulin G
IgM imunoglobulin M
SK sialová kyselina
Konflikt zájmů: žádný.
Práce vznikla za podpory grantu NT11081 a 15-33686A.
ADRESA PRO KORESPONDENCI:
prof. MUDr. Karel Matoušovic, DrSc.
Interní klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
e-mail: kmatousovic@hotmail.com
Sources
1. Brod J. Acute diffuse glomerulonephritis. Am J Med 1949; 7 : 317–335.
2. Rossmann P, Brod J. Klinický průběh chronické glomerulonefritidy se zřetelem k mikroskopickému obrazu v biopsii ledviny. Čas Lék čes 1968; 107 : 959–964.
3. Kinkaid-Smith P, Mathew TH, Becker EC. Glomerulonephritis. morphology, natural history and treatment. New York: John Willey and Sons 1973.
4. Kerjaschki D. Molecular pathogenesis of membranous nephropathy. Kidney Int 1992; 41 : 1090–1105.
5. Kerjaschki D. Pathomechanisms and molecular basis of membranous glomerulopathy. Lancet 2004; 364 : 1194–1196.
6. Davies DJ, et al. Segmental necrotising glomerulonephritis with antineutrophil antibody: possible arbovirus aetiology?. Brit Med J (Clinical Research ed.) 1982; 285 : 606.
7. van der Woude FJ, et al. Autoantibodies against neutrophils and monocytes: tool for diagnosis and marker of disease activity in Wegener’s granulomatosis. Lancet 1985; 2 : 425–529.
8. Glassock RJ. The pathogenesis of IgA nephropathy. Curr Opin Nephrol Hypertens 2011; 20 : 153–160.
9. Donadio JV, Grande JP. IgA nephropathy. N Engl J Med 2002; 347 : 738–748.
10. Wyatt RJ, Julian BA. IgA nephropathy. N Engl J Med 2013; 368 : 2402–2414.
11. Berger J, Hinglais N. Les depôts intercapillaires d’IgA-IgG. J Urol Nephrol 1968; 74 : 694–695.
12. Suzuki K, et al. Incidence of latent mesangial IgA deposition in renal allograft donors in Japan. Kidney Int 2003; 63 : 2286–2294.
13. Monteiro RC. Role of IgA and IgA Fc receptors in inflammation. J Clin Immunol 2010; 30 : 1–9.
14. Coppo R, et al. IgA1 and IgA2 immune complexes in primary IgA nephropathy and Henoch-Schönlein nephritis. Clin Exp Immunol 1984; 57 : 583–590.
15. Tomana M, et al. Galactose-deficient IgA1 in sera of IgA nephropathy patients is present in complexes with IgG. Kidney Int 1997; 52 : 509–516.
16. Tomana M, et al. Circulating immune complexes in IgA nephropathy consist of IgA1 with galactose-deficient hinge region and antiglycan antibodies. J Clin Invest 1999; 104 : 73–81.
17. Mestecky J, et al. Defective galactosylation and clearance of IgA1 molecules as a possible etiopathogenic factor in IgA nephropathy. Contrib Nephrol 1993; 104 : 172–182.
18. Mestecky J, et al. IgA nephropathy: molecular mechanisms of the disease. Annu Rev Pathol 2013; 8 : 217–240.
19. Allen AC, et al. Galactosylation of N - and O-linked carbohydrate moieties of IgA1 and IgG in IgA nephropathy. Clin Exp Immunol 1995; 100 : 470–474.
20. Barratt J, et al. Immunopathogenesis of IgAN. Semin Immunopathol 2007; 29 : 427–443.
21. Matoušovic K, et al. IgA nefropatie. Význam glykozylace imunoglobulinu A pro patogenezi a její klinický obraz. Čas Lék čes 2002; 141 : 729–734.
22. Raska M, et al. Identification and characterization of CMP-NeuAc:GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. J Mol Biol 2007; 369 : 69–78.
23. Suzuki H, et al. Cytokines alter IgA1 O-glycosylation by dysregulating C1GalT1 and ST6GalNAc-II enzymes. J Biol Chem 2014; 289 : 5330–5339.
24. Stuchlova Horynova M, et al. N-Acetylgalactosaminide α2,6-sialyltransferase II is a candidate enzyme for sialylation of galactose-deficient IgA1, the key autoantigen in IgA nephropathy. Nephrol Dial Transplant 2015; 30 : 234–238.
25. Novak J, et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney Int 2005; 67 : 504–513.
26. Julian BA, et al. Familial IgA nephropathy. Evidence of an inherited mechanism of disease. N Engl J Med 1985; 312 : 202–208.
27. Julian BA, et al. IgA nephropathy: a clinical overview. Contrib Nephrol 2007; 157 : 19–26.
28. Kiryluk K, et al. Discovery of new risk loci for IgA nephropathy implicates genes involved in immunity against intestinal pathogens. Nat Genet 2014; 46 : 1187–1196.
29. Feltis JT, et al. Active and chronic phases of Berger‘s disease (IgA nephropathy). Am J Kidney Dis 1984; 3 : 349–356.
30. Haas M. Histologic subclassification of IgA nephropathy: a clinicopathologic study of 244 cases. Am J Kidney Dis 1997; 29 : 829–842.
31. Working Group of the International IgA Nephropathy Network and the Renal Pathology Society. In Coppo R et al. The Oxford IgA nephropathy clinicopathological classification is valid for children as well as adults. Kidney Int 2010; 77 : 921–927.
32. Bohle A, et al. The pathogenesis of chronic renal failure. Pathol Res Pract 1989; 185 : 421–440.
33. Matoušovic K, Rossmann P. Primary glomerulonephritis. Morphological and Clinical Aspects of Diagnosis and prognosis. Praha: Academia 1994.
34. Tumlin JA. Crescentic, proliferative IgA nephropathy: clinical and histological response to methylprednisolone and intravenous cyclophosphamide. Nephrol Dial Transplant 2003; 18 : 1321–1329.
35. Wallace E, et al. Immune profile of IgA-dominant diffuse proliferative glomerulonephritis. Clin Kidney J 2014; 7 : 479–483.
36. KDIGO Clinical Practice Guidline for Glomerulonephriis. Kidney Int 2012; Suppl 2 : 139–274.
37. Nolin L, Courteau M. Management of IgA nephropathy. Evidence-based recommendations. Kidney Int 1999; 55(Suppl 70): S56–S62.
38. Bedogna V. Effects of ACE inhibition in normotensive patients with chronic glomerular disease and normal renal function. Kidney Int 1990; 38 : 101–117.
39. Hogg RJ, Southwest Pediatric Nephrology Study Group. Clinical trial to evaluate omega-3 fatty acids and alternate day prednisone in patients with IgA nephropathy: report from the Southwest Pediatric Nephrology Study Group. Clin J Am Soc Nephrol 2006; 1 : 467–474.
40. Donadio JV, et al. The long-term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Mayo Nephrology Collaborative Group. J Am Soc Nephrol 2001; 12 : 791–799.
41. Hamers-Casterman C, et al. Naturally occurring antibodies devoid of light chains. Nature 1993; 363 : 446–448.
42. Rahbarizadeh F, et al. Nanobody: an old concept and new vehicle for immunotargeting. Immunol Invest 2011; 40 : 299–338.
43. Kasperova A, et al. Preventing of formation of IgA1 - Containing Immune Complexes in IgA 1 Nephropathy, J Am Soc Nephrol 2013; 23 : 490A.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- The story of Appendix
- Gout and its manifestations, description and treatment in ancient times
- A short history of infectious diseases since the fifties of the last century and the importance of vaccination
- New options for therapeutic revascularization in lower extremity limb ischemia linked to the diabetic foot syndrome by autologous stem cell transplantation
- IgA Nephropathy. Facts, uncertainties, and potential causal therapy approaches
- Gastric lavage after peroral intoxication – controversial views
- Health effects of ambient ultrafine particles – the project UFIREG
- Analysis of serum levels of Dickkopf-1 (DKK-1) in monoclonal gammopathy of undetermined significance and multiple myeloma
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Gastric lavage after peroral intoxication – controversial views
- The story of Appendix
- A short history of infectious diseases since the fifties of the last century and the importance of vaccination
- IgA Nephropathy. Facts, uncertainties, and potential causal therapy approaches
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

