-
Medical journals
- Career
Dlouhodobá udržovací léčba idiopatických střevních zánětů*
: K. Lukáš 1; M. Dastych 2; A. Novotný 1; L. Prokopová 2; V. Zbořil 2
: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN 1; Masarykova univerzita v Brně, Lékařská fakulta, Interní gastroenterologická klinika FN 2
: Čas. Lék. čes. 2012; 151: 231-242
: Review Articles
Crohnova nemoc a ulcerózní kolitida jsou chronická zánětlivá onemocnění gastrointestinálního traktu. Léčba indukuje remisi a po jejím dosažení je cílem ji dlouhodobě udržet. Výběr léků závisí na jejich účinnosti, vedlejších účincích, předchozí odpovědi na léčbu a na přítomnosti extraintestinálních manifestací a komplikací. 5-aminosalicyláty jsou účinné pro udržení remise u pacientů s distálním postižením. Thiopuriny jsou doporučovány k dlouhodobé léčbě. U pacientů, kteří na imunosupresivní léčbu nereagují nebo ji netolerují, jsou podávány preparáty anti-TNF-α. Účinné v udržení remise jsou thiopuriny, infliximab a adalimumab.
Klíčová slova:
Crohnova nemoc, ulcerózní kolitida, remise, dlouhodobá léčba, aminosalicyláty, glukokortikoidy, thiopuriny, infliximab, adalimumab.*Základem pro článek je blok přednášek na téma „Dlouhodobá léčba idiopatických střevních zánětů“ na 32. českém a slovenském gastroenterologickém kongresu v Brně dne 4. listopadu 2011.
ÚVOD
Idiopatické střevní záněty (ISZ) zahrnující Crohnovu nemoc (CN) a ulcerózní kolitidu (UC) jsou chronická zánětlivá onemocnění gastrointestinálního traktu. ISZ se projevují signifikantními příznaky zahrnujícími průjem, bolest břicha, krvácení, anemizaci a úbytek na váze a mohou být spojeny s širokým spektrem extraintestinálních manifestací, např. s artritidou, ankylózující spondylitidou, sklerózující cholangitidou, uveitidou, iritidou, pyoderma gangrenosum a erythema nodosum. Patogeneze ISZ zahrnuje s největší pravděpodobností faktory genetické, imunologické a faktory zevního prostředí (1).
ISZ jsou celoživotní relabující a remitující onemocnění s různým průběhem a nejsou v současnosti konzervativně trvale vyléčitelné. Ale u většiny pacientů umožňuje léčba potlačit příznaky, zabránit komplikacím a zabezpečit dobrou kvalitu života. ISZ vyžadují kontinuální léčbu a trvalé sledování (2, 3). Základním cílem léčby ISZ je odstranění symptomů. Definitivním cílem léčby je udržení remise (4, 5).
Progresivní průběh a rozvoj komplikací je zjišťován u více než 2/3 pacientů s CN (6, 7) a u méně než 1/3 pacientů s UC (8, 9). V současnosti je díky účinné léčbě „přirozený“ průběh ISZ výrazně modifikován efektivní konzervativní léčbou a většina pacientů s ISZ je v symptomatické remisi, nemoc nevzplane, nebo má aktivitu jen mírnou (10–12).
Hlavními symptomy UC jsou krvavý průjem, kolikovité bolesti břicha, urgentní vyprazdňování a tenezmy. UC má několik možných průběhů: 1. chronický intermitentní, kdy se střídají remise s relapsy (50 % nemocných s UC má relaps každý rok), 2. chronický kontinuální (13, 14), 3. fulminantní nebo 4. proběhne (jen) jedna ataka (15).
Podstatnými symptomy CN jsou bolesti břicha, průjem a úbytek na váze. Průběh CN je chronický intermitentní, probíhá s remisemi a relapsy. Při současné léčbě je většina pacientů buď v remisi, nebo má nemoc jen mírnou aktivitu (12).
Padesát procent nemocných s CN má chirurgický zákrok v prvních 10 letech od stanovení diagnózy a 70–80 % má chirurgický zákrok během života (13).
Remise je vymezována jako klinická (nepřítomnost symptomů), endoskopická (nepřítomnost lézí), laboratorní (nepřítomnost známek aktivity), histologická (nepřítomnost mikroskopického nálezu) nebo radiologická (nepřítomnost nálezu na rtg, CT, MRI, scintigrafii).
Relaps je určen jako klinický (obnovený výskyt příznaků), endoskopický (obnovený průkaz lézí), laboratorní (obnovená přítomnost známek aktivity), histologický (obnovená přítomnost mikroskopického nálezu) nebo radiologický (obnovená přítomnost nálezu na rtg, CT, MRI, scintigrafii).
Pooperační rekurence CN je definována jako přítomnost nové objektivně zjištěné střevní léze CN po resekci radikální nebo kurativní. Radikální resekce = kompletní excize s odstraněním celého postiženého úseku a lymfatických uzlin, s dostatečnou délkou (dostatečná délka = 5–15 cm) od makroskopicky normálního okraje na obou koncích nemocného segmentu (16).
Pooperační rekurence CN je rozdělována na: 1. morfologickou (zjištěny nové léze prokázané vyšetřovacími technikami), 2. endoskopickou (endoskopicky prokázaný výskyt nových slizničních lézí v neoterminálním ileu časně po chirurgické resekci), 3. klinickou (rekurence zhodnocená konvenčními indexy aktivity, do 10 let po operaci se projeví u 32–76 %), 4. chirurgickou (pacient potřebuje reoperaci, do 10 let po první operaci u 20–44 %) (17–19).
Predikci průběhu ISZ lze často předvídat podle věku v čase stanovení diagnózy – čím dříve nemoc začne, tím mívá agresivnější průběh. Tato předpověď je částečně možná i dle primární lokalizace nemoci. Je-li CN postiženo terminální ileum, je zvýšené riziko striktur a penetrací a zvýšená potřeba chirurgických zásahů. Při postižení horní části tenkého střeva je zvýšeno riziko rekurence nemoci (20).
Jedna třetina pacientů s těžkou UC potřebuje kortikosteroidy (14). U pacientů s UC diagnostikovanou do 50 let věku je udáván průměrný čas relapsu po 1. atace 2–3 roky. Tíže a rozsah zánětu při první prezentaci nemoci mají vliv na čas kolektomie, při těžkém průběhu má 50 % nemocných kolektomii do 2 let a při pankolitidě má kolektomii 50 % nemocných do 5 let.
Rozvoj komplikovaného a devastujícího onemocnění lze očekávat u pacientů s CN diagnostikovanou v nízkém věku, mohou mít postiženo tenké střevo a perianální nemoc, striktury, penetrace, jsou často hospitalizováni a potřebují aplikaci glukokortikoidů již při počátečním vzplanutí, nebo vyžadují brzké podání imunosuprese a biologické léčby. Těžký průběh může predikovat i trombocytémie. Při vzplanutí ztrácejí nemocní na váze a mají horečky. Těžký průběh je možné předpokládat v případech, kdy je provedena resekce dvou segmentů střeva, nejméně v délce 70 cm, nebo části tračníku, nebo je-li chirurgicky ošetřovaná perianální nemoc, nebo je provedena definitivní stomie. CN probíhá hůře u kuřáků (21).
Medikamentózní léčba indukční má co nejrychleji snížit zánětlivou aktivitu a zajistit ústup známek nemoci klinických, laboratorních a endoskopických. Léčba ISZ zahrnuje režimová opatření (např. dietní, zásadní je zanechání kouření u CN), léčbu konzervativní a chirurgickou (22).
Medikamentózní léčba dlouhodobá udržovací má zabránit návratu subjektivních příznaků i objektivních znaků nemoci. Trvale podávaná udržovací léčba je menším zdrojem protilátek než léčba epizodická. Intermitentní udržovací léčba je výjimečně akceptovatelná u malého počtu UC bez extenzivního postižení. U distální kolitidy je terapií volby udržovací terapie v lokální aplikaci, která nemusí být podávána každý den, ale dobrý účinek je popisován i při aplikaci ob den nebo každý druhý, třetí den.
Léčba chirurgická je nutná u 70–90 % pacientů s CN (ale 90 % má rekurenci) a u 10 % pacientů s UC. Proktokolektomie u UC je definitivním vyřešením nemoci, i když mutilujícím. Indikacemi chirurgického řešení pro UC jsou selhání konzervativní léčby, fulminantní kolitida neřešitelná konzervativní léčbou, toxické megakolon, perforace, nekontrolovatelné – nezvládnutelné krvácení, vedlejší účinky konzervativní léčby, striktury, high-grade dysplazie, karcinom, retardace růstu u dětí (23).
V současnosti je nahlíženo na léčbu ISZ jako na velmi účinnou, která ale zatím nedokáže nemoc definitivně vyléčit. Působí jako prevence komplikací a prevence progrese a rekurence, tedy k udržení remise. Léčba musí být aplikována včas (tzn. již od stanovení diagnózy), její dlouhodobé podávání je prospěšné pro všechny pacienty bez rozdílu věku (17, 24, 25). Podstatné je doporučení pro včasné podání preparátu anti-TNF-α, který, aby měl dostatečný efekt, musí být aplikován před tím, než dojde k ireverzibilním anatomickým změnám na trávicím traktu (26, 27). Otázkou je dostupnost dlouhodobé udržovací léčby anti-TNF-α (28).
Současná „filozofie“ léčby ISZ říká, že čím dříve léčba začne, tím je na ní lepší odpověď, a že relativní rezistence na léčbu roste s časem. Čím dříve lze léčbou průběh nemoci ovlivnit, tím dříve lze zabránit zhoršování, komplikacím, hospitalizaci, nutnosti chirurgického výkonu a zvyšování dávek kortikosteroidů, a tím jejich vedlejším účinkům. Důležitým úkolem je dosažení kompletního slizničního zhojení (29, 30).
Cílem udržovací medikamentózní terapie ISZ je zabránit relapsu nemoci po navození remise a zamezit vzniku komplikací a udržet dobrou kvalitu života nemocného (31). Volba medikamentózní profylaxe závisí na individuálním přirozeném vývoji nemoci (věk při první manifestaci, frekvence a tíže akutních atak), rozsahu postižení trávicího traktu (lokalizovaná a extenzivní forma) a typu nemoci (zánětlivý, penetrující, stenózující), endoskopickém nálezu (morfologické aktivitě) a komplikacích nebo extraintestinálních manifestacích, ale také na efektivitě a toleranci předchozí zvolené terapie. Důležité je posoudit i adherenci nemocného k terapii. Prospěch pro nemocného musí převyšovat rizika a kontraindikace terapie. I když jsou již navozeny určité stereotypy v udržovací léčbě, tak její indikace musí být individuálně posouzena u každého nemocného. Časné zavedení udržovací léčby je prospěšné pro všechny pacienty bez rozdílu věku (17, 24, 25, 32, 33).
DLOUHODOBÁ UDRŽOVACÍ LÉČBA
V souvislosti s dlouhodobou udržovací léčbou se pokusíme odpovědět na pět následujících otázek, které jsme si položili:
- A. Jaké jsou indikace dlouhodobé udržovací léčby?
- B. Jak dlouho má (může) být dlouhodobá udržovací léčba podávána?
- C. Kdy se má (může) ukončit dlouhodobá léčba?
- D. Jak postupovat při relapsu během dlouhodobé udržovací léčby?
- E. Jaké jsou indikace dlouhodobé léčby po chirurgickém výkonu?
Ad A. Jaké jsou indikace dlouhodobé udržovací léčby?
Při dlouhodobé udržovací léčbě je nutno vzít v úvahu tři důležitá kritéria: 1. průběh nemoci (iniciální projevy, častost a tíže vzplanutí), 2. rozsah postižení (lokalizovaná nebo extenzivní) a 3. účinnost a toleranci dosavadní léčby užité k indukci remise a jejímu udržení. V úvahu je zapotřebí vzít i intenzitu zánětu (často sledovanou jen hladinou C-reaktivního proteinu), možnost komplikací a pacientův přístup k léčbě (34, 35). Ve zjednodušené formě uvádí indikace tabulka 1.
1. Indikace dlouhodobé udržovací léčby léčby ISZ 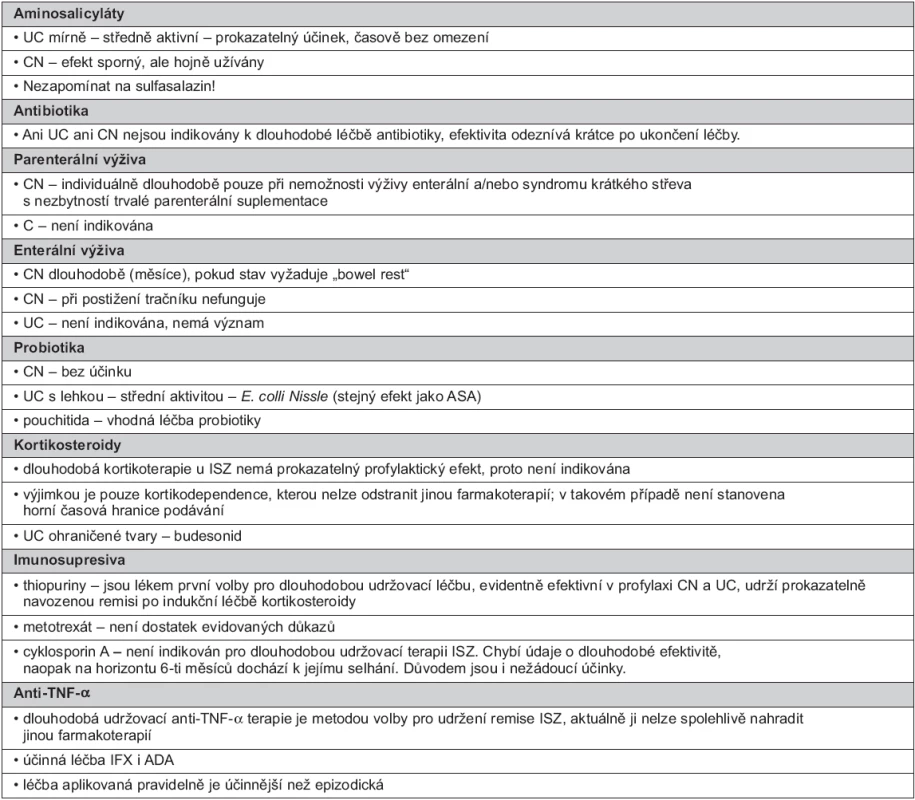
Aminosalicyláty
Efekt aminosalicylátů (ASA) u UC je prokazatelný řadou studií. Indikací (dlouhodobé) léčby ASA je mírně aktivní až středně aktivní UC. V závislosti na extenzi postižení je nutné volit perorální terapii v tabletách (extenzivní kolitida) nebo lokální terapii ve formě čípků či klyzmat (proktitida, sigmoiditida a levostranný tvar). ASA jsou u UC podávány mnoho let (od roku 1942), jsou dobré zkušenosti s jejich aplikací, mají minimum nežádoucích účinků a jsou výborně tolerovány.
Perorálně a lokálně podávané preparáty mesalazinu (5 ASA) mají dobrou účinnost pro udržení remise u pacientů s distální UC a jsou indikovány jako lék k dlouhodobé léčbě první linie u nemocných, kteří na ně dobře odpovídají (23, 36–39). Jako druhá linie k dlouhodobé aplikaci u UC je doporučována kombinace preparátů orálních a rektálních (ve formě čípků či klyzmat) ASA, a tato kombinace je považována za vhodnou i u ohraničeného tvaru UC (31, 40–42). Kombinace je užívána i u mírné až středně aktivní kolitidy extenzivní. Otázkou je vždy pacientova tolerance lokálních forem. Doporučovaná denní p.o. dávka je minimálně 2 g denně, maximálně 4,8 g denně. Minimálně efektivní dávka je 1 g denně, lokálně 3 g týdně. Intermitentní topická léčba 5-ASA se ukazuje jako lepší proti orální 5-ASA při prevenci relapsu nebo při vzplanutí UC. Místo v dlouhodobé léčbě má stále, při dobré toleranci, salazosulfapyridin (sulfasalazin). Nelze jej odmítat, vhodný je zejména při extraintestinálních manifestacích, při bolestech kloubů, kde výborně účinkuje sulfapyridin (cost-effective oproti mesalazinu). U vysoce aktivní kolitidy – extenzivní UC, ale i těžké UC ohraničeného tvaru nemají ASA prokazatelný efekt (43, 44). Rektálně podávané ASA jsou účinnější než rektálně aplikované steroidy (41). Mesalazinové čípky jsou účinné pro indukci a udržení remise u pacientů s proktitidou (39).
U CN jsou ASA užívány hojně (45), zejména ve formě mikropelet, jejich efekt je hodnocen jako sporný. Prospěšnost ASA v udržovací terapii medikamentózně navozené remise u CN není jasně definována (1, 2, 12, 13, 34, 44, 46–48).
Při CN je sulfasalazin účinnější u postižení tračníku, dávka ASA při udržovací léčbě musí být nejméně 2 g/den (38, 41).
Pro léčbu ASA u ISZ mluví letité zkušenosti s jejich aplikací, minimum nežádoucích účinků a výborná tolerance, jsou bezpečně prospěšné a jsou prakticky bez rizika (17).
Dávka orálního mesalazinu při léčbě udržovací by měla být stejná jako dávka, která indukovala remisi. Někteří pacienti mají tendenci snižovat dávky na polovinu, na třetinu; při relapsu je potřebné se vrátit na dávku původní. I s lokálně aplikovaným mesalazinem se musí zacházet stejně, ačkoliv existují starší studie, které připouštějí aplikaci ob den, nebo každý třetí den atd. Rychlé vysazení není doporučováno, protože může dojít k tzv. „rebound“ relapsu (12).
Antibiotika
Dlouhodobost aplikace antibiotik (ATB) u ISZ je velmi relativní.
U UC byl zjišťován dlouhodobý efekt ciprofloxacinu, metronidazolu (MT) a rifaximinu. Ale ATB nejsou indikována k dlouhodobé udržovací terapii UC (49).
ATB by měla být podávána vždy jen po omezenou dobu, maximální délka aplikace p.o. ATB většinou nepřesahuje při léčbě CN 3 měsíce. ATB mají své místo především při septických komplikacích ISZ (zánětlivý infiltrát, bakteriální přerůstání v souvislosti se strikturou, perianální nemoc, píštěle) (41). Vysoká dávka MT (20 mg/kg/den) po dobu 3 měsíců má profylaktický efekt na klinickou a endoskopickou rekurenci po dobu 1 roku a s numerickou, nikoliv statistickou, prospěšností po dobu dalších 2–3 let (45, 50).
Při chronické pouchitidě je podávána terapie řádově týdny (alespoň 4 týdny). Užíván je ciprofloxacin, MT p.o., většinou v kombinaci s budesonidem, nebo lokální léčba MT čípky s eventuální malou dávkou kortikoidů.
Obecná doporučení říkají, že ATB u UC ani u CN nejsou indikována k dlouhodobé léčbě, výjimkou je jen chronická pouchitida, ale jsou i názory, že jsou nedostatečné studie pro tuto léčbu a její pokračování není zcela vyloučeno (12).
Enterální výživa
Enterální výživa (EV) má u ISZ dvě zásadní indikace:
- U pacientů malnutričních (BMI pod 18,5, pokles albuminu, klinicky významný váhový úbytek) je indikována dlouhodobě:
- a) vždy formou sippingu (popíjením v dávce 300–600 kcal/den),
- b) nebo přechodně plnou EV sondou či formou nočního podávání (1000 kcal) s následným sippingem, a to jak u UC tak u CN. Malnutrice je rizikový faktor průběhu choroby a nežádoucích účinků léčby.
- K ovlivnění aktivity a udržení remise vlastní choroby:
- a) U UC nemá význam, nezlepšuje průběh, ani nesnižuje riziko relapsu.
- b) U CN snižuje EV riziko relapsu při dávce větší jak 1000–1200 kcal/den popíjením nebo sondou. Čím je dávka vyšší, tím je riziko relapsu menší. U CN tračníku je bez efektu (51–54).
Parenterální výživa
Parenterální výživu (PV) lze užít u ISZ v indikaci „udržovací“ do doby definitivní operace nebo nástupu účinku biologické léčby v trvání několika měsíců.
U CN po operaci je aplikována dlouhodobě individuálně u syndromu krátkého střeva. U UC není PV indikována (51–54).
Probiotika
Bakteriální střevní flóra bezesporu hraje roli v etiopatogenezi ISZ. Proto jsou probiotika (PB) jasným kandidátem léčby. Ale ačkoliv mnoho pacientů probiotika užívá, není zcela jasně prokazován efekt u UC ani CN.
Jsou ojedinělé studie se Sacharomyces boulardii u UC, kde efekt v udržení remise byl prokázán, ale sestavy jsou malé a ne zcela validní, jsou v nich dohromady pacienti jak bez resekce, tak s resekcí (55).
Kmen Escherichia coli Nissle1917 (200 mg/den) aplikován u UC s lehkou až střední aktivitou – není méně účinný než 5 ASA (1,5 g/den) (56).
Při metaanalýze studií (od roku 1948 do roku 2009), které se zabývaly podáváním probiotik u UC bylo zjištěno, že Escherichia coli Nissle 1917 má stejné výsledky při udržení remise u UC jako mesalazin. Léčba samotným Lactobacillus rhamnosus GG nebo v kombinaci s mesalazinem dává nesignifikantní výsledky. Při podávání bifidobakteriemi fermentovaného mléka dochází k signifikantní redukci exacerbací UC ve srovnání s pacienty, kteří mléko nedostávali (57).
U CN v udržení remise nebyl účinek Sacharomyces boulardii prokázán (58).
Při pouchitidě byl prokázán efekt v udržení remise a při vzplanutí zánětu při vysokém dávkování VSL#3® (přípravek obsahuje živé lyofilizované probiotické bakterie, směs osmi různých kmenů bakterií mléčného kvašení a bifidobakterií: Bifidobacterium longum, Bifidobacterium breve, Bifidobacterium infantis, Lactobacillus acidophilus, Lactobacillus delbrueckii subsp. bulgaricus, Lactobacillus paracasei, Lactobacillus plantarum, Streptococcus thermophilus). Lactobacillus rhamnossus GG byl v této indikaci bez efektu (41).
U CN jsou PB bez efektu.
Kortikosteroidy
Kortikosteroidy (KS) jsou pilířem léčby ISZ (1), ale v dlouhodobé léčbě u CN ani u UC nejsou indikovány ani nejsou účinné ani bezpečné (2, 41, 45, 59), výjimku pochopitelně tvoří kortikodependence. Dlouhodobá léčba KS je spojena s vedlejšími účinky, zejména s osteoporózou (34, 41, 60–62). Délku podávání KS obvykle limitují vedlejší účinky léčby (41).
U ohraničených tvarů distální UC bývá lokálně v nálevech podáván topický kortikoid (budesonid), ale není určen typicky pro udržovací léčbu. Budesonid oddaluje vzplanutí relapsu, ale v udržení remise po dobu jednoho roku není účinný (2, 34, 38). Osteoporóza je při léčbě budesonidem mírnější než u klasických KS, ale zcela eliminována není (34).
Imunosupresiva
Ze skupiny imunosupresiv (IS) jsou nejčastěji užívány thiopuriny, které jsou doporučovány, je-li 5-ASA neúčinná, nebo není dobře snášena nebo je-li pacient kortikosteroiddependentní (23). Azathioprin (AZA) je účinnější než placebo. Vedlejší účinky této léčby, kam patří akutní pankreatitida a potlačení krvetvorby v kostní dřeni, se vyskytují ve více než 10 % případů (63). AZA je doporučován při extenzivní CN (34).
Udržovací terapie IS v profylaxi recidivy po medikamentózně navozené remisi KS je indikována (2).
Udržovací terapie UC po medikamentózně navozené remisi je doporučována pro všechny nemocné s rizikem relapsu. Prediktory zvýšeného rizika relapsu pro UC v remisi jsou: předchozí krátké trvání remise a mladý věk, vysoká frekvence relapsů v předcházejícím období, extenzivní kolitida, potřeba terapie systémovým KS, intolerance a rezistence KS, dependence KS (až 22 % nemocných), předcházela-li indukční terapie cyklosporinem A (CyA), extraintestinální projevy, dieta s nízkým obsahem vlákniny, nezávislým rizikovým faktorem jsou perzistující histopatologické změny v rektální biopsii. Dále je volba udržovací terapie UC determinována extenzí, průběhem, neúspěchem předchozí terapie, stupněm aktivity posledního relapsu, terapií zvolenou pro indukci remise posledního relapsu, bezpečností udržovací terapie a neopomenutím prevence manifestace malignity.
Léčba IS je vhodná u konzervativně léčených nemocných s CN s vysokým rizikem relapsu a nepříznivého vývoje onemocnění, tzn. u pacientů kortikosteroiddependentních (relaps při snížení dávky KS < 15 mg/den), u pacientů kortikosteroidrezistentních, při intoleranci kortikosteroidů a po první atace CN, byla-li remise navozena systémovým KS (u lokalizované formy CN je možné i v tomto případě při příznivém vývoji nezvolit udržovací terapii), objeví-li se relaps do 3 měsíců od ukončení terapie KS, při nutnosti opakovaného podávání KS 2krát (a více) za rok, u extenzivní formy CN (vždy!), u penetrující formy CN, u formy luminální i perianální (perianální CN i s využitím chirurgických postupů u komplexních fistulí) a u extraintestinálních manifestací (34, 40, 44, 49, 64–67).
Léčba thiopurinem (TP) je spojována se zvýšeným, i když nízkým, rizikem lymfoproliferativních onemocnění (< 1 případ na 1000 pacientů za rok) (68). Lehká leukopenie ukazuje, že lék je účinný. Při udržovací léčbě by měl být krevní obraz kontrolován po 3 měsících. Je uváděno, že léky indukovaná pankreatitida se vyskytuje u 3–5 % pacientů v prvních 6 týdnech léčby pomocí AZA nebo 6-MP. Pankreatitida je kontraindikací dalšího podávání IS (1).
TP jsou u ISZ v dlouhodobé terapii lékem první volby, protože udrží prokazatelně navozenou remisi po indukční léčbě KS.
Dávka IS při udržovací léčbě má být stejná jako dávka počáteční. Rutinní snižování dávky není doporučováno u pacientů s normálním krevním obrazem a tzv. jaterními testy a pokud nejsou přítomny vedlejší účinky léčby (12).
Metotrexát (MTX) podáván i.m. nebo s.c. jednou týdně v dávce 25 mg. Po 40 týdnech bylo v remisi 65 % nemocných (při placebu 39 %). Vyskytnou-li se vedlejší účinky, je doporučeno dávku snížit na 15 mg (69).
Anti-tumor necrosis factor alfa
U nemocných s ISZ, kteří neodpoví na imunosupresivní léčbu nebo ji netolerují, je plně indikována léčba anti-tumor necrosis faktorem alfa (anti-TNF-α). V současnosti jsou aplikovány dvě formy anti-TNF-α: infliximab (IFX) u UC i CN a adalimumab (ADA) u CN (35). Dne 4. dubna 2012 byla schválena EMEA nová indikace pro ADA: ulcerózní kolitida u dospělých pacientů (EMEA/H/C/481/II/82 + 91). Prospěšné je časné nasazení biologické léčby u kortikoiddependentních nemocných (70).
Po podání IFX u UC (a prokazované jeho přítomnosti v cirkulaci) je zjišťována vysoká míra remisí a zlepšení endoskopického nálezu, následně je nižší potřeba kolektomií (71).
ADA je účinný v léčbě indukční i udržovací u pacientů s aktivní středně těžkou – těžkou CN, naivních k anti-TNF-α nebo s intolerancí nebo ztrátou odpovědi k IFX a u pacientů s perianální fistulizující formou CN (72–74).
Pacienti se středně těžkou a těžkou CN léčení IFX a AZA nebo IFX monoterapií přejdou do remise spíše než ti, kteří jsou léčeni monoterapií AZA (75).
V dlouhodobé léčbě je účinná léčba IFX i ADA (2, 76). Biologická léčba aplikovaná pravidelně je účinnější než léčba epizodická (34).
Dávka léku při udržovací léčbě má být stejná jako dávka, která vedla k indukci remise (IFX 5 mg/kg, ADA 40 mg každý druhý týden). Je možné dávku zvýšit nebo zkrátit intervaly při ztrátě odpovědi (12).
Kalcineurinové inhibitory
Cyklosporin A (CyA) může být podáván jako přemosťující („bridge“), dokud se neprojeví účinek AZA/6-MP (39).
Ad B. Jak dlouho má (může) být dlouhodobá udržovací léčba podávána?
Názory na dlouhodobé podávání udržovací léčby nejsou příliš rozporné. Přehledně délku léčby uvádí tabulka 2.
2. Délka podávání dlouhodobé udržovací léčby 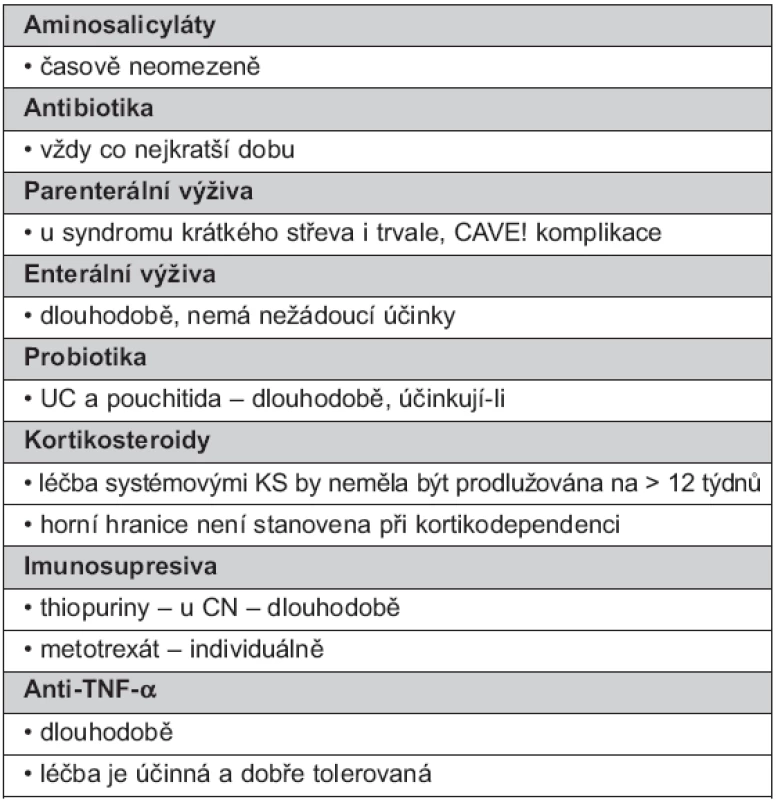
Aminosalicyláty
Preparáty 5-ASA jsou užívány již mnoho let nejen k léčbě lehké a středně těžké aktivní UC a CN, i k udržení remise. 5 ASA mají zřejmě potenciál jako chemopreventivní agens u kolorektálního karcinomu vznikajícího jako komplikace ISZ. Kolorektální karcinom je považován u 10–15 % zemřelých pacientů s ISZ za příčinu úmrtí (78, 79). Metaanalýza 116 studií uvádí prevalenci kolorektálního karcinomu u 3,7 % pacientů s UC a 5,4 % u pacientů s pankolitidou. Kumulativní riziko je vysoké při dlouhém trvání, po 30 letech až 18 % (80).
Udržovací léčba aminosalicyláty u UC je účinnější než podávání placeba. Je podáván mesalazin i sulfasalazin (81).
Dlouhodobá léčba 5-ASA je podávána u pacientů s CN tenkého střeva a u pacientů, kteří přestali kouřit (79).
ASA lze podávat časově neomezeně.
Antibiotika
ATB se mají aplikovat vždy co nejkratší možnou dobu. Maximální doba by neměla překročit 3 měsíce a následně by měl být pacient převeden na jinou terapii, nabízí se imunosuprese nebo chirurgické řešení.
Je k dispozici práce, při které byl podáván ciprofloxacin u pacientů s UC refrakterní k léčbě mesalazienm a KS po dobu 6 měsíců. V remisi nezůstalo 21 % pacientů (82).
Enterální výživa
EV má u ISZ je podávána dlouhodobě zejména u CN, není paušálně indikována u všech, ale má být užita u komplikovaných případů, často rezistentních na léčbu, po opakovaných resekcích a s rizikem další resekce a u pacientů se syndromem krátkého střeva. Po resekci je užita jako sipping po dobu jednoho roku a eventuálně i déle dle vývoje.
EV je možno aplikovat dlouhodobě, nemá nežádoucí účinky.
Parenterální výživa
PV je v některých případech nutné podávat trvale, ale je zapotřebí upozornit na komplikace z ní vyplývající. Jedná se o pacienty se syndromem krátkého střeva po opakovaných resekcích (51–54, 82, 84).
Probiotika
PB jsou dlouhodobě aplikována u UC a pouchitidy (57).
Kortikosteroidy
KS systémové nejsou efektivní v prodloužení medikamentózně navozené remise UC. Léčba systémovými KS by optimálně neměla být prodlužována na více než 12 týdnů, s výjimkou specifických situací. Protrahovaná terapie systémovým KS zvyšuje riziko závažných nežádoucích účinků, které nemusí být závislé na délce a dávce podávání. Pochopitelně horní hranice není stanovena při kortikodependenci.
Budesonid je ve formě rektálního nálevu indikován u ohraničených tvarů UC pro udržovací terapii 2. volby spolu s 5 ASA perorálně. Účinnost rektálních nálevů 5-ASA a topického steroidu rektálně podávaného jsou srovnatelné.
KS systémové a budesonid nejsou efektivní v prodloužení medikamentózně navozené remise CN. Léčba systémovými KS by optimálně neměla být prodlužována > 12 týdnů, s výjimkou specifických situací. Protrahovaná terapie systémovým KS zvyšuje riziko závažných nežádoucích účinků, které ale nemusí být závislé na dávce a délce podávání.
Budesonid, u lokalizované ileocékální formy CN, která je mírně až středně aktivní, může v terapii nahradit systémový KS. Budesonid u ileocékální formy CN může oddálit relaps po medikamentózně navozené remisi. Remisi v takovém případě neprodlouží na déle než 12 měsíců (40, 44, 64, 65).
Thiopuriny
Optimální délka léčby u pacientů s UC není zatím známa. U pacientů s CN jsou k dispozici studie s udržovací léčbou AZA/6-MP v trvání 5 let (31, 86, 87).
TP u ISZ jsou podávány dlouhodobě. Je-li nemocný s CN v dlouhodobé remisi na udržovací terapii AZA, ukončení léčby může být zváženo po 4 letech (34, 88). Data ukazují že, je-li po > 3,5 letech terapie AZA vysazen, riziko relapsu v průběhu dalších 18 měsíců stoupá na 8–21 %. Kumulativní riziko relapsu v 1. roce je 14 %, ve 3. roce 53 % a v 5. roce je 63 %.
Problematickým může být „restart“, tedy návrat na AZA, který je spojen s vyšším rizikem selhání. Je třeba nezapomínat na riziko non-Hodgkinova lymfomu při terapii AZA, zejména u mladých pacientů (89). Na druhé straně je plnohodnotná remise na AZA prospěchem převyšujícím z hlediska kvality života rizika.
Vysoké procento relapsu (50 %) se objeví u CN do 3 let po vysazení AZA u pacientů, kteří byli v remisi při 5leté léčbě (45, 90).
Dlouhodobá léčba TP by měla být ukončena při manifestaci nežádoucích účinků a selhání léčby nebo při ztrátě odpovědi na léčbu.
Pro MTX nejsou evidence-based doporučení pro dobu trvání udržovací terapie. Prolongování léčby je přípustné, ale posouzeno musí být individuálně. U MTX se nepotvrdilo zvýšené riziko těžké hepatotoxicity. Po ukončení léčby MTX je riziko relapsu vysoké (91). MTX je doporučován k léčbě v zemích, kde není k dispozici anti-TNF-α (41).
Anti-TNF-α
Dlouhodobá léčba anti-TNF-α je účinná a dobře tolerovaná.
Při IFX u UC podávaném dlouhodobě (52 týdnů) v dávce 5 mg/kg byla klinická odpověď 69 %. ADA v dávce 40 mg s.c. každý druhý týden nebo každý týden udržel remisi po jednom roce u 68 %, resp. u 83 %. ADA je účinný i u některých pacientů s CN, kteří dříve odpověděli na IFX, ale u kterých došlo ke ztrátě odpovědi, nebo měli alergickou reakci po infuzi a nemohli tak v léčbě pokračovat (12).
Kalcineurinové inhibitory
Cyklosporin A (CyA) pro udržovací terapii ISZ není indikován. Ale, je-li podáván perorálně, je možné pokračovat po dobu 3–6 měsíců, než je možná operace nebo než nastoupí účinek AZA. Pacient s dlouhodobou profylaxí CyA je ohrožen pneumonií způsobenou Pneumocystis jiroveci. Jako profylaxe se podává trimetoprim-sulfametoxazol (31).
Ad C. Kdy se má (může) ukončit dlouhodobá léčba?
Tato otázka není ve všech případech definitivně dořešena, současné názory jsou přehledně v tabulce 3.
3. Ukončení dlouhodobé udržovací léčby 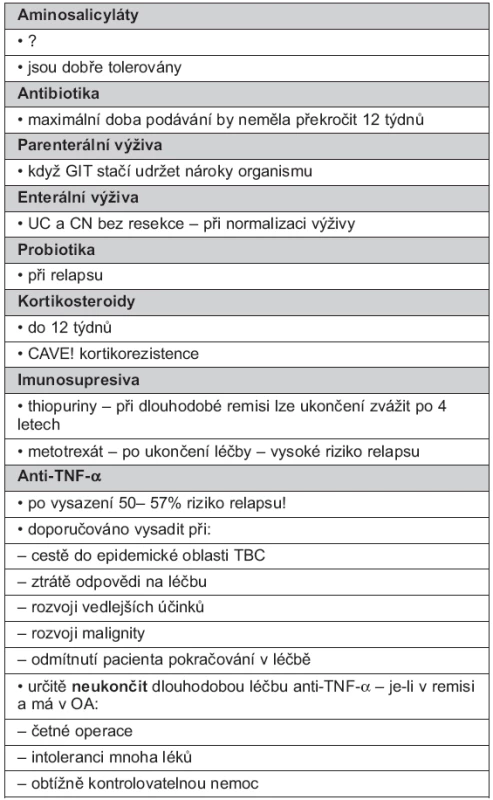
Aminosalicyláty
Dlouhodobost terapie provedené studie neřeší, ASA jsou dobře tolerovány, stále zvažován možný profylaktický efekt stran snížení rizika vzniku kolorektálního karcinomu. Pokud jsou ASA dobře tolerovány, lze je podávat neomezenou dobu (78, 79).
Antibiotika
Oficiální data jsou nejednotná a sporná, některé práce a klinická praxe prokazuje efekt ATB terapie, jejíž maximální doba by neměla překročit 3 měsíce (většinou kombinace ciprofloxacin a MT). Jde o prevenci předpokládaných septických komplikací u aktivní choroby. Následně je nezbytné převedení na jinou terapii (imunosuprese, chirurgické řešení) (41, 49).
Při chronické pouchitidě je podávána ATB terapie řádově týdny (4 týdny).
Enterální výživa
EV je obvykle ukončena u UC a CN bez resekce, pokud se normalizoval stav výživy (83, 84).
Parenterální výživa
PV je možno ukončit, když gastrointestinální trakt, po navození remise nebo obnovení střevní pasáže, dokáže udržet nutriční nároky organismu (51–54).
Probiotika
Léčba PB je ukončena při relapsu (57).
Kortikosteroidy
Jak již bylo řečeno, podávání KS by nemělo překročit 12 týdnů, s výjimkou kortikodependence (64, 65).
Thiopuriny
V případě, že uvažujeme o ukončení léčby TP, je nutné zhodnotit rozsah a aktivitu onemocnění (včetně morfologie), adherenci nemocného k terapii a potenciální komplikace a nežádoucí účinky léčby. Je-li dávka IS optimální, nejsou důkazy, že by další navyšování dávky bylo efektivní, naopak jde o velmi rizikový krok. Při intoleranci nebo nežádoucích účincích IS se doporučuje převést pacienta na jinou alternativu imunosuprese (MTX nebo anti-TNF-α).
Selhává-li léčba IS, je vhodné se vyhýbat použití systémových KS, pokud to není nevyhnutelné. Krátkodobé podání KS může být nezbytné k překlenutí doby nástupu efektu jiného IS, dávka KS by měla být (s ohledem na minimalizaci nežádoucího účinku terapie) postupně snižována (40, 44, 64, 66, 67). Při dlouhodobé remisi lze ukončení aplikace TP zvážit po 4 letech (34, 88).
CAVE! Po ukončení léčby MTX hrozí vysoké riziko relapsu!
Anti-TNF-α
Anti-TNF-α jsou podávány dlouhodobě, i když je pacient asymptomatický. Vysazovány jsou při: 1. plánované cestě, zejména do oblasti s endemickou TBC, 2. ztrátě odpovědi na léčbu, 3. rozvoji vedlejších účinků, 4. rozvoji malignity, 5. nechuti pacienta pokračovat v léčbě.
CAVE! Po vysazení anti-TNF-α se do 6 měsíců objeví relaps v 50–57 %.
Určitě nelze ukončit dlouhodobou léčbu anti-TNF-α u pacienta s CN (i když je v remisi), ale v anamnéze má četné operace, nesnáší mnoho léků a jeho nemoc je obtížně kontrolovatelná (92).
Prolongovaná terapie biologickou léčbou je přípustná s respektováním kontraindikací (34, 40, 41, 64–67).
Ukončení léčby údajně ovlivňují i místní zvyklosti, pacientova preference nebo proplácení léku, ale dostupná data nejsou dostatečná, aby bylo možné přikazovat zastavení aplikace (70). Padesát procent pacientů s CN léčených déle než jeden rok IFX a antimetabolity mají do jednoho roku po ukončení léčby IFX relaps (6, 88).
Kalcineurinové inhibitory
CyA je užíván prakticky jen při akutní těžké UC, neměl by být podáván déle než 6 měsíců, protože působí renální insuficienci a hypertenzi. Po vysazení CyA jsou popsány časté kolektomie (1, 41).
Ad D. Jak postupovat při relapsu během dlouhodobé udržovací léčby?
Postup při relapsu při dlouhodobé léčbě se příliš neliší od obvyklé léčby step-up, záleží na aktuální terapii, názory jsou přehledně uvedeny v tabulce 4.
4. Léčba relapsu při dlouhodobé udržovací léčbě 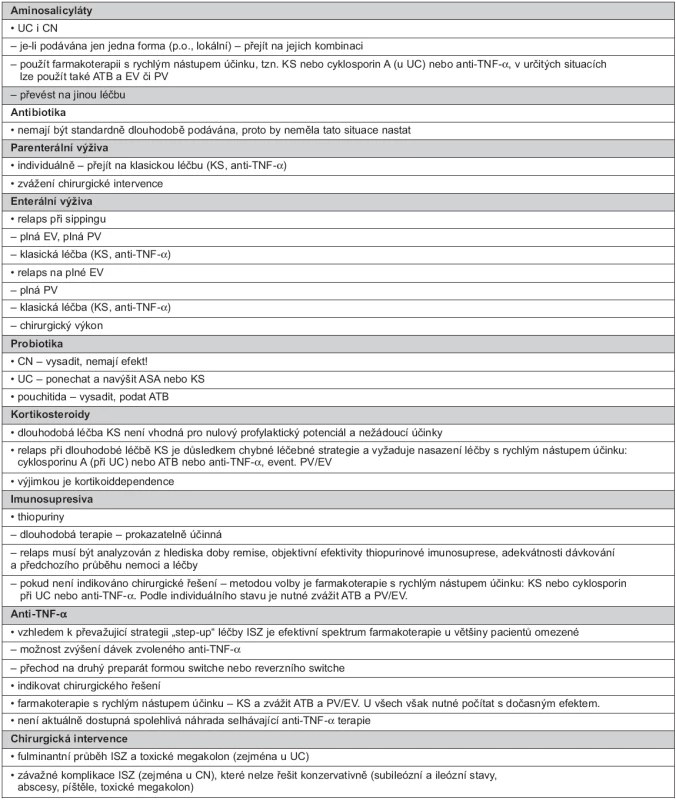
Aminosalicyláty
ASA jsou dlouhodobě podávány často jak u UC, tak i u CN. V případě, že je léčba jen p.o., přidáváme při postižení terminální části tračníku nebo rekta ASA lokální. A naopak, pokud má pacient jen lokální ASA, zintenzivníme léčbu současnou aplikací léků perorálně. Nebo přidáme krátkodobě lék jiné skupiny (KS), nebo pacienta převedeme na jinou („vyšší“) terapii (37).
Antibiotika
Nejsou (nemají být) v dlouhodobé léčbě podávána.
Enterální výživa
Objeví-li se relaps při sippingu, převedeme pacienta na plnou EV nebo PV. Je-li relaps u pacienta, který je na plné EV, převedeme jej na PV. A v obou případech pokračujeme v intenzivní léčbě klasické (KS, anti-TNF-α) (83, 84).
Parenterální výživa
Pokračujeme v klasické léčbě (KS, anti-TNF-α), u které zvýšíme dávku nebo zkrátíme intervaly aplikace a zvažujeme chirurgickou intervenci (83, 84).
Probiotika
U CN je možné PB vysadit, protože v indukční léčbě efekt prokázán nebyl.
U UC možno PB ponechat a navýšit současně ASA nebo KS.
Při pouchitidě je vhodné PB vysadit a podat ATB. Po zklidnění je možné znovu PB podat.
Kortikosteroidy
U pacientů s dlouhodobou léčbou KS, tedy kortikoiddependentních, je při relapsu nutný rychlý zásah – podat CyA u UC, ATB nebo anti-TNF-α a převést pacienta na EV nebo PV, a začít aplikovat TP, jejichž účinek nastoupí v odstupu několika měsíců.
Selhává-li léčba IS, je lépe se vyhýbat použití systémových KS (pokud to není zcela nezbytné).
Krátkodobé podání KS může být nevyhnutelné k překlenutí doby nástupu efektu jiného IS, dávka KS by měla být (s ohledem na minimalizaci nežádoucích účinků terapie) postupně snižována.
Thiopuriny
Dojde-li k relapsu, je nutné přehodnotit rozsah a aktivitu onemocnění (včetně morfologie), adherenci nemocného k terapii a potenciální komplikace a nežádoucí účinky léčby. Je-li dávka imunosupresiva optimální, nejsou důkazy, že by další navyšování dávky bylo efektivní, naopak jde o velmi rizikový krok. Pak přichází v úvahu jiná alternativa (KS nebo MTX nebo anti-TNF-α). V úvahu přichází EV nebo PV a je potřebné zvážit i chirurgické řešení.
Stejně tak při intoleranci nebo nežádoucích účincích při léčbě TP, lze převést nemocného na methotrexát nebo anti TNF α (34).
Asi 13 % nemocných s UC má tzv. „indolentní (benigní) formu UC“, tedy onemocnění s příznivým průběhem, bez relapsů v prvních 5 letech od diagnózy. U těchto nemocných je možné ukončení medikamentózní terapie a další pravidelné sledování vývoje (93).
Anti-TNF-α
Při relapsu při léčbě anti-TNF-α, je v první řadě doporučeno navýšit dávku nebo zkrátit intervaly mezi aplikacemi, přejít na druhý preparát (pokud je nemocný léčen IFX, zaměnit za ADA), eventuálně přidat KS a ATB a zavést EV nebo PV. Jsou-li tato opatření bez efektu, zvážit chirurgické řešení (41).
Ad E. Jaké jsou indikace dlouhodobé léčby po chirurgickém výkonu?
Patofyziologie pooperační rekurence u CN je neznámá, pravděpodobně je stejná jako u CN před operací a je nepředvídatelná. Roli hrají zřejmě bakteriální flóra, vlivy zevního prostředí (např. kouření, dieta), imunitní odpověď a obviňováno je i genetické vybavení (94–96). Kouření cigaret zdvojnásobuje riziko rekurence a je nejen rizikovým faktorem rozvoje CN, ale má vliv i na aktivitu nemoci po resekci (97). Vyšší pooperační rekurence je sdružena s vyšší předoperační aktivitou nemoci a lokalizací nemoci v době diagnózy (17).
Dvacet až dvacet pět procent pacientů s UC vyžaduje chirurgický zákrok v případě, že konzervativní léčba nestačí, nebo při přítomnosti dysplazie. Chirurgická resekce (proktokolektomie) u UC je pokládána za kurativní.
Sedmdesát až sedmdesát pět procent pacientů s CN při neúčinnosti konzervativní léčby nebo při komplikacích potřebuje chirurgický zákrok. Operace u CN je málokdy kurativní, po chirurgickém zákroku často nemoc rekuruje. Ale u některých pacientů může operace vést i k dlouhodobější remisi (41, 98). Zásadním opatřením po operaci pro CN je ukončení kouření (34, 41)!
Endoskopická rekurence po ileokolonické resekci pro CN je popisována ve 28–93 % během jednoho roku, a klinický relaps je popisován ve 20 % během prvního roku a ve 34 % během 3 let. Průměrně 30 % pacientů potřebuje reoperaci během 10 let (38). Radikální resekce u CN není prevencí rekurence (99).
Prevence rekurence po střevní resekci je zásadním cílem v léčbě CN v této fázi. Po kompletní resekci se endoskopické léze objeví do jednoho roku u 70–90 % operovaných, ale jen 10–20 % má příznaky (5).
V preventivní dlouhodobé léčbě nebyla prokázána účinnost při podávání budesonidu (95, 100, 101), kortikosteroidů (102), interleukinu 10 (103), probiotik (104), kombinace probiotik s prebiotiky (105) a rybího oleje (102).
Po operaci musí klinik spolu s pacientem pečlivě rozvážit, jak pokračovat: 1. bez léčby nebo s léčbou ASA – u pacientů s velmi nízkým rizikem rekurence, 2. imunosupresivy (eventuálně v kombinaci s MT na omezenou dobu) – u pacientů se středním rizikem rekurence, 3. anti-TNF-α – u nemocných s vysokým rizikem rekurence. Kolonoskopie má být provedena za 6–12 měsíců po operaci k identifikaci rekurence (106) (tabulka 5).
5. Indikace dlouhodobé udržovací léčby po chirurgickém výkonu 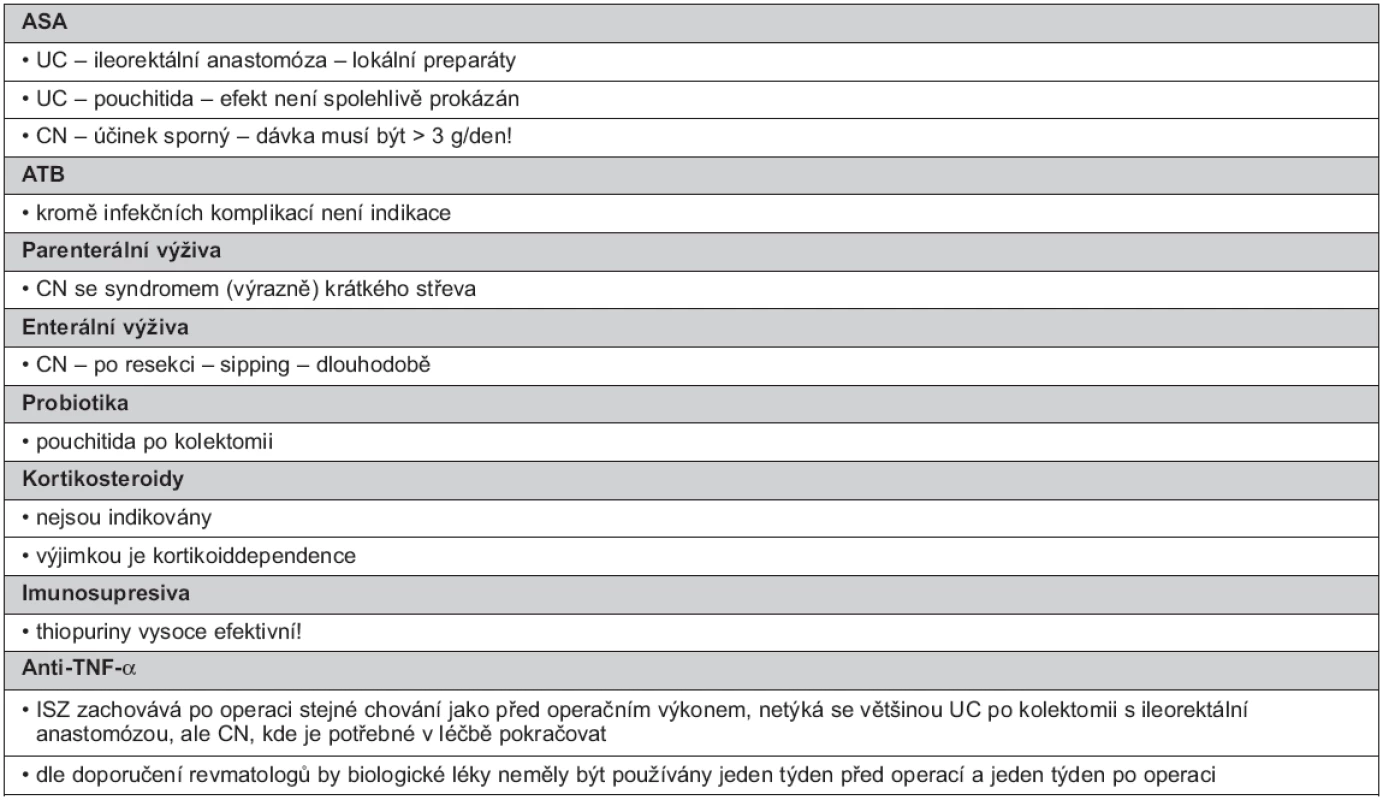
Aminosalicyláty
U pacientů s UC po operaci s vytvořenou ileorektální anastomózou je považována za vhodnou lokální terapie ASA. Při UC po operaci s vytvořením pouche s následnou pouchitidou není efekt spolehlivě prokázán.
Při CN je účinek sporný, pokud jsou ASA podávány, jsou doporučovány dávky nejméně 3 g perorálně/den. Některé výsledky prokazují snížení rizika endoskopické rekurence CN o 18 % a klinické rekurence o 15 %. Existuje i názor, že pooperační udržovací léčba p.o. podávanou 5-ASA snižuje frekvenci a tíži rekurence (38, 41, 107).
Antibiotika
ATB nejsou k dlouhodobé léčbě indikována, výjimkou jsou infekční komplikace.
Metronidazol 20 mg/kg po dobu 3 měsíců signifikantně snižuje incidenci závažné endoskopické rekurence po dobu jednoho roku (zejména u pacientů po ileocekální resekci). Podávání je limitováno vedlejšími účinky MT (dysgeuzie a neuropatie). Ornidazol podávaný od 10. dne po operaci v dávce 1 g/den a pokračující jeden rok je prospěšnější než placebo jak v procentu klinické, tak endoskopické rekurence (38, 41).
Při pouchitidě jsou podávána antibiotika (metronidazol, ciprofloxacin nebo rifaximin) délka podávání se řídí aktivitou onemocnění (23).
Enterální výživa
Indikací EV jsou komplikované případy CN, často rezistentní na léčbu, po opakovaných resekcích s rizikem potřeby další resekce při relapsu a rozvojem syndromu krátkého střeva. Protože enterální výživa nemá nežádoucí účinky je možné ji aplikovat dlouhodobě a opakovaně.
Doporučováno je pravidelné cyklické podávání plné EV (2krát ročně na dobu 2 měsíců). Má dobrý účinek na oddálení relapsu. Po roce vyhodnocujeme efekt léčby. Sipping je indikován po resekci terminálního ilea na dobu 6–12 měsíců (51–54, 84).
Parenterální výživa
PV není indikována k udržovací léčbě CN, ale může být podávána dlouhodobě individuálně při CN se syndromem krátkého střeva, kdy trávicí trakt nedokáže zajistit potřeby organismu (51–54, 84).
Probiotika
PB (VSL#3) jsou indikována při pouchitidě (108). Incidence pouchitidy je vysoká, je prokazována až ve 40 % a zůstává chronickou až ve 20 % (109). Příčinou pouchitidy je nespecifický zánět pravděpodobně způsobený nově se vyskytujícími bakteriálními kmeny v ileálním pouchi, kdy dojde k bakteriální nerovnováze, dysbióze (110). PB jsou podávána dlouhodobě, jsou účinná v prevenci rekurence. Při selhání funkce pouche je provedena jeho excize, která je nahrazena trvalou stomií (23).
Kortikosteroidy
KS podávané po dobu kratší než 1 měsíc mohou být rychle vysazeny. KS (v dávce 20 mg a větší/den) podávané po dobu 1–3 měsíců, mají být po operaci vysazovány postupně snižováním dávky o 5 mg/den každý týden. KS podávané po dobu 3–6 měsíců mají být snižovány redukcí dávky o 2,5 mg/den každý týden. KS podávané déle než 6 měsíců mají být redukovány pomalu o 1 mg/týden (41). KS musí být perioperačně aplikovány u kortikodependence.
Budesonid v dávce 3–6 mg/den není účinný v prevenci pooperační ani klinické ani endoskopické rekurence (38, 101, 111).
Thiopuriny
TP jsou považovány za vysoce efektivní pooperační profylaxi. Pooperační udržovací léčba AZA/6-MP snižuje frekvenci a tíži rekurence (41).
Přerušení léčby TP při chirurgickém výkonu je predikujícím faktorem klinické rekurence. Proto má léčba TP pokračovat i po operaci (112). Při léčbě AZA podávané perioperačně není zvýšené riziko (41).
Pooperační udržovací terapie IS potlačí nepříznivou prognózu přirozeného vývoje onemocnění. Po ileocékální resekci bez medikamentózní profylaxe je endoskopická rekurence v 1. roce vysoká, dosahuje 65–90 % a klinicky se rekurence projeví jen ve 20–25 %. V průběhu dalších 3 let je endoskopická rekurence 80–100 %.
Indikacemi podání IS u CN po operaci: 1. po ileocékální resekci a závažné prognóze (podat IS časně po 2. týdnu od operace), 2. po extenzivní resekci zejména tenkého střeva, 3. obvykle je IS podáváno i po segmentální resekci ilea a tračníku, ale nejsou k dispozici dostatečná data.
TP jsou kombinovány s MT, s dobrou účinností zejména u pacientů po druhé resekci. Je-li tato kombinace podávána u pacientů, kteří zanechali kouření, výrazně se sníží riziko reoperace. Dále je vhodná tato kombinace u vysoce rizikových pacientů s CN (kuřáci, nemocní po druhé resekci a u penetrující nemoci). TP jsou v pooperační profylaxi efektivnější než 5-ASA nebo imidazol (17, 113, 114).
Anti-TNF-α
Za léky účinné v udržení pooperační remise je považován jak IFX (115), tak ADA (17, 116).
V léčbě je potřebné při CN po operaci pokračovat. Dle doporučení amerických revmatologů by biologické léky neměly být používány jeden týden před operací a jeden týden po operaci (117).
ZÁVĚR
- Remise je zachovávána jen dlouhodobou léčbou.
- Prospěch dlouhodobé léčby musí převyšovat rizika.
- Optimální délka podávání léků není známa.
- Trvale podávaná udržovací léčba je menším zdrojem protilátek než léčba epizodická.
- Schéma aplikace musí být jednoduché a stereotypní.
- Sledování a kontrolování má být pravidelné a ostražité.
- Při počínajících příznacích, i jen subklinického zánětu, reagovat úpravou léčby.
- Za léky účinné v udržení remise jsou považovány thiopuriny (AZA), infliximab a adalimumab.
- V současné době je biologická léčba nejefektivnější a není k dispozici farmakoterapie, která by ji spolehlivě nahradila. Ukončení efektivní biologické terapie s přechodem na imunosupresivní profylaxi je zatíženo do 12 měsíců 50% rizikem relapsu.
- Anti-TNF-α není vhodné vysazovat u pacientů po četných operacích, mnohočetné lékové intoleranci a špatně kontrolované nemoci.
- A konečně zůstává zásadní názor, že léčba má pokračovat – i je-li pacient asymptomatický.
Zkratky
5-ASA – mesalazin
ADA – adalimumab
anti-TNF-α – anti tumor necrosis factor α
ASA – aminosalicylát
ATB – antibiotikum
AZA – azathioprin
CN – Crohnova nemoc
CT – výpočetní tomografie
CyA – cyklosporin A
EV – enterální výživa
IFX – infliximab
IS – imunosupresivum
ISZ – idiopatický střevní zánět
KS – kortikosteroid
MRI – magnetická rezonance
MT – metronidazol
MTX – metotrexát
PB – probiotikum
PV – parenterální výživa
TP – thiopurin
UC – ulcerózní kolitidaADRESA PRO KORESPONDENCI:
MUDr. Karel Lukáš, CSc.
Gastroenterologické centrum
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
e-mail: klukas@vfn.cz
Sources
1. Pithadia AB, Jain S. Treatment of inflammatory bowel disease. Pharmacol Rep 2011; 63(3): 629–642.
2. Lichtenstein GR, Hanauer SB, Sandborn WJ, The Practice Parameters Committee of the American College of Gastroenterology. Management of Crohn’s disease in adults. Am J Gastroenterol 2009; 104 : 465–483.
3. Arai R. Therapy Adherence in Crohn’s Disease: An Adult Case Study. Case Rep Gastroenterol 2010; 4 : 153–157.
4. Peyrin-Biroulet L, Lémann M. Review article: remission rates achievable by current therapies for inflammatory bowel disease.Aliment Pharmacol Ther 2011; 33(8): 870–879.
5. Prantera C, Scribano ML. Which type of treatment is advisable in the prevention of recurrence after surgery in Crohn’s disease? Inflamm Bowel Dis 2008; 14(Suppl 2): S277–278.
6. Louis E, Collard A, Oger AF, Degroote E, Aboul Nasr El Yafi FA, Belaiche J. Behaviour of Crohn’s disease according to the Vienna classification: changing pattern over the course of the disease. Gu. 2001; 49(6): 777–782.
7. Cosnes J, Cattan S, Blain A, Beaugerie L, Carbonnel F, Parc R, Gendre JP. Long-term evolution of disease behavior of Crohn’s disease. Inflamm Bowel Dis 2002; 8(4): 244–250.
8. Michener WM, Whelan G, Greenstreet RL, Farmer RG. Comparison of the clinical features of Crohn’s disease and ulcerative colitis with onset in childhood or adolescence. Cleve Clin Q 1982 Spring; 49(1): 13–16.
9. Hoie O, Wolters FL, Riis L, et al. Low colectomy rates in ulcerative colitis in an unselected European cohort followed for 10 years. Gastroenterology 2007; 132(2): 507–515.
10. Loftus EV Jr, Schoenfeld P, Sandborn WJ. The epidemiology and natural history of Crohn’s disease in population-based patient cohorts from North America: a systematic review. Aliment Pharmacol Ther 2002; 16(1): 51–60.
11. Etienney I, Bouhnik Y, Gendre JP, et al. Crohn’s disease over 20 years after diagnosis in a referral population. Gastroenterol Clin Biol 2004; 28(12): 1233–1239.
12. Stenson WF, Hanauer SB, Cohen RS. Inflammatory bowel disease. In: Yamada T, ed. Textbook of gastroenterology. Willey-Blackwell Oxford 2009; 1386–1472.
13. Mowat C, Cole A, Windsor A. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60(5): 571–607.
14. Faubion WA Jr, Loftus EV Jr, Harmsen WS, Zinsmeister AR, Sandborn WJ. The natural history of corticosteroid therapy for inflammatory bowel disease: a population-based study. Gastroenterology 2001; 121(2): 255–260.
15. Edwards EC, Truelove SC. The course and prognosis of ulcerative colitis. Gut 1963; 4 : 299–315.
16. Rutgeerts P. Review article: recurrence of Crohn’s disease after surgery – the need for treatment of new lesions. Aliment Pharmacol Ther 2006; 24(Suppl 3): 29–32.
17. Nos P, DomŹnech E. Postoperative Crohn’s disease recurrence: A practical approach. World J Gastroenterol 2008; 14(36): 5540–5548.
18. Sankey EA, Dhillon AP, Anthony A, et al. Early mucosal changes in Crohn’s disease. Gut 1993; 34 : 375–381.
19. Yamamoto T. Factors affecting recurrence after surgery for Crohn’s disease. World J Gastroenterol 2005; 11 : 3971–3979.
20. Lukáš K. Idiopatické střevní záněty – predikce průběhu a včasná léčba. Čas Lék čes 2011; 150(6): 315–320.
21. Loly C, Belaiche J, Louis E. Predictors of severe Crohn’s disease. cand J Gastroenterol 2008; 43 : 948–954.
22. Abraham C, Cho JH. Inflammatory Bowel disease. N Engl J Med 2009; 361(21): 2066–2078.
23. Danese S, Fiocchi C. Ulcerative Colitis. N Engl J Med 2011; 365(18): 1713–1725.
24. D’Haens G, aert , an Assche G, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet 2008; 371(9613): 660–667.
25. Markowitz J, Grancher K, Kohn N, Lesser M, Daum F. A multicenter trial of 6-mercaptopurine and prednisone in children with newly diagnosed Crohn’s disease. Gastroenterology 2000; 119 : 895–902.
26. Cosnes J, Seksik P. Inflammatory bowel disease: from sulfasalazine to biologics. Gastroenterol Clin Biol 2009; 33(8–9): 692–701.
27. Hanauer SB. Clinical perspectives in Crohn’s disease. Turning traditional treatment strategies on their heads: current evidence for „step-up“ versus „top-down“. Rev Gastroenterol Disord 2007; 7(Suppl 2): S17–22.
28. Bodger K. Cost effectiveness of treatments for inflammatory bowel disease. Pharmacoeconomics 2011; 29(5): 387–401.
29. Shergill AK, Terdiman JP. Controversies in the treatment of Crohn’s disease: the case for an accelerated step-up treatment approach. World J Gastroenterol 2008; 14(17): 2670–2677.
30. Baert F, Moortgat L, Van Assche G, et al. Mucosal healing predicts sustained clinical remission in patients with early-stage Crohn’s disease. Gastroenterology 2010; 138(2): 463–468.
31. Su C, Lichtenstein GR. Ulcerative Colitis. In: Feldman M, Friedman LS, Brandt LJ. (eds.) Sleisenger and Fordtrans Gastrointestinal and Liver Disease. 8th edition. Saunders Elservier Philadelphia 2006; 2499–2548.
32. Pariente B, Cosnes J, Danese S, et al. Development of the Crohn’s Digestive Damage Score, the Léman Score. Inflamm Bowel Dis 2011; 17(6): 1415–1422.
33. Yanai H, Hanauer SB. Assessing Response and Loss of Response Biological Therapies in IBD. Am J Gastroenterolol 2011; 106 : 685–698.
34. Dignass A, Van Assche G., Lindsay JO, Lémann M, et al. The second European evidence-based consensus on the diagnosis and management of Crohn’s disease. JCC 2010; 4 : 40–50.
35. Hamlin PJ, Warren L, Everett SM. Establishing a biologics service for patients with inflammatory bowel disease. Frontline Gastroenterology 2011; 2 : 133–139.
36. D’Albasio G, Trarolli G, Ghetti A, et al. Intermittent therapy with high-dose 5-aminosalicylic enemas for maintenance remission in ulcerative proctosigmoiditis. Dis Colon Rectum 1990; 33 : 394–397.
37. Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2006; 2: CD000544.
38. Kozuch PL, Hanauer SB. Treatment of inflammatory bowel disease: A review of medical therapy. World J Gastroenterol 2008; 14(3): 354–377.
39. Hecht TE, Su CG, Lichtenstein GR. Medical therapy of inflammatory bowel disease. In: Cohen RD. (ed.) Inflammatory bowel disease: diagnosis and therapeutics. Totowa, New Yersey: Humana Press 2003 : 131–156.
40. Travis SP, Stange EF, Leman M, et al. European evidence – based consensus on the management of ulcerative colitis: Current management. J Crohn Colitis 2008; 2 : 24–62.
41. Bernstein CN, Krabshuis JH, Fedail S, t al. World gastroenterology organization practice guidelines for the diagnosis and management of IBD in 2010. Inflamm Bowel Disease 2010; 16(1): 112–124.
42. d’Albasio G, Pacini F, Camarri F, et al. Combined therapy with 5-aminosalicylic acid tablets and enemas for maintaining remission in ulcerative colitis: a randomized double-blind study. Am J Gastroenterol 1997; 92 : 1143–1147.
43. Ford AC, Khan KJ, Achkar J-P, Moayyedi P. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2011; doi: 10.1038/ajg.2011.410
44. Travis SP, Stange EF, Lémann M, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: current management. Gut 2006; 55(Suppl 1): i16–35.
45. Sands BE. Crohn’s Disease. In: Feldman M, Friedman LS, Brandt LJ. (eds.) Sleisenger and fordtrans gastrointestinal and liver disease. 8th edition. Philadelphia: Saunders Elservier 2006; 2459–2498.
46. Camma C, Giunta M, Rosselli M, Cottone M. Mesalamine in the maintenance treatment of Crohn’s disease. A meta-analysis adjusted for confounding variables. Gastroenterology 1997; 113 : 1465–1473.
47. Gendre JP, Mary JY, Florent C, et al. Oral mesalamine (Pentasa) as maintenance treatment in Crohn’s disease: a multicenter placebo-controlled study. The Groupe d‘Etudes Thérapeutiques des Affections Inflammatoires Digestives (GETAID). Gastroenterology 1993; 104(2): 435–439.
48. Esser D, Cornillie F, Diamond RH, Spiegel RJ. On the updated ECCO consensus guidelines for medical management of Crohn’s disease. J Crohns Colitis 2011; 5(2): 165–166.
49. Stange EF, Travis SP, Vermeire S, et al. European evidence-based Consensus on the diagnosis and management of ulcerative colitis: definitions and diagnosis. J Crohns Colitis 2008; 2(1): 1–23.
50. Rutgeerts P, Hiele M, Geboes K, t al. Controlled trial of metronidazole treatment for prevention of Crohn’s recurrence after ileal resection. Gastroenterology 1995; 108 : 1617–1621.
51. Yamamoto T, Nakahigashi M, Umegae S, Matsumoto K. Enteral nutrition for the maintenance of remission in Crohn’s disease: a systematic review. Eur J Gastroenterol Hepatol 2010; 22(1): 1–8.
52. Yamamoto T, Nakahigashi M, Umegae S, Matsumoto K. Prospective clinical trial: enteral nutrition during maintenance infliximab in Crohn’s disease. J Gastroenterol. 2010; 45(1): 24–29.
53. Yamamoto T, Nakahigashi M, Saniabadi AR, Iwata T, Maruyama Y, Umegae S, Matsumoto K. Impacts of long-term enteral nutrition on clinical and endoscopic disease activities and mucosal cytokines during remission in patients with Crohn’s disease: a prospective study. Inflamm Bowel Dis 2007; 13(12): 1493–1501.
54. Lochs H. Enteral nutrition-the new maintenance therapy in Crohn’s disease? Inflamm Bowel Dis 2007; 13(12): 1581–1582.
55. Guslandi M, Giollo P, Testoni PA. A pilot trial of Saccharomyces boulardii in ulcerative colitis. Eur J Gastroenterol Hepatol 2003; 15(6): 697–698.
56. Kruis W, Frič P, Pokrotnieks J, et al. Maintaining remission of ulcerative colitis with probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004; 53(11): 1617–1623.
57. Do VT, Baird BG, Kockler DR. Probiotics for maintaining remission of ulcerative colitis in adults. Ann Pharmacother 2010; 44(3): 565–571.
58. Thomas S, Metzke D, Schmitz J, Dörffel Y, Baumgart DC. Anti-inflammatory effects of Saccharomyces boulardii mediated by myeloid dendritic cells from patients with Crohn’s disease and ulcerative colitis. Am J Physiol Gastrointest Liver Physiol 2011; 301(5): 1083–1092.
59. Steinhart AH, Ewe K, Griffiths AM, et al. Corticosteroids for maintaining remission of Crohn’s disease. Cochrane Database Syst Rev 2000; 2: CD000301.
60. Van Asche G, Dignass A, Panes J, et al. The second European evidence-based consensus on diagnosis and management of Crohn’s disease: Definition and diagnosis. J Crohn’s Colitis 2010; 4(1): 7–27.
61. van Asche G, Dignass A, Reinisch W, et al. The second European evidence-based consensus on diagnosis and management of Crohn’s disease: Special situations. J Crohn’s Colitis 2010; 4(1): 63–101.
62. Caprilli R, Gassull MA, Escher JC, et al. European evidence based consensus on the diagnosis and management of Crohn’s disease: special situation. Gut 2006; 55(Suppl 1): i36–58.
63. Ardizzone S, Maconi G, Russo A, Ibesi V, Colombo E, Bianchi Porro C. Randomised controlled trial of azathioprine and 5-aminosalicylic acid for treatment of steroid dependent ulcerative colitis. Gut 2006; 55 : 47–53.
64. Halley NJ, Areu MT, Achkar JP, Bernstein CN, et al. An evidence-based systematic review on medical therapies for inflammatory bowel disease. Am J Gastroenterol 2011; 106(Suppl 1): 1–24.
65. Ford AC, Bernstein CN, Khan KJ, et al. Glucocorticosteroide therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 : 590–599.
66. Khan KJ, Dubinsky MC, Ford AC, et al. Efficacy of immunosupresive therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 : 630–642.
67. Ford AC, Khan KJ, Sandborn WJ, et al. Efficacy of biological therapies in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 : 644–659.
68. Beaugerie L, Brousse N, Bouvier AM, et al. Lymfoproliferative disorders in patients receiving thiopurines for inflammatory boel disease: a prospective observational cohort study. Lancet 2009; 374 : 1617–1625.
69. Feagan BG, Fedorak RN, Irvine EJ, et al. A comparison of methotrexate with placebo for the maintenance of remission in Crohn’s disease. North American Crohn’s Group Investigatiators. N Engl J Med 2000; 342 : 1627–1632.
70. D’Haens GR, Panaccione R, Higgins PD, et al. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohn‘s and Colitis Organization: when to start, when to stop, which drug to choose, and how to predict response? Am J Gastroenterol 2011; 106(2): 199–212.
71. Seow CH, Newman A, Irvin SP, Steinhart AH, Silverberg MS, Greenberg GR. Trough serum infliximab: a predictive factor for clinical outcome of infliximab treatment in acute ulcerative colitis. Gut 2010; 59 : 49–54.
72. Guidi L, Pugliese D, Armuzzi A. Update on the management of inflammatory bowel disease: specific role of adalimumab. Clin Experimental Gastroeterol 2011; 4 : 163–172.
73. Fiorino G, Szabė H, Fries W, Malesci A, Peyrin-Biroulet L, Danese S. Adalimumab in Crohn’s disease: tips and tricks after 5 years of clinical experience. Curr Med Chemistry 2011; 18(8): 1–9.
74. Pracovní skupina pro idiopatické střevní záněty ČGS. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů. Čes a Slov Gastroent a Hepatol 2008; 62(5): 285–291.
75. Colombel JF, Sandborn WJ, Reinisch W, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med 2010; 362 : 1383–1395.
76. Behm BW, Bickston SJ. Tumor necrosis factor-alpha antibody for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2008; (1): CD006893.
77. Feagan BG, Léman M, Befrits R, et al. Recommendations for the treatment of Crohn’s disease with tumor necrosis factor antagonists: an expert consensus report. Inflamm Bowel Dis 2012; 18(1): 152–160.
78. Munkholm P. 5-aminosalicylic acid and colorectal cancer prevention in inflammatory bowel disease. Eur Gastroenterol. Hepatol Review 2011; 160–165.
79. Bergman R, Parkes M. Systematic review the use of mesalazine in inflammatory bowel disease. Aliment Pharmacol Ther 2006; 23 : 841–855.
80. Baden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a metaanalysis. Gut 2001; 48 : 526–535.
81. Sutherland L, Macdonald JF. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2006; CD000544.
82. Turunen UM, Farkilla MA, Hakala K, t al. Long-term treatment of ulcerative colitis with ciprofloxacin: a prospective double-blind, placebo controlled study. Gastroenterology 1998; 115 : 1072–1078.
83. Verma S, Kirkwood B, Brown S, Giaffer MH. Oral nutritional supplementation is effective in the maintenance of remission in Crohn’s disease. Dig Liver Dis 2000; 32(9): 769–774.
84. Akobeng AK, Thomas AG. Enteral nutrition for maintenance of remission in Crohn’s disease. Cochrane Database Syst Rev 2007; (3): CD005984.
85. Leung Y, Heyman MB, Mahadevan U. Transitioning adolescent inflammatory bowel disease patient: guidelines for the adult and pediatric gastroenterologist. Inflamm Bowel Dis 2011; 17(10): 2169–2173.
86. Kim PS, Zlatanic J, Korelitz BI, et al. Optimum duration of treatment with 6-mercaptopurine for Crohn’s disease. A J Gastroenterol 1999; 94 : 3254–3257.
87. Fraser AG, Orchard TR, Jewell DP. The efficacy of azathioprine for the treatment of inflammatory bowel disease. Gut 2002; 50 : 485–489.
88. Léman M, Mary JY, Colombel J-F, et al. A randomized, double-blind, controlled withdrawal trial in Crohn’s disease patients in long-term remission on azathioprine. Gastroenterology 2005; 128 : 1812–1818.
89. Bradford K, Shih DQ. Optimizing 6-mercaptopurine and azathioprine therapy in the management of inflammatory bowel disease. World J Gastroenterol 2011; 17(37): 4166–4173.
90. Trenton X, Bouhnik Y, Mary JY, et al. Azathioprine withdrawal in patients with Crohn’s disease maintained on prolonged remission under treatment is associated with a high risk of relapse. Gastroenterology 2004; 126(Suppl 2): A113.
91. Karaca C. Methotrexate dose in current ECCO consensus on Crohn’s disease. J Crohns Colitis 2010; 4(4): 483.
92. Kamm MA, Ng SC, De Cruz P, Allen P, Hanauer SB. Practical application of anti-TNF therapy for luminal Crohn’s disease. Inflamm Bowel Dis 2011; 17(11): 2366–2391.
93. Allez M, Modigliani R. Clinical features of inflammatory bowel disease. Curr Opin Gastroenterol 2000; 16(4): 329–336.
94. Ahmed T, Rieder F, Fiocchi C, Achkar JP. Pathogenesis of postoperative recurrence in Crohn’s disease. Gut 2011; 60 (4): 553–562.
95. Cho SM, Cho SW, Regueiro M. Postoperative management of Crohn’s disease. in: challenges in inflammatory bowel disease. Med Clin N Amer 2010; 94(1): 179–188.
96. McCartney S. Inflammatory bowel disease in transition: challenges and solutions in adolescence care. Frontline Gastroenterology 2011; 2 : 237–241.
97. Lindberg E, Jarnerot G, Huidfeldt B. Smoking in Crohn’s disease: effects on localisation and clinical course. Gut 1992; 33 : 779–782.
98. Oschenkühn T, D’Haens G. Current misunderstanding in the management of ulcerative colitis. Gut 2011; 60 : 1294–1299.
99. Williams RG, Wong WD, Rothenberg DA, Goldberg SM. Recurrence of Crohn’s disease after resection. Brit J Surg 1991; 78(1): 10–19.
100. Papi C, Luchetti R, Gili L, Montani S, Koch M, Capurso L. Budesonide in the treatment of Crohn’s disease: a metaanalysis. Aliment Pharmacol Ther 2000; 14 : 1419–1428.
101. Hellers G, Cortot A, Jewell D, et al. Oral budesonide for prevention of postsurgical recurrence in Crohn’s disease. Gastroenterology 1999; 116 : 294–300.
102. Rutgeerts P. Review article: recurrence of Crohn’s disease after surgery – the need for treatment of new lesions. Aliment Pharmacol Ther 2006; 24(Suppl 3): 29–32.
103. Colombel JF, Rutgeerts P, Malchow H, et al. Interleukin 10 (Tenovil) in the prevention of postoperative recurrence of Crohn’s disease. Gut 2001; 49 : 42–46.
104. Marteau P, Lemann M, Seksip P, et al. Ineffectiveness of Lactobacillus johnsonii LA1 for prophylaxis of postoperative recurrence in Crohn’s disease. Gut 2006; 55 : 842–847.
105. Chermesh I, Tamir A, Reshef R, et al. Failure of Synbiotic 2000 to prevent postoperative recurrence of Crohn’s disease. Dig Dis Sci 2007; 52 : 385–389.
106. Regueiro M. Management and prevention of postoperative Crohn’s disease. Inflamm Bowel Dis 2009; 15 : 1583–1590.
107. Rampton DS. Crohn’s disease recurrence can be prevented after ileal resection. Gut 2002; 51 : 153–154.
108. Seksik P, Dray X, Sokol H, Marteau P. Is there any place for alimentary probiotics, prebiotics or synbiotics, for patients with inflammatory bowel disease? Mol Nutr Food Res 2008; 52(8): 906–901.
109. Pardi DS, D’Haens G, Shen B, Campbell S, Gionchetti P. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis 2000; 15 : 1424–1431.
110. Wu H, Shen B. Pouchitis and pouch dysfunction. Gastroenterol Clin North Am 2009; 38 : 651–668.
111. Ewe K, Bottger T, Buhr HJ, Ecker KW, Otto HF. Low dose budesonide treatment for prevention postoperative recurrence of Crohn’s disease: a multicentre randomized placebo--controlled trial. German Budesonide Study Group. Eur J Gastroenterol Hepatol 1999; 11 : 277–282.
112. D’Haens G, Geboes K, Ponette E, Penninckx F, Rutgeerts P. Healing of severe recurrent ileitis with azathioprine therapy in patients with Crohn’s disease. Gastroenterology 1997; 112 : 475–481.
113. D’Haens, G, Noman M, van Assche G, et al. Severe postoperative recurrence of Crohn’s disease is significantly reduced with combination therapy metronidazole + azathioprine. J Crohn Colitis (Suppl) 2007; 1 : 4.
114. Papay P, Reinisch W, Miehsler W, et al. Maintenance therapy with azathioprine/6-mercaptopurine in Crohn’s disease reduces the risk of re-operation particulary in smokers. J Crohn Colitis (Suppl) 2008; 2 : 3.
115. Hanauer SB, Feagan BG, Lichtenstein GR, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002; 359 : 1541–1549.
116. Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut 2007; 56 : 1232–1239.
117. Saag GS, Ten GG, Patkar NM, et al. Americal college of rheumatology 2008 recommendations for the use of nonbiologic and biologic disease modifying antirheumatic drugs in rheumatoid arthritis. Arthritis & Rheumatism 2008; 59(6): 762–784.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Long-term therapy of idiopathic inflammatory bowel disease
- Addition of statins into the public water supply? Risks of side effects and low cholesterol levels
- Physician and freedom of conscience
- Smoke-free New Zealand 2025 – utopia or a model?
- Czech paediatric cardiac surgery – history and presence
- Caecal ligation and puncture in the minipig – a model of sepsis induction
- Caecal ligation and puncture in the minipig – a model of sepsis induction
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Czech paediatric cardiac surgery – history and presence
- Addition of statins into the public water supply? Risks of side effects and low cholesterol levels
- Long-term therapy of idiopathic inflammatory bowel disease
- Physician and freedom of conscience
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

