-
Medical journals
- Career
K štruktúre a funkcii lymfatických kapilár v synoviálnom kĺbe
Authors: Emília Rovenská; Jozef Rovenský
Authors‘ workplace: Národný ústav reumatických chorôb, Piešťany, SR
Published in: Čas. Lék. čes. 2012; 151: 520-522
Category: Review Articles
Overview
Prehľadný článok zameriava pozornosť na práce o štruktúre a funkcii lymfatických kapilár v spojivovom tkanive v koži, vo svale a v synoviálnej membráne. Lymfatické kapiláry (iniciálne lymfatiky) pozostávajú z endotelových buniek usporiadaných navzájom tak, že ich medzibunkové spojenia majú odlišnú štruktúru. V jednom type medzibunkových spojení sa distálne konce endotelových buniek navzájom prekrývajú vo forme výbežkov, pričom medzi bunkovými membránami vonkajšieho a vnútorného výbežku chýbajú dezmozómy a nenachádzajú sa medzi nimi ani ďalšie spojovacie komplexy. Vonkajší výbežok endotelovej bunky je pevne pripojený k okolitému spojivovému tkanivu pomocou zakotvujúcich vlákien (anchoring filaments). Vnútorný výbežok zo susednej endotelovej bunky sa môže preklopiť do lúmena lymfatickej kapiláry a môže vzniknúť niekoľko mikrometrov široká komunikácia medzi interstíciom a lúmenom pri efluxe tkanivovej tekutiny a leukocytov z interstícia do lúmena kapiláry. Vyššie uvedené otvárateľné medzibunkové spojenia označujú lymfológovia vo svojich prácach aj ako endotelové mikrochlopne a tiež ako primárne chlopne. Tieto primárne chlopne v kooperácii s klasickými (sekundárnymi) intralymfatickými chlopňami umožňujú jednosmerný tok lymfy pri spontánnych kontrakciách iniciálnych lymfatík. Predpokladá sa, že primárne chlopne v lymfatických kapilárach majú dôležitú úlohu pri drenáži zápalom postihnutého spojivového tkaniva aj v synoviálnom kĺbe.
Kľúčové slová:
synoviálny kĺb, lymfatické kapiláry, drenáž, bunky imunitného systému.
Lymfatické cievy a ich spojenie s lymfatickými cievami v perioste, šľachách a ligamentách zobrazil Davies (1) v synoviálnom kĺbe pomocou retrográdneho nástreku tušom. Zo siete hrubších lymfatických ciev vystupovali k povrchu synoviálnej membrány lymfatické kapiláry, ktoré sa zobrazili ako lakuniformne rozšírené útvary; autor ich opísal ako slepo zakončené prítoky. Obraz, ktorý v tom čase získal vtedy používanou morfologickou metódou – retrográdnym nástrekom prenodálnych lymfatických ciev – mu neumožnil zobraziť primárne chlopne, ktoré sa nachádzajú v stenách iniciálnych lymfatík a umožňujú priamu komunikáciu instestícia spojivového tkaniva s ich lúmenom (2, 3). Lymfológovia ich najprv pomenovali ako endotelové mikrochlopne (4), neskôr ako primárne chlopne (2), ktoré spolu so sekundárnymi (klasickými) chlopňami situovanými v lúmenoch lymfatických kapilár umožňujú jednosmerný tok lymfy počas spontánnej kontraktility iniciálnych lymfatík. Podľa lymfológov je teda tradičná predstava o slepom začiatku lymfatických kapilár následkom (5) retrorádnych nástrekových metód používaných v morfológii.
Lymfatické cievy sú súčasťou lymfatického systému. Podľa Olszewskeho (6) k lymfatickému systému patria: interstícium, lymfatické cievy, lymfatické orgány a ich pohyblivé poslovia – migrujúce bunky imunitného systému. Väčšina zrelých lymfocytov totiž neustále migruje a recirkuluje z krvi do tkanív a prostredníctvom lymfy naspäť do krvi 1–2krát za deň. Tento 12–24hodinový cyklus recirkulácie sa opakuje až pokým bunka nájde svoj antigén alebo odumrie (7). Lymfocyty vykonávajú pri migrácii cez interstícium takmer vo všetkých orgánoch imunologický dozor a zodpovedajú za šírenie imunitných odpovedí a distribuovanie imunologickej pamäte v organizme (8, 9). Migrácia subpopulácií malých lymfocytov je tkanivovo špecifická.
Lymfatické cievy prepravujú lymfu, ktorá obsahuje krvinky. V periférnej (afferentnej, prenodálnej) lymfe z lymfatických ciev z končatín a niektorých orgánov oviec sa našli ojedinelé erythrocyty, malé lymfocyty, plazmatické bunky, monocyty, makrofágy, neutrofilné a eozinofilné granulocyty (10). Aferentná lymfa obsahuje veľa monocytov, pretože oni nepretržite vystupujú z krvného prúdu v postkapilárových venulách, migrujú a diferencujú sa v interstíciu a vykonávajú ich funkciu a vstupujú do lymfatických kapilár (10). Monocyty, makrofágy a dendritické bunky sa obvykle nenachádzajú v eferentnej lymfe.
Centrálna (eferentná, postnodálna) lymfa obsahuje oveľa viac krviniek, pretože v lymfatických uzlinách do lymfy vstupujú naivné lymfocyty z postkapilárových venúl s vysokým endotelom; na podklade mikroskopického obrazu ich endotelových buniek boli pomenované ako HEV (high endothelial venules). Tento jav opísal Gowans a Knight (11) a je známy ako fyziologická recirkulácia lymfocytov; prostredníctvom postnodálnej lymfy sa lymfocyty vrátia do krvného prúdu.
Pamäťové a efektorové lymfocyty môžu migrovať a recirkulovať cez riedke väzivo v čreve, cez väzivo v pľúcach, cez interstícium spojivového tkaniva v koži a kĺboch (12, 13). Dôležitú úlohu zohrávajú lymfatické cievy – hlavne lymfatické kapiláry – pri zápale. Lynch so spolupracovníkmi (14) vyvolali akútny zápal vo svale a podkoží u potkanov a študovali transport fluoreskujúcich značkovačov z interstícia do iniciálnych lymfatík. Pri akútnom zápale unikali fluoreskujúce častice z lymfatík do interstícia, preto autori vyslovili záver, že pri akútnom zápale zlyhajú primárne chlopne v iniciálnych lymfatikách, čo má za následok zväčšovanie edému a hromadenie mediátorov zápalu v interstíciu (14, 15).
Je všeobecne známe, že zápalový exudát s jeho bunkami a detritom odvádzajú z interstícia spojivového tkaniva lymfatické kapiláry. Už v roku 1937 Pullinger a Florey pri experimente u morčiat zistili (16), že pri zápale lymfatické cievy proliferujú (nastane lymfangiogenéza) a odvádzajú z podkožia postihnutého zápalom bunkový detritus jednak priamo alebo vo fagocytujúcich bunkách – v makrofágoch do lymfatických uzlín. Fagocytujúce bunky situované v lúmenoch lymfatických ciev pozoroval aj Kuhns (17) pri štúdiu lymfatickej drenáže kĺbov u králikov. Olszewski (18) pozoroval bunkový detritus v aferentnej lymfe získanej kanylovaním povrchových lymfatických ciev na dolných končatinách u ľudí. Makrofágy a bunkovú debris opísali aj v lymfatických kapilárach synoviálnej membrány pri reumatoidnej artritíde.
Novšie fyziologické štúdie predložili dôkazy, že interstícium spojivového tkaniva synoviálnej membrány má dôležitú úlohu pri drenáži proteínov z kĺbovej dutiny do lymfatických ciev (19, 20). V interstíciu spojivového tkaniva opísali existenciu „ultracirkulačného systému tkanivových kanálikov“ Hauck (5) a Casley-Smith (21). Funkčný vzťah medzi tkanivovými kanálikmi a lymfatickými kapilárami opísal Casley-Smith (22) v roku 1980.
Predtým Leak a Burke (23) pomocou transmisnej elektrónovej mikroskopie dokázali v spojivovom tkanive z kože špecializované spojenia medzi endotelovými bunkami lymfatických kapilár. Ich jestvovanie bolo predmetom diskusií viacerých morfológov počas mnohých rokov. V týchto špecializovaných spojeniach sa medzi prekrývajúcimi výbežkami susedných endotelových buniek nenachádzajú dezmozómy ani ďalšie spojovacie komplexy, takže vnútorný výbežok sa pri stúpnutí tlaku v interstíciu môže preklopiť do lúmena kapiláry. Tieto špecializované spojenia (primárne chlopne) sa môžu otvoriť do takej miery, že vznikne až niekoľko mikrometrov široké priame spojenie medzi interstíciom a lúmenom lymfatickej kapiláry, takže bunky imunitného systému môžu vstúpiť z interstícia spojivového tkaniva do systému lymfatických ciev (3). Nedávno sa zistilo, že pre vstup lymfocytov z periférnych tkanív do lymfatických kapilár je potrebný chemokínový receptor CCR7 (24).
Otvárateľnosť primárnych chlopní umožňujú aj zakotvujúce sa vlákna (anchoring filanents), ktoré pripevňujú vonkajší výbežok endotelovej bunky špecializovaného spojenia k okolitému spojivovému tkanivu. Ich jestvovanie opísali pomocou svetelného mikroskopu Pullinger a Florey (25) pri štúdiu lokálneho edému po vyvolaní zápalu v koži myší. Ich nálezy potvrdil pomocou transmisnej elektrónovej mikroskopie Casley-Smith (26). Zakotvujúce sa vlákna zabraňujú kolabovaniu lymfatických kapilár pri edéme okolitého spojivového tkaniva. Zakotvujúce sa vlákna boli demonštrované aj na lymfatických kapilárach synoviálnej membrány (27).
Na obrázku 1 z materiálu získaného pri synovektómii pacientky s juvenilnou idiopatickou artritídou demonštrujeme ultraštruktúru a štruktúru špecializovaných interendotelových spojení v stene lymfatických kapilár v synoviálnej membráne. S edémom situovaným v kĺboch alebo ich okolí sa stretávajú reumatológovia pri reumatoidnej artritíde (RA) aj pri juvenilnej idiopatickej artritíde (JIA), ktoré patria k zápalovým reumatickým chorobám. Podľa Ahlquista (28) edém synoviálneho kĺbu naznačuje relatívnu insuficienciu lymfatických ciev. Pri reumatoidnej artritíde je zvýšená permeabilita krvných kapilár, ktorá má za následok zvýšenú tvorbu tkanivovej tekutiny a vznik generalizovaného edému. Je zvýšená aj rýchlosť lymfatickej drenáže, avšak táto nestačí kompenzovať tvorbu tkanivovej tekutiny (29, 30). Olszewski a spol. (31) potvrdili literárne údaje vyššie uvedených autorov; zistili, že u pacientov s RA je priemerná rýchlosť toku prenodálnej lymfy dvojnásobná v porovnaní s nálezmi u zdravých ľudí kontrolnej skupiny. Autori kanylovali a analyzovali prenodálnu lymfu a zistili v nej dvojnásobnú koncentráciu buniek v porovnaní s normálnou koncentráciou.
Image 1. Elektrónovo-mikroskopické obrázky a mikrofotografie endotelových mikrochlopní lymfatických kapilár synoviálnej membrány od pacientky s juvenilnou idiopatickou artritídou. a, b – ultraštruktúra špecializovaných medzibunkových spojení – endotelových mikrochlopní. Sú vytvorené prekrývajúcimi sa výbežkami susedných endotelových buniek. Vlákna z okolitého spojivového tkaniva (ST) sú zakotvené do vonkajšieho výbežku. Malé medzery (hviezdičky) sú zobrazené medzi vnútorným a vonkajším cípom. Ultratenké rezy kontrastované uranylacetátom a citranom olovnatým; c, d – lymfocyt (šípka), ktorý vstúpil do lúmena lymfatickej kapiláry (L) cez otvorenú endotelovú mikrochlopňu. Ďalší lymfocyt (malá šípka) sa nachádza v prelymfatickom tkanivovom kanáliku – na jeho ceste z interstícia do lúmena lymfatickej kapiláry. Polotenké rezy farbené toluidínovou modrou. 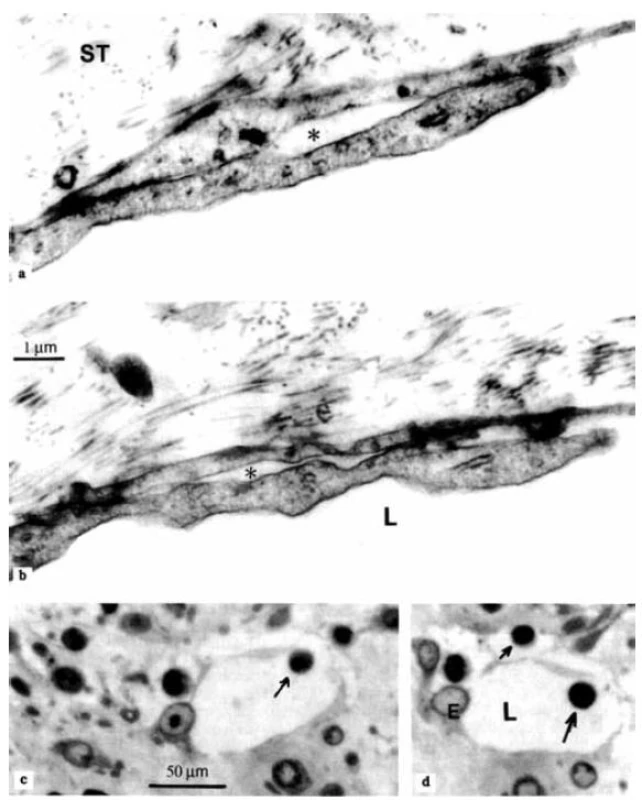
V posledných rokoch vedecké tímy skúmajú možnosti použitia rastových faktorov VEGF-C a VEGF-D, o ktorých je známe, že vyvolávajú lymfagiogenézu pri liečbe edémov v tkanivách pri rôznych chorobách a pri hojení rán pri diabete (32–35). Nedávno Polzer a spol. (36) študovali pomocou imunohistochemickej metódy synoviálnu membránu získanú pri biopsiách kolenných kĺbov od pacientov s RA pred liečbou a po liečbe s anti-TNF protilátkou. Kvantitatívne imunohistochemické vyšetrenie protilátkami proti VEGF-C a podoplanínu ukázalo zvýšený počet lymfatických ciev vo vzorkách od pacientov s RA po 4 týždňoch liečby s anti-TNF protilátkou. Autori dokázali, že blokáda TNF pri RA stimuluje utvorenie nových lymfatických ciev v synoviálnej membráne postihnutej zápalom. Tento nález ich viedol k predpokladu, že podporenie lymfangiogenézy sa môže významne podieľať na efluxe buniek a tekutiny zo zápalom postihnutého tkaniva. Nálezy Polzera a spol. sú v zhode s pozorovaniami Pullingera a Floreya (16), ktorí opísali lymfangiogenézu po vyvolaní zápalu v koži myší.
Nedávno Chaitanya a spol. (37) skúmali účinok rôznych cytokínov na lymfatické endotelové bunky in vitro. Dokázali, že zápalové cytokíny zmenia rast lymfatických endotelových buniek, aktiváciu a bariérovú funkciu in vitro a môžu prerušiť lymfatický klírens, čo môže zvýšiť edém tkaniva in vivo. Na podklade svojich výsledkov autori vyslovili záver, že liečba, ktorá udržiava alebo reštauruje funkciu lymfatických ciev (vrátane blokády cytokínov) môže predstavovať dôležité stratégie pre obmedzenie zápalu. Ich práca je v zhode s pozorovania, ktoré publikovali Polzer a spol. (36).
Podporenie lymfangiogenezy pri RA adekvátnou terapiou môže prispieť k navodeniu imunologickej homeostázy v synoviálnom kĺbe.
Skratky
- HEV – venuly s vysokým endotelom
- JIA – idiopatická juvenilná artritída
- RA – reumatoidná artritída
- TNF – faktor nekrotizujúci nádor
- VEGF-C – cievny endotelový rastový faktor C
- VEGF-D – cievny endotelový rastový faktor D
ADRESA PRO KORESPONDENCI:
doc. MUDr. Emília Rovenská, CSc.
Národný ústav reumatických chorôb
Teplická 27/98, 921 01 Piešťany, SR
e-mail: jozef.rovensky@nurch.sk
Sources
1. Davies DV. The lymphatics of the synovial membrane. J Anat 1946; 80 : 21–25.
2. Schmidt-Schönbein GW. The second valve system in lymphatics. Lymphat Res Biol 2003; 1(1): 25–29.
3. Ikomi E, Hunt J, Hanna G, et al. Interstitial fluid, plasma protein, colloid, and leukocyte uptake into initial lymphatics. J Cell Physiol 1996; 81 : 2060–2067.
4. Trzewick J, Mallipattu SK, Artmann GM, et al. Evidence for a second valve system in lymphatics: endothelial microvalves. FASEB J 2001; 15 : 1711–1717.
5. Hauck G. The connective tissue in view of the lymphology. Experientia (Basel) 1982; 38 : 1121–1222.
6. Olszewski WL. Interrelationships within the lymphatic system. In: Olszewski WL. Lymph stasis. Pathophysiology, diagnosis and treatment. Bocca Raton: CRC Press 1991; 5–12.
7. Salmi M, Jalkanen S. How do lymphocytes know where to go: current concepts and enigmas of lymphocyte homing. Adv Immunol 1997; 64 : 139–218.
8. Hay JB, Young AL. Lymphocyte circulation. In: Reed RK, Bert JL (eds). Interstitium, connective tissue and lymphatics. London: Portland Press, 1995; 245–250.
9. Abernethy NJ, Hay JB. The recirculation of lymphocytes from blood to lymph: physiological considerations and molecular mechanisms. Lymphology 1992; 25 : 1–30.
10. Smith JB, McIntosh GB, Morris B. The traffic of cells through tissues: a study of peripheral lymph in sheep. J Anat 1970; 107 : 87–100.
11. Gowans JL, Knight EJ. The route of recirculation of lymphocytes in the rat. Proc R Soc B 1964; 159 : 257.
12. Butcher EC, Picker LJ. Lymphocyte homing and homeostasis. Science 1996; 272 : 60–66.
13. Hall JG. An essay in lymphocyte circulation and the gut. In: Trnka Z, Cahill RN (eds.). Essays on the anatomy and physiology of lymphoid tissues. Basel, S. Karger 1980; 100–111.
14. Lynch PM, Delano FA, Schmid-Schönbein GW. The primary valves in the initial lymphatics during inflammation. Lymphat Res Biol 2007; 5 : 3–10.
15. Angeli V, Randolph GJ. Inflammation, lymphatic function, and dendritic cell migration. Lymphat Res Biol 2006; 4 : 217–228.
16. Pulllinger BD, Florey HW. Proliferation of lymphatics in inflammation. J Pathol 1937; 45 : 157–170.
17. Kuhns JG. Lymphatic drainage of joints. Arch Surg 1933; 27 : 345–391.
18. Olszewski WL. Human afferent lymph contains apoptotic cells and “free” apoptotic DNA fragments – can DNA be reutilised by the lymph node cells? Lymphology 2001; 34 : 179–183.
19. Simkin PA. Synovial perfusion and synovial fluid solutes. Ann Rheum Dis 1995; 54 : 424–428.
20. Levick JR. A method for estimating macromolecular reflection by human synovium using measurements of intra-articular half lives. Ann Rheum Dis 1998; 57 : 339–344.
21. Casley-Smith JB. The structure and functioning of the blood vessels, interstitial tissues, and lymphatics. In: Földi M, Casley-Smith JR. Lymphangiology. New York-Stuttgart: Schattauer 1983; 832.
22. Casley-Smith JB. The structure and functioning of tissue channels and lymphatics. Lymphology 1980; 13 : 177–183.
23. Leak LV, Burke JF. Fine structure of the lymphatic capillary and the adjoining connective tissue area. Am J Anat 1966; 118 : 785–810.
24. Debes GE, et al. Chemokine receptor CCR7 required for T lymphocyte exit from peripheral tissues. Nature Rev Immunol 2005; 6 : 889–894.
25. Pullinger BD, Florey HW. Some observations on the structure and functions of lymphatics: their behaviour in local oedema. Brit J Exp Pathol 1935; 16 : 49–61.
26. Casley-Smith JR. Are initial lymphatics normally pulled open by the anchoring filaments? Lymphology 1980; 13 : 120–129.
27. Rovenská E, Rovenský J. Lymphatic vessels: structure and function. IMAJ 2011; 13 : 762–768.
28. Ahlquist J. Swelling of synovial joints – An anatomical, physiological and energy metabolical approach. Pathophysiology 2000; 7 : 1–19.
29. Jayson MIV, Barks JS. Oedema in rheumatoid arthritis: changes in the coefficient of capillary filtration. Brit Med J 1971; 2 : 555–557.
30. Jayson MIV, Cavill I, Barks JS. Lymphatic clearance rates in rheumatoid arthritis. Ann Rheum Dis 1971; 30 : 638–639.
31. Olszewski WL, Pazdur J, Kubasiewicz E, et al. Lymph draining from foot joints in rheumatoid arthritis provides insight into local cytokine and chemokine production and transport to lymph nodes. Arthritis Rheum 2001; 44 : 541–549.
32. Karkkainen MJ, et al. Molecular regulation of lymphangiogenesis and targets for tissue oedema. Trends Mol Med 2001; 7 : 18–22.
33. Szuba A, et al. Therapeutic lymphangiogenesis with human recombinant VEGF-C. FASEB J 2002; 16 : 1985–1987.
34. Saaristo A, et al. Vascular endothelial growth factor-C accelerates diabetic wound healing. Amer J Pathol 2006; 169 : 1080–1087.
35. Alitalo K, Tammela T, Petrova TV. Lymphangiogenesis in development and human disease. Nature 2005; 438 : 946–953.
36. Polzer K, Baeten D, Soleiman A, et al. Tumor necrosis factor blockade increases lymphangiogenesis in murine and human arthritic joints. Ann Rheum Dis 2008; 67 : 1610–1616.
37. Chaitanya GV, Franks SE, Cromer V, et al. Differential cytokine responses in human and mouse lymphatic endothelial cells to cytokines in vitro. Lymph Res Biol 2010; 8 : 155–164.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Papiledém a ischemický edém terče optiku
- Biomedicínský výzkum se třetími zeměmi v 7. rámcovém programu EU na roky 2007–2013
- Výročí Josefa Thomayera – 85 let od smrti, 160 let od narození
- Principy pro zacházení s lidským genetickým materiálem a genotypizační informací
- Enterohemoragické kmeny Escherichia coli – nebezpečné novější patogeny
- K štruktúre a funkcii lymfatických kapilár v synoviálnom kĺbe
- Lymphogranuloma venereum
- Náhlé zhoršení renálních funkcí u staršího pacienta na léčbě vancomycinem pro endokarditidu
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Papiledém a ischemický edém terče optiku
- Enterohemoragické kmeny Escherichia coli – nebezpečné novější patogeny
- Lymphogranuloma venereum
- Principy pro zacházení s lidským genetickým materiálem a genotypizační informací
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

