-
Medical journals
- Career
Biochemické mechanismy účinků antidepresiv
Authors: Zdeněk Fišar; Jana Hroudová; Jiří Raboch
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, Psychiatrická klinika VFN
Published in: Čas. Lék. čes. 2011; 150: 531-540
Category: Review Article
Overview
Jsou uvedeny hlavní poznatky o přímých, časných a dlouhodobých biochemických účincích antidepresiv. Zmíněny jsou mechanismy účinku některých dalších látek s antidepresivními účinky a léčiv podporujících účinky antidepresiv. Psychotropní látky používané při léčbě poruch nálady vykazují po dlouhodobém podávání neurotrofní a neuroprotektivní účinky. Proto je pozornost věnována kromě adenylátcyklázového, guanylátcyklázového, fosfoinozitidového a kalciového sytému také tyrozinkinázové a Wnt signální cestě. Je uveden význam, možnosti a výhledy ve vývoji nových antidepresiv v souvislosti s poznatky o biologických znacích poruch nálady a prediktorech účinnosti jejich farmakoterapie.
Klíčová slova:
antidepresivum, neurotransmiter, deprese, receptor, přenašeč, neuroplasticita.Úvod
Antidepresiva jsou užívána především pro léčbu poruch nálady a úzkostných poruch. Výzkum etiopatogeneze deprese a mechanismů účinků antidepresiv jsou nezbytné, neboť významná část pacientů neodpovídá dostatečně na farmakoterapii. Význam studia mechanismů účinků antidepresiv narůstá spolu s medicínským i společensko-ekonomickým významem léčby poruch nálady, které patří mezi nejčastější duševní poruchy a postihují z hlediska celoživotního téměř pětinu populace (1, 2). Ze studií Světové zdravotnické organizace, Harvard School of Public Health a Světové banky „Global Burden of Disease“ (3–5) vyplývá, že při měnících se socioekonomických podmínkách a při prodlužování lidského věku se neuropsychiatrické choroby staly jednou z nejvýznamnějších skupin nemocí. Pro měření zdraví populace byl zaveden parametr DALY (disability-adjusted life years), který kombinuje roky života ztracené předčasným úmrtím (years of life lost – YLL) a roky života žité v jiném než plném zdraví (years of life lived with disability – YLD). Do budoucna se předpokládá zvýšení DALY způsobené nepřenosnými nemocemi, např. zastoupení neuropsychiatrických onemocnění (očekává se zvýšení z 10,5 % v roce 1990 na 14,7 % v roce 2020) nebo kardiovaskulárních onemocnění (zvýšení z 11,1 % na 14,7 %) (4). Depresivní porucha patří mezi nejčastější příčiny DALY a předpokládá se, že v celosvětovém měřítku se dostane ještě více do popředí. V tabulce 1 je uvedeno deset hlavních příčin ztrát pracovní schopnosti vlivem narušeného zdraví nebo předčasných úmrtí v roce 2001 v hospodářsky rozvinutých oblastech. Unipolární deprese je na 3. místě a Alzheimerova choroba a jiné demence na 4. místě, hned za ischemickou chorobu srdeční a mozkocévními onemocněními (5). Odhaduje se, že v roce 2020 se deprese dostane na 2. místo v hodnocení podle DALY (pro obě pohlaví a všechny věkové kategorie); ve věkové kategorii 15–44 let je na 2. místě již dnes (6).
Table 1. Deset hlavních příčin pracovní neschopnosti způsobené onemocněním nebo předčasným úmrtím posuzovaných podle roků života ztracených plus roků žitých v neschopnosti (disability-adjusted life years – DALY) v roce 2001 v hospodářsky vyspělých zemích (5) 
Příčiny vzniku poruch nálady ani mechanismy podmiňující terapeutické účinky antidepresiv nejsou dosud dostatečně známy. Etiologickými faktory zapojenými do vzniku deprese jsou chronický stres, geneticky daná náchylnost, systémová onemocnění (např. hyperkorticismus), nepříznivé události v dětství, stimulace imunitního systému (např. chronické podávání interferonu-α), odnětí návykových látek nebo nedostatek prekurzorů monoaminových neurotransmiterů.
Biochemické účinky antidepresiv jsou zkoumány jednak pro poznání mechanismů vedoucích k jejich terapeutickým účinkům, jednak jako zatím nejvhodnější způsob jak se přiblížit k poznání neurochemické podstaty poruch nálady. Antidepresiva používaná v současné době vyvolávají požadovanou odezvu asi ve 2/3 případů a významně terapeuticky působí až po několika týdnech podávání. Remise je po počáteční léčbě dosaženo přibližně v 1/3 a po dlouhodobé léčbě ve 2/3 případů. Cílem výzkumu v této oblasti je jednak poznat etiopatogenezi vzniku poruch nálady, jednak nalézt nová rychleji a účinněji působící antidepresiva.
Přímé biochemické účinky antidepresiv jsou většinou známy velmi dobře, působí na metabolismus monoaminových neurotransmiterů a aktivitu jejich receptorů a membránových přenašečů. Oproti tomu mechanismy odpovědné za klinické účinky antidepresiv jsou známy mnohem méně, neboť spočívají v jejich schopnosti indukovat adaptivní změny v centrální neurotransmisi, a tyto změny nejsou dostatečně poznány.
Přímé biochemické účinky antidepresiv
Jako antidepresiva je v současnosti užíváno více než 40 léčiv (tab. 2) a řada dalších je podávána pro posílení a udržení jejich antidepresivních účinků. Dále existuje mnoho látek, u nichž byly prokázány antidepresivní účinky, ale které se z různých důvodů (nežádoucí účinky, možnost zneužívání, toxicita, nedokončený vývoj, stažení z prodeje) běžně klinicky neužívají.
Table 2. Přímé biochemické účinky antidepresiv 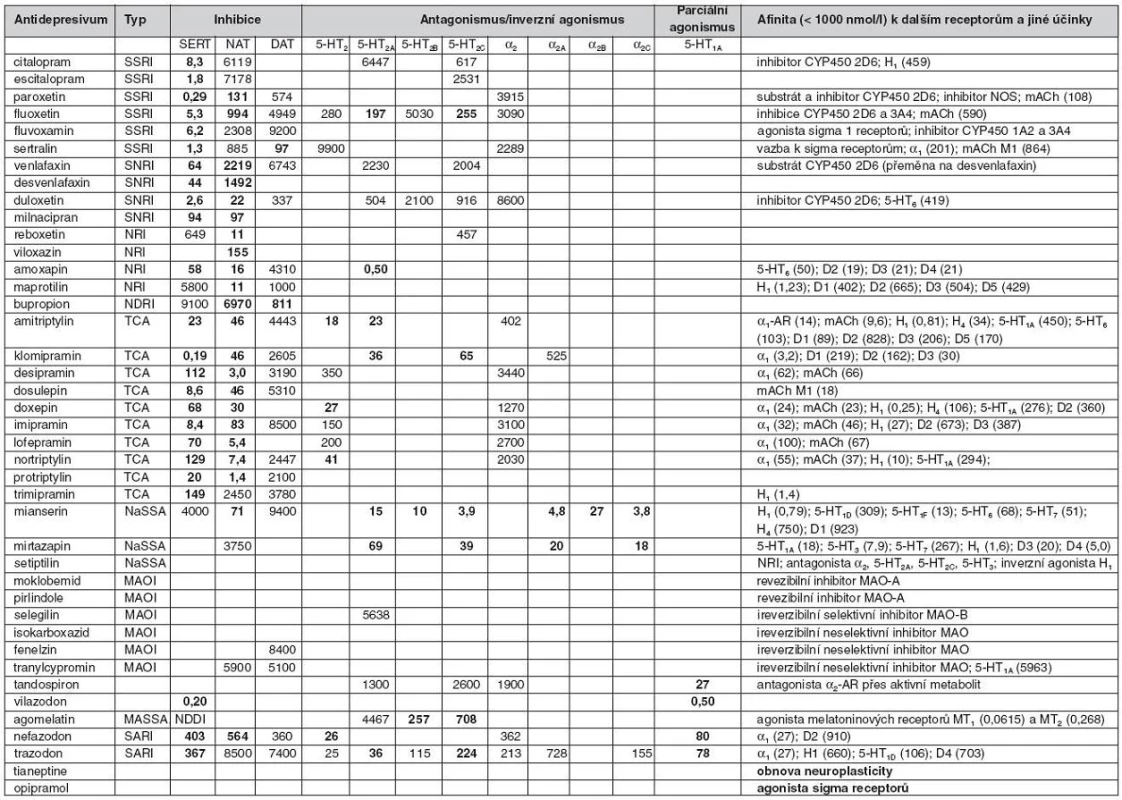
Tučně jsou označeny hodnoty disociačních a inhibičních konstant u přenašečů a receptorů, které jsou určující pro antidepresivní účinky. CYP450 – cytochrom P450, DAT – přenašeč pro dopamin, MAOI – inhibitor monoaminoxidázy, MASSA – melatoninový agonista a selektivní serotoninový antagonista, NaSSA – noradrenergní a specifické serotonergní antidepresivum, NAT – přenašeč pro noradrenalin, NDDI – noradrenalinový a dopaminový disinhibitor, NDRI – inhibitor zpětného vychytávání noradrenalinu a dopaminu, NOS – syntáza oxidu dusnatého, NRI – inhibitor zpětného vychytávání noradrenalinu, SARI – serotoninový antagonista a inhibitor zpětného vychytávání serotoninu, SERT – přenašeč pro serotonin, SNRI – inhibitor zpětného vychytávání serotoninu a noradrenalinu, SSRI – selektivní inhibitor zpětného vychytávání serotoninu, TCA – tricyklické antidepresivum Přímé biochemické účinky antidepresiv a stabilizátorů nálady, které vedou k jejich terapeutickým účinkům, jsou:
- inhibice zpětného vychytávání (reuptake) monoaminových neurotransmiterů – serotoninu (5-HT, 5-hydroxytryptamin), noradrenalinu (NA) nebo dopaminu (DA);
- inhibice metabolismu monoaminových neurotransmiterů, především inhibice monoaminoxidáz (MAO);
- agonismus receptorů, hlavně postsynaptických serotoninových 1A receptorů (5-HT1A);
- antagonismus monoaminových receptorů, hlavně postsynaptických serotoninových receptorů typu 2A a 2C (5-HT2A, 5 HT2C) a presynaptických α2-adrenergních receptorů (α2-AR);
- inhibice či stimulace složek nitrobuněčných signálních cest podílejících se na neurotransmisi.
Do poslední uvedené skupiny patří např. tianeptin, který sice zvyšuje zpětné vychytávání serotoninu, ale jeho afinita k membránovému přenašeči pro serotonin (SERT) je nízká a jeho terapeutické účinky jsou pravděpodobně spojeny s přímým nitrobuněčným působením vedoucím k reparaci poškození synaptické glutamátergní neurotransmise indukované stresem a obnově normální neuroplasticity (7). Rovněž stabilizátory nálady jako lithium, valproát a karbamazepin působí primárně na nitrobuněčné úrovni. Například lithium inhibuje inozitolmonofosfatázu a snižuje transport inozitolu do buňky (celkově tak snižuje aktivitu proteinkináz C), inhibuje glykogensyntázukinázu-3 (GSK-3) a zvyšuje koncentrace cytoprotektivního proteinu Bcl-2. Užívají se také antidepresiva, která jsou agonisty sigma receptorů (opipramol) (8), nebo agonisty melatoninových receptorů a antagonisty 5-HT2C receptorů (agomelatin) (9, 10).
Podle svých přímých účinků jsou antidepresiva dělena do skupin. Některá antidepresiva jsou z hlediska přímých účinků dosti selektivní (např. selektivní inhibitory zpětného vychytávání serotoninu – SSRI), ale často vykazují více primárních účinků. V tabulce 2 jsou uvedeny průměrné hodnoty disociačních a inhibičních konstant v nmol/l (menší hodnoty znamenají vyšší afinitu k receptorovému vazebnému místu nebo větší blokádu přenašeče) uvedených pro člověka v PDSP databázi (NIMH Psychoactive Drug Screening Program, http://pdsp.med.unc.edu/, březen 2011); další zdroje dat byly použity pro agomelatin (11, 12), mirtazapin (13), tandospiron (14) a vilazodon (15).
Antidepresiva, která primárně inhibují membránový přenos neurotransmiterů, jsou většinou silnějšími blokátory přenosu serotoninu než noradrenalinu. Nejsilnějším inhibitorem SERT je paroxetin, nejsilnějším inhibitorem přenašeče pro noradrenalin (NAT) je desipramin a přenašeče pro dopamin (DAT) sertralin (16). Největší selektivitu inhibice SERT vůči NAT vykazuje citalopram, resp. escitalopram; největší selektivitu inhibice NAT vůči SERT vykazuje maprotilin (viz tab. 2). Při vyšších koncentracích řada antidepresiv do určité míry ztrácí selektivitu; např. fluoxetin, citalopram nebo tricyklická antidepresiva inhibují MAO při koncentracích 10-5 mol/l, které jsou v mozku snadno dosažitelné (17).
S inhibicí přenašečů a aktivací nebo blokádou neurotransmiterových receptorů jsou spojovány jak terapeutické, tak nežádoucí vedlejší účinky antidepresiv. Antidepresivní účinky jsou indukovány inhibicí monoaminových přenašečů a blokádou 5 HT2 receptorů nebo muskarinových acetylcholinových receptorů (mACh). Nežádoucí vedlejší účinky může vyvolat inhibice monoaminových přenašečů nebo blokáda receptorů α1-adrenergních, dopaminových D2, histaminových H1 nebo mACh (18). Optimálně by měla inhibice přenašečů a adaptace receptorů po dlouhodobém podávání antidepresiv vést k posílení jejich antidepresivních účinků a současně ke snížení nežádoucích vedlejších účinků, což bylo podrobně popsáno pro serotonergní antidepresiva (19).
Časné a dlouhodobé účinkyantidepresiv
Protože terapeutické účinky antidepresiv se projevují až po dlouhodobém podávání (1–3 týdny), je zřejmé, že za tyto účinky jsou odpovědné adaptivní procesy v přenosu nervového signálu. Tyto adaptivní procesy a jejich regulační mechanismy byly hledány a nalezeny na úrovni:
- neurochemické – zahrnují především a) změny hustoty a senzibility neurotransmiterových receptorů (které se ale pro řadu antidepresiv a stabilizátorů nálady v podmínkách in vivo neprokázaly) (20, 21); b) změny genové exprese, neuroplasticity a neurogeneze vedoucí k obnově funkcí mozkových buněk a neuronálních sítí narušených při depresivní poruše nebo chronickém stresu (22);
- neuroimunitní – vycházejí ze skutečnosti, že těžká depresivní fáze může být doprovázena aktivací imunitního systému nebo zánětlivou odezvou a na farmakologických účincích antidepresiv se potom mohou podílet jejich protizánětlivé účinky (23);
- neuroendokrinní – realizace terapeutických účinků antidepresiv spočívá v regulaci funkce osy hypotalamus – hypofýza – kůra nadledvin (HPA), která je při depresi často zvýšeně aktivována (24);
- chronobiologické – terapeutické účinky antidepresivní léčby jsou dávány do souvislosti se synchronizací chronobiologických rytmů narušených při depresi (25–27).
Všeobecně se předpokládá, že klinické účinky antidepresiv jsou způsobeny jejich schopností indukovat adaptivní změny v monoaminergních neurotransmiterových systémech (hlavně noradrenergním, serotonergním a dopaminergním). Zpočátku byly studovány jejich účinky na změnu dostupnosti monoaminových neurotransmiterů v synapsích, později vliv na změny hustoty a senzibility receptorů a přenašečů a nejnověji účinky na vlastnosti molekul podílejících se na postreceptorové transdukci signálu.
Receptory, přenašeče a monoaminoxidáza
Dlouhodobě je snaha vysvětlovat zpožděný nástup terapeutických účinků antidepresiv a naopak rychlý nástup jejich nežádoucích vedlejších účinků na receptorové úrovni. Předpokládá se, že vedlejší účinky jsou spojeny s jednak s přímými účinky antidepresiv na určité synaptické receptory, jednak se zvýšenou aktivací některých monoaminových receptorů v důsledku antidepresivy vyvolaných změn mimobuněčných koncentrací neurotransmiterů. Terapeutické účinky antidepresiv se dávají do souvislosti s dlouhodobými adaptivními mechanismy zahrnujícími aktivaci či inhibici, senzibilizaci či desenzibilizaci a upregulaci či downregulaci určitých receptorů a přenašečů.
Experimenty prováděné in vitro nebo na pokusných zvířatech ukázaly, že chronické podávání antidepresiv vede obvykle ke změnám počtu vazebných míst a změněné citlivosti u různých receptorových systémů. Nejčastěji pozorované receptorové změny vyvolané dlouhodobým podáváním antidepresiv byly regulace snížením počtu ß1-adrenergních receptorů nebo snížení odezvy na agonisty (desenzibilizace) somatodendritických 5 HT1A receptorů. Byly však pozorovány změny také v jiných receptorových systémech.
Klíčový serotoninový receptor v antidepresivní odezvě je postsynaptický 5-HT1A podtyp, především v určitých strukturách mozku. Ke zvýšení signalizace přes postsynaptické 5 HT1A receptory dochází přímými i nepřímými účinky SSRI, tricyklických antidepresiv (TCA), lithia, valproátu i elektrokonvulzivní terapie (28). Preklinické důkazy ukázaly, že dlouhodobé podávání různých antidepresiv a elektrokonvulzivní terapie vede ke zvýšení výsledné serotonergní neurotransmise měřené jako zvýšení frekvence zažíhání akčních potenciálů v presynaptických serotonergních neuronech (29–31). Podkladem pro toto zvýšení bylo snížení citlivosti inhibičních somatodendritických 5-HT1A autoreceptorů. Rozdílné změny v odezvě somatodendritických a postsynaptických 5-HT1A receptorů ukazují, že 5-HT1A receptory v mozku mají různé farmakologické vlastnosti. Dosud však byl naklonován pouze jeden 5-HT1A receptor, proto lze různé fyziologické vlastnosti receptoru připsat různým konfiguracím receptorového vazebného místa v membráně.
Blokáda SERT antidepresivy (např. při léčbě SSRI je těmito antidepresivy v mozku obsazeno asi 80% SERT (32)) vede ke zvýšení mimobuněčných koncentrací serotoninu a následně ke zvýšené aktivaci všech typů serotoninových receptorů v mozku. Tyto účinky mohou být zesíleny antagonisty presynaptických α2-adrenoceptorů nebo inhibitory monoaminoxidázy (MAOI). Předpokládá se, že za terapeutické účinky serotonergních antidepresiv jsou odpovědné zvýšené aktivační účinky serotoninu na postsynaptické 5-HT1A receptory a desenzibilizace či blokáda 5-HT2A a 5-HT2C receptorů. Aktivace inhibičních 5-HT1A receptorů vede k inhibici kortikálních pyramidových neuronů, které jsou při depresi příliš aktivovány (33). Inhibice excitačních 5-HT2 receptorů antagonisty tento efekt podporuje. Dalším mechanismem, jímž antagonisté 5-HT2A nebo 5-HT2C receptorů mohou uplatnit antidepresivní účinky, je zvýšení uvolňování dopaminu a noradrenalinu v prefrontální kůře, neboť serotonin může inhibovat uvolňování dopaminu a noradrenalinu např. přes aktivaci 5-HT2A a 5-HT2C receptorů na inhibičních GABAergních interneuronech (33, 34).
Receptorové změny v mozku při depresi a její léčbě byly podpořeny měřením na experimentálních zvířatech, ale nebyly zatím dostatečně prokázány měřením u lidí. Měření neurotransmiterových receptorů a přenašečů in vivo umožňuje například pozitronová emisní tomografie (PET) a jednofotonová emisní výpočetní tomografie (SPECT). Většina molekulárních PET studií je zaměřena na monoaminergní systémy v mozku, především na syntézu 5-HT a DA, na receptory 5-HT1A, 5-HT2, D1, D2, mACh, H1, na přenašeče SERT, NAT, DAT a na MAO (35). Některé z těchto molekulárních studií ukázaly snížení vazebné kapacity 5-HT1A receptorů při depresivní poruše, přičemž toto snížení nebylo ovlivněno léčbou SSRI a bylo pozorováno i u eutymických pacientů (36–38). Tyto výsledky zatím nejsou dostatečně prokázány, ale indikují, že snížená vazba na 5-HT1A receptory by mohla být predisponujícím znakem („trait marker“) pro unipolární depresi a znakem průběhu onemocnění („state marker“) pro bipolární afektivní poruchu (39). Jiné studie ale zjistily zvýšenou vazbu 5-HT1A receptorů v mozcích depresivních pacientů (40) a nepozorovaly vliv léčby antidepresivy (41) ani vliv deplece tryptofanu (42) na tuto vazbu.
Celkově lze říci, že dosavadní výzkum neprokázal ani nevyvrátil hypotézu, že vazebné potenciály neurotransmiterových receptorů nebo přenašečů měřitelné pomocí PET jsou kauzálně vztaženy k depresivní poruše. PET a SPECT studie neposkytly souhlasné výsledky o nedostatečné serotonergní nebo dopaminergní funkci při depresi a není pravděpodobné, že by depresivní porucha byla způsobena jedinou příčinou měřitelnou in vivo skanováním (21, 35).
Monoaminoxidázy katalyzují oxidační deaminaci monoaminových neurotransmiterů (tj. serotoninu, dopaminu i noradrenalinu). Při těžké depresivní poruše byly pozorovány zvýšené koncentrace MAO typu A (MAO-A) v různých oblastech mozku; toto zvýšení přetrvává i po dlouhodobé léčbě SSRI (43). Vzhledem k nedostatku jiných přesvědčivých vysvětlení pro úbytek monoaminů při depresi, lze předpokládat, že tato zvýšená hustota MAO-A je primárním procesem vedoucím ke snížení monoaminů při depresi. PET studie také ukázaly, že hustota SERT v mozku neléčených depresivních pacientů v remisi se nelišila od kontrol, zatímco nemedikovaní akutně depresivní pacienti měli sníženou hustotu SERT v různých oblastech mozku (44). Dostupnost SERT v mozku je tedy pravděpodobně „trait marker“ akutní deprese. Zdokonalená monoaminová hypotéza (45) předpokládá, že zvýšené hladiny MAO-A mohou být brány jako obecný proces snižující monoaminy v mozku (bez vztahu k určitým symptomům), zatímco regionální hustota monoaminových transportérů (především SERT) má selektivní vliv na jednotlivé monoaminy (se silným vztahem k určitým symptomům depresivní poruchy).
Vazebný potenciál SERT se mění během roku; u zdravých osob byly vyšší hodnoty pozorovány na podzim a v zimě oproti hodnotám jarním a letním. Vyšší hustota SERT je spojena se snížením synaptických koncentrací serotoninu, proto může být regulace hustoty SERT fyziologickým mechanismem, který by mohl vysvětlit sezonní změny v normálním a patologickém chování (46).
Nová data ukazují, že v účincích antidepresiv mohou být zapojeny i sigma receptory. Kromě opipramolu, který je primárně agonista sigma receptorů, se k těmto receptorům váže s poměrně vysokou afinitou většina užívaných antidepresiv včetně SSRI, TCA, MAOI a ketaminu (8), což není v tabulce 2 zahrnuto. Mechanismus antidepresivních účinků agonistů sigma receptorů není dostatečně znám, ale předpokládá se, že podporují procesy neuroplasticity (47).
Genová exprese, neuroplasticita a neurogeneze
Novější teorie o mechanismech účinků antidepresiv se zaměřují na postreceptorové procesy regulující genovou expresi, tj. na změny v nitrobuněčných signálních cestách, které jsou na monoaminové receptory přímo či nepřímo napojeny. Konkrétněji, studium adaptivních změn vyvolaných v centrálním nervovém systému po dlouhodobém podávání antidepresiv a stabilizátorů nálady se zaměřuje na jejich neurotrofní účinky, které by mohly být společné pro všechna antidepresiva a mohly by být základem rozmanitých procesů vedoucích k jejich terapeutickým účinkům. Pro tento vliv současných antidepresiv na genovou expresi jsou pravděpodobně nezbytné jejich předchozí účinky na neurotransmiterové receptory.
Předpokládá se, že na účincích antidepresiv a stabilizátorů nálady se podílí pět hlavních signálních cest:
- adenylátcyklázová aktivovaná přes Gs proteiny;
- fosfoinozitidová aktivovaná přes Gq/11 proteiny;
- kalciová, přičemž změny cytoplasmatického kalcia zajišťuje jeho vstup přes napěťově řízené glutamátové receptory (např. N-metyl-D-aspartátové, NMDA) nebo jeho uvolňování z nitrobuněčných zásob endoplazmatického retikula a mitochondrií;
- neurotrofní aktivovaná neurotrofiny (např. mozkovým neurotrofním faktorem, BDNF);
- kanonická Wnt cesta, jejíž aktivace vede, mimo jiné, k inhibici glykogensyntázykinázy-3 (GSK-3).
Jednotlivé signální cesty spolu interagují, a vytvářejí tak nitrobuněčný signální systém, který neuronům umožňuje zpracovat signály od různých neurotransmiterových systémů a je zahrnut v regulaci neuroplasticity a odezvě na stres (48). V neuropatologii poruch nálady je zahrnuta i signální cesta oxidu dusnatého, rozpustné guanylátcyklázy a cyklického guanozinmonofosfátu (cGMP). Snížení koncentrací cGMP inhibicí složek této cesty může mít antidepresivní účinky (49, 50).
Podle neurotrofní hypotézy deprese (22) je při depresi narušena plasticita neuronů a antidepresiva ji svými neurotrofními vlastnostmi obnovují, což vede k jejich terapeutickým účinkům. Bylo zjištěno, že dlouhodobé podávání antidepresiv vede ke zvýšení přenosu v určitých signálních drahách a společným mechanismem jejich účinku by mohla být zvýšená aktivace transkripčního faktoru aktivovaného v odezvě na zvýšení hladin cyklického adenozinmonofosfátu (CREB), neurotrofinu BDNF a antiapoptotického faktoru Bcl-2, což vede k podpoře plasticity neuronů, jejich přežívání, konektivity a fungování (obr. 1). Nejvíce pozornosti je z tohoto hlediska věnováno adenylátcyklázové cestě, jejíž aktivace vede ke zvýšení produkce cAMP a aktivaci proteinkináz A (PKA), které fosforylují řadu buněčných proteinů včetně transkripčního faktoru CREB, který je tím aktivován a zvyšuje genovou expresi BDNF, jeho receptoru TrkB a antiapoptotického faktoru Bcl-2. CREB může být fosforylován (aktivován) jak aktivací adenylátcyklázové cesty, tak proteinkinázami závislými na Ca2+ a kalmodulinu (CaMK) v odezvě na aktivaci receptorů napojených na fosfoinozitidovou cestu nebo glutamátových ionotropních receptorů. Také aktivace neurotrofní cesty působí kladnou zpětnou vazbou na aktivitu CREB. Celkově nejsou přesné mechanismy změn neuroplasticity po dlouhodobém podávání antidepresiv dobře známy.
Image 1. Zjednodušené schéma vlivu antidepresiv na neuroplasticitu Přímé účinky antidepresiv způsobují zvyšování mimobuněčných koncentrací monoaminových neurotransmiterů a aktivaci či inhibici jejich receptorů spřažených s G proteiny (R-G<sub>s</sub>, R-G<sub>q/11</sub>), což má za následek aktivaci kaskád nitrobuněčného přenosu signálu a výslednou podporu plasticity neuronů, jejich přežívání, konektivity a fungování. K upregulaci transkripčního faktoru aktivovaného v odezvě na zvýšené koncentrace cAMP (CREB) a mozkového neurotrofního faktoru (BDNF) a jeho receptoru TrkB dochází při aktivaci adenylátcyklázové cesty v odezvě na dlouhodobé podávání různých antidepresiv. CREB může být fosforylován (aktivován) také proteinkinázami závislými na Ca<sup>2+</sup> a kalmodulinu (CaMK) v odezvě na aktivaci receptorů napojených na fosfoinozitidovou cestu nebo na aktivaci glutamátových ionotropních receptorů (GluR). Inhibice glykogensyntázykinázy-3 (GSK-3) vede k neuroprotektivním účinkům a podpoře neuroplasticity, neurogeneze a buněčné odolnosti přes regulaci různých signálních drah v buňce a přes změny v genové expresi proteinů zahrnutých do mechanismů apoptózy a synaptické plasticity. Bcl-2 zeslabuje procesy vedoucí k buněčné smrti nebo atrofii sekvestrací kaspáz, inhibicí uvolňování mitochondriálních apoptotických faktorů, jako je Ca<sup>2+</sup>, cytochrom c (cyt c) nebo apoptózu indukující faktor (AIF). Bcl-2 dále zvyšuje mitochondriální uptake Ca<sup>2+</sup> a zabraňuje otevírání mitochondriálních propustných přechodových pórů (MPTP), což je klíčový děj v buněčné smrti, neboť vede přinejmenším k přechodné ztrátě vnitřního transmembránového potenciálu Δψ<sub>m</sub>, vstupu vody do matrixu a vyrovnání koncentrací iontů. ERK – kináza regulovaná mimobuněčným signálem, MAO – monoaminoxidáza, MAOI – inhibitor MAO, PKA – proteinkináza typu A (aktivovaná cAMP), PKB (Akt) – proteinkináza typu B, PKC – proteinkináza typu C, ROS – reaktivní formy kyslíku, WntR – receptor pro proteiny Wnt 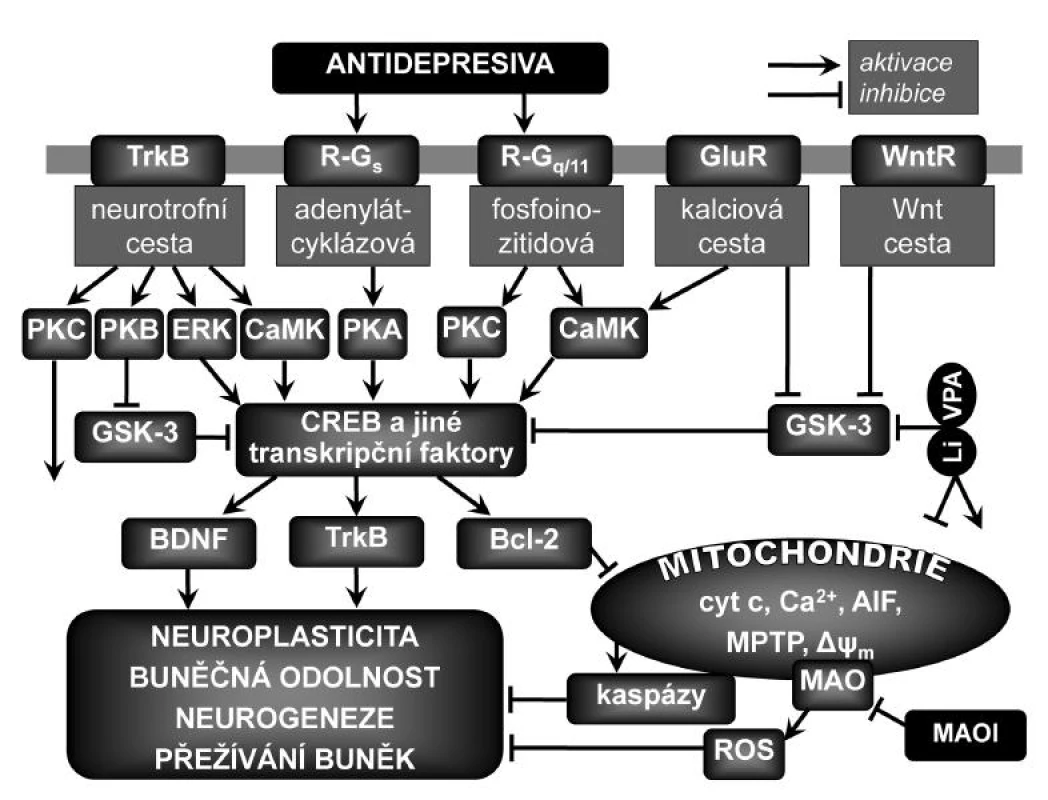
Významným nitrobuněčným enzymem z hlediska účinků antidepresiv a stabilizátorů nálady je zřejmě GSK-3, který může být deaktivován podněty pocházejícími z různých signálních cest, např. z Wnt cesty, fosfatidylinozitol-3 kinázové cesty, od PKA nebo proteinkináz C (PKC) a dalších. Aktivitu GSK-3 moduluje mnoho stabilizátorů nálady a antidepresiv, a to buď přímo, nebo následnými mechanismy. GSK-3 má zřejmě významnou úlohu v patofyziologii a léčbě bipolární poruchy (51).
Přídavná, podpůrná a jiná terapie poruch nálady
Stabilizátory nálady (tymoprofylaktika)
Jako stabilizátory nálady, hlavně při bipolární afektivní poruše, se podávají lithium (inhibuje inozitolmonofosfatázu, snižuje transport inozitolu do buňky, inhibuje GSK-3 a zasahuje do cirkadiánních biorytmů, může ovlivňovat membránový transport kationtů, indukuje změny genové exprese, ovlivňuje glutamátergní neurotransmisi, zvyšuje koncentrace cytoprotektivního proteinu Bcl-2), valproát semisodný (zvyšuje koncentrace GABA inhibicí GABAtransaminázy, blokuje napěťově řízené sodíkové kanály a T-typ kalciových kanálů, inhibuje histondeacylázu 1, inhibuje GSK-3 a zasahuje do cesty vnějším signálem regulovaných proteinkináz (ERK), ovlivňuje metabolismus inozitolu a arachidonátu), karbamazepin (stabilizuje inaktivovaný stav napěťově řízených sodíkových kanálů a snižuje tak excitovatelnost neuronů, potencuje GABAA receptory), lamotrigine (inhibuje napěťově řízené sodíkové kanály, čímž stabilizuje neuronální membrány a moduluje uvolňování excitačních neurotransmiterů) (52, 53). Jako stabilizátory nálady a pro léčbu úzkosti se předepisují také některá atypická antipsychotika, např. risperidon (antagonista 5-HT2A, α1-AR, H1, D2, α2-AR, 5-HT2C, 5-HT1D, 5-HT7, 5-HT1A, D1; má aktivní metabolit paliperidon), olanzapin (antagonista mACh, 5-HT2A, D2, 5-HT2C, α1-AR, D1) a quetiapin (antagonista H1, α1-AR, α2-AR, D2, 5-HT1A, 5-HT2A, 5-HT2C, 5-HT7, D1, D3, D4; jeho aktivní metabolit norquetiapin je navíc silný inhibitor NAT a antagonista mACh).
Přídavná farmakoterapie
Jako přídatná terapie se často užívají kombinace antidepresiv s anxiolytiky, hypnotiky a antipsychotiky. Antidepresiva se kombinují s benzodiazepiny (alprazolam, diazepam, klonazepam nebo kombinovaný lék chlordiazepoxid/amitriptylin), nebo se používají další přídavná léčiva, jako buspiron (agonista 5 HT1A; antagonista D2, α1-AR, α2-AR), gepiron (parciální agonista 5-HT1A), atomoxetin (silný inhibitor NAT, slabší inhibitor SERT) a psychostimulancia jako amfetamin (zvyšuje dopamin v cytosolu presynaptických neuronů a/nebo obrací směr přenosu dopaminu jeho přenašečem DAT; v určitých oblastech mozku inhibuje a/nebo obrací také přenos serotoninu a noradrenalinu; zvyšuje excitabilitu glutamátergních cest; předpokládá se, že enantiomer d-amfetamin působí více přes dopaminergní systém, zatímco l-amfetamin působí spíše přes noradrenergní systém) a jeho deriváty (např. lisdexamfetamin), metylfenidát (hlavně d-metylfenidát; inhibuje NAT a DAT, zvyšuje uvolňování NA a DA) nebo modafinil (zvyšuje uvolňování dopaminu, noradrenalinu, serotoninu a histaminu ze synaptických zakončení v určitých oblastech mozku; slabě inhibuje DAT; ovlivňuje účinnost těsných spojení („gap junctions“) mezi neurony). Při insomnii jsou krátkodobě nasazována Z-hypnotika – zolpidem, zopiklon a zaleplon (podobně jako benzodiazepiny zvyšují inhibiční účinnost GABAA receptorů); další možností terapie insomnie spojenou s poruchami cirkadiánních rytmů je užití melatoninu jako přirozeného hormonu. Kombinace perfenazin/amitriptylin, tedy typického antipsychotika a antidepresiva se používala při agitované depresi. Pro léčbu bipolární afektivní poruchy a farmakorezistentní deprese se používají kombinace antidepresiv a atypických antipsychotik; samostatně byla schválena například kombinace olanzapin/fluoxetin.
Antidepresivní účinky ketaminu jsou dávány do souvislosti s nekompetitivní blokádou glutamátových NMDA receptorů následovanou zvýšením aktivity glutamátových receptorů pro kyselinu (±)-α-amino-3-hydroxy-5-methyl-4-izoxazol propionovou (AMPA) (54). Experimentuje se také s antidepresivními účinky dalších antagonistů NMDA receptorů, např. memantinu.
Některé neuropeptidy, např. látka P, hormon uvolňující kortikotropin (CRH), neuropeptid Y, arginin vasopressin, galanin a další, mohou mít úlohu při depresivních a úzkostných poruchách tím, že modulují monoaminergní neurotransmisi. Tyto neuropeptidy a jejich receptory mohou potom být cíli antidepresiv (55). Novým receptorovým mechanismem v účincích antidepresiv by mohl být antagonismus glukokortikoidních receptorů, neboť u těžké deprese s psychotickými rysy vykazuje účinky – např. mifepriston, antagonista progesteronových receptorů (56). Dalším novým mechanismem pro léčbu deprese, úzkosti a jiných poruch vztažených ke stresu, kdy dochází k nadměrné aktivitě CRH, by mohl být antagonismus receptoru typu 1 pro CRH (57).
Při nadměrném uvolňování neuropeptidového neurotransmiteru neurokininu A by antidepresivně mohly působit blokátory tachykininových NK2 receptorů. Testován byl např. saredutant (antagonista NK2 receptorů), ale klinické studie byly přerušeny. Vývoj byl ukončen i pro amibegron, jehož antidepresivní účinky měly být spojeny s aktivací ß3-AR. Jako přídavné látky při léčbě bipolární afektivní poruch jsou testovány agonisté dopaminových receptorů, např. kariprazin (parciální agonista i antagonista D2 a D3 receptorů), pramipexol (agonista D2, D3 a D4 receptorů), ropinirol (agonista D2, D3, D4). Pro přídavnou léčbu unipolární depresivní poruchy byl schválen aripiprazol (parciální agonista D2, 5-HT1A a 5-HT2C; antagonista D3, D4, 5-HT2A a 5-HT7; má střední afinitu k histaminovým receptorům, α-AR a SERT), který se podává i při bipolární afektivní poruše.
Rostlinné extrakty
Poměrně málo údajů je o biochemických mechanismech účinků různých rostlinných antidepresiv. Antidepresivní účinky vykazuje např. extrakt z třezalky tečkované (Hypericum perforatum) (58). Připravuje se z květů a listů nadzemní části rostliny. Předpokládá se, že hlavními složkami odpovědnými za antidepresivní účinky jsou hyperforin (inhibitor reuptake serotoninu, noradrenalinu, dopaminu, GABA a glutamátu), hypericin (inhibuje dopamin ß-hydroxylázu), různé flavonoidy, GABA a norathyriol. Hypericin působí také fotoaktivně. Třezalka je silný induktor enzymu 3A4 cytochromu P450 (CYP3A4), a má tedy vliv na lékové interakce; zvyšuje také expresi transportního proteinu P-glykoproteinu přes aktivaci nukleárního receptoru PXR. Je dobře tolerovaná a výskyt nežádoucích účinků je podobný jako po placebu (59).
V tradiční perské medicíně je užíván při léčbě deprese a demence šafrán setý (Crocus sativus). Antidepresivní, antikonvulzivní, antioxidační a další terapeutické účinky šafránu byly potvrzeny v několika randomizovaných, dvojitě slepých studiích kontrolovaných placebem (60, 61). Aktivními látkami jsou zřejmě metabolity zeaxantinu: krocin a jeho deriváty, pikrokrocin a safranal. Jedná se o poměrně bezpečnou léčbu; informace o toxicitě šafránu pocházejí pravděpodobně ze záměny s účinky ocúnu jesenního (Colchicum autumnale).
Známým rostlinným antidepresivem a neuroprotektivem je berberin, který se nachází například ve vodilce kanadské (Hydrastis canadensis), dřišťálech a dalších rostlinách. Tento alkaloid inhibuje prolylendopeptidázu a jeho antidepresivní účinky mohou být spojeny s aktivací sigma receptorů, inhibicí MAO, blokádou α2-AR a ovlivněním signální cesty oxidu dusnatého a cyklického guanozinmonofosfátu (62). Účinné složky proti úzkosti, stresu a depresi jsou zřejmě obsaženy v bylinách z čeledi hluchavkovitých (Lamiaceae) – v levanduli lékařské (Lavandula angustifolia), šalvěji muškátové (Salvia sclarea) a rozmarýnu lékařském (Rosmarinus officinalis), a z čeledi routovitých (Routaceae) – pomerančovníku pravém (Citrus aurantium var. sinensis), citroníku bergamotovém (Citrus bergamia), a citroníku obecném (Citrus limon). Jsou přítomny v heřmánku římském (Anthemis nobilis), růži damašské (Rosa damascena) (63), snad také v pelyňku pravém (Artemisia absinthium), santalu bílém (Santalum album), v rodu pelargonií (Pelargonium spp.) a dalších (64).
Prekurzory monoaminových neurotransmiterů
Z hlediska vlivu výživy na poruchy nálady bylo nejpodrobněji studováno potravou indukované snížení či zvýšení koncentrací monoaminových neurotransmiterů. Serotonin je v mozku syntetizován z tryptofanu, zatímco noradrenalin a dopamin z tyrozinu. Koncentrace těchto prekurzorů v plasmě mohou souviset s účinností a rychlostí klinické odezvy na podávání různých antidepresiv. Význam prekurzorů monoaminových neurotransmiterů ukazují studie, v nichž byly sledovány důsledky jejich uměle vyvolaného nedostatku (vyčerpání, deplece). Ke snížení syntézy 5-HT dochází po vyčerpání tryptofanu nebo vlivem p-chlorfenylalaninu, který inhibuje syntézu 5-HT. Ke snížení koncentrací NA a DA dochází po vyčerpání fenylalaninu/tyrozinu nebo vlivem α-metyl-p-tyrozinu, který je inhibitorem tyrozinhydroxylázy.
Provokační studie s deplecí monoaminů neukázaly zhoršení nálady u zdravých kontrol, pouze mírné zhoršení nálady u osob s rodinnou historií těžké depresivní poruchy. Nejvýraznější byl účinek deplece tryptofanu u pacientů s těžkou depresivní poruchou, kteří byli v remisi a užívali serotonergní antidepresiva (65). Lze to vysvětlit tím, že akutní snížení hladin synaptického serotoninu vede ke snížení hladin mozkového neurotrofního faktoru (BDNF), a to vede k rychlému snížení uvolňování řady neurotransmiterů, což indukuje depresivní relaps u těchto pacientů.
Nenasycené mastné kyseliny
Úloha cholesterolu, fosfolipidů a polynenasycených mastných kyselin (PUFA) je již dlouho diskutována v některých biochemických hypotézách afektivních poruch, které vycházejí z předpokladu, že pro správný vývoj a funkci mozkových struktur je nezbytný normální neuronální lipidový metabolismus. PUFA jsou syntetizovány z potravních prekurzorů, linolové kyseliny (18 : 2, n-6) pro n-6 skupinu a α-linolenové kyseliny (18 : 3, n-3) pro n-3 skupinu mastných kyselin. Mechanismy působení n-3 a n-6 nenasycených mastných kyselin při normální nebo patologické funkci neuronální aktivity nejsou dostatečně známy, ale je zřejmé, že dokosahexaenová kyselina (DHA, 22 : 6, n-3) je hlavní n-3 mastná kyselina v mozku a že eikosapentaenová kyselina (EPA, 20 : 5, n-3) má významnou úlohu jako protizánětlivý prekurzor. Kyselina arachidonová (20 : 4, n-6) je u lidí prekurzorem prostaglandinů, prostacyklinů, tromboxanů a leukotrienů. Obecně mohou být nenasycené mastné kyseliny spojeny s mnoha aspekty funkce neuronů včetně neurotransmise, fluidity membrán, regulace receptorů, přenašečů a iontových kanálů a genové exprese.
Diskuze o úloze n-3 (omega-3) PUFA při depresi a její léčbě probíhá poměrně dlouho. U pacientů s těžkou depresivní poruchou se vyskytuje často komorbidita s kardiovaskulárními onemocněními. Jak na kardiovaskulární zdravotní stav, tak na léčbu poruch nálady mohou mít n-3 PUFA podpůrný vliv. Z placebem kontrolovaných studií vyplývá, že n-3 PUFA jsou významnou přídavnou látkou v léčbě depresivní poruchy (66–69). Vhodné dávkování a poměr podávaných n-3 mastných kyselin (EPA samotná, EPA plus DHA, DHA samotná) musí být teprve stanoveno. Pro doporučení monoterapie poruch nálady pomocí n-3 mastných kyselin není zatím dostatek výsledků. Mechanismy vysvětlující vztah mezi stavem n-3 PUFA a depresí zahrnují: 1. regulaci serotonergního systému (70); 2. zvýšenou zánětlivou odezvu imunitního systému (23); 3. narušený fosfolipidový metabolismus a přenos signálu vztažený k mastným kyselinám (71).
Antioxidanty, vitaminy, bioenergetické látky, stopové prvky
Předpokládá se, že depresivní porucha souvisí s narušením neuroplasticity v důsledku poškození mozkových buněk. Ochranu mozku před účinky reaktivních forem kyslíku a dusíku (RONS) zajišťují endogenní antioxidačními systémy, které zahrnují superoxiddismutázy, peroxiredoxiny a glutathionperoxidázy, katalázy a vychytávače reaktivních látek, jako je α-tokoferol a kyselina askorbová (72). V séru osob s těžkou depresivní poruchou byla pozorována snížená celková antioxidační kapacita a zvýšený celkový oxidační stav; léčba antidepresivy vedla v některých studiích k normalizaci těchto parametrů (73), v jiných studiích ale nebyly v remisi po dlouhodobém podávání antidepresiv pozorovány významné změny (74).
Látky, které jsou pro své neuroprotektivní účinky zahrnuty v terapeutických strategiích farmakologické léčby různých duševních a neurodegenerativních onemocnění, lze rozdělit na vitaminy a antioxidanty (B1 – thiamin, B2 – riboflavin, B3 – niacin, B5 – kyselina pantothenová, B6 – pyridoxin, B7 – biotin, B9 – kyselina listová, C – kyselina askorbová, E – tokoferoly, karotenoidy, CoQ10, kyselina lipoová, acetylcystein) a bioenergetické látky (karnitiny, kreatin, pyruvát, sirtuiny, nikotinamid a další) (75). Také nedostatek či nadbytek stopových prvků, jako železo, měď, zinek, mangan nebo selen může být spojen s buněčnými dysfunkcemi (76).
Obecně nemusí být vysoké koncentrace antioxidantů dobré a mohou způsobit i buněčné poškození (77). Mnohé antioxidanty účinkují na zvířecích modelech, ale nikoli u lidí. Existuje však i řada důkazů o tom, že dysfunkce buněčných enzymů mohou být zlepšeny odpovídajícím příjmem substrátů a prekurzorů koenzymů a tyto látky tedy mohou být užitečné v prevenci poškození při Alzheimerově či Parkinsonově nemoci (78).
Metylace je natolik nezbytnou částí funkce mozku, že její narušení vede ke změně aktivity neuronů. Není potom důležitý nějaký produkt metylace, ale metylace samotná. Proces metylace zahrnuje zvláště metionin, S-adenozylmetionin a kyselinu listovou (folát, vitamin B9, Bc, folacin). Transmetylační reakce ovlivňují například syntézu monoaminů, různé membránové reakce a genovou expresi. Metabolismus monoaminů v mozku je propojen s kyselinou listovou a S-adenozylmetioninem přes regeneraci tetrahydrobiopterinu, kofaktoru nezbytného pro aktivitu tryptofanhydroxylázy, fenylalaninhydroxylázy a tyrozinhydroxylázy. Nízké koncentrace folátu v séru a červených krvinkách byly nalezeny asi u třetiny osob s těžkou depresivní poruchou, přičemž vyšší počáteční koncentrace folátu predikovaly větší zlepšení depresivních symptomů po podávání antidepresiv a podávání folátu mělo potencující účinky na terapii antidepresivy (79). Citlivějším indikátorem funkční nedostatečnosti kyseliny listové, nebo vitaminu B12 je celkový plazmatický homocystein. Syntéza metioninu z homocysteinu vyžaduje dodání metylových skupin z aktivního metabolitu folátu, metylfolátu (5-metyltetrahydrofolátu) a také vitamin B12 jako kofaktor. Tedy funkční nedostatečnost jednoho nebo druhého vitaminu má za následek zvýšené koncentrace homocysteinu. Metionin je bezprostředním prekurzorem S-adenozylmetioninu, který je donorem metylových skupin v nespočetných reakcích v mozku.
Antidepresivní terapie může zahrnovat také procesy, které nejsou farmakologické, jako je spánková deprivace, fototerapie, elektrokonvulzivní terapie, repetitivní transkraniální magnetická stimulace, vagová stimulace (stimulace levého bloudivého nervu), hluboká mozková stimulace a psychoterapie. Jak jejich použití změní neurochemii a neurobiologii mozku není často dobře známo, ale předpokládá se, že účinky jsou podobné jako po podávání antidepresiv.
Závěr
Molekulární mechanismy vzniku poruch nálady nejsou dosud známy, proto se při hledání nových antidepresiv stále vychází z jejich účinků na monoaminové přenašeče a receptory a na další receptory (sigma, melatoninové, neuropeptidové, glutamátové NMDA, GABA), případně z vícenásobných účinků na přenašeče i receptory. Protože za terapeutické účinky jsou odpovědné až adaptivní procesy vyvolané dlouhodobým podáváním antidepresiv, dochází ke zpoždění jejich terapeutických účinků. Zpožděný nástup terapeutických účinků antidepresiv je pravděpodobně dán mechanismem jejich působení, nikoliv samotným onemocněním, neboť například spánková deprivace nebo elektrokonvulzivní terapie vykazují rychlejší odezvu. Důvodem tohoto zpoždění je zřejmě potřeba vyvolání změn neuroplasticity a dalších adaptivních procesů modulujících neurotransmisi. Časový sled základních procesů a změn spojených a účinky různých antidepresiv je shrnut na obrázku 2.
Image 2. Předpokládaný sled účinků antidepresiv BDNF – mozkový neurotrofní faktor, CREB – transkripční faktor aktivovaný v odezvě na zvýšení hladin cyklického adenozinmonofosfátu, DAT – přenašeč pro dopamin, NAT – přenašeč pro noradrenalin, HPA – osa hypotalamus-hypofýza-kůra nadledvin, NGF – nervový růstový faktor, LTD – dlouhodobá deprese, LTP – dlouhodobá potenciace, SERT – přenašeč pro serotonin 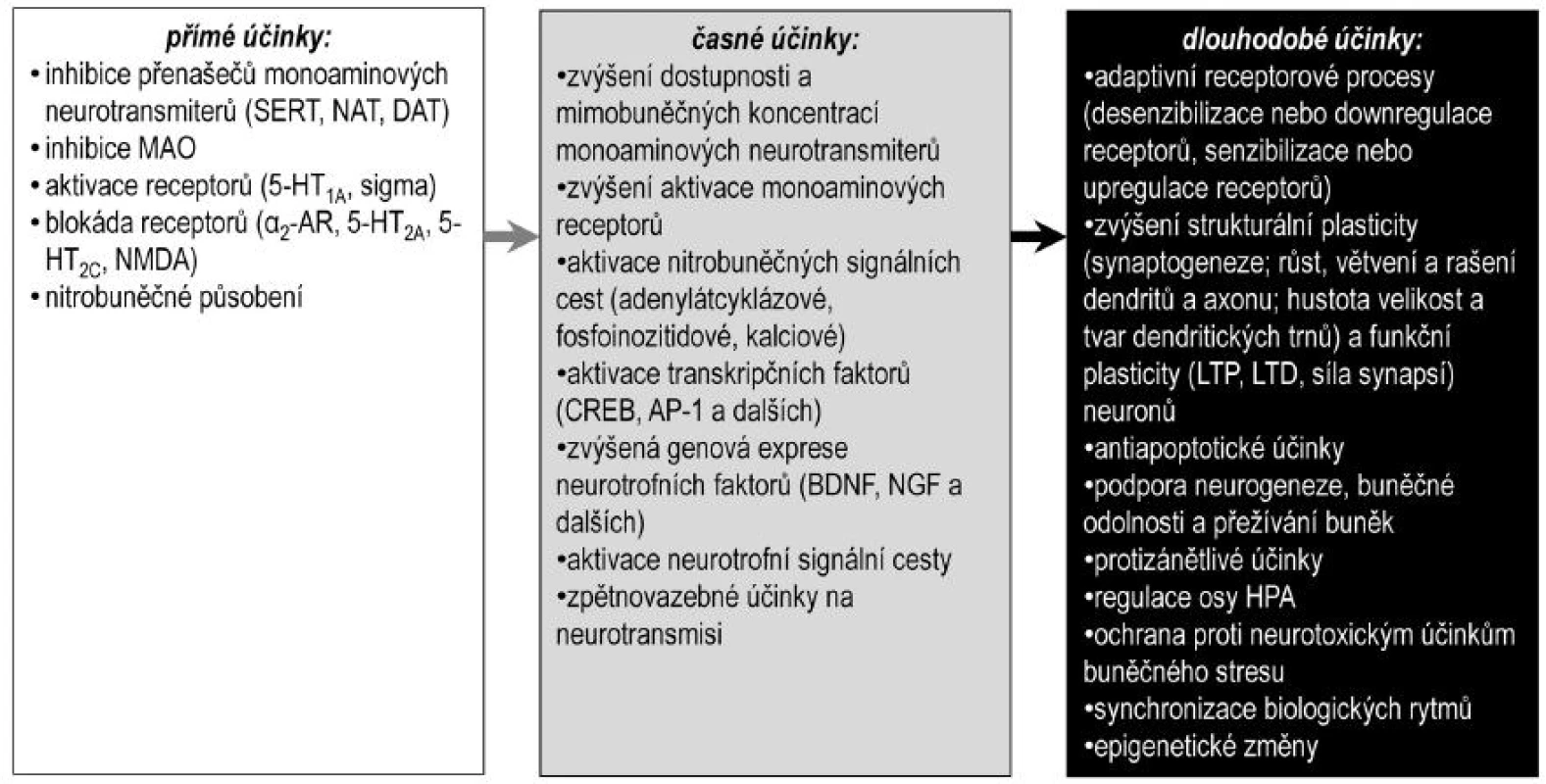
Problém zpožděného nástupu terapeutických účinků antidepresiv by snad mohlo vyřešit užívání látek působících přímo na určité složky nitrobuněčných signálních cest v určitých oblastech mozku. Jak nalezení těchto složek, tak možnost selektivního působení na vybrané oblasti mozku a jejich propojení jsou předmětem současného výzkumu normálních i patofyziologických procesů spojených s přenosem, uchováním a zpracováním informací v mozku (80).
Největší pozornost byla věnována účinkům antidepresiv na serotonergní systém, ale vzhledem k propojení monoaminergních, glutamátergních, GABAergních, acetylcholinergních a peptidergních systémů v mozku lze očekávat, že antidepresivní účinky mohou vykazovat i látky, které neovlivňují přímo monoaminergní neurony. Nově jsou testovány například účinky ketaminu (antagonista NMDA receptorů), který u farmakorezistentní bipolární deprese vykazuje silné a rychlé (během 40 minut) antidepresivní účinky již po jedné intravenózní aplikaci (81). Další nová antidepresiva by mohla primárně či sekundárně působit na abnormality v cirkadiánních biorytmech, které jsou přítomny ve všech typech deprese včetně sezonních afektivních poruch, depresivní poruchy a bipolární afektivní poruchy (82). Vzhledem k důležité úloze fosfodiesteráz (enzymů degradujících cyklické nukleotidy) v nitrobuněčných signálních kaskádách aktivovaných řadou neurotransmiterových receptorů jsou testovány i antidepresivní účinky inhibitorů fosfodiesteráz (83, 84). Je zajímavé, že téměř všechny nové psychotropní léky jsou multifunkční, tj., mají více než jeden možný mechanismus terapeutického působení (85).
Současný pohled na molekulární mechanismy provázející depresi a její léčbu daleko překračuje klasickou monoaminovou hypotézu, resp. rozšiřuje ji o mnoho neurobiologických procesů měnících strukturální i funkční neuroplasticitu, jako jsou genová exprese, nitrobuněčný přenos signálu, cytokiny a neurotrofní faktory. Přes intenzivní výzkum a snahu nalézt biologické markery a diagnostický test zůstává diagnóza deprese klinická. V současné době neexistuje spolehlivý biochemický, genetický, fyziologický či jiný biologický test, který by umožnil diagnostikovat depresivní poruchu a její podtypy, nebo který by umožnil předpovědět úspěšnost farmakoterapie. Klíčovou úlohu v léčebných účincích antidepresiv mají adaptivní změny v neurotransmisi, jejichž přesné určení ztěžuje jednak vzájemná provázanost nitrobuněčných procesů, jednak skutečnost, že odezva na stejné antidepresivum je rozdílná u osob se stejnými depresivními symptomy.
Nejvýznamnějším výzkumným směrem v molekulární psychiatrii posledních let je hledání biologických znaků využitelných pro diagnostiku duševních a neurodegenerativních onemocnění a pro predikci účinnosti farmakoterapie. Kromě nových monoaminových mechanismů je přitom pozornost věnována i mechanismům glutamátovým a neuropeptidovým. Předpokládá se, že poznání nitrobuněčných procesů mezi aktivací neurotransmiterových receptorů a zvýšením genové exprese neurotrofinů a dalších molekul podílejících se na neuroplasticitě umožní vysvětlit interindividuálními rozdíly v odezvě na léčbu antidepresivy a případně nalézt nová rychleji a účinněji působící antidepresiva. Existence křížových propojení mezi nitrobuněčnými signálními cestami transdukce signálu ovlivněnými při poruchách nálady, podávání antidepresiv, stresu, apoptóze a synaptické plasticitě znamená, že změny neuroplasticity mohou být vyvolány v různých místech různých signálních cest a že terapeutická strategie léčby poruch nálady by měla být optimálně zaměřena na více cílů a mechanismů v signálních cestách. Výzkum se zaměřuje na ty nitrobuněčné procesy, které jsou prokazatelně ovlivněny při poruchách nálady nebo které jsou citlivé na podávání antidepresiv a stabilizátorů nálady. V současné době to jsou především transkripční faktor CREB, neurotrofin BDNF, antiapoptotický faktor Bcl-2, GSK-3, PUFA, kortizol, melatonin, cytokiny, katechol-O-metyltransferáza, MAO, cytochromy P450, homocystein, SERT, Na+K+-ATPázy, mitochondriální dysfunkce, reaktivní formy kyslíku, oxid dusnatý, cytoplazmatické kalcium a kalmodulin, membránový potenciál a další (86). Celkově je pozornost zaměřena hlavně na farmakogenetiku, neuroendokrinní testy, vlastnosti SERT, MAO, mitochondriální funkce a růstové faktory.
Zkratky
- 5-HT – serotonin, 5-hydroxytryptamin
- AIF – apoptózu indukující faktor
- AMPA – kyselina (±)-α-amino-3-hydroxy-5-methyl-4-izoxazol propionová
- AR – adrenoceptor, adrenergní receptor
- Bcl-2 – antiapoptoticky působící člen rodiny proteinů Bcl-2
- BDNF – mozkový neurotrofní faktor
- CaMK – proteinkináza závislá na vápníku a kalmodulinu
- CREB protein – transkripční faktor aktivovaný v odezvě na zvýšení hladin cyklického adenozinmonofosfátu (cAMP response element-binding protein)
- CRH – hormon uvolňující kortikotropin, kortikoliberin
- CYP, CYP450 – cytochrom P450
- cyt c – cytochrom c
- DA – dopamin
- DALY – roky života ztracené předčasným úmrtím nebo žité v jiném než plném zdraví (disability-adjusted life years)
- DAT – přenašeč pro dopamin
- DHA – dokosahexaenová kyselina (22 : 6, n-3)
- EPA – eikosapentaenová kyselina (20 : 5, n-3)
- ERK – kináza regulovaná mimobuněčným signálem
- GABA – kyselina γ-aminomáselná
- GluR – glutamátový ionotropní receptor
- GSK-3 – glykogensyntázakináza-3
- HPA – osa hypotalamus-hypofýza-kůra nadledvin
- LTD – dlouhodobá deprese
- LTP – dlouhodobá potenciace
- mACh – muskarinový acetylcholinový receptor
- MAO – monoaminoxidáza
- MAOI – inhibitor monoaminoxidázy
- MASSA – melatoninový agonista a selektivní serotoninový antagonista
- MPTP – mitochondriální propustný přechodový pór
- NA – noradrenalin
- NaSSA – noradrenergní a specifické serotonergní antidepresivum
- NAT – přenašeč pro noradrenalin
- NDDI – noradrenalinový a dopaminový disinhibitor
- NDRI – inhibitor zpětného vychytávání noradrenalinu a dopaminu
- NGF – nervový růstový faktor
- NMDA – N-metyl-D-aspartát
- NOS – syntáza oxidu dusnatého
- NRI – inhibitor zpětného vychytávání noradrenalinu
- PET – pozitronová emisní tomografie
- PKA – proteinkináza typu A
- PKB (Akt) – proteinkináza typu B
- PKC – proteinkináza typu C
- PUFA – polynenasycené mastné kyseliny
- R-Gs, R-Gq/11 – receptory spřažené s G proteiny
- RONS – reaktivní forma kyslíku a dusíku
- ROS – reaktivní formy kyslíku
- SARI – serotoninový antagonista a inhibitor zpětného vychytávání serotoninu
- SERT – přenašeč pro serotonin
- SNRI – inhibitor zpětného vychytávání serotoninu a noradrenalinu
- SPECT – jednofotonová emisní výpočetní tomografie
- SSRI – selektivní inhibitor zpětného vychytávání serotoninu
- TCA – tricyklické antidepresivum
- WntR – receptor pro proteiny Wnt
- YLD – roky života žité v jiném než plném zdraví („years of life lived with disability“,)
- YLL – roky života ztracené předčasným úmrtím („years of life lost“)
- Δψm – vnitřní transmembránový potenciál
Práce byla podpořena výzkumným záměrem Ministerstva školství, mládeže a tělovýchovy ČR MSM0021620849.
ADRESA PRO KORESPONDENCI:
doc. RNDr. Zdeněk Fišar, CSc.
Psychiatrická klinika 1. LF UK a VFN
Ke Karlovu 11, 128 02 Praha 2
tel./fax: +420 224 965 313, e-mail: zfisar@lf1.cuni.cz
Sources
1. Simon GE, et al. Is the lifetime risk of depression actually increasing? J Clin Epidemiol 1995; 48(9): 1109–1118.
2. Kessler RC, et al. Lifetime prevalence and age-of-onset distributions of mental disorders in the World Health Organization’s World Mental Health Survey Initiative. World Psychiatry 2007; 6 : 168–176.
3. Murray CJL, Lopez AD. Alternative visions of the future: projecting mortality and disability, 1990–2020. In: Murray CJL, et al. The global burden of disease: a comprehensive assessment of mortality and disability from diseases, injuries, and risk factors in 1990 and projected to 2020. Cambridge, Mass: Harvard School of Public Health on behalf of the WHO and the World Bank 1996; 325–395.
4. Murray CJ, Lopez AD. Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study. Lancet 1997; 349(9064): 1498–1504.
5. Mathers CD, Lopez AD, Murray ChJL. The Burden of Disease and Mortality by Condition: Data, Methods, and Results for 2001. In: Lopez AD, et al. Global Burden of Disease and Risk Factors. Disease Control Priorities Project. Washington (DC): World Bank 2006; 45–93.
6. WHO. Depression. World Health Organization (WHO), Geneva 2011, http://www.who.int/mental_health/management/depre ssion/definition/en/
7. McEwen BS, et al. The neurobiological properties of tianeptine (Stablon): from monoamine hypothesis to glutamatergic modulation. Mol Psychiatry 2010; 15(3): 237–249.
8. Fishback JA, et al. Sigma receptors: potential targets for a new class of antidepressant drug. Pharmacol Ther 2010; 127(3): 271–282.
9. Popoli M. Agomelatine: innovative pharmacological approach in depression. CNS Drugs 2009; 23(Suppl 2): 27–34.
10. Švestka J, et al. Agomelatin – antidepresivum s novým mechanizmem působení. Psychiatrie 2010; 14(2): 98–108.
11. Millan MJ, et al. The novel melatonin agonist agomelatine (S20098) is an antagonist at 5-hydroxytryptamine2C receptors, blockade of which enhances the activity of frontocortical dopaminergic and adrenergic pathways. J Pharmacol Exp Ther 2003; 306(3): 954–964.
12. Bourin M, et al. Antidepressant-like activity of S 20098 (agomelatine) in the forced swimming test in rodents: involvement of melatonin and serotonin receptors. J Psychiatry Neurosci 2004; 29(2): 126–133.
13. Anttila SA, et al. A review of the pharmacological and clinical profile of mirtazapine. CNS Drug Rev 2001; 7(3): 249–264.
14. Hamik A, et al. Analysis of tandospirone (SM-3997) interactions with neurotransmitter receptor binding sites. Biol Psychiatry 1990; 28(2): 99–109.
15. Bartoszyk GD, et al. EMD 68843, a serotonin reuptake inhibitor with selective presynaptic 5-HT1A receptor agonistic properties. Eur J Pharmacol 1997; 322(2–3): 147–153.
16. Tatsumi M, et al. Pharmacological profile of antidepressants and related compounds at human monoamine transporters. Eur J Pharmacol 1997; 340(2–3): 249–258.
17. Fisar Z, et al. Inhibition of monoamine oxidase activity by antidepressants and mood stabilizers. Neuro Endocrinol Lett 2010; 31(5): 645–656.
18. Richelson E. Pharmacology of antidepressants. Mayo Clin Proc 2001; 76(5): 511–527.
19. Fišar Z, et al. Serotonergní účinky antidepresiv. Česká a slovenská psychiatrie 2011; 107: (2): 115–120.
20. Richelson E. Interactions of antidepressants with neurotransmitter transporters and receptors and their clinical relevance. J Clin Psychiatry 2003; 64(Suppl 13): 5–12.
21. Nikolaus S, et al. In vivo imaging of synaptic function in the central nervous system: II. Mental and affective disorders. Behav Brain Res 2009; 204(1): 32–66.
22. Duman RS. Neuronal damage and protection in the pathophysiology and treatment of psychiatric illness: stress and depression. Dialogues Clin Neurosci 2009; 11(3): 239–255.
23. Maes M, et al. The inflammatory & neurodegenerative (I & ND) hypothesis of depression: leads for future research and new drug developments in depression. Metab Brain Dis 2009; 24(1): 27–53.
24. Nikisch G. Involvement and role of antidepressant drugs of the hypothalamic-pituitary-adrenal axis and glucocorticoid receptor function. Neuro Endocrinol Lett 2009; 30(1): 11–16.
25. Bunney JN, et al. Circadian abnormalities, molecular clock genes and chronobiological treatments in depression. Br Med Bull 2008; 86 : 23–32.
26. Schulz P, et al. Neurobiology of circadian systems. CNS Drugs 2009; 23(Suppl 2): 3–13.
27. Mendlewicz J. Disruption of the circadian timing systems: molecular mechanisms in mood disorders. CNS Drugs 2009; 23(Suppl 2): 15–26.
28. Savitz J, et al. 5-HT1A receptor function in major depressive disorder. Prog Neurobiol 2009; 88(1): 17–31.
29. Blier P, et al. Current advances and trends in the treatment of depression. Trends Pharmacol Sci 1994; 15(7): 220–226.
30. Blier P, et al. Possible serotonergic mechanisms underlying the antidepressant and anti-obsessive-compulsive disorder responses. Biol Psychiatry 1998; 44(5): 313–323.
31. Blier P, et al. Is there a role for 5-HT1A agonists in the treatment of depression? Biol Psychiatry 2003; 53(3): 193–203.
32. Meyer JH. Imaging the serotonin transporter during major depressive disorder and antidepressant treatment. J Psychiatry Neurosci 2007; 32(2): 86–102.
33. Stahl SM. Mechanism of action of trazodone: a multifunctional drug. CNS Spectr 2009; 14(10): 536–546.
34. Blier P. The pharmacology of putative early-onset antidepressant strategies. Eur Neuropsychopharmacol 2003; 13(2): 57–66.
35. Smith DF, et al. Molecular tools for assessing human depression by positron emission tomography. Eur Neuropsychopharmacol 2009; 19(9): 611–628.
36. Sargent PA, et al. Brain serotonin1A receptor binding measured by positron emission tomography with [11C]WAY-100635: effects of depression and antidepressant treatment. Arch Gen Psychiatry 2000; 57(2): 174–180.
37. Bhagwagar Z, et al. Persistent reduction in brain serotonin1A receptor binding in recovered depressed men measured by positron emission tomography with [11C]WAY-100635. Mol Psychiatry 2004; 9(4): 386–392.
38. Drevets WC, et al. Serotonin-1A receptor imaging in recurrent depression: replication and literature review. Nucl Med Biol 2007; 34(7): 865–877.
39. Sargent PA, et al. 5-HT1A receptor binding in euthymic bipolar patients using positron emission tomography with [carbonyl-11C]WAY-100635. J Affect Disord 2010; 123(1-3): 77–80.
40. Parsey RV, et al. Altered serotonin 1A binding in major depression: a [carbonyl-C-11]WAY100635 positron emission tomography study. Biol Psychiatry 2006; 59(2): 106–113.
41. Moses-Kolko EL, et al. Measurement of 5-HT1A receptor binding in depressed adults before and after antidepressant drug treatment using positron emission tomography and [11C]WAY-100635. Synapse 2007; 61(7): 523–530.
42. Praschak-Rieder N, et al. Tryptophan depletion and serotonin loss in selective serotonin reuptake inhibitor-treated depression: an [18F] MPPF positron emission tomography study. Biol Psychiatry 2004; 56(8): 587–591.
43. Meyer JH, et al. Brain monoamine oxidase A binding in major depressive disorder: relationship to selective serotonin reuptake inhibitor treatment, recovery, and recurrence. Arch Gen Psychiatry 2009; 66(12): 1304–1312.
44. Selvaraj S, et al. Diminished brain 5-HT transporter binding in major depression: a positron emission tomography study with [11C]DASB. Psychopharmacology (Berl) 2011; 213(2–3): 555–562.
45. Meyer JH, et al. Elevated monoamine oxidase a levels in the brain: an explanation for the monoamine imbalance of major depression. Arch Gen Psychiatry 2006; 63(11): 1209–1216.
46. Praschak-Rieder N, et al. Seasonal variation in human brain serotonin transporter binding. Arch Gen Psychiatry 2008; 65(9): 1072–1078.
47. Yang S, et al. Sigma receptor agonists provide neuroprotection in vitro by preserving bcl-2. Anesth Analg 2007; 104(5): 1179–1184.
48. Fišar Z, et al. Intracellular signalling pathways and mood disorders. Folia Biol (Praha) 2010; 56(4): 135–148.
49. Heiberg IL, et al. Reduction of cGMP and nitric oxide has antidepressant-like effects in the forced swimming test in rats. Behav Brain Res 2002; 134(1–2): 479–484.
50. Paul IA, et al. Glutamate and depression: clinical and preclinical studies. Ann NY Acad Sci 2003; 1003 : 250–272.
51. Gould TD, et al. Targeting signal transduction pathways in the treatment of mood disorders: recent insights into the relevance of the Wnt pathway. CNS Neurol Disord Drug Targets 2007; 6(3): 193–204.
52. Chen G, et al. The extracellular signal-regulated kinase pathway: an emerging promising target for mood stabilizers. Curr Opin Psychiatry 2006; 19(3): 313–323.
53. Rapoport SI, et al. Bipolar disorder and mechanisms of action of mood stabilizers. Brain Res Rev 2009; 61(2): 185–209.
54. Machado-Vieira R, et al. Ketamine and the next generation of antidepressants with a rapid onset of action. Pharmacol Ther 2009; 123(2): 143–150.
55. Madaan V, et al. Neuropeptides: relevance in treatment of depression and anxiety disorders. Drug News Perspect 2009; 22(6): 319–324.
56. Flores BH, et al. Clinical and biological effects of mifepristone treatment for psychotic depression. Neuropsychopharmacology 2006; 31(3): 628–636.
57. Kehne JH. The CRF1 receptor, a novel target for the treatment of depression, anxiety, and stress-related disorders. CNS Neurol Disord Drug Targets 2007; 6(3): 163–182.
58. Linde K. St. John’s wort – an overview. Forsch Komplementmed 2009; 16(3): 146–155.
59. Ernst E, et al. Adverse effects profile of the herbal antidepressant St. John’s wort (Hypericum perforatum L.). Eur J Clin Pharmacol 1998; 54(8): 589–594.
60. Akhondzadeh Basti A, et al. Comparison of petal of Crocus sativus L. and fluoxetine in the treatment of depressed outpatients: a pilot double-blind randomized trial. Prog Neuropsychopharmacol Biol Psychiatry 2007; 31(2): 439–442.
61. Akhondzadeh S, et al. A 22-week, multicenter, randomized, double-blind controlled trial of Crocus sativus in the treatment of mild-to-moderate Alzheimer’s disease. Psychopharmacology (Berl) 2010; 207(4): 637–643.
62. Kulkarni SK, et al. Berberine: a plant alkaloid with therapeutic potential for central nervous system disorders. Phytother Res 2010; 24(3): 317–324.
63. Seol GH, et al. Antidepressant-like effect of Salvia sclarea is explained by modulation of dopamine activities in rats. J Ethnopharmacol 2010; 130(1): 187–190.
64. Setzer WN. Essential oils and anxiolytic aromatherapy. Nat Prod Commun 2009; 4(9): 1305–1316.
65. Delgado PL, et al. Tryptophan-depletion challenge in depressed patients treated with desipramine or fluoxetine: implications for the role of serotonin in the mechanism of antidepressant action. Biol Psychiatry 1999; 46(2): 212–220.
66. Sontrop J, et al. ω-3 polyunsaturated fatty acids and depression: a review of the evidence and a methodological critique. Prev Med 2006; 42(1): 4–13.
67. Nemets H, et al. Omega-3 treatment of childhood depression: a controlled, double-blind pilot study. Am J Psychiatry 2006; 163(6): 1098–1100.
68. Freeman MP. Omega-3 fatty acids in major depressive disorder. J Clin Psychiatry 2009; 70(Suppl 5): 7–11.
69. Appleton KM, et al. Updated systematic review and meta-analysis of the effects of n-3 long-chain polyunsaturated fatty acids on depressed mood. Am J Clin Nutr 2010; 91(3): 757–770.
70. Hibbeln JR, et al. Plasma total cholesterol concentrations do not predict cerebrospinal fluid neurotransmitter metabolites: implications for the biophysical role of highly unsaturated fatty acids. Am J Clin Nutr 2000; 71(1 Suppl): 331S–338S.
71. Horrobin DF, et al. Depression and bipolar disorder: relationships to impaired fatty acid and phospholipid metabolism and to diabetes, cardiovascular disease, immunological abnormalities, cancer, ageing and osteoporosis. Possible candidate genes. Prostaglandins Leukot Essent Fatty Acids 1999; 60(4): 217–234.
72. Halliwell B. Oxidative stress and neurodegeneration: where are we now? J Neurochem 2006; 97(6): 1634–1658.
73. Cumurcu BE, et al. Total antioxidant capacity and total oxidant status in patients with major depression: impact of antidepressant treatment. Psychiatry Clin Neurosci 2009; 63(5): 639–645.
74. Gałecki P, et al. Lipid peroxidation and antioxidant protection in patients during acute depressive episodes and in remission after fluoxetine treatment. Pharmacol Rep 2009; 61(3): 436–447.
75. BolaĖos JP, et al. Mitochondria and reactive oxygen and nitrogen species in neurological disorders and stroke: Therapeutic implications. Adv Drug Deliv Rev 2009; 61(14): 1299–1315.
76. Valko M, et al. Metals, toxicity and oxidative stress. Curr Med Chem 2005; 12(10): 1161–1208.
77. Gutteridge JM, et al. Antioxidants: Molecules, medicines, and myths. Biochem Biophys Res Commun 2010; 393(4): 561–564.
78. Raboch J. Kognitivní funkce, stárnutí a stravovací návyky. Čes a slov psychiat 2010; 106(2): 81–86.
79. Miller AL. The methylation, neurotransmitter, and antioxidant connections between folate and depression. Altern Med Rev 2008; 13(3): 216–226.
80. Tanti A, et al. Open questions in current models of antidepressant action. Br J Pharmacol 2010; 159(6): 1187–1200.
81. Diazgranados N, et al. A randomized add-on trial of an N-methyl-D-aspartate antagonist in treatment-resistant bipolar depression. Arch Gen Psychiatry 2010; 67(8): 793–802.
82. Kennaway DJ. Clock genes at the heart of depression. J Psychopharmacol 2010; 24(8): 5–14.
83. Halene TB, et al. PDE inhibitors in psychiatry – future options for dementia, depression and schizophrenia? Drug Discov Today 2007; 12(19-20): 870–878.
84. Cashman JR, et al. Dual inhibitors of phosphodiesterase-4 and serotonin reuptake. J Med Chem 2009; 52(6): 1530–1539.
85. Stahl SM. Multifunctional drugs: a novel concept for psychopharmacology. CNS Spectr 2009; 14(2): 71–73.
86. Fišar Z, et al. Depression, antidepressants, and peripheral blood components. Neuro Endocrinol Lett 2008; 29(1): 17–28.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Biochemické mechanismy účinků antidepresiv
- Hypofosfatázia – biochemické a klinické prejavy, molekulovo-genetická podstata
- Posttraumatická pannikulitida (dekubitus ?) prsu – klinický případ
- Nové medicínské paradigma posuzování stupně závislosti pro účely příspěvku na péči
- Střet zájmů v medicíně: stanovisko Světové lékařské asociace
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biochemické mechanismy účinků antidepresiv
- Hypofosfatázia – biochemické a klinické prejavy, molekulovo-genetická podstata
- Střet zájmů v medicíně: stanovisko Světové lékařské asociace
- Posttraumatická pannikulitida (dekubitus ?) prsu – klinický případ
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

