-
Medical journals
- Career
Postgenomová éra a co příjde po ní?
Authors: R. Brdička
Authors‘ workplace: Ústav hematologie a krevní transfuze, Praha 2
Published in: Čas. Lék. čes. 2010; 149: 315-318
Category: Topic
Overview
Odhadovat směřování jakéhokoliv vědního oboru je sice tématem velice přitažlivým, nicméně riskantním, a v dnešním pojetí něčím na způsob adrenalinového sportu. Zvláště posouzení rychlosti, kterou se biologické vědy budou pohybovat, může být ošidné, protože se stává stále méně závislou na lidských pozorovacích schopnostech, paměti a zručnosti, tedy na lidských mírách. Stáváme se stále více závislými na technickém pokroku, na tom, v čem nás předčí přístroje. I v genetice můžeme díky nim sledovat neustálé zrychlování, s jakou přibývají naše poznatky. Množí se proto i způsoby pohledu a po dlouhém období klasické genetiky založené na pozorováních fenotypových znaků jsme postupně dospěli až do období nejrůznějších „omics“. Za vrchol a předěl současné genetiky považujeme dokončení stanovení sekvence nukleotidů celého lidského genomu potažmo roky 2000–2003. Dnes máme již k dispozici genomové sekvence celé řady dalších organismů a věnujeme svou pozornost modifikacím, které, aniž by měnily sekvenci samu, dokážou dočasně měnit funkční vlastnosti genetických informací – potlačovat, anebo aktivovat jejich uvolňování. Další intenzivně studovanou oblastí jsou „mezigenové vztahy“, jejich sítivo, a zdá se, že nezbytným směrem našeho dalšího postupu bude návrat k fenotypu, ovšem na úrovni vyplývající ze současných znalostí funkce genetického aparátu. Tuto historickou cestu lze schematicky vyjádřit jako fenom → genom → fenom.
Klíčová slova:
genom, metylom, traskriptom, proteom, metabolom, fenom, epigenetika, remodelace chromatinu.Úvod
Ačkoliv se mi zdá, že genomová éra ještě neskončila a označení současné fáze vývoje biologických věd jako postgenomovou, považuji za značně přehnané, je hojně používáno. Je zřejmě reakcí na formálně ukončené sekvenování lidského genomu v rámci projektu organizace HUGO. Ve skutečnosti sice již známe téměř celou sekvenci lidské DNA získané vlastně z jakéhosi směsného vzorku, ale teprve nyní se pouštíme do analýz DNA jednotlivých osob a teprve se začínáme věnovat otázkám její sekvenční rozmanitosti. Přitom stále ještě musíme doplňovat naše poznatky o struktuře lidského genomu, významu jeho částí a zvláště pak o jeho funkci.
Genom je součástí genetického aparátu buňky a představuje sklad informací, včetně pokynů k jejich uvolňování a používání. A to nejen z hlediska jedné konkrétní buňky, ale i vzhledem k jejímu zapojení v rámci mnohobuněčného organismu. Všechny tyto informace jsou v zásadě přítomné ve všech buňkách tvořících makroorganismus a téměř se nemění během celého individuálního vývoje.
Genetický aparát je schopen tyto informace uchovávat, pokud možno v „nepoškozeném“ stavu, případně je opravovat, kopírovat a regulovat jejich uvolňování. Na těchto funkcích genetického aparátu se pochopitelně podílejí nejen molekuly nukleových kyselin, ale i celá řada dalších molekul, především bílkovinných. Pokud bychom je chtěli sestavit do jakýchsi funkčních jednotek, zjistíme, že jsou obvykle součástí určitých funkčních struktur, tvoří určité systémy. Existují mezi nimi vzájemné vztahy – sítivo vztahů. Jejich uspořádání je do jisté míry analogické uspořádání buněk do tkání a tkání do orgánů, v němž dochází k vzájemnému ovlivňování. Přiřadíme-li k němu i určitý cíl, pak k jeho dosažení vede obvykle větší počet cest. Jinými slovy o realizaci genetických informací rozhoduje mnoho faktorů. Nejen fakt, že příslušná informace musí být k dispozici a v uvolnitelné podobě, ale měla by být použitelná k dosažení cíle, ke kterému byla určena. Každá z těchto informací existuje obvykle v jedinečné podobě jako tzv. alela a tam, kde je genetická výbava zdvojená (čemuž tak u diploidních organismů ve většině případů je), má svého dvojníka, někdy identického, jindy poněkud odlišného. Schopnost dostát svému účelu je u různých alel různá, chybí-li úplně, nebo částečně, a je to zaviněno její strukturou, jde o tzv. patogenní alely. Někdy však i alely, jejichž původní struktura je „bezchybná“, svou funkci neplní, neboť v nich došlo ke změnám, které jsou „dočasného“ charakteru – jde o tzv. epigenetické změny, mezi které patří především metylace cytosinů.
Epigenetika
Problematikou změn, které ovlivňují funkci, aniž by měnily sekvenci nukleotidů dané oblasti genomu, se zabývá epigenetika, v současnosti intenzivně studovaný směr genomiky a z hlediska uplatnění metylací jsme se dopracovali k termínu metylom.
O funkční zdatnosti genomu, jeho některých částí, rozhoduje nejen momentální stav genetické paměti tvořené DNA, ale i bílkoviny, které jsou nosnou strukturou jejich dlouhých vláknitých molekul – histony. Vztah mezi molekulou DNA a ji nesoucími klubky histonů může být vztah velice těsný, charakteristický pro nepoužívanou oblast DNA, nebo naopak poměrně volný v místech, kde jsou genetické informace uvolňovány, opravovány nebo kopírovány. O těsnosti vztahu mezi DNA a histony rozhoduje jejich stav – mohou být na různých místech jejich molekul opět metylovány, ale i acetylovány a upravovány ještě mnoha dalšími způsoby. Rejstřík „úprav“ jak DNA a zvláště histonů je pestrý, stejně jako určování míst, ve kterých k nim dojde, může být alelně specifický a vlastně vytvářet zvláštní formu funkční heterozygnosti. Jako každý proces může být „nezávadný“, nebo vést k patologickému fenotypu. Známe řadu onemocnění, která mají svůj původ v epigenetických procesech, školním příkladem jsou syndrom Angelmanův a Prader-Williho, u nichž dochází k tzv. genetickému imprintingu. V případě Angelmanova syndromu (OMIM 105830)je u potomka epigeneticky inaktivována paternální alela (bez ohledu na stav alely maternální) a u syndromu Prader-Willi (OMIM 176270) je epigeneticky inaktivována alela maternální. U obou syndromů je postižena přibližně stejná oblast 15. chromozomu, přičemž alely pocházející od druhého rodiče bývají zbaveny funkčnosti strukturálně. Epigenetické modifikace genetického aparátu jsou v poslední době velice intenzivně studovány nejen jako příčiny onemocnění, ale i z hlediska jejich uplatnění během ontogeneze (embryogeneze) a možnosti jejich ovlivnění jako léčebných opatření. Klasickým příkladem může být postupná směna v aktivitě hemoglobinových řetězců, která bývá zakončena dominantní tvorbou „dospělého“ hemoglobinu s minoritními podíly hemoglobinu A2 a F. U některých poruch tvorby dospělého hemoglobinu může docházet k částečné kompenzaci zvýšením podílu fetálního hemoglobinu. Protože k poklesu jeho vzniku dochází fyziologicky na podkladě metylace genu pro řetězec gama, směřuje terapeutická snaha k jeho demetylaci. První léčebné pokusy využívaly 5-azacytidin, o jehož vstupu do molekuly DNA (při replikaci) se předpokládalo, že metylaci brání. Nedávné nálezy však demetylační podstatu účinku azacytidinu na DNA zpochybňují (1), ačkoliv jeho vliv na demetylaci histonů je zřejmý. Podobně byly částečně úspěšné pokusy o kontrolu epigenetickcýh změn u myelodysplastického syndromu (MDS) podáváním látek s předpokládaným demetylačním účinkem, např. inhibitorů blokujících aktivitu DNA metyltransferázy – DNMT (2). K blokování aktivity mRNA genů pro DNA metyltransferázu byly použity i siRNA (3). Za zvlášť „náchylné“ k metylaci jsou považovány tzv. CpG ostrůvky nepravidelně roztroušené v molekulách DNA – bývá jich málo v kódujících oblastech, zatímco nahloučené je najdeme v promotorových oblastech genů. V tomto smyslu se normální buňky liší od nádorových, v nichž metylace bývá více chaotická. Kvantitativní rozdíly, např. ve smyslu hypermetylace, ale i rozdíly kvalitativní z hlediska metylovaných pozic mezi normálními a nádorovými tkáněmi jsou v poslední době zjišťovány velice často: (4) – nádory prsu, (5) – mnohočetný myelom, (6) – karcinom tlustého střeva. Epigenetické modifikace DNA mohou zasahovat i do méně specifických, ale o to podstatnějších procesů – včetně její replikace (7).
Složitější než u DNA, kde připadá v úvahu hlavně metylace, případně těžko odlišitelná hydroxymetylace, je situace u histonů, kde metylovatelných míst (aminokyselin) či jinak modifikovatelných pozic je mnohem více. Metylovanými aminokyselinami bývají lysiny nebo argininy a postiženými histony H3 a H4. Dalšími modifikacemi mohou být fosforylace, ubiquitylace a sumoylace (OMIM 601912). Zatímco ubiquitylace začíná vazbou s ligázou (8) a směřuje k degradaci bílkovinné molekuly, sumoylace odstraňuje jen několik, většinou koncových, aminokyselin a má spíše regulační účinek. Modifikace histonů vede k tzv. remodelaci chromatinu a sémantické definici uvolněného nukleozomu – tzv. remozomu (9–11).
Funkční genomika
Jinou významnou sférou zájmu současného výzkumu jsou mezigenové vztahy – poznání regulací, signálních cest – tedy problematika, která charakterizovala klinickou biochemii a fyziologii po řadu desetiletí a kterou bychom dnes v době módy nejrůznějších „omiksů“ mohli označit názvem metabolomika. Dnes do ní významně přispívá i komerční sféra nabízející edukativně dobře využitelná schémata různých signálních drah – mezigenových vztahů (http: //www.sabiosciences.com/pathwaycentral.php). Snad nejdůkladněji prostudovaným systémem jsou geny ovládající buněčný cyklus, a přímo tedy související s regulací buněčného dělení. Některé původní představy vycházely ze značně zjednodušeného schématu a předpokládaly, že bude možné identifikovat jakýsi uzlový bod, jehož ovládnutím bude možné vyřešit i otázku nádorového bujení. Ukázalo se však, že takových míst, ve kterých se sítivo mezigenových vztahů sbíhá, je více a že buňka mívá většinou k dispozici náhradní řešení. Teprve tam, kde neexistuje žádná odbočka či paralelní dráha, může při zamezení nějakého kroku dojít k zásadním změnám. Také se stalo postupně zřejmějším, že jeden gen může vystupovat jako účastník více různých drah, mít více různých funkcí a úkolů. Na tomto místě se můžeme zmínit například o pRb a p53. Oba proteiny hrají důležité role v onkogenezi (12, 13). RB1 (OMIM 180200) je základním kamenem Knudsonovy teorie dvou zásahů, jinými slovy poznatku, že příčinou vzniku retinoblastomu je ztráta funkce obou alel, z nichž jedna může být jako nefunkční alelou zděděnou (14) a druhá získanou v podobě somatické mutace. Tumor protein p53 jako vykonavatel informace uložené v genu TP53 (OMIM 191170) je většinou zařazován do kategorie tumor supresorových genů. Je rozhodčím buněčného osudu z hlediska stavu jeho genomu. Rozhoduje o uplatnění opravných procesů, a to nejen v rámci centrálního genomu, ale zřejmě i mitochondriálního, který je omezen na systém BER (base excission repair) (15). Jeho úloha je velice mnohostranná, jak snadno zjistíme nahlédnutím do databáze založené McKusickem, dokonce natolik, že není téměř oblasti života buňky, do které by nezasahoval. I částečná ztráta tumor supresorové funkce (jedné z alel), vede ke vzniku tzv. Li-Frameni syndromu (OMIM 151623) s autozomálně dominantním typem dědičnosti. To naznačuje, že i kvantitativní hledisko p53 je pro jeho správnou funkci důležité, a zvyšuje tak nároky na adekvátnost případné terapie.
Image 1. Schéma cest vedoucích k apoptóze – programované buněčné smrti: Genom metylom transkriptom proteom metabolom Apoptóza je důležitý proces – konečné řešení mnoha situací i v rámci ontogenetických procesů. Často je zdůrazňována úloha p53, produkt genu TP53 – i ten je součástí mnoha různých regulačních procesů. Obrázek byl uveřejněn se svolením společnosti BioLegend (originál na adrese: http://www.biolegend.com/pop_pathway.php?id=2) 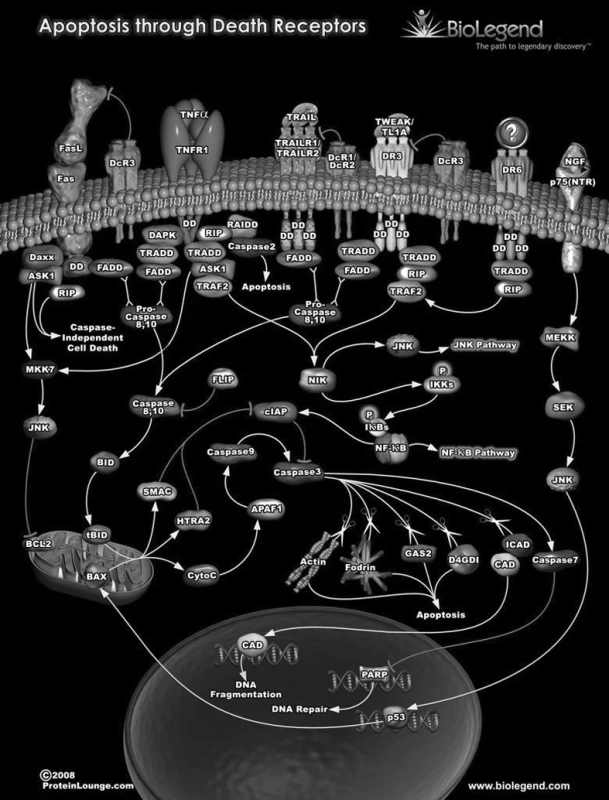
Výhledy
Jestliže na počátku výzkumu dědičnosti jsme nezbytně soustředili svou pozornost na fenotyp a dnes tuto fázi vývoje můžeme označit jako Mendelovskou genetiku a teprve postupně jsme v době druhé světové války pronikli k nukleovým kyselinám jmenovitě k DNA jako nositelce genetických informací, kterou dnes již považuje za „dobře“ známou a její funkci pro nás srozumitelnou, pak dáváme najevo pro člověka typický nedostatek skromnosti. Ten se ostatně mohl skrývat i za Sokratovým prohlášením „Vím, že nic nevím“. Dnes již téměř úplným poznáním nukleotidové sekvence člověka jsme si tuto fázi výzkumu dědičnosti označili jako genomovou a současnost jako postgenomovou. Značného pokroku jsme dosáhli i při sledování cest, které vedou k realizaci genetických informací a vytvořili označení oborů jako transkriptomika, proteomika a spoustu dalších, kterými jsme se sice zabývali již dříve, ale neměli jsme pro ně tyto módní názvy. Pokud bychom sledovali míru rozmanitosti vyskytující se v daných oblastech, zjistili bychom, že nejvyšší se týká fenotypu a genialita Mendelova spočívala především v tom, že ji redukoval na pozorování několika málo jednoduše dědičných znaků. Variabilita genomu je nepoměrně menší, alespoň soudě podle našich současných možností ji zkoumat, a směrem k transkriptomu a proteomu opět stoupá. Kromě zárodečného genomu, který je poměrně stabilní v čase – v principu předáváme našim potomkům jen to, co jsme sami dostali od našich rodičů, v buňkách našeho těla dochází k několikanásobnému zmnožení informací tím, že jsou přepisovány a k dalšímu zpracování různě upravovány. Takto vzniklá množina na úrovni RNA informačních produktů je dále použita k proteosyntéze, při níž a po níž dochází k dalším úpravám nyní již informací v podobě bílkovin. Tyto procesy zvyšující rozmanitost informačních molekul jsou již zřetelně dynamické, tj., mění se v čase. To je také důvodem, proč v našich výzkumech směřujeme k jednotlivým buňkám a k určitým fázím života, k situacím, v nichž se ta která buňka nachází. Současné technologie a metody nám to již začínají umožňovat. Něco podobného platí i pro celé naše tělo – o našem fenotypu, k němuž se nezbytně budeme vracet. Náš fenotyp by nevznikl bez našich zárodečných genetických informací, a jsou tedy podmínkou sine qua non, ale jejich promítnutí do fenotypu podléhá mnoha dalším, řekněme vnějším vlivům. Jistě všem, se kterým se náš organismus setkal, a to již od počátku svého vzniku v podobě zygoty. První vnější vlivy pocházely od mateřského organismu, jeho vnitřního prostředí sice upravovaného placentou, ale i od prostředí, ve kterém se mateřský organismus nacházel. Po narození se musel náš organismus vyrovnávat s vlivy prostředí již sám, a jaké stopy na něm tyto vlivy zanechaly, je nejzřetelnější v případě různých onemocnění, především úrazů. Všechny tyto vlivy absorboval náš fenotyp, reagoval na ně a nechal se jimi formovat a zcela jistě mnoho z nich zanechalo v něm trvalou, někdy velice hlubokou stopu. Některé obory se této problematice cíleně věnují, např. nutrigenomika (16–18), pro kterou by se hodilo heslo: „ Jsme to, co jíme“. Někteří z nás se možná pamatují na rybí vůni masa vepřů krmených rybí moučkou. Dnes ovšem k odhalení původu nebo přísad naší potravy používáme sofistikovanější metody a můžeme význam jednotlivých složek hodnotit již na molekulární úrovni (19). Analogicky pracuje eko - a genotoxikologie zkoumající vlivy prostředí na náš genom (20, 21). Nesmíme však zapomínat na cílené zasahování, které se někdy podobá vyhánění čerta ďáblem, na problematiku patřící do sféry farmakogenetiky (22), a zvláště pak na stále se zvyšující a hromadící se vlivy stresu, o kterém podobně jako o některých infekcích, zvláště virových (horizontální genetika – HGT, 23) začínáme připouštět, že jejich důsledky se mohou přenášet i do dalších generací (24).
K tomu, abychom jejich význam zhodnotili, budeme potřebovat dlouhodobé monitorování, pro začátek zřejmě těch nejzákladnějších životních funkcí – tak jako to provádíme na jednotkách intenzivní péče (25) a během operačních zákroků. I v tomto směru vkládáme naděje do technického pokroku v podobě miniaturizace snímacích a záznamových zařízení, zvětšování počtu zaznamenatelných veličin a možnosti dálkového a bezdrátového přenosu informací (26). Jakýsi předobraz takových zařízení máme již dnes v mobilních telefonech (27), které začínají být využívány i pro medicínské účely, a kardiostimulátorech, které kontrolují a ovládají srdeční rytmus. Na této cestě bude významnou roli zaujímat oblast bioinformatiky, která dnes u nás trpí vážným nedostatkem kádrů.
Můžeme si domyslet, že takovými monitorovacími přístroji by mohly být podkožní čipy, které by nesloužily pouze k identifikaci, jako tomu je u domácích zvířat, ale právě k výzkumu vnějších vlivů formujících náš fenotyp. A není vyloučené, že k takovému přístupu dospějeme po překonání předsudků a obav o své soukromí, podobně jako ti, kteří si dnes dobrovolně a veřejně nechávají analyzovat svůj genom. Také až zvládneme pravou „ochranu soukromí“, což zatím řešíme omezováním dostupnosti informací, namísto toho, abychom se především zaměřili proti jejich zneužití.
Zkratky
- BER – base excission repair
- DNA – deoxyribonucleic acid
- DNMT – DNA metyltransferáza
- HGT – horizontal gene transfer
- HUGO – Human Genome Organisation
Text článku vychází z přednášky „Lidský genom – a co dál“ přednesené postgraduálním studentům na základě pobídky kolegy Petra Goetze a vznikl s podporou grantu IGA 9804.
Adresa pro korespondenci:
prof. MUDr. Radim Brdička, DrSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1, 128 20 Praha 2
e-mail: molgen@uhkt.cz
Sources
1. Mabaera R, et al. Neither DNA hypomethylation nor changes in the kinetics of erythroid differentiation explain 5-azacytidine’s ability to induce human fetal hemoglobin. Blood 2008; 111 : 411–420.
2. Claus R, et al. Targets of epigenetic therapy – Gene reactivation as a novel approach in MDS treatment. Cancer Treatment Reviews 2007; 33(Suppl 1): S47–S52.
3. Yamanaka K, et al. Gene silencing of DNA methyltransferases by RNA interference in bovine fibroblast cells. Journal of Reproduction and Development 2010; 56 : 60–67.
4. Flanagan JM, et al. DNA Methylome of Familial Breast Cancer Identifies Distinct Profiles Defined by Mutation Status. American Journal of Human Genetics 2010; 86 : 420–433.
5. Smith EM, et al. The potential role of epigenetic therapy in multiple myeloma 2010. British Journal of Haematology 2010; 148 : 702–713.
6. Vlaicu SI, et al. Epigenetic modifications induced by RGC-32 in colon cancer. Experimental and Molecular Pathollogy 2010; 88 : 67–76.
7. Martín V, et al. Epigenetic regulation of the non-canonical Wnt pathway in acute myeloid leukemia. Cancer Science 2010; 101 : 425–432.
8. An JY, et al. UBR2 mediates transcriptional silencing during spermatogenesis via histone ubiquitination. PNAS 2010; 107 : 1912–1917.
9. Chikhirzhina GI, et al. Transcription factors of the nuclear factor 1 (NF1) family. Role in chromatin remodelation. Molekuliarnaia biologiia 2008; 42 : 388–404.
10. Shukla MS, et al. RSC generated non-mobilized particles with approximately 180 bp DNA loosely associated with the histone octamer. PNAS 2010; 107 : 1936–1941.
11. Lorch Y, et al. Mechanism of chromatin remodeling. PNAS 2010; 107 : 3458–3462.
12. Toguchida J, Nakayama T. Molecular genetics of sarcomas: applications to diagnoses and therapy. Cancer Science 2009; 100 : 1573–1580.
13. Arici DS, et al. Expression of retinoblastoma and cyclin D1 in gastric carcinoma. Neoplasma 2009; 56 : 63–67.
14. Mohammed AM, et al. Constitutional retinoblastoma gene deletion in Egyptian patients. World Journal of Pediatrics 2009; 5 : 222–225.
15. Chen D, et al. The p53 pathway promotes efficient mitochondrial DNA base excision repair in colorectal cancer cells. Cancer Research 2006; 66 : 3485–3494.
16. Gorduza EV, et al. Nutrigenomics in postgenomic era. Revista medico-chirurgicala. Soc Med Nat I 2008; 112 : 152–164.
17. Ghosh D. Personalised food: How personal is it? Genes and Nutrition 2010; 5 : 51–53.
18. de Vrieze J, et al. Nutrition Tailored to the Individual? Not Just Yet – Realigning Nutrigenomic Science with Contemporary Society. Journal of Nutrigenetics and Nutrigenomics 2010; 2 : 184–188.
19. Dragsted LO. Biomarkers of meat intake and the application of nutrigenomics. Meat Science 2010; 84 : 301–307.
20. Singh N, et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials 2009; 30 : 3891–3914.
21. Topinka J, et al. Biomarkers of exposure to tobacco smoke and environmental pollutants in mothers and their transplacental transfer to the foetus. Part I: bulky DNA adducts. Mutat Res 2009; 669 : 13–19.
22. Tarazona JV, et al. Targeting the enviromental risk assesment of pharmaceuticals: facts and fantasies. Integr Environ Assess Manag 2009; 6.
23. Arber W. Systemic aspects of biological evolution. Journal of Biotechnology 2009; 144 : 242–244.
24. Matthews SG, Phillips DIW. Minireview: Transgenerational inheritence of the stres response: A new frontier in stress research. Endocrinology 2010; 151 : 7–13.
25. Arbour C a Gélinas C. Are vital signs valid indictors for the assesment of pain in postoperative cardiac surgery ICU adults? Intensive and Critical Care Nursing 2010; 26 : 83–90.
26. Bender JE, et al. Nonivasive monitoring of tissue hemoglobin using UV-VIS diffuse reflectance. Optics Express 2010; 17 : 23396–23409.
27. Busis. Mobile phones to improve the practice of neurology. Neurologic Clinic 2010; 28 : 395–410.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Postgenomová éra a co příjde po ní?
- Žírné buňky – nový pohled na staré známé
- Výskyt etanolu a dalších drog u smrtelných dopravních nehod v České republice v roce 2008
- Biliární ileus – diagnostická i terapeutická výzva
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
- Výskyt metabolického syndromu u žen se syndromem polycystických ovarií
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Biliární ileus – diagnostická i terapeutická výzva
- Žírné buňky – nový pohled na staré známé
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
- Výskyt metabolického syndromu u žen se syndromem polycystických ovarií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

