-
Medical journals
- Career
Parenterálna nutrícia pred resekčným výkonom na hornom gastrointestinálnom trakte
Authors: L. Lakyová; J. Belák; J. Vajó; M. Kudláč; J. Radoňak
Authors‘ workplace: II. chirurgická klinika LF UPJŠ, Košice
Published in: Čas. Lék. čes. 2008; 147: 222-227
Category: Original Article
Overview
Východisko.
Cieľom retrospektívnej analýzy je zhodnotenie efektu predoperačnej parenterálnej prípravy u malnutričného pacienta na zníženie rizika komplikácií po resekčnom výkone na hornom gastrointestinálnom trakte.Metódy a výsledky.
Do súboru bolo zaradených 57 pacientov s karcinómom pažeráka alebo žalúdka. Pacienti boli rozdelení do troch skupín: I. skupina: resekabilný tumor, parenterálna príprava, malnutrícia, II. skupina: neresekabilný tumor, parenterálna príprava, malnutrícia, III. skupina: resekabilný tumor, bez parenterálnej prípravy, bez malnutrície. Po 7 dňovej aplikácii aminokyselinových prípravkov a vakov All‑In-One sa v skupine malnutričných pacientov zaznamenal štatisticky významný vzostup hodnôt bielkovín (I.: 62 ± 3,8→70 ± 1,75, II.: 59,7 ± 3,2→69,2 ± 1,2) a albumínu (I.: 32,6 ± 1,95→38,0 ± 1,09, II.: 31,1 ± 1,2→37,5 ± 0,9) pri p < 0,001. Komplikácie spojené so zavedením centrálneho venózneho katétra klesali v následovnom poradí: upchatie (17,6 %), lokálny erytém (7,5 %), pneumotorax (5 %), flebotrombóza (5 %), hemotorax (0,4 %). Pooperačné komplikácie v skupine I. až III. nezaznamenali na hladine p < 0,05 štatistickú významnosť. Najvyššia incidencia dehiscencií rán, anastomóz a sepsy bola zaznamenaná v skupine I., najnižšia v skupine III. Brochopneumónia mala najvyšší výskyt v II. skupine, najnižší v III. skupine.Závery.
Predoperačná parenterálna nutrícia ako prevencia vzniku komplikácií po resekčnom výkone na žalúdku a pažeráku je vhodná u stredne a ťažko malnutričných pacientov aj na úkor vyšších ekonomických nákladov a predĺženej doby hospitalizácie vzhľadom na porovnateľné percento pooperačných komplikácií v skupine dobre živených pacientov s malnutričnými, pričom nutričná suplementácia by mala trvať aspoň sedem dní.Kľúčové slová:
parenterálna výživa, predoperačná príprava, malnutrícia, karcinóm horného gastrointestinálneho traktu.Pacienti s nádorovým ochorením gastrointestinálneho traktu (GIT), ktorí prichádzajú do nemocnice za účelom chirurgickej liečby sú často malnutriční už pri príjme. Až 79–85 % pacientov s GIT malignitou trpia podvýživou (1, 2). Malnutrícia je definovaná ako strata 10 % hmotnosti tela za posledný polrok, BMI (body mass index) menej ako 18,5 a hladina sérového albumínu je nižšia ako 30 g/l. V klinickom obraze pacienta dominuje znížená svalová a dychová sila, spomalené hojenie rán a poruchy imunitného systému. Typickým príznakom je tzv. nádorový marazmus, kedy utilizáciou tukov a šetrením proteínov pacient javí známky kachexie, ale je bez edémov. Neskôr marazmus vyústi až u polovice pacientov ešte pred stanovením diagnózy do nádorovej kachexie s prítomnosťou futilných cyklov, pri ktorých sa glukóza a laktát recykluje za vzniku energetických strát (3). Rozpad rán a anastomóz v pooperačnom období je dôsledkom spomaleného hojenia rán a zníženej imunity u tohto pacienta.
Žiaľ aj v dnešnej dobe sa v rámci manažmentu pacienta kladie hlavný dôraz na diagnostiku, chirurgickú liečbu, infúznu liečbu v pooperačnom období, prípadne objednanie pacienta na adjuvantnú terapiu, pokiaľ je indikovaná onkológom a následnú skorú emisiu pacienta z nemocnice. V chirurgii gastrointestinálneho traktu sa často spolieha iba na samotnú techniku resekcie a šitia anastomóz. V pooperačnom období sa preto často vyskytujú komplikácie ako následok zanedbania nutričnej a imunitnej podpory.
Mnohé klinické štúdie sa zaoberajú možným ovplyvnením malnutričného stavu v predoperačnom období parenterálnou alebo enterálnou cestou. V praxi ostáva však naďalej preferovaný skorý chirurgický zákrok bez adekvátnej predoperačnej nutričnej suplementácie vzhľadom na skeptický názor o jej pozitívnom účinku pri jej ďalších predpokladaných negatívach, ako je finančne náročná liečba a predĺženie hospitalizácie pacienta v nemocnici. Viacero zahraničných štatistík potvrdzuje nízke percento predoperačnej prípravy pacienta pred elektívnym chirurgickým zákrokom (4, 5). Na druhej strane je potrebné zvážiť, či neskoršie náklady na liečbu pacienta pooperačných komplikácií u malnutričných pacientov neprevýšia náklady na preventívnu liečbu.
Súbor pacientov a použité metódy
V priebehu troch rokov 2004–2006 bolo na II. chirurgickej klinike LF UPJŠ v Košiciach hospitalizovaných 84 pacientov s malignitou horného GITu. Do sledovaného súboru bolo zaradených 57 pacientov, z toho 33 pacientov s diagnózou tumoru pažeráka a 24 pacientov s nádorovým postihnutím žalúdka, 16 pacientov s malígnym ochorením pažeráka podstúpilo totálnu resekciu pažeráka s následnou ezofagogastroanastomózou a u 17-tich pacientov s neresekabilným nálezom sa aplikovala gastrostómia podľa Witzela alebo Kadera. Z 24-tich pacientov s diagnózou tumoru žalúdka bolo resekabilných 16, tí podstúpili totálnu alebo subtotálnu gastrektómiu, pričom u zvyšných 9-tich pacientov sa vykonala iba paliatívna gastroenteroanastomóza a enteroenteroanastomóza alebo vyživovacia jejunostómia vzhľadom na pokročilý nález. Skupina pacientov s exploratívnou laparotómiou (N = 19) resp. implantovanou Härringovou protézou (N = 8) s alebo bez predoperačnej prípravy bola vyradená zo štúdie vzhľadom na nemožnosť porovnania pooperačných komplikácií so sledovaným súborom v zmysle dehiscencie anastomózy, či vyvedenej gastro alebo jejunostómie, ako aj z dôvodu možného skreslenia sledovaných parametrov pri možnosti skoršej perorálnej alimentácie v pooperačnom období u tohto súboru. Sledovanú skupinu pacientov bez parenterálnej prípravy s paliatívnym výkonom na GIT-e sme nezaradili do štatistického vyhodnotenia pre nízky počet (N = 4).
Pacienti boli zaradení do parenterálnej predoperačnej prípravy vzhľadom na to, že v pooperačnom období neprijímali perorálne stravu dlhšie ako 5 dní a v rámci predoperačného obdobia bola perorálna alimentácia kvôli sprievodným komplikáciám ochorenia často limitovaná. Každý z týchto pacientov musel zároveň spĺňať kritéria malnutričného pacienta, ktoré boli vyhodnocované podľa PG–SGA skóre (Patient-generated-subjective global Assessment Scoring) určené špeciálne na vyhodnocovanie nutričného stavu u onkologických pacientov (6, 7). Pacienti podľa PG – SGA bodovacieho systému boli zaradení do A, B a C skupiny, pričom skupina stredne a ťažko malnutričná (B, C) bola indikovaná na parenterálnu nutríciu. Kritéria pre výber pacienta do skupiny pre parenterálnu predoperačnú nutríciu sú zhrnuté na obrázku 1.
Image 1. Kritéria pre výber pacienta do skupiny pre parenterálnu predoperačnú prípravu 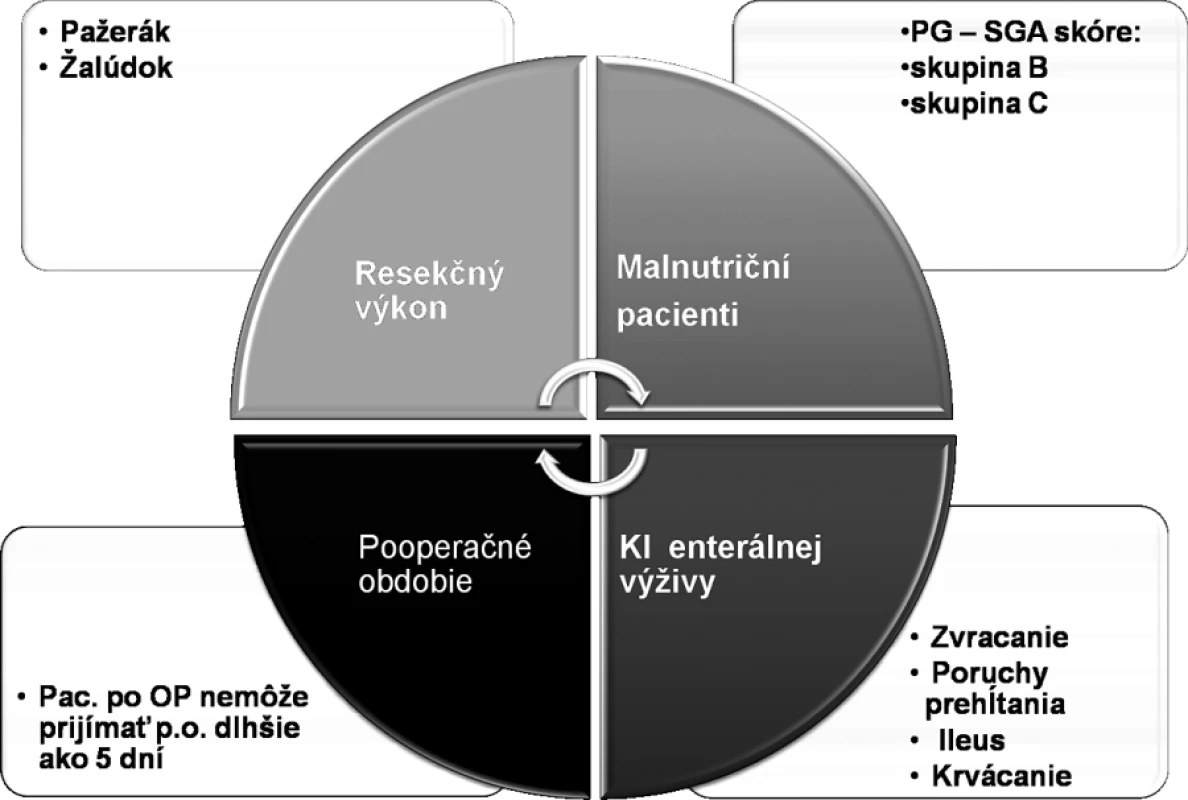
Pacienti zaradení do štúdie boli rozdelení do troch skupín podľa kritéria resekability a použitia predoperačnej parenterálnej prípravy. Do prvej skupiny boli zaradení pacienti s predoperačnou prípravou, u ktorých bol operačný nález resekabilný, druhú skupinu pacientov tvorili pacienti pripravovaní parenterálnou výživou, no vzhľadom na operačný nález bol vykonaný iba paliatívny zákrok, a do tretej skupiny boli zaradení pacienti, ktorí nevyžadovali vzhľadom na dobrý nutričný stav parenterálnu prípravu a podstúpili radikálny výkon. Sledované parametre sú znázornené v tabuľke 1.
Energetická a aminokyselinová podpora bola hradená prípravkami „All in One“ (Oliclinomel N6, N7, Baxter) ako aj aminokyselinovými prípravkami typu (Aminoplasmal, AS hepa a Nephrotect, Baxter), a to popri peroorálnemu príjmu pacienta.
Parenterálna nutrícia bola aplikovaná cez subklaviálny set Cava fix Duo (Braun) v priemere sedem dní v rámci predoperačnej prípravy, 10 až 12 dní po resekčnom zákroku a 5 dní po paliatívnom výkone. Množstvo podávaných prípravkov bolo presne sledované a individuálne dávkované u každého pacienta podľa Harris Benediktového vzorca pre výpočet bazálneho metabolizmu upraveného faktormi zvyšujúcimi základnú energetickú potrebu nášho súboru pacientov.
Muži: BMR = 66 + (13,7 × m) + (5 × h) – (6,8 × a),
Ženy: BMR = 655 + (9,6 × m) + (1,8 × h) – (4,7 × a),
kde je m – telesná hmotnosť v kg, h – telesná výška v cm,
a – vek v rokoch
Každému z pacientov, ktorý podstúpil radikálny výkon, bola v peroperačnom období na konci výkonu aplikovaná punkčná jejunostómia za účelom kombinácie enterálnej výživy s parenterálnou až do obdobia perorálneho príjmu po operácii. Do jejunostómie boli aplikované enterálne prípravky Nutrison – prášok a Peptisorb – roztok (Nutricia). Pacienti či už po paliatívnom alebo resekčnom výkone aj v rámci pooperačného obdobia napriek rozličnému postupu výživy (parenterálna nutrícia verzus parenterálna kombinovaná s enterálnou) mali kalorický ako aj aminokyselinový príjem kvantitatívne porovnateľný. Podiel enterálnej a parenterálnej výživy u I. a III. skupiny sa každým dňom upravoval podľa individuálnej tolerancie pacienta zo strany gastrointestinálneho traktu a výskytu hnačiek po nej. V priemere od 1. po 10. pooperačný deň bola dávka enterálnej formuly zvyšovaná z 20 % až na 70 % podiel celkového kalorického príjmu pacienta.
Monitoring pacienta spočíval vo vstupnom vyšetrení KO: Leu, Ery, Tr, Htc a dennom sledovaní VP: celkové bielkoviny, albumín, Na+, K+, Cl-, CRP. Pacientom dostávajúcim parenterálnu prípravu vo vakoch „All-in-One“ bol denne kontrolovaný glykemický profil vzhľadom na všeobecne známu skutočnosť výskytu hyperglykémie po aplikácii týchto prípravkov. Iniciálne vypočítaná dávka inzulínového krytia bola následne individuálne upravovaná podľa parametrov glykémie.
Okrem laboratórnych parametrov boli sledované komplikácie v pooperačnom období (dehiscencia rán, anastomóz, bronchopneumónia, sepsa a mortalita), komplikácie spojených so zavedením CVK (kanylová sepsa, flebotrombóza, lokálny erytém, upchatie CVK, pneumotorax, hemotorax). Pri štatistickom vyhodnotení výsledkov bol v jednotlivých skupinách vypočítaný priemer a smerodajná odchýlka. Štatistická významnosť porovnaním jednotlivých skupín bola vyhodnotená pomocou programu Arcus Statistical software (Biomedical Version 1.1.) Pri vyhodnotení výsledkov bol použitý χ2 test.
Výsledky
Použitím parenterálnych prípravkov sa dosiahli v skupine malnutričných pacientov (skupina PG-SGA B, C) po 7 dňovej aplikácii zvýšenie laboratórnych parametrov na hodnoty takmer porovnateľné s parametrami u pacientov zaradených do A skupiny podľa PG-SGA (tab. 1). Pri štatistickom spracovaní porovnaním vstupných hodnôt bielkovín a albumínu po sedemdňovej aplikácii PEV použitím χ2 testu sa zaznamenal na hladine 0,05 štatisticky významný rozdiel (P < 0,001) v skupine pacientov s predoperačnou prípravou PEV s resekabilným aj neresekabilným nálezom.
Table 1. Sledované parametre u pacientov v jednotlivých skupinách 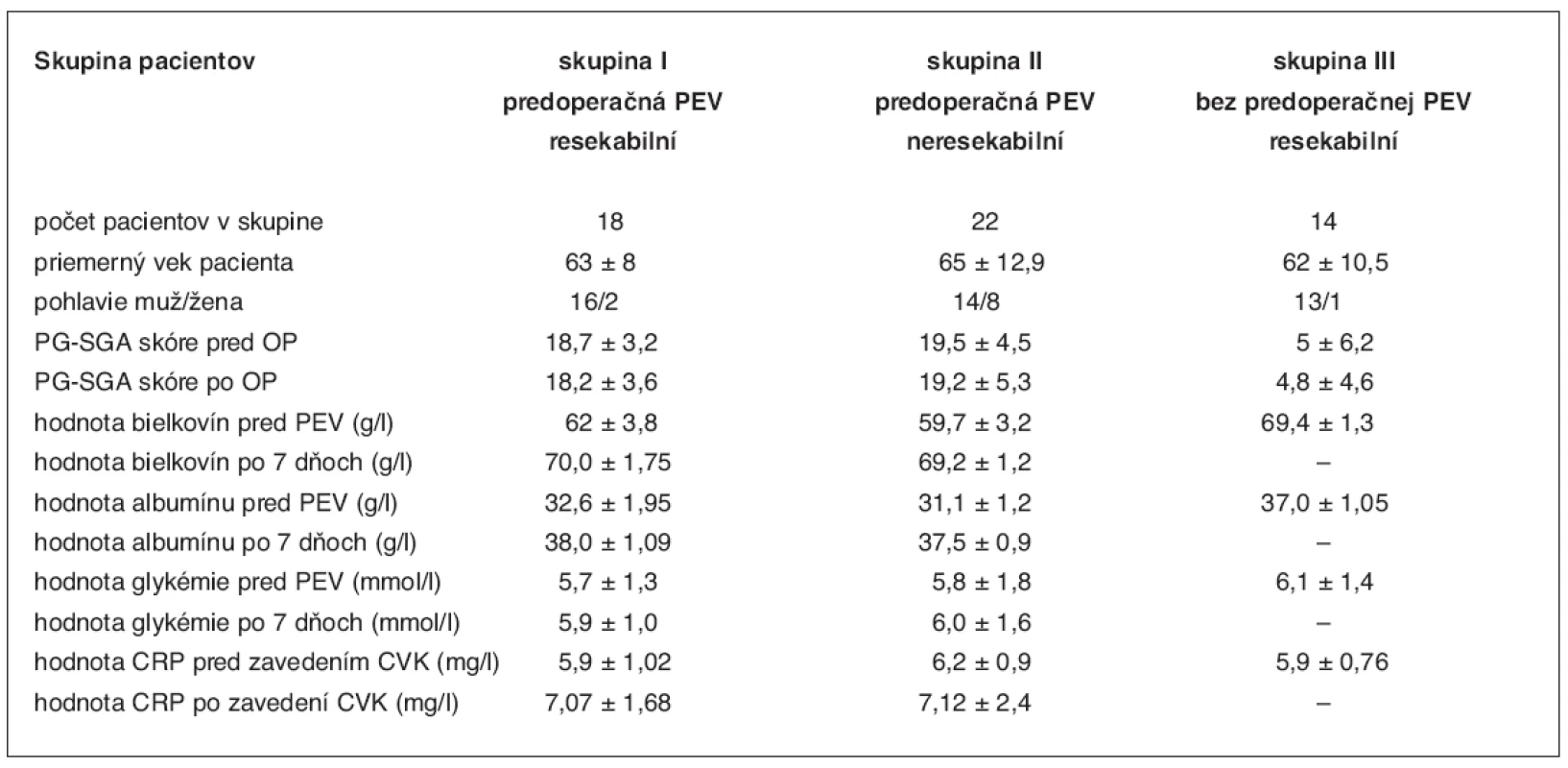
Hodnoty v tabuľke sú uvedené ako priemer ± smerodajná odchýlka – ( x ± SD).
Najčastejšou komplikáciou súvisiacou so zavedením centrálneho venózneho katétra (CVK) bolo upchatie kanyly, no je nutné zdôrazniť, že u žiadneho zo sledovaných pacientov v dôsledku technických komplikácií nebola prerušená PEV po dobu, kedy boli schopní pacientov prijímať stravu p.o. V prípade upchatia kanyly pokiaľ sa lúmen nespriechodnil podaním pretlakového bolusu fyziologického roztoku, bola kanylovaná centrálna véna na kontralaterálnej strane. Rovnaký postup bol použitý aj v štyroch prípadoch vytrhnutia CVK samotným pacientom. V dvoch prípadoch flebotrombózy napriek štandardne používanej antikoaguačnej dávke nízkomolekulárnych heparínov, bola kanyla zrušená. V oboch prípadoch sa komplikácia vyskytla v období, kedy pacienti prechádzali na perorálnu výživu, preto to sledované výsledky neovplyvnilo. Kanylová sepsa u štyroch pacientov potvrdená zo špičky katétra odoslaného na kultiváciu pre niekoľkodňové febrility nejasného pôvodu sa objavila v priemere na 25. deň. V tomto prípade sa PEV podávala periférnou linkou a prípravky určené do centrálnej žily boli nahradené prípravkami vhodnými aj pre periférnu cestu. Vzniknutý pneumotorax (2 prípady) a hemotorax (1 prípad) po kanylácii vena subclavia sa riešil drenážou hrudníka. Percentuálny podiel komplikácií v sledovanom súbore 40-tich kanylovaných pacientov je vyjadrený prehľadne na obrázku 2.
Image 2. Komplikácie spojené so zavedením CVK 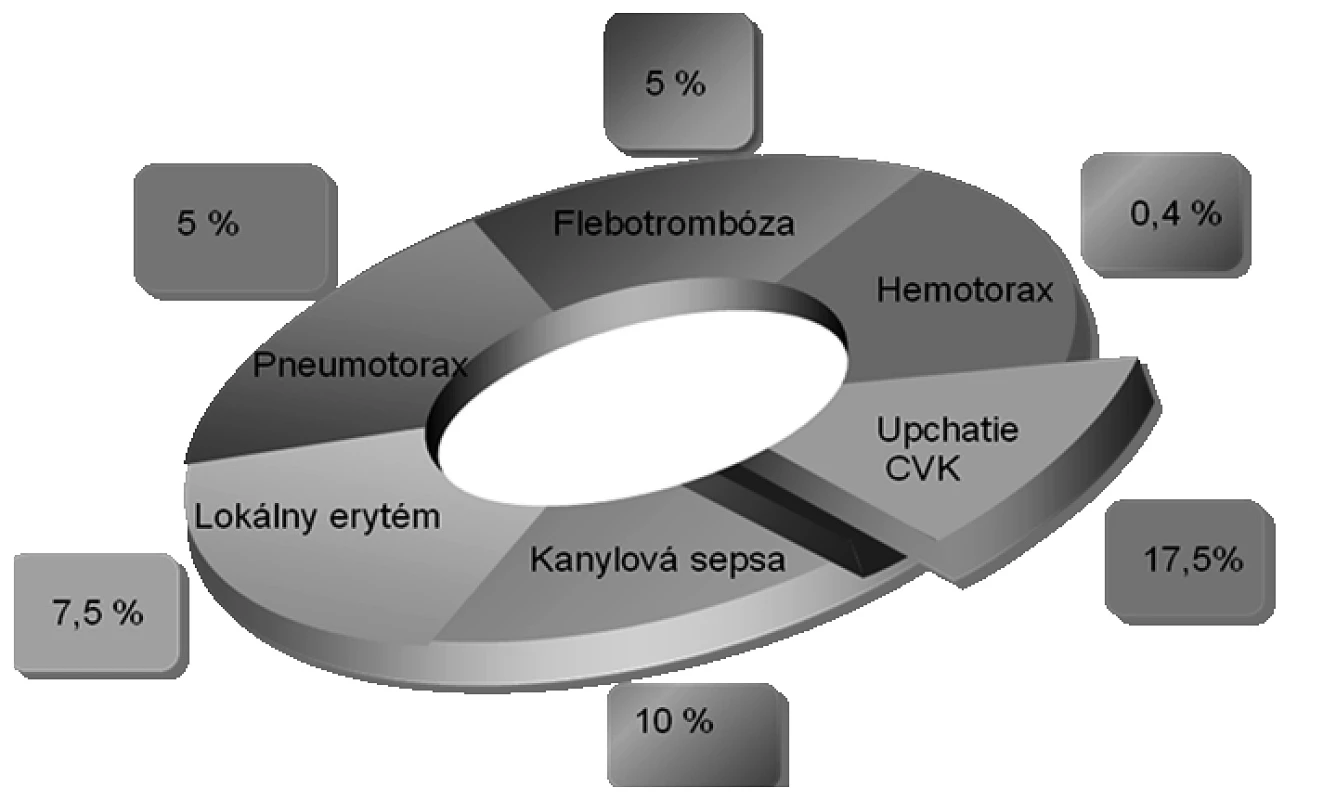
U pacientov dostávajúcich v rámci predoperačného obdobia vaky „All-In-One“ sa zaznamenali výkyvy glykemického profilu v zmysle zvýšenej hodnoty a to s maximom v druhý až tretí deň aplikácie prípravku. Korelačný koeficient medzi prídavkom inzulínu k iniciálne vypočítanej dávke podľa obsahu glukózy v prípravku verzus hodnota glykémie boli podobné u všetkých pacientov, pričom v priemere na piaty až šiesty deň sa dosiahla podobná východisková hodnota glykémie ako pred podávaním PEV (tab. 1). Ani v jednom prípade sme sa nestretli s inzulínovou rezistenciou.
Denne sledovaná hladina C-reaktívneho proteínu nebola štatisticky významne elevovaná v skupine I. a II. v súvislosti so zavedením CVK ani s podávaním PEV pri hladine 0,05 (tab. 1) v rámci predoperačného obdobia.
V grafe 1 je porovnaný percentuálny výskyt pooperačných komplikácií u troch skupín pacientov. Štatistické výsledky týkajúce sa pooperačných komplikácií medzi skupinami I.–III. nepreukázali pri hladine 0,05 podľa χ2 testu štatistickú významnosť.
Graph 1. Komplikácie v pooperačnom období percentuálne vyjadrené v priebehu 1 mesiaca po OP 
Dĺžka hospitalizácie v pooperačnom období bola medzi I. a III. skupinou pacientov bola v skupine s PEV predĺžená v priemere o dva dni, II. skupina vzhľadom na paliatívny výkon a skoršiu realimentáciu bola v priemere o 6 dní prepustená z nemocnice skôr. Celková doba hospitalizácie u I. skupiny pacientov bola teda predĺžená v priemere o deväť dní v rámci jej predoperačnej prípravy ako aj miernej predĺženej pooperačnej doby vzhľadom na nepatrný vyšší výskyt komplikácií v pooperačnom období. Spolu s predĺženou dobou hospitalizácie sa zvýšili aj náklady na liečbu u tejto skupiny pacientov (viď tab. 2). Vzhľadom na to, že naša klinika štandardne pripravuje všetkých malnutričných pacientov pred veľkým resekčným výkonom parenterálnou cestou, nebolo možné pooperačné komplikácie porovnať so skupinou malnutričných pacientov bez parenterálnej prípravy.
Table 2. Porovnanie sledovaných parametrov medzi skupinami I, II, III 
Diskusia
História parenterálnej výživy siaha do obdobia objavenia krvného obehu Williamom Harveyom v roku 1616. Prvé pokusy o jej použitie sa datujú do 17. storočia, kedy Felli a Wren aplikovali psom do krvného obehu pomocou husacieho brka a prasačieho mechúra ópium, víno a pivo (8). Odvtedy došlo vo vývoji parenterálnej výživy k veľkému pokroku, na dnešnom trhu sú prítomné priemyselne vyrobené bezpečné roztoky cukrov, bielkovín a tukov, pričom bola zvládnutá aj technika zavedenia centrálneho venózneho katétra.
Parenterálna výživa po operácii vzhľadom na nemožnosť príjmu stravy p.o. je v dnešnej dobe samozrejmosťou. Otázkou ostáva jej použitie v rámci predoperačného obdobia u pacientov pripravovaných na veľký resekčný výkon. Množstvo štúdií dokázalo vo fáze predoperačej prípravy pozitívnejší vplyv enterálnej výživy v porovnaní s parenterálnou či už z hľadiska fyziologického, alebo ekonomického. V prípade, kedy pacient má poruchy prehĺtania, zvracia alebo má príznaky ileózneho stavu, je nutné príjem p.o. nahradiť parenterálnou výživou.
Pri zadaní kľúčových slov „parenterálna výživa, predoperačná príprava, onkologická chirurgia“ bolo v databáze PubMed za posledných 10 rokov (1997–2006) publikovaných 40 štúdií, podľa ktorých sme vyhodnotili skúsenosti zahraničných autorov s predoperačnou parenterálnou prípravou (graf 2). Podľa výsledkov uverejnených článkov boli štúdie rozdelené podľa pozitívnych, či negatívnych skúseností autorov s použitím parenterálnej výživy. Pri vyhľadávaní publikácií sme sa stretli s veľkým nepomerom počtu štúdií, ktoré sa venovali predoperačnej a pooperačnej akcelerovanej starostlivosti o pacienta s resekčným výkonom na GIT-e. Len málo vedeckých prác sa zaoberá s predoperačnou PEV prípravou u pacientov s obmedzenou možnosťou enterálneho prístupu živín. Tento výsledok potvrdzuje prieskum, ktorý vyhodnocoval mieru používania predoperačnej parenterálnej prípravy, pričom porovnaním rokov 90-tych s rokmi 2001–2002 sa zistil až 30% pokles (4). Podobné výsledky popisuje aj iní autori (5). Za najpodstatnejší dôvod tohto poklesu považuje Schwenk a Lanoir finančnú náročnosť a predĺženú dobu hospitalizácie v nemocnici v súvislosti s jej podávaním. Najväčší počet vedeckých prác sa zaoberal tematikou porovnávania výhod a nevýhod enterálnej v porovnaní s parenterálnou výživou v pooperačnom období. Výsledky jednoznačne hovoria v prospech enterálnej výživy (9–12). Podobné skúsenosti máme aj na našom pracovisku (13). Pozitívne skúsenosti s predoperačnou PEV pred výkonom na hornom GIT-e publikovali viaceré štúdie (14–16). Uvádzajú 10 až 20% redukciu pooperačných komplikácií (14). Použitím predoperačnej PEV sa zaznamenal benefit aj v kolorektálnej chirurgii (17–19). V našej štúdii sa pooperačné komplikácie vyskytovali vo väčšej miere u resekabilných pacientov s PEV prípravou ako bez PEV prípravy, no rozdiel nebol štatisticky signifikantný. Autori tento fakt pripisujú pokročilejšiemu nálezu, malnutrícii a toho aj vyplývajúcemu vyššiemu riziku vzniku pooperačných komplikácií v porovnaní s dobre živenými pacientmi s menej progresívnym stupňom ochorenia. Vyšší výskyt bronchopneumónií u pacientov bez PEV v porovnaní s pacientmi s PEV súvisí s hypostázou. Pacienti s týždňovou predoperačnou PEV v rámci edukácie o nutnosti rehabilitácie a dychových cvičení ako prevencie bronchopneumónie najmä po torakochirugickom prístupe pri oesophagektómiách boli disciplinovanejší. Porovnateľný výskyt komplikácií u dobre živených pacientov a malnutričných pacientov hovorí v našej štúdii v prospech používania PEV u malnutričných pacientov, čo pozitívne koreluje s výsledkami iných analýz, ktoré hovoria o význame podávania PEV iba u stredne a ťažko malnutričných pacientov (20). Štúdie zároveň uvádzajú aj skrátenú dobu hospitalizácie v dôsledku zníženia pooperačných komplikácií (20, 21). V našej retrospektívnej analýze sa doba hospitalizácie u PEV pripravovaných pacientov predĺžila o dobu siedmich dní, pričom pooperačná doba hospitalizácie bola v priemere o dva dni dlhšia, teda skoro porovnateľná s pooperačnou rekonvalescenciou u pacientov bez predoperačnej PEV. Bozzetti uvádza podobné výsledky vo svojej štúdii, a to predĺženú dobu hospitalizácie vzhľadom na predoperačnú prípravu, pričom pooperačná doba sa štatisticky nelíši od kontrolnej skupiny bez PEV (17). Napriek tomu však v závere práce popisuje znížený výskyt pooperačných komplikácií po desaťdňovej predoperačnej PEV príprave. Na druhej strane rozsiahla retrospektívna analýza od Koretza poukazuje na benefit PEV iba u nerandomizovaných štúdií, u ostatných 22 randomizovaných štúdií sa iba štyri vyjadrili o pozitívnom efekte PEV na zníženie pooperačných komplikácií (22).
Graph 2. Vyhodnotenie výsledkov štúdií s kľúčovým slovami „Parenterálna výživa, predoperačná príprava, onkologická chirurgia“ zahrnutých v databáze Pubmed z rokov 1997–2006 
Okrem vplyvu parenterálnej výživy na nutričný stav sledujú niektoré štúdie jej ovplyvňovanie nežiadúcich účinkov chemoterapie u onkologických ochorení GIT-u. Parenterálna nutrícia podávaná u pacientov podstupujúcich chemoterapiu (CHT) pred samotným resekčným výkonom na GIT-e podľa Farriola pomáha udržať hladinu erytrocytov a trombocytov na vyššej úrovni, než u pacientov bez tejto podpory (19). Jin vo svojej práci uvádza, že PEV pred resekčným výkonom na GIT-e zvyšuje efektivitu CHT u malnutričného pacienta, a to bez urýchlenia proliferácie nádorových buniek u pacientov (23). Názor na túto otázku je však nejednotný, niektorí autori podporujú teóriu, že arteficiálna výživa môže selektívne podporovať rast nádoru, ktorý pôsobí ako jednosmerná energetická pasca bez pozítívneho efektu na hostiteľský organizmus (24).
Okrem spomínaných výhod parenterálnej výživy sa vedecké štúdie zaoberajú aj nežiadúcimi účinkami PEV. Jej nadbytočný príjem môže vyústiť do volumového preťaženia, hyperlipidémie, hyperglykémie s následným zvýšením rizika septických komplikácií a mortality (25–27). Správnym dávkovaním podľa našich skúseností možno však takýmto komplikáciam predísť.
Záver
Použitie predoperačnej parenterálnej prípravy u malnutričného pacienta pred chirurgickým výkonom na gastrointestinálnom trakte ostáva stále nevyriešenou otázkou. Vedľajšie nežiadúce účinky parenterálnych prípravkov, komplikácie spojené so zavedením centrálneho venózneho katétra, vysoké náklady a predĺžená doba hospitalizácie sú dôvodmi jej zriedkavého použitia v praxi. Na druhej strane je známe, že v pooperačnom období u malnutričných pacientov dochádza frekventnejšie ku komplikáciám. V našej štúdii sa nepotvrdil štatisticky významný rozdiel pooperačných komplikácií medzi skupinou bez a s parenterálnou prípravou, ale vzhľadom na to, že kritériom pre výber pacienta bola malnutrícia, porovnaním dobre živených a malnutričných pacientov s podobnými percentuálne zastúpenými pooperačnými komplikáciami to považujeme za pozitívny výsledok. Nutričná suplementácia by mala trvať aspoň sedem dní, aby sa dosiahol efekt sledovateľný zmenou laboratórnych parametrov. Podľa našich skúseností by nežiadúce vedľajšie účinky parenterálnej nutrície nemali byť limitujúcim faktorom jej aplikácie, keďže v našom súbore pacientov sa vyskytlo iba nízke percento výskytu komplikácií spojených so zavedením centrálneho venózneho katétra. Dysbalancia glykémie v súvislosti s aplikáciou parenterálnej výživy bola dobre farmakologicky zvládnuteľná. Benefit spočíva hlavne vo výrazne zlepšenom proteínovom stave pacienta po siedmich dňoch aplikácie aminokyselinových prípravkov. Ako nevýhoda predoperačnej parenterálnej prípravy sa v našej štúdii ukázala vyššia finančná náročnosť a predĺžená doba hospitalizácie.
Skratky
CVK – centrálny venózny katéter
BMI – body mass index
EV – enterálna výživa
GIT – gastroinetestinálny trakt
PEV – parenterálna výživa
MUDr. Lucia Lakyová
II. chirurgická klinika LF UPJŠ a FNLP
Rastislavova 43, 041 90 Košice, SR
fax: +421 556 152 154, e-mail: lalucka@azet.sk
Sources
1. Argiles, J. M.: Cancer-associated malnutrition. Europan Journal of Oncology Nursing, 2005, 9, s. 39–50.
2. Riccardi, D., Allen, K.: Nutritional Management of Patients with Esophageal and Esophagogastric Junction Cancer. Journal of the Moffitt Cancer Center, 1999, 6, s. 64–72.
3. Fearon, K. CH.: Nutritional support in cancer. Clinical Nutrition, 2001, 20, s. 187–190.
4. Schwenk, W., Günther, N., Haase, O. et al.: Changes in perioperative treatment for elective colorectal resections in Germany 1991 and 2001/2002. Zentralbl Chir., 2003, 128, s. 1086–1092.
5. Lanoir, D., Chambrier, C., Vergnon, P.: Perioperative artificial nutrition in elective surgery: an impact study of French guidelines. Clinical Nutrition, 1998, 17, s. 153 –157.
6. Bauer, J., Capra, S., Ferguson, M.: Use of the scored Patient-Generated Subjective Global Assessment (PG-SGA) as a nutrition assessment tool in patients with cancer. European Journal of Clinical Nutrition, 2002, 56, s. 779–785.
7. Swinton, N., Kasymjanova, G., Steinberg, T.: Do most newly diagnosed advanced NSCLC patients need nutritional intervention? Journal of Clinical Oncology, Part I., 2007, 25, s. 9108.
8. Philosophical Transactions of the Royal Society of London, 1656, stručný opis, Londýn, 1809, s. 45.
9. Pavia, R., Barresi, P., Piermanni, V. et al.: Treatment of the esophageal cancer: the impact of peri-operative parenteral nutrition. Recenti Prog. Med., 2006, 97, s. 219–224.
10. Goonetilleke, K. S., Siriwardena, A. K.: Systematic review of peri-operative nutritional supplementation in patients undergoing pancreaticoduodenectomy. JOP, 2006, 11, s. 5.
11. Gabor, S,, Renner, H,. Matzi, V., Ratzenhofer, B.: Early enteral feeding compared with parenteral nutrition after oesophageal or oesophagogastric resection and reconstruction. Br. J. Nutr., 2005, 93, s. 509–513.
12. Braga, M., Gianotti, L., Gentilini, O., Parisi, V.: Early postoperative enteral nutrition improves gut oxygenation and reduces costs compared with total parenteral nutrition. Crit. Care Med., 2001, 29, s. 242–248.
13. Lakyová, L., Radoňák, J., Stebnický, M. et al.: Enterálna výživa po resekčných výkonoch na pažeráku. Slovenská chirurgia, 2007, 4, s. 30–34.
14. Braga, M., Gianotti, L., Nespoli, L.: Nutritional approach in malnourished surgical patients. Arch Surg., 2002, 137, s. 174–180.
15. Cooper, S. C., Hulley, C. M., Grimley, C. E., Howden, J.: Perioperative peripheral parenteral nutrition for patients undergoing esophagectomy for cancer: a pilot study of safety, surgical, and nutritional outcomes. Int. Surg., 2006, 91, s. 358–364.
16. Liao, Q., Zhao, Y. P., Wang, W. B. et al.: Perioperative nutrition support of the patients with pancreatic head cancer. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2005, 27, s. 579–582.
17. Bozzetti, F., Gavazzi, C., Miceli, R. et al.: Perioperative total parenteral nutrition in malnourished, gastrointestinal cancer patients: a randomized, clinical trial. JPEN J. Parenter. Enteral. Nutr., 2000, 24, s. 7–14.
18. Radoňak, J., Vajó, J., Belák, J., Stebnický, M.: All-in-One systém parenterálnej výživy v rámci intenzívnej starostlivosti v chirurgii. Plzeňský lékařský sborník, 1992, 65, s. 23–25.
19. Farriol, M., Pons, M., Roca, N. et al.: Preoperative chemotherapy and total parenteral nutrition in colon cancer. Nutr. Hosp., 2006 , 21, s. 303–306.
20. Wu, G. H., Liu, Z.H., Wu, Z.H., Wu, Z.G.: Perioperative artificial nutrition in malnourished gastrointestinal cancer patients. World J Gastroenterol., 2006, 21, s. 2441–2444.
21. Komorowski, A. L., Łobaziewicz, W., Kołodziejski, L., Duda, K.: Early results of esophagectomy and total or proximal gastrectomy without perioperative administration of total parenteral nutrition. Wiad. Lek., 2003, 56, s. 122–126.
22. Koretz, R. L.: Do data support nutrition support? Part I: Intravenous nutrition, 2007, 107, s. 988–996.
23. Jin, D., Phillips, M., Byles, J. E.: Effects of parenteral nutrition support and chemotherapy on the phasic composition of tumor cells in gastrointestinal cancer. JPEN J. Parenter. Enteral. Nutr., 1999, 23, s. 237–241.
24. Mikula, J., Uhliariková, H., Očenášová, M.: Výživa u onkologických pacientov. Interná medicína, 2004, 7, s. 413–415.
25. McCowen, K. C., Friel, C., Sternberg, J. et al.: Hypocaloric total parenteral nutrition: effectiveness in prevention of hyperglycemia and infectious complications – a randomized clinical trial. Crit. Care Med., 2000, 28, s. 3606–3611.
26. Van den Berghe, G., Wouters, P., Weekers, F., Verwaest, C.: Intensive insulin therapy in the critically ill patients. N. Engl. J. Med., 2001, 345, s. 1359–1367.
27. Ikeda, K., Kimura, Y., Iwaya, T.: Perioperative nutrition for gastrointestinal surgery. Nippon Geka Gakkai Zarshi, 2004, 105, s. 218–222.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Venózny ulkus – súčasné pohľady na etiopatogenézu, diagnostiku a terapiu
- Léčba chronické myeloidní leukémie – méně běžný pohled na moderní postupy
- Postižení periferního nervového systému a míra motorického postižení u Parkinsonovy nemoci: korelační studie
- Vývoj respirační morbidity dětí ve vztahu k jejich expozici pasivnímu kouření
- Parenterálna nutrícia pred resekčným výkonom na hornom gastrointestinálnom trakte
- Rizikové faktory vzniku atelektázy po plicní lobektomii
- Analoga somatostatinu v léčbě karcinoidu
- Stimulace sakrálního nervu v léčbě neurogenní anální inkontinence
- Alfred Kohn, profesor histologie na Německé univerzitě v Praze
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Rizikové faktory vzniku atelektázy po plicní lobektomii
- Analoga somatostatinu v léčbě karcinoidu
- Stimulace sakrálního nervu v léčbě neurogenní anální inkontinence
- Parenterálna nutrícia pred resekčným výkonom na hornom gastrointestinálnom trakte
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

